Zum Anzeigen dieser Inhalte ist ein JoVE-Abonnement erforderlich. Melden Sie sich an oder starten Sie Ihre kostenlose Testversion.
Method Article
Eine allgemeine Methode zur Erkennung von Nitrosamide Formation in der In-vitro- Metabolismus von Nitrosaminen durch Cytochrom P450s
In diesem Artikel
Zusammenfassung
Α-Hydroxylierung von krebserregenden Nitrosaminen durch Cytochrom P450s ist der anerkannte Stoffwechselweg, der DNA-schädigenden Zwischenprodukte, produziert die Mutationen verursachen. Neue Daten gibt jedoch weitere Oxidation zu Nitrosamides auftreten kann. Wir beschreiben eine allgemeine Methode zur Erkennung von Nitrosamides aus in-vitro- Cytochrom P450-katalysierte Metabolismus von Nitrosaminen hergestellt.
Zusammenfassung
N-Nitrosamine sind eine gut etablierte Gruppe Umwelt Karzinogene, die Oxidation von Cytochrom P450 Aktivität zeigen erfordern. Die akzeptierteste Mechanismus der Stoffwechselaktivierung beinhaltet Bildung von α-Hydroxynitrosamines, die spontan an DNA alkylierende Agenten zu zerlegen. Ansammlung von DNA-Schäden und die daraus resultierende Mutationen kann letztlich zu Krebs führen. Neue deutet darauf hin, dass α-Hydroxynitrosamines weiter zu Nitrosamides processively von Cytochrom P450s oxidiert werden können. Da Nitrosamides in der Regel stabiler als α-Hydroxynitrosamines sind und auch DNA Alkylat können, kann Nitrosamides in Krebsentstehung eine Rolle spielen. In diesem Bericht beschreiben wir ein allgemeines Protokoll für die Bewertung der Nitrosamide Herstellung von in-vitro- Cytochrom P450-katalysierte Metabolismus von Nitrosaminen. Dieses Protokoll nutzt eine allgemeine Ausrichtung zur Synthese der relevanten Nitrosamides und eine in-vitro- Cytochrom P450 Stoffwechsel Assay mit flüssiger Chromatographie-Nanospray Ionisierung-hohe Auflösung Tandem-Massenspektrometrie zur Erkennung. Diese Methode erkannt N′- Nitrosonorcotinine als kleine Stoffwechselprodukt von N′- Nitrosonornicotine in der Beispiel-Studie. Die Methode hat hohe Empfindlichkeit und selektiv durch genaue Masse Erkennung. Anwendung dieser Methode auf eine Vielzahl von Nitrosaminen Cytochrom P450 Systeme können die Allgemeingültigkeit dieser Transformation zu bestimmen. Da Cytochrom P450s polymorph sind und in der Aktivität variieren, konnte ein besseres Verständnis der Nitrosamide Bildung in einzelnen Krebs-Risiko-Bewertung helfen.
Einleitung
N-Nitrosamine sind eine große Klasse von Karzinogenen gefunden in der Ernährung, Tabakwaren und das allgemeine Umfeld; Sie können auch im menschlichen Körper1endogen gebildet werden. Mehr als 300 N -Nitrosoverbindungen wurden getestet und > 90 % wurden als krebserzeugend in Tiermodelle2,3. Um ihre Karzinogenität aufweisen, müssen diese Verbindungen zunächst durch Cytochrom P450s1,2,3aktiviert werden. Die Forschung zeigt, dass Cytochrom P450s oxidieren leicht Nitrosamine, α-Hydroxynitrosamines (Abbildung 1), die sind hochreaktive Verbindungen mit Halbwertszeiten von ~ 5 s vor spontan zerlegen, Alkyldiazohydroxides. Letzteres kann DNA nach dem Verlust von H2O und N2Alkylat. Die daraus resultierende DNA Addukte, wenn verstopft, kann dazu führen, dass Mutationen, die bei kritischen Onko- oder Tumor-Suppressor-Gene, zu Krebs Entwicklung1führen. Aus diesem Grund, um ein umfassendes Verständnis der Stoffwechselwege zu erwerben wurde viel Aufwand betrieben wurde, DNA-Addukten, und nachgelagerten Metaboliten von Cytochrom P450-Oxidation von krebserregenden Nitrosaminen. Dieses Wissen hat mögliche Anwendung in einzelnen Krebs Risiko Bewertung4.
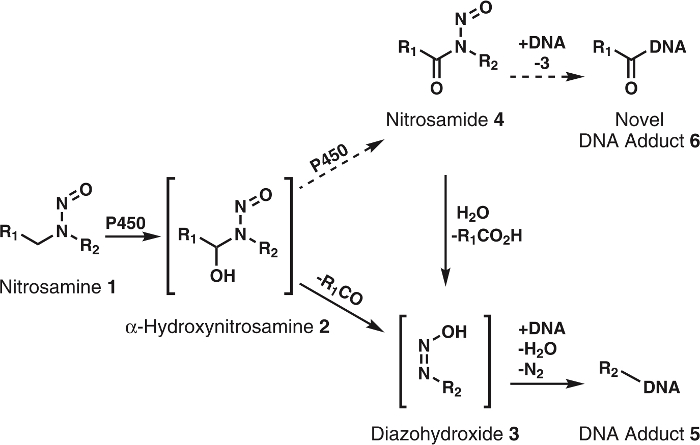
Abbildung 1: Allgemeine und vorgeschlagenen Stoffwechsel von Nitrosaminen.
Nitrosamine (1) werden durch P450s, α-Hydroxynitrosamines (2) oxidiert, die spontan zu Alkyldiazohydroxides (3) zerlegen. Diese Verbindungen können an DNA zu binden, die DNA Addukte. Es wird vermutet, dass 2 werden weiter durch P450s Nitrosamides 4oxidiert. Diese können direkt an der DNA in Form binden, die neuartige DNA Addukte oder 3 zu bilden, die bekannte DNA Addukte hydrolysiert werden. R1 und R2 repräsentieren jede Alkylgruppe. Bitte klicken Sie hier für eine größere Version dieser Figur.
Obwohl die α-Hydroxynitrosamine-Hypothese fest von umfangreichen Daten unterstützt wird, gibt es ein paar Ungereimtheiten; einem großen ist die kurze Halbwertszeit von α-Hydroxynitrosamines5,6. Es ist bekannt, dass diese Verbindungen an der Membran des endoplasmatischen Retikulum hergestellt werden und später Zellkern-DNA Alkylat. Angesichts ihrer Lebenszeit von ein paar Sekunden, ist es rätselhaft, wie diese Zwischenprodukte überleben erforderlichen Reise aber die Zellflüssigkeit. Eine Hypothese ist, dass ein Teil der α-Hydroxynitrosamines sind processively oxidiert, Nitrosamides7,8, die sind ziemlich stabil im Vergleich9. Dies würde vermutlich über Vorratsspeicherung von α-Hydroxynitrosamines im Cytochrom P450 aktiven auftreten. Präzedenzfall für diese Art der Oxidation ist mit Nikotin10, Alkohole11und einfache Alkylnitrosamines12,13gesehen worden. Darüber hinaus sind Nitrosamides direktwirkenden Karzinogene2,3. Basierend auf ihre Reaktivität9, werden diese Verbindungen geglaubt, produzieren DNA Addukte identisch mit denen aus α-Hydroxynitrosamines zusammen mit neuen, unerforschten DNA Addukte (Abbildung 1). So, diese Hypothese erklärt nicht nur den Transport durch das Zytosol, sondern auch die Bildung von DNA Schäden an Produkten.
In diesem Papier wird ein allgemeines Protokoll für die Beurteilung der in-Vitro -Cytochrom P450-vermittelte Umwandlung von Nitrosaminen in Nitrosamides beschrieben. Die bisher gemeldete Umwandlung von N′- Nitrosonornicotine (NNN), N′- Nitrosonorcotinine (NNC) von Cytochrom P450 2A6 ist als ein Beispiel14präsentiert. Anwendung dieses Protokolls zu einer Vielzahl von Enzym-Substrat-Systeme helfen, die Bedeutung der Nitrosamides im gesamten Nitrosaminen Stoffwechsel festzustellen.
Access restricted. Please log in or start a trial to view this content.
Protokoll
1. Materialien und allgemeine Verfahren
- Synthe NNN wie oben beschrieben 15. Erhalten Norcotinine, P450 2A6 Baculosomes NADPH Regenerationssystem, 0,5 X Reaktion Puffer und anderen Chemikalien oder Lösungsmittel aus kommerziellen Quellen in Reagenz Klasse.
- Rekord-NMR-Spektren auf einem 500 MHz-Spektrometer. Bericht chemische Verschiebungen als Teile pro million (ppm). Verwenden Sie restliche Lösungsmittel Gipfel als interne Verweise für 1 H-NMR (7,26 ppm CDCl 3) und 13 C-NMR (77,2 ppm CDCl-3).
Hinweis: Peak teilen die folgenden Abkürzungen verwendet: s Singulett, d = Wams, Dd = Wams von Dubletten, dt = = Wams von Drillingen, Dq = Wams Quartette, Ddd = Wams Wams von Dubletten und m = Multiplet. - Führen Sie hochauflösende Massenspektrometrie (HRMS) für ausgewählte Verbindungen auf einem LTQ Orbitrap Velos und Berichtsdaten als m/Z.
- Einsatz Polygram vorbeschichtet Kieselgel TLC-Platten (40 mm x 80 mm, 0,2 mm dick) mit 254 nm fluoreszierenden Indikator für Dünnschichtchromatographie (TLC). TLC-Platten durch UV Lampe Bestrahlung zu visualisieren.
- Führen Sie Flash-Chromatographie auf einem 60 Å, 70-150 Mesh Silica-Gel mit einer Glassäule 1,5 x 15 cm.
2. Vorbereitung der Nitrosamide Positivkontrolle (N ′-Nitrosonorcotinine, NNC)
- trocken, in einem Ofen über Nacht (16 h, ca. 140 ° C), ein 25 mL Rundboden Kolben mit einer magnetischen Stir Bar. Am Morgen, cool bewerten die Flasche unter einen Stream von N 2 während der Verwendung einer Öl-Wäscher, um N 2 Fluss zu halten unter einem Blase pro Sekunde.
Hinweis: Nach dem Abkühlen sind keine Vorsichtsmaßnahmen treffen, um den Kolben unter N 2 halten erforderlich. - In einer Dampfhaube hinzufügen Norcotinine (31,8 mg, 0.196 Mmol), Essigsäureanhydrid (5 mL) und Essigsäure (1 mL) in den abgekühlten Kolben. Rühren Sie diese Mischung ständig beim Abkühlen auf 0 ° C mit einem Wasser-Eis-Bad.
Vorsicht: Essigsäureanhydrid und Essigsäure sind korrosiv. - Fügen Sie NaNO 2 (33,3 mg, 0.483 Mmol) in einer portion und ständig rühren Sie die Mischung für 2,5 h überwachen Reaktion des Fortschritts von TLC (100 % EtOAc, R f = 0,19, siehe Punkt 1.4).
Hinweis: In dieser Zeit die Mischung werden zunehmend gelb mit gelegentlichen sprudeln. - Stillen die Reaktion durch Gießen die Mischung in eiskalten H 2 O (18 mL). Die wässrige Lösung mit 18 mL CH 2 Cl 2 in einem 100 mL separatory Trichter sofort zu extrahieren. Die wässrige Schicht mindestens 2 weitere Male mit CH 2 Cl 2 (9 mL) zu extrahieren.
- Trocknen der gepoolten Organics über ~ 100 mg MgSO 4 für 2 min. Filter und konzentrieren sich die Lösung durch rotary Verdampfung, eine rohe, gelbe Öl nachgeben. Erhitzen im Wasserbad bis 30 ° C beim Verdampfen die verbleibende Essigsäure entfernen.
Hinweis: Das Protokoll kann angehalten werden hier wird die Verbindung in CH 2 Cl 2 und die Lösung im Dunkeln bei 2-8 ° c gespeichert aufgelöst - Reinigen die krude Mischung durch Säulenchromatographie (siehe Punkt 1.5) mit Kieselgel als stationäre Phase und 100 % EtOAc als Laufmittel 16.
Vorsicht: NNC und verwandte Nitrosamides sollten mit Vorsicht behandelt werden, da sie davon ausgegangen sind, menschliche Karzinogene. - Lösen sich die reine Verbindung in CDCl 3 und NMR zu verwenden (siehe Schritt 1.2) bestätigen die Struktur und bestimmen das Molarity von dieser Lösung 17. Speichern Sie diese Lösung in der Dunkelheit bei 2 bis 8 ° C bis benötigt.
Hinweis: Diese Lösung wird als die positive Kontrolle in der in-Vitro-Assay (Schritt 3.5) verwendet werden. NMR-Spektren und chemische Verschiebungen gibt es in den unterstützenden Informationen. - Mit einer reinen NNC Lösung bestätigen die genaue Masse Eltern und Produkt Ion Massen durch direkte Infusion auf einem hochauflösenden Massenspektrometer (HRMS) unter in Schritten 1.3 und 4.3 beschriebenen Parameter bestimmen.
Hinweis: Produkt Massen werden für die Erkennung dieser Verbindung in der in-vitro- Metabolismus-Assay (Schritt 4.3) verwendet werden.
3. Ein Beispiel Nitrosaminen-P450 in-vitro- Inkubation
- P450 2A6 Baculosomes, Vivid-NADPH-Regenerationssystem und 10 mM NADP + Lager-Lösung aus einem-80 ° C Gefrierschrank entfernen und sie auf dem Eis auftauen lassen. Einmal aufgetaut, verdünnen Sie die Baculosomes und NADPH-Regeneration System 1:10 und 01:50, bzw. in einem einzigen 1 mL-Tube mit 0,5 X Reaktion Puffer. In ähnlicher Weise hinzufügen 3 μL des NADP + Lager Lösung zu 97 μL von 0,5 X Reaktion Buffer.
Hinweis: NADP + ist lichtempfindlich. Halten Sie diese Lösung, geschützt durch das seinem Container in Alufolie einwickeln. Enzym-Lösungen sind empfindlich gegen Frost-Tau-Wechseln; beschränken Sie auf nicht mehr als 2 Zyklen. Aliquote Bedarf für zukünftige Experimente vorzubereiten. - Für jede Inkubation hinzufügen 50 μL der Enzymlösung (mit 5 Pmol P450) zu 1 mL tube enthält 40 μl 4 μM NNN Lösung mit Reaktion Puffer gemacht. Bereits inkubieren Sie diese neue Mischung für 2 min bei 37 ° C mit einem Wasserbad und fügen Sie dann 10 μL der verdünnten Lösung NADP +. Inkubieren Sie das vollständige System für 1-30 min bei 37 ° c
Hinweis: Mit 5-Minuten-Intervallen für die Inkubationszeiten (z. B. 5, 10, 15 min, etc.) bieten eine ausreichende Zeit Nitrosamide Ausbildungskurs. - Nach der gewünschten Inkubationszeit zu stillen, von ersten Hinzufügen von 10 μl von 3,0 N ZnSO 4 und dann 10 μL von 3,0 N Ba(OH) 2. Vortex wird diese Lösung und einen weißen Niederschlag bilden. Zentrifugieren Sie die Probe bei 8000 X g für 4 min bis den Niederschlag pellet.
Hinweis: Das Verfahren muss nicht an dieser Stelle anhalten, wie die gebildeten Nitrosamides Stabilität in wässrigen Lösungen begrenzt haben. Lange Pausen können zu falsch negativen führen. - Sofort pipette überstand und analysieren 2 μL von Flüssigkeitschromatographie positive Nanoelectrospray-Ionisierung hochauflösende tandem Massenspektrometrie (LC-NSI +-HRMS/MS, Schritte 4.1-4.3).
- Für die Positivkontrolle Inkubationen verdunsten eine aliquote mit 100 Fmol synthetisierten NNC-Lösung in einer 1 mL-Tube unter einen Stream von N 2. Zu diesem Fläschchen voll Enzymsystem aus Schritt 3.2 hinzufügen und gehen Sie wie beschrieben Schritte 3.3 3.4.
- Für Negativkontrolle Inkubationen führen Sie das Experiment als beschrieben (Schritte 3,2-3,4) außer ersetzen die 50 μl Enzymlösung mit 0,5 X Reaktion Puffer.
4. Beispiel-Parameter für Nitrosamide Erkennung durch LC-NSI +-HRMS/MS
- für LC-Komponente gelten die folgende mehrstufige Steigung im Schritt 4.2 zu einem UPLC-System mit einem kommerziellen, handverpackt 18 C18 (5 μm), 100 mm x 75 μm, 15 μm Öffnung Kapillare Spalte.
- Mittels 5 mM NH 4 OAc als Lösungsmittel A und MeCN als Lösungsmittel B, laden die Probe auf die Säule durch die Ausführung mit 5 % B mit 1 μl/min von 0 - 5 min, und dann verlangsamt die Durchflussmenge 0,3 μL/min danach. Als nächstes führen Sie ein Gefälle von 5 auf 20 % B über 4 min, gefolgt von einer Rampe auf 55 % B mehr als 10 min, und dann wieder Gleichgewichtherstellung auf 5 % B.
- Führen die LC-NSI +-HRMS/MS auf eine LTQ Orbitrap. Monitor für NNC full-Scan und MS 2 Fragmentierung. Führen Sie vollständigen Scan mit einer Auflösung von 60.000 und extrahieren Sie die genaue Elternteil Masse (192.07670) zu einer Masse Toleranz von 5 ppm. Verwenden MS 2 Fragmentierung zu isolieren Elternteil Ionen (2,0 amu) und Fragment durch Kollision-induzierte Dissoziation (CID) mit einer Aufprallenergie von 25 eV, Auflösung von 15.000, und scan-Zeit von 30 Ms. extrahieren die genaue Massen für Produkt-Ionen des NNC (m/z 192 m/Z 134.04739 und 162.07874) zu einer Masse Toleranz von 5 ppm.
Access restricted. Please log in or start a trial to view this content.
Ergebnisse
Basierend auf der Arbeit von weißen Et Al. 19Norcotinine war Nitrosated, NNC sauber und in hoher Ausbeute (80-92 %), einen Standard für die in-vitro- Experiment zu produzieren. Strukturelle Hinweise für eine erfolgreiche Reaktion wurde von spektroskopische Analysen inklusive 1H-NMR, 13C-NMR, gemütlich und HSQC-(unterstützenden Informationen) zusammen mit HRMS, die die übergeordneten Masse [M + H] bestätigt erhalten
Access restricted. Please log in or start a trial to view this content.
Diskussion
Aufklärung des Stoffwechsels von Nitrosaminen ist eine wichtige Komponente für das Verständnis ihrer Karzinogenität. Da die beteiligten Cytochrom P450s und andere metabolische Enzyme polymorph sind, konnte weitere Anwendung dieses Wissens potentiell risikoreiche Einzelpersonen1,4identifizieren. Neue Daten gibt an, dass weitere Oxidation von α-Hydroxynitrosamines, die mutmaßlichen Hauptmetaboliten von Nitrosaminen DNA-Bindung beteiligt, Nitrosamides ist mög...
Access restricted. Please log in or start a trial to view this content.
Offenlegungen
Die Autoren haben nichts preisgeben.
Danksagungen
Diese Studie wurde unterstützt durch Zuschuss keine. CA-81301 vom National Cancer Institute. Wir bedanken uns bei Bob Carlson für redaktionelle Unterstützung, Dr. Peter Villalta und Xun Ming für Massenspektrometrie Unterstützung in der analytischen Biochemie geteilt Ressource des freimaurerischen Cancer Center und Dr. Adam T. Zarth und Dr. Anna K. Michel für ihre wertvollen Diskussionen und Input. Die analytische Biochemie gemeinsame Ressource wird teilweise unterstützt durch National Cancer Institut Krebs Center Support Grant CA-77598
Access restricted. Please log in or start a trial to view this content.
Materialien
| Name | Company | Catalog Number | Comments |
| Norcotinine | AKoS GmbH (Steinen, Germany) | CAS 17708-87-1, AKoS AK0S006278969 | |
| Acetic acid | Sigma-Aldrich | 695092 | |
| Acetic Anhydride | Sigma-Aldrich | 242845 | |
| Ammonium Acetate | Sigma-Aldrich | 431311 | |
| Barium Hydroxide | Sigma-Aldrich | 433373 | |
| D-Chloroform | Sigma-Aldrich | 151823 | |
| HPLC Acetonitrile | Sigma-Aldrich | 34998 | |
| Magnesium Sulfate | Sigma-Aldrich | M7506 | |
| Methylene Chloride | Sigma-Aldrich | 34856 | |
| Sodium Nitrite | Sigma-Aldrich | 237213 | |
| ViVid CYP2A6 Blue Screening Kit | Life Technologies | PV6140 | |
| Zinc Sulfate | Sigma-Aldrich | 221376 | |
| 0.5 mL tubes | Fisher | AB0533 | |
| 100 mL round bottom flask | Sigma-Aldrich | Z510424 | |
| 125 mL Erlenmeyer flask | Sigma-Aldrich | CLS4980125 | |
| 125 mL Separatory Funnel | Sigma-Aldrich | Z261017 | |
| 25 mL round bottom flask | Sigma-Aldrich | Z278262 | |
| 500 MHz NMR Spectrometer | Bruker | ||
| Allegra X-22R Centrifuge | Beckman-Coulter | ||
| LC vials | ChromTech | CTC–0957–BOND | |
| LTQ Orbitrap Velos | Thermo Scientific | ||
| Magnetic Stir bar | Sigma-Aldrich | Z127035 | |
| NMR tube | Sigma-Aldrich | Z274682 | |
| P1000, P200, and P10 pipettes | Eppendorf | ||
| Rotary evaporator | Sigma-Aldrich | Z691410 | |
| RSLCnano UPLC system | Thermo Scientific | ||
| Shaking Water Bath | Fisher | FSSWB15 | |
| Stir plate | Sigma-Aldrich | CLS6795420 | |
| PicoFrit Column | New Objective | PF3607515N5 | |
| Luna C18, 5 um | Phenomenex | 535913-1 |
Referenzen
- Rom, W. N., Markowitz, S. Environmental and Occupational Medicine. , 4th ed, Wolters Kluwer/Lippincott Williams & Wilkins. 1226-1239 (2007).
- Preussmann, R., Stewart, B. W. Chemical Carcinogens, ACS Monograph 182. Searle, C. E. 2, 2nd ed, American Chemical Society. 643-828 (1984).
- Magee, P. N., Montesano, R., Preussmann, R. Chemical Carcinogens. ACS monograph 173. Searle, C. E. , American Chemical Society. 491-625 (1976).
- Zhu, A. Z., et al. Alaska Native smokers and smokeless tobacco users with slower CYP2A6 activity have lower tobacco consumption, lower tobacco-specific nitrosamine exposure and lower tobacco-specific nitrosamine bioactivation. Carcinogenesis. 34 (1), 93-101 (2013).
- Mesić, M., Revis, C., Fishbein, J. C. Effects of structure on the reactivity of alpha-hydroxydialkynitrosamines in aqueous solutions. J. Am. Chem. Soc. 118, 7412-7413 (1996).
- Mochizuki, M., Anjo, T., Okada, M. Isolation and characterization of N-alkyl-N- (hydroxymethyl)nitrosamines from N-alkyl-N- (hydroperoxymethyl)nitrosamines by deoxygenation. Tetrahedron Lett. 21, 3693-3696 (1980).
- Guttenplan, J. B. Effects of cytosol on mutagenesis induced by N-nitrosodimethylamine, N-nitrosomethylurea and à-acetoxy-N-nitrosodimethylamine in different strains of Salmonella:evidence for different ultimate mutagens from N-nitrosodimethylmine. Carcinogenesis. 14, 1013-1019 (1993).
- Elespuru, R. K., Saavedra, J. E., Kovatch, R. M., Lijinsky, W. Examination of a-carbonyl derivatives of nitrosodimethylamine in ethylnitrosomethyamine as putative proximate carcinogens. Carcinogenesis. 14, 1189-1193 (1993).
- Chow, Y. L. ACS Symposium Series. 101, American Chemical Society. 13-37 (1979).
- von Weymarn, L. B., Retzlaff, C., Murphy, S. E. CYP2A6- and CYP2A13-catalyzed metabolism of the nicotine delta5'(1')iminium ion. J. Pharmacol. Exp. Ther. 343 (2), 307-315 (2012).
- Bell-Parikh, L. C., Guengerich, F. P. Kinetics of cytochrome P450 2E1-catalyzed oxidation of ethanol to acetic acid via acetaldehyde. J Biol Chem. 274 (34), 23833-23840 (1999).
- Chowdhury, G., Calcutt, M. W., Nagy, L. D., Guengerich, F. P. Oxidation of methyl and ethyl nitrosamines by cytochrome P450 2E1 and 2B1. Biochemistry. 51 (50), 9995-10007 (2012).
- Chowdhury, G., Calcutt, M. W., Guengerich, F. P. Oxidation of N-nitrosoalkylamines by human cytochrome P450 2A6: sequential oxidation to aldehydes and carboxylic acids and analysis of reaction steps. J Biol Chem. 285 (11), 8031-8044 (2010).
- Carlson, E. S., Upadhyaya, P., Hecht, S. S. Evaluation of nitrosamide formation in the cytochrome P450-mediated metabolism of tobacco-specific nitrosamines. Chem Res Toxicol. 29 (12), 2194-2205 (2016).
- Amin, S., Desai, D., Hecht, S. S., Hoffmann, D. Synthesis of tobacco-specific N-nitrosamines and their metabolites and results of related bioassays. Crit. Rev. Toxicol. 26, 139-147 (1996).
- Clark, A. G., Wong, S. T. A rapid chromatographic technique for the detection of dye-binding. Anal Biochem. 89 (2), 317-323 (1978).
- Pauli, G. F., et al. Importance of purity evaluation and the potential of quantitative (1)H NMR as a purity assay. J Med Chem. 57 (22), 9220-9231 (2014).
- van der Heeft, E., et al. A microcapillary column switching HPLC-electrospray ionization MS system for the direct identification of peptides presented by major histocompatibility complex class I molecules. Anal Chem. 70 (18), 3742-3751 (1998).
- White, E. H. The Chemistry of the N-Alkyl-N-nitrosoamides. I. Methods of Preparation. J. Am. Chem. Soc. 77, 6008-6010 (1955).
- Patten, C., et al. Evidence for cytochrome P450 2A6 and 3A4 as major catalysts for N'-nitrosonornicotine alpha-hydroxylation by human liver microsomes. Carcinogenesis. 18, 1623-1630 (1997).
- Wong, H. L., Murphy, S. E., Hecht, S. S. Cytochrome P450 2A-catalyzed metabolic activation of structurally similar carcinogenic nitrosamines: N'-nitrosonornicotine enantiomers, N-nitrosopiperidine, and N-nitrosopyrrolidine. Chem. Res. Toxicol. 18, 61-69 (2004).
- Hecht, S. S. Biochemistry, biology, and carcinogenicity of tobacco-specific N-nitrosamines. Chem. Res. Toxicol. 11, 559-603 (1998).
- von Weymarn, L. B., Zhang, Q. Y., Ding, X., Hollenberg, P. F. Effects of 8-methoxypsoralen on cytochrome P450 2A13. Carcinogenesis. 26 (3), 621-629 (2005).
Access restricted. Please log in or start a trial to view this content.
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten