È necessario avere un abbonamento a JoVE per visualizzare questo. Accedi o inizia la tua prova gratuita.
Method Article
Un metodo generale per la rilevazione Nitrosamide formazione nel metabolismo In Vitro di nitrosammine di citocromo P450s
In questo articolo
Riepilogo
Α-idrossilazione di nitrosamine cancerogene dal citocromo P450s è accettata via metabolica che produce intermedi danneggiano il DNA, che causano mutazioni. Tuttavia, nuovi dati indicano ulteriore ossidazione a nitrosamides può verificarsi. Descriviamo un generale metodo per la rilevazione nitrosamides prodotta da in vitro metabolismo del citocromo P450-catalizzata di nitrosammine.
Abstract
N-nitrosammine sono un gruppo ben consolidato degli agenti cancerogeni ambientali, che richiedono l'ossidazione del citocromo P450 per esibire l'attività. Il meccanismo di attivazione metabolica accettato coinvolge la formazione di α-hydroxynitrosamines che si decompongono spontaneamente agli agenti alchilanti del DNA. Accumulazione di danno del DNA e le mutazioni risultante in ultima analisi può portare al cancro. La nuova prova indica che α-hydroxynitrosamines può essere ulteriormente ossidata a nitrosamides processively dal citocromo P450s. Poiché nitrosamides sono generalmente più stabili di α-hydroxynitrosamines e anche possibile alchilare il DNA, nitrosamides possono svolgere un ruolo nella carcinogenesi. In questo rapporto, descriviamo un protocollo generale per valutare la produzione di nitrosamide da metabolismo P450-catalizzata-citocromo in vitro di nitrosammine. Questo protocollo utilizza un approccio generale alla sintesi del nitrosamides pertinenti e un in vitro del citocromo P450 metabolismo test utilizzando la spettrometria di massa tandem di cromatografia a fase mobile liquida-nanospray ionizzazione-alta risoluzione per il rilevamento. Questo metodo ha rilevato N′- nitrosonorcotinine come un metabolita secondario di N′- nitrosonornicotine nello studio di esempio. Il metodo ha alta sensibilità e selettivamente dovuto accurata rilevazione di masse. Applicazione di questo metodo per una vasta gamma di sistemi di nitrosamina-citocromo P450 aiuterà a determinare la generalità di questa trasformazione. Perché citocromo P450s sono polimorfici e variano in attività, una migliore comprensione della formazione di nitrosamide potrebbe aiutare nella valutazione del rischio di cancro individuali.
Introduzione
N-nitrosammine sono una vasta classe di agenti cancerogeni trovati nella dieta, prodotti del tabacco e l'ambiente in generale; si possono anche formare in modo endogeno nel corpo umano1. Più di 300 N -nitroso composti sono stati testati e > 90% sono stati valutati come cancerogeni in modelli animali2,3. Per esibire la loro cancerogenicità, questi composti devono prima essere attivati dal citocromo P450s1,2,3. La ricerca dimostra che il citocromo P450s ossidare prontamente nitrosammine di α-hydroxynitrosamines (Figura 1), che sono composti altamente reattivi con emivita di ~ 5 s prima spontaneamente decomponendosi in alkyldiazohydroxides. Quest'ultimo può alchilazione del DNA dopo la perdita di H2O e N2. Addotti del DNA risultante, se trafficatissime, può causare mutazioni che, in caso di critica onco - o geni oncosoppressori, portano al cancro di sviluppo1. Per questo motivo, molto sforzo è stato consumato per acquisire una piena comprensione delle vie metaboliche, complessi del DNA e metaboliti a valle di ossidazione del citocromo P450 di nitrosamine cancerogene. Questa conoscenza ha potenziale applicazione individuale cancro rischio valutazione4.
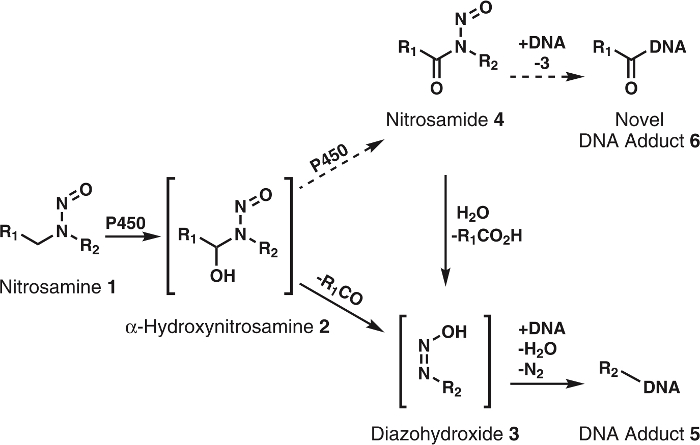
Figura 1: Generale e metabolismo proposto di nitrosammine.
Nitrosammine (1) sono ossidati da P450s a α-hydroxynitrosamines (2) che si decompongono spontaneamente a alkyldiazohydroxides (3). Questi composti possono legare al DNA per formare che complessi del DNA. È supposto che 2 sono ulteriormente ossidati da P450s a nitrosamides 4. Questi possibile associare direttamente al DNA a forma novella del DNA addotti o essere idrolizzata a 3 per formare che complessi del DNA noto. R1 R2 rappresentano qualsiasi gruppo alchilico. Clicca qui per visualizzare una versione più grande di questa figura.
Anche se l'ipotesi di α-hydroxynitrosamine è solidamente sostenuto da numerosi dati, ci sono alcune incoerenze; una maggiore è la breve emivita di α-hydroxynitrosamines5,6. È noto che questi composti sono prodotti alla membrana del reticolo endoplasmatico e successivamente alchilazione del DNA nucleare. Dato il loro ciclo di vita di pochi secondi, esso è sconcertante come questi intermedi sopravvivono la corsa richiesta però nel citosol. Un'ipotesi è che una parte di α-hydroxynitrosamines processively sono ossidati a nitrosamides7,8, che sono abbastanza stabili in confronto9. Presumibilmente questo avverrebbe attraverso una trattenuta di α-hydroxynitrosamines nel sito attivo del citocromo P450. Precedente per questo tipo di ossidazione è stato visto con nicotina10, alcoli11e semplice alkylnitrosamines12,13. Inoltre, nitrosamides sono ad azione diretta agenti cancerogeni2,3. Basato su loro reattività9, questi composti sono creduti per produrre DNA addotti identici a quelli derivanti da α-hydroxynitrosamines insieme a nuovi, complessi inesplorate del DNA (Figura 1). Così, questa ipotesi non solo spiega il trasporto attraverso il citosol, ma anche la formazione di DNA danneggiare i prodotti.
In questa carta, un protocollo generale per la valutazione in vitro del citocromo P450-mediata conversione di nitrosammine in nitrosamides è descritto. La conversione precedentemente segnalata di N′- nitrosonornicotine (NNN) N′- nitrosonorcotinine (NNC) di citocromo P450 2A6 viene presentata come un esempio14. Applicazione del presente protocollo ad una vasta gamma di sistemi di enzima-substrato aiuterà a determinare l'importanza di nitrosamides nel metabolismo di nitrosamina complessiva.
Protocollo
1. materiali e procedure generali
- Synthesize NNN come precedentemente descritto 15. Ottenere norcotinine, P450 2A6 Baculosomes, sistema di rigenerazione NADPH, tampone di reazione 0,5 x e tutte le altre sostanze chimiche o solventi da fonti commerciali in grado reagente.
- Gli spettri RMN record su uno spettrometro di 500 MHz. Prodotto chimico relazione sposta come parti per milione (ppm). Utilizzare picchi di solventi residui come riferimenti interni per 1 H-NMR (7,26 ppm CDCl 3) e 13 C-NMR (77,2 ppm CDCl 3).
Nota: Peak spaccare usate le seguenti abbreviazioni: s = singoletto, d = doppietto, dd = doppietto di doppietti, dt = doppietto di terzine, dq = doppietto di quartetti, ddd = doppietto di doppietto di doppietti e m = multipletto. - Eseguire la spettrometria di massa ad alta risoluzione (HRMS) per composti selezionati su un LTQ Orbitrap Velos e dei dati del report come m/z.
- Uso polygram prerivestiti lastre di gel di silice TLC (40 mm x 80 mm, spessore di 0,2 mm) con indicatore fluorescente di 254 nm per cromatografia di strato sottile (TLC). Visualizzare lastre TLC di irradiazione UV Lampada.
- Eseguire cromatografia flash su un 60 Å, gel di silice di 70-150 mesh utilizzando una colonna di vetro 1,5 cm x 15 cm.
2. Preparazione del controllo positivo nitrosamide (N ′-nitrosonorcotinine, NNC)
- asciutto, in un forno durante la notte (16h, ~ 140 ° C), un 25 mL, pallone a sfondo sferico contenente un'ancoretta magnetica. Al mattino, raffreddare il pallone sotto un flusso di N 2 durante l'utilizzo di una vasca di gorgogliamento dell'olio per mantenere il flusso di 2 N valuta sotto una bolla al secondo.
Nota: Dopo il raffreddamento, non per tenere il pallone N. 2 sono necessarie precauzioni. - In una cappa, aggiungere norcotinine (31,8 mg, 0.196 mmol), l'anidride acetica (5 mL) e acido acetico (1 mL) nel matraccio raffreddato. Mescolate il composto continuamente durante il raffreddamento a 0 ° C con un bagno di ghiaccio d'acqua.
Attenzione: L'anidride acetica e acido acetico sono corrosivi. - Aggiungere NaNO 2 (33,3 mg, 0,483 mmol) in una porzione e mescolare continuamente per 2,5 h. monitorare l'avanzamento della reazione di TLC (100% EtOAc, R f = 0,19, vedi punto 1.4).
Nota: Oltre questo orario, il composto diventerà sempre più giallo con occasionali bubbling. - Placare la reazione versando il composto in ghiacciata H 2 O (18ml). Estrarre immediatamente la soluzione acquosa con 18 mL di CH 2 Cl 2 in un imbuto separatore mL 100. Estrarre lo strato acquoso almeno 2 volte con CH 2 Cl 2 (9 mL ciascuno).
- Asciugare i prodotti organici riuniti più di ~ 100 mg di MgSO 4 per 2 min filtro e concentrare la soluzione mediante evaporazione rotativa per produrre un olio grezzo, giallo. Riscaldare il bagno di acqua a 30 ° C durante l'evaporazione per rimuovere il residuo di acido acetico.
Nota: Il protocollo può essere messo in pausa qui se il composto è dissolto in CH 2 Cl 2 e la soluzione conservati al buio a 2-8 ° C. - Purificare il grezzo composto da cromatografia a colonna (Vedi punto 1.5) utilizzando il gel di silice come fase stazionaria e 100% EtOAc come l' eluente 16.
Attenzione: NNC e nitrosamides correlate devono essere maneggiati con cura come essi vengono considerati come agenti cancerogeni umani. - Sciogliere il composto puro in CDCl 3 e utilizzare NMR (Vedi punto 1.2) per confermare la struttura e determinare la molarità di questa soluzione 17. Conservare questa soluzione al buio a 2-8 ° C fino a quando necessario.
Nota: Questa soluzione sarà utilizzata come controllo positivo nel test in vitro (punto 3.5). Gli spettri RMN e gli spostamenti chimici sono disponibili nelle informazioni di supporto. - Con una soluzione pura di NNC, confermare il preciso padre massa e determinare le masse di ioni prodotto da infusione diretta su uno spettrometro di massa ad alta risoluzione (HRMS) sotto i parametri descritti ai punti 1.3 e 4.3.
Nota: Masse di prodotto verranno utilizzate per la rilevazione di questo composto in vitro test metabolismo (punto 4.3).
3. Una nitrosamina-P450 in vitro incubazione di esempio
- rimuovere P450 2A6 Baculosomes, sistema di Vivid-NADPH-rigenerazione e 10mm NADP + soluzione Stock da un congelatore a-80 ° C e lasciarli scongelare su ghiaccio. Una volta scongelato, diluire il Baculosomes e la NADPH-rigenerazione sistema 1:10 e 01:50, rispettivamente, in un tubo singolo 1 mL con reazione di 0,5 X Buffer. Allo stesso modo, aggiungere 3 μL di NADP + soluzione Stock a 97 μL di 0,5 X tampone di reazione.
Nota: NADP + è sensibile alla luce. Mantenere questa soluzione protetta avvolgendo il contenitore in carta stagnola. Soluzioni enzimatiche sono sensibile ai cicli di gelo-disgelo; limitare questo per non più di 2 cicli. Preparare aliquote come necessarie per gli esperimenti futuri. - Per ciascuna incubazione aggiungere 50 μL di soluzione di enzima (contenente 5 pmol P450) ad un 1 mL tubo contenente 40 μL di soluzione NNN μM 4 fatta con tampone di reazione. Pre-Incubare questa nuova miscela per 2 min a 37 ° C, usando un bagno di acqua e aggiungere 10 μL di soluzione diluita di NADP +. Incubare il sistema completo per 1-30 min a 37 ° C.
Nota: Utilizzando intervalli di 5 min per tempi di incubazione (per esempio 5, 10, 15 min, ecc.) fornirà un sufficiente corso di tempo di formazione nitrosamide. - Dopo il tempo di incubazione desiderato, placare prima aggiungere 10 μl di 3.0 ZnSO N 4 e poi 10 μL di 3.0 N BA (Oh) 2. Vortice formeranno questa soluzione e un precipitato bianco. Centrifugare il campione a 8000 x g per 4 min a pellet il precipitato.
Nota: La procedura non deve sospendere in questo passaggio come il formato nitrosamides hanno limitato la stabilità in soluzione acquose. Lunghe pause possono causare falsi negativi. - Immediatamente Pipettare il surnatante e analizzare 2 μL di spettrometria tandem massa ad alta risoluzione nanoelectrospray-ionizzazione positiva di cromatografia liquida (LC-NSI +-HRMS/MS, punti 4.1-4.3).
- Per le incubazioni di controllo positivo, evaporare una parte aliquota contenente 100 fmol di soluzione NNC sintetizzato in una provetta 1 mL sotto un flusso di N 2. Questo flacone, aggiungere il sistema enzimatico completo passaggio 3.2 e procedere come descritto per la procedura 3.3-3.4.
- Per le incubazioni di controllo negativo, eseguire l'esperimento come descritti (passaggi 3.2-3.4) tranne sostituire il 50 μL di soluzione enzimatica con 0,5 X tampone di reazione.
4. Parametri di esempio per il rilevamento di nitrosamide di LC-NSI +-HRMS/MS
- per the LC componente, applicare la sfumatura di multi-step seguente nel passaggio 4.2 a un sistema UPLC utilizzando un commerciale, confezionate 18 C18 (5 μm), 100 mm x 75 μm, colonna capillare orifizio di 15 μm.
- Utilizzando 5 mM NH 4 OAc come A solvente e MeCN come solvente B, caricare il campione sulla colonna eseguendo al 5% B al punto 1 μL/min da 0 - 5 min e quindi rallentare la velocità di flusso a 0,3 µ l/min in seguito. Successivamente, eseguire una sfumatura dal 5 al 20% B in 4 minuti, seguita da una rampa al 55% B oltre 10 minuti e poi riequilibrio al 5% B.
- Eseguire il LC-NSI +-HRMS/MS su un LTQ Orbitrap. Monitor per NNC da scansione completa e frammentazione di 2 MS. Eseguire scansione completa con una risoluzione di 60.000 ed estrarre la massa accurata padre (192.07670) a una tolleranza di massa di 5 ppm. Uso MS 2 frammentazione per isolare ioni genitore (2,0 amu) e frammento di dissociazione indotta da collisione (CID) con un'energia di collisione di 25 eV, risoluzione di 15.000 e tempo di 30 ms di scansione estrarre le masse accurate per gli ioni prodotto di NNC (m/z 192 m/z 134.04739 e 162.07874) a una tolleranza di massa di 5ppm.
Risultati
Basato sul lavoro di bianco et al. 19, norcotinine era nitrosi a NNC in modo pulito e nell'alto rendimento (80-92%) per produrre uno standard per l'esperimento in vitro . Prove strutturali per una reazione di successo è stata ottenuta da analisi spettroscopiche compreso 1H-NMR, 13C-NMR, COSY e HSQC (supporto informazioni) insieme a HRMS che ha confermato la massa di padre [M + H]+ all'interno di 5 ppm della valore...
Discussione
Delucidamento il metabolismo di nitrosammine è un componente critico per comprendere la loro cancerogenicità. Poiché il coinvolto citocromo P450s e altri enzimi metabolici sono polimorfici, ulteriore applicazione di questa conoscenza potrebbe potenzialmente identificare gli individui ad alto rischio1,4. Nuovi dati indica che l'ulteriore ossidazione di α-hydroxynitrosamines, presunti principali metaboliti di nitrosammine coinvolti nel legame al DNA, a nitrosam...
Divulgazioni
Gli autori non hanno nulla a rivelare.
Riconoscimenti
Questo studio è stato sostenuto da grant no. CA-81301 dal National Cancer Institute. Ringraziamo Bob Carlson per assistenza editoriale, Dr. Peter Villalta e Xun Ming per assistenza di spettrometria di massa nella analitica biochimica ha condiviso risorsa del Masonic Cancer Center e Dr. Adam T. Zarth Dr. Anna K. Michel per le loro discussioni importanti e di input. La risorsa condivisa biochimica analitica è parzialmente supportata da nazionale Cancer Institute cancro centro supporto Grant CA-77598
Materiali
| Name | Company | Catalog Number | Comments |
| Norcotinine | AKoS GmbH (Steinen, Germany) | CAS 17708-87-1, AKoS AK0S006278969 | |
| Acetic acid | Sigma-Aldrich | 695092 | |
| Acetic Anhydride | Sigma-Aldrich | 242845 | |
| Ammonium Acetate | Sigma-Aldrich | 431311 | |
| Barium Hydroxide | Sigma-Aldrich | 433373 | |
| D-Chloroform | Sigma-Aldrich | 151823 | |
| HPLC Acetonitrile | Sigma-Aldrich | 34998 | |
| Magnesium Sulfate | Sigma-Aldrich | M7506 | |
| Methylene Chloride | Sigma-Aldrich | 34856 | |
| Sodium Nitrite | Sigma-Aldrich | 237213 | |
| ViVid CYP2A6 Blue Screening Kit | Life Technologies | PV6140 | |
| Zinc Sulfate | Sigma-Aldrich | 221376 | |
| 0.5 mL tubes | Fisher | AB0533 | |
| 100 mL round bottom flask | Sigma-Aldrich | Z510424 | |
| 125 mL Erlenmeyer flask | Sigma-Aldrich | CLS4980125 | |
| 125 mL Separatory Funnel | Sigma-Aldrich | Z261017 | |
| 25 mL round bottom flask | Sigma-Aldrich | Z278262 | |
| 500 MHz NMR Spectrometer | Bruker | ||
| Allegra X-22R Centrifuge | Beckman-Coulter | ||
| LC vials | ChromTech | CTC–0957–BOND | |
| LTQ Orbitrap Velos | Thermo Scientific | ||
| Magnetic Stir bar | Sigma-Aldrich | Z127035 | |
| NMR tube | Sigma-Aldrich | Z274682 | |
| P1000, P200, and P10 pipettes | Eppendorf | ||
| Rotary evaporator | Sigma-Aldrich | Z691410 | |
| RSLCnano UPLC system | Thermo Scientific | ||
| Shaking Water Bath | Fisher | FSSWB15 | |
| Stir plate | Sigma-Aldrich | CLS6795420 | |
| PicoFrit Column | New Objective | PF3607515N5 | |
| Luna C18, 5 um | Phenomenex | 535913-1 |
Riferimenti
- Rom, W. N., Markowitz, S. . Environmental and Occupational Medicine. , 1226-1239 (2007).
- Preussmann, R., Stewart, B. W., Searle, C. E. . Chemical Carcinogens, ACS Monograph 182. 2, 643-828 (1984).
- Magee, P. N., Montesano, R., Preussmann, R., Searle, C. E. . Chemical Carcinogens. ACS monograph 173. , 491-625 (1976).
- Zhu, A. Z., et al. Alaska Native smokers and smokeless tobacco users with slower CYP2A6 activity have lower tobacco consumption, lower tobacco-specific nitrosamine exposure and lower tobacco-specific nitrosamine bioactivation. Carcinogenesis. 34 (1), 93-101 (2013).
- Mesić, M., Revis, C., Fishbein, J. C. Effects of structure on the reactivity of alpha-hydroxydialkynitrosamines in aqueous solutions. J. Am. Chem. Soc. 118, 7412-7413 (1996).
- Mochizuki, M., Anjo, T., Okada, M. Isolation and characterization of N-alkyl-N- (hydroxymethyl)nitrosamines from N-alkyl-N- (hydroperoxymethyl)nitrosamines by deoxygenation. Tetrahedron Lett. 21, 3693-3696 (1980).
- Guttenplan, J. B. Effects of cytosol on mutagenesis induced by N-nitrosodimethylamine, N-nitrosomethylurea and à-acetoxy-N-nitrosodimethylamine in different strains of Salmonella:evidence for different ultimate mutagens from N-nitrosodimethylmine. Carcinogenesis. 14, 1013-1019 (1993).
- Elespuru, R. K., Saavedra, J. E., Kovatch, R. M., Lijinsky, W. Examination of a-carbonyl derivatives of nitrosodimethylamine in ethylnitrosomethyamine as putative proximate carcinogens. Carcinogenesis. 14, 1189-1193 (1993).
- Chow, Y. L. . ACS Symposium Series. 101, 13-37 (1979).
- von Weymarn, L. B., Retzlaff, C., Murphy, S. E. CYP2A6- and CYP2A13-catalyzed metabolism of the nicotine delta5'(1')iminium ion. J. Pharmacol. Exp. Ther. 343 (2), 307-315 (2012).
- Bell-Parikh, L. C., Guengerich, F. P. Kinetics of cytochrome P450 2E1-catalyzed oxidation of ethanol to acetic acid via acetaldehyde. J Biol Chem. 274 (34), 23833-23840 (1999).
- Chowdhury, G., Calcutt, M. W., Nagy, L. D., Guengerich, F. P. Oxidation of methyl and ethyl nitrosamines by cytochrome P450 2E1 and 2B1. Biochemistry. 51 (50), 9995-10007 (2012).
- Chowdhury, G., Calcutt, M. W., Guengerich, F. P. Oxidation of N-nitrosoalkylamines by human cytochrome P450 2A6: sequential oxidation to aldehydes and carboxylic acids and analysis of reaction steps. J Biol Chem. 285 (11), 8031-8044 (2010).
- Carlson, E. S., Upadhyaya, P., Hecht, S. S. Evaluation of nitrosamide formation in the cytochrome P450-mediated metabolism of tobacco-specific nitrosamines. Chem Res Toxicol. 29 (12), 2194-2205 (2016).
- Amin, S., Desai, D., Hecht, S. S., Hoffmann, D. Synthesis of tobacco-specific N-nitrosamines and their metabolites and results of related bioassays. Crit. Rev. Toxicol. 26, 139-147 (1996).
- Clark, A. G., Wong, S. T. A rapid chromatographic technique for the detection of dye-binding. Anal Biochem. 89 (2), 317-323 (1978).
- Pauli, G. F., et al. Importance of purity evaluation and the potential of quantitative (1)H NMR as a purity assay. J Med Chem. 57 (22), 9220-9231 (2014).
- van der Heeft, E., et al. A microcapillary column switching HPLC-electrospray ionization MS system for the direct identification of peptides presented by major histocompatibility complex class I molecules. Anal Chem. 70 (18), 3742-3751 (1998).
- White, E. H. The Chemistry of the N-Alkyl-N-nitrosoamides. I. Methods of Preparation. J. Am. Chem. Soc. 77, 6008-6010 (1955).
- Patten, C., et al. Evidence for cytochrome P450 2A6 and 3A4 as major catalysts for N'-nitrosonornicotine alpha-hydroxylation by human liver microsomes. Carcinogenesis. 18, 1623-1630 (1997).
- Wong, H. L., Murphy, S. E., Hecht, S. S. Cytochrome P450 2A-catalyzed metabolic activation of structurally similar carcinogenic nitrosamines: N'-nitrosonornicotine enantiomers, N-nitrosopiperidine, and N-nitrosopyrrolidine. Chem. Res. Toxicol. 18, 61-69 (2004).
- Hecht, S. S. Biochemistry, biology, and carcinogenicity of tobacco-specific N-nitrosamines. Chem. Res. Toxicol. 11, 559-603 (1998).
- von Weymarn, L. B., Zhang, Q. Y., Ding, X., Hollenberg, P. F. Effects of 8-methoxypsoralen on cytochrome P450 2A13. Carcinogenesis. 26 (3), 621-629 (2005).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneThis article has been published
Video Coming Soon