É necessária uma assinatura da JoVE para visualizar este conteúdo. Faça login ou comece sua avaliação gratuita.
Method Article
Um método geral para detectar a formação de Nitrosamide no metabolismo In Vitro de nitrosaminas por citocromo P450s
Neste Artigo
Resumo
Α-hidroxilação de nitrosaminas cancerígenas pelo citocromo P450s é a aceita via metabólica que produz o DNA de danos intermediários, que causam mutações. No entanto, novos dados indicam mais pode ocorrer oxidação para nitrosamides. Descrevemos um general método para a detecção de nitrosamides produzidos a partir de em vitro citocromo P450-catalisada metabolismo de nitrosaminas.
Resumo
N-nitrosaminas são um grupo bem estabelecido de agentes cancerígenos ambientais, que requerem a oxidação do citocromo P450 que apresentam atividade. O mecanismo aceito de activação metabólica envolve a formação de α-hydroxynitrosamines que decompõem espontaneamente para agentes de alquilação de DNA. Acúmulo de danos ao DNA e mutações resultantes, em última análise, pode levar ao câncer. Novas evidências indicam que α-hydroxynitrosamines pode ser ainda mais oxidado para nitrosamides processively pelo citocromo P450s. Porque nitrosamides são geralmente mais estáveis do que α-hydroxynitrosamines e pode também alquilação de DNA, nitrosamides pode desempenhar um papel na carcinogênese. Neste relatório, descrevemos um protocolo geral para avaliar a produção de nitrosamide em vitro citocromo P450-catalisada do metabolismo de nitrosaminas. Este protocolo utiliza uma abordagem geral para a síntese da nitrosamides relevantes e um em vitro citocromo P450 metabolismo ensaio utilizando espectrometria de massa em tandem de ionização de alta resolução da cromatografia líquida-nanospray para a deteção. Esse método detectado n'- nitrosonorcotinine como um metabólito menor de n- nitrosonornicotine no estudo de exemplo. O método tem alta sensibilidade e deteção de massa seletivamente devida à precisão. Aplicação deste método para uma grande variedade de sistemas de nitrosamina-citocromo P450 ajudará a determinar a generalidade desta transformação. Porque citocromo P450s são polimórficos e variar em atividade, uma melhor compreensão da formação de nitrosamide poderia ajudar na avaliação do risco individual de câncer.
Introdução
N-nitrosaminas são uma grande classe de substâncias cancerígenas encontradas na dieta, produtos do tabaco e o ambiente em geral; Eles também podem ser formados endogenamente no corpo humano1. Mais de 300 N -nitroso compostos foram testados e > 90% foram avaliados como sendo cancerígenos em animais modelos2,3. Para expor sua carcinogenicidade, estes compostos primeiro devem ser ativados pelo citocromo P450s1,2,3. A pesquisa mostra que citocromo P450s oxidar prontamente nitrosaminas para α-hydroxynitrosamines (Figura 1), que são compostos altamente reativos com meia-vida de 5 ~ s antes de decompor-se espontaneamente para alkyldiazohydroxides. Este último pode alkylate DNA após a perda de H2O e N2. O DNA resultante adutos, se sem conserto, pode causar mutações que, em caso de crítica onco - ou genes supressores de tumor, levam ao desenvolvimento de câncer1. Por este motivo, muito esforço tem sido dispendido para adquirir um completo entendimento das vias metabólicas, adutos de DNA e a jusante dos metabolitos de oxidação do citocromo P450 de nitrosaminas cancerígenas. Este conhecimento tem potencial aplicação de avaliação de risco de câncer individual4.
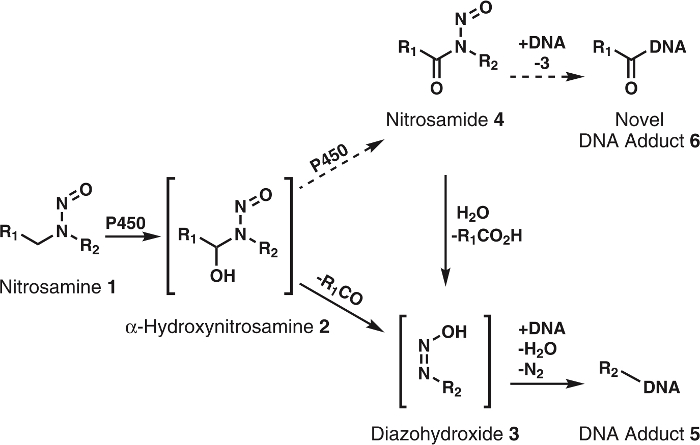
Figura 1: Geral e metabolismo proposto de nitrosaminas.
Nitrosaminas (1) são oxidadas por P450s para α-hydroxynitrosamines (2) que decompõem espontaneamente para alkyldiazohydroxides (3). Estes compostos podem ligar ao DNA para formar que adutos de DNA. Supor que 2 são mais oxidado P450s em nitrosamides 4. Estas diretamente podem vincular a DNA para formar o DNA romance adutos ou ser hidrolisado a 3 para formar que adutos de DNA conhecido. R1 e R2 representam qualquer grupo alquila. Clique aqui para ver uma versão maior desta figura.
Embora a hipótese de α-hydroxynitrosamine é solidamente apoiada por dados abrangentes, existem algumas inconsistências; uma importante é a meia-vida curta de α-hydroxynitrosamines5,6. É conhecido que estes compostos são produzidos na membrana do retículo endoplasmático e posteriormente alquilação de DNA nuclear. Dado seu tempo de vida de alguns segundos, isso é intrigante como esses intermediários sobrevivem a viagem necessária embora o citosol. Uma hipótese é que uma parte da α-hydroxynitrosamines processively são oxidados nitrosamides7,8, que são bastante estáveis na comparação9. Isso provavelmente ocorrerá através de retenção do α-hydroxynitrosamines no sítio activo citocromo P450. Precedente para este tipo de oxidação tem sido visto com nicotina10, álcoois11e simples alkylnitrosamines12,13. Além disso, nitrosamides são agentes cancerígenos de acção directa2,3. Com base em sua reatividade9, estes compostos são acreditados produzir DNA adutos idênticos aos resultantes da α-hydroxynitrosamines, juntamente com o novo, inexplorado DNA adutos (Figura 1). Assim, esta hipótese explica não só o transporte através do citosol, mas também a formação de DNA danificar os produtos.
Neste trabalho, é descrito um protocolo geral para avaliar o em vitro citocromo P450 mediada por conversão de nitrosaminas para nitrosamides. A conversão anteriormente relatada de n- nitrosonornicotine (NNN) para n- nitrosonorcotinine (NNC) pelo citocromo P450 2A6 é mostrada como um exemplo14. Aplicação do presente protocolo para uma ampla gama de sistemas de enzima-substrato ajudará a determinar a importância de nitrosamides no metabolismo de nitrosamina global.
Access restricted. Please log in or start a trial to view this content.
Protocolo
1. materiais e procedimentos gerais
- Synthesize NNN conforme descrito anteriormente 15. Obter norcotinine, P450 2A6 Baculosomes, sistema de regeneração de NADPH, amortecedor da reação de 0,5 x e todos os outros produtos químicos ou solventes de fontes comerciais em grau reagente.
- Espectro RMN de registro em um espectrômetro de 500 MHz. Produto químico relatório turnos como partes por milhão (ppm). Usar a picos de solventes residuais como referências internas para 1 H-NMR (7,26 ppm CDCl 3) e 13 C-NMR (77,2 ppm CDCl 3).
Nota: Pico divisão utilizada as seguintes abreviações: s = singleto, d = dubleto, dd = dubleto de parelhas, dt = dubleto de trigêmeos, dq = dubleto de quartetos, ddd = dubleto de gibão de Parelhas e m = multiplet. - Realizar a espectrometria de massa de alta resolução (HRMS) para compostos selecionados em um LTQ Orbitrap Velos e dados do relatório como m/z.
- Uso polygram pré-revestido placas de sílica gel TLC (40 mm x 80 mm, 0,2 mm de espessura) com indicador fluorescente de 254 nm para cromatografia de camada fina (TLC). Visualizar placas do TLC por irradiação de lâmpada UV.
- Realizar a cromatografia flash em um 60 Å, 70-150 malha sílica gel usando uma coluna de vidro de 1,5 x 15 cm.
2. Preparação de nitrosamide controle positivo (N ′-nitrosonorcotinine, NNC)
- seco, em estufa durante a noite (16 h, ~ 140 ° C), um 25 mL, balão de fundo redondo contendo uma barra de agitação magnética. Pela manhã, fixe o balão sob um fluxo de N 2 enquanto estiver usando um borbulhador de óleo para manter o fluxo de 2 N taxa sob uma bolha por segundo.
Nota: Após o resfriamento, sem precauções para mantê-lo sob N 2 são necessárias. - Em uma coifa, adicionar norcotinine (31,8 mg, 0.196 mmol), (5 mL) de anidrido acético e ácido acético (1 mL) no balão de refrigeração. Mexa essa mistura continuamente arrefecendo a 0 ° C, com um banho de água-gelo.
Atenção: Anidrido acético e ácido acético são corrosivos. - Adicionar NaNO 2 (33,3 mg, 0.483 mmol) em uma parcela e continuamente, agitar a mistura por 2,5 h. acompanhar os progressos reação do TLC (100% AcOEt, R f = 0,19, consulte a etapa 1.4).
Nota: Durante este tempo, a mistura se tornará cada vez mais amarela com subida ocasional. - Saciar a reação derramando a mistura em gelada H 2 O (18 mL). Extraia imediatamente a solução aquosa com 18 mL de CH 2 Cl 2 em um funil de separação de 100ml. Extrair a camada aquosa pelo menos 2 vezes adicionais com CH 2 Cl 2 (9 mL cada uma).
- Secar o organics em pool mais ~ 100 mg de MgSO 4 por 2 min. filtro e concentrar a solução por evaporação rotativa para produzir um óleo cru, amarelo. Aqueça o banho de água a 30 ° C durante a evaporação para remover o ácido acético residual.
Nota: O protocolo pode ser pausado aqui se o composto é dissolvido em CH 2 Cl 2 e a solução armazenada no escuro a 2-8 ° C. - Purificar o composto cru por cromatografia em coluna (ver passo 1.5) utilizando sílica gel como fase estacionária e 100% AcOEt como o eluente 16.
Atenção: NNC e nitrosamides relacionados devem ser manuseados com cuidado, como eles são considerados cancerígenos humanos. - Dissolver o composto puro no CDCl 3 e usar NMR (consulte a etapa 1.2) para confirmar a estrutura e determinar a molaridade desta solução 17. Armazene esta solução no escuro a 2-8 ° C até ser necessário.
Nota: Esta solução será usada como o controle positivo no ensaio em vitro (passo 3.5). Espectro RMN e mudanças químicas estão disponíveis nas informações de apoio. - Com uma solução NNC pura, confirmar a precisão pai massa e determinar massas de íon produto por infusão direta em um espectrômetro de massa de alta resolução (HRMS) sob parâmetros descritos nas etapas 1.3 e 4.3.
Nota: Massas de produto serão usadas para a detecção deste composto em vitro metabolismo ensaio (passo 4.3).
3. Uma nitrosamina-P450 em vitro incubação de exemplo
- remover P450 2A6 Baculosomes, sistema de regeneração-Vivid-NADPH e 10mm NADP + solução de estoque de um freezer-80 ° C e deixe-os descongelar no gelo. Uma vez descongelado, diluir o Baculosomes e o sistema de regeneração de NADPH-1:10 e 01:50, respectivamente, em um tubo único 1 mL com 0,5 reação X Buffer. Da mesma forma, adicionar 3 μL do NADP + solução de estoque para 97 μL de 0.5 X reação Buffer.
Nota: NADP + é sensível à luz. Manter essa solução protegida por seu recipiente de embrulho em papel de alumínio. Soluções de enzima são sensíveis aos ciclos de gelo-degelo; Este limite a não mais de 2 ciclos. Preparar alíquotas conforme necessário para futuras experiências. - Para cada incubação, adicionar 50 μL de solução de enzima (contendo 5 pmol P450) para um 1 mL do tubo contendo 40 μL de solução NNN 4 μM feitos com amortecedor da reação. Pre-incubar esta nova mistura por 2 min a 37 ° C, utilizando um banho de água e em seguida, adicionar 10 μL de solução diluída de NADP +. Incubar o sistema completo para 1 / 30 min a 37 ° C.
Nota: Usando intervalos de 5 min para tempos de incubação (por exemplo, 5, 10, 15 min, etc) irá fornecer um curso de tempo de formação suficiente do nitrosamide. - Após o tempo de incubação desejado, saciar pelo primeiro adicionando 10 μl de 3.0 N ZnSO 4 e em seguida 10 μL de 3.0 N Ba(OH) 2. Vórtice formarão a esta solução e um precipitado branco. Centrifugar a amostra a 8000 x g, durante 4 min para o precipitado de Pelotas.
Nota: O procedimento não deve pausar a este passo como os nitrosamides formados limitaram a estabilidade em soluções aquosas. Longas pausas podem resultar em falsos negativos. - Imediatamente pipetar o sobrenadante e analisar 2 μL por espectrometria de massa em tandem de alta resolução da nanoelectrospray-ionização positiva cromatografia líquida (LC-NSI +-HRMS/MS, passos 4,1-4,3).
- Para incubação do controle positivo, evaporar uma alíquota contendo 100 fmol de solução NNC sintetizada num tubo 1 mL sob um fluxo de N 2. Este frasco, adicione o sistema de enzima completa da etapa 3.2 e prossiga conforme descrito por etapas 3.3-3.4.
- Para incubação do controlo negativo, realizar o experimento como descritas (etapas 3,2-3,4), exceto a solução de substituir o 50 μL da enzima com 0.5 X amortecedor da reação.
4. Parâmetros de exemplo para a detecção de nitrosamide por LC-NSI +-HRMS/MS
- para o LC componente, aplicar o gradiente de várias etapa seguinte na etapa 4.2 para um sistema UPLC usando um comercial, mão-embalados 18 C18 (5 μm), 100 mm x 75 μm, coluna capilar de orifício μm 15.
- Usando 5 mM NH 4 OAc como solvente A e MeCN como solvente B, carregar a amostra na coluna executando a 5% B em 1 µ l/min de 0 - 5 min e em seguida, diminuindo a taxa de fluxo para 0.3 μL/min depois. Em seguida, execute um gradiente de 5 a 20% B 4 min, seguido por uma rampa para 55% B mais de 10 min e então re-equilibração a 5% B.
- Executar o LC-NSI +-HRMS/MS em um LTQ Orbitrap. Monitor para NNC por varredura completa e fragmentação de 2 MS. Executar uma varredura completa em uma resolução de 60.000 e extrair a massa exata do pai (192.07670) para uma tolerância em massa de 5 ppm. Fragmentação de 2 MS de uso para isolar o pai íons (2,0 amu) e fragmento por induzida por colisão dissociação (CID) com uma energia de colisão de 25 eV, resolução de 15.000 e verificação de tempo de 30 ms. extrair as massas precisas para íons de produto da NNC (m/z 192 m/z 134.04739 e 162.07874) para uma tolerância em massa de 5ppm.
Access restricted. Please log in or start a trial to view this content.
Resultados
Baseado no trabalho de branco et al. 19, norcotinine nitrosados para NNC foi limpa e de alto rendimento (80-92%) para produzir um padrão para o experimento em vitro . Evidências estruturais para uma bem sucedida reação foi obtida a partir de análises espectroscópicas, incluindo 1H-NMR, 13C-NMR, acolhedor e HSQC (informações de apoio), juntamente com o HRMS que confirmou a massa pai [M + H]+ dentro de 5 ppm ...
Access restricted. Please log in or start a trial to view this content.
Discussão
Elucidação do metabolismo de nitrosaminas é um componente crítico para a compreensão de sua carcinogenicidade. Desde que os envolvidos citocromo P450s e outras enzimas metabólicas são polimórficas, mais aplicação deste conhecimento potencialmente poderia identificar indivíduos de alto risco1,4. Novos dados indica que mais oxidação do α-hydroxynitrosamines, os presumíveis principais metabolitos de nitrosaminas envolvidos na ligação de DNA, para ni...
Access restricted. Please log in or start a trial to view this content.
Divulgações
Os autores não têm nada para divulgar.
Agradecimentos
Este estudo foi suportado por grant não. 81301-CA do Instituto Nacional do câncer. Agradecemos a Bob Carlson para assistência editorial, Dr. Peter Villalta Xun Ming para assistência de espectrometria de massa no recurso de compartilhado de bioquímica analítica do centro de câncer maçônico e Dr. Adam T. Zarth e Dr. Anna K. Michel por suas valiosas discussões e de entrada. O recurso de compartilhado de bioquímica analítica parcialmente financiado pela National câncer Instituto câncer centro suporte Grant CA-77598
Access restricted. Please log in or start a trial to view this content.
Materiais
| Name | Company | Catalog Number | Comments |
| Norcotinine | AKoS GmbH (Steinen, Germany) | CAS 17708-87-1, AKoS AK0S006278969 | |
| Acetic acid | Sigma-Aldrich | 695092 | |
| Acetic Anhydride | Sigma-Aldrich | 242845 | |
| Ammonium Acetate | Sigma-Aldrich | 431311 | |
| Barium Hydroxide | Sigma-Aldrich | 433373 | |
| D-Chloroform | Sigma-Aldrich | 151823 | |
| HPLC Acetonitrile | Sigma-Aldrich | 34998 | |
| Magnesium Sulfate | Sigma-Aldrich | M7506 | |
| Methylene Chloride | Sigma-Aldrich | 34856 | |
| Sodium Nitrite | Sigma-Aldrich | 237213 | |
| ViVid CYP2A6 Blue Screening Kit | Life Technologies | PV6140 | |
| Zinc Sulfate | Sigma-Aldrich | 221376 | |
| 0.5 mL tubes | Fisher | AB0533 | |
| 100 mL round bottom flask | Sigma-Aldrich | Z510424 | |
| 125 mL Erlenmeyer flask | Sigma-Aldrich | CLS4980125 | |
| 125 mL Separatory Funnel | Sigma-Aldrich | Z261017 | |
| 25 mL round bottom flask | Sigma-Aldrich | Z278262 | |
| 500 MHz NMR Spectrometer | Bruker | ||
| Allegra X-22R Centrifuge | Beckman-Coulter | ||
| LC vials | ChromTech | CTC–0957–BOND | |
| LTQ Orbitrap Velos | Thermo Scientific | ||
| Magnetic Stir bar | Sigma-Aldrich | Z127035 | |
| NMR tube | Sigma-Aldrich | Z274682 | |
| P1000, P200, and P10 pipettes | Eppendorf | ||
| Rotary evaporator | Sigma-Aldrich | Z691410 | |
| RSLCnano UPLC system | Thermo Scientific | ||
| Shaking Water Bath | Fisher | FSSWB15 | |
| Stir plate | Sigma-Aldrich | CLS6795420 | |
| PicoFrit Column | New Objective | PF3607515N5 | |
| Luna C18, 5 um | Phenomenex | 535913-1 |
Referências
- Rom, W. N., Markowitz, S. Environmental and Occupational Medicine. , 4th ed, Wolters Kluwer/Lippincott Williams & Wilkins. 1226-1239 (2007).
- Preussmann, R., Stewart, B. W. Chemical Carcinogens, ACS Monograph 182. Searle, C. E. 2, 2nd ed, American Chemical Society. 643-828 (1984).
- Magee, P. N., Montesano, R., Preussmann, R. Chemical Carcinogens. ACS monograph 173. Searle, C. E. , American Chemical Society. 491-625 (1976).
- Zhu, A. Z., et al. Alaska Native smokers and smokeless tobacco users with slower CYP2A6 activity have lower tobacco consumption, lower tobacco-specific nitrosamine exposure and lower tobacco-specific nitrosamine bioactivation. Carcinogenesis. 34 (1), 93-101 (2013).
- Mesić, M., Revis, C., Fishbein, J. C. Effects of structure on the reactivity of alpha-hydroxydialkynitrosamines in aqueous solutions. J. Am. Chem. Soc. 118, 7412-7413 (1996).
- Mochizuki, M., Anjo, T., Okada, M. Isolation and characterization of N-alkyl-N- (hydroxymethyl)nitrosamines from N-alkyl-N- (hydroperoxymethyl)nitrosamines by deoxygenation. Tetrahedron Lett. 21, 3693-3696 (1980).
- Guttenplan, J. B. Effects of cytosol on mutagenesis induced by N-nitrosodimethylamine, N-nitrosomethylurea and à-acetoxy-N-nitrosodimethylamine in different strains of Salmonella:evidence for different ultimate mutagens from N-nitrosodimethylmine. Carcinogenesis. 14, 1013-1019 (1993).
- Elespuru, R. K., Saavedra, J. E., Kovatch, R. M., Lijinsky, W. Examination of a-carbonyl derivatives of nitrosodimethylamine in ethylnitrosomethyamine as putative proximate carcinogens. Carcinogenesis. 14, 1189-1193 (1993).
- Chow, Y. L. ACS Symposium Series. 101, American Chemical Society. 13-37 (1979).
- von Weymarn, L. B., Retzlaff, C., Murphy, S. E. CYP2A6- and CYP2A13-catalyzed metabolism of the nicotine delta5'(1')iminium ion. J. Pharmacol. Exp. Ther. 343 (2), 307-315 (2012).
- Bell-Parikh, L. C., Guengerich, F. P. Kinetics of cytochrome P450 2E1-catalyzed oxidation of ethanol to acetic acid via acetaldehyde. J Biol Chem. 274 (34), 23833-23840 (1999).
- Chowdhury, G., Calcutt, M. W., Nagy, L. D., Guengerich, F. P. Oxidation of methyl and ethyl nitrosamines by cytochrome P450 2E1 and 2B1. Biochemistry. 51 (50), 9995-10007 (2012).
- Chowdhury, G., Calcutt, M. W., Guengerich, F. P. Oxidation of N-nitrosoalkylamines by human cytochrome P450 2A6: sequential oxidation to aldehydes and carboxylic acids and analysis of reaction steps. J Biol Chem. 285 (11), 8031-8044 (2010).
- Carlson, E. S., Upadhyaya, P., Hecht, S. S. Evaluation of nitrosamide formation in the cytochrome P450-mediated metabolism of tobacco-specific nitrosamines. Chem Res Toxicol. 29 (12), 2194-2205 (2016).
- Amin, S., Desai, D., Hecht, S. S., Hoffmann, D. Synthesis of tobacco-specific N-nitrosamines and their metabolites and results of related bioassays. Crit. Rev. Toxicol. 26, 139-147 (1996).
- Clark, A. G., Wong, S. T. A rapid chromatographic technique for the detection of dye-binding. Anal Biochem. 89 (2), 317-323 (1978).
- Pauli, G. F., et al. Importance of purity evaluation and the potential of quantitative (1)H NMR as a purity assay. J Med Chem. 57 (22), 9220-9231 (2014).
- van der Heeft, E., et al. A microcapillary column switching HPLC-electrospray ionization MS system for the direct identification of peptides presented by major histocompatibility complex class I molecules. Anal Chem. 70 (18), 3742-3751 (1998).
- White, E. H. The Chemistry of the N-Alkyl-N-nitrosoamides. I. Methods of Preparation. J. Am. Chem. Soc. 77, 6008-6010 (1955).
- Patten, C., et al. Evidence for cytochrome P450 2A6 and 3A4 as major catalysts for N'-nitrosonornicotine alpha-hydroxylation by human liver microsomes. Carcinogenesis. 18, 1623-1630 (1997).
- Wong, H. L., Murphy, S. E., Hecht, S. S. Cytochrome P450 2A-catalyzed metabolic activation of structurally similar carcinogenic nitrosamines: N'-nitrosonornicotine enantiomers, N-nitrosopiperidine, and N-nitrosopyrrolidine. Chem. Res. Toxicol. 18, 61-69 (2004).
- Hecht, S. S. Biochemistry, biology, and carcinogenicity of tobacco-specific N-nitrosamines. Chem. Res. Toxicol. 11, 559-603 (1998).
- von Weymarn, L. B., Zhang, Q. Y., Ding, X., Hollenberg, P. F. Effects of 8-methoxypsoralen on cytochrome P450 2A13. Carcinogenesis. 26 (3), 621-629 (2005).
Access restricted. Please log in or start a trial to view this content.
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados