Для просмотра этого контента требуется подписка на Jove Войдите в систему или начните бесплатную пробную версию.
Method Article
Генеральный метод для обнаружения Nitrosamide формирование в метаболизм в Vitro нитрозамины, цитохром P450s
В этой статье
Резюме
Α-гидроксилирования канцерогенных нитрозаминов цитохрома P450s является признанным метаболический путь, который производит повреждения ДНК промежуточных продуктов, которые вызывают мутации. Однако новые данные указывают на дальнейшего окисления nitrosamides может произойти. Мы описываем общий метод для обнаружения nitrosamides, образующиеся в vitro цитохрома P450-катализировано метаболизм нитрозамины.
Аннотация
N-нитрозаминов являются устоявшихся группой экологической канцерогенов, которые требуют цитохрома Р450 окисления проявлять активность. Признанных механизм активации метаболических предполагает формирование α-hydroxynitrosamines, который самопроизвольно разлагаться в ДНК алкилирующих агентов. Накопление повреждений ДНК и результате мутации в конечном итоге может привести к раку. Новые свидетельства указывают, что α-hydroxynitrosamines может быть далее окисляется до nitrosamides processively цитохрома P450s. Потому что nitrosamides как правило более стабильными, чем α-hydroxynitrosamines и может также алкилата ДНК, nitrosamides могут играть определенную роль в канцерогенезе. В настоящем докладе мы описываем общий протокол для оценки добычи nitrosamide в vitro цитохрома P450-катализировано метаболизм нитрозамины. Этот протокол использует общий подход к синтезу соответствующих nitrosamides и в пробирке цитохрома Р450 метаболизм assay с использованием жидкого хроматографии наноспрей тандем ионизации высокое разрешение масс-спектрометрии для обнаружения. Этот метод обнаружения N′- nitrosonorcotinine как незначительные метаболит N′- нитрозонорникотина в примере исследования. Метод обладает высокой чувствительностью и выборочно из-за точного обнаружения массового. Применение этого метода в широкий спектр нитрозамины цитохрома P450 систем поможет определить общего характера этой трансформации. Потому что цитохрома P450s являются полиморфными и различаются по активности, лучшего понимания формирования nitrosamide могут помочь в оценке риска отдельных рака.
Введение
N-нитрозаминов являются большой класс канцерогенов в диете, табачных изделий и общей окружающей среды; Они также могут быть созданы эндогенно в организм человека1. Более чем 300 N -Нитрозоые смеси были протестированы и > 90% были оценены как канцерогенные в животных моделей2,3. Выставлять их канцерогенности, эти соединения необходимо сначала активировать цитохрома P450s1,2,3. Исследования показывают, что цитохрома P450s легко окисляются нитрозаминов в α-hydroxynitrosamines (рис. 1), которые являются высоко реактивных соединений с периодом полураспада ~ 5 s перед спонтанно разлагается на alkyldiazohydroxides. Последний может алкилата ДНК после потери H2O и N2. Результате ДНК аддукты, если неустраненное, может вызвать мутации, которые, если в критических онко - или генов супрессоров опухолей, привести к развитию рака1. По этой причине, много усилий было потрачено получить полное представление о метаболических, аддукты ДНК и вниз по течению метаболитов цитохрома Р450 окисления канцерогенных нитрозаминов. Это знание имеет потенциальное применение в отдельных рак риска оценки4.
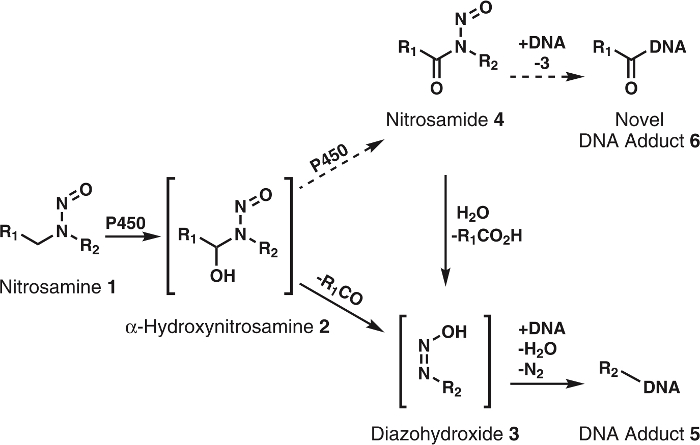
Рисунок 1: Общего и предлагаемых метаболизма нитрозамины.
Нитрозамины (1) окисляются P450s с α-hydroxynitrosamines (2), который самопроизвольно разлагаться в alkyldiazohydroxides (3). Эти соединения можно привязать к ДНК к форме, которую аддукты ДНК. Можно предположить, что 2 далее окисляются, P450s nitrosamides 4. Эти можно непосредственно связываются с ДНК форме Роман ДНК аддукты или гидролизуется до 3 к форме, которую аддукты известных ДНК. R1 и R2 представляют собой любой алкильную группу. Пожалуйста, нажмите здесь, чтобы посмотреть большую версию этой фигуры.
Хотя α-hydroxynitrosamine гипотеза поддерживается прочно обширные статистические данные, есть несколько несоответствий; один крупный является короткий период полураспада α-hydroxynitrosamines5,6. Известно, что эти соединения производятся на мембраны эндоплазматического ретикулума и позднее алкилата ядерной ДНК. Учитывая их жизни на несколько секунд, это вызывает недоумение, как эти промежуточные выжить необходимые поездки хотя цитозоль. Одна из гипотез является, что часть α-hydroxynitrosamines processively окисляются до7,nitrosamides8, которые являются довольно стабильными в сравнение9. Это предположительно будет происходить через удержание α-hydroxynitrosamines на активном узле цитохрома P450. Прецедент для этого типа окисления видел с никотина10, спирты11и простой alkylnitrosamines12,13. Кроме того nitrosamides, прямого действия канцерогенов2,3. Основываясь на их реакционную способность9, эти соединения считаются производить ДНК аддукты идентичны результате α-hydroxynitrosamines вместе с новой, неизведанной ДНК аддукты (рис. 1). Таким образом эта гипотеза не только объясняет транспорта через цитозоле, но также формирование ДНК повреждения изделия.
В этом документе описывается общий протокол для оценки в vitro цитохрома P450-опосредованной преобразование нитрозаминов в nitrosamides. Сообщалось ранее преобразование N′- нитрозонорникотина (NNN) N′- nitrosonorcotinine (НЦП) от цитохрома Р450 2A6 продемонстрированы как пример14. Применение настоящего протокола к широкому спектру субстрата ферментных систем поможет определить значение nitrosamides в целом метаболизм нитрозамины.
Access restricted. Please log in or start a trial to view this content.
протокол
1. материалы и общие процедуры
- синтезируют NNN как описано 15. Получить norcotinine, P450 2A6 Baculosomes, системы регенерации NADPH, 0.5 x буфер реакции и других химических веществ или растворителей из коммерческих источников в классе реагент.
- Запись NMR спектров на 500 МГц спектрометр. Доклад химические сдвиги как частей на миллион (ppm). Использование остаточного растворителя вершины как внутренние ссылки для 1 H ЯМР (7,26 ppm CDCl 3) и 13 C-ЯМР (77,2 ppm CDCl 3).
Примечание: Пик расщепления используются следующие сокращения: s = синглет, d = Дуплет, dd = Дуплет Дуплеты, dt = Дуплет Тройняшки, dq = Дуплет квартетов, ddd = Дуплет Дуплет Дуплеты, и m = multiplet. - Выполнять масс-спектрометрии высокого разрешения (СУЛР) для отдельных соединений на LTQ Орбитрэп Velos и данные отчета как m/z.
- Использование polygram предварительно покрытием пластин силикагель TLC (40 x 80 мм, толщиной 0,2 мм) с 254 Нм флуоресцентный индикатор для тонкослойной хроматографии (ТСХ). Визуализировать TLC пластины, УФ-лампа облучения.
- Выполнять флэш-хроматографии на 60 Е, 70-150 сетки силикагель с помощью столбца стекла 1,5 см х 15 см.
2. Подготовка nitrosamide позитивного управления (N ′-nitrosonorcotinine, НЯЦ РК)
- сухой, в духовке на ночь (16 ч, ~ 140 ° C), 25 мл, раунд нижней колбе содержащие бар магнитные перемешать. Утром, прохладный колбу под поток N 2 при использовании барботер нефти, чтобы сохранить поток 2 N оценить под одной пузырь в секунду.
Примечание: После охлаждения, требуются не меры предосторожности, чтобы держать флакон под N 2. - В Зонта, добавить norcotinine (31,8 мг, 0,196 ммоль), ангидрид уксусной кислоты (5 мл) и уксусной кислоты (1 мл) в охлажденный настой. Перемешайте эту смесь непрерывно во время охлаждения до 0 ° C с ванной водно ледниковые.
Осторожностью: Ангидрид уксусной кислоты и уксусной кислоты являются коррозионные. - Добавить NaNO 2 (33,3 мг, 0.483 ммоль) в одной порции и непрерывно размешивать смесь для 2,5 ч. контролировать прогресс реакции методом ТСХ (100% EtOAc, R f = 0,19, шаг 1.4).
Примечание: За это время смесь станет все более желтый с случайных пузырьков. - Утолить реакции путем заливки смеси в ледяной H 2 O (18 мл). Сразу же извлечь водный раствор с 18 мл CH 2 Cl 2 в воронку separatory 100 мл. Экстракт водный слой по крайней мере 2 еще раз с CH 2 Cl 2 (9 мл каждая).
- Сухой пуле organics более ~ 100 мг 4 MgSO на 2 мин фильтр и сконцентрировать решение испарением Ротари приносить нефти сырой, желтый. Тепло водяной бане до 30 ° C во время испарения для удаления остаточного уксусная кислота.
Примечание: Протокол может быть приостановлена здесь если смесь растворяется в CH 2 Cl 2 и решение, хранящиеся в темноте при 2-8 ° C. - Очистить территорию сырой, колоночной хроматографии (см. шаг 1.5) с помощью силикагель стационарной фазы и 100% EtOAc как элюента 16.
Осторожностью: НЯЦ РК и связанных с ними nitrosamides должны быть обработаны с осторожностью, поскольку они, как предполагается, человеческих канцерогенов. - Распустить чистого соединения в CDCl 3 и использовать ЯМР (см. шаг 1.2) для подтверждения структуры и определить Молярность это решение 17. Хранить это решение в темноте при 2-8 ° C до тех пор, пока требуется.
Примечание: Это решение будет использоваться как положительный контроль в assay в пробирке (шаг 3.5). NMR спектров и химические сдвиги доступны в поддержку информации. - С чистой решения НЯЦ РК, подтвердить точное родительского массы и определить продукт ионной масс путем прямого настой на разрешением масс-спектрометр (СУЛР) под параметры, описанные в шаге 1.3 и 4.3.
Примечание: Массы продукта будет использоваться для обнаружения этого соединения в в vitro метаболизм assay (шаг 4.3).
3. Пример нитрозамины P450 в vitro инкубации
- Удалить P450 2A6 Baculosomes, яркие-NADPH-регенерация системы и 10 мм NADP + складе решение из морозильной камеры-80 ° C и пусть они оттепели на льду. После размораживания, разбавить Baculosomes и NADPH-регенерация системы 1:10 и 1:50, соответственно, в одной 1 мл трубку с 0.5 X реакции буфера. Аналогичным образом, добавить 3 мкл NADP + складе решение 97 мкл 0.5 X буфер реакции.
Примечание: NADP + — светочувствительный. Держите это решение, защищенных в алюминиевой фольги, заключив его контейнера. Фермент решения чувствительны к циклам замораживания оттаивания; Ограничивайте это не более чем 2 циклов. Подготовить аликвоты, необходимых для дальнейших экспериментов. - Для каждого инкубации, добавьте 50 мкл раствора фермента (содержащие 5 пмоль P450) по 1 мл трубки содержащие 40 мкл раствора 4 мкм NNN с буфером реакции. Предварительно инкубировать эта новая смесь для 2 минут при 37 ° C, с помощью водяной бане, а затем добавить 10 мкл разбавленного раствора NADP +. Инкубировать полной системы для 1-30 минут при 37 ° с.
Примечание: С помощью 5-мин интервалами для инкубации раз (например, 5, 10, 15 мин, и т.д.) будет обеспечивать достаточную курс время формирования nitrosamide. - После желаемого инкубации время утолить первое добавление 10 мкл 3.0 N ZnSO 4 и затем 10 мкл 3.0 N Ba(OH) 2. Вихревой это решение и Белый преципитат лягут. Центрифуга образца на 8000 x g 4 мин для пеллет преципитата.
Примечание: Процедура должна не прерывалось на этот шаг как сформированные nitrosamides имеют ограниченное стабильности в водных растворах. Длительных пауз может привести к ложным негативов. - Немедленно Пипетка супернатант и анализировать 2 мкл положительные nanoelectrospray ионизации жидкостной хроматографии высокого разрешения тандем массовым спектрометрированием (LC-НСИ +-HRMS/MS, шаги 4.1-4.3).
- Для позитивного управления инкубаций, испаряются Алиготе, содержащий 100 фмоль синтезированные решения НЯЦ РК в 1 мл трубку под поток N 2. Этот флакон, шаге 3.2 добавьте полный фермента системы и действуйте, как описано для шагов 3.3-3.4.
- Для отрицательного контроля инкубаций, выполнить эксперимент как описано (шаги 3.2-3.4) за исключением замены 50 мкл фермента раствор с 0.5 X буфер реакции.
4. Пример параметров для обнаружения nitrosamide LC-НСИ +-HRMS/МС
- для LC компонент, применить следующие многоступенчатый градиент в шаге 4.2 на UPLC систему, с помощью коммерческих, рука Упакованные 18 C18 (5 мкм), 100 мм x 75 мкм, 15 мкм отверстия капиллярной колонки.
- С использованием 5 мм NH OAc 4 как растворитель A и MeCN растворителей b, загрузите образец на столбце, запустив на 5% B в 1 мкл/мин от 0 - 5 мин и затем потом замедляется скорость потока до 0,3 мкл/мин. Далее, запустите градиент от 5 до 20% В течение 4 мин, после чего Нагрейте до 55% В течение 10 мин, а затем повторно уравновешивания до 5% б.
- Выполнять LC-НСИ +-HRMS/МС на LTQ Орбитрэп. Монитор для НЯЦ РК, полная проверка и MS 2 фрагментации. Выполните полное сканирование с разрешением 60 000 и извлечь Точная родительского массы (192.07670) на массовые терпимости 5 ppm. Использование MS 2 фрагментации изолировать родительского ионов (2,0 сам) и фрагмент, столкновения индуцированной диссоциации (СИД) с энергией столкновений 25 eV, резолюции 15 000, и время 30 г-жа сканирования извлеките точных масс для продукта ионов НЯЦ РК (m/z 192 m/z 134.04739 и 162.07874) на массовые терпимости 5 ppm.
Access restricted. Please log in or start a trial to view this content.
Результаты
Основано на работе белого и др. 19, norcotinine был нитрозированные НЯЦ чисто и в высокодоходных (80-92%) производить стандарт для эксперимента в пробирке . Структурные доказательства для успешного реакции был получен от спектроскопического анализа, вклю?...
Access restricted. Please log in or start a trial to view this content.
Обсуждение
Изучение метаболизма нитрозамины является критическим компонентом для понимания их канцерогенности. Поскольку участие цитохрома P450s и других метаболических ферментов являются полиморфными, дальнейшее применение этого знания потенциально может определить высокого риска лиц
Access restricted. Please log in or start a trial to view this content.
Раскрытие информации
Авторы не имеют ничего сообщать.
Благодарности
Это исследование было поддержано Грант не. CA-81301 из Национального института рака. Мы благодарим Боб Карлсон для редакционной помощи, д-р Питер Villalta и Xun Ming для оказания помощи масс-спектрометрии в аналитическая Биохимия общий ресурс масонской онкологический центр и д-р Адам т. Zarth и д-р Анна K. Мишель за их ценное обсуждение и ввода. Аналитический ресурс общей биохимии частично поддерживается путем национальных рака институт рака центр поддержки Грант CA-77598
Access restricted. Please log in or start a trial to view this content.
Материалы
| Name | Company | Catalog Number | Comments |
| Norcotinine | AKoS GmbH (Steinen, Germany) | CAS 17708-87-1, AKoS AK0S006278969 | |
| Acetic acid | Sigma-Aldrich | 695092 | |
| Acetic Anhydride | Sigma-Aldrich | 242845 | |
| Ammonium Acetate | Sigma-Aldrich | 431311 | |
| Barium Hydroxide | Sigma-Aldrich | 433373 | |
| D-Chloroform | Sigma-Aldrich | 151823 | |
| HPLC Acetonitrile | Sigma-Aldrich | 34998 | |
| Magnesium Sulfate | Sigma-Aldrich | M7506 | |
| Methylene Chloride | Sigma-Aldrich | 34856 | |
| Sodium Nitrite | Sigma-Aldrich | 237213 | |
| ViVid CYP2A6 Blue Screening Kit | Life Technologies | PV6140 | |
| Zinc Sulfate | Sigma-Aldrich | 221376 | |
| 0.5 mL tubes | Fisher | AB0533 | |
| 100 mL round bottom flask | Sigma-Aldrich | Z510424 | |
| 125 mL Erlenmeyer flask | Sigma-Aldrich | CLS4980125 | |
| 125 mL Separatory Funnel | Sigma-Aldrich | Z261017 | |
| 25 mL round bottom flask | Sigma-Aldrich | Z278262 | |
| 500 MHz NMR Spectrometer | Bruker | ||
| Allegra X-22R Centrifuge | Beckman-Coulter | ||
| LC vials | ChromTech | CTC–0957–BOND | |
| LTQ Orbitrap Velos | Thermo Scientific | ||
| Magnetic Stir bar | Sigma-Aldrich | Z127035 | |
| NMR tube | Sigma-Aldrich | Z274682 | |
| P1000, P200, and P10 pipettes | Eppendorf | ||
| Rotary evaporator | Sigma-Aldrich | Z691410 | |
| RSLCnano UPLC system | Thermo Scientific | ||
| Shaking Water Bath | Fisher | FSSWB15 | |
| Stir plate | Sigma-Aldrich | CLS6795420 | |
| PicoFrit Column | New Objective | PF3607515N5 | |
| Luna C18, 5 um | Phenomenex | 535913-1 |
Ссылки
- Rom, W. N., Markowitz, S. Environmental and Occupational Medicine. , 4th ed, Wolters Kluwer/Lippincott Williams & Wilkins. 1226-1239 (2007).
- Preussmann, R., Stewart, B. W. Chemical Carcinogens, ACS Monograph 182. Searle, C. E. 2, 2nd ed, American Chemical Society. 643-828 (1984).
- Magee, P. N., Montesano, R., Preussmann, R. Chemical Carcinogens. ACS monograph 173. Searle, C. E. , American Chemical Society. 491-625 (1976).
- Zhu, A. Z., et al. Alaska Native smokers and smokeless tobacco users with slower CYP2A6 activity have lower tobacco consumption, lower tobacco-specific nitrosamine exposure and lower tobacco-specific nitrosamine bioactivation. Carcinogenesis. 34 (1), 93-101 (2013).
- Mesić, M., Revis, C., Fishbein, J. C. Effects of structure on the reactivity of alpha-hydroxydialkynitrosamines in aqueous solutions. J. Am. Chem. Soc. 118, 7412-7413 (1996).
- Mochizuki, M., Anjo, T., Okada, M. Isolation and characterization of N-alkyl-N- (hydroxymethyl)nitrosamines from N-alkyl-N- (hydroperoxymethyl)nitrosamines by deoxygenation. Tetrahedron Lett. 21, 3693-3696 (1980).
- Guttenplan, J. B. Effects of cytosol on mutagenesis induced by N-nitrosodimethylamine, N-nitrosomethylurea and à-acetoxy-N-nitrosodimethylamine in different strains of Salmonella:evidence for different ultimate mutagens from N-nitrosodimethylmine. Carcinogenesis. 14, 1013-1019 (1993).
- Elespuru, R. K., Saavedra, J. E., Kovatch, R. M., Lijinsky, W. Examination of a-carbonyl derivatives of nitrosodimethylamine in ethylnitrosomethyamine as putative proximate carcinogens. Carcinogenesis. 14, 1189-1193 (1993).
- Chow, Y. L. ACS Symposium Series. 101, American Chemical Society. 13-37 (1979).
- von Weymarn, L. B., Retzlaff, C., Murphy, S. E. CYP2A6- and CYP2A13-catalyzed metabolism of the nicotine delta5'(1')iminium ion. J. Pharmacol. Exp. Ther. 343 (2), 307-315 (2012).
- Bell-Parikh, L. C., Guengerich, F. P. Kinetics of cytochrome P450 2E1-catalyzed oxidation of ethanol to acetic acid via acetaldehyde. J Biol Chem. 274 (34), 23833-23840 (1999).
- Chowdhury, G., Calcutt, M. W., Nagy, L. D., Guengerich, F. P. Oxidation of methyl and ethyl nitrosamines by cytochrome P450 2E1 and 2B1. Biochemistry. 51 (50), 9995-10007 (2012).
- Chowdhury, G., Calcutt, M. W., Guengerich, F. P. Oxidation of N-nitrosoalkylamines by human cytochrome P450 2A6: sequential oxidation to aldehydes and carboxylic acids and analysis of reaction steps. J Biol Chem. 285 (11), 8031-8044 (2010).
- Carlson, E. S., Upadhyaya, P., Hecht, S. S. Evaluation of nitrosamide formation in the cytochrome P450-mediated metabolism of tobacco-specific nitrosamines. Chem Res Toxicol. 29 (12), 2194-2205 (2016).
- Amin, S., Desai, D., Hecht, S. S., Hoffmann, D. Synthesis of tobacco-specific N-nitrosamines and their metabolites and results of related bioassays. Crit. Rev. Toxicol. 26, 139-147 (1996).
- Clark, A. G., Wong, S. T. A rapid chromatographic technique for the detection of dye-binding. Anal Biochem. 89 (2), 317-323 (1978).
- Pauli, G. F., et al. Importance of purity evaluation and the potential of quantitative (1)H NMR as a purity assay. J Med Chem. 57 (22), 9220-9231 (2014).
- van der Heeft, E., et al. A microcapillary column switching HPLC-electrospray ionization MS system for the direct identification of peptides presented by major histocompatibility complex class I molecules. Anal Chem. 70 (18), 3742-3751 (1998).
- White, E. H. The Chemistry of the N-Alkyl-N-nitrosoamides. I. Methods of Preparation. J. Am. Chem. Soc. 77, 6008-6010 (1955).
- Patten, C., et al. Evidence for cytochrome P450 2A6 and 3A4 as major catalysts for N'-nitrosonornicotine alpha-hydroxylation by human liver microsomes. Carcinogenesis. 18, 1623-1630 (1997).
- Wong, H. L., Murphy, S. E., Hecht, S. S. Cytochrome P450 2A-catalyzed metabolic activation of structurally similar carcinogenic nitrosamines: N'-nitrosonornicotine enantiomers, N-nitrosopiperidine, and N-nitrosopyrrolidine. Chem. Res. Toxicol. 18, 61-69 (2004).
- Hecht, S. S. Biochemistry, biology, and carcinogenicity of tobacco-specific N-nitrosamines. Chem. Res. Toxicol. 11, 559-603 (1998).
- von Weymarn, L. B., Zhang, Q. Y., Ding, X., Hollenberg, P. F. Effects of 8-methoxypsoralen on cytochrome P450 2A13. Carcinogenesis. 26 (3), 621-629 (2005).
Access restricted. Please log in or start a trial to view this content.
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены