Un abonnement à JoVE est nécessaire pour voir ce contenu. Connectez-vous ou commencez votre essai gratuit.
Method Article
Une méthode générale pour la détection des Nitrosamide Formation du métabolisme In Vitro des Nitrosamines par Cytochrome P450s
Dans cet article
Résumé
Α-hydroxylation des nitrosamines cancérogènes par le cytochrome P450s est la voie métabolique acceptée qui produit des intermédiaires endommageant l’ADN, ce qui provoquent des mutations. Toutefois, les nouvelles données indiquent encore l’oxydation en nitrosamides peut se produire. Nous décrivons un général méthode pour détecter les nitrosamides produites in vitro du cytochrome P450-catalysée métabolisme de nitrosamines.
Résumé
N-nitrosamines sont un groupe bien établi des carcinogènes environnementaux, qui exigent l’oxydation du cytochrome P450 pour montrer l’activité. Le mécanisme accepté d’activation métabolique implique la formation de α-hydroxynitrosamines qui se décomposent spontanément aux agents alkylants ADN. L’accumulation de dommages à l’ADN et les mutations qui en résulte peut finalement mener au cancer. Nouveaux éléments de preuve indiquent que α-hydroxynitrosamines peut être encore oxydé nitrosamides progressivement par le cytochrome P450s. Parce que nitrosamides sont généralement plus stables que les α-hydroxynitrosamines et pouvez également alkylat ADN, nitrosamides peut jouer un rôle dans la cancérogenèse. Dans ce rapport, nous décrivons un protocole général pour évaluer la production de nitrosamide de in vitro du cytochrome P450-catalysée du métabolisme des nitrosamines. Ce protocole utilise une approche générale de la synthèse de la nitrosamides pertinents et un essai in vitro du cytochrome P450 métabolisme avec par spectrométrie de masse en tandem par chromatographie liquide-tuyères d’ionisation-haute résolution pour la détection. Cette méthode détecté N′- nitrosonorcotinine comme un métabolite mineur de N′- nitrosonornicotine dans l’étude de l’exemple. La méthode a haute sensibilité et le dépistage de masse sélectivement due à précis. Application de cette méthode à une grande variété de systèmes de nitrosamine-cytochrome P450 aidera à déterminer la portée générale de cette transformation. Parce que le cytochrome P450s sont polymorphes et varier en activité, une meilleure compréhension de la formation de nitrosamide pourrait aider dans l’évaluation du risque individuel de cancer.
Introduction
N-nitrosamines sont une large classe de substances cancérigènes dans l’alimentation, de produits du tabac et de l’environnement en général ; ils peuvent également se former de manière endogène dans le corps humain1. Plus de 300 N -nitroso composés ont été testés et > 90 % ont été évalués comme cancérogène chez les modèles animaux2,3. Pour exposer leur cancérogénicité, ces composés doivent tout d’abord être activés par le cytochrome P450s1,2,3. La recherche montre que le cytochrome P450s oxyder facilement nitrosamines de α-hydroxynitrosamines (Figure 1), qui sont des composés très réactifs ayant une demi-vie de ~ 5 s avant de se décomposer spontanément à alkyldiazohydroxides. Ce dernier peut alkylat ADN après la perte de H2O et N2. Adduits de l’ADN qui en résulte, si non réparé, peut causer des mutations qui, en cas de critique onco - ou les gènes suppresseurs de tumeur, mener à cancer du développement1. Pour cette raison, beaucoup d’efforts ont été déployé afin d’acquérir une compréhension complète des voies métaboliques, adduits à l’ADN et des métabolites en aval de l’oxydation du cytochrome P450 des nitrosamines cancérigènes. Cette connaissance a application potentielle dans l’évaluation de risque de cancer individuel4.
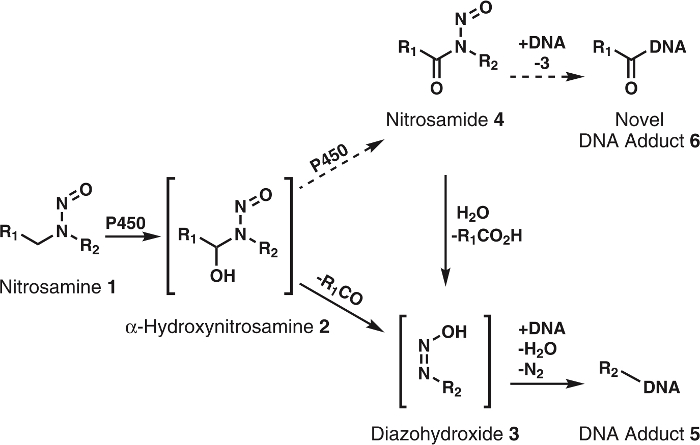
Figure 1 : Général et métabolisme proposé des nitrosamines.
Nitrosamines (1) sont oxydés par P450s de α-hydroxynitrosamines (2) qui se décomposent spontanément à alkyldiazohydroxides (3). Ces composés peuvent lier à l’ADN pour former que des adduits d’ADN. On fait l’hypothèse que les 2 sont oxydés par P450s nitrosamides 4. Ceux-ci peuvent directement lier à l’ADN pour former de nouveaux ADN adduits ou être hydrolysé en 3 pour former que des adduits d’ADN connu. R1 et R2 représentent un groupe alkyle. S’il vous plaît cliquez ici pour visionner une version agrandie de cette figure.
Bien que l’hypothèse de le α-hydroxynitrosamine est solidement soutenue par nombreuses données, il y a quelques incohérences ; importante est la courte demi-vie des α-hydroxynitrosamines5,6. On sait que ces composés sont produits à la membrane du réticulum endoplasmique et plus tard alkylation de l’ADN nucléaire. Compte tenu de leur durée de vie de quelques secondes, c’est curieux comment ces intermédiaires survivent le voyage requis si le cytosol. Une hypothèse est qu’une partie de le α-hydroxynitrosamines s’oxydent progressivement nitrosamides7,8, qui sont assez stables en comparaison de9. Cela se produirait vraisemblablement par l’intermédiaire de rétention des α-hydroxynitrosamines dans le site actif de cytochrome P450. Précédent pour ce type d’oxydation a été constaté avec la nicotine10, alcools11et simple alkylnitrosamines12,13. En outre, nitrosamides sont action directe carcinogènes2,3. Basé sur leur réactivité9, ces composés sont crus pour produire de l’ADN des adduits identiques à celles qui résultent de le α-hydroxynitrosamines ainsi que de nouveau, adduits à l’ADN inexploré (Figure 1). Ainsi, cette hypothèse explique non seulement le transport à travers le cytosol, mais également la formation de l’ADN endommager les produits.
Dans cet article, on décrit un protocole général pour évaluer in vitro du cytochrome P450 induite par la conversion des nitrosamines nitrosamides. La conversion a déjà été indiquée de N′- nitrosonornicotine (NNN) N′- nitrosonorcotinine (NNC) de 2 a 6 du cytochrome P450 est présentée comme un exemple de14. Application du présent protocole à un large éventail de systèmes de substrat-enzyme aidera à déterminer l’importance des nitrosamides dans métabolisme global de nitrosamine.
Access restricted. Please log in or start a trial to view this content.
Protocole
1. matériaux et procédures générales
- synthétisent NNN décrite précédemment 15. Obtenir norcotinine, P450 2 a 6 Baculosomes, système de régénération de NADPH, tampon de réaction x 0,5 et tous les autres produits chimiques ou des solvants de sources commerciales en réactif.
- Des spectres de RMN de l’enregistrement sur un spectromètre 500 MHz. Déplacements chimiques en rapport en parties par million (ppm). Utiliser des pics de solvants résiduels comme références internes pour 1 H-RMN (7,26 ppm CDCl 3) et 13 C-RMN (77,2 ppm CDCl 3).
NOTE : Fractionnement de pointe utilisé les abréviations suivantes : s = singulet, d = doublet, dd = doublet de doublets, dt = doublet de triplets, dq = doublet des quatuors, ddd = doublet de doublet de doublets et m = multiplet. - Effectuer la spectrométrie de masse haute résolution (SGRH) pour certains composés sur un LTQ Orbitrap valant Velos et les données du rapport m/z.
- Utilisation polygram pré-enrobé plaques de gel de silice TLC (40 mm x 80 mm, 0,2 mm d’épaisseur) avec indicateur fluorescent de 254 nm pour la chromatographie sur couche mince (CCM). Visualiser les plaques de CCM par l’irradiation UV lampe.
- Exécuter flash chromatographie sur une 60 Å, gel de silice 70-150 mesh en utilisant une colonne de verre 1,5 cm x 15 cm.
2. Préparation du contrôle positif de nitrosamide (N ′-nitrosonorcotinine, CNN)
- sec, dans un four toute la nuit (16 h, ~ 140 ° C), un 25 mL, ballon contenant une barre d’agitation magnétique. Le matin, cool le ballon sous un flux de N 2, tout en utilisant un barboteur d’huile pour maintenir le flux de 2 N taux sous une bulle par seconde.
Nota : Après refroidissement, aucune précaution pour garder le ballon sous N 2 n’est nécessaires. - Sous une hotte, ajouter norcotinine (31,8 mg, 0,196 mmol), l’anhydride acétique (5 mL) et l’acide acétique (1 mL) dans le ballon refroidi. Incorporer ce mélange en continu en refroidissant à 0 ° C avec un bain de glace d’eau.
Mise en garde : L’anhydride acétique et l’acide acétique sont corrosifs. - Ajouter NaNO 2 (33,3 mg, 0,483 mmol) dans une portion et agiter continuellement le mélange pour 2,5 h. suivre les progrès de réaction par TLC (100 % EtOAc, R f = 0,19, reportez-vous à l’étape 1.4).
Remarque : Pendant cette période, le mélange va devenir plus en plus jaune avec bulles occasionnels. - Étancher la réaction en versant le mélange en glacee H 2 O (18 mL). L’extrait immédiatement la solution aqueuse avec 18 mL de CH 2 Cl 2 dans une ampoule à décanter de 100 mL. Extraire la phase aqueuse au moins 2 fois avec CH 2 Cl 2 (9 mL chacune).
- Sécher les matières organiques regroupées plus de ~ 100 mg de MgSO 4 pendant 2 min. filtre et concentrer la solution par évaporateur rotatif pour produire une huile brute, jaune. Faire chauffer le bain d’eau à 30 ° C au cours de l’évaporation à éliminer l’acide acétique résiduel.
Remarque : Le protocole peut être suspendu ici si le composé est dissous dans la CH 2 Cl 2 et la solution conservés dans l’obscurité à 2-8 ° C. - Purifier le brut composé par chromatographie sur colonne (Voir l’étape 1.5) avec gel de silice comme phase stationnaire et 100 % EtOAc comme l' éluant 16.
Mise en garde : CNN et nitrosamides connexes doivent être manipulés avec précaution car ils sont supposés pour être cancérogènes pour les humains. - Dissoudre le composé pur dans CDCl 3 et utilisent la RMN (Voir l’étape 1.2) pour confirmer la structure et déterminer la molarité de cette solution 17. Conserver cette solution dans l’obscurité entre 2 et 8 ° C jusqu'à ce que nécessaire.
NOTE : Cette solution servira comme contrôle positif dans l’essai in vitro avec (étape 3.5). Les spectres RMN et les déplacements chimiques sont disponibles dans l’Information à l’appui. - Avec une solution pure de CNN, confirmer la précision masse de parent et de déterminer les masses des ions produit par perfusion directe sur un spectromètre de masse à haute résolution (SGRH) sous paramètres décrits aux points 1.3 et 4.3.
Remarque : Les masses produit seront utilisés pour détecter ce composé dans le dosage de métabolisme in vitro (étape 4.3).
3. Une nitrosamine-P450 in vitro incubation de l’exemple
- supprimer P450 2 a 6 Baculosomes, Vivid-NADPH-régénération système et 10 mM NADP + Solution-mère d’un congélateur à-80 ° C et laissez-les décongeler sur la glace. Une fois décongelé, diluer le Baculosomes et le NADPH-régénération système 1:10 et 01:50, respectivement, dans un tube unique 1 mL avec réaction de X 0,5 tampon. De même, ajoutez 3 μL du NADP + Solution-mère à 97 μL de 0,5 X réaction Buffer.
Remarque : Le NADP + est sensible à la lumière. Conserver cette solution protégée en l’enveloppant de son conteneur en aluminium. Les solutions enzymatiques sont sensibles aux cycles de gel-dégel ; Cela se limite à pas plus de 2 cycles. Préparer des aliquotes nécessaires pour de futures expériences. - Pour chaque incubation, ajouter 50 μL de solution d’enzyme (contenant 5 pmol P450) à un 1 mL tube contenant 40 μL de solution NNN μM 4 faite avec tampon de réaction. Incuber avant ce nouveau mélange pendant 2 min à 37 ° C à l’aide d’un bain d’eau et puis ajouter 10 μL de la solution diluée de NADP +. Incuber le système complet pour 1-30 min à 37 ° C.
Remarque : L’utilisation des intervalles de 5 min pour le temps d’incubation (par exemple 5, 10, 15 min, etc.) donnera un cours de temps de formation nitrosamide suffisants. - Après l’heure souhaitée d’incubation, étancher par première ajouter 10 μl de 3,0 ZnSO N 4 et ensuite 10 μL de 3,0 N Ba(OH) 2. Vortex, cette solution et un précipité blanc seront forme. Centrifuger l’échantillon à 8000 x g pendant 4 min granuler le précipité.
Remarque : La procédure doit arrête pas à cette étape que les nitrosamides formés ont peu de stabilité en solution aqueuse. Faux négatifs peuvent entraîner de longues pauses. - Immédiatement Pipeter le surnageant et analyser 2 μL par spectrométrie de masse en tandem haute résolution SPECTROMETRIE-ionisation positive par chromatographie liquide (LC-NSI +-HRMS/MS, étapes de 4,1 à 4,3).
- Pour des incubations de contrôle positif, s’évaporer une partie aliquote contenant 100 fmol de solution de CNN synthétisée dans un tube de 1 mL dans un flux de N 2. Ce flacon, ajouter le système enzymatique complet de l’étape 3.2 et procédez comme pour les étapes 3.3-3.4.
- Pour des incubations de contrôle négatif, réaliser l’expérience comme décrits (étapes 3.2-3.4) sauf remplacer le 50 μL enzyme solution avec 0,5 X tampon de réaction.
4. Exemple de paramètres pour la détection de nitrosamide par LC-NSI +-HRMS/MS
- pour le LC composant, appliquer le dégradé de plusieurs étape suivant à l’étape 4.2 vers un système UPLC à l’aide d’un commercial, emballées à la main 18 C18 (5 μm), 100 mm x 75 μm, colonne capillaire en 15 μm orifice.
- à l’aide de 5 mM NH 4 OAc comme solvant A et MeCN comme solvant B, charger l’échantillon sur la colonne en exécutant à 5 % B à 1 μL/min de 0 - 5 min et puis ralentir la vitesse d’écoulement à 0,3 μL/min par la suite. Ensuite, exécutez un gradient de 5 à 20 % B pendant 4 min, suivie d’une rampe à 55 % B pendant 10 min, puis ré-équilibration à 5 % B.
- Effectuer le LC-NSI +-HRMS/MS sur une LTQ Orbitrap valant. Moniteur pour CNN par balayage complet et fragmentation de 2 MS. Exécuter une analyse complète avec une résolution de 60 000 et extraire la masse exacte parent (192.07670) avec une tolérance de masse de 5 ppm. Utilisation MS 2 fragmentation isoler parent ions (2,0 UMA) et fragment de collision dissociation induite (CID) avec une énergie de collision de 25 eV, résolution de 15 000, et l’analyse des temps de Mme 30 extraire les masses exactes des ions produits de CNN (m/z 192 m/z 134.04739 et 162.07874) avec une tolérance de masse de 5 ppm.
Access restricted. Please log in or start a trial to view this content.
Résultats
Basé sur le travail de blanc et al. 19, norcotinine était nitrosés à NNC proprement et avec un rendement élevé (80 à 92 %) de produire une norme pour l’expérience in vitro . Preuves de structure pour une réaction réussie a été obtenus par analyse spectroscopique dont 1H-RMN, 13C-RMN, COSY et HSQC (renseignements à l’appui) ainsi que SGRH qui a confirmé la masse parent [M + H]+ au sein de 5 ppm de ...
Access restricted. Please log in or start a trial to view this content.
Discussion
Élucider le métabolisme des nitrosamines est un élément essentiel à la compréhension de leur cancérogénicité. Étant donné que la cause du cytochrome P450s et autres enzymes métaboliques sont polymorphes, d’application de cette connaissance pourrait potentiellement identifier plus précisément haut risque particuliers1,4. Nouvelles données indiquent que l’oxydation supplémentaire des α-hydroxynitrosamines, les principaux métabolites présumée...
Access restricted. Please log in or start a trial to view this content.
Déclarations de divulgation
Les auteurs n’ont rien à divulguer.
Remerciements
Cette étude a été financée par grant pas. CA-81301 du National Cancer Institute. Nous remercions Bob Carlson pour aide à la rédaction, le Dr Peter Villalta et Xun Ming à l’aide de la spectrométrie de masse dans la ressource de partagée de biochimie analytique du Cancer Centre maçonnique et Dr Adam T. Zarth Dr Anna K. Michel pour leurs discussions précieuses et d’entrée. La ressource de partage de biochimie analytique est partiellement pris en charge par National Cancer Institute Cancer Center Support Grant CA-77598
Access restricted. Please log in or start a trial to view this content.
matériels
| Name | Company | Catalog Number | Comments |
| Norcotinine | AKoS GmbH (Steinen, Germany) | CAS 17708-87-1, AKoS AK0S006278969 | |
| Acetic acid | Sigma-Aldrich | 695092 | |
| Acetic Anhydride | Sigma-Aldrich | 242845 | |
| Ammonium Acetate | Sigma-Aldrich | 431311 | |
| Barium Hydroxide | Sigma-Aldrich | 433373 | |
| D-Chloroform | Sigma-Aldrich | 151823 | |
| HPLC Acetonitrile | Sigma-Aldrich | 34998 | |
| Magnesium Sulfate | Sigma-Aldrich | M7506 | |
| Methylene Chloride | Sigma-Aldrich | 34856 | |
| Sodium Nitrite | Sigma-Aldrich | 237213 | |
| ViVid CYP2A6 Blue Screening Kit | Life Technologies | PV6140 | |
| Zinc Sulfate | Sigma-Aldrich | 221376 | |
| 0.5 mL tubes | Fisher | AB0533 | |
| 100 mL round bottom flask | Sigma-Aldrich | Z510424 | |
| 125 mL Erlenmeyer flask | Sigma-Aldrich | CLS4980125 | |
| 125 mL Separatory Funnel | Sigma-Aldrich | Z261017 | |
| 25 mL round bottom flask | Sigma-Aldrich | Z278262 | |
| 500 MHz NMR Spectrometer | Bruker | ||
| Allegra X-22R Centrifuge | Beckman-Coulter | ||
| LC vials | ChromTech | CTC–0957–BOND | |
| LTQ Orbitrap Velos | Thermo Scientific | ||
| Magnetic Stir bar | Sigma-Aldrich | Z127035 | |
| NMR tube | Sigma-Aldrich | Z274682 | |
| P1000, P200, and P10 pipettes | Eppendorf | ||
| Rotary evaporator | Sigma-Aldrich | Z691410 | |
| RSLCnano UPLC system | Thermo Scientific | ||
| Shaking Water Bath | Fisher | FSSWB15 | |
| Stir plate | Sigma-Aldrich | CLS6795420 | |
| PicoFrit Column | New Objective | PF3607515N5 | |
| Luna C18, 5 um | Phenomenex | 535913-1 |
Références
- Rom, W. N., Markowitz, S. Environmental and Occupational Medicine. , 4th ed, Wolters Kluwer/Lippincott Williams & Wilkins. 1226-1239 (2007).
- Preussmann, R., Stewart, B. W. Chemical Carcinogens, ACS Monograph 182. Searle, C. E. 2, 2nd ed, American Chemical Society. 643-828 (1984).
- Magee, P. N., Montesano, R., Preussmann, R. Chemical Carcinogens. ACS monograph 173. Searle, C. E. , American Chemical Society. 491-625 (1976).
- Zhu, A. Z., et al. Alaska Native smokers and smokeless tobacco users with slower CYP2A6 activity have lower tobacco consumption, lower tobacco-specific nitrosamine exposure and lower tobacco-specific nitrosamine bioactivation. Carcinogenesis. 34 (1), 93-101 (2013).
- Mesić, M., Revis, C., Fishbein, J. C. Effects of structure on the reactivity of alpha-hydroxydialkynitrosamines in aqueous solutions. J. Am. Chem. Soc. 118, 7412-7413 (1996).
- Mochizuki, M., Anjo, T., Okada, M. Isolation and characterization of N-alkyl-N- (hydroxymethyl)nitrosamines from N-alkyl-N- (hydroperoxymethyl)nitrosamines by deoxygenation. Tetrahedron Lett. 21, 3693-3696 (1980).
- Guttenplan, J. B. Effects of cytosol on mutagenesis induced by N-nitrosodimethylamine, N-nitrosomethylurea and à-acetoxy-N-nitrosodimethylamine in different strains of Salmonella:evidence for different ultimate mutagens from N-nitrosodimethylmine. Carcinogenesis. 14, 1013-1019 (1993).
- Elespuru, R. K., Saavedra, J. E., Kovatch, R. M., Lijinsky, W. Examination of a-carbonyl derivatives of nitrosodimethylamine in ethylnitrosomethyamine as putative proximate carcinogens. Carcinogenesis. 14, 1189-1193 (1993).
- Chow, Y. L. ACS Symposium Series. 101, American Chemical Society. 13-37 (1979).
- von Weymarn, L. B., Retzlaff, C., Murphy, S. E. CYP2A6- and CYP2A13-catalyzed metabolism of the nicotine delta5'(1')iminium ion. J. Pharmacol. Exp. Ther. 343 (2), 307-315 (2012).
- Bell-Parikh, L. C., Guengerich, F. P. Kinetics of cytochrome P450 2E1-catalyzed oxidation of ethanol to acetic acid via acetaldehyde. J Biol Chem. 274 (34), 23833-23840 (1999).
- Chowdhury, G., Calcutt, M. W., Nagy, L. D., Guengerich, F. P. Oxidation of methyl and ethyl nitrosamines by cytochrome P450 2E1 and 2B1. Biochemistry. 51 (50), 9995-10007 (2012).
- Chowdhury, G., Calcutt, M. W., Guengerich, F. P. Oxidation of N-nitrosoalkylamines by human cytochrome P450 2A6: sequential oxidation to aldehydes and carboxylic acids and analysis of reaction steps. J Biol Chem. 285 (11), 8031-8044 (2010).
- Carlson, E. S., Upadhyaya, P., Hecht, S. S. Evaluation of nitrosamide formation in the cytochrome P450-mediated metabolism of tobacco-specific nitrosamines. Chem Res Toxicol. 29 (12), 2194-2205 (2016).
- Amin, S., Desai, D., Hecht, S. S., Hoffmann, D. Synthesis of tobacco-specific N-nitrosamines and their metabolites and results of related bioassays. Crit. Rev. Toxicol. 26, 139-147 (1996).
- Clark, A. G., Wong, S. T. A rapid chromatographic technique for the detection of dye-binding. Anal Biochem. 89 (2), 317-323 (1978).
- Pauli, G. F., et al. Importance of purity evaluation and the potential of quantitative (1)H NMR as a purity assay. J Med Chem. 57 (22), 9220-9231 (2014).
- van der Heeft, E., et al. A microcapillary column switching HPLC-electrospray ionization MS system for the direct identification of peptides presented by major histocompatibility complex class I molecules. Anal Chem. 70 (18), 3742-3751 (1998).
- White, E. H. The Chemistry of the N-Alkyl-N-nitrosoamides. I. Methods of Preparation. J. Am. Chem. Soc. 77, 6008-6010 (1955).
- Patten, C., et al. Evidence for cytochrome P450 2A6 and 3A4 as major catalysts for N'-nitrosonornicotine alpha-hydroxylation by human liver microsomes. Carcinogenesis. 18, 1623-1630 (1997).
- Wong, H. L., Murphy, S. E., Hecht, S. S. Cytochrome P450 2A-catalyzed metabolic activation of structurally similar carcinogenic nitrosamines: N'-nitrosonornicotine enantiomers, N-nitrosopiperidine, and N-nitrosopyrrolidine. Chem. Res. Toxicol. 18, 61-69 (2004).
- Hecht, S. S. Biochemistry, biology, and carcinogenicity of tobacco-specific N-nitrosamines. Chem. Res. Toxicol. 11, 559-603 (1998).
- von Weymarn, L. B., Zhang, Q. Y., Ding, X., Hollenberg, P. F. Effects of 8-methoxypsoralen on cytochrome P450 2A13. Carcinogenesis. 26 (3), 621-629 (2005).
Access restricted. Please log in or start a trial to view this content.
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationThis article has been published
Video Coming Soon