このコンテンツを視聴するには、JoVE 購読が必要です。 サインイン又は無料トライアルを申し込む。
Method Article
試金を使用して SIAT1 MDCK 細胞のインフルエンザ a (h3n2) ウイルス中和によるひと血清中の抗体を中和することを測定
要約
インフルエンザ中和抗体は、インフルエンザ感染症の保護と関連付けてください。中和血清中和抗体価の測定し、インフルエンザのひと血清にしばしば使用します。次のインフルエンザの予防接種や感染症現代 3C.2a 3C.3a a (h3n2) ウイルス中和抗体価を測定する SIAT1 MDCK 細胞を用いた中和試験について述べる。
要約
インフルエンザ ウイルスのヘマグルチニン (HA) に対する中和抗体は、インフルエンザ感染症のための保護に関係する主な免疫機構と見なされます。中和 (MN) の試金はインフルエンザ予防接種や感染症後ひと血清中の中和抗体を測定するために使われます。Madine ダービー犬腎臓 (MDCK) 細胞は、MN の試金のための一般的に使用されるセル基板です。しかし、受容体結合特異性を変更現在循環 3C.2a と 3C.3a の a (h3n2) インフルエンザ ウイルスが取得しています。表面に増加 α 2, 6 シアル ガラクトース防 MDCK SIAT1 細胞株は、これら現代の a (h3n2) ウイルスの改良された感染性と従来の MDCK 細胞よりもより忠実な複製を提供するために証明されています。ここでは、これら現代の a (h3n2) ウイルス中和抗体を定量化するために最適化された SIAT1 MDCK 細胞を用いた MN アッセイについて述べる。このプロトコルでは熱不活化血清中和抗体を含む最初連続希釈されて、次いで, 100 TCID50/インフルエンザ a (h3n2) ウイルスにバインドする血清中の抗体をできるようにするのも。SIAT1 MDCK 細胞はウイルス抗体の混合物に追加し、37 ° c、a (h3n2) ウイルス SIAT1 MDCK 細胞に感染するを許可するように 5% CO2 18 20 時間培養します。一晩インキュベートした後板が固定されており、それぞれのウイルスの量も抗インフルエンザ ウイルスを用いた酵素免疫測定法 (ELISA) による定量化は np モノクローナル抗体。中和抗体は、ウイルスの感染性の: 50% 阻害を提供します最高血清希釈の逆数として定義されます。
概要
インフルエンザ ウイルスは、人間の人口毎年の罹患率と死亡率を引き起こし続けます。HA は、インフルエンザ ウイルスの主要な表面の糖蛋白。HA を対象と中和抗体は、インフルエンザ感染1,2の保護に関係する主な免疫メカニズムです。赤血球凝集抑制 (HI) アッセイ MN アッセイは、インフルエンザ感染症や予防接種3後血清抗体を測定に広く用いられる 2 つの方法。こんにちはアッセイは赤血球凝集抑制抗体を測定し、サロゲートの試金であります。こんにちとは異なり MN の試金は直接細胞培養のインフルエンザ感染を中和するヒトの血清中の抗体のレベルを測定できます。MDCK 細胞、インフルエンザ ウイルス分離に使われます、MN4の試金。
インフルエンザ ウイルスは、抗原ドリフトとウイルスの受容体結合特異性を変えることができる HA 蛋白の変異を取得し、shift キーを常に受けます。2014 年以来 a (h3n2) ウイルスの新しいクラスターが登場し、現在のシーズンまで循環し続けた。これらのウイルスのほとんどは、遺伝的グループ 3C.2a と HA タンパク質の系統解析に基づく 3C.3a に属します。循環の 3C.2a ウイルスの多くは赤血球を hemagglutinate する能力を減少していた、こんにちは試金5特徴ことはできません。中和の試金は6を hemagglutinate いないこれらのウイルスの抗体を測定するために使わなければなりません。また、研究によるとこれら現代の a (h3n2) ウイルスが以前 a (h3n2) のウイルスと比較して受容体結合特性を変更しているし、文化適応変異と多型生体外細胞で継代されたときに蓄積する傾向があります。文化7,8,9。従来の MDCK 細胞と比べて、MDCK SIAT1 は Matrosovichらによって開発された細胞株です。を通じて人間 α 2, 6-sialtransferase (SIAT1) の cDNA を用いた MDCK 細胞のトランスフェクションを安定。この細胞株は、α 2, 6 シアル ガラクトースと親 MDCK 細胞10より 3 シアル酸部分の α 2、量も減るの増加量を表しています。SIAT1 MDCK 細胞は MDCK 細胞11と比較して a (h3n2) ウイルスの分離率を改善するために示されています。最近では、林ら新たに出現した 3C.2a および 3C.3a 人間 a (h3n2) インフルエンザ ウイルスのより忠実なウイルス複製よりウイルス感染であったウイルスが MDCK 細胞7と比較して SIAT1 MDCK 細胞の培養が報告。したがって、a (h3n2) ウイルスの最近のクラスター抗体反応を特徴付けるミネソタの試金は SIAT1 MDCK 細胞が適しています。
ここ現代 3C.2a とひと血清中の 3C.3a a (h3n2) ウイルスに抗体を測定する SIAT1 MDCK 細胞を用いた MN の試金を記述します。卵の細胞成長のウイルスは、この試金で使用できます。熱不活化血清中和抗体を含むは希釈した直列ではまず、100 TCID50/インフルエンザ a (h3n2) ウイルスにバインドする血清中の抗体を許可するのも、培養しました。SIAT1 MDCK 細胞はウイルス抗体の混合物に追加し、37 ° c、a (h3n2) ウイルス SIAT1 MDCK 細胞に感染し、複製を許可する 5% CO2 18 20 時間培養します。一晩インキュベートした後、プレート固定、抗インフルエンザ A NP モノクローナル抗体を用いた elisa 法による各ウェルのウイルスの量を定量化します。NP の検出は、ウイルス感染の有無と中和抗体の有無を示します。中和抗体は、ウイルスの感染性の ≥ 50% 阻害を提供します最高血清希釈の逆数として定義されます。
プロトコル
すべてのインフルエンザ ウイルスは、適切なバイオ セーフティ レベル要件に従って処理する必要があります (BSL 2 またはそれ以上) の微生物学的および生物医学研究所 (BMBL)12バイオで定義されています。
1. 試薬・原料の準備
-
SIAT1 MDCK 細胞と無菌細胞培養培地を準備します。
- 高グルコースと 500 mL ダルベッコ変更イーグル培地 (DMEM) を使用してSIAT1 MDCK 細胞培養液の準備、ウシ胎児血清 (FBS)、2 ミリメートル L グルタミン、1 mM ピルビン酸ナトリウム、1 mg/mL G418 硫酸塩 (例えば10 %v/v 熱が不活化ジェネティシン) と 100 μ g/mL ストレプトマイシン (オプション) と 100 U/ml ペニシリン。0.2 μ M 孔サイズの膜によるろ過滅菌します。G418 硫酸塩が SIAT1 MDCK 細胞のプラスミドの安定性を確保するために追加されます。
- SIAT1 MDCK細胞ラインを準備します。162 cm の2- 30 mL 滅菌の細胞培養媒体を含む組織培養 flask(s) 2-2.5 x 10 の6 SIAT1 MDCK 細胞とフラスコをシードし、2 日間, 5% CO2の 37 ° C でこれは組織培養感染量 (TCID) 測定と MN のため使用されますの試金。
注: SIAT1 MDCK 細胞は、博士・ m ・ Matrosovich、ドイツのマールブルク10によって提供された親切。この細胞株は、市販も取得できます (材料の表を参照してください)。
- DMEM 高グルコース 0.3% ウシ血清アルブミン (BSA) 分数 V、100 U/mL ペニシリン、100 μ g/mL ストレプトマイシンの 500 mL と 20 mM HEPES を使用して滅菌ウイルス伝搬メディアを準備します。0.2 μ M 孔サイズの膜によるろ過滅菌します。
- リン酸緩衝生理食塩水 (PBS) 0.01 M PBS、pH 7.2 の含むの 0.75% (v/v)モルモット赤血球 (gpRBCs)を準備します。
- DMEM 高グルコース、1% 牛アルブミン分画 V (BSA)、100 U/mL ペニシリン、100 μ g/mL ストレプトマイシンと 20 mM HEPES を使用してウイルスを滅菌希釈液を準備します。0.2 μ m 孔サイズの膜でろ過滅菌し、新鮮なそれぞれの試金のための準備します。
- PBS (0.01 M PBS、pH 7.2) で 80% 冷アセトンとして冷たいセル定着剤を準備します。
- 準備、洗浄バッファーを PBS (0.01 M PBS pH 7.2) を使用して 0.3% (v/v) トゥイーン 20。
- PBS (0.01 M PBS、pH 7.2) を使用する抗体希釈液を用意し、0.3% (v/v) トゥイーン-20、および 5% 無脂肪粉ミルクします。
- 一次抗体として抗インフルエンザ A NP マウス モノクローナル抗体クローン A1 と A3 のプールを使用します。滴定によって決定される最適な濃度に希釈抗体を希釈します。
- 使用ヤギ抗マウス igg 抗体は、二次抗体としてペルオキシダーゼ (HRP) に共役。滴定によって決定される最適な濃度に希釈抗体を希釈します。
- 0.05 M リン酸クエン酸バッファー ph 5 のo- フェニレンジアミン二塩酸塩 (OPD) を用いたペルオキシダーゼ基質を準備します。1 カプセル/100 mL の脱イオン H2o. 溶解 1 OPD 錠 (10 mg) を溶解することにより 0.05 M リン酸クエン酸バッファーを準備/20 mL の使用直前にリン酸クエン酸バッファー。
- OPD 停止ソリューションとして 0.5 M 硫酸を使用します。972 mL の脱イオン H2O の化学フード 18 M 硫酸株式 28 mL を追加します。
-
人間と動物の血清中の治療
- 熱は、アッセイの前に 30 分の 56 ° c の水浴中 MN の試金で使用される人間の血清を不活化します。すぐに使用するか、必要な場合は 4 ° c 以上 24 h; 解凍血清を保存長期保管が必要な場合は、-20 ° C で凍結またはより冷たい血清を保存します。
- 受容体を破壊する酵素 (RDE) と MN の試金で使用される動物の血清を扱い、熱が次のように分析前に不活化します。
- 37 ° C の水浴の血清を解凍、氷の上を配置します。RDE の 3 巻で動物の血清サンプルの 1 ボリュームをミックスします。18-20 h の 37 ° C で孵化させなさい。
- 熱は、PBS、1:10 の最終前の希釈のために各サンプルに pH 7.2 の 30 分追加 6 ボリュームの 56 ° C で扱われる RDE 血清を不活化します。必要な場合は、24 h 以上; 4 ° C で融解血清を保存します。長期保管が必要な場合は、-20 ° C で凍結またはより冷たい血清を保存します。
注: 動物の血清は、インフルエンザ ウイルスの HAs にバインドし、インフルエンザ特定アンチの結合を阻害する可能性のある各種のシアル酸糖鎖を含めることができます-HA 抗体。したがって、それは RDE に必要な血清試料中のこれらの非特異的ウイルス HA バインダーを削除するミネソタ法の前にすべての動物血清を扱います。
2. SIAT1 MDCK 細胞培養の経過
注: すべての細胞培養は生物学的安全性の汚染を防ぐためにキャビネットで実行する必要があります。
- 162 cm2フラスコで単層の細胞から細胞培養液をデカントします。細胞をトリプシン-EDTA と単分子膜の洗浄によって trypsinize します。5 mL のトリプシン-EDTA 単層細胞をカバーするために追加します。37 ° C、5% CO2単層が (5-10 分) を引き抜いてで孵化させなさい。トリプシンのセルの上下別の細胞にピペットを含む各フラスコに MDCK SIAT1 の細胞培養媒体の 15 mL を追加します。
- 検定とトリパン ブルー セルをカウントして生存率を使用します。30 mL で 2-2.5 x 10 の6セル/flask の細胞培養媒体を含む新しい 162 cm2培養フラスコ内のセルをシードし、TCID と MN の試金で使用するため 2 日間の 5% CO2と 37 ° C で孵化させなさい。種 4 - 5 x 10 の6セル/フラスコ細胞とウイルス伝搬用 2 日間, 5% CO2と 37 ° C で。
注: 短いまたは長い培養期間が必要な場合は、播種密度を調整できます。ウイルス伝播の細胞が以上に達する 100% の confluency。組織培養感染量 (TCID) と MN の試金のためセルは 75-95% の confluency (図 1) にする必要があります。
3. SIAT1 MDCK 細胞における a (h3n2) ウイルス伝播
注: a (h3n2) ウイルスをいずれかの 10-11 日古い鶏の卵の標準プロトコル3、または SIAT1 MDCK 細胞によると文化伝播できます。SIAT1 MDCK 細胞を 100% 以上に達するウイルス接種合流。ウイルス種株式は、接種の複数の希釈で接種することができます。HA の最高の収穫を接種希釈と感染は、さらに MN アッセイに使用できます。
- 単層の細胞から細胞培養液を削除 (> 100% の confluency) 162 cm2フラスコで。二度と 15 mL の滅菌 0.01 M PBS、pH 7.2, 単分子膜を洗浄し、デカントします。
- ラベルのコントロールとして 1 フラスコとウイルス伝搬メディア 20 mL を加えます。5% CO2と 37 ° C でフラスコを孵化させなさい。このフラスコをそのまま残すし、比較ウイルス伝搬の 1 日後に使用します。
- Flask(s) に滅菌ウイルス伝搬のメディアの 10 mL を追加し、37 ° c、5% CO2のすべての flask(s) を孵化させなさい。室温でのインフルエンザ ウイルス株のバイアルを解凍、氷の上を配置します。ターゲット希釈ウイルス伝搬媒体で希釈します。
注: 希釈液を調整することができますターゲット ウイルス株の HA 抗体価に基づいています。準備、1: 1000 希釈菌、滅菌ウイルス伝搬メディア 9.9 mL にウイルスの 100 μ L を追加します。軽く反転、1: 100 希釈 9 mL に滅菌ウイルス伝搬メディアの 1 mL を削除、1: 1000 希釈菌を軽く反転します。氷の上を配置します。 - インキュベーターからコントロール フラスコを除くすべてのフラスコを削除します。SIAT1 MDCK 細胞の flask(s) からウイルス伝搬のメディアを削除し、各フラスコ 10 ml の希釈ウイルスを接種します。37 ° C、5% CO2回転 flask(s) 15 分毎、1 時間でフラスコを孵化させなさい。
- Flask(s) から接種の 5 mL を削除し、1 μ G/ml TPCK トリプシンを含む 15 mL ウイルス伝搬メディアに置き換えます。37 ° c、5% CO2 16 18 h の flask(s) を孵化させなさい。
- 一晩インキュベートした後顕微鏡倍率 X 100 の下で flask(s) を観察し、細胞の細胞変性効果 (CPE) を探します。Flask(s) からウイルス上清の 15-17 mL を削除し、2 μ G/ml TPCK トリプシンを含む作りたてウイルス伝搬メディアの 15-17 mL に置き換えます。
- 37 ° c、5% CO2フラスコを孵化させなさい。(細胞制御フラスコ) との比較による単分子膜の CPE を監視し、0.75 %gprbc に収穫まで定期的に HA (すべての 4 h) を確認してください。
- ハ 96年ウェル マイクロ プレートを設定します。0.01 M PBS、pH 7.2 井戸 A2 ・ B2 ・ B12 と A12 の 50 μ L を追加 (重複) や井戸 H1 - コントロールの H12。
- A1 と A2 に 100 μ L のウイルス上清を追加、A1 と B1 から A12 と B12 から 2 倍連続希釈を行います。A12 と B12 で混合後の 50 μ L を破棄します。A、B、および H の行に 0.75 %gprbcs の 50 μ L を追加します。
- プレートをタップして 1 時間室温で孵化させなさい。
- 60 ° の角度を 45 ° 96 ウェル マイクロ プレートを傾けることによってウイルスの培養上清中の HA を決定します。
- 赤血球凝集のためのプレートを読む完全な凝集反応を実現するウイルスの最高の希釈は、特定のウイルスの HA 滴定終点と見なされます。高いウイルスの希釈の完全な凝集の HA 価としてウイルス逆数を記録します。
注: 行 H (コントロール) で解決された赤血球に「実行」を開始、重力のため小さなティア ドロップ形状を形成します。井戸終了コントロールに赤血球まで待つを実行しているし、ウイルスの赤血球ボタン滴定井戸をお読み。RBC ボタンと「実行」を示すものは赤血球凝集反応を得られない。完全にウイルスの終点の HA 価として赤血球凝集を阻害するウイルスの最高の希釈を探します。
- ウイルス培養の HA の台地やウイルス培養ターゲット HA に達するときウイルスの収穫 (例えば、> 16 天后) が単分子膜が重要な CPE を表示を開始するセルの前に。
- ウイルス培養細胞の残骸をペレットへの 4 ° C で 10 分の 300 x g で上清を遠心します。クリーン チューブにウイルスの収穫を含む明確化の上清を転送します。分注ウイルスを含む上清は、単回使用滅菌セラム チューブに収穫し、-70 ° c またはより冷たい、すぐにフリーズします。
メモ: 高い感染力価と最小限の欠陥のある粒子、MN アッセイに使用ウイルス株が必要。ミネソタの試金のため 100 TCID5050 μ L を達成するためにウイルス株の最小希釈は 1: 100 です。
注: ミネソタの試金で使用されるウイルス株がない解凍なり凍結。
- ウイルス培養細胞の残骸をペレットへの 4 ° C で 10 分の 300 x g で上清を遠心します。クリーン チューブにウイルスの収穫を含む明確化の上清を転送します。分注ウイルスを含む上清は、単回使用滅菌セラム チューブに収穫し、-70 ° c またはより冷たい、すぐにフリーズします。
4. ウイルスの TCID の定量
- 1 日目: ウイルスの滴定
- 室温でウイルスのバイアルを解凍し、すぐに氷の場所します。
- 2 つの異なる開始の希釈率でウイルスをテスト: 10-2 , 10-3。ウイルス 10-2希釈用希釈剤の 9.9 mL にウイルスの 100 μ L を追加します。10-3希釈用希釈ウイルス 9.0 mL に 10-2希釈の 1 mL を追加します。
- 2 つのマイクロを使用してプレート (プレート 10-2希釈用 1) と 10-3希釈用プレート 2 は 96 ウェル マイクロ プレートの 1 列を除くすべての井戸に希釈ウイルスの 100 μ L を追加します。
- ½log10希釈液 (10 の-2、10-2.5、10-3など) を実行します。1 列目のすべての井戸に希釈を開始ウイルスの 146 μ L を追加し、11 (図 2) の列を 1 列から連続 46 μ L を転送します。井戸の間変更ピペット チップ。11 列を混合した後 46 μ L 希釈でヒントを破棄します。
- 使用する列 12 セル制御 (CC) として;ウイルスの希釈のみ含まれています。37 ° C、5% の CO で 1 時間インキュベート2.
- 1 日目: SIAT1 MDCK 細胞の準備
注: SIAT1 MDCK 細胞膜は TCID と MN の試金のための 75-95% の confluency に達するべきであります。95% の confluency で 1 つの 162 cm2フラスコは、種子に十分な細胞を得られるはず 〜 4 5 マイクロタイター プレート。- 20 ml の培地で、FBS を削除する PBS の 75-95% コンフルエント単層を洗います。セルをとおり trypsinize します。
- 滅菌 PBS の単分子膜を洗い流し、細胞膜をカバーする 7 mL のトリプシン-EDTA を追加します。フラスコを置くフラット、37 ° C、5% CO2単層デタッチ (約 5-10 分) までで孵化させなさい。Trypsinized セルを含む各フラスコに希釈ウイルス液 7 mL を追加します。
- FBS を削除するウイルスの希釈液で細胞を洗浄します。
- 優しくピペットの上下に、細胞を分離します。50 mL コニカル チューブ; にセルを転送します。ウイルスの希釈液で管を埋めます。
- 485 x g で 5 分間デカント希釈ウイルスの遠心分離機、50 mL の新鮮なウイルスの希釈液に置き換えると 485 x g で 5 分間デカント希釈ウイルスで遠心し、新鮮なウイルスの希釈液に置き換えます (10 mL/フラスコ) にペレットを再懸濁します。
- 細胞数と生存率を決定する検定とトリパン ブルー色素を使用します。1.5 倍の 105セル/mL に希釈ウイルス細胞濃度を調整します。
- (104細胞/ウェル × 1.5) マイクロタイター プレートの各ウェルに希釈 SIAT1 MDCK 細胞の 100 μ L を追加し、プレートをカバーします。37 ° C、5% CO2 18 20 時間で孵化させなさい。
- 20 ml の培地で、FBS を削除する PBS の 75-95% コンフルエント単層を洗います。セルをとおり trypsinize します。
- 2 日目: ELISA
-
細胞の固定
- マイクロタイター プレートからメディアを削除します。それぞれを洗って 200 μ L の PBS とも。各ウェルに 300 μ L 冷 80% アセトンを追加し、10 分固定を削除し、乾燥空気にプレートを許可するために、室温でインキュベートします。
-
ELISA
-
一次抗体の付加
注: 抗インフルエンザ A NP モノクローナル抗体は、elisa 法で一次抗体として過剰に使用する必要があります。MN で抗体の滴定を行うことで、一次抗体のロットごとの最適な抗体希釈を決定します。過剰とバック グラウンド強度比に最高の信号は、一次抗体の濃度を選択します。- ターゲット濃度希釈抗体に抗インフルエンザ A NP モノクローナル抗体 (一次抗体) を希釈 (抗体のターゲット希釈 1: 1000 希釈 30 mL に一次抗体の 30 μ L を追加するなど)。
- 洗浄バッファーの 300 μ L で 3 回洗い板。各ウェルに 100 μ L の希釈した一次抗体を追加します。1 時間室温で孵化させなさい。
-
二次抗体の付加
注:ヤギ抗マウス IgG 共役ホースラディッシュにペルオキシダーゼ (HRP) が ELISA で二次抗体として過剰に使用する必要があります。二次抗体のロットごとの最適な抗体希釈を抗体の滴定を行い決定します。過剰とバック グラウンド強度比に最高の信号は、二次抗体の濃度を選択します。- ヤギ抗マウス igg 抗体標識 HRP 抗体 (二次抗体) を希釈抗体 (二次抗体抗体のターゲット 1:4000 希釈用希釈剤 30 mL に例えば追加 7.5 μ) のターゲット濃度に希釈します。
- 300 μ L 洗浄バッファーで 3 回プレートを洗います。各ウェルに 100 μ L の希釈した二次抗体を追加します。1 時間室温で孵化させなさい。
-
基板追加とプレートの読書
- 5 回で 300 μ L 洗浄バッファーと - リントフリーのタップ プレートを洗います。
- 各ウェルに作りたて基板の 100 μ L を追加し、常温色開発飽和するまで、細胞制御井戸の光学濃度 (OD) 孵化させなさい < 0.2。
- すべての井戸に停止液を 100 μ L を追加します。490 で井戸の OD を読む nm マイクロ プレート分光光度計を使用しています。
-
一次抗体の付加
-
細胞の固定
- TCID 50計算
- セル コントロール (12 列) の中央値外径490を計算します。
- 中央 OD490 CC 井戸「肯定的」としての二度より大きい外径490任意のテストを検討してください。そうでなければ、それは「負の」と見なされます。
- リード Muench 方法13を使用してウイルスの TCID50を計算します。
- 陽性とネガごとの希釈での数を決定します。
- 「累積的なポジティブ」、「否定的な累積的な」、「比」、「% 肯定的な」として表 1に示すを計算します。
- 希釈表示間「比例距離」の計算 > 50 パーセント原級と希釈表示 < 50% 陽性次を使用して。
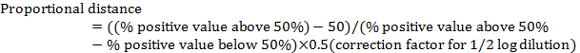
注: ½ ログ希釈用補正係数は 0.5 です。たとえば、表 1の: (80 − 50)/(80 − 20) 0.5 = 0.25 x - > 50% の陽性を示す希釈する比例距離を追加することによってウイルス TCID50を計算します。
注: たとえば、テーブル 2、TCID50は 10-5+(-0.25) = 10-5.25。これは 100 μ L (または 10-5.25100 μ L) あたりウイルスの TCID50に注意してください。
- ウイルスの希釈を計算します。ミネソタの試金のため 200 TCID50100 μ L (100 TCID5050 μ L/ウェルに相当) にウイルスを希釈します。
注:表 1の例では、1 の TCID50は 100 μ L の 10-5.25希釈 200 TCID50100 μ L を達成するためには、計算に基づく 1:891: 200 x 10-5.25 10-2.95 = 1/102.95を = = 1891/
5 SIAT1 MDCK 細胞を用いた MN アッセイ
-
1 日目: テストとコントロール血清の準備とプレート レイアウト
- 37 ° C の水浴の血清を解凍し、解凍後すぐに削除します。因数のテストが必要な血清の量一重項の 1 つのウイルスでテストする元のセラの 10 μ L の最小値です。可能であれば重複で血清をテストします。
- 熱は、1.12.1 の手順と 56 ° C の水浴中で 30 分間血清を不活化します。氷の上場所血清熱不活化を投稿、ウイルスの希釈液を 1:10 を達成するために血清中に追加前希釈。
- RDE は、治療し、事前 1:10 1.12.2 あたりコントロール用に動物血清を希釈します。
注: もはや 24 時間よりも血清は-20 ° C で凍結保存する必要がありますまたはアッセイに必要な保管期間が長ければ寒い、解凍と扱われた人間や動物の血清は 4 ° C で保存できます。 - 1 つのウイルスをテストするため追加 100 μ L 1:10 の希釈列 A1 A10 に血清 (図 4)。H、11 および 12 (図 4) の列を除いて、B 行に希釈ウイルスの 50 μ L を追加します。行 A H からから 2 倍連続希釈を実行し、(図 4) H の行から最後の 50 μ L を破棄します。
注: 複数のウイルスをテストする場合は、血清は価管内希釈できます。血清の希釈血清力価、よく a を決定する目的は 1:10、1:20 B をよくまあ C 1:40、よく D ホームキットも E 1: 160、F 1:320、よく G 1: 640、よく H 1:1,280 (図 4) をよきます。 - ウイルス制御 A12、B12、C12、D12 の井戸にウイルスの希釈液 50 μ L を追加 (世羅ありません)。セル コントロールの E12、F12、G12、H12 の井戸にウイルスの希釈液 100 μ L を追加 (いいえウイルス, いいえ血清)。
- コントロール血清 (フェレット血清コントロールなど) では、11 のコラムをよくし井戸 B11 - H11 に希釈ウイルスの 50 μ L を追加希薄コントロール血清の 100 μ L を追加します。シリアルを希薄。
- カバー プレート、37 ° C、ウイルスの追加の準備ができるまで 5% CO2で孵化させなさい。
-
1 日目: ウイルス追加
- 100 TCID5050 μ L に希釈ウイルスのウイルスを希釈します。
- 背部滴定 (BT) 板とセル制御井戸 E12、F12、G12、H12 すべてプレート (図 4) の 11 列を除く、すべての井戸に 50 μ L 希釈ウイルスを追加します。11 列にコントロール血清をそれらの板は、列 11 にウイルスを追加します。
- 背部滴定 (BT)
- 重複板 (たとえば、プレートの 1A および 1 b) の 1 つのセットの列 11 BT は、あります。[11] 列のすべての井戸に希釈ウイルスの 50 μ L を追加します。(A11) の第 1 のウェルに 100 TCID5050 μ L でウイルスの 50 μ L を追加します。上下にピペッティングで混ぜます。
- ミックスし、50 μ L を 2 倍のシリアル希薄を実行する連続した井戸に転送します。ウイルスのキャリー オーバーを避けるために井戸のピペット チップを変更します。よく H11 から 50 μ L を破棄します。
- 最終巻を 100 μ L にさせる 11 の列に希釈ウイルスの 50 μ L をタップをミックスするプレートを追加します。
- 37 ° c、1 時間 5% CO2版を孵化させなさい。
- 1 日目に MDCK SIAT1 セル加算と 4.2 と 4.3 (5.3 および 5.4 で説明も) の手順で説明するように 2 日目に elisa 法を実行します。
-
1 日目: MDCK SIAT1 セル追加
- 4.2 の手順で説明されているように MDCK SIAT1 セルを準備します。1.5 倍の 105セル/mL で 100 μ SIAT1 MDCK 細胞を各ウェル (1.5 倍の 104細胞/ウェル) に追加します。37 ° c、5% CO2 18 20 h のプレートを孵化させなさい。
-
2 日目: ELISA
- 2 日目の一晩インキュベートした後手順 4.3 80% 冷アセトンでセルを修正します。
-
一次抗体の付加
- 300 μ L 洗浄バッファーで 3 回プレートを洗います。抗インフルエンザ A NP モノクローナル抗体 (一次抗体) を抗体希釈液の滴定によって決定される最適な濃度に希釈 (抗体のターゲット希釈 1: 1000 希釈 30 mL に一次抗体の 30 μ L を追加するなど)。
注: 一次抗体の 100 μ L/ウェル必要です。〜 10 mL は、プレートごと必要です。 - 各ウェルに 100 μ L の希釈した一次抗体を追加します。1 時間室温で孵化させなさい。
- 300 μ L 洗浄バッファーで 3 回プレートを洗います。抗インフルエンザ A NP モノクローナル抗体 (一次抗体) を抗体希釈液の滴定によって決定される最適な濃度に希釈 (抗体のターゲット希釈 1: 1000 希釈 30 mL に一次抗体の 30 μ L を追加するなど)。
-
二次抗体の付加
- プレート 300 μ L 洗浄バッファーで 3 回洗います。希釈ヤギ抗マウス IgG 抗体希釈液 (例えば追加 7.5 μ L の二次抗体抗体のターゲット 1:4000 希釈 30 ml) でターゲット濃度に HRP 抗体 (二次抗体) を共役。
注: 二次抗体の 100 μ L よく 96 あたり必要です。〜 10 mL は、プレートごと必要です。 - 各ウェルに 100 μ L の希釈した二次抗体を追加します。1 時間室温で孵化させなさい。
- プレート 300 μ L 洗浄バッファーで 3 回洗います。希釈ヤギ抗マウス IgG 抗体希釈液 (例えば追加 7.5 μ L の二次抗体抗体のターゲット 1:4000 希釈 30 ml) でターゲット濃度に HRP 抗体 (二次抗体) を共役。
-
基板追加とプレートの読書
- 5 回で 300 μ L 洗浄バッファーと - リントフリーのタップ プレートを洗います。
- 各ウェルに作りたて基板の 100 μ L を追加し、室温で孵化させなさいウイルス制御井戸まで外径490 = 0.8 - 3 低セル コントロールの背景の OD490 < 0.2。
- すべての井戸に停止液を 100 μ L を追加します。490 で井戸の OD を読む nm マイクロ プレート分光光度計を使用しています。
-
データ分析
注: ミネソタの計算は各プレートの個別に決定されます。- 各血清サンプルの中和抗体価を決定します。
- 次の式を使用して各板の 50% ウイルス中和の OD490カットオフを計算します。
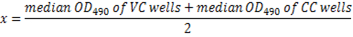
注: ここに x = 中和カットオフの 50%。OD490と最高の希釈に対応する相互血清希釈カットオフ (: 50% 阻害) の 50% 未満は、その血清のサンプル (図 5) に対する中和抗体価と見なされます。
- 次の式を使用して各板の 50% ウイルス中和の OD490カットオフを計算します。
- セル制御井戸外径490ことを確認 < 0.2 とウイルス制御井戸がある OD490 = 0.8 - 3。
- 各分析で BT のウイルス bt 社許容範囲によっては (100 x TCID50) ウイルスの感染性は 50、100、または 200 TCID を確認します。4.4.2 のステップで定義されている同じカットを使用して、カットオフ OD と BT 列に最高のウイルスの希釈は井戸 E11、f11 キーを押して、G11 のはずです。
注: 血清ポジティブ コントロールは、倍内価を与える必要があります以前のテストで得られた値の。否定的な血清コントロールの OD490は類似ウイルス コントロールの観察するはずです。
- 各血清サンプルの中和抗体価を決定します。
結果
ウイルス株の感染性の決定は、MN の試金の最初のステップです。図 2は、ウイルス株の TCID50を決定するプレート レイアウトを示しています。不明な感染力を持つウイルス株ウイルス ウイルスの感染性を計算する最高の滴定曲線をキャプチャするためにから複数の前希釈、たとえば 10-2と 10-3、滴定することができます。?...
ディスカッション
MN アッセイは、インフルエンザ血清インフルエンザ感染またはワクチン接種後抗体を検出するために使用する主な試金のひとつです。ミネソタの試金から生成された抗体は多くのインフルエンザおこなえる研究の主な成果として使われます。ミネソタの試金は、血清診断とワクチンの免疫原性の評価にも広く使用されます。MN アッセイ複数研究所14の実行を比較する国際間?...
開示事項
利害の衝突を報告しません。調査結果と本書の結論のこれらの者は、疾病や予防、資金提供機関のためにセンターのビューを必ずしも表さない。
謝辞
この原稿の準備で博士 Xiuhua Lu、リュー風水とその批判的検討と支援の CDC のインフルエンザ部門からさんアシュリー ・ バロウズに感謝します図 3のグラフィックスを準備することの彼の援助の CDC のインフルエンザ部門から博士エイドリアン ・ レーバーに感謝いたします。最後に、博士 M. Matrosovich、マールブルク、ドイツ SIAT1 MDCK 細胞を提供するために感謝いたします。
資料
| Name | Company | Catalog Number | Comments |
| Dulbecco’s Modified Eagle Medium (DMEM) with high Glucose | Life Science | 11965 | A critical component of Sterile Cell Culture, Virus Propagation and Virus Diluent Media |
| Fetal bovine serum (FBS) | Hyclone | SH30070.03 | |
| Bovine Serum Albumin (BSA) Fraction V, Protase Free | Sigma-Aldrich | 3117332001 | |
| L-Glutamine | Life Science | 25030-081 | |
| Sodium pyruvate | Life Science | 11360-070 | |
| Geneticin G-418 disulfate salt | Sigma-Aldrich | A1720-5G | |
| HEPES | Life Science | 15630-080 | |
| Penicillin/Streptomycin | Life Science | 15140-122 | |
| Acetone | VWR | 67-64-1 | Used at an 80% concentration |
| Phosphate-Citrate Buffer with Sodium Perborate | Sigma-Aldrich | SLBF2806V | |
| O-Phenylenediamine Dihydrochloride tablet | Sigma-Aldrich | SLBQ1086V | 1 tablet per 100ml of cell culture grade water |
| Sulfuric Acid | Fisher Scientific | A510-P500 | Used 0.5M final concentration |
| Ethanol, Denatured, 4L | VWR | EM-AX0422-3 | Used at an 70% concentration |
| Trypsin-EDTA | Life Science | 1748048 | |
| RDE II "Seiken" | Denka Seiken | 370013 | |
| Tween 20 | Sigma-Aldrich | P1379-500ml | |
| Anti-NP mouse monoclonal Ab | Millipore pool | MAB 8257 MAB 8258 | |
| Anti-mouse IgG HRP | KPL | 074-1802 | |
| 96-well flat-bottom plates | Thermo Scientific | 3455 | |
| Plate reader | Molecular Device | Spectromax 384 plus | |
| Cell Culture Flask 162 cm2/Vent Cap | Corning/VWR | 3151 |
参考文献
- Reber, A., Katz, J. Immunological assessment of influenza vaccines and immune correlates of protection. Expert Rev of Vaccines. 12, 519-536 (2013).
- Li, C. K., Rappuoli, R., Xu, X. N. Correlates of protection against influenza infection in humans--on the path to a universal vaccine?. Curr Opin in Immunol. 25, 470-476 (2013).
- WHO Global Influenza Surveillance Network. . Manual for the labratory diagnosis and virological surveillence of influenza. , (2011).
- Govorkova, E. A., Kodihalli, S., Alymova, I. V., Fanget, B., Webster, R. G. Growth and immunogenicity of influenza viruses cultivated in Vero or MDCK cells and in embryonated chicken eggs. Dev Biological Stand. 98, 39-51 (1999).
- Levine, M. Z., et al. Neutralizing Antibody Responses to Antigenically Drifted Influenza A(H3N2) Viruses among Children and Adolescents following 2014-2015 Inactivated and Live Attenuated Influenza Vaccination. Clin Vaccine Immunol : CVI. 23, 831-839 (2016).
- Lin, Y., et al. The characteristics and antigenic properties of recently emerged subclade 3C.3a and 3C.2a human influenza A(H3N2) viruses passaged in MDCK cells. Influenza Other Respir Viruses. , (2017).
- Lin, Y. P., et al. Neuraminidase receptor binding variants of human influenza A(H3N2) viruses resulting from substitution of aspartic acid 151 in the catalytic site: a role in virus attachment?. J of Virol. 84, 6769-6781 (2010).
- Skowronski, D. M., et al. Mutations acquired during cell culture isolation may affect antigenic characterisation of influenza A(H3N2) clade 3C.2a viruses. Euro Surveillance. 21, 30112 (2016).
- Matrosovich, M., Matrosovich, T., Carr, J., Roberts, N. A., Klenk, H. D. Overexpression of the alpha-2,6-sialyltransferase in MDCK cells increases influenza virus sensitivity to neuraminidase inhibitors. J of Virol. 77, 8418-8425 (2003).
- Oh, D. Y., Barr, I. G., Mosse, J. A., Laurie, K. L. MDCK-SIAT1 cells show improved isolation rates for recent human influenza viruses compared to conventional MDCK cells. J Clin Microbiol. 46, 2189-2194 (2008).
- US Department of Health and Human Services. . Biosafety in Microbiological and Biomedical Laboratories. , (2009).
- Reed, H. M. A simple method of estimating fifty percent endpoints. The American Journal of Hygiene. 27, (1938).
- Laurie, K. L., et al. International Laboratory Comparison of Influenza Microneutralization Assays for A(H1N1)pdm09, A(H3N2), and A(H5N1) Influenza Viruses by CONSISE. Clinical Vaccine Immunol : CVI. 22, 957-964 (2015).
- Lin, Y., Gu, Y., McCauley, J. W. Optimization of a Quantitative Micro-neutralization Assay. J Vis Exp : JoVE. , (2016).
- van Baalen, C. A., et al. ViroSpot microneutralization assay for antigenic characterization of human influenza viruses. Vaccine. 35, 46-52 (2017).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved