Для просмотра этого контента требуется подписка на Jove Войдите в систему или начните бесплатную пробную версию.
Method Article
Измерения гриппа, нейтрализуя антитело ответы на A(H3N2) вирусов в человеческой сыворотки, Microneutralization Assays клетки с помощью MDCK-SIAT1
В этой статье
Резюме
Гриппа нейтрализующих антител коррелируют с защитой гриппа инфекций. Microneutralization измерения нейтрализующих антител в человеческой сыворотки и часто используются для гриппа человека серология. Мы описываем microneutralization анализа с использованием клеток MDCK-SIAT1 для измерения нейтрализующие антитела титры для современных вирусов, 3C.2a и 3C.3a A(H3N2) после вакцинации против гриппа или инфекции.
Аннотация
Нейтрализующие антитела против гемагглютинина (HA) вирусов гриппа, считаются основным иммунного механизма, который коррелирует с защитой для инфекции гриппа. Microneutralization (MN) анализы часто используются для измерения нейтрализующие антитела ответы в человеческой сыворотки после вакцинации против гриппа или инфекции. Клетки Madine Darby собак почек (MDCK) являются широко используемых ячеек субстрат для MN анализов. Однако в настоящее время циркулирует 3C.2a и 3C.3a A(H3N2) гриппа, которую приобрели вирусы изменена специфика связывания рецептора. MDCK-SIAT1 линия клетки с повышенной α-2,6 сиаловых галактозы постановление на поверхности оказалось обеспечить улучшение инфективности и более верным репликаций, чем обычные клетки MDCK для этих современных вирусов A(H3N2). Здесь мы описываем MN assay клетки MDCK-SIAT1, который был оптимизирован для количественного определения нейтрализации титры антител к этим современным A(H3N2) вирусов. В этом протоколе тепла инактивированная сера содержит нейтрализующие антитела являются впервые серийно разводили, затем инкубируют с 100 TCID50/хорошо A(H3N2) вирусов гриппа разрешить антител в сыворотке для привязки к вирусов. MDCK-SIAT1 клетки затем добавляется в смесь вирус антитела и инкубированы для 18-20 ч при 37 ° C, 5% CO2 разрешить A(H3N2) вирусов заразить клетки MDCK-SIAT1. После ночи инкубации, крепятся плиты и количество вируса в каждом хорошо количественно энзим соединенный assay иммуносорбента (ELISA) с помощью противогриппозные Нуклеопротеиды (NP) моноклональные антитела. Нейтрализация титр антител определяется как взаимные высоких сыворотки разрежения, которая обеспечивает ≥50% ингибирования инфективности вируса.
Введение
Вирусы гриппа по-прежнему вызывать заболеваемость и смертность населения каждый год. ГА является основной поверхности гликопротеина вирусов гриппа. Нейтрализующие антитела против га являются основным иммунного механизма, который коррелирует с защитой гриппа инфекция1,2. Два метода, широко используется для измерения реакции антитела в человеческой сыворотки после гриппа инфекции или вакцинации3гемагглютинации ингибирование (HI) анализов и MN анализов. HI меры ингибитирование антитела вируса гемагглютинации красных кровяных клеток и считается пробирного суррогат. В отличие от Привет MN assay может непосредственно измерить уровни антител в человеческой сыворотки, которые нейтрализуют инфекции гриппа в клеточных культурах. MDCK клетки часто используются в изоляции вируса гриппа и MN assays4.
Вирусы гриппа постоянно проходят антигенный дрейф и shift, приобретения мутации на HA белков, которые могут изменить рецептор привязки специфика вирусов. С 2014 года новые кластеры A(H3N2) вирусов возникли и продолжают циркулировать до текущего сезона. Большинство этих вирусов принадлежат генетические группы 3C.2a и 3C.3a на основе филогенетического анализа белков HA. Многие из циркулирующих вирусов 3C.2a снизили способность hemagglutinate красных кровяных клеток и поэтому не могут характеризоваться Привет анализов5. Нейтрализация анализов должны использоваться для измерения антитела ответы на эти вирусы, которые не hemagglutinate6. Кроме того исследования показали, что эти современные вирусы A(H3N2) изменили свойства привязки рецепторов, по сравнению с ранее A(H3N2) вирусов и имеют тенденцию накапливаться культуры адаптированы мутации и полиморфизм когда пассированной в ячейке в пробирке 7,культур8,9. По сравнению с обычными MDCK клеток, MDCK-SIAT1 является линия клетки, разработанный Матросович и др. Благодаря стабильной transfection клетки MDCK с cDNA человека α2, 6-sialtransferase (SIAT1). Эта линия клетки выражает повышенных количествах α2, постановление 6-сиаловых галактозы и снижение количества α2, 3-сиаловых кислот постановление чем родительской клетки MDCK10. MDCK-SIAT1 клеток показали, чтобы улучшить показатели изоляции на вирусы A(H3N2), по сравнению с MDCK клеток11. Недавно, Линь и др. сообщили, что для вновь появившихся 3C.2a и 3C.3a человека A(H3N2) вирусов гриппа, более верным вирус репликаций и лучше инфективности вируса были достигнуты когда вирусы были культивировали в MDCK-SIAT1 клеточных линий по сравнению с MDCK клетки7. Таким образом MDCK-SIAT1 клетки лучше подходят в MN анализов характеризовать антитела ответы на последние кластеры A(H3N2) вирусов.
Здесь мы описываем пробирного MN, используя MDCK-SIAT1 клетки для измерения антитела ответы на современных 3C.2a и 3C.3a A(H3N2) вирусов в человеческой сыворотки. Вирусы, выращенных в яйца или клетки могут использоваться в этом assay. Тепла инактивированная сера содержит нейтрализующие антитела впервые серийно разводили, затем инкубируют с 100 TCID50/хорошо вируса гриппа A(H3N2) разрешить антител в сыворотке для привязки к вирусу. MDCK-SIAT1 клетки затем добавляется в смесь вирус антитела и инкубированы для 18-20 ч при 37 ° C, 5% CO2 разрешить A(H3N2) вирус заражает MDCK-SIAT1 клетки и репликации. После ночи инкубации пластины являются фиксированными и количество вируса в каждой скважине количественно, ELISA с использованием моноклональных антител против гриппа NP. Обнаружение NP указывает на наличие вирусной инфекции и отсутствие нейтрализующих антител. Нейтрализация титр антител определяется как взаимные высоких сыворотки разрежения, которая обеспечивает ≥ 50% ингибирования инфективности вируса.
протокол
Все вирусы гриппа должны обрабатываться согласно требований к уровню соответствующего биобезопасности (BSL-2 или выше), определенных в области биобезопасности на микробиологические и биомедицинских лабораториях (BMBL)12.
1. Подготовка реагентов и исходного материала
-
Подготовка клетки MDCK-SIAT1 и стерильные клетки культуры среднего
- Подготовить MDCK-SIAT1 клеток культуры среднего с использованием 500 мл из Дульбекко изменение Eagle среднего (DMEM) с высоким глюкозы, 10% v/v тепла инактивированная плода бычьим сывороточным (ФБС), 2 мм L-глютамин, 1 мм пируват натрия, сульфат 1 мг/мл G418 (например, Geneticin) и 100 ед/мл пенициллин с 100 мкг/мл стрептомицина (необязательно). Стерилизуют фильтрацией через мембрану поры 0,2 мкм. G418 сульфат добавляется для обеспечения стабильности плазмида в клетках MDCK-SIAT1.
- Подготовьте линию клеток MDCK-SIAT1 . 162 см2- flask(s) культуры ткани, содержащие 30 мл стерильного клетки культуры средств массовой информации, семян колбы с 2-2,5 х 106 MDCK-SIAT1 клеток и инкубировать при 37 ° C в 5% CO2 в течение 2 дней; Это будет использоваться для определения инфекционных дозы (TCID) культуры ткани и MN анализов.
Примечание: MDCK-SIAT1 клетки были любезно предоставлены д-р M. Матросович, Марбург, Германия10. Эта линия клетки могут быть получены также коммерчески (см. Таблицу материалов).
- Подготовьте стерильные вирус распространения массовой информации с использованием 500 мл DMEM высокие глюкоза, 0,3% бычьим сывороточным альбумином (БСА) часть V, 100 ед/мл пенициллин, 100 мкг/мл стрептомицина и 20 мм HEPES. Стерилизуют фильтрацией через мембрану поры 0,2 мкм.
- Подготовьте 0,75% (v/v) морской свинки красные кровяные клетки (gpRBCs) в фосфатный буфер (PBS) содержащий 0,01 М PBS, при рН 7,2.
- Подготовка разбавителя стерильные вирус с помощью DMEM высокие глюкоза, 1% V фракция говядину альбумина (BSA), 100 ед/мл пенициллин, 100 мкг/мл стрептомицина и 20 мм HEPES. Стерилизуют фильтрацией с 0,2 мкм-поры мембраны и готовить свежие для калибровочных.
- Подготовьте холодной камере фиксатором как 80% холодной ацетона в PBS (0,01 М PBS, pH 7.2).
- Готовить, стирать буфера с помощью PBS (0,01 М PBS рН 7,2) и 0,3% (v/v) tween-20.
- Подготовка разбавителя антитела используя PBS (0,01 М PBS, pH 7.2), 0,3% (v/v) tween-20 и 5% обезжиренное сухое молоко.
- Используйте противогриппозные NP мыши моноклональные антитела клон A1 и A3 бассейн как основное антитело. Развести в разбавителя в оптимальной концентрации определяется титрования антител.
- Коза использовать анти мыши IgG конъюгированных с пероксидазой (ПХ) как вторичное антитело. Развести в разбавителя в оптимальной концентрации определяется титрования антител.
- Подготовьте пероксидазы субстрат с помощью o- фенилендиамином дигидрохлорид (OPD) в 0,05 М фосфатного буфера цитрата при рН 5. Подготовьте 0,05 М фосфатного буфера цитрата, растворяя 1 капсуле/100 мл деионизированная H2O. растворить 1 OPD таблетки (10 мг) / 20 мл фосфатного буфера цитрата непосредственно перед использованием.
- Качестве OPD остановить решениеиспользовать 0,5 М серной кислоты. Добавьте 28 мл серной кислоты акций 18 М в 972 мл деионизированная H2O в химические вытяжки.
-
Лечения человека и животных сера
- Тепла инактивирует человека сера используется в MN анализов на водяной бане в 56 ° C за 30 мин до assay. Использовать сразу же или в случае необходимости, хранить размороженные сера при 4 ° C для не более чем на 24 ч; Если необходим длительный срок хранения, магазин сера замороженные при температуре-20 ° C или холоднее.
- Лечить животных сера используется в MN анализов с рецепторов уничтожая фермента (РДЭ) и тепловой инактивации до assay следующим образом.
- Оттепель sera в ванну воды 37 ° c, а затем поместить на льду. Смешайте 1 объем выборки животных сыворотки с 3 тома эру. Инкубируйте на 37 градусов для 18-20 ч.
- Тепла инактивирует РДЭ лечение sera в 56 градусов 30 минут добавить 6 томов PBS, pH 7,2 до каждого образца для окончательного предварительного разбавления 1:10. При необходимости Храните размороженные сера при 4 ° C для не более чем на 24 ч; Если необходим длительный срок хранения, магазин сера замороженные при температуре-20 ° C или холоднее.
Примечание: Животных Сера может содержать различные гликанов сиаловые кислоты, которые могут связать HAs вирусов гриппа и подавляют привязки гриппа специфических анти-Ха антител. Таким образом, это необходимо для РДЭ лечить всех животных сера до MN анализов, чтобы удалить эти неспецифической вирусный HA вяжущих в образцах сыворотки.
2. прохождение культуры клеток MDCK-SIAT1
Примечание: Все клеточных культур должны быть выполнены в биологической безопасности кабинета для предотвращения загрязнения.
- Декант среднего культуры клеток от монослое клеток в колбах2 162 см. Trypsinize клетки, промыв монослой с трипсина ЭДТА. Добавьте 5 мл трипсина ЭДТА для покрытия монослое клеток. Инкубируйте при 37 ° C, 5% CO2 пока не монослое (5-10 мин). Добавьте 15 мл MDCK-SIAT1 клеток культуры средств массовой информации для каждого флакон, содержащий trypsinized клетки, Пипетка вверх и вниз для разделения клетки.
- Используйте Горяева и Трипановый синий определить что клеток и жизнеспособности. Заполнение ячеек в новые 162 см2 культуры ткани флаконы содержащие 30 мл СМИ культуры клеток с 2-2,5 х 106 клеток /flask и инкубировать при 37 ° C с 5% CO2 на 2 дня для использования в TCID и MN анализов. Семян клетки на 4-5 х 106 клеток/колба и инкубировать при 37 ° C с 5% CO2 на 2 дня для использования в распространении вируса.
Примечание: Плотность посева может быть скорректирована по желанию периодов короче или длиннее культуры. Для размножения вирус, клетки должны достичь более 100% confluency. Для культуры ткани инфекции доза (TCID) и MN анализов клетки должно быть 75-95% confluency (рис. 1).
3. распространение вируса A(H3N2) в клетках MDCK-SIAT1
Примечание: A(H3N2) вирус может распространяться либо в 10-11 день, старый эмбриональные куриные яйца согласно стандартному протоколу3, или MDCK-SIAT1 клеток культур. MDCK-SIAT1 клетки должны достигать более 100% confluency для вирус вакцинации. Посевного вируса могут быть привиты с несколько разведений посевным материалом. Посевным материалом разведений с лучший урожай HA и инфективности могут использоваться для дальнейшего MN анализов.
- Удалите средство культуры клеток из монослое клеток (> 100% confluency) в 162 см2 фляги. Вымойте монослоя дважды с 15 мл стерильного 0,01 М PBS, pH 7.2 и сцеживаться.
- Пометить 1 флакон как управления и добавляют 20 мл вирус распространения средств массовой информации. Инкубируйте настой при 37 ° C с 5% CO2. Оставить этот настой нетронутой и использовать для сравнения после 1 день распространения вируса.
- Добавить 10 мл стерильной вирус распространения средств массовой информации в flask(s) и Инкубируйте все flask(s) при 37 ° C, 5% CO2. Оттепель флакон запасов вируса гриппа при комнатной температуре, а затем поместить на льду. Разбавляют СМИ распространения вируса в разведениях целевой.
Примечание: Цель разведениях может быть скорректирована на основе HA титры запасов вируса. Подготовить 1: 1000 разбавленный посевным материалом, 100 мкл вируса до 9,9 мл стерильного вирус распространения средств массовой информации. Инвертировать мягко, удалить 1 mL разбавления 1: 100 до 9 мл стерильной вирус распространения средств массовой информации, осторожно перевернуть для посевным материалом разводят 1: 1000. Место на льду. - Удалите все колбы, за исключением управления настой из инкубатора. Удалите средства распространения вируса от flask(s) MDCK-SIAT1 клеток и прививать каждый флакон с 10 мл разбавленной вируса. Инкубируйте фляги при 37 ° C, 5% CO2 за 1 ч, вращающихся flask(s) каждые 15 мин.
- Удалить из flask(s) 5 мл посевным материалом и заменить 15 мл вирус распространения носителей, содержащих 1 мкг/мл TPCK-трипсина. Инкубируйте flask(s) при 37 ° C, 5% CO2 для 16-18 ч.
- После ночи инкубации наблюдать за flask(s) под 100 X микроскоп увеличением и искать цитопатического воздействия (CPE) на клетки. Удалить из flask(s) 15-17 мл вируса супернатанта и заменить 15-17 мл свежеприготовленные вирус распространения средств массовой информации, содержащие 2 мкг/мл TPCK-трипсина.
- Инкубируйте фляги при 37 ° C, 5% CO2. Следить за CPE монослое (по сравнению с ячейки управления колбу) и проверить HA периодически (каждые 4 ч) с gpRBC 0,75% до сбора урожая.
- Настройка HA 96-луночных микротитровальных пластины. Добавьте 50 мкл 0,01 М PBS, pH 7.2 скважин A2 - A12 и B2 - B12 (дубликаты) и скважины H1 - H12 для элемента управления.
- 100 мкл вируса супернатанта A1 и A2, выполните 2 раза серийный разрежения от A1 и B1 через A12 и B12. Отменить 50 мкл после смешивания в A12 и B12. Добавьте 50 мкл gpRBCs 0,75% строки A, B и H.
- Коснитесь значка пластину и инкубации при комнатной температуре в течение 1 ч.
- Определите HA вируса супернатанта, отогнув пластину 96-луночных микротитровальных 45 ° под углом 60°.
- Читать знаки для гемагглютинации; высокая разрежения вируса, который достигает полной гемагглютинации считается конечной точки титрования HA для конкретного вируса. Рекорд взаимной высокого разрежения вирус с полным гемагглютинации как HA титр вируса.
Примечание: Поселились эритроцитов в строке H (элементы управления) должны «запуск» и образуют небольшой каплевидной формы тяжести. Ждать до БС в элементе управления, который Уэллс закончить работает, то прочитайте кнопки РБК в вирус титрования скважин. Те, которые exhibit РБК кнопки и «run», не достигают гемагглютинации. Найдите высокого разрежения вируса, который полностью подавляют гемагглютинации как конечную точку HA титр вируса.
- Урожай вируса, когда HA культуры вируса плато или культуры вируса достигает цели ха (например, > 16 ГАУ), но перед ячейкой монослоя начинает отображать значительные CPE.
- Центрифуга культуры вируса супернатант в 300 g x 10 мин при 4 ° C для пеллет сотовой мусора. Перенесите топленое супернатанта, содержащий вирус урожай чистую пробирку. Аликвота супернатант, содержащий вирус урожай в одноразовые стерильные криогенных флаконов и немедленно заморозить на-70 ° C или холоднее.
Примечание: Вирус запасов, используемые для MN анализов должны иметь высокий титр инфекционных и минимальным дефектных частиц. Минимальное разбавление запасов вируса для достижения 100 мкл TCID50/50 для MN assay-1: 100.
Примечание: Вирус запасов, используемые в MN анализов следует не оттаяла и размораживают.
- Центрифуга культуры вируса супернатант в 300 g x 10 мин при 4 ° C для пеллет сотовой мусора. Перенесите топленое супернатанта, содержащий вирус урожай чистую пробирку. Аликвота супернатант, содержащий вирус урожай в одноразовые стерильные криогенных флаконов и немедленно заморозить на-70 ° C или холоднее.
4. Определение TCID вируса
- День 1: Вирус титрования
- Оттепель флакон вируса при комнатной температуре и немедленно разместить на льду.
- Тестовый вирус в двух различных разведениях начиная: 10-2 и 10-3. Добавьте 100 мкл вируса 9.9 мл разбавителя для разбавления 10-2 вируса. Добавьте 1 mL разбавления 10-2 до 9.0 мл разбавителя для разбавления 10-3 вируса.
- С помощью двух микротитровальных пластин (1 для разбавления 10-2 ) и крышку 2 для 10-3 разрежения, мкл 100 вирус разбавителя для всех скважин, за исключением столбца 1 96-луночных микротитровальных пластины.
- Выполните ½log10 разведений (10-2, 10-2,5, 10-3, и т.д.). 146 мкл вируса начиная разрежения для всех скважин в колонке 1 и передача 46 мкл поочередно из столбца 1 через колонку 11 (рис. 2). Наконечники изменения между скважинами. После смешивания колонке 11, отбросить советы с 46 мкл разрежения.
- Используйте столбец 12 как клетки контроля (CC); Он содержит только вирус разбавителя. Инкубировать 1 час при 37 ° C, 5% CO2.
- День 1: Подготовка клеток MDCK-SIAT1
Примечание: Монослоя клеток MDCK-SIAT1 должен достичь 75-95% confluency для анализов TCID и MN. Один флакон 162 cm2 на 95% confluency должна принести достаточно клетки семян ~ 4-5 микротитровальных пластины.- Вымойте вырожденная монослоя 75-95% с 20 мл PBS для удаления FBS в культуре средств массовой информации. Следующим trypsinize клетки.
- Промойте монослой с стерильных PBS, добавить 7 мл трипсина ЭДТА для покрытия монослое клеток. Заложить колбу с плоским и инкубировать при 37 ° C, 5% CO2 пока не монослое (приблизительно 5-10 мин). Добавьте 7 мл разбавителя вируса в каждый флакон, содержащий trypsinized клетки.
- Вымойте клетки с вирусом растворителя для удаления FBS.
- Аккуратно Пипетка вверх и вниз, чтобы отделить клетки. Передача клетки в 50-мл Конические трубки; Заполните трубу с вирусом разбавителя.
- Центрифуга на 485 x g для 5 минут Decant вирус разбавителя, заменить свежим 50 мл разбавителя вирус и центрифуги на 485 x g для 5 минут Decant вирус разбавителя и заменить свежий вирус разбавителя (10 мл/колба) для Ресуспензируйте гранулы.
- Используйте Горяева и Трипановый синий определить клеток и жизнеспособности. Регулировка концентрации клеток с вирусом 1,5 x 105 клеток/мл разбавителя.
- Добавить 100 мкл разбавленного MDCK-SIAT1 клеток в каждой скважине микротитровальных пластин (1,5 х 104 клетки/хорошо) и накладки. Инкубируйте при 37 ° C, 5% CO2 на 18-20 ч.
- Вымойте вырожденная монослоя 75-95% с 20 мл PBS для удаления FBS в культуре средств массовой информации. Следующим trypsinize клетки.
- День 2: ELISA
-
Фиксация клеток
- Удалите носитель из микротитровальных плит. Мыть каждый хорошо с 200 мкл PBS. Добавить 300 мкл холодной 80% ацетона в каждой скважине и инкубации при комнатной температуре за 10 минут снять фиксатор и позволяют пластины в воздух сухой.
-
ELISA
-
Ослабленный первичный гуморальный дополнение
Примечание: Противогриппозные NP моноклональное антитело должно использоваться в избытке как основное антитело в ELISA. Определите оптимальный антитела разрежения для каждой партии первичных антител, выполняя антитела титрования в MN. Выберите основное антитело концентрацию, которая находится в избытке и с лучшее соотношение сигнал-фон.- Разбавить противогриппозные NP моноклональных антител (основное антитело) целевой концентрации в антитела разбавителя (например мкл 30 основное антитело по 30 мл разбавителя для целевого разбавления 1: 1000 антител).
- Мыть тарелки 3 раза с 300 мкл буфера мытья. Добавьте 100 мкл разбавленного основное антитело в каждой скважине. Инкубации при комнатной температуре в течение 1 ч.
-
Добавление вторичного антитела
Примечание: Коза анти мыши IgG конъюгированных хрен пероксидазы (ПХ) должны использоваться в избытке как вторичное антитело в ELISA. Определите оптимальный антитела разрежения для каждой партии вторичных антител, выполняя антитела титрования. Выберите вторичное антитело концентрации в избытке и с лучшее соотношение сигнал-фон.- Разбавьте коза анти мыши IgG конъюгированных с ПХ антитело (вторичное антитело) целевой концентрации в разбавителя антител (например , добавить 7,5 мкл вторичные антитела к 30 мл разбавителя для цели 1: 4000 разбавления антитела).
- Мыть тарелки 3 раза с 300 мкл буфера мытья. Добавьте 100 мкл разбавленного вторичное антитело в каждой скважине. Инкубации при комнатной температуре в течение 1 ч.
-
Добавление подложки и пластины чтения
- Промойте пластины 5 раз с 300 мкл буфера мытья и нажмите на ворса протрите.
- 100 мкл свеже-приготовленный субстрат для каждой скважины и инкубации при комнатной температуре до тех пор, пока цвет развития насыщает и оптической плотности (OD) клеток контроля скважин < 0,2.
- Добавьте 100 мкл универсальное решение для всех скважин. Читайте на од скважин на 490 Нм, используя спектрофотометр микроплиты.
-
Ослабленный первичный гуморальный дополнение
-
Фиксация клеток
- TCID 50 расчет
- Рассчитайте средний ОД490 элементов ячейки (колонка 12).
- Рассмотрим любые испытания с ОД490 больше чем дважды медиана ОД490 скважин CC как «позитивные»; в противном случае он считается «негативный».
- Вычислите TCID50 вируса, используя метод Рид-Мюнх13.
- Определите количество срабатываний и негативы на каждом разрежения.
- Вычислить «совокупное позитив», «Кумулятивного негативного», «Соотношение» и «% положительных» как показано в таблице 1.
- Вычислить «пропорциональной расстояние» между разрежения показаны > 50% срабатываний и разбавления показаны < 50% срабатываний, используя следующие:
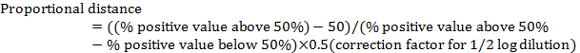
Примечание: Поправочный коэффициент для разбавления ½ журнала — 0,5. Например, в таблице 1: (80 − 50) /(80 − 20) x 0,5 = 0.25 - Вычислить вирус TCID50 , добавив пропорциональной расстояние для разбавления, показаны > 50% положительных.
Примечание: например, в таблице 2, TCID50 -10-5+(-0.25) = 10-5.25. Обратите внимание, что это TCID50 вируса на 100 мкл (или 10 мкл-5.25/100).
- Вычислите вирус разрежения. Для анализов MN разбавляют вирус TCID50/100 промаркированные (эквивалент 100 мкл TCID50/50 за хорошо).
Примечание: В примере в таблице 1, 1 TCID50 10-5.25 в 100 мкл, и разбавления до достижения 200 мкл TCID50/100 1:891, на основе расчетов: 200 x 10-5.25 = 10-2.95 = 1/102,95 = 1 / 891
5. MN Assay клетки MDCK-SIAT1
-
День 1: Тест и управления сера подготовки и пластины макет
- Оттепель sera в ванну воды 37 ° C и удалить сразу после оттаивания. Алиготе количество сыворотки, которые должны быть испытаны; минимум 10 мкл оригинальных Сера необходима для тестирования с одного вируса в синглетно. Если возможно проверьте Сера в дубликаты.
- Тепла инактивирует человеческой сыворотки для 30 мин на водяной бане 56 ° C как шаг 1.12.1. Sera место на льду пост тепловой инактивации, добавьте разбавитель вирус сывороток для достижения 1:10 до растворения.
- РДЭ лечения и предварительно разбавить животных сера до 1:10 для контроля за 1.12.2.
Примечание: Талой и обработанных человека и животных Сера может храниться при температуре 4 ° C, не больше чем 24 h. Sera следует хранить замороженные при температуре-20 ° C или холоднее, если дольше срок хранения требуется до assay. - Чтобы проверить с одного вируса, добавить 100 мкл 1:10 разбавленный сывороток для столбцов A1 до A10 (рис. 4). 50 мкл вируса разбавителя для строки B через час, за исключением столбцов, 11 и 12 (рис. 4). Выполняют два раза серийный разрежения от строки A через час и отбросить последние 50 мкл в строке H (рис. 4).
Примечание: Когда несколько вирусы должны быть проверены, Сера может быть разбавлен в титре трубы. Разведении сыворотки, с целью установления титр сыворотки, ну а — 1:10, ну B 1:20, хорошо C 1:40, хорошо 1:80 D, и E 1: 160, ну F 1:320, хорошо G 1:640, хорошо H 1:1,280 (рис. 4). - Для управления вирус, 50 мкл вирус разбавителя для скважин, A12, B12, C12 и D12 (не сера). Для ячейки, добавить 100 мкл растворителя вирус скважин E12, F12, G12 и Н12 (не вирус, не сера).
- Для управления sera (например, элементы управления хорька сера) добавьте 100 мкл разбавленного контроля сывороток также столбец 11 и добавить 50 мкл вируса разбавителя скважин B11 - H11. Серийный разбавленный вниз.
- Накладки, инкубации при 37 ° C, 5% CO2 до готовности для добавления вирус.
-
День 1: Вирус дополнение
- Разбавьте вирус 100 мкл TCID50/50 с вирусом разбавителя.
- Добавьте 50 мкл разбавленного вирус для всех скважин, за исключением столбца 11 на задней титрования (BT) пластины и ячейки управления скважин E12, F12, G12 и H12 на все пластины (рис. 4). Для этих пластин с управления Сера в колонке 11 добавьте столбец 11 вирусов.
- Вернуться титрования (BT)
- Включите BT в колонке 11 одного набора повторяющихся пластин (например, плиты 1A и 1B). Добавьте 50 мкл вируса разбавителя для всех скважин в колонке 11. 50 мкл вируса в 100 мкл TCID50/50 к первой скважины (A11). Смешайте закупорить вверх и вниз.
- Смешать и передачи 50 мкл последовательных скважин для выполнения 2 раза серийных разведений. Измените наконечники между скважинами, чтобы избежать переноса вирусов. Отменить 50 мкл от хорошо Н11.
- Добавьте 50 мкл вируса разбавителя в колонке 11 довести окончательный объем до 100 мкл. Коснитесь пластины смешивать.
- Инкубируйте пластины при 37 ° C, 5% CO2 на 1 ч.
- Выполняет сложение клеток MDCK-SIAT1 на 1 день и ИФА на день 2, как описано в шагах 4.2 и 4.3 (также описан в 5.3 и 5.4)
-
День 1: MDCK-SIAT1 клеток дополнение
- Подготовка клетки MDCK-SIAT1, как описано в шаге 4.2. Добавьте 100 мкл MDCK-SIAT1 клеток на 1,5 x 105 клеток/мл для каждой скважины (1,5 х 104 клетки/хорошо). Инкубируйте пластины при 37 ° C, 5% CO2 на 18-20 ч.
-
День 2: ELISA
- После ночи инкубации, на второй день исправить клетки с холодной ацетона 80%, как описано в шаге 4.3.
-
Ослабленный первичный гуморальный дополнение
- Мыть тарелки 3 раза с 300 мкл буфера мытья. Разбавляют противогриппозные NP моноклональных антител (основное антитело) до оптимальной концентрации как определяется титрования в разбавителе антитела (например мкл 30 основное антитело по 30 мл разбавителя для целевого разбавления 1: 1000 антител).
Примечание: 100 мкл основное антитело требуется за хорошо. ~ 10 мл необходим каждой пластины. - Добавьте 100 мкл разбавленного основное антитело в каждой скважине. Инкубации при комнатной температуре в течение 1 ч.
- Мыть тарелки 3 раза с 300 мкл буфера мытья. Разбавляют противогриппозные NP моноклональных антител (основное антитело) до оптимальной концентрации как определяется титрования в разбавителе антитела (например мкл 30 основное антитело по 30 мл разбавителя для целевого разбавления 1: 1000 антител).
-
Добавление вторичного антитела
- Мыть тарелки 3 раза с 300 мкл буфера мытья. Разбавить коза анти мыши IgG конъюгированных HRP антитело (вторичное антитело) целевой концентрации в антитела растворителя (например добавить 7,5 мкл вторичные антитела к 30 мл разбавителя для цели 1: 4000 антитела.)
Примечание: 100 мкл вторичное антитело требуется за 96 хорошо. ~ 10 мл необходим каждой пластины. - Добавьте 100 мкл разбавленного вторичное антитело в каждой скважине. Инкубации при комнатной температуре в течение 1 ч.
- Мыть тарелки 3 раза с 300 мкл буфера мытья. Разбавить коза анти мыши IgG конъюгированных HRP антитело (вторичное антитело) целевой концентрации в антитела растворителя (например добавить 7,5 мкл вторичные антитела к 30 мл разбавителя для цели 1: 4000 антитела.)
-
Добавление подложки и пластины чтения
- Промойте пластины 5 раз с 300 мкл буфера мытья и нажмите на ворса протрите.
- 100 мкл свеже-приготовленный субстрат для каждой скважины и инкубации при комнатной температуре до тех пор, пока вирус контроля скважин достичь ОД490 = 0,8 - 3, с ячейки на низком фон ОД490 < 0,2.
- Добавьте 100 мкл универсальное решение для всех скважин. Читайте на од скважин на 490 Нм, используя спектрофотометр микроплиты.
-
Анализ данных
Примечание: Расчеты MN определяются индивидуально для каждой пластины.- Определите, нейтрализующие антитела титр каждого образца сыворотки.
- Вычислите ОД490 прекращении нейтрализации вируса 50% для каждой пластины, используя следующее уравнение:
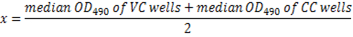
Примечание: Здесь x = 50% нейтрализации светотеневой границы. Взаимные сыворотки разрежения, соответствующий высоким разрежения с ОД490 менее 50% производства (≥50% ингибирования) считается титр антител нейтрализации для этого образца сыворотки (рис. 5).
- Вычислите ОД490 прекращении нейтрализации вируса 50% для каждой пластины, используя следующее уравнение:
- Убедитесь, что ячейки управления скважин ОД490 < 0,2 и вирус контроля скважин у ОД490 = 0,8 - 3.
- Убедитесь, что инфективности вируса в калибровочных (100 x TCID50) вирусом BT. приемлемого диапазона BT 50, 100 или 200 TCID. При использовании же ДЗПРМ, как определено в шаге 4.4.2, высокий вирус разрежения в столбце БТ с OD выше светотеневой границы должно быть в скважинах E11, F11, G11.
Примечание: Сыворотка позитивные элементы управления должны дать титры в 2 раза из значения, полученные в предыдущих тестах. ОД490 негативные сыворотки управления должна быть близка к соотношению для управления вирус.
- Определите, нейтрализующие антитела титр каждого образца сыворотки.
Результаты
Определение инфективности вируса запасов является первым шагом в MN assay. Рисунок 2 иллюстрирует структуру пластины для определения TCID50 запасов вируса. Для запасов вируса с неизвестным инфективности вирус можно титруют из нескольких предваритель?...
Обсуждение
MN assay является одним из основных анализов, используемые для гриппа серология для обнаружения антител реакции после инфекции гриппа или вакцинации. Титры, созданный из MN анализов часто используются как основной результат многих исследований Сероэпидемиология гриппа. MN анализов также ш...
Раскрытие информации
Авторы доклада никакого конфликта интересов. Выводы и заключения в этой публикации являются мнениями авторов и не обязательно отражают взгляды центров по контролю и профилактике заболеваний и финансирования Агентства.
Благодарности
Мы благодарим д-р Лу Xiuhua, доктор Фэн Лю и г-жа Эшли Берроуз в отделе гриппа CDC для их критического обзора и помощь в подготовке этой рукописи. Мы благодарим д-р Адриан Reber отдела гриппа CDC за его помощь в подготовке графика на рисунке 3. И наконец мы благодарим д-р M. Матросович, Марбург, Германия для обеспечения MDCK-SIAT1 клеток.
Материалы
| Name | Company | Catalog Number | Comments |
| Dulbecco’s Modified Eagle Medium (DMEM) with high Glucose | Life Science | 11965 | A critical component of Sterile Cell Culture, Virus Propagation and Virus Diluent Media |
| Fetal bovine serum (FBS) | Hyclone | SH30070.03 | |
| Bovine Serum Albumin (BSA) Fraction V, Protase Free | Sigma-Aldrich | 3117332001 | |
| L-Glutamine | Life Science | 25030-081 | |
| Sodium pyruvate | Life Science | 11360-070 | |
| Geneticin G-418 disulfate salt | Sigma-Aldrich | A1720-5G | |
| HEPES | Life Science | 15630-080 | |
| Penicillin/Streptomycin | Life Science | 15140-122 | |
| Acetone | VWR | 67-64-1 | Used at an 80% concentration |
| Phosphate-Citrate Buffer with Sodium Perborate | Sigma-Aldrich | SLBF2806V | |
| O-Phenylenediamine Dihydrochloride tablet | Sigma-Aldrich | SLBQ1086V | 1 tablet per 100ml of cell culture grade water |
| Sulfuric Acid | Fisher Scientific | A510-P500 | Used 0.5M final concentration |
| Ethanol, Denatured, 4L | VWR | EM-AX0422-3 | Used at an 70% concentration |
| Trypsin-EDTA | Life Science | 1748048 | |
| RDE II "Seiken" | Denka Seiken | 370013 | |
| Tween 20 | Sigma-Aldrich | P1379-500ml | |
| Anti-NP mouse monoclonal Ab | Millipore pool | MAB 8257 MAB 8258 | |
| Anti-mouse IgG HRP | KPL | 074-1802 | |
| 96-well flat-bottom plates | Thermo Scientific | 3455 | |
| Plate reader | Molecular Device | Spectromax 384 plus | |
| Cell Culture Flask 162 cm2/Vent Cap | Corning/VWR | 3151 |
Ссылки
- Reber, A., Katz, J. Immunological assessment of influenza vaccines and immune correlates of protection. Expert Rev of Vaccines. 12, 519-536 (2013).
- Li, C. K., Rappuoli, R., Xu, X. N. Correlates of protection against influenza infection in humans--on the path to a universal vaccine?. Curr Opin in Immunol. 25, 470-476 (2013).
- WHO Global Influenza Surveillance Network. . Manual for the labratory diagnosis and virological surveillence of influenza. , (2011).
- Govorkova, E. A., Kodihalli, S., Alymova, I. V., Fanget, B., Webster, R. G. Growth and immunogenicity of influenza viruses cultivated in Vero or MDCK cells and in embryonated chicken eggs. Dev Biological Stand. 98, 39-51 (1999).
- Levine, M. Z., et al. Neutralizing Antibody Responses to Antigenically Drifted Influenza A(H3N2) Viruses among Children and Adolescents following 2014-2015 Inactivated and Live Attenuated Influenza Vaccination. Clin Vaccine Immunol : CVI. 23, 831-839 (2016).
- Lin, Y., et al. The characteristics and antigenic properties of recently emerged subclade 3C.3a and 3C.2a human influenza A(H3N2) viruses passaged in MDCK cells. Influenza Other Respir Viruses. , (2017).
- Lin, Y. P., et al. Neuraminidase receptor binding variants of human influenza A(H3N2) viruses resulting from substitution of aspartic acid 151 in the catalytic site: a role in virus attachment?. J of Virol. 84, 6769-6781 (2010).
- Skowronski, D. M., et al. Mutations acquired during cell culture isolation may affect antigenic characterisation of influenza A(H3N2) clade 3C.2a viruses. Euro Surveillance. 21, 30112 (2016).
- Matrosovich, M., Matrosovich, T., Carr, J., Roberts, N. A., Klenk, H. D. Overexpression of the alpha-2,6-sialyltransferase in MDCK cells increases influenza virus sensitivity to neuraminidase inhibitors. J of Virol. 77, 8418-8425 (2003).
- Oh, D. Y., Barr, I. G., Mosse, J. A., Laurie, K. L. MDCK-SIAT1 cells show improved isolation rates for recent human influenza viruses compared to conventional MDCK cells. J Clin Microbiol. 46, 2189-2194 (2008).
- US Department of Health and Human Services. . Biosafety in Microbiological and Biomedical Laboratories. , (2009).
- Reed, H. M. A simple method of estimating fifty percent endpoints. The American Journal of Hygiene. 27, (1938).
- Laurie, K. L., et al. International Laboratory Comparison of Influenza Microneutralization Assays for A(H1N1)pdm09, A(H3N2), and A(H5N1) Influenza Viruses by CONSISE. Clinical Vaccine Immunol : CVI. 22, 957-964 (2015).
- Lin, Y., Gu, Y., McCauley, J. W. Optimization of a Quantitative Micro-neutralization Assay. J Vis Exp : JoVE. , (2016).
- van Baalen, C. A., et al. ViroSpot microneutralization assay for antigenic characterization of human influenza viruses. Vaccine. 35, 46-52 (2017).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены