JoVE 비디오를 활용하시려면 도서관을 통한 기관 구독이 필요합니다. 전체 비디오를 보시려면 로그인하거나 무료 트라이얼을 시작하세요.
Method Article
사용 하 여 MDCK SIAT1 세포 분석 실험 측정 인플루엔자 항 체 응답 Microneutralization에 의해 인간의 세라에 A(H3N2) 바이러스를 중화
요약
인플루엔자 중화 항 체는 인플루엔자 감염의 보호와 연관. Microneutralization 분석 실험 인간 혈 청의 중화 항 체를 측정 하 고 자주 독감 인간의 혈 청 학에 대 한 사용 됩니다. 인플루엔자 예방 접종 또는 감염 다음 현대 3C.2a 및 3C.3a A(H3N2) 바이러스 중화 항 체 titers 측정 MDCK-SIAT1 세포를 사용 하 여 microneutralization 분석 결과 설명 합니다.
초록
조류 독감 바이러스 (HA)에 대 한 중화 항 체는 인플루엔자 감염에 대 한 보호와 상관 관계가 주요 면역 메커니즘으로 간주 됩니다. Microneutralization (미네소타) 분석 실험 자주 독감 예방 접종 또는 감염 후 인간의 혈 청의 중화 항 체 응답을 측정 하는 데 사용 됩니다. Madine 다 비 개 신장 (MDCK) 세포는 미네소타 분석 실험에 대 한 일반적으로 사용 되 셀 기판. 그러나, 현재 3C.2a 및 3C.3a A(H3N2) 인플루엔자 바이러스 획득 순환 수용 체 바인딩 특이성 변경. 표면에 증가 된 α-2, 6 sialic 갈 락 토스 moieties로 MDCK SIAT1 셀 라인은 이러한 현대 A(H3N2) 바이러스에 대 한 향상 된 infectivity 기존의 MDCK 셀 보다 더 충실 한 복제를 제공을 입증 했다. 여기, 우리는 미네소타 분석 결과 MDCK SIAT1 셀을 사용 하 여 이러한 현대 A(H3N2) 바이러스 중화 항 체 titers 계량 하도록 최적화 된 설명 합니다. 이 프로토콜 열 비활성화 세라 중화 항 체를 포함 하는 먼저 순차적으로 희석, 다음 100 TCID50/인플루엔자 바이러스에 바인딩할 세라에 항 체를 수 있도록 A(H3N2)의 인 큐베이 팅. MDCK-SIAT1 셀 다음 바이러스 항 체 혼합물에 추가 하 고 37 ° C, 5% CO2 A(H3N2) 바이러스 MDCK SIAT1 세포를 감염 시킬 수 있도록에서 18-20 h에 대 한 인 큐베이 팅. 하룻밤 배양 후 플레이트 고정 되 고 각 바이러스의 양을 잘 효소 연결 된 immunosorbent 분석 결과 (ELISA) 항 인플루엔자를 사용 하 여 계량은 nucleoprotein (NP) 단일 클론 항 체. 중화 항 체 titer 바이러스 infectivity의 50% 억제를 제공 하는 높은 혈 청 희석의 상호로 정의 됩니다.
서문
인플루엔자 바이러스는 인간의 인구 매년 사망률 및 사망 원인을 계속. 하는 인플루엔자 바이러스의 주요 표면 당단백질. HA를 대상으로 하는 중화 항 체는 인플루엔자 감염1,2의 보호와 상관 관계가 주요 면역 메커니즘입니다. Hemagglutination 억제 (HI) 분석 실험 및 MN 분석 널리 인플루엔자 감염이 나 예방 접종3후 인간의 혈 청에 항 체 응답을 측정 하는 데 사용 하는 두 가지 방법이 있습니다. 이 분석 결과 붉은 혈액 세포의 바이러스 hemagglutination의 항 체 억제를 측정 하 고 분석 결과 대리 하는 것으로 간주 됩니다. 안녕, 달리 미네소타 분석 결과 직접 인간의 세라 셀 문화에서 인플루엔자 감염을 중화 하는 항 체의 수치를 측정할 수 있습니다. MDCK 셀 인플루엔자 바이러스 분리에 자주 사용 하 고 미네소타 분석 실험4.
인플루엔자 바이러스는 지속적으로 antigenic 드리프트와 shift, 바이러스의 수용 체 의무적인 특이성을 변경할 수 있는 HA 단백질에 돌연변이 인수 받 다. 2014 년 이후 A(H3N2) 바이러스의 새로운 클러스터 등장 하 고 현재 시즌까지 회람 하기 위하여 계속 했다. 이 바이러스의 대부분은 유전 그룹 3C.2a와 3C.3a HA 단백질의 계통 발생 분석에 기반에 속한다. 순환 3C.2a 바이러스의 많은 hemagglutinate 붉은 혈액 세포 수를 감소 했다 고이 분석 실험5에 의해 특성화 될 수 없습니다. 중립화 분석6hemagglutinate 하지 않는 이러한 바이러스에 항 체 응답을 측정 하기 위해 사용 되어야 한다. 또한, 연구는 이러한 현대 A(H3N2) 바이러스 수용 체 바인딩 속성 이전 A(H3N2) 바이러스에 비해 변경 및 문화 적응 돌연변이 및 다형성 체 외에서 세포에 passaged 때 축적 하는 경향이 나타났습니다. 문화7,,89. 기존의 MDCK 세포와 비교 하면, MDCK-SIAT1는 Matrosovich 그 외 여러분 에 의해 개발 된 셀 라인 인간의 α2, 6-sialtransferase (SIAT1)의 cDNA와 MDCK 세포의 안정 되어 있는 transfection을 통해 이 셀 라인 α2, 6 sialic 갈 락 토스 moieties 및 α2, MDCK 셀10부모 보다 3 sialic acid moieties 감소 금액의 증가 양을 표현 한다. MDCK-SIAT1 세포 MDCK 세포11에 비해 A(H3N2) 바이러스에 대 한 격리 속도 향상 시킬 나타났습니다. 최근, 린 외. 보고는 새로 등장 3C.2a 및 3C.3a 인간 A(H3N2) 인플루엔자 바이러스, 더 충실 한 바이러스 복제와 더 나은 바이러스 infectivity 달성 했다 바이러스 MDCK SIAT1 셀 라인 MDCK 셀7와 비교에 교양 있었다. 따라서, MDCK-SIAT1 세포는 더 미네소타 A(H3N2) 바이러스의 최근 클러스터에 대 한 항 체 응답 특성 분석에 적합 합니다.
여기 현대 3C.2a 및 3C.3a A(H3N2) 바이러스 인간 혈 청에 항 체 응답을 측정 하기 위해 MDCK SIAT1 셀을 사용 하 여 MN 분석 결과 설명 합니다. 이 분석 결과에 계란 또는 세포에서 바이러스를 사용할 수 있습니다. 열 비활성화 세라 중화 항 체를 포함 하는 먼저 순차적으로 희석, 다음 100 TCID50/인플루엔자 바이러스에 바인딩할 세라에 항 체를 수 있도록 A(H3N2)의 인 큐베이 팅. MDCK-SIAT1 셀 다음 바이러스 항 체 혼합물에 추가 하 고 37 ° C, 5% CO2 A(H3N2) 바이러스 MDCK SIAT1 세포를 감염 하 고 복제를 허용 하도록에서 18-20 h에 대 한 인 큐베이 팅. 야간 보육, 후 판을 고정 하 고는 ELISA 항 인플루엔자 A NP 단일 클론 항 체를 사용 하 여 각 우물에서 바이러스의 양을 계량은. NP의 감지 바이러스 감염의 존재와 항 체를 중화의 부재를 나타냅니다. 중화 항 체 titer 바이러스 infectivity ≥ 50% 억제를 제공 하는 높은 혈 청 희석의 상호로 정의 됩니다.
프로토콜
모든 독감 바이러스는 적절 한 biosafety 수준 요구 사항에 따라 처리 되어야 합니다 (BSL-2 또는 더 높은) Microbiological 및 생물 의학 실험실 (BMBL)12에 Biosafety에 정의 된 대로.
1입니다. 시 약 및 시작 물자의 준비
-
MDCK-SIAT1 세포와 균 세포 배양 매체 준비
- 높은 포도와 500 mL의 Dulbecco의 수정이 글 중간 (DMEM)를 사용 하 여 MDCK SIAT1 세포 배양 을 준비, 10 %v / v 열 소 태아 혈 청 (FBS), 2 mM L-글루타민, 나트륨 1 mM pyruvate, 1 mg/mL G418 황산 염 (예를 들어, 비활성화 geneticin), 및 (옵션) 100 µ g/mL 스와 100 U/ml 페니실린. 0.2 µ M 기 공 크기 세포 막을 통해 여과 하 여 소독. G418 황산 염 MDCK SIAT1 세포에서 플라스 미드의 안정성을 보장 하기 위해 추가 됩니다.
- MDCK-SIAT1 셀 라인을 준비 합니다. 162 cm2-살 균 세포 배양의 30 mL를 포함 하는 조직 문화 flask(s) 씨앗 2-2.5 x 106 MDCK SIAT1 세포를 플라스 크에 2 일; 5% CO2 에서 37 ° C에서 품 어 이 조직 문화 감염 복용량 (TCID) 결정 하 고만 사용 될 것입니다 분석 실험.
참고: MDCK SIAT1 셀 친절 하 게 박사 M. Matrosovich, Marburg, 독일10에 의해 제공 되었다. 이 셀 라인 얻어질 수 있다 또한 상업적으로 ( 테이블의 자료를 참조).
- DMEM 높은 포도 당, 0.3% 소 혈 청 알 부 민 (BSA) 분수 V, 100 U/mL 페니실린, 스 100 µ g/mL, 500 mL와 20 mM HEPES 사용 하 여 살 균 바이러스 전파 미디어 를 준비 합니다. 0.2 µ M 기 공 크기 세포 막을 통해 여과 하 여 소독.
- 버퍼링 인산 염 (PBS) 0.01 M PBS, pH 7.2에 포함 된에서 0.75% (v/v) 기니 피그 적혈구 (gpRBCs)를 준비 합니다.
- DMEM 높은 포도 당, 1% 소 민 분수 V (BSA), 100 U/mL 페니실린, 100 µ g/mL 스, 그리고 20 mM HEPES 사용 하 여 살 균 바이러스 희석제 를 준비 합니다. 0.2 µ m 기 공 크기 막으로 여과 하 여 살 균 하십시오 그리고 신선한 각 분석 결과 대 한 준비.
- PBS (0.01 M PBS, pH 7.2)에서 80% 찬 아세톤으로 차가운 세포 정착 제 를 준비 합니다.
- 세척 버퍼 PBS (0.01 M PBS pH 7.2)를 사용 하 여 준비 및 0.3% (v/v) 트윈-20.
- PBS (0.01 M PBS, pH 7.2)를 사용 하 여 항 체 희석 액 을 준비, 0.3% (v/v) 트윈-20, 그리고 5% 비-지방 우유를 건조.
- 1 차 항 체로 항 인플루엔자 A NP 마우스 단일 클론 항 체 클론 A1 및 A3 풀을 사용 합니다. 희석제 최적 농도에서 정한 적정 항 체에 희석.
- 사용 염소 반대로 마우스 IgG 활용 말 무 과산화 효소 (HRP) 이차 항 체. 희석제 최적 농도에서 정한 적정 항 체에 희석.
- 과산화 효소 기질 0.05 M 인산 염 구 연산 염 버퍼 pH 5에서에서 o-phenylenediamine dihydrochloride (OPD)를 사용 하 여 준비 합니다. 1 캡슐/100 mL 이온된 H2o. 분해 1 OPD 태블릿 (10 mg)을 용 해 하 여 0.05 M 인산 염 구 연산 염 버퍼를 준비 / 인산 염 구 연산 염 버퍼 사용 직전의 20 mL.
- OPD 중지 솔루션으로 0.5 M의 황산을 사용 합니다. 972 mL 이온된 H2O 화학 후드에서 18 M 황산 재고 28 mL를 추가 합니다.
-
인간과 동물 세라의 치료
- 열 분석 결과 이전 30 분 동안 56 ° C에서 물 욕조에만 분석에 사용 되는 인간의 세라 비활성화. 즉시 사용 하거나 필요한 경우, 저장 더 이상 24 h; 4 ° C에서 해 동된 세라 장기간 보관이 필요한 경우 세라-20 ° C에서 냉동 또는 추운 저장 합니다.
- 수용 체 파괴 효소 (RDE)와 MN 분석 실험에 사용 된 동물 세라 치료 및 열 분석 결과 사전 다음과 같이 비활성화.
- 37 ˚C 물 욕조에 세라를 녹여 다음 얼음에. 믹스 1 RDE의 3 볼륨 동물 혈 청 샘플의 볼륨. 18-20 h 37 ˚C에서 품 어.
- 열 비활성화 PBS, pH 7.2 1시 10분의 최종 사전 희석에 대 한 각 샘플의 30 분 추가 6 볼륨 56 ˚C에서 취급 하는 RDE 세라. 필요한 경우, 저장 더 이상 24 h; 4 ° C에서 해 동된 세라 장기간 보관이 필요한 경우 세라-20 ° C에서 냉동 또는 추운 저장 합니다.
참고: 동물 세라 인플루엔자 바이러스의 있다 바인딩할 하 고 인플루엔자-특정 안티의 바인딩을 억제 수 있습니다 다양 한 sialic acid glycans 포함 될 수 있습니다-HA 항 체. 따라서, 그것은 필요가 RDE 치료 혈 청 샘플에서 이러한 일반적인 바이러스 성 하 바인더를 제거 하려면 미네소타 분석 전에 모든 동물 세라.
2. MDCK SIAT1 세포 배양의 통로
참고: 모든 셀 문화 생물 안전 캐비닛 오염을 방지 하기 위해 수행 되어야 합니다.
- 162 cm2 플라스 크에 세포 단층에서 세포 배양을 가만히 따르다. 트립 신-EDTA와 단층을 rinsing 하 여 세포를 trypsinize. 5 mL 트립 신-EDTA 셀 단층 커버를 추가 합니다. 37 ° c, 5% CO2 는 단층 분리 (5-10 분) 때까지 품 어. 포함 된 trypsinized 셀, 셀을 아래로 피펫으로 각 플라스 크에 MDCK SIAT1 세포 배양의 15 mL를 추가 합니다.
- 사용 하 여 hemocytometer trypan 블루 셀 계산을 결정 하 고 생존. 시드 2-2.5 x 106 세포 /flask 세포 배양의 30 mL를 포함 새로운 162 cm2 조직 배양 플라스 크에 세포와 TCID와 MN 분석 실험에서 사용 하기 위해 2 일 동안 5% CO2 와 37 ° C에서 품 어. 씨 4-5 x 106 셀/플라스 크에 세포와 바이러스 전파에 사용 하기 위해 2 일 동안 5% CO2 와 37 ° C에서 품 어.
참고: 짧은 지 또는 긴지를 문화 기간 바란다면 시드 밀도 조정할 수 있습니다. 바이러스 전파에 대 한 셀에 도달 해야 이상 100 %confluency. 조직 문화 감염 복용량 (TCID)와 MN 분석 실험, 셀 75-95 %confluency (그림 1)에 있어야 합니다.
3. A(H3N2) MDCK SIAT1 세포에 바이러스의 전파
참고: A(H3N2) 바이러스 오래 된 embryonated 암 탉의 계란 표준 프로토콜3, 또는 MDCK SIAT1 셀 문화 10-11 하루 중에 전파 될 수 있습니다. MDCK-SIAT1 셀 이상 100%에 도달 해야 바이러스 접종에 대 한 confluency. 바이러스 씨 주식 inoculum의 여러 희석으로 주사 될 수 있습니다. 최고의 수확 하 inoculum 희석 및 infectivity 추가 MN 분석 실험을 위해 사용할 수 있습니다.
- 셀 단층에서 세포 배양 매체를 제거 (> 100 %confluency) 162 cm2 플라스 크에. 살 균 0.01 M PBS, pH 7.2의 15 mL로 두 번 단층을 세척 하 고 가만히 따르다.
- 제어로 1 플라스 크 라벨 고 바이러스 전파 미디어의 20 mL를 추가 합니다. 플라스 크 5% CO2와 37 ° C에서 품 어. 이 플라스 크 그대로 두고 바이러스 전파의 1 일 후 비교를 위해 사용.
- flask(s)에 살 균 바이러스 전파 미디어의 10 mL를 추가 하 고 37 ° C, 5% CO2에서 모든 flask(s)를 품 어. 실 온에서 인플루엔자 바이러스의 유리병을 녹여 다음 얼음에. 바이러스 전파 미디어 대상 희석을 희석.
참고: 대상 희석 조정 될 수 있다 바이러스 주식의 HA titers 기반으로 합니다. 준비는 1:1000 inoculum을 희석, 살 균 바이러스 전파 미디어의 9.9 mL를 100 µ L 바이러스의 추가. 부드럽게 반전, 제거 살 균 바이러스 전파 미디어의 9 mL에 1: 100 희석의 1 mL, 희석 1:1000 inoculum 위한 살짝 반전. 얼음에 놓습니다. - 인큐베이터에서 제어 플라스 크를 제외 하 고 모든 플라스 크를 제거 합니다. Flask(s) MDCK-SIAT1 세포에서 바이러스 전파 미디어를 제거 하 고 희석된 바이러스의 10 mL와 함께 각 플라스 크에 접종. 37 ° C, 5% CO2 1 h, flask(s) 15 분 마다 회전에 플라스 크를 품 어.
- flask(s)에서 inoculum의 5 mL을 제거 하 고 1 µ g/mL TPCK-트립 신을 포함 하는 15 mL 바이러스 전파 미디어 바꿉니다. 37 ° C, 5% CO2 16-18 h에서 flask(s)를 품 어.
- 밤새 부 화 후 현미경 배율 X 100에서 flask(s)를 관찰 하 고 cytopathic 효과 (CPE) 셀에 대 한 보고. Flask(s)에서 15-17 mL의 표면에 뜨는 바이러스를 제거 하 고 2 µ g/mL TPCK-트립 신을 포함 하는 갓된 바이러스 전파 미디어의 15-17 mL를 바꿉니다.
- 37 ° c, 5% CO2플라스 크를 품 어. (비교해보면 셀 제어 플라스 크) 단층의 CPE를 모니터링 하 고 주기적으로 HA (모든 4 h) 0.75 %gpRBC 수확까지 확인.
- HA 96 잘 결정 플레이트를 설정 합니다. 0.01 M PBS, pH 7.2 웰 스 A2-a 12와 b 2-b 12의 50 µ L 추가 (중복), 및 제어를 위한 H12 웰 스 H1-.
- 추가 바이러스 표면에 뜨는 100 µ L a 1과 A2, A1 및 B1 A12 그리고 B12 통해 2-fold 직렬 희석을 수행 합니다. A12 그리고 B12 혼합 후 50 µ L를 버리십시오. 0.75 %gpRBCs 50 µ L A, B, 및 H. 행 추가
- 접시를 누르고 1 시간 실 온에서 품 어.
- 60 ° 각도를 45 °에서 96 잘 결정 플레이트를 기울이기에 의해 표면에 뜨는 바이러스의 HA를 결정 합니다.
- Hemagglutination;에 대 한 번호판을 읽기 완전 한 hemagglutination를 달성 하는 바이러스의 가장 높은 희석에는 특정 바이러스에 대 한 적정 하 끝점으로 간주 됩니다. 높은 바이러스 희석의 완전 한 hemagglutination와 HA titer로 바이러스의 상호를 기록 합니다.
참고: 행 H (컨트롤)에 정착된 Rbc "실행" 시작 하 고 중력으로 인해 작은 눈 물방울 모양을 형성 한다. 제어 우물 완료에서 Rbc까지 대기 팬 들은 바이러스에 RBC 버튼 적정 웰 스의 정보를 읽고 다음 실행. RBC 단추 및 "실행", 그 hemagglutination을 달성 하지 않습니다. 바이러스의 끝점 HA titer로 hemagglutination를 완전히 억제 하는 바이러스의 가장 높은 희석을 찾습니다.
- 바이러스 문화의 하 고원 또는 바이러스 문화 대상 하에 도달 하는 경우 바이러스를 수확 (예 > 16 HAU), 셀 전에 단층 상당한 CPE를 표시 하기 시작 하지만.
- 300 x g 작은 세포질 파편을 4 ° C에서 10 분 동안에 표면에 뜨는 바이러스 문화 원심 깨끗 한 관을 바이러스 수확을 포함 하는 명확히 상쾌한 전송. Aliquot 바이러스를 포함 하는 상쾌한 일회용 살 균 저온 튜브에 수확 하 고-70 ° C에 또는 추 즉시 동결.
참고: MN 분석 실험을 위해 사용 하는 바이러스 주식 해야 높은 감염 titer 최소한의 결함이 있는 입자. 바이러스 주식 100 TCID50/50 µ L MN 분석 결과 대 한 달성의 최소 희석 1: 100입니다.
참고: MN 분석 실험에서 사용 하는 바이러스 주식 해야 안 수 해 동 및 refrozen.
- 300 x g 작은 세포질 파편을 4 ° C에서 10 분 동안에 표면에 뜨는 바이러스 문화 원심 깨끗 한 관을 바이러스 수확을 포함 하는 명확히 상쾌한 전송. Aliquot 바이러스를 포함 하는 상쾌한 일회용 살 균 저온 튜브에 수확 하 고-70 ° C에 또는 추 즉시 동결.
4입니다. 바이러스의 TCID의 결정
- 제 1 일: 바이러스 적정
- 실 온에서 바이러스의 유리병을 해 동 하 고 즉시 얼음에 놓습니다.
- 두 개의 다른 시작 희석에서 바이러스 테스트: 10-2 , 10-3. 10-2 희석에 대 한 희석제 바이러스의 9.9 mL에 바이러스의 100 µ L를 추가 합니다. 10-3 희석에 대 한 희석제 바이러스의 9.0 mL를 10-2 희석의 1 mL를 추가 합니다.
- 두 결정을 사용 하 여 접시 (접시 1 10-2 희석에 대 한) 및 격판덮개 2 10-3 희석, 96-잘 결정 접시의 1 열을 제외한 모든 우물에 바이러스 희석제의 100 µ L를 추가 합니다.
- ½log10 희석 (10-2, 10-2.5, 10-3, 등)을 수행 합니다. 열 1에서에서 시작 하는 모든 우물을 희석 하는 바이러스의 146 µ L을 추가 하 고 열 열 11 (그림 2)를 통해 1에서에서 46 µ L를 직렬로 전송. 웰 스 사이 변화 피 펫 팁. 혼합 후 열 11, 46 µ L 희석와 팁을 삭제 합니다.
- 사용 열 12로 셀 제어 (CC); 그것은 바이러스 희석제를 포함 됩니다. 37 ° C, 5 %CO 1 시간에 대 한 품 어2.
- MDCK-SIAT1 세포의 제 1 일: 준비
참고: MDCK SIAT1 세포 단층 TCID와 MN 분석 실험에 대 한 75-95 %confluency 도달 한다. 95 %confluency 한 162 cm2 플라스 크 씨에 게 충분 한 세포를 산출 해야 한다 ~ 4-5 결정 플레이트.- 75-95 %confluent 단층 20 mL 문화 미디어에서는 FBS를 제거 하는 PBS로 세척. Trypsinize 셀 다음과 같습니다.
- 살 균 PBS와 단층 린스, 7 mL 트립 신-EDTA 셀 단층 커버를 추가 합니다. 플라스 크를 누워 평평 하 고 37 ° c, 5% CO2 는 단층 분리 (약 5-10 분) 때까지 품 어. Trypsinized 셀에 포함 된 각 플라스 크에 바이러스 희석제의 7 mL를 추가 합니다.
- 워시는 FBS를 제거 하려면 바이러스 희석제와 셀.
- 부드럽게 아래로 셀을 분리 하기 위하여 플라스틱. 50 mL 원뿔 튜브; 셀 전송 바이러스 희석제로 튜브를 채우십시오.
- 5 분 Decant 희석제 바이러스에 대 한 485 x g에서 원심, 신선한 50 mL 바이러스 희석제, 대체 및 5 분 Decant 희석제 바이러스에 대 한 485 x g에서 원심 및 신선한 바이러스 희석제를 바꿉니다 (10ml/플라스 크) resuspend 펠 릿을.
- 이용 hemocytometer trypan 블루 셀 수와 생존 능력 결정 하. 1.55 셀/10ml x 희석제 바이러스 세포 농도 조정 합니다.
- 결정 플레이트 (104 셀/잘 x 1.5)의 각 음을 희석된 MDCK SIAT1 세포의 100 µ L을 추가 하 고 번호판 커버. 37 ° C, 5% CO2 18-20 h에서 품 어.
- 75-95 %confluent 단층 20 mL 문화 미디어에서는 FBS를 제거 하는 PBS로 세척. Trypsinize 셀 다음과 같습니다.
- 제 2 일: 애 란
-
셀의 고정
- 결정 플레이트에서 매체를 제거 합니다. 각 씻어 PBS의 200 µ L로 잘. 각 잘을 300 µ L 찬 80% 아세톤을 추가 하 고 10 분은 정착 액을 제거 하 고 공기 접시 건조 허용에 대 한 실 온에서 품 어.
-
ELISA
-
1 차적인 항 체 추가
참고: 항 인플루엔자 A NP 단일 클론 항 체 사용 되어야 한다 초과에서 ELISA에 1 차 항 체로. 미네소타에 있는 항 체 titrations를 수행 하 여 기본 항 체의 각 주차장에 대 한 최적의 항 체 희석을 결정 합니다. 최상의 신호 대 배경 비와 초과에서 기본 항 체 농도 선택 합니다.- 희석제 항 체에서 대상 농도에 항 인플루엔자 A NP 단일 클론 항 체 (1 차적인 항 체)를 희석 (예: 추가 30 µ L 1 차적인 항 체의 항 체 1:1000의 대상 희석에 대 한 희석제의 30 mL).
- 3 번 워시 버퍼의 300 µ L로 세척 접시. 각 잘을 100 µ L 희석된 1 차적인 항 체를 추가 합니다. 1 시간에 대 한 실 온에서 품 어.
-
이차 항 체 추가
참고: 염소 마우스 IgG 말 무에 활용 된 안티 과산화 효소 (HRP)로 사용 해야 초과에서 ELISA에서 이차 항 체. 항 체 titrations를 수행 하 여 각 많이 이차 항 체에 대 한 최적의 항 체 희석을 결정 합니다. 최상의 신호 대 배경 비 초과에서 2 차 항 체 농도 선택 합니다.- 염소-마우스 IgG HRP 항 체 (이차 항 체)를 활용 (30 ml 희석제 대상 1:4000 희석에 대 한 항 체의 이차 항 체의예: 추가 7.5 µ L)에 항 체 희석제에 대상의 농도에 희석.
- 3 회 300 µ L 워시 버퍼와 접시 세척. 각 잘을 100 µ L 희석된 이차 항 체를 추가 합니다. 1 시간에 대 한 실 온에서 품 어.
-
기판 추가 및 판 읽기
- 5 회와 300 µ L 워시 버퍼 보풀 지우기에 꼭지 격판덮개를 세척.
- 각 우물에 갓된 기판의 100 µ L을 추가 하 고 색상 개발 포화 될 때까지 실 온과 세포 제어 우물의 광학 밀도 (OD)에서 품 어 < 0.2.
- 모든 우물을 정지 솔루션의 100 µ L를 추가 합니다. 490에서 우물의 OD 읽기 nm microplate 분 광 광도 계를 사용 하 여.
-
1 차적인 항 체 추가
-
셀의 고정
- TCID 50 계산
- 셀 컨트롤 (열 12)의 메디아 OD490 을 계산 합니다.
- OD490 와 잘 테스트를 두 번 중간 "긍정적인";로 CC 우물의 OD490 보다 큰 고려 그렇지 않으면, 그것은 "부정적인" 간주 됩니다.
- 13의 리드 Muench 메서드 사용 하 여 바이러스의 TCID50 을 계산 합니다.
- 확실성 그리고 네거티브 각 희석에의 수를 결정 합니다.
- "누적 긍정", "누적 부정적인", "비율", 그리고 "긍정적인"으로 % 표 1에 나와 있는 계산 합니다.
- 희석 보여주는 사이 "비례 거리" 계산 > 50% 확실성 및 희석 표시 < 50% 긍정 다음을 사용 하 여:
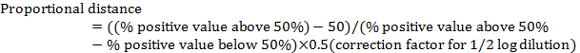
참고: ½ 로그 희석에 대 한 수정 계수는 0.5. 예를 들어 표 1에: (80 − 50) /(80 − 20) x 0.5 = 0.25 - > 50% 긍정적인 보여주는 희석에 비례 거리를 추가 하 여 바이러스 TCID50 을 계산 합니다.
참고: 예를 들어 표 2, TCID50 는 10-5+(-0.25) 10-5.25=. 이것은 100 µ L (또는 10-5.25/100 µ L) 바이러스의 TCID50 note.
- 바이러스 희석을 계산 합니다. MN 분석 실험, 대 한 바이러스 200 TCID50/100 µ L (잘 당 100 TCID50/50 µ L에 해당)를 희석.
주: 표 1에서 예제 1 TCID50 100 µ L에 10-5.25 이며 200 TCID50/100 µ L를 달성 하기 위해 희석 1:891 계산에 따라: 200 x 10-5.25 10-2.95 = 1/102.95 = = 1 / 891
5. 미네소타 분석 결과 MDCK SIAT1 셀을 사용 하 여
-
주 1: 테스트 및 제어 세라 준비와 접시 레이아웃
- 37 ° C 물 목욕에서 세라를 녹여 고 녹고 후 즉시 제거 합니다. 약 테스트; 하는 세라의 금액 수 원래 세라의 10 µ L의 최소 일 중에 하나의 바이러스 테스트 필요 합니다. 중복에서 세라를 가능 하면 테스트.
- 열 비활성화 단계 1.12.1 에서처럼 56 ° C 물 욕조에 30 분에 대 한 인간의 세라. 얼음에 장소 세라 열 비활성화, 1시 10분을 달성 하는 세라를 바이러스 희석제를 추가 사전 희석.
- RDE 취급 하 고 미리 동물 세라 1.12.2 당 컨트롤 사용 하 여 1:10 희석.
참고: 해 동된 대우 인간과 동물 세라 이상 24 h. 보다 세라 저장 되어야 한다-20 ° C에서 냉동 또는 추운 경우 더 이상 저장 기간 분석 결과 이전 필요 4 ° C에 저장할 수 없습니다. - 한 바이러스를 테스트 하려면 추가 100 µ L 1시 10분 희석 A10 a 1 열을 세라 (그림 4). 행 B 열 11 및 12 (그림 4)를 제외 하 고 H 통해 바이러스 희석제의 50 µ L를 추가 합니다. 2-fold 직렬 희석 행 A H을 통해 수행 하 고 삭제는 마지막 50 µ L 행 H (그림 4).
참고: 지금까지 여러 바이러스 테스트할 때에 세라 titer 튜브에 희석 수 있습니다. 혈 청 희석 잘 a에서 혈 청 titer를 결정의 목적에 대 한 1:10, 잘 B 1시 20분, C 1:40, 잘 D 1:80 E 1:160 잘 잘, 잘 F 1:320, G 1:640 잘 잘 H 1:1,280 (그림 4). - 바이러스 컨트롤 추가 바이러스 희석제의 50 µ L 웰 스 A12, B12, C12, 그리고 D12 (세라). 셀 컨트롤 추가 바이러스 희석제의 100 µ L 우물 E12, F12, G12, 및 H12 (아니 바이러스, 아니 세라).
- 제어 세라 (예를 들어 흰 족제비 세라 컨트롤)에 대 한 잘 열 11를 하 고 바이러스 희석제의 50 µ L 우물 B11-H11 희석된 제어 세라의 100 µ L를 추가 합니다. 시리얼 다운 희석입니다.
- 커버 플레이트, 37 ° c, 5% CO2 바이러스 추가 대 한 준비까지 품 어.
-
제 1 일: 바이러스 추가
- 희석제 바이러스 바이러스 100 TCID50/50 µ L 희석.
- 다시 적정 (BT) 접시에 모든 플레이트 (그림 4)에 셀 제어 우물 E12, F12, G12, 및 H12 11 열 제외한 모든 우물에 50 µ L 희석된 바이러스를 추가 합니다. 열 11에서 제어 세라와 그 번호판에 대 한 열 11에 바이러스를 추가 합니다.
- 다시 적정 (BT)
- (예를 들어 접시 1A 및 1B) 중복 격판덮개의 1 세트의 열 11에에서는 BT를 포함 합니다. 11 열에 있는 모든 우물에 바이러스 희석제의 50 µ L를 추가 합니다. 첫 번째 우물 (A11)를 100 TCID50/50 µ L에서 바이러스의 50 µ L를 추가 합니다. 아래로 pipetting으로 혼합.
- 혼합 하 고 50 µ L 2-fold 직렬 희석을 수행 하기 위해 연속 웰 스 전송. 피 펫 팁을 피하기 위해 바이러스 월 우물 사이 변경 합니다. 잘 H11에서 50 µ L를 삭제 합니다.
- 바이러스 열 100 µ L. 최종 볼륨을가지고 11 희석제의 50 µ L를 섞어 판 탭을 추가 합니다.
- 37 ° C, 5% CO2 1 h에서 접시를 품 어.
- 하루에 1 MDCK-SIAT1 셀 추가 및 ELISA 하루에 2 단계 4.2 및 4.3 (또한 5.3 및 5.4에 설명 된)에 설명 된 대로 수행
-
제 1 일: MDCK SIAT1 셀 추가
- 4.2 단계에서 설명한 대로 MDCK SIAT1 셀을 준비 합니다. 각 잘 (104 셀/잘 x 1.5)를 1.5 x 105 셀/mL에서 100 µ L MDCK SIAT1 셀을 추가 합니다. 37 ° C, 5% CO2 18-20 h에서 번호판을 품 어.
-
제 2 일: 애 란
- 4.3 단계에서 설명한 대로 두 번째 날, 하룻밤 부 화 후 80% 찬 아세톤과 셀을 수정.
-
1 차적인 항 체 추가
- 3 회 300 µ L 워시 버퍼와 접시 세척. 적정 항 체 희석 액에 의해 결정으로 최적 농도를 항 인플루엔자 A NP 단일 클론 항 체 (1 차적인 항 체)를 희석 (예: 추가 30 µ L 1 차적인 항 체의 항 체 1:1000의 대상 희석에 대 한 희석제의 30 mL).
참고: 기본 항 체의 100 µ L가 잘 당 필요 합니다. ~ 10 mL 접시 당 필요 하다. - 각 잘을 100 µ L 희석된 1 차적인 항 체를 추가 합니다. 1 시간에 대 한 실 온에서 품 어.
- 3 회 300 µ L 워시 버퍼와 접시 세척. 적정 항 체 희석 액에 의해 결정으로 최적 농도를 항 인플루엔자 A NP 단일 클론 항 체 (1 차적인 항 체)를 희석 (예: 추가 30 µ L 1 차적인 항 체의 항 체 1:1000의 대상 희석에 대 한 희석제의 30 mL).
-
이차 항 체 추가
- 세척 접시 3 번 300 µ L 워시 버퍼. 염소를 희석 안티 마우스 IgG 항 체 희석 액 (예: 추가 7.5 µ L의 이차 항 체 항 체 대상 1:4000에 대 한 희석제의 30 ml.)에서 대상 농도에 HRP 항 체 (이차 항 체)를 활용
참고: 이차 항 체의 100 µ L가 필요 당 96 잘 합니다. ~ 10 mL 접시 당 필요 하다. - 각 잘을 100 µ L 희석된 이차 항 체를 추가 합니다. 1 시간에 대 한 실 온에서 품 어.
- 세척 접시 3 번 300 µ L 워시 버퍼. 염소를 희석 안티 마우스 IgG 항 체 희석 액 (예: 추가 7.5 µ L의 이차 항 체 항 체 대상 1:4000에 대 한 희석제의 30 ml.)에서 대상 농도에 HRP 항 체 (이차 항 체)를 활용
-
기판 추가 및 판 읽기
- 5 번와 300 µ L 워시 버퍼 지우기 보풀에 꼭지 격판덮개를 세척 하십시오.
- 각 우물에 갓된 기판의 100 µ L을 추가 하 고 바이러스 컨트롤 우물 OD490 에 도달할 때까지 실 온에서 품 어 = 0.8-3, 낮은 셀 컨트롤과 배경 OD490 < 0.2.
- 모든 우물을 정지 솔루션의 100 µ L를 추가 합니다. 490에서 우물의 OD 읽기 nm microplate 분 광 광도 계를 사용 하 여.
-
데이터 분석
참고: 미네소타 계산 결정 됩니다 각 접시에 대 한 개별적으로.- 각 혈 청 샘플의 중화 항 체 titer를 결정 합니다.
- 다음 수식을 사용 하 여 각 접시에 대 한 50% 바이러스 중립화의 OD490 컷 계산:
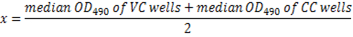
참고: 여기 x = 중화 컷오프의 50%. OD490 으로 높은 희석에 해당 상호 혈 청 희석 컷오프 (50% 억제)의 50% 미만 그 혈 청 샘플 (그림 5)에 대 한 중화 항 체 titer를 간주 됩니다.
- 다음 수식을 사용 하 여 각 접시에 대 한 50% 바이러스 중립화의 OD490 컷 계산:
- 셀 컨트롤 우물 OD490 확인 < 0.2와 바이러스 컨트롤 웰 스는 OD490 = 0.8-3.
- 각 분석 결과 (100 x TCID50) BT의 바이러스 BT. 허용 가능한 범위에에서 바이러스 infectivity은 50, 100, 또는 200 TCID를 확인 합니다. 4.4.2 단계에서 정의 된 동일한 커트 오프를 사용 하 여, 경우는 커트 오프의 위 세는 BT 열에 높은 바이러스 희석 우물 E11, F11, G11에에서 있어야 합니다.
주: 혈 청 긍정적인 컨트롤 줘야 내 titers 2-fold 이전 테스트에서 얻은 값의. OD490 부정적인 혈 청 컨트롤의 유사한 바이러스 컨트롤에 대 한 관찰 해야 합니다.
- 각 혈 청 샘플의 중화 항 체 titer를 결정 합니다.
결과
바이러스 주식의 infectivity의 결정만 분석 결과 첫 번째 단계입니다. 그림 2 에서는 접시 레이아웃을 바이러스 주식의 TCID50 결정을 보여 줍니다. 알 수 없는 infectivity 바이러스 주식, 대 한 바이러스 바이러스의 infectivity 계산을 최고의 적정 곡선을 캡처하기 위해 여러 사전 희석, 예 10-2 와 10-3에서 적정 수 있습니다. MN 분석 결?...
토론
MN 분석 결과 인플루엔자 혈 청 학에 대 한 인플루엔자 감염이 나 예방 접종을 다음과 같은 항 체 응답을 검색 하는 데 사용 하는 주요 분석 실험 중 하나입니다. 많은 인플루엔자 seroepidemiology 연구의 주요 결과 titers MN 분석 실험에서 생성 된 자주 사용 됩니다. MN 분석 sero 진단 및 백신 immunogenicity의 평가 또한 널리 사용 됩니다. 국제 간 연구소 연구14여러 실험실 수행 하는 미네소?...
공개
저자는 충돌의 관심을 보고. 결과 및 결론을이 책에서 저자는 고 반드시 센터의 질병 통제 및 예방 및 자금 지원 기관에 대 한 대표 하지 않습니다.
감사의 말
우리이 원고 준비 박사 Xiuhua Lu, 박사 펭 류, 및 그들의 중요 한 검토 및 지원에 대 한 질병 통제 센터의 독감 부문에서 양 애슐리 버로우즈 감사합니다. 우리는 그림 3의 그래픽을 준비 하 고 그의 도움에 대 한 질병 통제 센터의 독감 부문에서 박사 아드리안 Reber 감사. 마지막으로, 우리는 박사 M. Matrosovich, Marburg, 독일 MDCK SIAT1 세포를 제공 하기 위한 감사 합니다.
자료
| Name | Company | Catalog Number | Comments |
| Dulbecco’s Modified Eagle Medium (DMEM) with high Glucose | Life Science | 11965 | A critical component of Sterile Cell Culture, Virus Propagation and Virus Diluent Media |
| Fetal bovine serum (FBS) | Hyclone | SH30070.03 | |
| Bovine Serum Albumin (BSA) Fraction V, Protase Free | Sigma-Aldrich | 3117332001 | |
| L-Glutamine | Life Science | 25030-081 | |
| Sodium pyruvate | Life Science | 11360-070 | |
| Geneticin G-418 disulfate salt | Sigma-Aldrich | A1720-5G | |
| HEPES | Life Science | 15630-080 | |
| Penicillin/Streptomycin | Life Science | 15140-122 | |
| Acetone | VWR | 67-64-1 | Used at an 80% concentration |
| Phosphate-Citrate Buffer with Sodium Perborate | Sigma-Aldrich | SLBF2806V | |
| O-Phenylenediamine Dihydrochloride tablet | Sigma-Aldrich | SLBQ1086V | 1 tablet per 100ml of cell culture grade water |
| Sulfuric Acid | Fisher Scientific | A510-P500 | Used 0.5M final concentration |
| Ethanol, Denatured, 4L | VWR | EM-AX0422-3 | Used at an 70% concentration |
| Trypsin-EDTA | Life Science | 1748048 | |
| RDE II "Seiken" | Denka Seiken | 370013 | |
| Tween 20 | Sigma-Aldrich | P1379-500ml | |
| Anti-NP mouse monoclonal Ab | Millipore pool | MAB 8257 MAB 8258 | |
| Anti-mouse IgG HRP | KPL | 074-1802 | |
| 96-well flat-bottom plates | Thermo Scientific | 3455 | |
| Plate reader | Molecular Device | Spectromax 384 plus | |
| Cell Culture Flask 162 cm2/Vent Cap | Corning/VWR | 3151 |
참고문헌
- Reber, A., Katz, J. Immunological assessment of influenza vaccines and immune correlates of protection. Expert Rev of Vaccines. 12, 519-536 (2013).
- Li, C. K., Rappuoli, R., Xu, X. N. Correlates of protection against influenza infection in humans--on the path to a universal vaccine?. Curr Opin in Immunol. 25, 470-476 (2013).
- WHO Global Influenza Surveillance Network. . Manual for the labratory diagnosis and virological surveillence of influenza. , (2011).
- Govorkova, E. A., Kodihalli, S., Alymova, I. V., Fanget, B., Webster, R. G. Growth and immunogenicity of influenza viruses cultivated in Vero or MDCK cells and in embryonated chicken eggs. Dev Biological Stand. 98, 39-51 (1999).
- Levine, M. Z., et al. Neutralizing Antibody Responses to Antigenically Drifted Influenza A(H3N2) Viruses among Children and Adolescents following 2014-2015 Inactivated and Live Attenuated Influenza Vaccination. Clin Vaccine Immunol : CVI. 23, 831-839 (2016).
- Lin, Y., et al. The characteristics and antigenic properties of recently emerged subclade 3C.3a and 3C.2a human influenza A(H3N2) viruses passaged in MDCK cells. Influenza Other Respir Viruses. , (2017).
- Lin, Y. P., et al. Neuraminidase receptor binding variants of human influenza A(H3N2) viruses resulting from substitution of aspartic acid 151 in the catalytic site: a role in virus attachment?. J of Virol. 84, 6769-6781 (2010).
- Skowronski, D. M., et al. Mutations acquired during cell culture isolation may affect antigenic characterisation of influenza A(H3N2) clade 3C.2a viruses. Euro Surveillance. 21, 30112 (2016).
- Matrosovich, M., Matrosovich, T., Carr, J., Roberts, N. A., Klenk, H. D. Overexpression of the alpha-2,6-sialyltransferase in MDCK cells increases influenza virus sensitivity to neuraminidase inhibitors. J of Virol. 77, 8418-8425 (2003).
- Oh, D. Y., Barr, I. G., Mosse, J. A., Laurie, K. L. MDCK-SIAT1 cells show improved isolation rates for recent human influenza viruses compared to conventional MDCK cells. J Clin Microbiol. 46, 2189-2194 (2008).
- US Department of Health and Human Services. . Biosafety in Microbiological and Biomedical Laboratories. , (2009).
- Reed, H. M. A simple method of estimating fifty percent endpoints. The American Journal of Hygiene. 27, (1938).
- Laurie, K. L., et al. International Laboratory Comparison of Influenza Microneutralization Assays for A(H1N1)pdm09, A(H3N2), and A(H5N1) Influenza Viruses by CONSISE. Clinical Vaccine Immunol : CVI. 22, 957-964 (2015).
- Lin, Y., Gu, Y., McCauley, J. W. Optimization of a Quantitative Micro-neutralization Assay. J Vis Exp : JoVE. , (2016).
- van Baalen, C. A., et al. ViroSpot microneutralization assay for antigenic characterization of human influenza viruses. Vaccine. 35, 46-52 (2017).
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유