Method Article
バイオセンサーベースの高スループットバイオパンニングおよびバイオインフォマティクス分析戦略による、薬物-タンパク質相互作用のグローバル検証
要約
本研究は、薬物とペプチドの相互作用を同定するための戦略を提示することを目的とした。この戦略は、水晶結晶マイクロバランス(QCM)バイオセンサーに基づく薬物認識短いペプチドのバイオパンニングを含み、続いてタンパク質上の薬物認識および薬物結合部位の注釈のために得られた情報を定量的に評価するためのバイオインフォマティクス分析を行う。
要約
受容体と酵素タンパク質は、生体活性低分子の結合標的として作用する重要な生体分子です。したがって、薬物とタンパク質相互作用の迅速かつグローバルな検証は、治療効果の根底にある分子メカニズムを理解するだけでなく、臨床用の吸着、分布、代謝、排泄、毒性(ADMET)などの薬物特性を評価するためにも非常に望ましい。ここでは、ファージキャプシド上に容易に表示できるT7ファージ表示短いペプチドのバイオパニングに対するバイオセンサーベースの高スループット戦略を提示する。その後の、短いセグメントを含むペプチドのアミノ酸配列の解析は、「壊れた遺物」として、受容体リガンド接触(RELIC)群におけるバイオインフォマティクスプログラムを用いた薬物結合部位の、また示されている。この方法を、抗腫瘍イリノテカンと抗インフルエンザオセルタミビルの2つの臨床的に承認された薬物に適用することにより、薬物認識ペプチド配列を収集し、標的タンパク質の薬物結合部位を強調するための詳細なプロセスを本論文で説明する。本明細書に記載されている戦略は、関心のある任意の小分子に適用することができる。
概要
薬物結合標的の同定は、疾患の分子メカニズムを理解する上で、薬物の開発に不可欠である。特に、受容体および酵素タンパク質は、生体活性小分子1の最も重要な分子標的である。アフィニティーキャプチャは、薬物結合タンパク質2を同定するための十分に確立された技術であるが、タンパク質の低溶解性などの技術的な制限は、しばしば薬物標的2の検証を妨げる。最も重要なことは、固定化された小分子は、ドッキングに必要な自由度を失い、より大きな標的タンパク質上の内部に位置する結合部位にアクセスできないことである。さらに、タンパク質のミスフォールディング、共結晶化条件の解析不能、分子サイズによる制限が、しばしばX線結晶学の使用を妨げる、核磁気共鳴(NMR)、および薬物タンパク質相互作用を研究するための実験分析を妨げる。
T7ファージディスプレイバイオパンニングの使用は、小分子餌3のタンパク質上の結合部位を決定するための効率的な方法である。特に、合成DNAをマルチクローニング部位に挿入して構築できるT7ファージ表示ランダムペプチドライブラリーが有効である。T7ファージライブラリー表示タンパク質と比較して、短いペプチドは、物理的な制限なしにT7ファージキャプシドに表示されるように容易に設計することができ、固体支持体2上に固定された任意の低分子薬物との滅体的接触が可能である。さらに、T7ファージディスプレイバイオパニングプラットフォームへの水晶結晶マイクロバランス(QCM)バイオセンサの導入により、QCM周波数4,5の減少をモニタリングすることにより、短いペプチドと薬物の弱い特異的な相互作用を同定することができる。結合したT7ファージは、次いで宿主の大腸菌(BLT5615)に感染して直接回収され、アフィニティー選択ペプチドをコードする領域のDNA配列は薬物認識短いセグメントを含む。ペプチド集団のアミノ酸配列のその後の分析は、薬物認識に関する情報を提供する。救出されたアミノ酸配列のインシリコ対アライメントでは、選択したプロテオーム内の薬物の生物学的標的に関する情報を得るために使用することができる。この高スループットの薬物に対する親和性を有するタンパク質断片の同定は、陶器シャード6から古代のアーティファクトを再構築することと同様の方法で薬物結合部位をヒューリスティックに再構築するために使用することができる。特に、このユニークなアプローチは、従来のプロテオミクスアプローチが失敗したときに役立ちます。
ここでは、小分子の標的検証のためのT7ファージ表示ペプチドのバイオパニングおよびバイオインフォマティクス解析のためのバイオセンサーベースの戦略を提示する。従来の方法の技術的な制限を超えて、この戦略は、同一のプロトコルの下で関心のある任意の小分子の標的タンパク質上の薬物結合部位の同定を可能にする。
プロトコル
注:以下は、QCMバイオセンサーを使用して薬物認識T7ファージをスクリーニングし、大腸菌(BLT5615)感染を介してスクリーニングされたファージを回復するためのステップです。自己集合単層(SAM)を形成する小分子の誘導体の合成およびT7ファージ表示15-merランダムペプチドライブラリの構築のためのプロトコルは、他の6,7を見つけることができます。
1. QCMセンサーチップの準備
- 27MHz QCM装置の発振器にセラミックセンサーチップを取り付け、小分子固定化前に空気相の固有周波数(Hz)を記録します。
- チップを取り外し、ピペットを使用してセンサーチップの金電極にSAMを形成する低分子誘導体の溶液(70%エタノールで1 mM)の20μLを取り外します。
注意: 金電極(Au、厚さ0.1mm、2.5mm i.d.、4.9 mm2)が位置するセンサーチップクリスタルは非常に薄く、割れやすい(SiO 2、0.06 mm厚、9mm i.d.)したがって、慎重にピペット。 - 湿らせたティッシュと部屋のライトから保護されたペトリ皿の室温(約20°C)で1時間放置します。
- 超純水で電極表面をやさしく洗います。次に、注射器またはエアダスターで空気を吹き飛ばして、水滴を除去します。
- QCM装置用センサーチップを設置し、空気相の周波数の減少を記録して、固定化された小分子の量を測定します。
注:少なくとも、100 Hzの固有周波数は、小分子固定化(1 Hz固定化30 pg)に必要です。
QCMバイオセンサーを用いたT7ファージライブラリのバイオパニング(図1)
- QCMバイオセンサーに専用の磁気スターラーを備えたキュベットをセットし、8 mLの反応バッファー(10 mM Tris-HCl、200 mM NaCl、pH 7-8)をキュベットに注ぎます。
- QCMセンサーチップをオシレーターに取り付け、オシレーターのアームを引き下げて、1000 rpmで攪拌されるバッファにチップを浸します。
- パーソナル コンピュータ (PC) で QCM 周波数の監視を開始し、センサーグラムが周波数ドリフトの約 3 Hz/分に平衡するまで待ちます。
- T7ファージライブラリ(1-2×10 10 pfu/mL)をキュベットに8μL注入し(最終濃度:1~1 ×07 pfu/mL)、センサーの射出点をマークします。
- 金電極表面に固定化された小分子へのT7ファージの結合によって生じる周波数低減を10分間監視します。
- QCM周波数モニタを停止し、センサーチップを発振器から外し、空気を吹き飛ばしたり、ワイプで拭き取ったりしてバッファを取り外します。
- センサーチップを湿ったペトリ皿に入れ、 大腸菌 (BLT5615)の懸濁液の20μL(IPTGを1mMに加えて37°Cで揺れた後、OD600 = 0.5-1.0)を金電極に取り付けます。
- 皿の蓋を閉め、アルミニウム箔で覆って光を遮断します。
- 96ウェルマイクロプレートミキサー(1000-1500 rpm)で37°Cで30分間インキュベートし、結合したT7ファージの回収を強化します。
- 溶液の20μLを回収し、200μLのLB培地に一時停止します。
注:このステップで得られたサンプルは、4°Cで1週間保存することができます。 - メーカーの指示8,9に記載された一般的な手順に従ってプラーク分離および DNA シーケンシング用のファージ溶液の希釈シリーズを準備します。
- 1%ドデシル硫酸ナトリウム溶液を浸した綿棒で金電極表面を拭きます。
- 洗浄ボトルから超純水で金の表面を洗い、その後、注射器やエアダスターで空気を吹くことによって水滴を除去します。
- 5 μLのピラニア溶液(コンク.H2SO4:30%H2O2 = 3:1)を金面に落とし、5分間放置します。
- 金の表面を水で洗い、空気を吹き飛ばしたり、拭き取ったりして乾かします。
- 手順 2.14 と 2.15 を繰り返します。
注意:使用する直前にピラニア溶液を準備してください。それは非常に強い酸であるため、慎重に、この液体を使用してください。5分以上の治療はセンサーチップを侵食する。
3. 受容体リガンドコンタクト(RELIC)プログラムスイート(図2)10,11を用いたバイオインフォマティクス解析
- MS Windows オペレーティング システムを搭載した PC 上でスタンドアロン RELIC プログラムを解凍します。
- 各テキストフォーマットファイル(name.txtで、薬物を使用してアフィニティー選択した15-merペプチドのアミノ酸配列を整列させるか、または未スクリーンの親ライブラリーから無作為に選択した。
- FASTA形式の各テキストファイルに、単一または複数のタンパク質のアミノ酸配列を入力するか、任意のタンパク質データベース(例えば、UniProt(http://www.uniprot.org/)またはドラッグバンク(https://www.drugbank.ca/)からFASTA形式でデータベーステキストファイルをダウンロードします。
- 各 RELIC プログラムを実行するために必要なフォルダーにテキスト ファイル (および HETEROalign 用 PDB ファイル) を配置します。
- 独立したフォルダで、AADIV、INFO、MOTIF、マッチ、ヘテロアライン、FASTAcon、および FASTAskan の実行可能ファイル (プログラム.exe) をクリックして、FTN95 のパーソナル バージョンを開きます。
- 各プログラムを実行し、必要なテキストフォーマットファイルを取得するには、コマンドメッセージに、適切なファイル名と拡張子(name.txt)を入力します。
- 結果のテキスト ファイルをスプレッドシート ソフトウェア (Excel など) にエクスポートして、BLOSUM62 (MATCH、HETEROalign) を使用して計算された情報コンテンツ (INFO) または累積類似性スコアのプロットを生成します。
注: 元の RELIC サーバー (http://relic.bio.anl.gov) は使用できなくなり、Windows プラットフォームを搭載した PC で動作するスタンドアロン型の RELIC プログラムの一部は、対応する作成者 (tkksg@rs.noda.tus.ac.jp) から入手できます。
結果
臨床的に承認された2つの薬剤の代表的な結果を図3に示す。イリノテカン(図3A)は、進行性大腸癌および非小細胞肺癌の治療に用いられる天然カンクトテシンの水溶性プロドラッグであり、肝臓においてSN-38に変換され、癌細胞12においてトポイソメラーゼIを阻害する。さらに、この化合物は、アセチルコリンエステラーゼ(AChE)13,14を直接阻害する。この戦略を通じて、IRIをSAMとして固定化したことを認めた29個のペプチドをQCMバイオセンサーベースの1サイクルバイオパニングサブセットによって同定した。29個のペプチドとAChEのその後のペアアライメントは、Y121、Q225、F290、E327、H440、およびY442の最大スコアを生み出し、その部分を立体構造で強調した。これらのアミノ酸残基は、AChEのIri結合部位を構成するものと一致した。同じサブセットのペプチドは、E99、L100、L252、L305、I387、およびV474をカルボキシレステラーゼ(CE)の触媒トライアド(S221、E353、およびH467)付近で同定し、これらのアミノ酸がイリエステル化時に認識するための足場を形成することを示す。このような触媒部位のアミノ酸残基は、従来のX線結晶学またはNMR分析を用いて直接同定することはできず、酵素反応が円滑に進行し、一般的な実験条件下で静的複合体を安定的に形成しない。したがって、複数のタンパク質の薬物結合部位の組み合わせ検出は、特定の薬物に対する代謝反応の間に酵素で形成される可能性のある中間複合体を含む、1つの薬物について決定される親和性選択ペプチドを用いることができる。
図3B は、オセルタミビル(オセル)に対して得られた他の結果を示し、オセルタミビルカルボキシレートに活性化される抗インフルエンザ薬であり、これはインフルエンザウイルス16のノイラミニダーゼ(NA)を阻害する。QCMセンサーチップ金電極表面を覆うオセルを認識した27個のペプチドは、NA16におけるオセル結合部位を正常に検出した。この結合部位は、オセルとのドッキング中に動的な動きを起こす可能性のある非構造化ペプチドループで構成されています。T7ファージキャプシドのオセル認識ペプチドは、QCMセンサーチップの金電極表面に固定されたオセルに結合する際に、この動的ドッキングを模倣する可能性があります。神経精神障害有害事象(NPAE)は、インフルエンザの若い患者で同定されており、患者への影響は薬物ではなく疾患自体に関連している可能性がある。研究は、オセルが積極的に血液脳関門(BBB)17中の多剤耐性(MDR)タンパク質を介してげっ歯類の中枢神経系(CNS)からエクスポートされることを実証しました。実際、このMDRのクラスのタンパク質の1つは、他のトランスポーター、神経伝達物質関連酵素および受容体に加えて、高いスコア(DrugBank 1.0タンパク質データベース18の4,396のうち上位5%)を示した。オセルの副作用の出現に関するこれらのタンパク質の薬理学的意義が調査されている。
これまでに、標的タンパク質上の単一および複数の小分子結合部位が、我々の戦略を用いて6つの低分子薬物について同定に成功している(図4)。Brz2001およびロキシスロマイシン(RXM)について、標的タンパク質上の同一の薬物結合部位は、ペプチドの異なるプールを用いて同定された、その数およびアミノ酸配列は、完全に7、19に変化した。さらに、Iri、RXM、オセルに対して得られた単一のペプチドプールは、イリ(図3A)のAChEおよびCE(図3A)20、アンジオモチンおよびCYP3A4(RXM19、21、およびオセルのNAおよびMDR関連タンパク質)など、各薬物の異なるタンパク質上の複数の結合部位を同定することにつながった。抗腫瘍化合物ドキソルビシン(FANCF)22について未知の分子標的を同定し、抗血管新生マクロライド系抗生物質RXM(アンジオモチン)19とを挙げることができる。
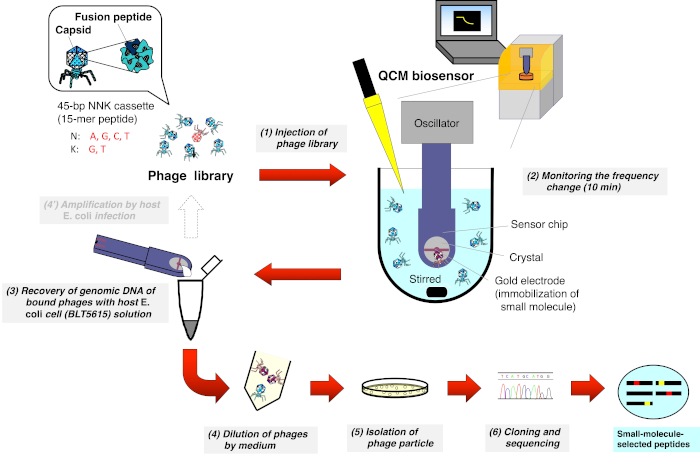
図1:T7ファージ表示ペプチドライブラリーのQCMバイオセンサーベースのバイオパニングの模式図ランダムなペプチドを表示するT7ファージライブラリは、QCMバイオセンサーチップが浸漬され、周波数が安定するバッファ(攪拌下)を含むキュベットに注入されます。センサーチップの金電極表面に固定化された小分子へのT7ファージの結合による周波数低減をモニタリングした後、センサーチップが発振器から切り離される。結合したT7ファージからのDNAは、宿主大腸菌(BLT5615)感染後に直接回収される。得られたT7ファージは、プラーク形成を介して単離され、最後に、T7ファージカプシドに表示される薬物親和性選択ペプチドのアミノ酸配列は、一般的なファージ表示法に従って決定される。この図の大きなバージョンを表示するには、ここをクリックしてください。
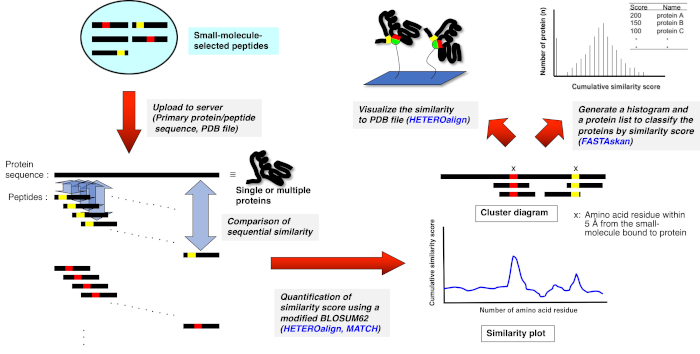
図2: 薬物選択ペプチドと単一または複数のタンパク質との間の配列比較の定量的評価の概略的表現.薬物選択ペプチド配列は、それぞれ単一および複数のタンパク質の一次アミノ酸配列と整列し、各3—5アミノ酸セットの類似性は、改変されたBLOSUM62行列に従ってペアワイズアライメントを介して累積スコア付けされる。得られたプロットまたは図は、タンパク質上の潜在的な薬物結合部位を構成する残基または部分を示す。適切なRELICプログラムを使用したさらなる分析は、3次元構造上の結合部位を強調するか(PDBファイルが利用可能な場合)、または結合ターゲットである可能性のあるタンパク質全体をランク付けする(HETEROalignプログラムは現在利用できません)。 この図の大きなバージョンを表示するには、ここをクリックしてください。
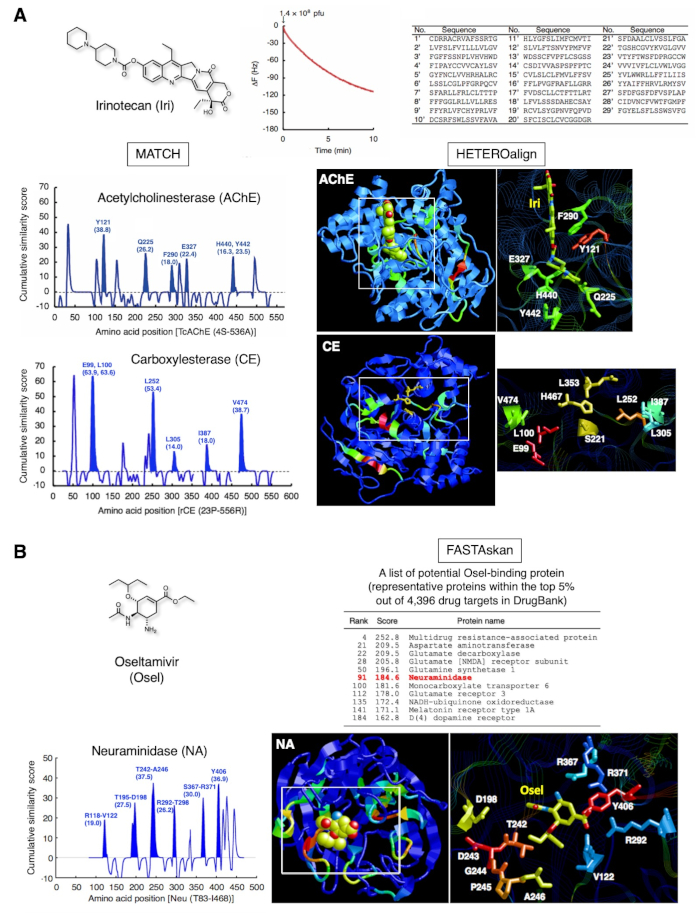
図3:ペプチドの収集とその後のバイオインフォマティクス分析の代表的な結果(A)イリノテカン(抗腫瘍プロドラッグ、トポイソメラーゼI阻害剤)。T7ファージ相互作用は、QCM周波数の減少として10分間監視した。結合したT7ファージのDNAを回収し、配列決定して、対応するアミノ酸配列を決定した。29個の15-merペプチドのアミノ酸配列を、1サイクルバイオパンニングのサブセットを用いて採取し、AChEのIri結合部位を構成するアミノ酸を強調した[PDB ID 1U65]。同じ29個のペプチドを用いたさらなる評価は、CEにおける触媒トライアドの隣接するアミノ酸残基(脱エステル化のための足場残基)を強調し、IriをSN-38(活性形態)に変換する肝酵素である[PDB ID:1K4Y]。未スクリーン親ライブラリー7から無作為に選ばれた103個のペプチドの類似性スコアは、ライブラリーバイアスを除去するためにこれらのスコアから減算されている。これらのフィギュアはエルゼビアの許可を得てRef.20から再現されています。(B)オセルタミビル(抗インフルエンザ薬)。オセル認識アミノ酸を含む27個のペプチドは、ノイラミニダーゼ(NA)(ウイルス酵素)のオセル結合部位の障害部分を強調した[PDB ID:2HT7]。DrugBank 1.018における27個のペプチドと4,396タンパク質の間の配列類似性のグローバル検証は、NAが中枢神経系の機能に関連する宿主ヒトタンパク質に加えて、トップ5%の範囲内にあるように明らかにした。この図の大きなバージョンを表示するには、ここをクリックしてください。
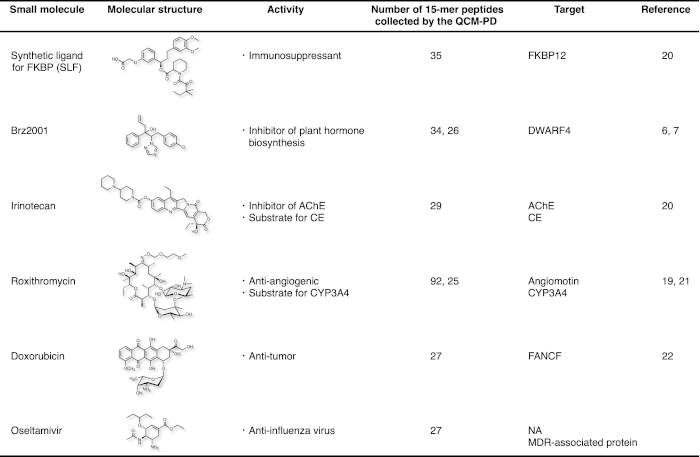
図4: この戦略を用いて同定された小分子の結合標的の概要.この図の大きなバージョンを表示するには、ここをクリックしてください。
ディスカッション
ここでは、薬物認識ペプチドのQCMバイオセンサーベースバイオパンニングの戦略、続いて、同定されたペプチドを用いた薬物とタンパク質相互作用を検証するためのバイオインフォマティクス分析が提示されている。バイオセンサの金電極上で固定化するための小分子誘導体の設計は重要なステップであり、導入リンカーとしては薬物を認識するペプチドの結合および収集を妨げる可能性がある。これを避けるために、導入されたリンカーの異なる位置を持つ誘導体は23.あるいは、疎水性の小分子を固定化するために、センサチップを10cmのペトリ皿にバルク水に浸漬し、低分子の20μL溶液(ジメチルスルホキシド中の10mM溶液)をバイオセンサの金極に落とし、その表面を覆い、5分間インキュベートする。これは、バイオパンニング中に少なくとも10分間保持される小分子のサブ百ヘルツ固有の周波数の保持を可能にする。実際、このような固定化を用いて、オセル親和性選択ペプチドはNAにおけるオセル結合部位を明確に強調した(図3)。
ここでペプチドライブラリーを調製するために使用されるT7ファージは、20個の標準アミノ酸の全てについて32コドンをコードし、2ストップコドン(UAA,UGA)の出現を抑制するNNK15カセットを用いて遺伝子操作され、UAG(図1)6、7のみを出現させる。これは、15-merの全長ペプチドを表示し、ライブラリの多様性を高めるには重要です。T7ファージディスプレイシステムは107-109 T7ファージの技術的な表示限界を有する。しかし、15-merペプチドライブラリーの多様性は理論的には20 15(3.27×1019)である。したがって、ライブラリの完全な構築には使用できません。それにもかかわらず、類似性検索または保存モチーフの採掘は、ライブラリー内のこの限られた多様性のペプチドであっても、タンパク質の薬物結合部位を含むアミノ酸の検出を可能にする。さらに、ライブラリーペプチド内での3—5アミノ酸ストレッチ(T7ファージディスプレイシステムを使用して実現できる1/203と1/205の間の出現率)は、小分子薬物の認識に関与している。したがって、標的タンパク質の薬物結合部位を構成する15-merアミノ酸配列を有するペプチド配列の100%一致は必要ない。実際、約30個のアフィニティー選択ペプチドが、試験した各薬剤に対する標的タンパク質の結合部位を強調した(図4)。これにより、使用される親T7ファージライブラリ(1.7×107 pfu/mL)の多様性を、薬物結合部位をヒューリスティックに再構成するために使用することができる。
典型的には、薬物認識アミノ酸ストレッチを含む15-merアミノ酸配列と同じ配列を示すT7ファージの3-5コピーが任意に単離された16プラーク内に出現し、我々のプロトコルの下で親和性選択の成功を示す。これは、18-30種類の薬物認識ペプチド配列が単離された96プラーク内で収集されることを示し(その数はマイクロプレート形式に関連付けられている)、DNAのシーケンシングを使用して後で同定され、対応するアミノ酸配列を得る。本戦略では、8 mLバッファーを含むキュベットへのT7ファージライブラリーの8μLの注入(ライブラリーの1000倍希釈)は、T7ファージの非特異的結合を低減するのに適している。アフィニティ選択ペプチドの多様性を高めるために、1サイクルの選択を数回繰り返し、スクリーニングごとに16または32プラークの単離を使用することは、一度に単一の溶液からの単一の単一の単一の単一の分離よりも効果的であることが判明した。例えば、約30種類の異なる配列の親和性選択ペプチドを効果的に収集するために、3-6組の1サイクル選択を行い、各実験で16または32のプラークを単離した。全16または32T7ファージのプラークの同一の配列の出現は、背景の偶発的な検出を示すか、または持ち越しとして汚染する可能性がある。対照的に、15-merの長さよりも短いペプチドを有する多くのT7ファージの同じ配列または出現を有するT7ファージの不在は、集団中のT7ファージが非特異的に高い確率で出現したことを示している。QCMの周波数低減は、このような場合でも同じ程度に起こるので、選択の成功は、単離されたT7ファージのDNAをシーケンシングすることによって包括的に評価されるべきであり、続いてペプチドのアミノ酸配列のバイオインフォマティクス分析を行う。さらに、従来のT7ファージ表示プロトコルとは異なり、繰り返し選択のラウンドは効果が低く、T7ファージの変動および数が小さく、増幅および選択ステップ23を繰り返した後も濃縮されない。
重要なことに、この方法は、ヒトのプロテオーム、病原性ウイルス、さらには植物のタンパク質中の低分子結合部位の採掘に適用可能である。興味深いことに、T7ファージキャプシド上のペプチドのおそらく非構造化短い表示長は、小分子とのドッキング中にタンパク質のペプチドの分子動力学を模倣することができます。これは、動的バインディング24を反映できます。従来の方法の技術的な制限を超えて、この戦略は、小分子のための同一のプロトコルに適用可能であり、薬物とタンパク質相互作用分析に関するより粒度を提供するだけでなく、薬物可能なプロテオームを拡大する可能性があります。
このアプローチの技術的な制限事項を考慮する必要があります。バイオセンサチップの金電極表面に低分子固定化を行う場合には有機合成が必要です。有機化学の非専門家のために、いくつかの固定化試薬は、機械的に結合によって小分子を固定するために市販されている。さらに、ペプチドの特定のナンセンス部分は、偽陽性として薬物ドッキングに関係しないタンパク質の一部の検出をもたらす可能性があります。これは、T7ファージのコピーが生成される場合、他の標準的なアミノ酸よりも多くのコドンによってコードされるロイシンまたはバリン残基が豊富なβシートまたはロイシンが豊富なドメインに経験的に対応する。ライブラリーペプチド長を制御すると、偽陽性の発生を制御する可能性があります。これに対し、X線結晶学やNMR解析を用いて実証されているように、ドッキングに関与する薬物結合部位のアミノ酸残基が検出されない場合がある。これは、より多くの薬物認識ペプチドを収集するか、または金電極上の小分子の固定方向を変更することによって解決することができる。
薬物使用の主な効果と二次的な効果に関連する多くの薬物とタンパク質の相互作用は、プロテオーム内で未確認である可能性があります。さらに、薬物吸収、分布、代謝、排泄、毒性を担う酵素およびトランスポーターも未確認である可能性があります。タンパク質結合は、薬物の生物活性に対して必ずしも責任を負わない。したがって、生物学的アッセイからの他の情報の組み合わせは、薬物の主および有害な影響を担う必須薬物標的の同定を改善する。この簡潔な技術のさらなる適応は、低分子薬物の広い範囲のタンパク結合部位の採掘のための実用性およびスループットを増加させる。本明細書に提示される方法は、関連分野における基礎研究を行うだけでなく、臨床使用における薬物の治療効果やその他の生物学的効果の根底にある分子メカニズムを明らかにすることに大きく貢献する。
開示事項
著者らは開示する利益相反を持っていません。
謝辞
著者は、オセルタミビルを提供してくれた林裕次郎博士と石川勇人博士、独立したRELICプログラムを提供してくれたイ・マコフスキ博士に感謝します。また、QCM実験の技術支援に関する川越哲也氏を認める。この作業は、JSPS KAKENHIグラント番号17K01363(Y.T.)によって部分的にサポートされました。
データ可用性ステートメント
本論文で用いられているプロテオームデータベースからのタンパク質配列と同様に、薬物に対するアフィニティー選択ペプチドの独立型RELICプログラムおよび配列データは、本著者から依頼(tkksg@rs.noda.tus.ac.jp)入手可能である。
資料
| Name | Company | Catalog Number | Comments |
| AFFINIXQN | ULVAC, Inc. (Tokyo, Japan) | QCM2008-STKIT | Contains Glass cuvette, stir magnet, operation and analysis software with a Windows PC |
| AADIV | Northeastern University (Lee Makowski) | AADIV.exe | Calculates the frequency of occurrence of each of the 20 amino acids at each recombinant insert position, as well as the overall position-independent frequency of each amino acid within that set of peptide sequences. Also roughly estimates the sequence diversity of a display library by statistical sampling method based upon sequences obtained from a limited number of randomly sampled members of the library. |
| Ceramic Sensor Chip | ULVAC, Inc. (Tokyo, Japan) | QCMST27C | 4 sensor chips/package |
| Dimethyl sulfoxide | Sigma-Aldrich (St. Louis, MO, USA) | D8418 | |
| Ethanol | Merck (Kenilworth, NJ, USA) | 09-0850 | |
| FASTAcon | Northeastern University (Lee Makowski) | FASTAcon.exe | Identifies proteins from a population with short consensus sequences. |
| FASTAskan | Northeastern University (Lee Makowski) | FASTAskan.exe | Lists proteins with high similarity to a peptide population. |
| Immiblization kit for AFFINIX | ULVAC, Inc. (Tokyo, Japan) | QCMIMKT | SAM reagent and amine coupling reagent |
| INFO | Northeastern University (Lee Makowski) | INFO.exe | Provides mathematical measure of the probability of observing a particular peptide sequence by random chance (i.e., nonspecific binding) as opposed to by selection for a specific property (affinity to small molecule). |
| Liquid LB medium | Sigma-Aldrich (St. Louis, MO, USA) | L3522 | Autoclave for 20 min |
| MATCH | Northeastern University (Lee Makowski) | MATCH.exe | Identifies any stretches of amino acid residues within a particular protein that exhibit significant similarity to a group of affinity-selected peptides. Outputs as cluster dia- gram and cumulative similarity plot calculated from a modified BLOSUM62 matrix with a short window (5–6 amino acids in length). |
| MOTIF1 | Northeastern University (Lee Makowski) | MOTIF1.exe | Searches for three continuous amino acid sequence motifs within a peptide population. |
| MOTIF2 | Northeastern University (Lee Makowski) | MOTIF2.exe | Searches for patterns of three amino acids and does not allow conservative amino acid substitutions, but does allow identical gap lengths. |
| NaCl | Merck (Kenilworth, NJ, USA) | S3014 | |
| Receptor ligand contacts (RELIC) | Argonne National Laboratory (Lemont, IL, USA) | https://www.relic.anl.gov | Currently unavailable (Stand-alone program can be used from correspondence author upon request) |
| Tris | Merck (Kenilworth, NJ, USA) | 252859 |
参考文献
- Santos, R., et al. A comprehensive map of molecular drug targets. Nature Reviews Drug Discovery. 16 (1), 19-34 (2017).
- Ziegler, S., Pries, V., Hedberg, C., Waldmann, H. Target identification for small bioactive molecules: finding the needle in the haystack. Angewandte Chemie International Edition (English). 52 (10), 2744-2792 (2013).
- Piggott, A. M., Karuso, P. Identifying the cellular targets of natural products using T7 phage display. Natural Product Reports. 33 (5), 626-636 (2016).
- Takakusagi, Y., Takakusagi, K., Sakaguchi, K., Sugawara, F. Phage display technology for target determination of small-molecule therapeutics: an update. Expert Opinion on Drug Discovery. 15 (10), 1199-1211 (2020).
- Takakusagi, Y., Takakusagi, K., Sugawara, F., Sakaguchi, K. Use of phage display technology for the determination of the targets for small-molecule therapeutics. Expert Opinion on Drug Discovery. 5 (4), 361-389 (2010).
- Takakusagi, Y., Takakusagi, K., Sugawara, F., Sakaguchi, K. Using the QCM Biosensor-Based T7 Phage Display Combined with Bioinformatics Analysis for Target Identification of Bioactive Small Molecule. Methods in Molecular Biology. 1795, 159-172 (2018).
- Takakusagi, Y., et al. Mapping a disordered portion of the Brz2001-binding site on a plant monooxygenase, DWARF4, using a quartz-crystal microbalance biosensor-based T7 phage display. ASSAY and Drug Devevelopment Technologies. 11 (3), 206-215 (2013).
- Novagen. T7 Select® System Manual. Novagen. , (2009).
- Novagen. OrientExpressTM cDNA Manual. Novagen. , (2009).
- Mandava, S., Makowski, L., Devarapalli, S., Uzubell, J., Rodi, D. J. RELIC--a bioinformatics server for combinatorial peptide analysis and identification of protein-ligand interaction sites. Proteomics. 4 (5), 1439-1460 (2004).
- Makowski, L., Petrenko, V. A., Smith, G. P. . Phage Nanobiotechnology. , 33-54 (2011).
- Garcia-Carbonero, R., Supko, J. G. Current perspectives on the clinical experience, pharmacology, and continued development of the camptothecins. Clinical Cancer Research. 8 (3), 641-661 (2002).
- Harel, M., et al. The crystal structure of the complex of the anticancer prodrug 7-ethyl-10-[4-(1-piperidino)-1-piperidino]-carbonyloxycamptothecin (CPT-11) with Torpedo californica acetylcholinesterase provides a molecular explanation for its cholinergic action. Molecular Pharmacology. 67 (6), 1874-1881 (2005).
- Dodds, H. M., Rivory, L. P. The mechanism for the inhibition of acetylcholinesterases by irinotecan (CPT-11). Molecular Pharmacology. 56 (6), 1346-1353 (1999).
- Bencharit, S., et al. Structural insights into CPT-11 activation by mammalian carboxylesterases. Nature Structural Biology. 9 (5), 337-342 (2002).
- Kim, C. U., et al. Influenza neuraminidase inhibitors possessing a novel hydrophobic interaction in the enzyme active site: design, synthesis, and structural analysis of carbocyclic sialic acid analogues with potent anti-influenza activity. Journal of the American Chemical Society. 119 (4), 681-690 (1997).
- Hoffmann, G., et al. Nonclinical pharmacokinetics of oseltamivir and oseltamivir carboxylate in the central nervous system. Antimicrobial Agents and Chemotherapy. 53 (11), 4753-4761 (2009).
- Wishart, D. S., et al. DrugBank 5.0: a major update to the DrugBank database for 2018. Nucleic Acids Research. 46 (1), 1074-1082 (2018).
- Takakusagi, K., et al. Multimodal biopanning of T7 phage-displayed peptides reveals angiomotin as a potential receptor of the anti-angiogenic macrolide Roxithromycin. European Journal of Medicinal Chemistry. 90, 809-821 (2015).
- Takakusagi, Y., et al. Efficient one-cycle affinity selection of binding proteins or peptides specific for a small-molecule using a T7 phage display pool. Bioorganic and Medicinal Chemistry. 16 (22), 9837-9846 (2008).
- Takakusagi, Y., Suzuki, A., Sugawara, F., Kobayashi, S., Sakaguchi, K. Self-assembled monolayer (SAM) of small organic molecule for efficient random-peptide phage display selection using a cuvette type quartz-crystal micobalance (QCM) device. World Journal of Engineering. 5, 1005-1006 (2009).
- Kusayanagi, T., et al. The antitumor agent doxorubicin binds to Fanconi anemia group F protein. Bioorganic and Medicinal Chemistry. 20 (21), 6248-6255 (2012).
- Takakusagi, Y., et al. Identification of C10 biotinylated camptothecin (CPT-10-B) binding peptides using T7 phage display screen on a QCM device. Bioorganic and Medicinal Chemistry. 15 (24), 7590-7598 (2007).
- Rodi, D. J., et al. Identification of small molecule binding sites within proteins using phage display technology. Combinatorial Chemistry and High Throughput Screening. 4 (7), 553-572 (2001).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved