このコンテンツを視聴するには、JoVE 購読が必要です。 サインイン又は無料トライアルを申し込む。
Method Article
連続部電子顕微鏡を用いた肝細胞細胞内細胞小器官間接触部位の3次元特性評価
要約
肝臓または他の組織の細胞から肝細胞細胞小器官間の膜接触部位の三次元的詳細を取得するための簡単で包括的なプロトコル。
要約
透過型電子顕微鏡は、細胞の超構造を可視化するためのゴールドスタンダードであると長い間考えられてきました。しかし、分析はしばしば2次元に限定され、細胞小器官間の3次元(3D)超構造および機能的関係を完全に記述する能力を妨げる。体積電子顕微鏡(vEM)は、メソスケール、マイクロスケール、およびナノスケールの解像度で3Dで細胞超微細構造の尋問を可能にする技術のコレクションを記述する。
このプロトコルは、シリアルセクション伝送EM(TEM)を使用してvEMデータを取得するためのアクセス可能で堅牢な方法を提供し、サンプル処理からデジタル3D再構成までの技術的側面を単一の簡単なワークフローでカバーします。この技術の有用性を実証するために、肝肝細胞における小胞体とミトコンドリアおよびそれらの接触部位との間の3D超構造関係が提示される。細胞小器官間接触は、オルガネラ間のイオン、脂質、栄養素、およびその他の小分子の移動において重要な役割を果たします。しかし、肝細胞での最初の発見にもかかわらず、それらの物理的特徴、ダイナミクス、および機能についてはまだ学ぶべきことがたくさんあります。
細胞小器官間接触は、2つの細胞小器官の互いに近接する(典型的には〜10〜30nm)および接触部位の程度(点状接触からより大きな3D槽様接触まで)において変化する形態の範囲を示すことができる。密接な接触の検査には高解像度イメージングが必要であり、シリアルセクションTEMは、肝細胞分化中の細胞小器官間接触の3D超構造、ならびに代謝性疾患に関連する肝細胞構造の変化を視覚化するのによく適している。
概要
1930年代の発明以来、電子顕微鏡は研究者が細胞や組織の構造成分を視覚化することを可能にしました1,2。3Dモデルの構築には、骨の折れるシリアルセクションコレクション、手動写真、ネガ処理、手動トレース、およびガラス、プラスチック、または発泡スチロール3,4のシートからの3Dモデルの作成と組み立てが必要であるため、ほとんどの調査は2D情報を提供しました。約70年後、顕微鏡性能、シリアルセクションコレクション、自動デジタルイメージング、3D再構成、視覚化、および分析のための洗練されたソフトウェアとハードウェアから、現在総称してボリュームEM(vEM)と呼ばれるものの代替アプローチまで、プロセスの多くの側面でかなりの進歩がありました。これらのvEM技術は、一般に、ミクロンスケールにわたってナノメートルの分解能で3D超微細構造情報を提供すると考えられており、透過型電子顕微鏡(TEM)および新しい走査型電子顕微鏡(SEM)技術を包含する。レビュー5,6,7,8を参照してください。
例えば、集束イオンビームSEM(FIB-SEM)は、SEM内の集束イオンビームを使用して、ブロックの表面の連続SEMイメージングスキャンの間にブロックの表面を粉砕し、サンプルの自動フライス加工/イメージングを繰り返し、再構成のための3Dデータセットを構築することを可能にする9,10。対照的に、シリアルブロックフェースSEM(SBF−SEM)は、SEM内のウルトラミクロトームを使用して、イメージング11,12の前にブロックフェースから材料を除去する一方、アレイ断層撮影は、SEM内のシーケンシャルセクションの関心領域をイメージングして3Dデータセットを生成する自動ワークフローを設定する前に、カバースリップ、ウェーハ、またはテープ上にシリアルセクションの収集を必要とする非破壊プロセスである。.アレイ断層撮影と同様に、シリアルセクションTEM(ssTEM)では、イメージングの前に物理セクションを収集する必要があります。しかし、これらの切片はTEMグリッド上で収集され、TEM14、15、16で画像化される。ssTEMは、傾斜断層撮影17、18、19を行うことにより延長することができる。直列傾斜断層撮影法は、x、y、およびzにおいて最良の解像度を提供し、細胞20全体を再構成するために使用されてきたが、それは合理的に困難である。このプロトコルは、現在特殊なセクショニングやvEM計測器にアクセスできないが、3D vEMデータを生成することで恩恵を受ける多くのEMラボが利用できる最もアクセスしやすいvEM技術として、ssTEMの実用的な側面に焦点を当てています。
3D再構成のための連続超微小切除術は、以前は困難と考えられてきました。断面の厚さであってもまっすぐなリボンを切断し、正しいサイズのリボンを正しい順序で、十分なサポートを備えたグリッド上に配置して拾うことは困難であったが、グリッドバーが関心領域を覆い隠さず、そして最も重要なのは、不完全なシリーズが完全な3D再構成を妨げる可能性があるため、セクションを失うことなく21。しかしながら、市販のウルトラミクロトーム、ダイヤモンド切断およびトリミングナイフ22,23、グリッド21,24上の電子透過性支持フィルム、および断面接着およびリボン保存13,21を支援するための接着剤に対する改善は、多くの研究室においてこの技術をより日常的にした長年にわたる漸進的な進歩のほんの一部にすぎない。シリアル切片が収集されると、TEMでのシリアルイメージングは簡単で、xとyのサブナノメートルpxサイズのEM画像を提供できるため、細胞内構造の高解像度の問い合わせが可能になります。ここで紹介するケーススタディは、肝肝細胞における小胞体(ER)-オルガネラ接触の研究におけるssTEMおよび3D再構成の使用を実証しており、ER-オルガネラ接触が最初に観察された25,26。
核エンベロープと隣接している一方で、ERはまた、リソソーム、ミトコンドリア、脂肪滴、および原形質膜27を含む多数の他の細胞小器官と密接に接触する。ER−オルガネラ接触は、脂質代謝28、ホスホイノシチドおよびカルシウムシグナル伝達29、オートファジー調節、およびストレス応答30、31に関与している。ER-オルガネラ接触および他の細胞小器官間接触は、細胞代謝ニーズおよび細胞外合図に応答する非常に動的な構造である。それらは、そのサイズおよび形状ならびにオルガネラ膜32、33間の距離において形態学的に変化することが示されている。これらの超構造の違いは、それらの異なるタンパク質/脂質組成および機能を反映している可能性が高いと考えられている34,35。しかし、オルガネラ間接触を定義し、それらを分析することは依然として困難な作業である36。したがって、さらなる調査のためには、細胞小器官間接触を調べて特徴付けるための信頼性が高くて簡単なプロトコルが必要です。
ER-オルガネラ接触は膜間分離で10~30nmの範囲であるため、同定のゴールドスタンダードは歴史的にTEMでした。薄切片TEMは、別個の膜接触における常在ERタンパク質に対する特異的サブドメイン局在を明らかにした37。伝統的に、これはnm分解能を有するER-オルガネラ接触を明らかにしてきたが、しばしばこれらの相互作用の2Dビューのみを提示した。しかし、vEMアプローチは、これらの接触部位の超構造的提示および文脈を3Dで明らかにし、接触の完全な再構成および接触のより正確な分類(点対管状対槽状)および定量化を可能にする38、39。ER-オルガネラ接触が観察された最初の細胞型であることに加えて25,26、肝細胞は、そのアーキテクチャおよび生理学において重要な役割を果たす他のオルガネラ間接触の広範なシステムを有する28,40。しかし、肝細胞におけるER-オルガネラおよび他のオルガネラ間接触の徹底的な形態学的特徴付けは依然として欠けている。したがって、再生および修復中に細胞小器官間接触がどのように形成および再構築されるかは、肝細胞生物学および肝機能に特に関連している。
プロトコル
すべての動物は英国内務省のガイドラインに従って飼育され、組織採取は1986年英国動物(科学的手順)法に従って実施された。
1. 試料の固定と準備
- 肝臓組織を適切なサイズの断片、約8 mm x 8 mm x 3 mmに解剖し、その断片を温かいリン酸緩衝生理食塩水(PBS、37°C)に入れる。
- 室温(20〜25°C)固定液(1%スクロース中の1.5%グルタルアルデヒド、0.1Mカコジル酸ナトリウム)を肝臓片に注入し、PBSから固定液に室温で最大20分間移す。乾燥を避けるために、常に組織を溶液に浸してください。
注:アルデヒドは腐食性であり、潜在的に発癌性の刺激物です。カコジル酸ナトリウムは、飲み込んだり吸入したりすると有毒です。すべての固定剤は、適切な個人用保護具を着用しながら取り扱う必要があり、実験はヒュームフード内で行う必要があります。良好な固定は、より堅い組織をもたらすであろう。 - 振動マイクロトームをブレード、氷浴、および冷たいPBS充填バッファトレイでセットアップします。固定された肝臓組織の最初の部分をシアノアクリレート接着剤で標本ホルダーに取り付け、ブロックを振動ミクロトームに移す。
- メーカーの推奨に従って、組織に近づき、固定された肝臓を厚さ100μmのスライスにスライスします。
- ヘラまたは天然ヘアペイントブラシを使用してスライスを収集し、氷の上で氷冷固定(1.5%グルタルアルデヒド、0.1Mカコジル酸ナトリウム)を含む12または24ウェルの皿に移す。すべてのサンプルがスライスされ、さらに処理する準備が整うまで、スライスを氷の上に置きます。
- さらに処理するために関心のある領域を含むスライスを選択し、穏やかな攪拌で洗浄する。12 ウェルまたは 24 ウェルのディッシュで室温の 0.1 M カコジル酸ナトリウムで 3 回 5 分間洗浄を行い、スライスが自由に動くのに十分なバッファーがあることを確認します。
注:一般に、関心のある領域は、研究の生物学的問題に関連する解剖学的特徴に基づいて選択され、シリーズ全体に存在する可能性が高い組織の領域、例えば、セクションの端になく、よく保存されている組織の領域によって導かれる。 - ヒュームフードで、0.1Mカコジル酸ナトリウムを、新しく調製した1%四酸化オスミウム/1.5%フェリシアン化カリウムと交換する。12 ウェルまたは 24 ウェルのディッシュを密閉容器に入れ、容器を有害化学物質の冷蔵庫に 1 時間移します。
注:オスミウムは、摂取、吸入、および皮膚接触の場合に非常に危険です。フェリシアン化カリウムは刺激物であり、吸入および皮膚接触によって有害である。常に適切な個人用保護具を使用して取り扱い、ヒュームフード内で実験を行ってください。 - ヒュームフード内で、四酸化オスミウム/フェリシアン化カリウムを専用のオスミウム廃液ボトルに取り出し、0.1Mカコジル酸ナトリウムで5分間サンプルを3回洗浄します。試料を密閉容器に放置し、4°Cで一晩放置する。
メモ: 潜在的な一時停止ポイント。サンプルは、0.1 M カコジル酸ナトリウムを密閉容器に入れて 4 °C で数週間保存することができ、保存にほとんど害はありません。乾燥を防ぐのに十分なバッファーがあることを確認します。 - サンプルを、新たに調製した1%タンニン酸と0.05 Mカコジル酸ナトリウム中、室温の暗所で45分間インキュベートする。
注:タンニン酸は刺激物であり、目の損傷を引き起こす可能性があります。適切な個人用保護具を着用し、ヒュームフードで実験を行います。 - 脱水および包埋の前に、ddH2Oで5分間洗浄を3回行う。
2. サンプル脱水、エポン樹脂埋め込み、実装
- エポン樹脂を重量比で以下の比率に従って調製する(工程2.2参照)。攪拌子を入れた100mLの使い捨てプラスチックビーカーで天秤を風袋に入れます。使い捨てプラスチックパスツールピペット5本から端部を切り取り、これらを使用して粘性樹脂成分をビーカーに移します。
- ビーカーに19.2gの樹脂-812、7.6gのDDSA、13.2gのMNA、および0.8gのDMP-30促進剤を順次加える。5番目のクリーンプラスチックパスツールピペットを使用して、樹脂成分を手で十分に混合します。
注:気泡の導入は避けますが、下部の樹脂と上部の樹脂を十分に混合して、成分層の色の変化と粗い混合を実現してください。すべての樹脂成分は刺激物であり、吸入および皮膚接触によって有害である。DMP-30は腐食性であり、皮膚腐食を引き起こす可能性がある。適切な個人用保護具を着用してください。 - ビーカーをマグネチックスターラーの上に置き、穏やかに攪拌したままにしておき、定期的に手動で樹脂を混合する。
- 70%エタノールで5分間穏やかな攪拌でサンプルを洗浄する。これを 1 回繰り返します。
- 90%エタノールで5分間穏やかな攪拌でサンプルを洗浄する。これを 1 回繰り返します。
- 100%エタノールで5分間穏やかな攪拌でサンプルを洗浄する。これを 1 回繰り返します。
- サンプルをヒュームフードで100%エタノール洗浄している間に、プロピレンオキシド(PO)耐性プラスチック蓋を備えたガラスバイアルに50:50(v / v)プロピレンオキシド(PO):Epon混合物を準備します。ガラスバイアルの蓋に慎重に、しかししっかりとクリップし、蓋とバイアルの両方を保持したまま、シェイクまたは渦を混ぜる。
注:プロピレンオキシドは、いくつかのプラスチックを溶解する急性毒性、可燃性の刺激剤です。適切な個人用保護具を着用し、ヒュームフードで実験を行います。 - ステップ2.6の後、サンプルをPO:EponとともにPO耐性容器(アルミニウムトレイまたはガラスバイアルなど )で1時間インキュベートし、ヒュームフード内で穏やかなロッキング/攪拌を行います。
- ヒュームフードで、サンプルを100%Eponに移します。ヒュームフード内で室温で2時間インキュベートし、揺動/回転/攪拌する。PO:エポン混合物を専用のガラスエポン廃棄物ボトルに移します。
- 手順 2.9 を 1 回繰り返します。
- 埋め込むサンプルをマウントします。スライスのサイズと関心領域に応じて、スライスを予め重合した樹脂製スタブに直接取り付けるか、解剖のために平らに埋め込んで後日再埋め込みます。
メモ: フラット埋め込みの場合、「スライドをキャスト」を使用して、一度に多くのスライスを埋め込むことができます。残った樹脂は、ビームカプセルを充填するために使用し、予備重合されたスタブを作るために焼成するか、または後で使用するために凍結することができる。 - 「キャスト-スライド」キャビティを埋めるのに十分な樹脂で取り付けて覆ったら、サンプルを60°Cのオーブンで一晩焼きます。
メモ: 潜在的な一時停止ポイント。サンプルは室温で何年も保存できます。 - 再包埋のために、平坦な包埋組織スライスにおける関心領域を特定する。宝石商のこぎりを用いて、適切なサイズ(1mm2〜4mm2 )の組織片を切り出し、ステップ2.2と同様に調製した樹脂を用いて予備重合ブロックの上に再埋め込み、60°Cのオーブンで一晩焼く。
メモ:または、ティッシュピースを2液型エポキシ樹脂でスタブまたはピンに接着することもできます。一晩セットに残します。潜在的な一時停止ポイント。
3. 埋め込みサンプルのトリミングとシリアルセクショニング
注: セクショニングは学習したスキルです。ユーザーは、シリアルセクショニングを試みる前に、超薄型セクショニングに堪能である必要があります。正確なミクロトームコントロールはメーカーによって異なるため、メーカーの指示とガイドラインに従ってください。
- サンプルをトリミングアダプターにロックした状態で、カミソリの刃を使用して樹脂埋め込み組織を慎重にトリミングし、次の基準を満たします( 図1A、Bを参照)。
- 関心のある領域の周囲に組織を露出させる平らな上面があることを確認します。
- 上端と下端がきれいで平行な台形であることを確認します。
- 全体の寸法は 、x で 200 ~ 500 μm、y で 100 ~ 500 μm であることを確認します。
- 非対称のブロック面、例えば 、約90°の右側の角、左上隅の鈍い、左下隅の鋭いことを確認します。
メモ:トリミングクライオナイフは、カミソリの刃の代替ツールになることがあります。その他の推奨事項は、イメージング時にセクションを注文するためのユーザーの利便性のためのものです。オプション: 断面が安定したリボンを形成できない場合、接触セメントをブロック面の前縁に適用してリボン形成を支援することができます。カミソリの刃は鋭いです。偶発的な滑りが個人的な害をもたらす可能性が低いように、カミソリの刃を保持するように注意してください。
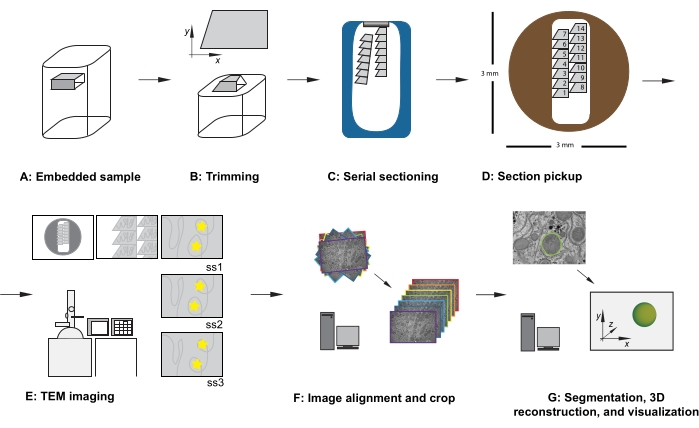
図1:シリアルセクションTEMワークフロー。(A)樹脂ブロック内の試料の図。(b)トリムブロックは、既知の向きを確保するために、直列切片および非対称ブロック面に適したエッジを有する台形形状を生成する。(C)ダイヤモンドナイフボートの水面に浮かぶ連続した断面のリボンを示す図。(d)直径3mmのTEMスロットグリッド上の断面およびリボン組織、断面の順序を指示して示す図。(E)TEMイメージングおよびナビゲーション。リボンとセクションの順序を表示し、画面参照用にモニター上の「黄色のスターステッカー」を使用して、後続のセクションで同じ関心領域のイメージを確実に再作成します。(F) 画像の配置とトリミング。(G)セグメンテーション、3D再構成、視覚化。略称:TEM=透過型電子顕微鏡。この図の拡大版を表示するには、ここをクリックしてください。
- トリミングが完了したら、試料アークをチャックおよびサンプルとともにミクロトームの試料アームに移し、アークの移動範囲が上から下まで流れるように試料アークを配置します。試料アークを所定の位置に固定します。
- ダイヤモンドナイフをナイフホルダーに入れてロックし、切断角度がナイフに適切に設定されていることを確認します。ナイフホルダーをステージにしっかりとロックします。
- ステージが点灯した状態で、ブロック面とナイフの刃先の関係を常に確認しながら、ナイフアドバンスを使用します。ナイフを試料に向かって慎重に進め、ブロックがナイフの端に揃うまで関連するノブを調整して、ナイフの横方向の角度、試料の傾き、および試料の回転を継続的に調整します。
- ステージのアップライトをオフにします。ステージのダウンライトをオンにします。試料アームの切断窓の上部と下部を設定する。標本をナイフの端のすぐ下に残します。
- ナイフボートを清潔なddH2Oで満たし、水面がナイフの端と水平で、わずかに凹んでいることを確認します。
- オプション:まつげを0.1%Triton X-100に浸してからナイフボートに水を入れて、水の表面張力を下げてクロロフォーミングとリボンピックアップを助けます。
- まつげ(カクテルスティックに接着されたまつげ)、formvarコーティングされたスロットグリッド、ラベル付きクロスオーバー鉗子、クロロホルム、0.1%Triton X-100溶液、蒸留水、ろ紙、およびグリッドボックスノート付きのグリッドボックスでワークステーションを準備します。
- 切削速度を1mm/s、初期切削厚さを100nmに設定し、切削サイクルを開始します。
- 最初の断面を切断した後、切断パラメータを切断速度0.8mm/s、切断厚さを70nmに変更し、切断を続け、セクションが水で満たされたナイフボートの表面を下に移動するリボンを形成できるようにします(図1C)。
注:これは多くの場合、樹脂セクションの厚さのより正確なガイドであるため、生成されるセクションの色に注意することが重要です。銀のセクションは通常約70nmの厚さですが、灰色のセクションはより薄く、金のセクションはより厚いです。 - ミクロトームがセクションを切断し続け、リボンが長くなるのを許します。
注:室内で大きな振動や物理的な障害を避けることが重要です。ドラフトは、セクションがナイフボートの水面上を移動する原因となり、物理的な振動によりミクロトームが不均一に切断される可能性があります。 - 十分なセクションが収集されたら、リボンがボートの端に達する前に、切断を停止します(サンプルがナイフの端を通過した直後)。
メモ: 必要なセクションの数は、ブロック面のサイズと収集するデータセットのサイズによって異なります。したがって、カットセクションが外れていくときに、ブロックのサイズとスロットグリッドの関係に注意すると便利です。 - 両手にまつげを使用して、スロットグリッドの長さに収まる小さなリボンにリボンをそっと分割し、サンプル内から相対的な位置を記録するように注意してください。
メモ: 結合幅が収まる場合は、複数のリボンを隣り合わせにそっと配置して、1 つのスロットグリッドにまとめて拾うことができます。1 つのスロット グリッドで複数のリボンを取得する場合は、リボンの順序と相対位置に注意してください。たとえば、リボンは、常にサンプルに既に含まれているリボンの右側に、 サンプルのさらに奥に配置してください (図 1D)。 - オプション: ガラス製アプリケーターロッドを使用して、クロロホルムを一滴のセクションの上に置き、セクションを平らにします。
注:クロロホルムは有毒で刺激性があります。クロロホルムを水面や水面に接触させないでください。誤ってそうなった場合は、セクショニングに戻る前に水を取り除き、ナイフを洗う必要があります。クロロホルムは、セクションを損傷し、ダイヤモンドをナイフボートに固定する接着剤を劣化させる可能性があります。 - 最初の番号の付いた鉗子を使用して、最初の空のスロットグリッド(スロットの右側、formvar側を下)を拾い上げ、Triton X-100に静かに浸してから蒸留水に2回浸してから、ろ紙を使用して鉗子の端から余分な水を取り除きます。
- 片手にまつげを、もう片方の手に鉗子を持って、formvarでコーティングされたスロットグリッドの約2/3をナイフボートの水に(セクションから離れて)静かに下げて、formvar側が下を 向くようにし、スロットの右側の長い端が水面にあり、水辺に平行になります。
- 水中のグリッドをリボンに向かって静かに漂わせて、戻りストローク時にセクションがグリッドに向かってドリフトするようにします。リボンの右端がスロットの右端と揃うまで、これをますます小さくして続けます。次に、最後の漂流で、グリッドを静かに上に上げて、セクションをスロットグリッドに上げます。
- グリッドボックスに保管する前に、グリッドを鉗子に入れて乾燥させ、グリッドボックスのリファレンスシートに適切に注釈を付けます。
- すべてのリボンが収集されるまで手順 3.16 を繰り返し、リボンの順序が維持されていることを確認します。
- さらにセクションが必要な場合は、ナイフを150 nm程度引っ込め、ボートの水位を確認し、必要に応じてさらに追加します。ステップ 3.11 から 3.18 に従って、切断プロセスをもう一度開始します。
- すべてのセクションが収集されたら、ナイフの端にセクションの破片がないことを確認し、ナイフをブロック面から引き抜き、ナイフを取り外して清掃します。
4. グリッド染色
- 乾いたら、ベンチのパラフィルムまたはペトリ皿でレイノルズの鉛クエン酸塩で切片を染色します。水酸化ナトリウムのペレットをペトリ皿の蓋の下に置き、二酸化炭素を含まない環境を提供します。次に、慎重にペレットから離れて、レイノルズのクエン酸鉛をパラフィルム上に40 μL滴、各グリッドに1つずつピペットします。
注: 一度にあまりにも多くのグリッドを染色しないでください。たとえば、最大値は 6 である必要があります。染色皿の上で直接呼吸しないようにしてください。二酸化炭素はクエン酸鉛と反応し、グリッド上に望ましくない沈殿物を引き起こす可能性があります。 - 各グリッド(セクション側を下に)をクエン酸鉛滴の上に反転させ、ペトリ皿の蓋で7〜10分間保護したままにします。グリッドが染色されている間、各グリッドに5滴の300 μLの蒸留水を入れた大きな2枚目のパラフィルムをベンチに用意します。
- クエン酸鉛インキュベーションの最後に、各グリッドを蒸留水の液滴に移し、グリッド上で直接呼吸することなく1分間洗浄する。
- 手順 4.3 を合計 5 回繰り返します。
- 番号付きのクロスオーバー鉗子を使用して、最初のグリッドを拾い上げ、グリッドの端をろ紙に触れて水の大部分を吸い取り、鉗子で乾かします(少なくとも20分間)。グリッドごとにこの手順を繰り返します。
5. TEMによるイメージング取得
メモ: 正確な TEM コントロールは製造元によって異なるため、製造元の指示とガイドラインに従ってください。次の手順は、TEM の使用に既に習熟しているユーザーが実行する必要があります。
- イメージングの前に、ビームアライメント、ゲインリファレンス、サンプルの真心度など、通常のチェックを実行します。
- 連続切片の最初のグリッドを試料ホルダーに慎重にロードし、スロット(したがって切片)を顕微鏡ステージの垂直軸に合わせるように注意してください。
メモ:この精度は必須ではありませんが、集録および将来のデータ処理段階での時間を節約します。グリッドを挿入するとき (セクション側を下または上) は、すべてのグリッドを同じ向きでイメージするように注意してください。 - 低倍率で、シリアルセクションの順序、位置、および位置を観察します(図1E)。グリッド上の系列の中央のセクションに移動します。
注:正確な研究目的に応じて、イメージングのアプローチは異なる場合があります。ただし、以下は有用な出発点です。セクションの形状とリボンの関係 (手順 3.14 で説明したとおり) によって、グリッド上のどのセクションが最初にあり、どのセクションが最後にあるかが決まります。 - サンプルを参照し、関心のある領域を特定します。サンプルを目的の倍率で観察し、断面が完全に整列していないことが多く、後で画像をトリミングする必要がある可能性があるため、わずかに低い倍率で系列を収集することを検討してください。
- 参照画像を低倍率で撮影して、関心領域のコンテキスト、断面境界に対する異なる倍率での大まかな位置、およびサンプル内のランドマークの特徴を理解します。これらを使用して、関心のある領域を他のセクションに標識します。
- オプション: 画面参照用に、再利用可能な粘着パテ、ステッカー、またはスクリーンにテープで貼られたオーバーヘッド・プロジェクター (OHP) 用紙を使用して、画面上に一時的なマーカーを配置して、データセット全体で画像の中心にある関心領域の同じフィーチャを日常的に再画像化できるようにします ( 図 1E の黄色の星を参照)。
- 参照画像を使用して、グリッドの最初のセクション上の関心領域に移動し、所望の倍率で画像を取得する。
メモ: 画像を保存するときは、シリーズの最初のイメージの最初のファイル名を書き留め、すべてのイメージ名がシリアルセクションの連続した順序に従うように、連続した命名法を使用します。 - 次のセクションに移動し、その関心領域のすべてのセクションがイメージ化されるまで、手順 5.7 を繰り返します。
6. 画像のエクスポートとシリアルセクションの配置登録
- 同じスタックに属するイメージファイルを 1 つのフォルダーにエクスポートします。フォルダがファイル名でソートされていることを確認します。
メモ: 理想的には、イメージは同じルート名を持ち、取得された順序に従う必要があります。 - フィジーを開き、[ ファイル|]をクリックしますインポート|イメージ シーケンス。
- フォルダの最初の画像をクリックし、[ 開く]をクリックします。 シーケンスオプションの ポップアップウィンドウが表示されるまで待ちます(図2A)。
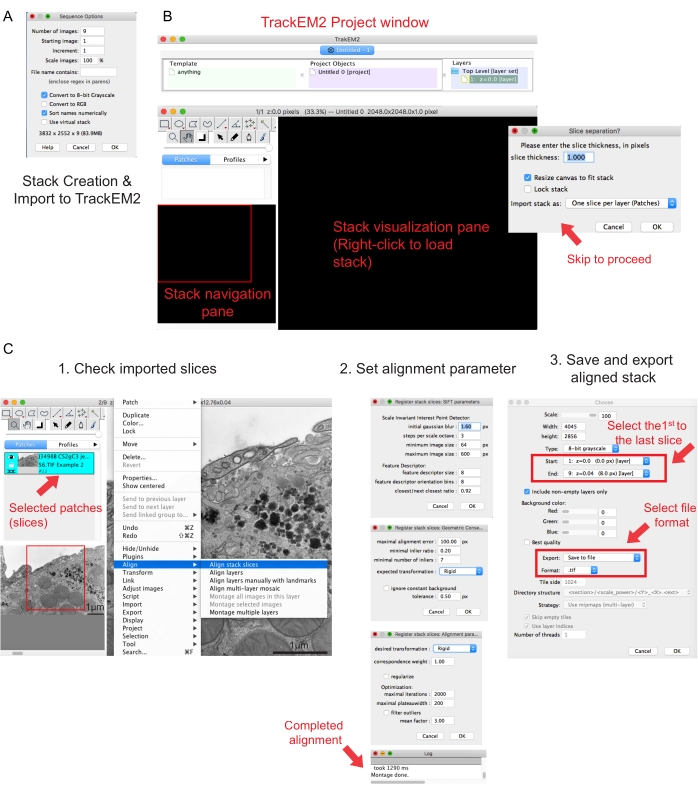
図2:フィジーを使用したシリアルスタックの作成とシリアルセクションのアライメント (A)シリアルスタックを作成するためのイメージをロードする際のシーケンスオプションを示すスクリーンショット。(B) TrackEM2プラグインのスクリーンショットとプラグインのキーウィンドウ。スライス分離で OK を押して、位置合わせを続行します。(C) シリアルスタックをビジュアライゼーションペインに正常にロードした後のスクリーンショット。整列パラメータの3つの連続したウィンドウは、 スタックスライスの整列 が選択されるとポップアップします。整列が完了したら、整列されたスタックをエクスポートします。 この図の拡大版を表示するには、ここをクリックしてください。
- [ 名前を数値で並べ替える] をクリック|8ビットオプションに変換します 。 OKを押します。
注: 8 ビットに変換すると、Amira へのデータのインポートが支援され、ファイル サイズが縮小されるため、後の手順で処理速度を高速化できます。 - 作成されたスタックの完全性、順序、および倍率を確認します。作成したスタックを.tifファイルとして保存します。
メモ:画像は同じ倍率で取得されている必要があります。 - TrakEM2 プラグイン41 を実行します。 ファイル|に移動します。新しい|トラックEM2 (空白)。
注:プラグインは、TrackEM2ファイルを保存するようにユーザーに求めます。必要に応じて、TrackEM2 ファイルをイメージ フォルダーに保存します。プロジェクト ウィンドウ、スタック ナビゲーション (左) ウィンドウ、スタック ビジュアライゼーション ウィンドウの 3 つのウィンドウが表示されます (図 2B)。 - 黒いビジュアライゼーションペインを右クリックします。 「インポート」|をクリックします。スタックをインポート し、以前に作成したスタックを選択します。
- 「 OK」 をクリックして、スタックをスタック・ナビゲーション・ウィンドウにロードします。
メモ: スライス分離ウィンドウがポップアップ表示され、ピクセルと寸法の関係を尋ねられます。スタックの配置のみの場合は、「 OK 」をクリックしてこのステップをスキップします。 - スライダーを使用して、スタックのすべてのスライスを確認します。ロードされたスライスを探します。このスライスは、ナビゲーション プランにパッチとして表示されます。次の配置に含めるパッチを選択します。
メモ: 選択したパッチは青色になります。 - 表示ペインの上にマウスを置きます。画像を右クリックし、[|揃え] を選択します。スタックスライスの位置を合わせます(図 2C-1)。
- 位置合わせパラメーターは、3 つの順次ウィンドウのセットを使用して指定します。
メモ: ほとんどのデータでは、剛体揃え(回転と平行移動は可能だが変換は可能)から開始し、その他のパラメータはデフォルトのままにします(図 2C-2)。 - 読み出しログに モンタージュが完了したと表示されるまで、アライメントの実行を許可します。
メモ: ランタイムは、ボクセルの数とコンピュータの速度によって異なります。 - 表示ペインで整列したスタックを確認します。Alt キーと - キー (PC の場合) または Ctrl キーと - キー (Mac の場合) を押すと、整列されたスタックが縮小表示されます。
- 整列されたスタックに満足したら、[ |のエクスポート] を右クリックします。整列したスタックを保存するために平らな画像を作成します 。
- スタックの先頭として最初のイメージを選択し、スタックの終わりとして最後のイメージを選択し、「OK」をクリックします(図 2C-3)。整列したスタックを.tifとして保存します。
メモ: ファイルサイズを小さくするには、必要な関心領域のみを含むようにデータをトリミングします。 - 必要に応じて、整列されたスタックでアフィン整列を実行します。フィジーで整列されたスタックを開き、[ プラグイン|]を選択します参加登録|スタックレッグ。
- アフィンオプションを選択し、OKを押します。プログラムが完了するまで待ちます。
- アフィン整列スタックを別のファイル名で保存します。
7. セグメンテーションと3D再構成
- アミラ42を開きます。[ファイル|]をクリックします。 Data を開いて 、整列されたスタックを読み込みます。
- 新しいポップアップウィンドウでボクセルの測定値を指定します(図3A)。
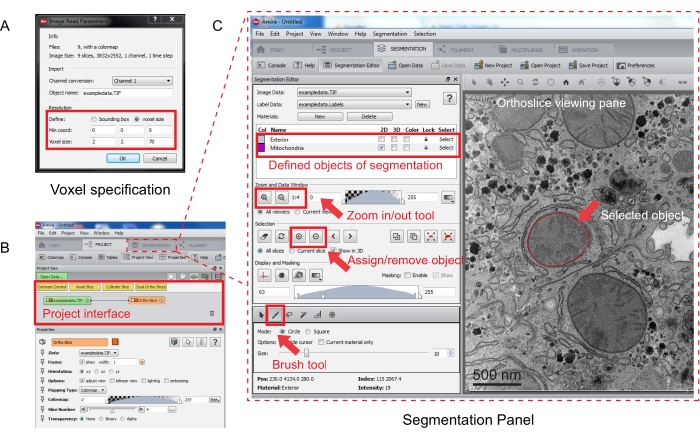
図 3: Amira. (A) 整列スタックをロードする前の Voxel 定義ポップアップウィンドウを使用したシリアルスタックのセグメンテーション。(B) スタックのインポート後のプロジェクトインターフェイスのスクリーンショット。「セグメンテーション」タブを選択して、セグメンテーションエディタパネルでオブジェクトのトレースを開始します。(C) セグメンテーションタブの主な機能。「セグメンテーション」タブの「セグメンテーションエディタ」セクションでセグメンテーションのオブジェクトを定義します。ズーム機能を使用して、オブジェクトの識別を支援します。ブラシツールを選択し、オブジェクトの境界をトレースします。[選択] の下の [+] 記号をクリックして、トレースを割り当てます。割り当てられたオブジェクトは、オルソスライスの表示ペインに赤い境界が表示されます。この図の拡大版を表示するには、ここをクリックしてください。
メモ: イメージスタックノードがプロジェクトインタフェースに表示され、オルソスライスが右側の表示ペインに表示されます(図3B)。
- セグメンテーションを開始するには、[セ グメンテーション]タブ を選択します(図3B)。
メモ: セグメンテーションの前と最中にセグメンテーションの進行状況を保存することをお勧めします。 モデル|に移動モデルを 任意の .am ファイルとして保存します。 - セ グ メンテーションエディタパネルで新規をクリックして、マテリアルリストに新しいオブジェクトを定義します。右クリックしてオブジェクトの色を変更し、ダブルクリックしてオブジェクトの名前を変更します。
- 手動セグメンテーションの場合は、材料リストの下にある セグメンテーション ツールを選択します。デフォルトの ブラシ ツールを選択して、ピクセルをハイライト表示します(図3C)。
メモ: または、 ブラシ ツールを使用してオブジェクトの輪郭をトレースし、 Shift + F キーを押してオブジェクトを塗りつぶします。 - ブラシツールを消しゴムに変換するには、Ctrl キーを押しながら補正するピクセルを選択します。スタック内のすべてのスライスに注釈を付けます。
- 確認したら、 + 記号をクリックして選択範囲をラベルに割り当てます。 - 記号をクリックして選択を解除します。
- セグメンテーションが完了したら、プロジェクト インターフェイスに戻ります。イメージスタックに接続されている拡張子 ".label" を持つノードを探します。
- 「.label」拡張子を右クリックし、「 サーフェス|を生成」を選択します。適用 して .surf ファイルを作成します。
- セグメント化されたオブジェクトの 3D モデルをレンダリングするには、.surf ファイルを右クリックし、「サーフェスビュー」( Surface ビュー ) を選択して、表示ペインに 3D モデルを生成します。
- 視覚化またはさらなる定量分析のために3Dモデルを保存します。
結果
この技術のために、関心のある領域は、生物学的研究目的に基づいて選択され、埋め込み組織のトリミングおよび切片化の前に同定される。同様に、ブロック面のサイズは、研究の質問によって決定されることがあります。この場合、サンプルは、約0.3 mm x 0.15 mmのブロック面を残すようにトリミングされました(図4A)。これにより、グリッドあたり9つのシリアル切片か?...
ディスカッション
オルガネラの構造と相互作用を3Dで視覚化するためのアクセス可能なvEM技術が、このプロトコルで説明されています。肝細胞における細胞小器官間接触の形態は、ここではケーススタディとして提示される。しかし、このアプローチは、末梢神経45におけるシュワン細胞-内皮相互作用、内皮細胞46におけるワイベル・パラデ・ボディ生合成、腎臓細胞47における貨物分泌、海?...
開示事項
著者らは、開示する利益相反はありません。
謝辞
ジョアンナ・ハンリー、レベッカ・フィアデイロ、アニア・ストラアートマン=イワノフスカに専門家の技術支援に感謝します。また、有益な議論をしてくれたStefan LabのメンバーとIan J. Whiteにも感謝します。J.J..B.は、UCLのMRC分子細胞生物学研究所へのMRCの資金提供によって支援されており、賞のコードMC_U12266Bです。C.J.S.は、UCLの分子細胞生物学大学ユニットのMRC研究所(賞コードMC_UU_00012/6)へのMRC資金によって支えられています。PGは、欧州研究評議会、助成金コードERC-2013-StG-337057によって資金提供されています。
資料
| Name | Company | Catalog Number | Comments |
| 0.22 µm syringe filter | Sarstedt | 83.1826.001 | |
| Aluminum trays | Agar Scientific | AGG3912 | |
| Amira v6 | ThermoFisher | https://www.thermofisher.com | |
| Chloroform | Fisher | C/4960/PB08 | |
| DDSA/Dodecenyl Succinic Anhydride | TAAB | T027 | Epon ingredient |
| Diamond knife | DiaTOME | ultra 45° | |
| DMP-30/2,4,6-tri (Dimethylaminomethyl) phenol | TAAB | D032 | Epon ingredient |
| Dumont Tweezers N5 | Agar Scientific | AGT5293 | |
| Fiji | https://imagej.net/ | ||
| Fiji TrakEM2 plugin | https://imagej.net/ | ||
| Formaldehyde 36% solution | TAAB | F003 | |
| Formvar coated slot grid | Homemade | Alternative: EMS diasum (FF2010-Cu) | |
| Glass bottle with applicator rod | Medisca | 6258 | |
| Glass vials | Fisher Scientific | 15364769 | |
| Gluteraldehyde 25% solution | TAAB | G011 | |
| MNA/Methyl Nadic Anhydride | TAAB | M011 | Epon ingredient |
| Osmium Tetroxide 2% solution | TAAB | O005 | |
| Potassium Ferricyanide | Sigma-Aldrich | P-8131 | |
| Propylene oxide | Fisher Scientific | E/0050/PB08 | |
| Reuseable adhesive | Blue Tack | ||
| Reynolds Lead Citrate | TAAB | L037 | Section stain |
| Sodium Cacodylate | Sigma-Aldrich | C-0250 | to make 0.1 M Caco buffer |
| Super Glue | RS Components | 918-6872 | Cyanoacrylate glue, Step 1.3 |
| TAAB 812 Resin | TAAB | T023 | Epon ingredient |
| Tannic acid | TAAB | T046 | |
| Triton X-100 | Sigma-Aldrich | T9284 | |
| Two part Epoxy Resin | RS Components | 132-605 | Alternative: Step 2.13 |
| Ultramicrotome | Leica | UC7 | |
| Vibrating microtome | Leica | 100 µm thick slices, 0.16 mm/s cutting at 1 mm amplitude . | |
| Weldwood Original Contact cement | DAP | 107 | Contact adhesive: Step 3.1.4 |
参考文献
- Knoll, M., Ruska, E. Das elektronenmikroskop. Zeitschrift für Physik. 78 (5), 318-339 (1932).
- von Ardenne, M. Daselektronen-rastermikroskop. Zeitschrift für Physik. 109 (9), 553-572 (1938).
- Bang, B. H., Bang, F. B. Graphic reconstruction of the third dimension from serial electron microphotographs. Journal of Ultrastructure Research. 1 (2), 138-139 (1957).
- Birch-Andersen, A. Reconstruction of the nuclear sites of Salmonella typhimurium from electron micrographs of serial sections. Journal of General Microbiology. 13 (2), 327-329 (1955).
- Denk, W., Horstmann, H. Serial block-face scanning electron microscopy to reconstruct three-dimensional tissue nanostructure. PLoS Biology. 2 (11), 329 (2004).
- Peddie, C. J., Collinson, L. M. Exploring the third dimension: volume electron microscopy comes of age. Micron. 61, 9-19 (2014).
- Titze, B., Genoud, C. Volume scanning electron microscopy for imaging biological ultrastructure. Biology of the Cell. 108 (11), 307-323 (2016).
- Kornfeld, J., Denk, W. Progress and remaining challenges in high-throughput volume electron microscopy. Current Opinion in Neurobiology. 50, 261-267 (2018).
- Heymann, J. A., et al. Site-specific 3D imaging of cells and tissues with a dual beam microscope. Journal of Structural Biology. 155 (1), 63-73 (2006).
- Knott, G., Marchman, H., Wall, D., Lich, B. Serial section scanning electron microscopy of adult brain tissue using focused ion beam milling. Journal of Neuroscience. 28 (12), 2959-2964 (2008).
- Leighton, S. B. SEM images of block faces, cut by a miniature microtome within the SEM - a technical note. Scanning Electron Microscopy. , 73-76 (1981).
- Martone, M. E., Deerinck, T. J., Yamada, N., Bushong, E., Ellisman, M. H. Correlated 3D light and electron microscopy: use of high voltage electron microscopy and electron tomography for imaging large biological structures. Journal of Histotechnology. 23 (3), 261-270 (2000).
- Micheva, K. D., Smith, S. J. Array tomography: a new tool for imaging the molecular architecture and ultrastructure of neural circuits. Neuron. 55 (1), 25-36 (2007).
- Sjostrand, F. S. Ultrastructure of retinal rod synapses of the guinea pig eye as revealed by three-dimensional reconstructions from serial sections. Journal of Ultrastructure Research. 2 (1), 122-170 (1958).
- Ware, R. W. Three-dimensional reconstruction from serial sections. International Review of Cytology. 40, 325 (1975).
- Stevens, J. K., Davis, T. L., Friedman, N., Sterling, P. A systematic approach to reconstructing microcircuitry by electron microscopy of serial sections. Cognitive Brain Research. 2 (3), 265-293 (1980).
- Hoppe, W. Three-dimensional electron microscopy. Annual Review of Biophysics. 10, 563-592 (1981).
- Frank, J. . Electron tomography: methods for three-dimensional visualization of structures in the cell. , (2008).
- Baumeister, W. Electron tomography: towards visualizing the molecular organization of the cytoplasm. Current Opinion in Structural Biology. 12 (5), 679-684 (2002).
- Hoog, J. L., Schwartz, C., Noon, A. T., O'Toole, E. T. Organization of interphase microtubules in fission yeast analyzed by electron tomography. Developmental Cell. 12 (3), 349-361 (2007).
- Harris, K. M., Perry, E., Bourne, J., Feinberg, M., Ostroff, L., Hurlburt, J. Uniform serial sectioning for transmission electron microscopy. Journal of Neuroscience. 26 (47), 12101-12103 (2006).
- Jesior, J. C. Use of low-angle diamond knives leads to improved ultrastructural preservation of ultrathin sections. Scanning Microscopy Supplement. 3, 147-152 (1989).
- Studer, D., Gnaegi, H. Minimal compression of ultrathin sections with use of an oscillating diamond knife. Journal of Microscopy. 197, 94-100 (2000).
- Gay, H., Anderson, T. F. Serial sections for electron microscopy. Science. 120 (3130), 1071-1073 (1954).
- Bernhard, W., Rouiller, C. Close topographical relationship between mitochondria and ergastoplasm of liver cells in a definite phase of cellular activity. The Journal of Biophysical and Biochemical Cytology. 2, 73-78 (1956).
- Palade, G. E. An electron microscope study of the mitochondrial structure. The Journal of Histochemistry & Cytochemistry. 1 (4), 188-211 (1953).
- Wu, H., Carvalho, P., Voeltz, G. K. Here, there, and everywhere: The importance of ER membrane contact sites. Science. 361 (6401), (2018).
- Vance, J. E. Inter-organelle membrane contact sites: implications for lipid metabolism. Biology Direct. 15 (1), 24 (2020).
- Stefan, C. J. Endoplasmic reticulum-plasma membrane contacts: Principals of phosphoinositide and calcium signaling. Current Opinion in Cell Biology. 63, 125-134 (2020).
- Zaman, M. F., Nenadic, A., Radojicic, A., Rosado, A., Beh, C. T. Sticking with it: ER-PM membrane contact sites as a coordinating nexus for regulating lipids and proteins at the cell cortex. Frontiers in Cell and Developmental Biology. 8, 675 (2020).
- van Vliet, A. R., Sassano, M. L., Agostinis, P. The unfolded protein response and membrane contact sites: tethering as a matter of life and death. Contact. 1, 1-15 (2018).
- Cohen, S., Valm, A. M., Lippincott-Schwartz, J. Interacting organelles. Current Opinion in Cell Biology. 53, 84-91 (2018).
- Hariri, H., et al. Lipid droplet biogenesis is spatially coordinated at ER-vacuole contacts under nutritional stress. EMBO Reports. 19 (1), 57-72 (2018).
- Stefan, C. J., Trimble, W. S., Grinstein, S., Drin, G. Membrane dynamics and organelle biogenesis-lipid pipelines and vesicular carriers. BMC Biology. 15 (1), 102 (2017).
- Eisenberg-Bord, M., Shai, N., Schuldiner, M., Bohnert, M. A tether is a tether is a tether: tethering at membrane contact sites. Developmental Cell. 39 (4), 395-409 (2016).
- Scorrano, L., De Matteis, M. A., Emr, S., Giordano, F. Coming together to define membrane contact sites. Nature Communications. 10 (1), 1287 (2019).
- Lak, B., Li, S., Belevich, I., Sree, S. Specific subdomain localization of ER resident proteins and membrane contact sites resolved by electron microscopy. European Journal of Cell Biology. 100 (7), 151180 (2021).
- Collado, J., Kalemanov, M., Campelo, F., Bourgoint, C. Tricalbin-mediated contact sites control ER curvature to maintain plasma membrane integrity. Developmental Cell. 51 (4), 476-487 (2019).
- West, M., Zurek, N., Hoenger, A., Voeltz, G. K. A 3D analysis of yeast ER structure reveals how ER domains are organized by membrane curvature. Journal of Cell Biology. 193 (2), 333-346 (2011).
- Ilacqua, N., Anastasia, I., Raimondi, A., Lemieux, P. A three-organelle complex made by wrappER contacts with peroxisomes and mitochondria responds to liver lipid flux changes. Journal of Cell Science. 135 (5), 259091 (2022).
- Cardona, A., Saalfeld, S., Schindelin, J., Arganda-Carreras, I. TrakEM2 software for neural circuit reconstruction. PLoS One. 7 (6), 38011 (2012).
- Stalling, D., Westerhoff, M., Hege, H. -. C. Amira: A highly interactive system for visual data analysis. The Visualization Handbook. 38, 749-767 (2005).
- Hsieh, T. S., Chen, Y. J., Chang, C. L., Lee, W. R., Liou, J. Cortical actin contributes to spatial organization of ER-PM junctions. Molecular Biology of the Cell. 28 (23), 3171-3180 (2017).
- Anastasia, I., Ilacqua, N., Raimondi, A., Lemieux, P. Mitochondria-rough-ER contacts in the liver regulate systemic lipid homeostasis. Cell Reports. 34 (11), 108873 (2021).
- Cattin, A. L., Burden, J. J., Van Emmenis, L., Mackenzie, F. E. Macrophage-Induced Blood Vessels Guide Schwann Cell-Mediated Regeneration of Peripheral Nerves. Cell. 162 (5), 1127-1139 (2015).
- Lopes-da-Silva, M., et al. A GBF1-dependent mechanism for environmentally responsive regulation of ER-Golgi transport. Developmental Cell. 49 (5), 786-801 (2019).
- Banushi, B., Forneris, F., Straatman-Iwanowska, A., Strange, A. Regulation of post-Golgi LH3 trafficking is essential for collagen homeostasis. Nature Communications. 7, 12111 (2016).
- Rey, S. A., et al. Ultrastructural and functional fate of recycled vesicles in hippocampal synapses. Nature Communications. 6, 8043 (2015).
- Belicova, L., Repnik, U., Delpierre, J., Gralinska, E. Anisotropic expansion of hepatocyte lumina enforced by apical bulkheads. Journal of Cell Biology. 220 (10), 202303003 (2021).
- Kizilyaprak, C., Daraspe, J., Humbel, B. M. Focused ion beam scanning electron microscopy in biology. Journal of Microscopy. 254 (3), 109-114 (2014).
- Xu, C. S., Hayworth, K. J., Lu, Z., Grob, P. Enhanced FIB-SEM systems for large-volume 3D imaging. Elife. 6, 1-36 (2017).
- Parlakgül, G., Arruda, A. P., Cagampan, E., Pang, S. High resolution 3D imaging of liver reveals a central role for subcellular architectural organization in metabolism. bioRxiv. , (2020).
- Guerin, C. J., Kremer, A., Borghgraef, P., Lippens, S. Targeted studies using serial block face and focused ion beam scan electron microscopy. The Journal of Visualized Experiments: JoVE. (150), e59480 (2019).
- Kremer, A., et al. A workflow for 3D-CLEM investigating liver tissue. Journal of Microscopy. 281 (3), 231-242 (2021).
- Hayat, M. . Principles and techniques of electron microscopy: biological applications. , (2000).
- Wisse, E., Braet, F., Duimel, H., Vreuls, C. Fixation methods for electron microscopy of human and other liver. World Journal of Gastroenterology. 16 (23), 2851-2866 (2010).
- Hanley, J., Dhar, D. K., Mazzacuva, F., Fiadeiro, R. Vps33b is crucial for structural and functional hepatocyte polarity. Journal of Hepatology. 66 (5), 1001-1011 (2017).
- Deerinck, T. J., Bushong, E. A., Thor, A., Ellisman, M. H. NCMIR methods for 3D EM: a new protocol for preparation of biological specimens for serial block face scanning electron microscopy. Microscopy. 1, 6-8 (2010).
- Miranda, K., Girard-Dias, W., Attias, M., de Souza, W., Ramos, I. Three dimensional reconstruction by electron microscopy in the life sciences: An introduction for cell and tissue biologists. Molecular Reproduction and Development. 82 (7-8), 530-547 (2015).
- Yamaguchi, M., Chibana, H. A method for obtaining serial ultrathin sections of microorganisms in transmission electron microscopy. The Journal of Visualized Experiments: JoVE. (131), e56235 (2018).
- Hall, D. H., Hartwieg, E., Nguyen, K. C. Modern electron microscopy methods for C. elegans. Methods in Cell Biology. 107, 93-149 (2012).
- Hagler, H. K. Ultramicrotomy for biological electron microscopy. Methods in Molecular Biology. 369, 67-96 (2007).
- Arganda-Carreras, I., Beichel, R. R., Sonka, M. Consistent and elastic registration of histological sections using vector-spline regularization. Computer vision approaches to medical image analysis, CVAMIA 2006, Lecture Notes in Computer Science. 4241, 85-95 (2006).
- Belevich, I., Joensuu, M., Kumar, D., Vihinen, H., Jokitalo, E. Microscopy image browser: a platform for segmentation and analysis of multidimensional datasets. PLoS Biology. 14 (1), 1002340 (2016).
- Fiala, J. C. Reconstruct: a free editor for serial section microscopy. Journal of Microscopy. 218, 52-61 (2005).
- Kremer, J. R., Mastronarde, D. N., McIntosh, J. R. Computer visualization of three-dimensional image data using IMOD). Journal of Structural Biology. 116 (1), 71-76 (1996).
- Iudin, A., Korir, P. K., Salavert-Torres, J., Kleywegt, G. J., Patwardhan, A. EMPIAR: a public archive for raw electron microscopy image data. Nature Methods. 13 (5), 387-388 (2016).
- Xu, C. S., Pang, S., Shtengel, G., Muller, A. An open-access volume electron microscopy atlas of whole cells and tissues. Nature. 599 (7883), 147-151 (2021).
- Karabag, C., et al. Semantic segmentation of HeLa cells: An objective comparison between one traditional algorithm and four deep-learning architectures. PLoS One. 15 (10), 0230605 (2020).
- Heinrich, L., Bennett, D., Ackerman, D., Park, W. Whole-cell organelle segmentation in volume electron microscopy. Nature. 599 (7883), 141-146 (2021).
- Kim, J. S., Greene, M. J., Zlateski, A., Lee, K. Space-time wiring specificity supports direction selectivity in the retina. Nature. 509 (7500), 331-336 (2014).
- Spiers, H., Songhurst, H., Nightingale, L., de Folter, J. Deep learning for automatic segmentation of the nuclear envelope in electron microscopy data, trained with volunteer segmentations. Traffic. 22 (7), 240-253 (2021).
- Hasan, N. M., Gupta, A., Polishchuk, E., Yu, C. H. Molecular events initiating exit of a copper-transporting ATPase ATP7B from the trans-Golgi network. The Journal of Biological Chemistry. 287 (43), 36041-36050 (2012).
- Stoeck, I. K., Lee, J. Y., Tabata, K., Romero-Brey, I. Hepatitis C virus replication depends on endosomal cholesterol homeostasis. The Journal of Virology. 92 (1), 01196 (2018).
- Ma, X., Qian, H., Chen, A., Ni, H. M., Ding, W. X. Perspectives on mitochondria-ER and mitochondria-lipid droplet contact in hepatocytes and hepatic lipid metabolism. Cells. 10 (9), 2273 (2021).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved