Для просмотра этого контента требуется подписка на Jove Войдите в систему или начните бесплатную пробную версию.
Method Article
Трехмерная характеристика межорганизационных контактных участков в гепатоцитах с помощью электронной микроскопии серийного сечения
В этой статье
Резюме
Простой и всеобъемлющий протокол для получения трехмерных деталей мембранных контактов между органеллами в гепатоцитах из печени или клетками в других тканях.
Аннотация
Просвечивающая электронная микроскопия долгое время считалась золотым стандартом визуализации клеточной ультраструктуры. Однако анализ часто ограничивается двумя измерениями, препятствуя способности полностью описать трехмерную (3D) ультраструктуру и функциональную связь между органеллами. Объемная электронная микроскопия (vEM) описывает набор методов, которые позволяют исследовать клеточную ультраструктуру в 3D в мезомасштабном, микромасштабном и наноразмерном разрешениях.
Этот протокол обеспечивает доступный и надежный метод получения данных vEM с использованием передачи EM последовательного сечения (TEM) и охватывает технические аспекты обработки образцов до цифровой 3D-реконструкции в едином, простом рабочем процессе. Чтобы продемонстрировать полезность этой методики, представлена 3D ультраструктурная связь между эндоплазматическим ретикулумом и митохондриями и их контактными сайтами в гепатоцитах печени. Межорганные контакты играют жизненно важную роль в переносе ионов, липидов, питательных веществ и других небольших молекул между органеллами. Однако, несмотря на их первоначальное открытие в гепатоцитах, еще многое предстоит узнать об их физических особенностях, динамике и функциях.
Межорганные контакты могут отображать диапазон морфологий, варьирующихся в близости двух органелл друг к другу (обычно ~ 10-30 нм) и протяженности места контакта (от пунктатных контактов до более крупных 3D-цистерноподобных контактов). Исследование близких контактов требует визуализации с высоким разрешением, а последовательное сечение ТЭМ хорошо подходит для визуализации 3D-ультраструктуры межорганных контактов при дифференцировке гепатоцитов, а также изменений в архитектуре гепатоцитов, связанных с метаболическими заболеваниями.
Введение
С момента своего изобретения в 1930-х годах электронные микроскопы позволили исследователям визуализировать структурные компоненты клеток и тканей 1,2. Большинство исследований предоставили 2D-информацию, так как построение 3D-моделей требует кропотливой последовательной коллекции секций, ручной фотографии, обработки негатива, ручной трассировки, а также создания и сборки 3D-моделей из листов стекла, пластика или пенополистирола 3,4. Почти 70 лет спустя были достигнуты значительные успехи во многих аспектах процесса, от производительности микроскопа, сбора последовательных секций, автоматизированной цифровой визуализации, сложного программного и аппаратного обеспечения для 3D-реконструкции, визуализации и анализа до альтернативных подходов к тому, что теперь в совокупности называется объемом EM (vEM). Эти методы vEM, как правило, считаются обеспечивающими 3D-ультраструктурную информацию с нанометровым разрешением в микронных масштабах и охватывающие просвечивающую электронную микроскопию (TEM) и более новые методы сканирующей электронной микроскопии (SEM); смотреть отзывы 5,6,7,8.
Например, сфокусированный ионный пучок SEM (FIB-SEM) использует сфокусированный ионный пучок внутри SEM для фрезерования поверхности блока между последовательными SEM-изображениями поверхности блока, что позволяет повторное автоматическое фрезерование / визуализацию образца и создание 3D-набора данных для реконструкции 9,10. В отличие от этого, SEM последовательного блока SEM (SBF-SEM) использует ультрамикротом внутри SEM для удаления материала из поверхности блока до визуализации 11,12, в то время как массивная томография является неразрушающим процессом, который требует сбора последовательных секций на крышках, пластинах или ленте, прежде чем настроить автоматизированный рабочий процесс визуализации интересующей области в последовательных секциях в SEM для создания набора 3D-данных13 . Подобно массивной томографии, последовательный срез TEM (ssTEM) требует, чтобы физические участки были собраны перед визуализацией; однако эти участки собираются на сетках ТЕА и изображаются в ТЕА 14,15,16. ssTEM можно продлить, выполнив наклонную томографию 17,18,19. Последовательная наклонная томография обеспечивает лучшее разрешение в x, y и z, и, хотя она использовалась для реконструкции целых клеток20, она достаточно сложна. Этот протокол фокусируется на практических аспектах ssTEM как наиболее доступного метода vEM, доступного для многих лабораторий EM, которые в настоящее время могут не иметь доступа к специализированным инструментам секционирования или vEM, но выиграют от создания данных 3D vEM.
Последовательная ультрамикротомия для 3D-реконструкции ранее считалась сложной задачей. Было трудно разрезать прямые ленты равномерной толщины сечения, уметь расставлять и подбирать ленты нужного размера, в правильном порядке, на сетки с достаточной опорой, но без сетчатых стержней, скрывающих интересующие участки, а главное, без потери секций, так как неполный ряд может помешать полной 3D-реконструкции21. Тем не менее, усовершенствования коммерческих ультрамикротомов, алмазной резки и обрезки ножей 22,23, электронных люцентных поддерживающих пленок на сетках 21,24 и клеев для вспомогательной адгезии сечения и сохранения ленты 13,21 - это лишь некоторые из постепенных достижений за эти годы, которые сделали технику более рутинной во многих лабораториях. После того, как последовательные участки были собраны, последовательная визуализация в TEM проста и может предоставить электромагнитные изображения с размерами субнанометра в x и y, что позволяет опрашивать субклеточные структуры с высоким разрешением - потенциальное требование для многих исследовательских вопросов. Представленное здесь тематическое исследование демонстрирует использование ssTEM и 3D-реконструкции при изучении эндоплазматических ретикулумных (ER)-органеллных контактов в гепатоцитах печени, где впервые наблюдались контакты ER-органелл25,26.
Будучи смежным с ядерной оболочкой, ER также устанавливает тесные контакты с многочисленными другими клеточными органеллами, включая лизосомы, митохондрии, липидные капли и плазматическую мембрану27. Контакты с ER-органеллами были вовлечены в метаболизм липидов28, передачу сигналов фосфоинозитида и кальция29, регуляцию аутофагии и реакцию на стресс30,31. Контакты ER-органелл и другие межорганные контакты являются высокодинамичными структурами, которые реагируют на клеточные метаболические потребности и внеклеточные сигналы. Было показано, что они морфологически различаются по размеру и форме, а расстояния между мембранами органелл 32,33. Считается, что эти ультраструктурные различия, вероятно, отражают их различные белковые / липидные составы и функцию34,35. Тем не менее, по-прежнему является сложной задачей определить межорганизационные контакты и проанализировать их36. Следовательно, для дальнейших исследований требуется надежный, но простой протокол для изучения и характеристики межорганизационных контактов.
Поскольку контакты ER-органелл могут варьироваться от 10 до 30 нм при мембранном разделении, золотым стандартом идентификации исторически был TEM. Тонкое сечение TEM выявило специфическую локализацию поддомена для резидентных ER-белков при различных мембранных контактах37. Традиционно это выявляло контакты ER-органелл с разрешением nm, но часто представляло только 2D-вид этих взаимодействий. Тем не менее, подходы vEM раскрывают ультраструктурное представление и контекст этих контактных участков в 3D, что позволяет полностью реконструировать контакты и более точную классификацию контактов (точечные и трубчатые против цистерноподобных) и количественную оценку38,39. Помимо того, что гепатоциты являются первым типом клеток, где наблюдалиськонтакты ER-органелл 25,26, они имеют обширную систему других межорганных контактов, которые играют жизненно важную роль в их архитектуре и физиологии28,40. Однако тщательная морфологическая характеристика ЭР-органелл и других межорганных контактов в гепатоцитах все еще отсутствует. Соответственно, то, как межорганные контакты формируются и ремоделируются во время регенерации и восстановления, имеет особое значение для биологии гепатоцитов и функции печени.
протокол
Все животные содержались в соответствии с руководящими принципами Министерства внутренних дел Великобритании, а сбор тканей проводился в соответствии с Законом Великобритании о животных (научные процедуры) 1986 года.
1. Фиксация и подготовка образца
- Рассейте ткань печени на кусочки соответствующего размера, приблизительно 8 мм х 8 мм х 3 мм, и поместите кусочки в теплый фосфатно-буферный физиологический раствор (PBS, 37 °C).
- Вводят фиксатор комнатной температуры (20-25 °C) (1,5% глутаральдегида в 1% сахарозы, 0,1 М какодилата натрия) в кусочки печени и переносят их из PBS в фиксатор на срок до 20 мин при комнатной температуре. Всегда держите ткань погруженной в растворы, чтобы избежать высыхания.
ПРИМЕЧАНИЕ: Альдегиды являются раздражителями, которые являются коррозионными и потенциально канцерогенными. Какодилат натрия токсичен при проглатывании или вдыхании. Все фиксаторы должны обрабатываться во время ношения соответствующих средств индивидуальной защиты, а эксперимент должен проводиться в вытяжном капюшоне. Хорошая фиксация приведет к более прочной ткани. - Установите вибрационный микротом с лезвием, ледяной ванной и холодным буферным лотком, заполненным PBS. Установите первый кусок неподвижной ткани печени на держатель образца с помощью цианоакрилатного клея и перенесите блок в вибрирующий микротом.
- Следуя рекомендациям производителя, подойдите к ткани и нарежьте неподвижную печень на ломтики толщиной 100 мкм.
- Соберите ломтики с помощью шпателя или натуральной кисти для волос и переложите их в 12- или 24-луночную посуду, содержащую ледяной фиксатор (1,5% глутаральдегида, 0,1 М какодилата натрия) на льду. Оставьте ломтики на льду до тех пор, пока все образцы не будут нарезаны и не будут готовы к дальнейшей обработке.
- Выберите ломтики, содержащие интересующие области, для дальнейшей обработки и смойте с мягким перемешиванием. Выполните три, 5 мин промывки комнатной температурой 0,1 М какодилата натрия в посуде из 12 или 24 лунок, гарантируя, что ломтики имеют достаточный буфер для свободного перемещения.
ПРИМЕЧАНИЕ: В целом, области, представляющие интерес, выбираются на основе анатомических особенностей, связанных с биологическим вопросом исследования, и руководствуются областями ткани, которые, вероятно, будут присутствовать во всем ряду, например, не на краю раздела, и которые хорошо сохранились. - В вытяжном шкафу замените 0,1 М какодилата натрия свежеприготовленным 1% тетроксидом осмия /1,5% феррицианида калия. Поместите 12- или 24-луночную посуду в герметичный контейнер и переложите контейнер в холодильник с опасными химическими веществами на 1 час.
ПРИМЕЧАНИЕ: Осмий чрезвычайно опасен при приеме внутрь, вдыхании и контакте с кожей. Феррицианид калия является раздражителем и вреден при вдыхании и контакте с кожей. Всегда обращайтесь с использованием соответствующих средств индивидуальной защиты и выполняйте эксперимент в вытяжной вытяжке. - В вытяжном шкафу извлеките тетроксид осмия / феррицианид калия в специальную бутылку для отходов осмия и промывайте образцы в течение 5 минут 0,1 М какодилата натрия три раза. Оставьте образцы в герметичном контейнере на ночь при температуре 4 °C.
ПРИМЕЧАНИЕ: Потенциальная точка паузы. Образцы могут храниться в 0,1 М какодилата натрия в герметичном контейнере при 4 °C в течение нескольких недель с небольшим ущербом для сохранности. Убедитесь, что имеется достаточный буфер для предотвращения высыхания. - Инкубировать образцы со свежеприготовленной 1% дубильной кислотой в 0,05 М какодилата натрия в течение 45 мин в темноте при комнатной температуре.
ПРИМЕЧАНИЕ: Дубильная кислота является раздражителем и может вызвать повреждение глаз. Наденьте соответствующие средства индивидуальной защиты и проведите эксперимент в вытяжке. - Выполните три 5-минутные промывки с ddH2O перед обезвоживанием и встраиванием.
2. Обезвоживание образца, встраивание смолы Epon и монтаж
- Готовят смолу Эпон в соответствии со следующим соотношением по весу (см. шаг 2.2). Нанесите весы с одноразовым пластиковым стаканом объемом 100 мл, содержащим перемешивающий батончик. Отрежьте концы из 5 одноразовых пластиковых пипеток Pasteur и используйте их для переноса компонентов вязкой смолы в стакан.
- Последовательно добавляют в стакан 19,2 г смолы-812, 7,6 г DDSA, 13,2 г MNA и 0,8 г ускорителя DMP-30. Используя пятую чистую пластиковую пипетку Pasteur, тщательно перемешайте смоляные компоненты вручную.
ПРИМЕЧАНИЕ: Избегайте введения пузырьков, но обеспечьте достаточное смешивание нижней смолы с верхней для достижения изменения цвета и грубого перемешивания слоев компонентов. Все компоненты смолы являются раздражителями и вредны при вдыхании и контакте с кожей. DMP-30 является коррозионным и может вызвать коррозию кожи. Носите соответствующие средства индивидуальной защиты. - Поместите стакан на магнитную мешалку и оставьте осторожно помешивать, периодически перемешивая смолу вручную.
- Промыть образцы щадящим перемешиванием в течение 5 мин 70% этанолом; повторить один раз.
- Промыть образцы щадящим перемешиванием в течение 5 мин 90% этанолом; повторить один раз.
- Промыть образцы щадящим перемешиванием в течение 5 мин 100% этанолом; повторить один раз.
- Пока образцы находятся в 100% этаноловой промывке в вытяжном шкафу, приготовьте окись пропилена (PO) 50:50 (v/v): смесь Epon в стеклянном флаконе с пластиковой крышкой, устойчивой к окиси пропилена (PO). Осторожно, но надежно закрепите стеклянную крышку флакона и, держа крышку и флакон, встряхните или вихрь перемешайте.
ПРИМЕЧАНИЕ: Оксид пропилена является остро токсичным, легковоспламеняющимся раздражителем, который растворяет некоторые пластмассы. Наденьте соответствующие средства индивидуальной защиты и проведите эксперимент в вытяжке. - После этапа 2.6 инкубируйте образцы с PO:Epon в течение 1 ч в контейнере, стойком к PO (например, алюминиевых лотках или стеклянных флаконах), с мягким раскачиванием/перемешиванием в вытяжном шкафу.
- В вытяжном шкафу перенесите образцы на 100% Epon. Инкубировать в течение 2 ч при комнатной температуре в вытяжном шкафу с раскачиванием/вращением/перемешиванием. Перенесите смесь PO:Epon в специальную стеклянную бутылку для отходов Epon.
- Повторите шаг 2.9 один раз.
- Смонтируйте образцы для встраивания. В зависимости от размера срезов и интересующей области, непосредственно установите срезы на предварительно полимеризованные смоляные заглушки или вставьте их для вскрытия и повторно вставьте их позже.
ПРИМЕЧАНИЕ: Для плоского встраивания можно использовать "cast-a slide" для встраивания нескольких фрагментов одновременно. Оставшаяся смола может быть использована для заполнения капсул пучка и запечена для изготовления предварительнополимеризованных заглушек или заморожена для последующего использования. - После установки и покрытия достаточным количеством смолы для заполнения полости «литой-слайд» выпекайте образцы в течение ночи в печи с температурой 60 °C.
ПРИМЕЧАНИЕ: Потенциальная точка паузы. Образцы могут храниться при комнатной температуре в течение многих лет. - Для повторного встраивания определите интересующую область в плоских внедренных срезах ткани. С помощью ювелирной пилы вырежьте кусок ткани соответствующего размера (от 1 мм2 до 4мм2) и повторно встройте с помощью смолы, приготовленной, как на этапе 2.2, на верхнюю часть предварительнополимеризованного блока и выпекайте на ночь в печи с температурой 60 °C.
ПРИМЕЧАНИЕ: Альтернативно, кусок ткани может быть приклеен к заглушке или штифту с двухкомпонентной эпоксидной смолой. Оставьте на ночь. Потенциальная точка паузы.
3. Обрезка и последовательное секционирование встроенных образцов
ПРИМЕЧАНИЕ: Секционирование является приобретенным навыком; пользователи должны владеть ультратонким сечением, прежде чем пытаться выполнять последовательное секционирование. Поскольку точные элементы управления микротомами различаются в зависимости от производителя, следуйте инструкциям и рекомендациям производителя.
- Когда образец заперт в адаптере для обрезки, используйте лезвие бритвы, чтобы тщательно обрезать ткань, встроенную в смолу, чтобы соответствовать следующим критериям (см. Рисунок 1A, B):
- Убедитесь, что есть плоская верхняя поверхность, обнажающая ткань вокруг интересующей области.
- Убедитесь, что трапециевидная форма с верхним и нижним краями являются чистыми и параллельными.
- Обеспечьте габаритные размеры 200-500 мкм в x, 100-500 мкм в y.
- Обеспечьте асимметричную грань блока, например, правые боковые углы ~90 °, верхний левый угол тупой, а левый нижний угол острый.
ПРИМЕЧАНИЕ: Обрезной криокниф может быть альтернативным инструментом для лезвия бритвы. Другие рекомендации предназначены для удобства пользователя при заказе разделов при визуализации. Необязательно: Если секции не образуют устойчивых лент, контактный цемент может быть нанесен на передний край поверхности блока, чтобы облегчить формирование ленты. Лезвия бритвы острые; позаботьтесь о том, чтобы держать лезвие бритвы так, чтобы случайные проскальзывания вряд ли привели к личному вреду.
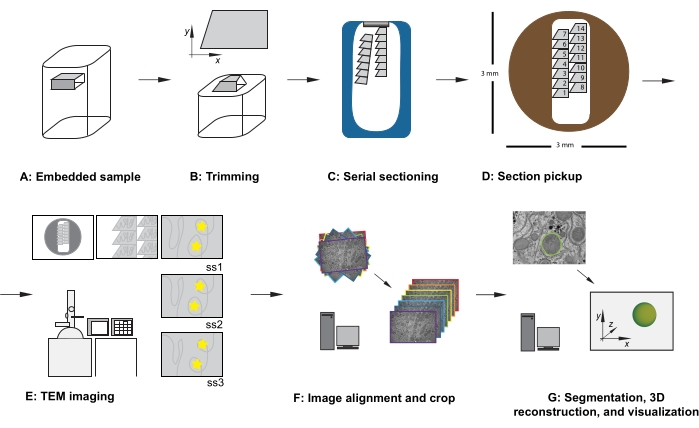
Рисунок 1: Рабочий процесс ТЕА последовательного сечения. (А) Схема образца в смоляном блоке. (B) Обрезать блок для создания трапециевидной формы с краями, подходящими для последовательного сечения, и асимметричной гранью блока для обеспечения известной ориентации. (C) Диаграмма, показывающая ленты серийных секций, плавающих на поверхности воды в лодке с алмазным ножом. (D) Диаграмма, показывающая расположение секций и лент, диктующих порядок секций, на сетке щелей ТЕА диаметром 3 мм. Е) Визуализация и навигация ТЕА. Отображение порядка лент и разделов и использование «желтых звездных наклеек» на мониторе для ссылок на экран, чтобы обеспечить повторное отображение той же области, представляющей интерес, в последующих разделах. (F) Выравнивание и обрезка изображений. (G) Сегментация, 3D-реконструкция и визуализация. Аббревиатура: TEM = просвечивающая электронная микроскопия. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
- После обрезки перенесите дугу образца вместе с патроном и образцом на образец кронштейна микротома, расположив дугу образца таким образом, чтобы диапазон перемещения дуги простирался сверху вниз; закрепить дугу образца на месте.
- Поместите и зафиксируйте алмазный нож в держателе ножа, убедившись, что угол резания установлен соответствующим ножом. Надежно зафиксируйте держатель ножа в сцене.
- Включив сцену, используйте нож вперед, постоянно проверяя связь между лицевой стороной блока и лезвием ножа. Осторожно продвигайте нож к образцу, постоянно регулируя боковой угол ножа, наклон образца и вращение образца, регулируя соответствующие ручки, пока блок не будет выровнен по краю ножа.
- Выключите освещение сцены; включить потолочное освещение сцены; установить верхнюю и нижнюю части режущего окна образца манипулятора; и оставьте экземпляр чуть ниже края ножа.
- Наполните лодку с ножом чистым ddH2O и убедитесь, что поверхность воды находится на одном уровне с лезвием ножа и слегка вогнута.
- Необязательно: Опустите ресницу в 0,1% Triton X-100, а затем в воду для ножевой лодки, чтобы уменьшить поверхностное натяжение воды, чтобы помочь хлороформированию и ленточному захвату.
- Подготовьте рабочую станцию ресницами (ресницы, приклеенные к коктейльной палочке), щелевыми сетками с формварным покрытием, маркированными щипцами кроссовера, хлороформом, 0,1% раствором Triton X-100, дистиллированной водой, фильтровальной бумагой и сеткой с сеткой.
- Установите скорость резания на уровне 1 мм/с, а начальную толщину реза на 100 нм и начните цикл резки.
- После того, как первая секция разрезана, измените параметры резания на скорость резания со скоростью 0,8 мм/с и толщину резания до 70 нм и продолжайте резку, позволяя секциям образовывать ленту, движущуюся вниз по поверхности заполненной водой ножевой лодки (рисунок 1С).
ПРИМЕЧАНИЕ: Важно знать цвет производимых секций, так как это часто является более точным руководством по толщине смоляных секций. Серебряные сечения обычно имеют толщину около 70 нм, в то время как серые секции тоньше, а золотые сечения толще. - Позвольте микротому продолжить резку секций, а ленте стать длиннее.
ПРИМЕЧАНИЕ: Важно избегать больших вибраций и физических нарушений в помещении. Сквозняки могут привести к тому, что секции будут перемещаться по поверхности воды в лодке-ноже, а физические вибрации могут привести к неравномерному разрезу микротома. - Как только будет собрано достаточное количество секций и до того, как лента доберется до конца лодки, прекратите резку (сразу после того, как образец пройдет лезвие ножа).
ПРИМЕЧАНИЕ: Количество необходимых разделов зависит от размера грани блока и размера собираемого набора данных. Таким образом, полезно знать о взаимосвязи между размером блока и сеткой слотов, когда разрезанные секции отрываются. - Используя ресницы в каждой руке, аккуратно разбейте ленту на более мелкие ленты, которые могут поместиться в длину сетки прорезей, позаботившись о том, чтобы сделать заметку об их относительном положении изнутри образца.
ПРИМЕЧАНИЕ: Если их общая ширина подходит, несколько лент могут быть аккуратно размещены рядом друг с другом и собраны вместе в сетку с одним слотом. При подборе нескольких лент на одной щелевой сетке обратите внимание на порядок и относительное положение лент. Например, всегда помещайте ленты дальше в образец справа от ленты, уже находящейся в образце (рисунок 1D). - Необязательно: Используя стеклянный стержень аппликатора, наведите каплю хлороформа на секции, чтобы выровнять их.
ПРИМЕЧАНИЕ: Хлороформ токсичен и является раздражителем. Не позволяйте хлороформу касаться поверхности воды или срезов. Если это произойдет случайно, воду нужно удалить, а нож промыть перед возвращением к разделению. Хлороформ может повредить секции и разрушить клей, который закрепляет алмаз в ножевой лодке. - Используя первые пронумерованные щипцы, возьмите первую пустую сетку щели (с правой стороны прорези, формвар стороной вниз), осторожно окуните в Triton X-100, а затем дважды в дистиллированную воду, прежде чем удалить лишнюю воду с края щипца с помощью листа фильтровальной бумаги.
- С ресницами в одной руке и щипцами в другой руке осторожно опустите примерно 2/3-ю щелевую сетку с покрытием formvar в воду ножевой лодки (вдали от секций), так что сторона formvar обращена вниз, а правый длинный край прорези находится у поверхности воды и параллельно кромке воды.
- Осторожно положите сетку в воде к лентам, чтобы при обратном ударе секции дрейфовали к сетке. Продолжайте делать это все меньшими и меньшими взмахами, пока правый край ленты не выровняется с правым краем слота. Затем, с последним взмахом, осторожно поднесите сетку вверх, чтобы поднять секции в сетку слотов.
- Оставьте сетку в щипцах для высыхания, прежде чем хранить ее в сетке, соответствующим образом аннотированной на справочном листе сетки.
- Повторяйте шаг 3.16 до тех пор, пока не будут собраны все ленты, обеспечив соблюдение порядка лент.
- Если требуются дополнительные секции, уберите нож на 150 нм или около того, проверьте уровень воды в лодке и добавьте больше, если это необходимо. Начните процесс резки снова, следуя шагам 3.11-3.18.
- После того, как все секции собраны, убедитесь, что лезвие ножа свободно от обломков секции, уберите нож от поверхности блока, а также извлеките и очистите нож.
4. Окрашивание сетки
- После высыхания окрасьте участки свинцовым цитратом Рейнольдса либо на парапленке на скамейке, либо в чашке Петри. Поместите несколько гранул гидроксида натрия под крышку чашки Петри, чтобы обеспечить среду, свободную от углекислого газа. Затем, осторожно, вдали от гранул, пипетка 40 мкл капли цитрата свинца Рейнольдса на парапленку, по одной на каждую сетку.
ПРИМЕЧАНИЕ: Не окрашивайте слишком много сеток одновременно; например, максимальное значение должно быть равно 6. Старайтесь не дышать прямо на окрашивающее блюдо. Углекислый газ может вступать в реакцию с цитратом свинца и вызывать нежелательный осадок на решетках. - Переверните каждую сетку (секцию стороной вниз) на каплю цитрата свинца и оставьте защищенной крышкой чашки Петри на 7-10 минут. Пока сетки окрашиваются, подготовьте на скамейке более крупный второй кусок парапленки с пятью каплями дистиллированной воды по 300 мкл для каждой сетки.
- В конце инкубации свинцового цитрата переложите каждую сетку на каплю дистиллированной воды для промывки в течение 1 мин, не дыша непосредственно на решетки.
- Повторите шаг 4.3 в общей сложности пять раз.
- Используя пронумерованные перекрестные щипцы, подберите первую сетку, прикоснитесь к краю сетки, чтобы фильтровать бумагу, чтобы отвести большую часть воды, и дайте высохнуть в щипцах (не менее 20 минут). Повторите для каждой сетки.
5. Получение изображений с помощью TEM
ПРИМЕЧАНИЕ: Поскольку точные элементы управления TEM различаются в зависимости от производителя, следуйте инструкциям и рекомендациям производителя. Следующие шаги должны быть выполнены пользователями, которые уже хорошо разбираются в использовании ТЕА.
- Перед визуализацией выполните обычные проверки, например, выравнивание луча, ссылки на усиление и эвцентриситет образца.
- Осторожно загрузите первую сетку последовательных секций в держатель образца, позаботившись о том, чтобы выровнять пазу (и, следовательно, секции) к вертикальной оси ступени микроскопа.
ПРИМЕЧАНИЕ: Эта точность не является существенной, но экономит время во время сбора и будущих этапов обработки данных. При вставке сетки (секция стороной вниз или секция стороной вверх) позаботьтесь о том, чтобы все сетки отображались в одной ориентации. - При небольшом увеличении наблюдайте за порядком, расположением и положением последовательных секций (рисунок 1E). Перейдите к средней части серии на сетке.
ПРИМЕЧАНИЕ: В зависимости от точной цели исследования подходы к визуализации могут варьироваться; однако нижеследующее является полезной отправной точкой. Форма секций и соотношение лент (как показано на шаге 3.14) определяют, какая секция была первой, а какая секция последней в сетке. - Просмотрите образец и определите интересующую область. Наблюдайте за образцом при желаемом увеличении и рассмотрите возможность сбора рядов при немного меньшем увеличении, так как участки часто не идеально выровнены, и изображения, возможно, придется обрезать позже.
- Возьмите эталонные изображения с меньшим увеличением, чтобы оценить контекст интересующей области, ее грубое расположение при различных увеличениях по отношению к границам секций и ориентировочные особенности в выборке. Используйте их для обозначения интересующего региона в других разделах.
- Дополнительно: для ссылок на экран используйте многоразовую клеевую шпаклевку, наклейки или кусок бумаги проектора (OHP), прикрепленный к экрану, чтобы разместить временные маркеры на экране, чтобы обеспечить рутинную повторную визуализацию одних и тех же объектов интересующей области в центре изображения по всему набору данных (см. желтые звезды на рисунке 1E).
- Используя эталонные изображения, перейдите к интересующей области на первом участке сетки и получите изображение при нужном увеличении.
ПРИМЕЧАНИЕ: При сохранении изображений запишите первое имя файла первого изображения серии и используйте последовательную номенклатуру именования, чтобы все имена изображений следовали последовательному порядку последовательных разделов. - Перейдите к следующему разделу и повторяйте шаг 5.7, пока все разделы не будут сфотографированы для интересующей области.
6. Экспорт изображений и регистрация выравнивания последовательной секции
- Экспортируйте файлы изображений, принадлежащие к одному стеку, в одну папку. Убедитесь, что папка отсортирована по имени файла.
ПРИМЕЧАНИЕ: В идеале изображения должны иметь одно и то же корневое имя и следовать порядку, в котором они были получены. - Откройте Fiji и нажмите на Файл | Импорт | Последовательность изображений.
- Нажмите на первое изображение папки и нажмите кнопку Открыть. Дождитесь появления всплывающего окна Параметры последовательности (рисунок 2A).
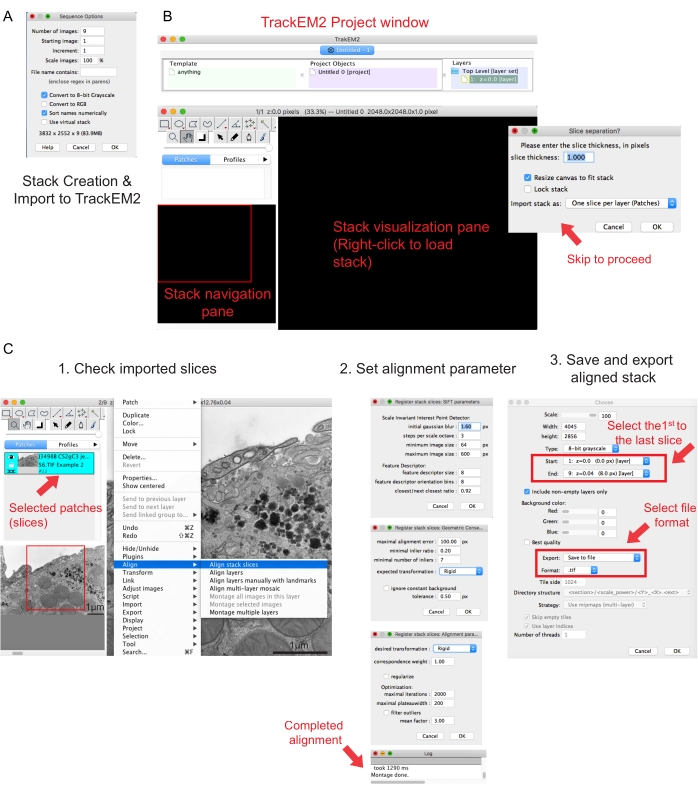
Рисунок 2: Создание последовательного стека и выравнивания последовательных секций с использованием Fiji. (A) Скриншот, показывающий параметры последовательности при загрузке изображений для создания последовательного стека. (B) Снимок экрана плагина TrackEM2 и ключевых окон плагина. Нажмите OK в разделении фрагментов, чтобы продолжить выравнивание. (C) Снимок экрана после успешной загрузки последовательного стека в панель визуализации. После выбора фрагментов стека «Выравнивание » появятся три последовательных окна параметров выравнивания. Экспортируйте выровненный стек после завершения выравнивания. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
- Щелкните Сортировать имена в числовом | Конвертировать в 8-битный параметр. Нажмите OK.
ПРИМЕЧАНИЕ: Преобразование в 8-бит облегчает импорт данных в Amira и уменьшает размер файла, что позволяет ускорить скорость обработки на последующих этапах. - Проверьте полноту, последовательность и увеличение созданного стека. Сохраните созданный стек в виде файла .tif.
ПРИМЕЧАНИЕ: Изображения должны были быть получены с одинаковым увеличением. - Запустите плагин TrakEM241. Перейти к файлу | Новые | ТрекЕМ2 (пустой).
ПРИМЕЧАНИЕ: Плагин попросит пользователя сохранить файлы TrackEM2. При необходимости сохраните файлы TrackEM2 в папку изображений. Должны появиться три окна: окно проекта, окно навигации стека (слева) и панель визуализации стека (рисунок 2B). - Щелкните правой кнопкой мыши черную панель визуализации. Нажмите Импортировать | Импортируйте стек и выберите ранее созданный стек.
- Нажмите кнопку ОК , чтобы загрузить стек в окно навигации стека.
ПРИМЕЧАНИЕ: Появится окно разделения фрагментов, чтобы запросить связь пикселей и размеров. Только для выравнивания стека нажмите кнопку ОК , чтобы пропустить этот шаг. - Используйте ползунок для проверки всех фрагментов стека. Найдите загруженный фрагмент, который будет отображаться как патч в навигационном плане. Выберите исправления, которые будут включены в следующее выравнивание.
ПРИМЕЧАНИЕ: Выбранные патчи станут синими. - Наведите указатель мыши на панель просмотра. Щелкните изображение правой кнопкой мыши и выберите «Выровнять | Выравнивание срезов стека (рисунок 2C-1).
- Укажите параметры выравнивания через набор из трех последовательных окон.
ПРИМЕЧАНИЕ: Для большинства данных начните с жесткого выравнивания (допускает вращение и перемещение, но не преобразование) и сохраните другие параметры по умолчанию (рисунок 2C-2). - Разрешите выравнивание до тех пор, пока в журнале считывания не будет указано Монтаж выполнен.
ПРИМЕЧАНИЕ: Время выполнения зависит от количества вокселей и скорости компьютера. - Проверьте выровненный стек в области просмотра. Нажмите клавиши Alt и - (на ПК) или клавиши Ctrl и - (на Mac) для уменьшения масштаба выровненного стека.
- Если выровненный стек удовлетворен, щелкните правой кнопкой мыши Экспорт | Сделайте плоское изображение , чтобы сохранить выровненный стек.
- Выберите первое изображение в качестве начала стека и последнее изображение в качестве конца стека, нажмите OK (рисунок 2C-3). Сохраните выровненный стек как .tif.
ПРИМЕЧАНИЕ: Чтобы уменьшить размер файла, обрежьте данные, чтобы они содержали только нужную интересующую область. - При необходимости выполните аффинное выравнивание на выровненном стеке. Откройте выровненный стек на Фиджи, выберите Плагин | Регистрационный | СтекРег.
- Выберите параметр аффина и нажмите OK. Дождитесь завершения программы.
- Сохраните стек, выровненный по размеру с аффинами, с другим именем файла.
7. Сегментация и 3D реконструкция
- ОткройтеAmira 42. Нажмите файл | Откройте Данные , чтобы загрузить выровненный стек.
- Укажите измерения вокселя в новом всплывающем окне (рисунок 3A).
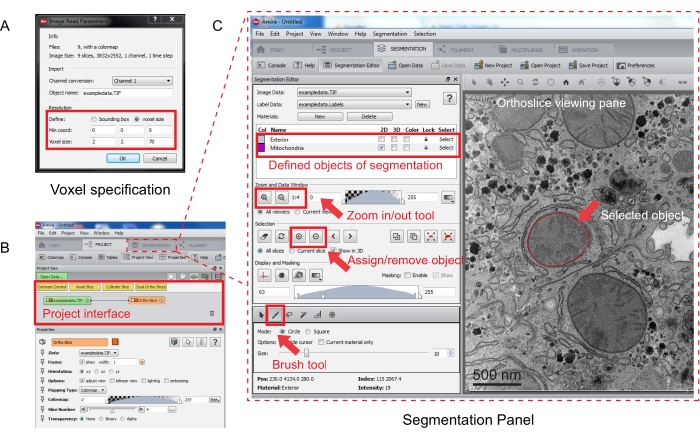
Рисунок 3: Сегментация последовательного стека с помощью Amira. (A) Всплывающее окно определения Voxel перед загрузкой выровненного стека. (B) Снимок экрана интерфейса проекта после импорта стека. Выберите вкладку Сегментация, чтобы начать трассировку объектов на панели Редактор сегментации. (C) Основные особенности вкладки сегментации. Определите объекты для сегментации в разделе Редактор сегментации вкладки Сегментация. Используйте функцию масштабирования для облегчения идентификации объектов. Выберите инструмент «Кисть» и проследите границу объекта. Щелкните символ + в разделе Выделение, чтобы назначить трассировку. Назначенный объект будет иметь красную границу в области просмотра ортослаза. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
ПРИМЕЧАНИЕ: Узел стека изображений появится в интерфейсе проекта, а ортослиц появится в области просмотра справа (рисунок 3B).
- Чтобы начать сегментацию, выберите вкладку Сегментация (рисунок 3B).
ПРИМЕЧАНИЕ: Рекомендуется сохранять ход сегментации до и во время сегментации. Перейти к | модели Сохранить модель как любой подходящий AM-файл. - Нажмите кнопку Создать на панели редактора сегментации, чтобы определить новые объекты в списке материалов. Щелкните правой кнопкой мыши, чтобы изменить цвет объекта, и дважды щелкните, чтобы переименовать объект.
- Для ручной сегментации выберите инструмент сегментации под списком материалов. Выберите инструмент «Кисть» по умолчанию, чтобы выделить пикселы (рисунок 3C).
ПРИМЕЧАНИЕ: Кроме того, можно использовать инструмент « Кисть » для трассировки контура объекта и нажать клавиши SHIFT+F для заливки объекта. - Чтобы преобразовать инструмент «Кисть » в ластик, постоянно нажимайте клавишу CTRL при выделении пикселов для коррекции. Аннотируйте каждый фрагмент в стеке.
- После подтверждения назначьте выделение метке, щелкнув знак + . Щелкните знак - чтобы удалить выделенную область.
- Вернитесь к интерфейсу проекта после завершения сегментации. Найдите узел с расширением ".label", подключенный к стеку изображений.
- Щелкните правой кнопкой мыши расширение ".label" и выберите Создать Surface | Применить для создания SURF-файла.
- Чтобы отобразить 3D-модель сегментированного объекта, щелкните правой кнопкой мыши файл .surf и выберите Вид Surface , чтобы создать 3D-модель в области просмотра.
- Сохраните 3D-модель для визуализации или дальнейшего количественного анализа.
Результаты
Для этого метода области, представляющие интерес, выбираются на основе цели биологического исследования и идентифицируются до обрезки и разрезания встроенной ткани. Аналогичным образом, размер грани блока может быть продиктован исследовательским вопросом; в этом случае образец обре?...
Обсуждение
Доступный метод vEM для визуализации структуры органелл и взаимодействий в 3D описан в этом протоколе. Морфология межорганных контактов в гепатоцитах представлена здесь в качестве тематического исследования. Однако этот подход также применялся для исследования множества других образц...
Раскрытие информации
У авторов нет конфликта интересов для раскрытия.
Благодарности
Мы благодарим Джоанну Хэнли, Ребекку Фиадейро и Аню Страатман-Ивановскую за экспертную техническую помощь. Мы также благодарим членов лаборатории Стефана и Яна Уайта за полезные обсуждения. J.J.B. поддерживается финансированием MRC Лаборатории молекулярной клеточной биологии MRC в UCL, код награды MC_U12266B. C.J.S. поддерживается финансированием MRC для Лаборатории молекулярной клеточной биологии MRC University Unit в UCL, код награды MC_UU_00012/6. P.G. финансируется Европейским исследовательским советом, код гранта ERC-2013-StG-337057.
Материалы
| Name | Company | Catalog Number | Comments |
| 0.22 µm syringe filter | Sarstedt | 83.1826.001 | |
| Aluminum trays | Agar Scientific | AGG3912 | |
| Amira v6 | ThermoFisher | https://www.thermofisher.com | |
| Chloroform | Fisher | C/4960/PB08 | |
| DDSA/Dodecenyl Succinic Anhydride | TAAB | T027 | Epon ingredient |
| Diamond knife | DiaTOME | ultra 45° | |
| DMP-30/2,4,6-tri (Dimethylaminomethyl) phenol | TAAB | D032 | Epon ingredient |
| Dumont Tweezers N5 | Agar Scientific | AGT5293 | |
| Fiji | https://imagej.net/ | ||
| Fiji TrakEM2 plugin | https://imagej.net/ | ||
| Formaldehyde 36% solution | TAAB | F003 | |
| Formvar coated slot grid | Homemade | Alternative: EMS diasum (FF2010-Cu) | |
| Glass bottle with applicator rod | Medisca | 6258 | |
| Glass vials | Fisher Scientific | 15364769 | |
| Gluteraldehyde 25% solution | TAAB | G011 | |
| MNA/Methyl Nadic Anhydride | TAAB | M011 | Epon ingredient |
| Osmium Tetroxide 2% solution | TAAB | O005 | |
| Potassium Ferricyanide | Sigma-Aldrich | P-8131 | |
| Propylene oxide | Fisher Scientific | E/0050/PB08 | |
| Reuseable adhesive | Blue Tack | ||
| Reynolds Lead Citrate | TAAB | L037 | Section stain |
| Sodium Cacodylate | Sigma-Aldrich | C-0250 | to make 0.1 M Caco buffer |
| Super Glue | RS Components | 918-6872 | Cyanoacrylate glue, Step 1.3 |
| TAAB 812 Resin | TAAB | T023 | Epon ingredient |
| Tannic acid | TAAB | T046 | |
| Triton X-100 | Sigma-Aldrich | T9284 | |
| Two part Epoxy Resin | RS Components | 132-605 | Alternative: Step 2.13 |
| Ultramicrotome | Leica | UC7 | |
| Vibrating microtome | Leica | 100 µm thick slices, 0.16 mm/s cutting at 1 mm amplitude . | |
| Weldwood Original Contact cement | DAP | 107 | Contact adhesive: Step 3.1.4 |
Ссылки
- Knoll, M., Ruska, E. Das elektronenmikroskop. Zeitschrift für Physik. 78 (5), 318-339 (1932).
- von Ardenne, M. Daselektronen-rastermikroskop. Zeitschrift für Physik. 109 (9), 553-572 (1938).
- Bang, B. H., Bang, F. B. Graphic reconstruction of the third dimension from serial electron microphotographs. Journal of Ultrastructure Research. 1 (2), 138-139 (1957).
- Birch-Andersen, A. Reconstruction of the nuclear sites of Salmonella typhimurium from electron micrographs of serial sections. Journal of General Microbiology. 13 (2), 327-329 (1955).
- Denk, W., Horstmann, H. Serial block-face scanning electron microscopy to reconstruct three-dimensional tissue nanostructure. PLoS Biology. 2 (11), 329 (2004).
- Peddie, C. J., Collinson, L. M. Exploring the third dimension: volume electron microscopy comes of age. Micron. 61, 9-19 (2014).
- Titze, B., Genoud, C. Volume scanning electron microscopy for imaging biological ultrastructure. Biology of the Cell. 108 (11), 307-323 (2016).
- Kornfeld, J., Denk, W. Progress and remaining challenges in high-throughput volume electron microscopy. Current Opinion in Neurobiology. 50, 261-267 (2018).
- Heymann, J. A., et al. Site-specific 3D imaging of cells and tissues with a dual beam microscope. Journal of Structural Biology. 155 (1), 63-73 (2006).
- Knott, G., Marchman, H., Wall, D., Lich, B. Serial section scanning electron microscopy of adult brain tissue using focused ion beam milling. Journal of Neuroscience. 28 (12), 2959-2964 (2008).
- Leighton, S. B. SEM images of block faces, cut by a miniature microtome within the SEM - a technical note. Scanning Electron Microscopy. , 73-76 (1981).
- Martone, M. E., Deerinck, T. J., Yamada, N., Bushong, E., Ellisman, M. H. Correlated 3D light and electron microscopy: use of high voltage electron microscopy and electron tomography for imaging large biological structures. Journal of Histotechnology. 23 (3), 261-270 (2000).
- Micheva, K. D., Smith, S. J. Array tomography: a new tool for imaging the molecular architecture and ultrastructure of neural circuits. Neuron. 55 (1), 25-36 (2007).
- Sjostrand, F. S. Ultrastructure of retinal rod synapses of the guinea pig eye as revealed by three-dimensional reconstructions from serial sections. Journal of Ultrastructure Research. 2 (1), 122-170 (1958).
- Ware, R. W. Three-dimensional reconstruction from serial sections. International Review of Cytology. 40, 325 (1975).
- Stevens, J. K., Davis, T. L., Friedman, N., Sterling, P. A systematic approach to reconstructing microcircuitry by electron microscopy of serial sections. Cognitive Brain Research. 2 (3), 265-293 (1980).
- Hoppe, W. Three-dimensional electron microscopy. Annual Review of Biophysics. 10, 563-592 (1981).
- Frank, J. . Electron tomography: methods for three-dimensional visualization of structures in the cell. , (2008).
- Baumeister, W. Electron tomography: towards visualizing the molecular organization of the cytoplasm. Current Opinion in Structural Biology. 12 (5), 679-684 (2002).
- Hoog, J. L., Schwartz, C., Noon, A. T., O'Toole, E. T. Organization of interphase microtubules in fission yeast analyzed by electron tomography. Developmental Cell. 12 (3), 349-361 (2007).
- Harris, K. M., Perry, E., Bourne, J., Feinberg, M., Ostroff, L., Hurlburt, J. Uniform serial sectioning for transmission electron microscopy. Journal of Neuroscience. 26 (47), 12101-12103 (2006).
- Jesior, J. C. Use of low-angle diamond knives leads to improved ultrastructural preservation of ultrathin sections. Scanning Microscopy Supplement. 3, 147-152 (1989).
- Studer, D., Gnaegi, H. Minimal compression of ultrathin sections with use of an oscillating diamond knife. Journal of Microscopy. 197, 94-100 (2000).
- Gay, H., Anderson, T. F. Serial sections for electron microscopy. Science. 120 (3130), 1071-1073 (1954).
- Bernhard, W., Rouiller, C. Close topographical relationship between mitochondria and ergastoplasm of liver cells in a definite phase of cellular activity. The Journal of Biophysical and Biochemical Cytology. 2, 73-78 (1956).
- Palade, G. E. An electron microscope study of the mitochondrial structure. The Journal of Histochemistry & Cytochemistry. 1 (4), 188-211 (1953).
- Wu, H., Carvalho, P., Voeltz, G. K. Here, there, and everywhere: The importance of ER membrane contact sites. Science. 361 (6401), (2018).
- Vance, J. E. Inter-organelle membrane contact sites: implications for lipid metabolism. Biology Direct. 15 (1), 24 (2020).
- Stefan, C. J. Endoplasmic reticulum-plasma membrane contacts: Principals of phosphoinositide and calcium signaling. Current Opinion in Cell Biology. 63, 125-134 (2020).
- Zaman, M. F., Nenadic, A., Radojicic, A., Rosado, A., Beh, C. T. Sticking with it: ER-PM membrane contact sites as a coordinating nexus for regulating lipids and proteins at the cell cortex. Frontiers in Cell and Developmental Biology. 8, 675 (2020).
- van Vliet, A. R., Sassano, M. L., Agostinis, P. The unfolded protein response and membrane contact sites: tethering as a matter of life and death. Contact. 1, 1-15 (2018).
- Cohen, S., Valm, A. M., Lippincott-Schwartz, J. Interacting organelles. Current Opinion in Cell Biology. 53, 84-91 (2018).
- Hariri, H., et al. Lipid droplet biogenesis is spatially coordinated at ER-vacuole contacts under nutritional stress. EMBO Reports. 19 (1), 57-72 (2018).
- Stefan, C. J., Trimble, W. S., Grinstein, S., Drin, G. Membrane dynamics and organelle biogenesis-lipid pipelines and vesicular carriers. BMC Biology. 15 (1), 102 (2017).
- Eisenberg-Bord, M., Shai, N., Schuldiner, M., Bohnert, M. A tether is a tether is a tether: tethering at membrane contact sites. Developmental Cell. 39 (4), 395-409 (2016).
- Scorrano, L., De Matteis, M. A., Emr, S., Giordano, F. Coming together to define membrane contact sites. Nature Communications. 10 (1), 1287 (2019).
- Lak, B., Li, S., Belevich, I., Sree, S. Specific subdomain localization of ER resident proteins and membrane contact sites resolved by electron microscopy. European Journal of Cell Biology. 100 (7), 151180 (2021).
- Collado, J., Kalemanov, M., Campelo, F., Bourgoint, C. Tricalbin-mediated contact sites control ER curvature to maintain plasma membrane integrity. Developmental Cell. 51 (4), 476-487 (2019).
- West, M., Zurek, N., Hoenger, A., Voeltz, G. K. A 3D analysis of yeast ER structure reveals how ER domains are organized by membrane curvature. Journal of Cell Biology. 193 (2), 333-346 (2011).
- Ilacqua, N., Anastasia, I., Raimondi, A., Lemieux, P. A three-organelle complex made by wrappER contacts with peroxisomes and mitochondria responds to liver lipid flux changes. Journal of Cell Science. 135 (5), 259091 (2022).
- Cardona, A., Saalfeld, S., Schindelin, J., Arganda-Carreras, I. TrakEM2 software for neural circuit reconstruction. PLoS One. 7 (6), 38011 (2012).
- Stalling, D., Westerhoff, M., Hege, H. -. C. Amira: A highly interactive system for visual data analysis. The Visualization Handbook. 38, 749-767 (2005).
- Hsieh, T. S., Chen, Y. J., Chang, C. L., Lee, W. R., Liou, J. Cortical actin contributes to spatial organization of ER-PM junctions. Molecular Biology of the Cell. 28 (23), 3171-3180 (2017).
- Anastasia, I., Ilacqua, N., Raimondi, A., Lemieux, P. Mitochondria-rough-ER contacts in the liver regulate systemic lipid homeostasis. Cell Reports. 34 (11), 108873 (2021).
- Cattin, A. L., Burden, J. J., Van Emmenis, L., Mackenzie, F. E. Macrophage-Induced Blood Vessels Guide Schwann Cell-Mediated Regeneration of Peripheral Nerves. Cell. 162 (5), 1127-1139 (2015).
- Lopes-da-Silva, M., et al. A GBF1-dependent mechanism for environmentally responsive regulation of ER-Golgi transport. Developmental Cell. 49 (5), 786-801 (2019).
- Banushi, B., Forneris, F., Straatman-Iwanowska, A., Strange, A. Regulation of post-Golgi LH3 trafficking is essential for collagen homeostasis. Nature Communications. 7, 12111 (2016).
- Rey, S. A., et al. Ultrastructural and functional fate of recycled vesicles in hippocampal synapses. Nature Communications. 6, 8043 (2015).
- Belicova, L., Repnik, U., Delpierre, J., Gralinska, E. Anisotropic expansion of hepatocyte lumina enforced by apical bulkheads. Journal of Cell Biology. 220 (10), 202303003 (2021).
- Kizilyaprak, C., Daraspe, J., Humbel, B. M. Focused ion beam scanning electron microscopy in biology. Journal of Microscopy. 254 (3), 109-114 (2014).
- Xu, C. S., Hayworth, K. J., Lu, Z., Grob, P. Enhanced FIB-SEM systems for large-volume 3D imaging. Elife. 6, 1-36 (2017).
- Parlakgül, G., Arruda, A. P., Cagampan, E., Pang, S. High resolution 3D imaging of liver reveals a central role for subcellular architectural organization in metabolism. bioRxiv. , (2020).
- Guerin, C. J., Kremer, A., Borghgraef, P., Lippens, S. Targeted studies using serial block face and focused ion beam scan electron microscopy. The Journal of Visualized Experiments: JoVE. (150), e59480 (2019).
- Kremer, A., et al. A workflow for 3D-CLEM investigating liver tissue. Journal of Microscopy. 281 (3), 231-242 (2021).
- Hayat, M. . Principles and techniques of electron microscopy: biological applications. , (2000).
- Wisse, E., Braet, F., Duimel, H., Vreuls, C. Fixation methods for electron microscopy of human and other liver. World Journal of Gastroenterology. 16 (23), 2851-2866 (2010).
- Hanley, J., Dhar, D. K., Mazzacuva, F., Fiadeiro, R. Vps33b is crucial for structural and functional hepatocyte polarity. Journal of Hepatology. 66 (5), 1001-1011 (2017).
- Deerinck, T. J., Bushong, E. A., Thor, A., Ellisman, M. H. NCMIR methods for 3D EM: a new protocol for preparation of biological specimens for serial block face scanning electron microscopy. Microscopy. 1, 6-8 (2010).
- Miranda, K., Girard-Dias, W., Attias, M., de Souza, W., Ramos, I. Three dimensional reconstruction by electron microscopy in the life sciences: An introduction for cell and tissue biologists. Molecular Reproduction and Development. 82 (7-8), 530-547 (2015).
- Yamaguchi, M., Chibana, H. A method for obtaining serial ultrathin sections of microorganisms in transmission electron microscopy. The Journal of Visualized Experiments: JoVE. (131), e56235 (2018).
- Hall, D. H., Hartwieg, E., Nguyen, K. C. Modern electron microscopy methods for C. elegans. Methods in Cell Biology. 107, 93-149 (2012).
- Hagler, H. K. Ultramicrotomy for biological electron microscopy. Methods in Molecular Biology. 369, 67-96 (2007).
- Arganda-Carreras, I., Beichel, R. R., Sonka, M. Consistent and elastic registration of histological sections using vector-spline regularization. Computer vision approaches to medical image analysis, CVAMIA 2006, Lecture Notes in Computer Science. 4241, 85-95 (2006).
- Belevich, I., Joensuu, M., Kumar, D., Vihinen, H., Jokitalo, E. Microscopy image browser: a platform for segmentation and analysis of multidimensional datasets. PLoS Biology. 14 (1), 1002340 (2016).
- Fiala, J. C. Reconstruct: a free editor for serial section microscopy. Journal of Microscopy. 218, 52-61 (2005).
- Kremer, J. R., Mastronarde, D. N., McIntosh, J. R. Computer visualization of three-dimensional image data using IMOD). Journal of Structural Biology. 116 (1), 71-76 (1996).
- Iudin, A., Korir, P. K., Salavert-Torres, J., Kleywegt, G. J., Patwardhan, A. EMPIAR: a public archive for raw electron microscopy image data. Nature Methods. 13 (5), 387-388 (2016).
- Xu, C. S., Pang, S., Shtengel, G., Muller, A. An open-access volume electron microscopy atlas of whole cells and tissues. Nature. 599 (7883), 147-151 (2021).
- Karabag, C., et al. Semantic segmentation of HeLa cells: An objective comparison between one traditional algorithm and four deep-learning architectures. PLoS One. 15 (10), 0230605 (2020).
- Heinrich, L., Bennett, D., Ackerman, D., Park, W. Whole-cell organelle segmentation in volume electron microscopy. Nature. 599 (7883), 141-146 (2021).
- Kim, J. S., Greene, M. J., Zlateski, A., Lee, K. Space-time wiring specificity supports direction selectivity in the retina. Nature. 509 (7500), 331-336 (2014).
- Spiers, H., Songhurst, H., Nightingale, L., de Folter, J. Deep learning for automatic segmentation of the nuclear envelope in electron microscopy data, trained with volunteer segmentations. Traffic. 22 (7), 240-253 (2021).
- Hasan, N. M., Gupta, A., Polishchuk, E., Yu, C. H. Molecular events initiating exit of a copper-transporting ATPase ATP7B from the trans-Golgi network. The Journal of Biological Chemistry. 287 (43), 36041-36050 (2012).
- Stoeck, I. K., Lee, J. Y., Tabata, K., Romero-Brey, I. Hepatitis C virus replication depends on endosomal cholesterol homeostasis. The Journal of Virology. 92 (1), 01196 (2018).
- Ma, X., Qian, H., Chen, A., Ni, H. M., Ding, W. X. Perspectives on mitochondria-ER and mitochondria-lipid droplet contact in hepatocytes and hepatic lipid metabolism. Cells. 10 (9), 2273 (2021).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены