Bu içeriği görüntülemek için JoVE aboneliği gereklidir. Oturum açın veya ücretsiz deneme sürümünü başlatın.
Method Article
Hepatositlerde Organeller Arası Temas Bölgelerinin Seri Kesitli Elektron Mikroskobu Kullanılarak Üç Boyutlu Karakterizasyonu
Bu Makalede
Özet
Karaciğerden hepatositlerdeki organeller veya diğer dokulardaki hücreler arasındaki membran temas bölgelerinin üç boyutlu ayrıntılarını elde etmek için basit ve kapsamlı bir protokoldür.
Özet
İletim elektron mikroskobu, uzun zamandır hücresel ultrayapının görselleştirilmesi için altın standart olarak kabul edilmiştir. Bununla birlikte, analiz genellikle iki boyutla sınırlıdır ve organeller arasındaki üç boyutlu (3D) ultra yapıyı ve fonksiyonel ilişkiyi tam olarak tanımlama yeteneğini engeller. Hacim elektron mikroskobu (vEM), hücresel ultrayapının mezo ölçekte, mikro ölçekte ve nano ölçekli çözünürlüklerde 3D olarak sorgulanmasını sağlayan tekniklerin bir koleksiyonunu tanımlar.
Bu protokol, seri kesit iletimi EM'sini (TEM) kullanarak vEM verilerini elde etmek için erişilebilir ve sağlam bir yöntem sağlar ve numune işlemenin teknik yönlerini tek, basit bir iş akışında dijital 3D rekonstrüksiyona kadar kapsar. Bu tekniğin yararlılığını göstermek için, endoplazmik retikulum ve mitokondri arasındaki 3D ultrastrüktürel ilişki ve karaciğer hepatositlerindeki temas bölgeleri sunulmuştur. Organeller arası temaslar, iyonların, lipitlerin, besinlerin ve diğer küçük moleküllerin organeller arasındaki transferinde hayati rol oynar. Bununla birlikte, hepatositlerdeki ilk keşiflerine rağmen, fiziksel özellikleri, dinamikleri ve işlevleri hakkında öğrenilecek çok şey var.
Organeller arası temaslar, iki organelin birbirine yakınlığında (tipik olarak ~ 10-30 nm) ve temas bölgesinin kapsamında (noktalama kontaklarından daha büyük 3D sarnıç benzeri kontaklara kadar) değişen bir dizi morfoloji görüntüleyebilir. Yakın temaslıların incelenmesi yüksek çözünürlüklü görüntüleme gerektirir ve seri kesit TEM, hepatosit farklılaşması sırasında organeller arası temasların 3D ultrastrüksiyonunu ve metabolik hastalıklarla ilişkili hepatosit mimarisindeki değişiklikleri görselleştirmek için çok uygundur.
Giriş
1930'lardaki icatlarından bu yana, elektron mikroskopları araştırmacıların hücrelerin ve dokuların yapısal bileşenlerini görselleştirmelerine izin verdi 1,2. Çoğu araştırma, 3D modeller oluşturmak için özenli seri bölüm toplama, manuel fotoğrafçılık, negatif işleme, manuel izleme ve cam, plastik veya strafor 3,4 tabakalarından 3D modellerin oluşturulması ve montajı gerektiğinden, 2D bilgi sağlamıştır. Neredeyse 70 yıl sonra, mikroskop performansı, seri bölüm toplama, otomatik dijital görüntüleme, 3D rekonstrüksiyon, görselleştirme ve analiz için sofistike yazılım ve donanımdan, şimdi toplu olarak hacim EM (vEM) olarak adlandırılan alternatif yaklaşımlara kadar, sürecin birçok alanında önemli ilerlemeler olmuştur. Bu vEM tekniklerinin genellikle mikron ölçeklerinde nanometre çözünürlüklerinde 3D ultrayapısal bilgi sağladığı ve iletim elektron mikroskobu (TEM) ve daha yeni taramalı elektron mikroskobu (SEM) tekniklerini kapsadığı düşünülmektedir; Bkz.yorumlar 5,6,7,8.
Örneğin, odaklanmış iyon ışını SEM (FIB-SEM), bloğun yüzeyinin sıralı SEM görüntüleme taramaları arasında bloğun yüzeyini frezelemek için bir SEM içinde odaklanmış bir iyon ışını kullanır, böylece bir numunenin tekrarlanan otomatik frezelenmesine / görüntülenmesine ve yeniden yapılanma için bir 3D veri kümesi oluşturulmasına izin verir 9,10. Buna karşılık, seri blok yüzü SEM (SBF-SEM), görüntüleme 11,12'den önce blok yüzünden materyali çıkarmak için SEM içinde bir ultramikrotom kullanırken, dizi tomografisi, 3D veri kümesini oluşturmak için SEM'deki sıralı bölümlerdeki ilgi alanını görüntülemek için otomatik bir iş akışı kurmadan önce, seri bölümlerin, kapaklara, gofretlere veya bantlara toplanmasını gerektiren tahribatsız bir işlemdir13 . Dizi tomografisine benzer şekilde, seri kesit TEM (ssTEM), fiziksel kesitlerin görüntülemeden önce toplanmasını gerektirir; ancak, bu bölümler TEM ızgaralarında toplanır ve bir TEM 14,15,16'da görüntülenir. ssTEM tilt tomografi17,18,19 yapılarak genişletilebilir. Seri eğimli tomografi x, y ve z'de en iyi çözünürlüğü sağlar ve tüm hücreleri20 yeniden yapılandırmak için kullanılmış olsa da, oldukça zordur. Bu protokol, şu anda özel bölümleme veya vEM cihazlarına erişimi olmayan ancak 3D vEM verileri oluşturmaktan fayda sağlayacak birçok EM laboratuvarı için mevcut olan en erişilebilir vEM tekniği olarak ssTEM'in pratik yönlerine odaklanmaktadır.
3D rekonstrüksiyon için seri ultramikrotomi daha önce zor olarak kabul edildi. Eşit kesit kalınlığındaki düz şeritleri kesmek, doğru boyuttaki şeritleri doğru sırayla, yeterli desteğe sahip ızgaralara yerleştirebilmek ve alabilmek zordu, ancak ilgi alanlarını gizleyen ızgara çubukları olmadan ve en önemlisi, bölümleri kaybetmeden, tamamlanmamış bir seri tam 3D rekonstrüksiyonu önleyebilir21. Bununla birlikte, ticari ultramikrotomlar, elmas kesme ve kırpma bıçakları 22,23, ızgaralar 21,24 üzerindeki elektron parlaklığı destek filmleri ve kesit yapışmasına ve şerit korumasına yardımcı olmak için yapıştırıcılar 13,21'deki iyileştirmeler, tekniği birçok laboratuvarda daha rutin hale getiren yıllar içindeki artan gelişmelerden sadece birkaçıdır. Seri kesitler toplandıktan sonra, TEM'deki seri görüntüleme basittir ve x ve y cinsinden subnanometre px boyutlarına sahip EM görüntüleri sağlayabilir ve hücre altı yapıların yüksek çözünürlüklü sorgulanmasına izin verebilir - birçok araştırma sorusu için potansiyel bir gereklilik. Burada sunulan vaka çalışması, karaciğer hepatositlerinde endoplazmik retikulum (ER)-organel temaslarının incelenmesinde ssTEM ve 3D rekonstrüksiyonun kullanımını göstermektedir ve burada ER-organel temasları ilk kez gözlenmiştir25,26.
Nükleer zarfla bitişik olmakla birlikte, ER ayrıca lizozomlar, mitokondri, lipit damlacıkları ve plazma zarı27 dahil olmak üzere çok sayıda diğer hücre organelleriyle yakın temas kurar. ER-organel temasları lipid metabolizması28, fosfoinositid ve kalsiyum sinyalizasyonu29, otofaji regülasyonu ve stres yanıtı30,31 ile ilişkilendirilmiştir. ER-organel temasları ve diğer organeller arası temaslar, hücresel metabolik ihtiyaçlara ve hücre dışı ipuçlarına cevap veren oldukça dinamik yapılardır. Morfolojik olarak boyut ve şekillerinde ve organel zarları arasındaki mesafelerde32,33 olarak değiştiği gösterilmiştir. Bu ultrastrüktürel farklılıkların farklı protein/lipid bileşimlerini yansıtması ve34,35 fonksiyonunu yansıtması muhtemeldir. Bununla birlikte, organlar arası temasları tanımlamak ve bunları analiz etmek hala zor bir görevdir36. Bu nedenle, daha ileri araştırmalar için organlar arası temasları incelemek ve karakterize etmek için güvenilir ancak basit bir protokol gereklidir.
ER-organel kontakları membrandan membrana ayırmada 10 ila 30 nm arasında değişebildiğinden, tanımlama için altın standart tarihsel olarak TEM olmuştur. İnce kesitli TEM, farklı membran temaslarında yerleşik ER proteinleri için spesifik alt alan lokalizasyonu ortaya koymuştur37. Geleneksel olarak, bu, nm çözünürlüklü ER-organel temaslarını ortaya çıkarmıştır, ancak genellikle bu etkileşimlerin yalnızca 2D bir görünümünü sunmuştur. Bununla birlikte, vEM yaklaşımları, bu temas bölgelerinin ultrayapısal sunumunu ve bağlamını 3D olarak ortaya koyarak, temasların tam olarak yeniden yapılandırılmasını ve kontakların daha doğru sınıflandırılmasını (nokta vs boru şeklindeki ve sarnıç benzeri) ve nicelleştirme38,39'u mümkün kılmaktadır. ER-organel temaslarının 25,26 gözlendiği ilk hücre tipi olmasının yanı sıra, hepatositler mimarilerinde ve fizyolojilerinde hayati roller üstlenen diğer organeller arası temaslardan oluşan kapsamlı bir sisteme sahiptir28,40. Bununla birlikte, hepatositlerde ER-organel ve diğer interorganel temaslarının tam morfolojik karakterizasyonu hala eksiktir. Buna göre, rejenerasyon ve onarım sırasında organeller arası temasların nasıl oluştuğu ve yeniden şekillendiği, hepatosit biyolojisi ve karaciğer fonksiyonu ile özellikle ilgilidir.
Access restricted. Please log in or start a trial to view this content.
Protokol
Tüm hayvanlar İngiltere İçişleri Bakanlığı yönergelerine uygun olarak barındırıldı ve doku hasadı 1986 İngiltere Hayvan (Bilimsel Prosedürler) Yasası'na uygun olarak gerçekleştirildi.
1. Numune sabitleme ve hazırlama
- Karaciğer dokusunu yaklaşık 8 mm x 8 mm x 3 mm boyutlarında parçalara ayırın ve parçaları ılık fosfat tamponlu salin (PBS, 37 °C) içine yerleştirin.
- Karaciğer parçalarına oda sıcaklığında (20-25 °C) fiksatif (% 1 sakarozda% 1.5 glutaraldehit, 0.1 M sodyum kakodilat) enjekte edin ve bunları PBS'den oda sıcaklığında 20 dakikaya kadar fiksatife aktarın. Kurumasını önlemek için dokuyu daima çözeltilere batırılmış halde tutun.
NOT: Aldehitler, korozif ve potansiyel olarak kanserojen olan tahriş edici maddelerdir. Sodyum kakodilat yutulursa veya solunduğunda toksiktir. Tüm sabitleyiciler, uygun kişisel koruyucu ekipman giyilirken kullanılmalı ve deney bir duman başlığında yapılmalıdır. İyi fiksasyon daha sıkı bir doku ile sonuçlanacaktır. - Titreşimli mikrotomu bir bıçak, buz banyosu ve soğuk PBS dolu bir tampon tepsisi ile ayarlayın. İlk sabit karaciğer dokusu parçasını siyanoakrilat yapıştırıcı ile bir numune tutucuya monte edin ve bloğu titreşen mikrotoma aktarın.
- Üreticinin tavsiyelerine uyarak, dokuya yaklaşın ve sabit karaciğeri 100 μm kalınlığında dilimler halinde dilimleyin.
- Bir spatula veya doğal saç boya fırçası kullanarak dilimleri toplayın ve buz üzerinde buz gibi soğuk sabitleme (% 1.5 glutaraldehit, 0.1 M sodyum kakodilat) içeren 12 veya 24 kuyulu bir kaba aktarın. Tüm numuneler dilimlenene ve daha fazla işlenmeye hazır olana kadar dilimleri buz üzerinde bırakın.
- Daha fazla işleme için ilgilenilen bölgeleri içeren dilimleri seçin ve nazik bir ajitasyonla yıkayın. 12 veya 24 delikli bir tabakta oda sıcaklığı 0,1 M sodyum kakodilat ile üç, 5 dakikalık yıkamalar gerçekleştirin ve dilimlerin serbestçe hareket etmesi için yeterli tampona sahip olduğundan emin olun.
NOT: Genel olarak, ilgilenilen bölgeler, çalışmanın biyolojik sorusuyla ilgili anatomik özelliklere dayanarak seçilir ve örneğin bölümün kenarında olmayan ve iyi korunmuş olan tüm seride bulunması muhtemel doku bölgeleri tarafından yönlendirilir. - Bir duman davlumbazında, 0,1 M sodyum kakodilatı taze hazırlanmış% 1 osmiyum tetroksit / % 1,5 potasyum ferrisiyanür ile değiştirin. 12 veya 24 delikli tabağı kapalı bir kaba koyun ve kabı 1 saat boyunca tehlikeli kimyasal bir buzdolabına aktarın.
NOT: Osmiyum, yutulması, solunması ve cilt teması durumunda son derece tehlikelidir. Potasyum ferrisiyanür tahriş edici bir maddedir ve inhalasyon ve cilt teması ile zararlıdır. Her zaman uygun kişisel koruyucu ekipman kullanın ve deneyi bir duman davlumbazında gerçekleştirin. - Bir duman davlumbazında, ozmiyum tetroksit / potasyum ferrisiyanürü özel bir ozmiyum atık şişesine çıkarın ve numuneleri üç kez 0,1 M sodyum kakodilat ile 5 dakika boyunca yıkayın. Numuneleri gece boyunca 4 °C'de kapalı bir kapta bırakın.
NOT: Olası duraklama noktası. Numuneler, 0,1 M sodyum kakodilat içinde 4 ° C'de kapalı bir kapta haftalarca saklanabilir ve korunmaya çok az zarar verebilir. Kurumayı önlemek için yeterli tampon bulunduğundan emin olun. - Numuneleri taze hazırlanmış% 1 tanik asit ile 0.05 M sodyum kakodilat içinde oda sıcaklığında karanlıkta 45 dakika boyunca inkübe edin.
NOT: Tanik asit tahriş edicidir ve göz hasarına neden olabilir. Uygun kişisel koruyucu ekipman giyin ve deneyi bir duman başlığında yapın. - Dehidrasyon ve gömme işleminden önce ddH2O ile üç adet 5 dakikalık yıkama gerçekleştirin.
2. Numune dehidrasyon, Epon reçinesinin gömülmesi ve montajı
- Epon reçinesini ağırlıkça aşağıdaki orana göre hazırlayın (bkz. adım 2.2). Bir karıştırma çubuğu içeren 100 mL tek kullanımlık plastik beher ile bir teraziyi darmadağın edin. 5 adet tek kullanımlık plastik Pasteur pipetin uçlarını kesin ve viskoz reçine bileşenlerini beherin içine aktarmak için bunları kullanın.
- Beherin içine sırasıyla 19.2 g reçine-812, 7.6 g DDSA, 13.2 g MNA ve 0.8 g DMP-30 hızlandırıcı ekleyin. Beşinci temiz plastik Pasteur pipeti kullanarak, reçine bileşenlerini elle iyice karıştırın.
NOT: Kabarcıklar sokmaktan kaçının, ancak renk değişikliği ve bileşen katmanlarının kabaca karıştırılmasını sağlamak için alt reçinenin üst kısımla yeterli şekilde karıştırıldığından emin olun. Tüm reçine bileşenleri tahriş edicidir ve inhalasyon ve cilt teması ile zararlıdır. DMP-30 aşındırıcıdır ve cilt korozyonuna neden olabilir. Uygun kişisel koruyucu ekipman giyin. - Beheri manyetik bir karıştırıcıya yerleştirin ve reçineyi periyodik olarak manuel olarak karıştırarak hafifçe karıştırmaya bırakın.
- Numuneleri% 70 etanol ile 5 dakika boyunca nazik ajitasyonla yıkayın; bir kez tekrarlayın.
- Numuneleri% 90 etanol ile 5 dakika boyunca nazik ajitasyonla yıkayın; bir kez tekrarlayın.
- Numuneleri% 100 etanol ile 5 dakika boyunca nazik ajitasyonla yıkayın; bir kez tekrarlayın.
- Numuneler bir davlumbazda %100 etanol yıkamalarda bulunurken, propilen oksit (PO) dirençli plastik kapaklı bir cam şişede 50:50 (v/v) propilen oksit (PO):Epon karışımı hazırlayın. Cam şişe kapağını dikkatlice ama güvenli bir şekilde klipsleyin ve hem kapağı hem de şişeyi tutarken, karıştırmak için sallayın veya girdap yapın.
NOT: Propilen oksit, bazı plastikleri çözen akut toksik, yanıcı bir tahriş edicidir. Uygun kişisel koruyucu ekipman giyin ve deneyi bir duman başlığında yapın. - Adım 2.6'dan sonra, numuneleri PO'ya dayanıklı bir kapta (örneğin, alüminyum tepsiler veya cam şişeler) 1 saat boyunca PO:Epon ile, duman davlumbazında hafifçe sallanma/çalkalama ile inkübe edin.
- Duman davlumbazında, numuneleri% 100 Epon'a aktarın. Sallanma/rotasyon/ajitasyon ile davlumbazda oda sıcaklığında 2 saat inkübe edin. PO: Epon karışımını özel bir cam Epon atık şişesine aktarın.
- Adım 2.9'u bir kez yineleyin.
- Katıştırmak için örnekleri bağlayın. Dilimlerin boyutuna ve ilgilenilen bölgeye bağlı olarak, dilimleri doğrudan prepolimerize reçine saplamalarına monte edin veya diseksiyon için düz gömün ve daha sonraki bir tarihte yeniden gömün.
NOT: Düz gömme için, aynı anda birçok dilimi gömmek için bir "döküm-a slaytı" kullanılabilir. Artık reçine, ışın kapsüllerini doldurmak için kullanılabilir ve prepolimerize saplamalar yapmak için pişirilebilir veya daha sonra kullanılmak üzere dondurulabilir. - "Döküm-a slayt" boşluğunu doldurmak için yeterli reçineye monte edildikten ve kaplandıktan sonra, numuneleri gece boyunca 60 ° C'lik bir fırında pişirin.
NOT: Olası duraklama noktası. Numuneler yıllarca oda sıcaklığında saklanabilir. - Yeniden gömmek için, düz gömülü doku dilimlerinde ilgilenilen bölgeyi tanımlayın. Bir kuyumcu testeresi kullanarak, uygun boyuttaki (1 mm 2 ila 4mm2) doku parçasını kesin ve2.2. adımda olduğu gibi hazırlanan reçineyi kullanarak prepolimerize bir bloğun üstüne tekrar gömün ve gece boyunca 60 ° C'lik bir fırında pişirin.
NOT: Alternatif olarak, doku parçası iki parçalı epoksi reçine ile bir saplama veya pime yapıştırılabilir. Gece boyunca ayarlamak için bırakın. Potansiyel duraklama noktası.
3. Gömülü numunelerin kırpılması ve seri bölümlenmesi
NOT: Bölümleme öğrenilmiş bir beceridir; kullanıcılar seri kesitlemeyi denemeden önce ultra ince kesitleme konusunda yetkin olmalıdır. Tam mikrotom kontrolleri üreticiler arasında farklılık gösterdiğinden, üreticinin talimatlarına ve yönergelerine uyun.
- Numune kırpma adaptöründe kilitliyken, reçineye gömülü dokuyu aşağıdaki kriterleri karşılayacak şekilde dikkatlice kesmek için bir tıraş bıçağı kullanın (bkz. Şekil 1A,B):
- İlgilenilen bölgenin etrafındaki dokuyu açığa çıkaran düz, üst bir yüzey olduğundan emin olun.
- Üst ve alt kenarları temiz ve paralel olacak şekilde yamuk bir şekil sağlayın.
- X'te 200-500 μm, y'de 100-500 μm genel boyutlar sağlayın.
- Asimetrik bir blok yüzü sağlayın, örneğin , ~ 90 ° 'lik sağ yan köşeler, sol üst köşe genişliği ve sol alt köşe akut.
NOT: Bir kırpma kriyobıçağı, tıraş bıçağı için alternatif bir araç olabilir. Diğer öneriler, görüntüleme sırasında bölümleri sipariş etmek için kullanıcıya kolaylık sağlamak içindir. İsteğe bağlı: Kesitler kararlı şeritler oluşturamazsa, şerit oluşumuna yardımcı olmak için blok yüzünün ön kenarına bir temas çimentosu uygulanabilir. Jilet bıçakları keskindir; Jilet bıçağını tutmaya özen gösterin, böylece kazara kaymalar kişisel zarara neden olmaz.
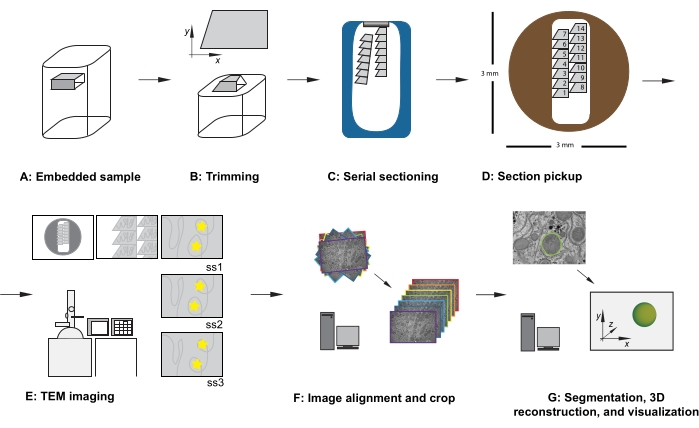
Resim 1: Seri kesit TEM iş akışı . (A) Reçine bloğundaki numunenin diyagramı. (B) Bilinen yönü sağlamak için seri kesitleme için uygun kenarlara ve asimetrik blok yüzüne sahip yamuk bir şekil oluşturmak için bloğu kırpın. (C) Elmas bıçaklı teknede su yüzeyinde yüzen seri kesitlerin şeritlerini gösteren diyagram. (D) 3 mm çapında bir TEM yuva ızgarası üzerinde, kesit ve şerit organizasyonunu gösteren, kesitlerin sırasını dikte eden diyagram. (E) TEM görüntüleme ve navigasyon. Şerit ve bölüm sırasını gösterme ve sonraki bölümlerde aynı ilgi alanının yeniden görüntülenmesini sağlamak için ekran referansı için monitörde "sarı yıldız çıkartmaları" kullanma. (F) Görüntü hizalama ve kırpma. (G) Segmentasyon, 3B yeniden yapılandırma ve görselleştirme. Kısaltma: TEM = transmisyon elektron mikroskobu. Bu şeklin daha büyük bir versiyonunu görüntülemek için lütfen buraya tıklayın.
- Kesildikten sonra, numune arkını, ayna ve numune ile birlikte, mikrotomun numune koluna aktarın ve numune arkını, arkın hareket aralığı yukarıdan aşağıya doğru ilerleyecek şekilde konumlandırın; numune arkını yerine sabitleyin.
- Elmas bıçağı bıçak tutucuya yerleştirin ve kilitleyin, kesme açısının bıçağa uygun şekilde ayarlandığından emin olun. Bıçak tutucuyu sahneye güvenli bir şekilde kilitleyin.
- Sahne açıldığında, blok yüzü ile bıçağın kenarı arasındaki ilişkiyi sürekli kontrol ederken bıçak ilerlemesini kullanın. Bıçağı numuneye doğru dikkatli bir şekilde ilerletin, blok bıçağın kenarına hizalanana kadar ilgili düğmeleri ayarlayarak bıçağın yanal açısını, numune eğimini ve numune dönüşünü sürekli olarak ayarlayın.
- Sahne alanı aydınlatmasını kapatın; sahne aydınlatmasını açın; numune kolunun kesme penceresinin üstünü ve altını ayarlayın; ve örneği bıçak kenarının hemen altında bırakın.
- Bıçaklı tekneyi temiz ddH2O ile doldurun ve su yüzeyinin bıçağın kenarı ile aynı hizada ve sadece hafif içbükey olduğundan emin olun.
- İsteğe bağlı: Bir kirpik %0,1 Triton X-100'e daldırın ve ardından kloroform ve şerit toplamaya yardımcı olmak için suyun yüzey gerilimini azaltmak için bıçaklı tekne suyuna batırın.
- İş istasyonunu kirpikler (kokteyl çubuğuna yapıştırılmış kirpik), formvar kaplı yuva ızgaraları, etiketli çapraz forsepsler, kloroform, %0,1 Triton X-100 çözeltisi, damıtılmış su, filtre kağıdı ve ızgara kutusu notalı ızgara kutusu ile hazırlayın.
- Kesme hızını 1 mm / s'ye ve ilk kesme kalınlığını 100 nm'ye ayarlayın ve kesme döngüsünü başlatın.
- İlk bölüm kesildikten sonra, kesme parametrelerini 0,8 mm / s'de bir kesme hızına ve kesme kalınlığını 70 nm'ye değiştirin ve kesmeye devam ederek bölümlerin su dolu bıçaklı teknenin yüzeyinde hareket eden bir şerit oluşturmasına izin verin (Şekil 1C).
NOT: Üretilen bölümlerin renginin farkında olmak önemlidir, çünkü bu genellikle reçine kesitlerinin kalınlığı için daha doğru bir kılavuzdur. Gümüş bölümler genellikle yaklaşık 70 nm kalınlığındayken, gri bölümler daha ince ve altın bölümler daha kalındır. - Mikrotomun bölümleri kesmeye devam etmesine ve şeridin uzamasına izin verin.
NOT: Odadaki büyük titreşimlerden ve fiziksel rahatsızlıklardan kaçınmak önemlidir. Taslaklar, bölümlerin bıçaklı teknedeki su yüzeyinde hareket etmesine neden olabilir ve fiziksel titreşimler mikrotomun düzensiz kesilmesine neden olabilir. - Yeterli bölüm toplandıktan sonra ve kurdele teknenin sonuna gelmeden önce, kesmeyi durdurun (numune bıçağın kenarını geçtikten hemen sonra).
NOT: Gerekli bölüm sayısı, blok yüzünün boyutuna ve toplanacak veri kümesinin boyutuna bağlıdır. Bu nedenle, kesilen bölümler çıkarken bloğun boyutu ile yuva ızgarası arasındaki ilişkinin farkında olmakta fayda vardır. - Her elinizde bir kirpik kullanarak, şeridi yavaşça yuva ızgarasının uzunluğuna sığabilecek daha küçük şeritlere ayırın ve numunenin içinden göreceli konumlarını not etmeye özen gösterin.
NOT: Birleşik genişlikleri uyuyorsa, birden fazla şerit nazikçe yan yana yerleştirilebilir ve tek bir yuva ızgarasında bir araya getirilebilir. Tek bir yuva ızgarasında birden fazla şerit alıyorsanız, şeritlerin sırasına ve göreceli konumuna dikkat edin. Örneğin, şeritleri her zaman numunede zaten bulunan bir şeridin sağındaki numunenin içine yerleştirin (Şekil 1D). - İsteğe bağlı: Bir cam aplikatör çubuğu kullanarak, düzleştirmek için bölümlerin üzerine bir damla kloroform getirin.
NOT: Kloroform toksiktir ve tahriş edicidir. Kloroformun su yüzeyine veya bölümlerine temas etmesine izin vermeyin. Yanlışlıkla olursa, suyun çıkarılması ve bıçağın bölümlemeye dönmeden önce yıkanması gerekir. Kloroform bölümlere zarar verebilir ve elması bıçaklı tekneye sabitleyen yapıştırıcıyı bozabilir. - İlk numaralı forsepsleri kullanarak, ilk boş yuva ızgarasını alın (yuvanın sağ tarafında, formvar tarafı aşağıda), Triton X-100'e hafifçe daldırın ve ardından bir parça filtre kağıdı kullanarak forseps kenarından fazla suyu çıkarmadan önce iki kez damıtılmış suya batırın.
- Bir elinizde kirpik ve diğer elinizde forseps ile, formvar kaplı yuvaızgarasının yaklaşık 2 / 3'ünü bıçak teknesinin suyuna (bölümlerden uzakta) yavaşça indirin, böylece formvar tarafı aşağıya bakar ve yuvanın sağ taraftaki uzun kenarı suyun yüzeyinde ve suyun kenarına paraleldir.
- Izgarayı yavaşça sudaki şeritlere doğru kaydırın, böylece dönüş vuruşunda bölümler ızgaraya doğru sürüklenir. Bunu, şeridin sağ kenarı yuvanın sağ kenarıyla aynı hizaya gelene kadar daha küçük ve daha küçük waft'larda yapmaya devam edin. Ardından, son waft ile, bölümleri yuva ızgarasına almak için ızgarayı yavaşça yukarı kaldırın.
- Forsepsteki ızgarayı, ızgara kutusu referans sayfasına uygun şekilde açıklama eklenmiş ızgara kutusunda saklamadan önce kurumaya bırakın.
- Tüm şeritler toplanana kadar adım 3.16'yı yineleyerek şeritlerin sırasının korunduğundan emin olun.
- Başka bölümler gerekirse, bıçağı 150 nm kadar geri çekin, teknedeki su seviyesini kontrol edin ve gerekirse daha fazlasını ekleyin. 3.11-3.18 adımlarını izleyerek kesme işlemine tekrar başlayın.
- Tüm bölümler toplandıktan sonra, bıçak kenarının kesit kalıntılarından arındırılmış olduğundan emin olun, bıçağı blok yüzünden uzağa geri çekin ve bıçağı çıkarın ve temizleyin.
4. Izgara boyama
- Kuruduktan sonra, bölümleri Reynolds'un kurşun sitratı ile banktaki parafilm üzerine veya bir Petri kabına boyayın. Karbondioksit içermeyen bir ortam sağlamak için Petri kabı kapağının altına birkaç sodyum hidroksit topağı yerleştirin. Daha sonra, dikkatli bir şekilde, peletlerden uzakta, her ızgara için bir tane olmak üzere parafilm üzerinde Reynolds'un kurşun sitratından 40 μL damla pipet.
NOT: Aynı anda çok fazla ızgarayı lekelemeyin; Örneğin, maksimum 6 olmalıdır. Doğrudan boyama kabının üzerinde nefes almamaya çalışın. Karbondioksit kurşun sitrat ile reaksiyona girebilir ve ızgaralarda istenmeyen çökeltiye neden olabilir. - Her ızgarayı (bölüm tarafı aşağı) kurşun sitrat damlasına ters çevirin ve Petri kabı kapağı tarafından 7 ila 10 dakika boyunca korunarak bırakın. Izgaralar lekelenirken, her ızgara için beş adet 300 μL damla damıtılmış su ile tezgahta daha büyük bir ikinci parafilm parçası hazırlayın.
- Kurşun sitrat inkübasyonunun sonunda, her ızgarayı doğrudan ızgaralarda nefes almadan 1 dakika boyunca yıkamak için bir damla damıtılmış su damlacığına aktarın.
- Adım 4.3'ü toplam beş kez yineleyin.
- Numaralandırılmış çapraz forseps kullanarak, ilk ızgarayı alın, suyun çoğunu fitillemek için kağıdı filtrelemek için ızgaranın kenarına dokunun ve forsepslerde kurumaya bırakın (en az 20 dakika boyunca). Her ızgara için tekrarlayın.
5. TEM ile görüntüleme alımı
NOT: Tam TEM kontrolleri üreticiler arasında farklılık gösterdiğinden, üreticinin talimatlarına ve yönergelerine uyun. Aşağıdaki adımlar, TEM kullanımında zaten yetkin olan kullanıcılar tarafından gerçekleştirilmelidir.
- Görüntülemeden önce, ışın hizalaması, referanslar kazanma ve numune ösentrikliği gibi olağan kontrolleri gerçekleştirin.
- Seri bölümlerin ilk ızgarasını numune tutucuya dikkatlice yükleyin, yuvayı (ve dolayısıyla bölümleri) mikroskop aşamasının dikey eksenine hizalamaya.
NOT: Bu doğruluk gerekli değildir, ancak edinme ve gelecekteki veri işleme aşamalarında zaman kazandırır. Kılavuzu eklerken (bölüm tarafı aşağı veya bölüm tarafı yukarı), tüm ızgaraları aynı yönde görüntülemeye dikkat edin. - Düşük büyütmede, seri bölümlerin sırasını, konumunu ve konumunu gözlemleyin (Şekil 1E). Kılavuzdaki serinin orta bölümüne gidin.
NOT: Araştırmanın tam amacına bağlı olarak, görüntüleme yaklaşımları değişebilir; ancak, aşağıdakiler yararlı bir başlangıç noktasıdır. Bölümlerin şekli ve şeritlerin ilişkisi (adım 3.14'te alındığı gibi), ızgarada hangi bölümün ilk ve hangi bölümün sonuncu olduğunu belirler. - Örneğe göz atın ve ilgilendiğiniz bir bölge belirleyin. Numuneyi istenen büyütmede gözlemleyin ve bölümler genellikle mükemmel bir şekilde hizalanmadığından ve görüntülerin daha sonra kırpılması gerekebileceğinden, seriyi biraz daha düşük bir büyütmede toplamayı düşünün.
- İlgilenilen bölgenin bağlamını, bölüm sınırlarına göre farklı büyütmelerdeki kaba konumunu ve numune içindeki yer işareti özelliklerini takdir etmek için referans görüntüleri daha düşük büyütmelerde alın. İlgilenilen bölgeyi diğer bölümlere imzalamak için bunları kullanın.
- İsteğe bağlı: Ekran referansı için, veri kümesi boyunca görüntünün merkezinde ilgilenilen bölgenin aynı özelliklerinin rutin olarak yeniden görüntülenmesini sağlamak üzere ekrana geçici işaretçiler yerleştirmek için ekrana bantlanmış yeniden kullanılabilir yapışkan macun, çıkartmalar veya bir parça tepegöz (OHP) kağıdı kullanın (bkz. Şekil 1E'deki sarı yıldızlar).
- Referans görüntüleri kullanarak, ızgaranın ilk bölümündeki ilgili bölgeye gidin ve istediğiniz büyütmede bir görüntü elde edin.
NOT: Görüntüleri kaydederken, serinin ilk görüntüsünün ilk dosya adını not edin ve tüm görüntü adlarının seri bölümlerinin sıralı sırasını izlemesi için sıralı adlandırma terminolojisi kullanın. - Bir sonraki bölüme gidin ve ilgilenilen bölge için tüm bölümler görüntülenene kadar adım 5.7'yi yineleyin.
6. Görüntü dışa aktarma ve seri bölüm hizalama kaydı
- Aynı yığına ait görüntü dosyalarını tek bir klasöre dışa aktarın. Klasörün dosya adına göre sıralandığından emin olun.
NOT: Görüntüler ideal olarak aynı kök adına sahip olmalı ve alındıkları sıraya uymalıdır. - Fiji'yi açın ve Dosya |'e tıklayın | içe aktar Görüntü Dizisi.
- Klasörün ilk resmine tıklayın ve Aç'a tıklayın. Sıra Seçenekleri'nin bir açılır penceresinin görünmesini bekleyin (Şekil 2A).
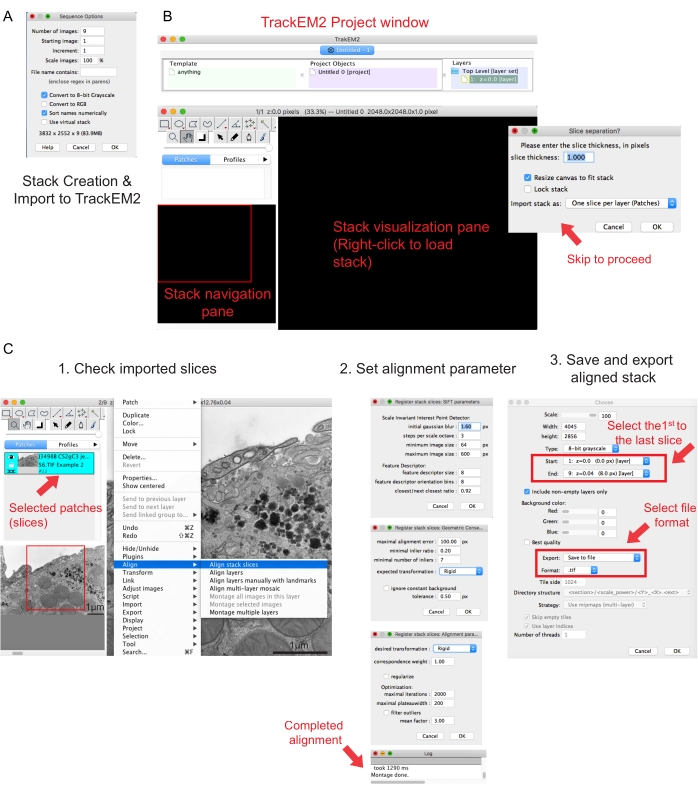
Şekil 2: Fiji kullanarak seri yığın oluşturma ve seri bölüm hizalaması . (A) Seri yığın oluşturmak için görüntüleri yüklerken Sıra Seçeneklerini gösteren ekran görüntüsü. (B) TrackEM2 eklentisinin ekran görüntüsü ve eklentinin anahtar pencereleri. Hizalamayla devam etmek için Dilim ayrımında Tamam'a basın. (C) Seri yığını görselleştirme bölmesine başarıyla yükledikten sonra ekran görüntüsü. Hizalama parametrelerinin üç sıralı penceresi Yığın dilimlerini hizala'dan sonra açılır. Hizalama tamamlandıktan sonra hizalanmış yığını dışa aktarın. Bu şeklin daha büyük bir versiyonunu görüntülemek için lütfen buraya tıklayın.
- Adları sayısal olarak sırala'yı | 8 bit seçeneğine dönüştürün. Tamam'a basın.
NOT: 8 bit'e dönüştürme, verilerin Amira'ya aktarılmasına yardımcı olur ve dosya boyutunu küçülterek sonraki adımlarda daha hızlı işlem hızları sağlar. - Oluşturulan yığının eksiksizliğini, sırasını ve büyütmesini kontrol edin. Oluşturulan yığını .tif dosyası olarak kaydedin.
NOT: Görüntüler aynı büyütmede elde edilmiş olmalıdır. - TrakEM2 eklentisini çalıştırın41. Dosya | Git Yeni | TrackEM2 (boş).
NOT: Eklenti kullanıcıdan TrackEM2 dosyalarını kaydetmesini isteyecektir. Gerekirse, TrackEM2 dosyalarını görüntü klasörüne kaydedin. Üç pencere görünmelidir: bir proje penceresi, bir yığın gezintisi (sol) penceresi ve bir yığın görselleştirme bölmesi (Şekil 2B). - Siyah görselleştirme bölmesine sağ tıklayın. | İçe Aktar'ı tıklatın Yığını içe aktarın ve önceden oluşturulmuş yığını seçin.
- Yığını yığın gezinti penceresine yüklemek için Tamam'ı tıklatın.
NOT: Piksel ve boyut ilişkisi istemek için bir Dilim ayırma penceresi açılır. Yalnızca yığın hizalaması için, bu adımı atlamak üzere Tamam'ı tıklatın. - Yığının tüm dilimlerini denetlemek için kaydırıcıyı kullanın. Gezinti planında yama olarak görünecek olan yüklü dilimi arayın. Aşağıdaki hizalamada yer alacak düzeltme eklerini seçin.
NOT: Seçilen yamalar mavi renkte görünür. - Fareyi görüntüleme bölmesinin üzerine getirin. Resme sağ tıklayın, | Hizala'yı seçin Yığın dilimlerini hizalayın (Şekil 2C-1).
- Hizalama parametrelerini üç sıralı pencereden oluşan bir küme aracılığıyla belirtin.
NOT: Çoğu veri için, katı bir hizalamayla başlayın (döndürme ve çeviriye izin verir, ancak dönüştürmeye izin vermez) ve diğer parametreleri varsayılan olarak saklayın (Şekil 2C-2). - Okuma günlüğünde Montaj tamamlandı yazana kadar hizalamanın çalışmasına izin verin.
NOT: Çalışma zamanı, voksel sayısına ve bilgisayarın hızına bağlıdır. - Görüntüleme bölmesinde hizalanmış yığını denetleyin. Hizalanmış yığının uzaklaştırılmış görünümü için Alt ve - tuşlarına (PC'de) veya Ctrl ve - tuşlarına (Mac'te) basın.
- Hizalanmış yığından memnunsanız, | dışa aktar'ı sağ tıklatın Hizalanmış yığını kaydetmek için düz görüntü oluşturun.
- Yığının başlangıcı olarak ilk görüntüyü ve yığının sonu olarak son görüntüyü seçin, Tamam'ı tıklatın (Şekil 2C-3). Hizalanmış yığını .tif olarak kaydedin.
NOT: Dosya boyutunu küçültmek için, verileri yalnızca gerekli ilgi alanını içerecek şekilde kırpın. - Gerekirse, hizalanmış yığında bir benzeşim hizalaması yürütün. Hizalanmış yığını Fiji'de açın, Eklenti'yi seçin | Kayıt | StackReg.
- Benzeşim seçeneğini belirleyin ve Tamam tuşuna basın. Program tamamlanana kadar bekleyin.
- Benzeşim hizalanmış yığını farklı bir dosya adıyla kaydedin.
7. Segmentasyon ve 3D rekonstrüksiyon
- Amira42'yi açın. Dosya |'nı tıklatın Hizalanmış yığını yüklemek için Veri'yi açın.
- Yeni açılır pencerede voksel ölçümlerini belirtin (Şekil 3A).
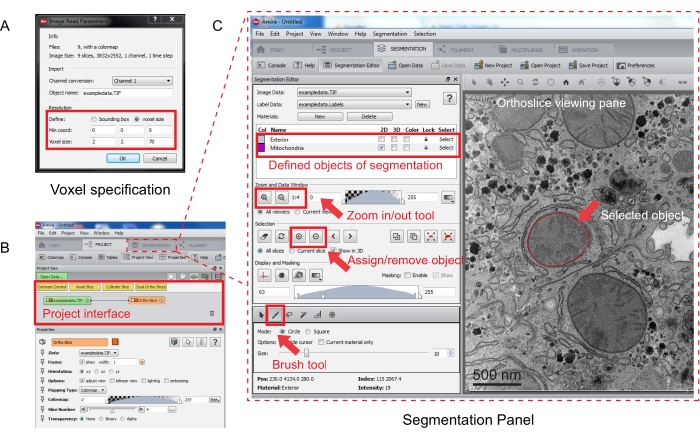
Şekil 3: Amira kullanarak seri yığının segmentasyonu. (A) Hizalanmış bir yığını yüklemeden önce Voxel tanımı açılır penceresi. (B) Bir yığının içe aktarılmasından sonra proje arayüzünün ekran görüntüsü. Segmentasyon Düzenleyici panelinde nesne izlemeyi başlatmak için Segmentasyon sekmesini seçin. (C) Segmentasyon sekmesinin temel özellikleri. Segmentasyon nesnelerini Segmentasyon sekmesinin Segmentasyon Düzenleyicisi bölümünde tanımlayın. Nesnelerin tanımlanmasına yardımcı olması için yakınlaştırma işlevini kullanın. Fırça aracını seçin ve nesnenin sınırını izleyin. İzlemeyi atamak için Seçim'in altındaki + sembolünü tıklatın. Atanan bir nesne, ortoslice görüntüleme bölmesinde kırmızı bir sınıra sahip gibi görünür. Bu şeklin daha büyük bir versiyonunu görüntülemek için lütfen buraya tıklayın.
NOT: Proje arabiriminde bir görüntü yığını düğümü görünür ve sağdaki görüntüleme bölmesinde bir ortosen dilimi görünür (Şekil 3B).
- Segmentasyonu başlatmak için Segmentasyon Sekmesini seçin (Şekil 3B).
NOT: Segmentasyon ilerlemesini segmentasyon öncesinde ve sırasında kaydetmeniz önerilir. Model |'e gidin Modeli Uygun olan herhangi bir .am dosyası olarak kaydedin. - Malzeme listesinde yeni nesneler tanımlamak için segmentasyon düzenleyici panelinde Yeni'yi tıklatın. Nesnenin rengini değiştirmek için sağ tıklatın ve nesneyi yeniden adlandırmak için çift tıklatın.
- Manuel segmentasyon için, malzeme listesinin altındaki segmentasyon aracını seçin. Pikselleri vurgulamak için varsayılan Fırça aracını seçin (Şekil 3C).
NOT: Alternatif olarak, nesnenin anahattını izlemek için fırça aracını kullanın ve nesneyi doldurmak için Shift + F tuşlarına basın. - Fırça aracını bir silgiye dönüştürmek için, düzeltme için pikselleri seçerken sürekli olarak Ctrl tuşuna basın. Yığındaki her dilime açıklama ekleyin.
- Onaylandıktan sonra, + işaretini tıklayarak seçimi bir etikete atayın. Seçimi kaldırmak için - işaretini tıklatın.
- Segmentasyon tamamlandıktan sonra proje arayüzüne geri dönün. Görüntü yığınına bağlı ".label" uzantılı bir düğüm arayın.
- ".label" uzantısını sağ tıklayın ve Yüzey Oluştur | Bir .surf dosyası oluşturmak için başvurun.
- Segmentlere ayrılmış bir nesnenin 3B modelini oluşturmak için, .surf dosyasına sağ tıklayın ve görüntüleme bölmesinde bir 3B model oluşturmak için Yüzey görünümü'nü seçin.
- Görselleştirme veya diğer nicel analizler için 3B modeli kaydedin.
Access restricted. Please log in or start a trial to view this content.
Sonuçlar
Bu teknik için, ilgilenilen bölgeler biyolojik araştırma amacına göre seçilir ve gömülü dokunun kesilmesi ve bölümlenmesinden önce belirlenir. Benzer şekilde, blok yüzünün boyutu araştırma sorusu tarafından belirlenebilir; Bu durumda, numune yaklaşık 0,3 mm x 0,15 mm'lik bir blok yüzü bırakacak şekilde kesildi (Şekil 4A). Bu, ızgara başına 9 seri bölümden oluşan iki ızgaraya izin verdi, 18 seri bölüm sağladı ve yaklaşık 62 μm3 (316 μm x 15...
Access restricted. Please log in or start a trial to view this content.
Tartışmalar
Organel yapısını ve etkileşimlerini 3D olarak görselleştirmek için erişilebilir bir vEM tekniği bu protokolde açıklanmıştır. Hepatositlerde interorganel temaslarının morfolojisi burada bir vaka çalışması olarak sunulmuştur. Bununla birlikte, bu yaklaşım, periferik sinirlerde Schwann hücresi-endotel etkileşimleri 45, endotel hücrelerinde Weibel Palade Vücut biyogenezi46, böbrek hücrelerinde kargo sekresyonu47 ve hipokampal nöronlarda sinaps morf...
Access restricted. Please log in or start a trial to view this content.
Açıklamalar
Yazarların açıklayacağı bir çıkar çatışması yoktur.
Teşekkürler
Joanna Hanley, Rebecca Fiadeiro ve Ania Straatman-Iwanowska'ya uzman teknik yardım için teşekkür ederiz. Ayrıca yararlı tartışmalar için Stefan laboratuvar üyelerine ve Ian J. White'a teşekkür ederiz. J.J.B., UCL'deki MRC Moleküler Hücre Biyolojisi MRC Laboratuvarı'na, ödül kodu MC_U12266B MRC finansmanı ile desteklenmektedir. C.J.S., UCL'deki Moleküler Hücre Biyolojisi Üniversite Birimi MRC Laboratuvarı'na MRC finansmanı ile desteklenmektedir, ödül kodu MC_UU_00012/6. P.G., Avrupa Araştırma Konseyi, hibe kodu ERC-2013-StG-337057 tarafından finanse edilmektedir.
Access restricted. Please log in or start a trial to view this content.
Malzemeler
| Name | Company | Catalog Number | Comments |
| 0.22 µm syringe filter | Sarstedt | 83.1826.001 | |
| Aluminum trays | Agar Scientific | AGG3912 | |
| Amira v6 | ThermoFisher | https://www.thermofisher.com | |
| Chloroform | Fisher | C/4960/PB08 | |
| DDSA/Dodecenyl Succinic Anhydride | TAAB | T027 | Epon ingredient |
| Diamond knife | DiaTOME | ultra 45° | |
| DMP-30/2,4,6-tri (Dimethylaminomethyl) phenol | TAAB | D032 | Epon ingredient |
| Dumont Tweezers N5 | Agar Scientific | AGT5293 | |
| Fiji | https://imagej.net/ | ||
| Fiji TrakEM2 plugin | https://imagej.net/ | ||
| Formaldehyde 36% solution | TAAB | F003 | |
| Formvar coated slot grid | Homemade | Alternative: EMS diasum (FF2010-Cu) | |
| Glass bottle with applicator rod | Medisca | 6258 | |
| Glass vials | Fisher Scientific | 15364769 | |
| Gluteraldehyde 25% solution | TAAB | G011 | |
| MNA/Methyl Nadic Anhydride | TAAB | M011 | Epon ingredient |
| Osmium Tetroxide 2% solution | TAAB | O005 | |
| Potassium Ferricyanide | Sigma-Aldrich | P-8131 | |
| Propylene oxide | Fisher Scientific | E/0050/PB08 | |
| Reuseable adhesive | Blue Tack | ||
| Reynolds Lead Citrate | TAAB | L037 | Section stain |
| Sodium Cacodylate | Sigma-Aldrich | C-0250 | to make 0.1 M Caco buffer |
| Super Glue | RS Components | 918-6872 | Cyanoacrylate glue, Step 1.3 |
| TAAB 812 Resin | TAAB | T023 | Epon ingredient |
| Tannic acid | TAAB | T046 | |
| Triton X-100 | Sigma-Aldrich | T9284 | |
| Two part Epoxy Resin | RS Components | 132-605 | Alternative: Step 2.13 |
| Ultramicrotome | Leica | UC7 | |
| Vibrating microtome | Leica | 100 µm thick slices, 0.16 mm/s cutting at 1 mm amplitude . | |
| Weldwood Original Contact cement | DAP | 107 | Contact adhesive: Step 3.1.4 |
Referanslar
- Knoll, M., Ruska, E. Das elektronenmikroskop. Zeitschrift für Physik. 78 (5), 318-339 (1932).
- von Ardenne, M. Daselektronen-rastermikroskop. Zeitschrift für Physik. 109 (9), 553-572 (1938).
- Bang, B. H., Bang, F. B. Graphic reconstruction of the third dimension from serial electron microphotographs. Journal of Ultrastructure Research. 1 (2), 138-139 (1957).
- Birch-Andersen, A. Reconstruction of the nuclear sites of Salmonella typhimurium from electron micrographs of serial sections. Journal of General Microbiology. 13 (2), 327-329 (1955).
- Denk, W., Horstmann, H. Serial block-face scanning electron microscopy to reconstruct three-dimensional tissue nanostructure. PLoS Biology. 2 (11), 329(2004).
- Peddie, C. J., Collinson, L. M. Exploring the third dimension: volume electron microscopy comes of age. Micron. 61, 9-19 (2014).
- Titze, B., Genoud, C. Volume scanning electron microscopy for imaging biological ultrastructure. Biology of the Cell. 108 (11), 307-323 (2016).
- Kornfeld, J., Denk, W. Progress and remaining challenges in high-throughput volume electron microscopy. Current Opinion in Neurobiology. 50, 261-267 (2018).
- Heymann, J. A., et al. Site-specific 3D imaging of cells and tissues with a dual beam microscope. Journal of Structural Biology. 155 (1), 63-73 (2006).
- Knott, G., Marchman, H., Wall, D., Lich, B. Serial section scanning electron microscopy of adult brain tissue using focused ion beam milling. Journal of Neuroscience. 28 (12), 2959-2964 (2008).
- Leighton, S. B. SEM images of block faces, cut by a miniature microtome within the SEM - a technical note. Scanning Electron Microscopy. , 73-76 (1981).
- Martone, M. E., Deerinck, T. J., Yamada, N., Bushong, E., Ellisman, M. H. Correlated 3D light and electron microscopy: use of high voltage electron microscopy and electron tomography for imaging large biological structures. Journal of Histotechnology. 23 (3), 261-270 (2000).
- Micheva, K. D., Smith, S. J. Array tomography: a new tool for imaging the molecular architecture and ultrastructure of neural circuits. Neuron. 55 (1), 25-36 (2007).
- Sjostrand, F. S. Ultrastructure of retinal rod synapses of the guinea pig eye as revealed by three-dimensional reconstructions from serial sections. Journal of Ultrastructure Research. 2 (1), 122-170 (1958).
- Ware, R. W. Three-dimensional reconstruction from serial sections. International Review of Cytology. 40, 325(1975).
- Stevens, J. K., Davis, T. L., Friedman, N., Sterling, P. A systematic approach to reconstructing microcircuitry by electron microscopy of serial sections. Cognitive Brain Research. 2 (3), 265-293 (1980).
- Hoppe, W. Three-dimensional electron microscopy. Annual Review of Biophysics. 10, 563-592 (1981).
- Frank, J. Electron tomography: methods for three-dimensional visualization of structures in the cell. , Springer. New York, NY. (2008).
- Baumeister, W. Electron tomography: towards visualizing the molecular organization of the cytoplasm. Current Opinion in Structural Biology. 12 (5), 679-684 (2002).
- Hoog, J. L., Schwartz, C., Noon, A. T., O'Toole, E. T. Organization of interphase microtubules in fission yeast analyzed by electron tomography. Developmental Cell. 12 (3), 349-361 (2007).
- Harris, K. M., Perry, E., Bourne, J., Feinberg, M., Ostroff, L., Hurlburt, J. Uniform serial sectioning for transmission electron microscopy. Journal of Neuroscience. 26 (47), 12101-12103 (2006).
- Jesior, J. C. Use of low-angle diamond knives leads to improved ultrastructural preservation of ultrathin sections. Scanning Microscopy Supplement. 3, 147-152 (1989).
- Studer, D., Gnaegi, H. Minimal compression of ultrathin sections with use of an oscillating diamond knife. Journal of Microscopy. 197, 94-100 (2000).
- Gay, H., Anderson, T. F. Serial sections for electron microscopy. Science. 120 (3130), 1071-1073 (1954).
- Bernhard, W., Rouiller, C. Close topographical relationship between mitochondria and ergastoplasm of liver cells in a definite phase of cellular activity. The Journal of Biophysical and Biochemical Cytology. 2, 73-78 (1956).
- Palade, G. E. An electron microscope study of the mitochondrial structure. The Journal of Histochemistry & Cytochemistry. 1 (4), 188-211 (1953).
- Wu, H., Carvalho, P., Voeltz, G. K. Here, there, and everywhere: The importance of ER membrane contact sites. Science. 361 (6401), (2018).
- Vance, J. E. Inter-organelle membrane contact sites: implications for lipid metabolism. Biology Direct. 15 (1), 24(2020).
- Stefan, C. J. Endoplasmic reticulum-plasma membrane contacts: Principals of phosphoinositide and calcium signaling. Current Opinion in Cell Biology. 63, 125-134 (2020).
- Zaman, M. F., Nenadic, A., Radojicic, A., Rosado, A., Beh, C. T. Sticking with it: ER-PM membrane contact sites as a coordinating nexus for regulating lipids and proteins at the cell cortex. Frontiers in Cell and Developmental Biology. 8, 675(2020).
- van Vliet, A. R., Sassano, M. L., Agostinis, P. The unfolded protein response and membrane contact sites: tethering as a matter of life and death. Contact. 1, 1-15 (2018).
- Cohen, S., Valm, A. M., Lippincott-Schwartz, J. Interacting organelles. Current Opinion in Cell Biology. 53, 84-91 (2018).
- Hariri, H., et al. Lipid droplet biogenesis is spatially coordinated at ER-vacuole contacts under nutritional stress. EMBO Reports. 19 (1), 57-72 (2018).
- Stefan, C. J., Trimble, W. S., Grinstein, S., Drin, G. Membrane dynamics and organelle biogenesis-lipid pipelines and vesicular carriers. BMC Biology. 15 (1), 102(2017).
- Eisenberg-Bord, M., Shai, N., Schuldiner, M., Bohnert, M. A tether is a tether is a tether: tethering at membrane contact sites. Developmental Cell. 39 (4), 395-409 (2016).
- Scorrano, L., De Matteis, M. A., Emr, S., Giordano, F. Coming together to define membrane contact sites. Nature Communications. 10 (1), 1287(2019).
- Lak, B., Li, S., Belevich, I., Sree, S. Specific subdomain localization of ER resident proteins and membrane contact sites resolved by electron microscopy. European Journal of Cell Biology. 100 (7), 151180(2021).
- Collado, J., Kalemanov, M., Campelo, F., Bourgoint, C. Tricalbin-mediated contact sites control ER curvature to maintain plasma membrane integrity. Developmental Cell. 51 (4), 476-487 (2019).
- West, M., Zurek, N., Hoenger, A., Voeltz, G. K. A 3D analysis of yeast ER structure reveals how ER domains are organized by membrane curvature. Journal of Cell Biology. 193 (2), 333-346 (2011).
- Ilacqua, N., Anastasia, I., Raimondi, A., Lemieux, P. A three-organelle complex made by wrappER contacts with peroxisomes and mitochondria responds to liver lipid flux changes. Journal of Cell Science. 135 (5), 259091(2022).
- Cardona, A., Saalfeld, S., Schindelin, J., Arganda-Carreras, I. TrakEM2 software for neural circuit reconstruction. PLoS One. 7 (6), 38011(2012).
- Stalling, D., Westerhoff, M., Hege, H. -C. Amira: A highly interactive system for visual data analysis. The Visualization Handbook. 38, 749-767 (2005).
- Hsieh, T. S., Chen, Y. J., Chang, C. L., Lee, W. R., Liou, J. Cortical actin contributes to spatial organization of ER-PM junctions. Molecular Biology of the Cell. 28 (23), 3171-3180 (2017).
- Anastasia, I., Ilacqua, N., Raimondi, A., Lemieux, P. Mitochondria-rough-ER contacts in the liver regulate systemic lipid homeostasis. Cell Reports. 34 (11), 108873(2021).
- Cattin, A. L., Burden, J. J., Van Emmenis, L., Mackenzie, F. E. Macrophage-Induced Blood Vessels Guide Schwann Cell-Mediated Regeneration of Peripheral Nerves. Cell. 162 (5), 1127-1139 (2015).
- Lopes-da-Silva, M., et al. A GBF1-dependent mechanism for environmentally responsive regulation of ER-Golgi transport. Developmental Cell. 49 (5), 786-801 (2019).
- Banushi, B., Forneris, F., Straatman-Iwanowska, A., Strange, A. Regulation of post-Golgi LH3 trafficking is essential for collagen homeostasis. Nature Communications. 7, 12111(2016).
- Rey, S. A., et al. Ultrastructural and functional fate of recycled vesicles in hippocampal synapses. Nature Communications. 6, 8043(2015).
- Belicova, L., Repnik, U., Delpierre, J., Gralinska, E. Anisotropic expansion of hepatocyte lumina enforced by apical bulkheads. Journal of Cell Biology. 220 (10), 202303003(2021).
- Kizilyaprak, C., Daraspe, J., Humbel, B. M. Focused ion beam scanning electron microscopy in biology. Journal of Microscopy. 254 (3), 109-114 (2014).
- Xu, C. S., Hayworth, K. J., Lu, Z., Grob, P. Enhanced FIB-SEM systems for large-volume 3D imaging. Elife. 6, 1-36 (2017).
- Parlakgül, G., Arruda, A. P., Cagampan, E., Pang, S. High resolution 3D imaging of liver reveals a central role for subcellular architectural organization in metabolism. bioRxiv. , (2020).
- Guerin, C. J., Kremer, A., Borghgraef, P., Lippens, S. Targeted studies using serial block face and focused ion beam scan electron microscopy. The Journal of Visualized Experiments: JoVE. (150), e59480(2019).
- Kremer, A., et al. A workflow for 3D-CLEM investigating liver tissue. Journal of Microscopy. 281 (3), 231-242 (2021).
- Hayat, M. Principles and techniques of electron microscopy: biological applications. , Cambridge University Press. (2000).
- Wisse, E., Braet, F., Duimel, H., Vreuls, C. Fixation methods for electron microscopy of human and other liver. World Journal of Gastroenterology. 16 (23), 2851-2866 (2010).
- Hanley, J., Dhar, D. K., Mazzacuva, F., Fiadeiro, R. Vps33b is crucial for structural and functional hepatocyte polarity. Journal of Hepatology. 66 (5), 1001-1011 (2017).
- Deerinck, T. J., Bushong, E. A., Thor, A., Ellisman, M. H. NCMIR methods for 3D EM: a new protocol for preparation of biological specimens for serial block face scanning electron microscopy. Microscopy. 1, 6-8 (2010).
- Miranda, K., Girard-Dias, W., Attias, M., de Souza, W., Ramos, I. Three dimensional reconstruction by electron microscopy in the life sciences: An introduction for cell and tissue biologists. Molecular Reproduction and Development. 82 (7-8), 530-547 (2015).
- Yamaguchi, M., Chibana, H. A method for obtaining serial ultrathin sections of microorganisms in transmission electron microscopy. The Journal of Visualized Experiments: JoVE. (131), e56235(2018).
- Hall, D. H., Hartwieg, E., Nguyen, K. C. Modern electron microscopy methods for C. elegans. Methods in Cell Biology. 107, 93-149 (2012).
- Hagler, H. K. Ultramicrotomy for biological electron microscopy. Methods in Molecular Biology. 369, 67-96 (2007).
- Arganda-Carreras, I., et al. Consistent and elastic registration of histological sections using vector-spline regularization. Computer vision approaches to medical image analysis, CVAMIA 2006, Lecture Notes in Computer Science. Beichel, R. R., Sonka, M., et al. 4241, Springer Berlin Heidelberg. Berlin, Heidelberg. 85-95 (2006).
- Belevich, I., Joensuu, M., Kumar, D., Vihinen, H., Jokitalo, E. Microscopy image browser: a platform for segmentation and analysis of multidimensional datasets. PLoS Biology. 14 (1), 1002340(2016).
- Fiala, J. C. Reconstruct: a free editor for serial section microscopy. Journal of Microscopy. 218, 52-61 (2005).
- Kremer, J. R., Mastronarde, D. N., McIntosh, J. R. Computer visualization of three-dimensional image data using IMOD). Journal of Structural Biology. 116 (1), 71-76 (1996).
- Iudin, A., Korir, P. K., Salavert-Torres, J., Kleywegt, G. J., Patwardhan, A. EMPIAR: a public archive for raw electron microscopy image data. Nature Methods. 13 (5), 387-388 (2016).
- Xu, C. S., Pang, S., Shtengel, G., Muller, A. An open-access volume electron microscopy atlas of whole cells and tissues. Nature. 599 (7883), 147-151 (2021).
- Karabag, C., et al. Semantic segmentation of HeLa cells: An objective comparison between one traditional algorithm and four deep-learning architectures. PLoS One. 15 (10), 0230605(2020).
- Heinrich, L., Bennett, D., Ackerman, D., Park, W. Whole-cell organelle segmentation in volume electron microscopy. Nature. 599 (7883), 141-146 (2021).
- Kim, J. S., Greene, M. J., Zlateski, A., Lee, K. Space-time wiring specificity supports direction selectivity in the retina. Nature. 509 (7500), 331-336 (2014).
- Spiers, H., Songhurst, H., Nightingale, L., de Folter, J. Deep learning for automatic segmentation of the nuclear envelope in electron microscopy data, trained with volunteer segmentations. Traffic. 22 (7), 240-253 (2021).
- Hasan, N. M., Gupta, A., Polishchuk, E., Yu, C. H. Molecular events initiating exit of a copper-transporting ATPase ATP7B from the trans-Golgi network. The Journal of Biological Chemistry. 287 (43), 36041-36050 (2012).
- Stoeck, I. K., Lee, J. Y., Tabata, K., Romero-Brey, I. Hepatitis C virus replication depends on endosomal cholesterol homeostasis. The Journal of Virology. 92 (1), 01196(2018).
- Ma, X., Qian, H., Chen, A., Ni, H. M., Ding, W. X. Perspectives on mitochondria-ER and mitochondria-lipid droplet contact in hepatocytes and hepatic lipid metabolism. Cells. 10 (9), 2273(2021).
Access restricted. Please log in or start a trial to view this content.
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiThis article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır