Method Article
浸潤の少ない新規細胞注入法
要約
この方法により、細胞懸濁液によって引き起こされる細胞注入中の大きな浸潤が排除されます。
要約
細胞を組織に直接注入することは、細胞投与や補充療法において必要なプロセスです。細胞注入には、細胞が組織に入るのに十分な量の懸濁液が必要です。懸濁液の量は組織に影響を及ぼし、これは細胞注射の結果として重大な侵襲的損傷を引き起こす可能性があります。本稿では、この傷害を回避することを目的としたスローインジェクションと呼ばれる新しい細胞注入法について報告する。しかし、針先から細胞を押し出すには、ニュートンのせん断力の法則に従って十分に高い注入速度が必要です。上記の矛盾を解決するために、この研究では、ゼラチン溶液などの非ニュートン流体を細胞懸濁液として使用しました。ゼラチン溶液は、約20°Cでゲルからゾルに形態が変化するため、温度感受性があります。 したがって、細胞懸濁液をゲル状に維持するために、シリンジをこのプロトコルで冷却し続けました。しかし、いったん溶液を体内に注入すると、体温によってゾルに変換されました。間質組織液の流れは、過剰な溶液を吸収することができます。この研究では、ゆっくりとした注入技術により、心筋細胞ボールが宿主の心筋に入り、周囲に線維化することなく生着することができました。本研究では、ラットの成体心臓の心筋梗塞の遠隔領域に、精製してボール状にしたラット心筋細胞をゆっくりと注入する手法を用いた。注射後2カ月で、移植群の心臓は収縮機能が有意に改善した。さらに、ゆっくりと注入された心臓の組織学的分析により、宿主と移植片心筋細胞の間に、ギャップ結合を含む挿入椎間板 を介した シームレスな接続が明らかになりました。この手法は、次世代の細胞治療、特に心臓再生医療への貢献が期待されます。
概要
細胞の投与と置換は、ひどく損傷した臓器に対する有望な新しい治療戦略です。その中でも、心臓再生医療が大きな注目を集めています。しかし、怪我によって引き起こされる炎症は、いくつかの臓器の瘢痕形成を媒介します1,2,3,4。人間の心臓は、約1010個の心筋細胞で構成されています。したがって、理論的には5,6、それは109以上の心筋細胞で治療されなければならない。従来の注射法で多数の心筋細胞を投与すると、重大な組織損傷につながる可能性があります7。この方法は、組織への浸潤を最小限に抑えた新しい細胞注入法を提供します。
臓器実質への細胞投与には注射が必要です。しかし、注射自体が組織損傷につながる可能性があるという点で矛盾があります。組織損傷は、臓器や組織に局所的な炎症や不治の瘢痕化を引き起こし、再生能力を損なう8,9,10。哺乳類の心臓は、その連続的なポンプ機能によって引き起こされる高血圧に耐えるために、直ちに損傷を修復する必要があるため、再生する代わりに瘢痕を発症する傾向が極めて高い11。アブレーション療法は、この瘢痕形成の傾向の高さを利用し、不整脈12を用いて瘢痕形成を起こしやすい回路を遮断する。以前の研究では、瘢痕組織が宿主の心筋に注入された心筋細胞を単離することが観察されました。このように、心臓再生医療における治療効果の向上のためには、次の課題を克服する必要があります。
組織間質液の流れは、酸素と栄養素を細胞に運び、細胞から排泄された老廃物を除去する上で重要な役割を果たします。各組織/器官における間質液の流れの生理学的速度は異なります(範囲は0.01〜10μm / s)13。著者の知る限り、病理学的浮腫なしに余分な量の体液をサポートする個々の組織/臓器の能力に関するデータはありません。しかし、この実験では、組織の損傷を減らすためにゆっくりとした注入速度を使用することを試みており、その結果を使用して、この概念の実用性を判断することができます。
プロトコル
動物実験は、関西医科大学動物実験倫理指針に則って実施され、倫理委員会(承認番号:23-104)で承認されました。すべての動物は、特定の病原体のない環境で一定の明暗サイクルの下で飼育されました。ハサミ、鉗子、リトラクターなどの滅菌された手術器具はすべてオートクレーブでクレーブ滅菌され、完全に乾燥されました。
1. 新生仔ラット心筋細胞ボールの調製
- 新生仔ラット心臓採取
- 心臓の採取については、前のレポート7で説明した手順と同様の手順に従います。
- 新生児(生後0〜2日)のSprague-Dawley(SD)ラットをポビドンヨードと70%エタノール溶液に順次浸し、気化したイソフルラン(濃度は10%v / vを超える必要があります)で満たされた気密ケースに移して深部麻酔を行います。.
- 自発運動の喪失による意識不明の確認後、背中から手で持ちながらラットの首を切り落とし、鋭利なハサミで胸郭の前中央から尾側、吻側方向に2〜4mmの組織を切断する。
- 背中の皮膚をつかんで切り口を引っ張り、胸郭から心臓を押し出します。ハサミを使用して心室を切断し、カルシウムまたはマグネシウムを含まないリン酸緩衝生理食塩水(PBS(PBS(-))に浸します。
- 新生仔ラット心筋細胞の分散
- オートクレーブ処理した凹面ガラス器具に最小限の量の Ads バッファー(Ads バッファー:116 mM NaCl、20 mM HEPES、12.5 mM NaH2PO 4、5.6 mM グルコース、5.4 mM KCl、0.8 mM MgSO4、pH 7.35)に分散させた回収した心室を、湾曲ハサミを使用して小片(1 mm x 1 mm)に細かく刻みます。
- ミンチした組織とマイクロマグネチックスターラーを50 mLの遠心分離チューブに移し、0.1%コラゲナーゼ、0.1%トリプシン、20 μg/mL DNase I、および50 nMテトラメチルローダミンメチルエステルをAdsバッファーに含んだ37°Cで30分間撹拌することにより、組織を単一細胞に分散させます。
- 凝集体と分散細胞を自然沈降で分離し、分散した細胞のみをチューブに集め、残った細胞凝集体を同じ消化培地で再度消化します。
- すべての細胞が完全に解離するまで、この手順を続けます。細胞の完全な分散を確認するには、顕微鏡(4倍の対物レンズ)でチューブを観察します。
- 150 x g で5分間遠心分離して分散した細胞を回収し、1〜2 mLのADSバッファーで解離します。
- 心筋細胞の蛍光活性化細胞選別
- 556-601 nmバンドパスフィルターを用いた蛍光活性化セルソーティング(FACS)を用いて細胞を解析し、赤色蛍光シグナルを検出します。
- プレゲーティングを慎重に行い、ダブレットフラクション14を排除します。ダブレット除去のゲート設定は、製造元の指示に従って行う必要があります。
- x軸に前方散乱光を、y軸に赤色蛍光シグナルを設定します。赤血球と死細胞を含む最下位の集団、線維芽細胞や内皮細胞などの非心筋細胞を含む中間の集団、純粋な心室心筋細胞を含む最上位の集団の3つの集団が観察された7。
- 赤色蛍光標識心筋細胞ボールの作製
- 心筋細胞を選択的に選別し、150 x gで5分間遠心分離します。細胞ペレットを、10%熱不活化ウシ胎児血清(FBS)を含む1 mLのアルファ修飾ミニマルエッセンシャル培地(α-MEM)に完全に溶解します。
- 血球計算盤を用いて細胞濃度を測定し、細胞懸濁液をα-MEM 10% FBSで3,000細胞/mLに希釈します。
- これらを細胞非粘着性の96ウェルプレート(ウェルあたり100 μL)に分配し、100 x gで5分間遠心分離し、37°Cで5%CO2 の細胞培養インキュベーターで2〜3日間培養します。
- 注入実験の前に、1,000 μLのピペットを使用して培地で吸引することにより、各ウェルから心筋細胞ボールを回収し、15 mLのチューブに回収します。
- 生着後の追跡に関するメーカーの指示に従ってPKH26で染色します。
2. スローインジェクション法の準備
- ゼラチン原液の調製
- ゼラチンを秤量し、Adsバッファーに溶解して10%w/v溶液を生成し、オートクレーブします。
- 細胞注入装置の製造
- デバイス全体の設計: 図1に示す装置を準備します。このシステムは、シリンジ冷却装置と主噴射装置と組み合わされています。
- 以下に説明する主噴射装置を準備します。
- 新生児心筋細胞ボール注射には、注射器を備えた29G、長さ50mmの針を使用します。
- 細胞注入シリンジを使用して、パワートランスファーシリンジ(18G、1 mL)を背中合わせに接続します(図1)。パワートランスファーシリンジの針を、ルーメン拡張性の低い細いポリプロピレンチューブに接続します。
- 次に、伝動管の反対側を同じシリンジ(18G、1mL)の針に接続し、シリンジポンプにセットします。2本のパワートランスファーシリンジとチューブに気泡のない水を入れます。
注意: パワートランスファーシリンジの一方のプランジャーを押し込むと、もう一方のシリンジに直接圧力が伝達され、プランジャーが突出します。
- 以下の説明に従って、注射シリンジ冷却システムを設定します。
- 銅管(外径=1mm、内径=0.3mm、厚さ=0.35mm)を細胞注入シリンジの細胞含有部分にしっかりと巻き付け、両端に10mmの余剰パイプを残します。
- 銅管をフレキシブルプラスチックチューブに接続します。さらに、プラスチックチューブのもう一方の端を外部ポンプに接続し、ラインに冷却水を満たし、余分な銅チューブを砕いた氷に浸して水を冷却します(図1)。
注意: この冷却システムは、シリンダー内の細胞懸濁液を約2°Cに維持します。
3. 鈍角冠動脈閉塞によるラット心筋梗塞モデルの開発
- 雄の免疫不全ヌードラット(F344 / Njcl-rnu / rnu)を3%イソフルランを含む空気で麻酔します。カニューレを気管に挿入し、人工呼吸器に接続します。
- カニューレをコントローラー付きのイソフルラン気化器に接続して、3%のイソフルラン濃度を維持し、十分な麻酔を維持します。痛みの刺激に反応しないことを確認します。乾燥を防ぐために、獣医師の軟膏を目に塗ります。
- 40°Cで温めたサージカルプレートにカットしたサージカルテープで手足を固定します。ラットの体を体軸の右側にひねり、左脇の下を術野として使用します。
- 脱毛クリームを使用して手術野の毛を取り除き、ポビドンヨードで皮膚を拭きます。鋭利なハサミを使用して、皮膚と大胸筋を1.5cm切開します。
- 3番目の肋間腔を確認し、先端が鈍いマイクロ鉗子を使用して肋間筋と肋骨胸膜を引き裂きます。リトラクターを使用して胸を開いたままにします。鉗子で薄い心膜をそっと取り除きます。
- 心臓側壁の梗塞モデルを構築するには、左心房の先端から尾側1mmの位置を見つけて鈍角冠動脈を特定し、7-0のシルク縫合糸を通し、背側から腹側にかけて幅2.5mm、深さ2.5mmの組織をすくい上げ、組織をしっかりと結紮します。
- 結紮糸から遠位の弱い収縮により、結紮が成功したことを確認します。リトラクターを静かに取り外した後、2番目と4番目の肋間腔の間に5-0のシルク縫合糸を配置し、開胸術を閉じます。
- イソフルラン濃度を1%に下げます。筋肉と皮膚を5-0シルクでやさしく縫合します。イソフルラン濃度を0%に下げ、自発呼吸が始まるまで約5分間待ちます。
- 生理食塩水で2 mg / mLのリドカインを切開部に局所的に適用します。.皮下注射 で 生理食塩水1mLを投与する。感染を防ぐために獣医の軟膏を局所的に塗布します。
- ラットを挿管チューブから取り出し、動物ケージに戻します。その後、個々のケージでラットを1週間飼育します。
- 心エコー検査を使用して心臓収縮ポンプ機能の変化を分析します。
注:外側心筋梗塞により心機能が低下します。
4. スローインジェクション法によるエコー誘導経皮的細胞移植
- 10%ゼラチンストックを37°Cで液体になるまで予熱します。
- 10%ゼラチンストックを予熱したADSバッファーで希釈し、最終的な注射可能な5%w/vゼラチン溶液(動物1匹あたり100μLが必要)を得ます。
- 心筋細胞ボール96個(合計:心筋細胞/動物28,800個)を予熱した注射液100μLに懸濁する。
- ステップ4.3で調製した懸濁液を細胞注射シリンジにロードし、余分な空気の吸引を避けます。
- シリンジ内の気泡をなくすには、針を上にして垂直に持ち、シリンジをたたき、シリンジの上部の隆起部に気泡を集めます。.
注意: このステップでは、心筋細胞ボールがプランジャーのゴム製シールに徐々に落ち着くのを観察します。 - シリンジの垂直位置を維持し、プランジャーをゆっくりと押し上げ、20 μLの細胞懸濁液がシリンジに残るまで気泡と余分な細胞懸濁液を廃棄します。心筋細胞ボールがプランジャーのゴムシールに載ったままになるように、プランジャーを一定の速度で慎重に押します。
- キャップをしたシリンジを氷浴に直接5分間浸します。
- 冷却したシリンジを注射装置に入れます。アニマルステージ上の微動装置に定着した注射シリンジ装置を、X-Y-Z位置調整可能な手作りクランプでしっかりと固定します。微動装置は、x方向の20mmスライド、y方向のスイング、z方向のボウイング運動を使用して針の位置を移動できます。
- 3%イソフルランを含む空気で満たされた密閉された箱でラットを麻酔します。.痛みの刺激に反応しないことで麻酔を確認します。乾燥を防ぐために、獣医師の軟膏を目に塗ります。
- 40°Cで温めたエコープレートに切断したサージカルテープで手足を固定します。十分な麻酔を維持するには、吸入した空気に約3%の濃度のイソフルランが含まれていることを確認してください。.
- 注射野(直径2cm)と胸部の脱毛クリームで脱毛し、ポビドンヨードで皮膚を拭きます。
- 胸部にエコーゲルを塗布し、プローブをエコーします。エコープローブを頭蓋軸と尾軸に沿って胸部の近くに置き、製造元のマニュアルに従ってBモード心エコー検査の取得を開始します。
- 正面図で注射針の先端を心筋に進めます(図2 および 補足ビデオ1)。
- メインシリンジポンプを作動させるには、 スタート ボタンを押し、ダイヤルを回して、約0.02μL/sの注入速度で所定の数値に調整します。感染症を防ぐために、ニードリングの位置の周りに獣医師の軟膏を局所的に塗布します。
注意: 注入液を使用して、目的の注入速度に適したダイヤル番号を決定する必要があります。注射後、例示的な移動システムを用いて注射針を抜去する。 - イソフルラン濃度を0%に下げ、動物が胸骨横臥位を維持するのに十分な意識を取り戻すまで約5分間待ちます。.
5.心機能の評価
- 3%イソフルランを含む空気で満たされた密閉された箱でラットを麻酔します。.痛みの刺激に反応しないことで麻酔を確認します。乾燥を防ぐために、獣医師の軟膏を目に塗ります。
- 四肢の先端に心電図取得用の帯電クリームを塗布します。40°Cで温めたエコープレートに切断したサージカルテープで手足を固定します。生理学的モニタリングシステムを使用して、リアルタイムの心電図と心拍数を検出します。
- 製造元の指示に従って、最初に左心室の頂点から流出路を示すBモードエコー画像を使用して長軸角度を決定し、次にエコープローブを90°回転させて短軸ビューに変更します。
- 動物期の尾側から吻側への微細な動きシステムのみを使用して、短軸ビューを乳頭筋レベルに調整します。次に、Mモードボタンを押して画像モードを Mモード に変更し、 シネループ ボタンを押して5秒間ビデオを録画します。
- ソフトウェアを使用して分数の短縮を分析および計算するには、 測定 ボタンと垂直線ツールを押して、収縮末期および拡張末期の左心室の内寸を定義します。ソフトウェアは、割合短縮率(FS)を自動的に計算します。
- イソフルラン濃度を0%に下げ、動物が胸骨横臥位を維持するのに十分な意識を取り戻すまで約5分間待ちます。.
6. 免疫組織化学
- 切断したサージカルテープを使用して安楽死した遺体をテーブルに固定し(ステップ1.1.3のように安楽死を実施)、心臓を切除し、PBSで洗浄し、心臓を4%パラホルムアルデヒド/ PBSに浸します。
- 心臓を3つのセクションに解剖し、凍結保護のために40%スクロースに浸し、最適な切断温度(OCT)化合物に埋め込み、-80°Cで凍結します。
- 凍結切片した組織(厚さ8μm)をアミノシランでコーティングしたスライドガラスに取り付けます。一般的なドライヤーで発生させた非加温風で十分に乾燥させた後、0.2%Tween-20(TBS-T)を含むトリス緩衝生理食塩水にスライドガラスを浸漬します。
- ブロッキング溶液に25°Cで30分間浸漬します。 一次抗体含有ブロッキング溶液100 μLをスライドに注ぎ、パラフィンシーリングで4°Cで一晩インキュベートし、抗体溶液が組織に広がり続けます。
注:抗体濃度は 材料表に示されています。 - 湿った紙の自然蒸気を利用して蒸発を防ぐ手作りの高湿度ボックスにスライドを水平に置きます。スライドをTBS-Tで3回洗浄します。
- 二次抗体含有ブロッキング剤を用いて、一次抗体と同様に25°Cで1時間処理します。3回の洗浄後、蛍光顕微鏡と共焦点レーザー顕微鏡を使用して蛍光シグナルを観察します。
注:抗体濃度は 材料表に示されています。 - 統計解析:細胞体積の比較では、 図3Aに示すように、対応のない t検定を実行します。 図4Aに示すように、徐行注入法を用いた心筋細胞投与後の心機能回復を評価するには、対応のある t検定を使用します。この研究では、 差はP < 0.01で統計的に有意であると考えられた。エラーバーは標準偏差を表します。
結果
細胞の生存とコラーゲン沈着に対するスローインジェクションの効果
PKH26で標識した新生仔ラット心筋細胞ボールを、正常または低速注射法を用いて正常なヌードラット心筋に注射した。その結果、スローインジェクション法では、生着細胞の体積が有意に増加し(図3A)、オンサイトI型コラーゲン沈着が有意に減少することが示されました(図3B)。
ラット梗塞モデルにおける治療効果に及ぼす緩慢注射の影響
モデルラットの心梗塞した心臓に、心エコー計ガイド下徐行注射法を用いて、新生仔ラット心筋細胞ボール(PBS(−))を注入した。細胞注射群単独では、2カ月後に心臓収縮機能に有意な改善が見られました(図4A)。免疫組織化学的解析により、生着細胞と宿主筋細胞の間には、ギャップ結合を含むインターカレートディスク を介して シームレスに接続されていることが明らかになりました(図4B)。
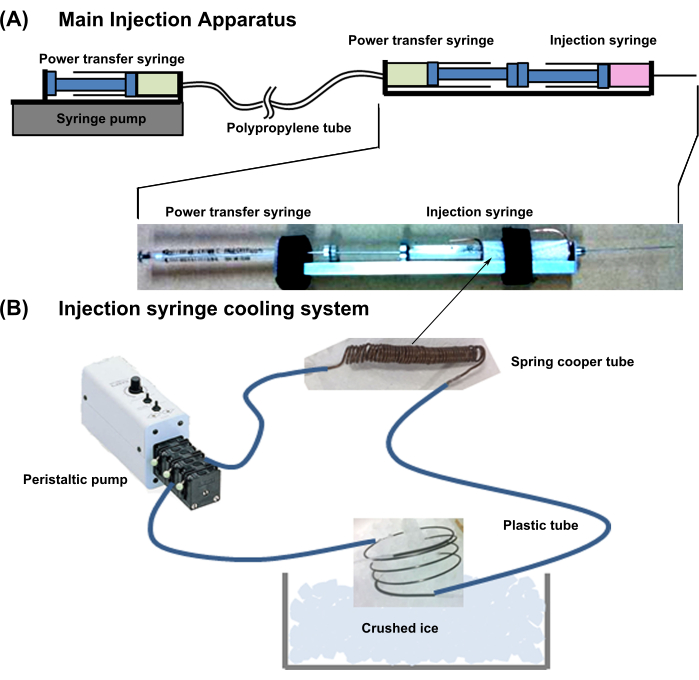
図1:噴射システム全体の概略図。 (A)主噴射装置。(B)注射器冷却システム。この図の拡大版をご覧になるには、ここをクリックしてください。
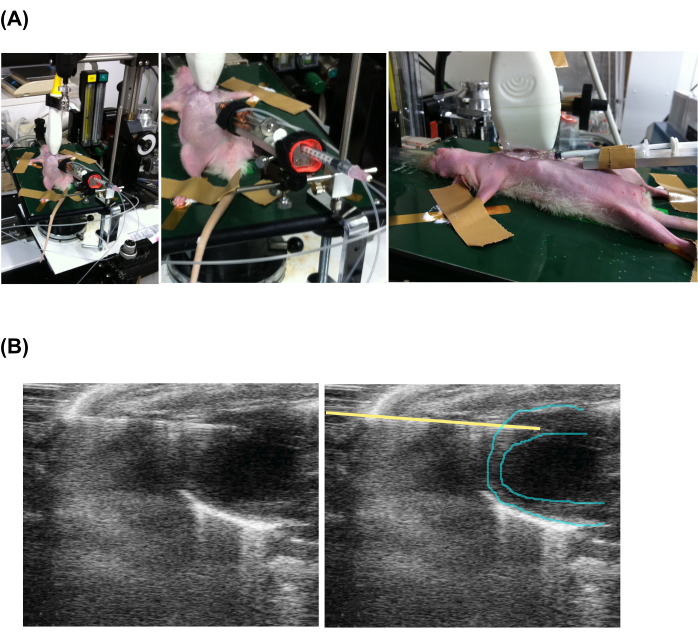
図2:心エコー図ガイド下経皮的徐行注射。 (a)動物のセッティング、エコープローブ、及び注射装置。(B)注射器と心臓の心エコー図。なお、左と右の写真は同じですが、針の位置を示す黄色い線が引かれています。この図の拡大版をご覧になるには、ここをクリックしてください。
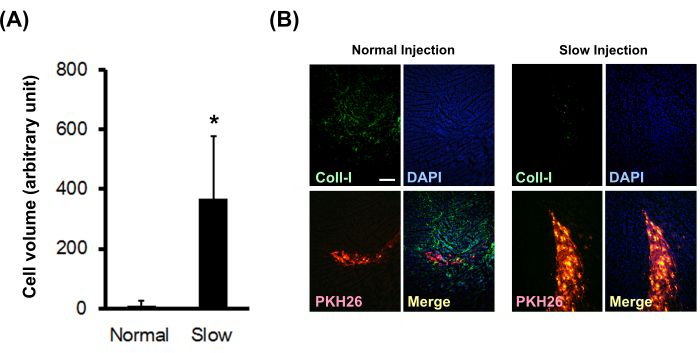
図3:生着細胞量とコラーゲン沈着に対するスローインジェクション法の影響 。 (A)生着した細胞体積(N=3)を連続切片から計算した。エラーバーは標準偏差を示します。*対応 のない t検定ではP<0.01です。(B)I型コラーゲンの免疫組織化学的染色。スケールバーは200μmを示しています。 この図の拡大版をご覧になるには、ここをクリックしてください。
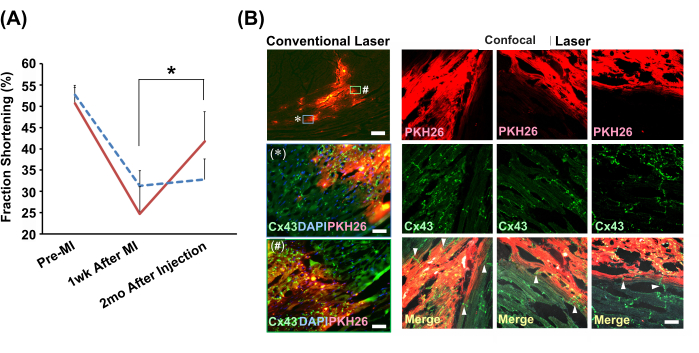
図4:スローインジェクション法で生着した心筋細胞ボールによる心機能および組織学的統合の改善。 (A)代表的な心エコー計のMモード図。グラフは、心筋細胞球移植群における分画短縮の推移を示しています(赤の実線;N=4)とビヒクル(低速注入法用の細胞懸濁液)群(青点線;N = 3) です。略語:MI =心筋梗塞;Cx43 =コネキシン43;DAPI = 4',6-ジアミジノ-2-フェニルインドール;PKH26 = 赤色蛍光細胞膜標識。誤差範囲は標準偏差を示します。*対応のあるt検定でです。(B)生着心筋細胞ボールと宿主心筋細胞との関係の免疫組織化学的解析。2倍の対物レンズを用いた従来のレーザー顕微鏡観察を左列に示します。ボックスに示されている * と # のラベルが付いた 2 つの領域の拡大 (20 倍対物レンズを使用) を以下に示します。スケールバー:トップ画像 = 300 μm;*および#=30μm。20倍の対物レンズを使用した共焦点レーザー顕微鏡画像は、比較のために一緒に示されています。3 つの位置が表示されます。マージされた画像では、矢印は移植片と宿主心筋細胞を直接接続するギャップ接合(Cx43)の存在を示しています。スケールバーは30μmを示しています。 この図の拡大版をご覧になるには、ここをクリックしてください。
補足動画1:エコーガイド低速注入法 正面図のBモード心エコー図では、注射針の先端が心筋に進んでいる様子が見られます。 このファイルをダウンロードするには、ここをクリックしてください。
ディスカッション
スローインジェクション法を成功させるための重要なポイントの1つは、強力なシリンジポンプと強力な圧力伝達チューブを使用して効果的な注入システムを準備することです。細い針の先端からゲルを押し出すには、高圧システムが必要です。2つ目の重要なポイントは、心臓の安定化です。心筋に進入した注射針に対して心臓を鼓動させると、組織が損傷する可能性があります。この研究では、動物が2回目の開胸損傷を受けるのを防ぎ、肺を膨らませた状態で安定した心臓に細胞注射を投与するために、エコーガイド下注射が行われました。さらに、大型動物やヒト向けのアプリケーションでは、心臓に取り付けられた注射装置をアプリケーションの戦略的設計の一部として考慮する必要があります。小動物の心臓への開胸注射では、心拍数が高いため、長くて柔軟な針の使用が推奨されます。
この研究では、スロー注入法は、通常の注入法と比較して、生存する心筋細胞の体積を有意に増加させました。通常の射出では、せん断応力15 によってセルが損傷します。これに対し、低速射出法は、低速射出に加えて非ニュートン解を使用するため、理論的にはこのような応力は発生しません。
局所線維症に関しては、通常注射された生き残った心筋細胞の周囲の間質腔は、強力で広範囲にわたるI型コラーゲン沈着を示しました。対照的に、スローインジェクション法を用いて移植された生着心筋細胞の周りのI型コラーゲンシグナルは、はるかに弱く、より限定的であった。このことは、低速注入法の方がダメージが有意に少なかったことを示唆している。新生児の心筋細胞を成人の心筋にゆっくりと注入すると、梗塞した心臓の収縮機能が有意に改善されました。組織学的解析の結果、スローインジェクション法を用いて心筋細胞を移植すると、宿主の心筋細胞と直接結合し、機能的に結合することが示唆された。この現象は、宿主心筋の機能回復のメカニズムを説明しています。私たちの知る限り、これは宿主の成体心筋細胞と大規模でシームレスな接続を持つ生着した新生児心筋細胞の最初の報告です。電気的および機械的結合 を介した 宿主心筋との機能的接続により、生着心筋細胞が成熟し、宿主の心機能に寄与する機能的な筋細胞として機能的に機能する可能性があります。宿主と移植片心筋細胞の間の長期的な物理的力の相互作用は、完全な成熟に不可欠です。したがって、梗塞した心臓の機能回復には、注射後2か月が必要になる場合があります。患者の心機能の時間依存的な回復は、治療用途で予想される現象である可能性があり、これは、宿主と移植された心筋細胞との間の de novo 機能結合と統合の確立の成功の特徴である可能性があります。
開胸手術中にゆっくりとした注射法を行うことができます。また、この方法はマウスにも適用できる。人間治療への将来の応用のためには、まだいくつかの問題を解決する必要があります。注入速度は、各ヒト標的臓器における間質液流の緩衝容量を考慮して最適化する必要があります。ヒトゼラチンや生分解性合成材料などのゼノフリー材料を適用する必要があります。コンパクトな臓器固有の使い捨てツールや再利用可能な広臓器適用可能な装置など、臨床GMPグレードの低速注射装置を開発する必要があります。
開示事項
著者は何も開示していません。
謝辞
本研究は、日本学術振興会科学研究費補助金(23390072 and 19K07335)およびAMED(A-149)の支援を受けて行われました。
資料
| Name | Company | Catalog Number | Comments |
| 18-gauge needle & tuberculin, 1 mL | Terumo | NN1838R, SS-01T | |
| 29-gauge 50 mm-long needle | Ito Corporation, Tokyo, Japan | 14903 Type-A | |
| A copper tube | General Suppliers | outer diameter, 1 mm; inner diameter, 0.3 mm; thickness, 0.35 mm | |
| Ads Buffer | Each ingredient was purchased from Fuji Film Wako Chemical Inc., Miyazaki, Japan | Hand made, Composition: 116 mM NaCl, 20 mM HEPES, 12.5 mM NaH2PO4, 5.6 mM glucose, 5.4 mM KCl, 0.8 mM MgSO4, pH 7.35 | |
| alpha-MEM | Fuji Film Wako Chemical Inc., Miyazaki, Japan | 051-07615 | |
| Anti-collagen type I rabbit polyclonal antibody (H+L) | Proteintech | 14695-1-AP | using dilution 1:100 |
| Anti-Connexin-43 rabbit polyclonal antibody (H+L) | Sigma Aldrich | C6219 | using dilution 1:100 |
| Anti-rabbit IgG (H+L) donley polyclonal antibody-AlexaFluo488 | Thermo Scientific | A21206 | using dilution 1:300 |
| blocking solution (Blocking One) | Nacalai Tesque, Kyoto, Japan | 03953-95 | |
| collagenase | Fuji Film Wako Chemical Inc., Miyazaki, Japan | 034-22363 | |
| confocal laser microscope | Carl Zeiss Inc., Oberkochen, Germany | LSM510 META | |
| DNase I | Sigma-Aldrich | DN25 | |
| FACS Aria III | Becton Dickinson, Franklin Lakes, NJ, USA | ||
| fetal bovine serum | BioWest, FL, USA | S1820-500 | |
| fine movement device (Micromanipulator) | Narishige Co., Ltd., Tokyo, Japan | M-44 | |
| fluorescence microscope | Nikon Instruments, Tokyo, Japan | Eclipse Ti2 | |
| gelatin from bovine skin | Sigma-Aldrich | G9382 | dissolving in PBS (-) to 10%, and autoclaving it |
| Neonatal Sprague-Dawley (SD) rats | Japan SLC Inc., Shizuoka, Japan | 0–2 d after birth | |
| non-adhesive 96-well plates (spheloid plate) | Sumitomo Bakelite, Tokyo, Japan | MS-0096S | |
| Optimal Cutting Temperature (OCT) Compound | Sakura Finetek USA, Inc., CA, USA | Tissue-Tek OCT compound | |
| peristaltic pump (for cooling system) | As One Co., Osaka, Japan | SMP-23AS | |
| PKH26 | Sigma-Aldrich | PKH26GL | |
| Stir Bar, Micro, Magnetic, PTFE, Length x Dia. in mm: 5 x 2 | Chemglass life sciences LLC, NJ, USA | CG-2003-120 | |
| syringe | Ito Corporation, Tokyo, Japan | MS-N25 | |
| syringe pump with remote controller | As One Co., Osaka, Japan | MR-1, CT-10 | |
| tetramethylrhodamine methyl ester | Thermo Fisher Scientific, Waltham, MA, USA | T668 | |
| trypsin | DIFCO, Becton Dickinson, Franklin Lakes, NJ, USA | 215240 | |
| Tween-20 | Fuji Film Wako Chemical Inc., Miyazaki, Japan | 167-11515 | |
| veterinarian ointment | Fujita Pharmaceutical Co., Ltd. | Hibikusu ointment #WAK-95832 | |
| Vevo 2100 Imaging System | Fujifilm VisualSonics, Inc., Toronto, Canada | Vevo 2100 | |
| Vevo 2100 Imaging System software version 1.0.0 | Fujifilm VisualSonics, Inc., Toronto, Canada | Vevo 2100 | |
| Weakly curved needle with ophthalmic thread | Natsume Seisakusho Co., Ltd., Tokyo, Japan | C7-70 |
参考文献
- Chavkin, N. W., et al. The cell surface receptors Ror1/2 control cardiac myofibroblast differentiation. Journal of the American Heart Association. 10 (13), e019904(2021).
- Li, H., et al. The cell membrane repair protein MG53 modulates transcription factor NF-κB signaling to control kidney fibrosis. Kidney International. 101 (1), 119-130 (2022).
- Liu, X., Liu, Y., Khodeiry, M. M., Lee, R. K. The role of monocytes in optic nerve injury. Neural Regeneration Research. 18 (8), 1666-1671 (2023).
- Weber, F., Treeck, O., Mester, P., Buechler, C. Expression and function of BMP and activin membrane-bound inhibitor (BAMBI) in chronic liver diseases and hepatocellular carcinoma. International Journal of Molecular Sciences. 24 (4), 3473(2023).
- Tohyama, S., et al. Distinct metabolic flow enables large-scale purification of mouse and human pluripotent stem cell-derived cardiomyocytes. Cell Stem Cell. 12 (1), 127-137 (2013).
- Hattori, F., Fukuda, K. Strategies for replacing myocytes with induced pluripotent stem in clinical protocols. Transplantation Reviews. 26 (3), 223-232 (2012).
- Hattori, F., et al. Nongenetic method for purifying stem cell-derived cardiomyocytes. Nature Methods. 7 (1), 61-66 (2010).
- Fernandes, S., et al. Human embryonic stem cell-derived cardiomyocytes engraft but do not alter cardiac remodeling after chronic infarction in rats. Journal of Molecular and Cellular Cardiology. 49 (6), 941-949 (2010).
- Shiba, Y., et al. Allogeneic transplantation of iPS cell-derived cardiomyocytes regenerates primate hearts. Nature. 538 (7625), 388-391 (2016).
- Wendel, J. S., et al. Functional effects of a tissue-engineered cardiac patch from human induced pluripotent stem cell-derived cardiomyocytes in a rat infarct model. Stem Cells Translational Medicine. 4 (11), 1324-1332 (2015).
- Hattori, F. Technology Platforms for Heart Regenerative Therapy Using Pluripotent Stem Cells. Stem Cells and Cancer Stem Cells, Volume 7: Therapeutic Applications in Disease and Injury. , 33-45 (2012).
- Tao, S., et al. Ablation lesion characterization in scarred substrate assessed using cardiac magnetic resonance. JACC: Clinical Electrophysiology. 5 (1), 91-100 (2019).
- Rutkowski, J. M., Swartz, M. A. A driving force for change: interstitial flow as a morphoregulator. Trends in Cell Biology. 17 (1), 44-50 (2007).
- Hattori, F. How to purify cardiomyocytes for research and therapeutic purposes. Cardiac Regeneration using Stem Cells. Fukuda, K., Yuasa, S. , CRC Press. Boca Raton, FL. (2013).
- Li, M., Tian, X., Zhu, N., Schreyer, D. J., Chen, X. Modeling process-induced cell damage in the biodispensing process. Tissue Engineering. Part C, Methods. 16 (3), 533-542 (2010).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved