Method Article
Новый метод введения клеток с минимальной инвазией
В этой статье
Резюме
Этот метод исключает любую серьезную инвазию во время инъекций клеток, вызванную раствором клеточной суспензии.
Аннотация
Непосредственное введение клеток в ткани является необходимым процессом при введении клеток и/или заместительной терапии. Для введения клеток требуется достаточное количество суспензионного раствора, чтобы позволить клеткам проникнуть в ткани. Объем раствора суспензии влияет на ткани, и это может привести к серьезному инвазивному повреждению в результате введения клеток. В этой статье сообщается о новом методе клеточной инъекции, называемом медленной инъекцией, который направлен на предотвращение этой травмы. Однако для выталкивания ячеек из кончика иглы требуется достаточно высокая скорость впрыска в соответствии с законом сдвиговой силы Ньютона. Для разрешения вышеуказанного противоречия в качестве раствора клеточной суспензии в данной работе использовалась неньютоновская жидкость, такая как раствор желатина. Раствор желатина обладает температурной чувствительностью, так как его форма меняется от геля к золю примерно на 20 °C. Поэтому для поддержания раствора клеточной суспензии в форме геля шприц держали охлажденным в этом протоколе; Однако, как только раствор был введен в организм, температура тела превратила его в золь. Поток межтканевой жидкости может абсорбировать излишки раствора. В этой работе техника медленной инъекции позволила шарикам кардиомиоцитов войти в миокард хозяина и прижиться без окружающего фиброза. В этом исследовании использовался метод медленной инъекции для введения очищенных и сформированных в виде шара кардиомиоцитов новорожденных крыс в отдаленную область инфаркта миокарда в сердце взрослой крысы. Через 2 месяца после инъекции в сердцах трансплантированных групп наблюдалось значительное улучшение сократительной функции. Кроме того, гистологический анализ медленно вводимых сердец выявил бесшовные связи между кардиомиоцитами хозяина и трансплантата через интеркалированные диски, содержащие щелевые соединения. Этот метод может внести вклад в клеточную терапию следующего поколения, особенно в регенеративной медицине сердца.
Введение
Введение и замена клеток являются многообещающими новыми терапевтическими стратегиями для сильно поврежденных органов. Среди этих новых терапевтических стратегий значительное внимание привлекла регенеративная медицина сердца. Однако воспаление, вызванное травмами, опосредует образование рубцов в нескольких органах 1,2,3,4. Человеческое сердце состоит примерно из10-10 кардиомиоцитов; Следовательно, теоретически5,6, его нужно лечить более чем 10-9 кардиомиоцитами. Введение большого количества кардиомиоцитов традиционными инъекционными методами может привести к значительному повреждению тканей7. Этот метод представляет собой новый метод введения клеток с минимальной инвазией в ткани.
Введение клеток в паренхиму органа требует инъекции. Однако существует несоответствие в том, что сама инъекция может привести к повреждению тканей. Повреждение тканей вызывает местное воспаление и неизлечимое рубцевание в органах и тканях, а также нарушение регенеративной способности 8,9,10. Сердце млекопитающих имеет чрезвычайно высокую склонность к образованию рубцов вместо того, чтобы восстанавливаться, потому что оно требует немедленного восстановления после травмы, чтобы выдержать высокое кровяное давление, вызванное его непрерывной насоснойфункцией. Абляционная терапия использует эту высокую склонность к образованию рубцов и блокирует цепь, которая может подвергнуться образованию рубцов с помощью аритмии12. В предыдущем исследовании было замечено, что рубцовая ткань изолирует введенные кардиомиоциты в миокарде хозяина. Таким образом, это представляет собой следующую целевую проблему, которую необходимо преодолеть для повышения терапевтической эффективности в сердечной регенеративной медицине.
Поток межтканевой жидкости играет жизненно важную роль в транспортировке кислорода и питательных веществ к клеткам и удалении выводимых из клеток отходов. Физиологическая скорость потока интерстициальной жидкости в каждой ткани/органе различна (диапазон 0,01-10 мкм/с)13. Насколько известно автору, нет данных о способности отдельных тканей/органов поддерживать избыточное количество жидкости без патологического отека; Тем не менее, в этом эксперименте предпринята попытка использовать медленную скорость инъекции, чтобы, возможно, уменьшить повреждение тканей, и результаты могут быть использованы для определения практичности этой концепции.
протокол
Эксперименты на животных проводились в соответствии с этическими рекомендациями Медицинского университета Кансай для экспериментов на животных и были одобрены этическими комитетами (номер одобрения: 23-104). Все животные были выращены в постоянном цикле света и темноты в специфической среде, свободной от патогенов. Все стерилизованные хирургические инструменты, такие как ножницы, щипцы и ретракторы, были автоклавированы и тщательно высушены.
1. Приготовление шариков кардиомиоцитов новорожденной крысы
- Коллекция сердец новорожденных крыс
- Для забора сердца выполните процедуру, аналогичную той, что описана в предыдущем отчете7.
- Неонатальных (0-2 дня после рождения) крыс Спрэга-Доули (SD) последовательно погружают в растворы повидон-йода и 70% этанола, а затем переносят их в герметичный футляр, заполненный испаренным изофлураном (концентрация должна быть более 10% v/v) для глубокой анестезии.
- После подтверждения потери сознания потерей двигательной активности обезглавить крысу, держась рукой за туловище со спины, а затем острыми ножницами отрезать 2-4 мм ткани от лобного центра грудной клетки до каудального и затем в ростральном направлении.
- Возьмитесь за кожу спины, чтобы растянуть порез и вытолкнуть сердце из грудной клетки. Разрежьте желудочки ножницами и погрузите их в фосфатно-солевой буфер (PBS) без кальция или магния (PBS(−)).
- Дисперсия кардиомиоцитов новорожденных крыс
- Собранные желудочки, диспергированные в минимальном количестве буфера Ads (буфер Ads: 116 мМ NaCl, 20 мМ HEPES, 12,5 мМ2PO 4, 5,6 мМ глюкозы, 5,4 мМ KCl, 0,8 мМ MgSO4, рН 7,35) в автоклавной вогнутой стеклянной посуде на небольшие кусочки (1 мм х 1 мм) с помощью изогнутых ножниц.
- Перенесите измельченные ткани и микромагнитную мешалку в центрифугированную пробирку объемом 50 мл и диспергируйте ткани в отдельные клетки с 0,1% коллагеназы, 0,1% трипсина, 20 мкг/мл ДНКазы I и 50 нМ метилового эфира тетраметилродамина в буфере Ads при 37 °C, перемешивая в течение 30 мин.
- Отделите агрегаты и дисперсные клетки путем естественного осаждения, соберите только дисперсные клетки в пробирку и снова переварите остаточные клеточные агрегаты в той же среде для сбраживания.
- Продолжайте эту процедуру до тех пор, пока все клетки полностью не диссоциируют. Чтобы убедиться в полной дисперсии клеток, понаблюдайте за пробирками под микроскопом (4-кратный объектив).
- Соберите дисперсные клетки с помощью центрифугирования при 150 x g в течение 5 мин и диссоциируйте их в 1-2 мл буфера Ads.
- Флуоресцентно-активированная сортировка клеток кардиомиоцитов
- Анализ клеток с помощью флуоресцентно-активированной сортировки клеток (FACS) с использованием полосовых фильтров 556-601 нм для обнаружения красных флуоресцентных сигналов.
- Тщательно выполняют предварительную литниковую обработку для исключения дублетных фракций14. Настройки строба для устранения дублетов должны соответствовать инструкциям производителя.
- Установите прямое рассеяние по оси X и красный сигнал флуоресценции по оси y. Наблюдались три популяции: самая нижняя популяция, содержащая эритроциты и мертвые клетки, средняя популяция, содержащая некардиомиоциты, включая фибробласты и эндотелиальные клетки, и верхняя популяция, содержащая чистые кардиомиоциты желудочков.
- Приготовление красных меченых флуоресценцией шариков кардиомиоцитов
- Селективно сортируют кардиомиоциты и центрифугируют в течение 5 мин при 150 х г. Полностью растворите клеточные гранулы в 1 мл альфа-модифицированной минимальной эфирной среды (альфа-МЭМ), содержащей 10% термически инактивированной фетальной бычьей сыворотки (FBS).
- Измерьте концентрацию клеток с помощью гемоцитометра и разбавьте раствор клеточной суспензии до 3000 клеток/мл альфа-MEM 10% FBS.
- Распределите их по клеточным неадгезивным 96-луночным планшетам (100 мкл на лунку), центрифуге в течение 5 мин при 100 x g и культивируйте в течение 2-3 дней в клеточном культуральном инкубаторе с 5% CO2 при 37 °C.
- Перед инъекционными экспериментами забор шарика кардиомиоцитов из каждой лунки путем аспирации с питательной средой с помощью пипетки объемом 1 000 мкл и сбор их в пробирку объемом 15 мл.
- Покрасьте PKH26 в соответствии с инструкциями производителя по отслеживанию после приживления.
2. Препараты для медленного инъекционного метода
- Приготовление исходного раствора желатина
- Взвесьте желатин, растворите его в буфере Ads, чтобы получить 10% раствор w/v, и автоклавируйте его.
- Производство устройства для введения клеток
- Общая конструкция устройства: Подготовьте устройство, показанное на рисунке 1. Данная система совмещена с аппаратом охлаждения шприца и основным инъекционным аппаратом.
- Подготовьте основной инъекционный аппарат, описанный ниже:
- Для инъекции шарика кардиомиоцитов новорожденным используют иглу 29 G, длиной 50 мм, оснащенную шприцем.
- Подключите шприц для передачи энергии (18 г, 1 мл) вплотную друг к другу с помощью шприца для инъекций клеток (Рисунок 1). Подсоедините иглу шприца для передачи мощности к тонкой полипропиленовой трубке с низкой расширяемостью просвета.
- Затем подсоедините другую сторону трубки для передачи мощности к игле того же шприца (18G, 1 мл) и установите ее в шприцевой насос. Наполните два силовых шприца и пробирки водой без пузырьков воздуха.
ПРИМЕЧАНИЕ: Когда один поршень шприца для передачи энергии вдавливается, давление напрямую передается другому шприцу, и поршень выступает.
- Настройте систему охлаждения инъекционного шприца, как описано ниже.
- Плотно намотайте медную трубку (внешний диаметр = 1 мм; внутренний диаметр = 0,3 мм; толщина = 0,35 мм) вокруг клеточной части шприца для инъекций клеток, оставив на обоих концах по 10 мм лишней трубы.
- Подсоедините медную трубку к гибкой пластиковой трубке. Далее подсоедините другие концы пластиковой трубки к внешнему насосу, заполните трубопровод охлаждающей водой и охладите воду, погрузив излишки медной трубки в колотый лед (рисунок 1).
ПРИМЕЧАНИЕ: Эта система охлаждения поддерживает суспензию ячеек в цилиндре при температуре около 2 °C.
3. Разработка модели инфаркта миокарда крысы при тупой окклюзии коронарных артерий
- Обезболивайте самцов голых крыс с иммунодефицитом (F344/Njcl-rnu/rnu) воздухом, содержащим 3% изофлурана. Вставьте канюлю в трахею и соедините ее с респиратором.
- Подключите канюлю к испарителю изофлурана с контроллером, чтобы поддерживать концентрацию изофлурана 3% и, таким образом, поддерживать достаточную анестезию. Убедитесь в отсутствии реакции на болевые раздражители. Наносите ветеринарную мазь на глаза, чтобы не допустить сухости.
- Зафиксируйте конечности разрезанными хирургическими лентами на хирургической пластине, нагретой при температуре 40 °C. Поверните тело крысы вправо от оси тела и используйте левую подмышку в качестве операционного поля.
- Удалите волосы в операционном поле с помощью крема для депиляции и протрите кожу повидон-йодом. С помощью острых ножниц сделайте разрез длиной 1,5 см на коже и большой грудной мышце.
- Подтвердите третье межреберье и разорвите межреберные мышцы и реберную плевру с помощью микрощипцов с тупыми кончиками. Держите грудную клетку открытой, используя втягивающее устройство. Аккуратно удалите тонкий перикард щипцами.
- Чтобы построить модель инфаркта боковой стенки сердца, найдите положение 1 мм каудально от кончика левого предсердия, чтобы определить тупую коронарную артерию, наложите шелковый шов 7-0, зачерпните ткань шириной 2,5 мм и глубиной 2,5 мм от дорсальной до вентральной и плотно перевязайте ткань.
- Подтвердите успешное перевязку слабым сокращением дистальнее лигатуры. Осторожно сняв ретрактор, наложите шелковый шов 5-0 между вторым и четвертым межреберьем и закройте торакотомию.
- Уменьшите концентрацию изофлурана до 1%. Аккуратно зашить мышцы и кожу шелком 5-0. Уменьшите концентрацию изофлурана до 0% и подождите примерно 5 минут, пока не начнется спонтанное дыхание.
- Местно нанесите на разрез 2 мг/мл лидокаина в физиологическом растворе. Ввести 1 мл физиологического раствора через подкожную инъекцию. Применяйте ветеринарную мазь местно, чтобы предотвратить инфекции.
- Извлеките крысу из интубационной трубки и вернитесь в клетку для животных; Затем выращивайте крыс в индивидуальных клетках в течение 1 недели.
- Анализируют изменения функции систолического насоса сердца с помощью эхокардиографии.
ПРИМЕЧАНИЕ: Сердечная функция снижается вследствие бокового инфаркта миокарда.
4. Чрескожная трансплантация клеток под контролем эхо-контроля методом медленной инъекции
- Предварительно нагрейте 10% желатиновый бульон при 37 °C, пока он не станет жидким.
- Разбавьте 10% желатиновый бульон предварительно подогретым буфером Ads, чтобы получить окончательный инъекционный 5%-ный раствор желатина (требуется 100 мкл на одно животное).
- Суспендировать 96 шариков кардиомиоцитов (всего: 28 800 кардиомиоцитов на животное) в 100 мкл предварительно подогретого раствора для инъекций.
- Суспензию, приготовленную на шаге 4.3, загружают в клеточный инъекционный шприц, избегая аспирации лишнего воздуха.
- Чтобы удалить пузырьки в шприце, держите его вертикально иглой вверх, постучите по шприцу и соберите все пузырьки на верхнем гребне шприца.
ПРИМЕЧАНИЕ: Во время этого шага наблюдайте, как шарики кардиомиоцитов постепенно оседают на резиновое уплотнение поршня. - Поддерживайте вертикальное положение шприца, медленно нажимайте на поршень и выбрасывайте пузырьки и излишки клеточной суспензии до тех пор, пока в шприце не останется 20 мкл клеточной суспензии. Осторожно надавите на поршень с постоянной скоростью, чтобы шарик кардиомиоцитов оставался лежащим на резиновом уплотнении поршня.
- Погрузите шприц с крышкой прямо в ледяную баню на 5 минут.
- Поместите остывший шприц в инъекционный аппарат. Плотно зафиксируйте инъекционный шприцевой аппарат, установленный на устройстве тонкого движения, на животном предмете с помощью зажима ручной работы с регулировкой положения X-Y-Z. Устройство точного перемещения может перемещать положение иглы с помощью ползуна 20 мм в направлении X, поворота в направлении Y и изгибающихся движений в направлении Z.
- Обезболивайте крыс в герметичной коробке, наполненной воздухом, содержащим 3% изофлурана. Подтвердите анестезию, не реагируя на болевые раздражители. Наносите ветеринарную мазь на глаза, чтобы не допустить сухости.
- Зафиксируйте конечности разрезанными хирургическими лентами на эхопластине, нагретой при температуре 40 °C. Чтобы обеспечить достаточную анестезию, убедитесь, что вдыхаемый воздух содержит примерно 3% концентрации изофлурана.
- Удалите волосы в месте инъекции (2 см в диаметре) и грудь кремом для депиляции и протрите кожу повидон-йодом.
- Нанесите эхо-гель на грудную клетку и эхозонд. Поместите эхо-зонд близко к грудной клетке вдоль черепной и каудальной осей и начните получать эхокардиографию в В-режиме, следуя инструкции производителя.
- Введите кончик инъекционной иглы в миокард в виде спереди (рис. 2 и дополнительное видео 1).
- Чтобы активировать главный шприцевой насос, нажмите кнопку «Пуск » и поверните диск, чтобы настроить скорость впрыска примерно 0,02 мкл/с. Нанесите ветеринарную мазь местно вокруг места иглоукалывания, чтобы предотвратить инфекции.
ПРИМЕЧАНИЕ: Необходимо определить соответствующий номер набора для предполагаемой скорости впрыска с помощью раствора для инъекций. После инъекции извлеките инъекционную иглу с помощью системы образцового движения. - Уменьшите концентрацию изофлурана до 0% и подождите примерно 5 минут, пока животное не придет в сознание, достаточное для поддержания положения грудины.
5. Оценка сердечной функции
- Обезболивайте крыс в герметичной коробке, наполненной воздухом, содержащим 3% изофлурана. Подтвердите анестезию, не реагируя на болевые раздражители. Наносите ветеринарную мазь на глаза, чтобы не допустить сухости.
- Нанесите электризующий крем для получения ЭКГ на кончики конечностей. Зафиксируйте конечности разрезанными хирургическими лентами на эхопластине, нагретой при температуре 40 °C. Используйте систему физиологического мониторинга для определения ЭКГ и частоты сердечных сокращений в режиме реального времени.
- В соответствии с инструкциями производителя, сначала определите угол длинной оси с помощью эхо-изображения B-режима, показывающего вершину левого желудочка к выходному тракту, а затем поверните эхо-зонд на 90°, чтобы переключиться на вид с короткой осью.
- Используя только систему тонких движений от каудальной оси до ростральной оси животного, отрегулируйте вид по короткой оси на уровне папиллярной мышцы. Затем переключите режим изображения на M-режим, нажав кнопку M-режима , и запишите видео в течение 5 секунд, нажав кнопку Cine-loop .
- Чтобы проанализировать и рассчитать укорочение фракции с помощью программного обеспечения, нажмите кнопку «Измерить » и инструмент вертикальной линии, чтобы определить конечные систолические и конечные диастолические внутренние размеры левого желудочка. Программа автоматически рассчитывает процент сокращения фракций (FS).
- Уменьшите концентрацию изофлурана до 0% и подождите примерно 5 минут, пока животное не придет в сознание, достаточное для поддержания положения грудины.
6. Иммуногистохимия
- Зафиксируйте усыпленное тело (выполните эвтаназию, как в шаге 1.1.3) на столе с помощью разрезанных хирургических лент, удалите сердца, промойте PBS и погрузите сердце в 4% параформальдегид/PBS.
- Разделите сердца на три части, погрузите их в 40% сахарозу для криозащиты, поместите в компаунд с оптимальной температурой резки (OCT) и заморозьте при −80 °C.
- Прикрепите криосекционированные ткани (толщиной 8 мкм) к предметным стеклам, покрытым аминосиланом. После достаточной сушки с использованием ненагретого ветра, создаваемого обычным феном, погрузите предметные стекла в трис-буферный физиологический раствор, содержащий 0,2% Tween-20 (TBS-T).
- Погрузите их в блокирующий раствор на 30 мин при температуре 25 °C. Налейте 100 мкл первичного блокирующего раствора, содержащего антитела, на предметное стекло и инкубируйте в течение ночи при температуре 4 °C с парафиновой герметизацией, чтобы раствор антител распределился по тканям.
ПРИМЕЧАНИЕ: Концентрация антител указана в таблице материалов. - Положите предметные стекла горизонтально в самодельную коробку с высокой влажностью, используя естественный пар от влажной бумаги, чтобы предотвратить испарение. Вымойте предметные стекла три раза с помощью TBS-T.
- Обрабатывать вторичным антителосодержащим блокатором в течение 1 ч при 25 °C так же, как и первичным антителом. После трех промывок наблюдайте за флуоресцентными сигналами с помощью флуоресцентного микроскопа и конфокального лазерного микроскопа.
ПРИМЕЧАНИЕ: Концентрация антител указана в таблице материалов. - Статистический анализ: Для сравнения объема ячейки, как показано на рисунке 3A, выполните непарный t-критерий; Для оценки функционального восстановления сердца после введения кардиомиоцитов методом медленной инъекции, как показано на рисунке 4А, используют парный Т-критерий. В данной работе различия считались статистически значимыми при P < 0,01. Столбцы погрешности представляют собой стандартное отклонение.
Результаты
Влияние медленной инъекции на выживаемость клеток и отложение коллагена
Шарики кардиомиоцитов новорожденных крыс, меченные PKH26, вводили в нормальный голый миокард крысы с помощью обычного или медленного метода инъекции. Результаты показали, что метод медленной инъекции значительно увеличил объем приживленных клеток (рис. 3А) и значительно снизил отложение коллагена I типа на месте (рис. 3Б).
Влияние медленной инъекции на эффективность лечения в модели инфаркта крыс
Метод медленной инъекции под контролем эхокардиографа был использован для введения шариков кардиомиоцитов новорожденных крыс или PBS(−) в инфарктные сердца модельных крыс. Только в группе, получавшей инъекции клеток, наблюдалось значительное улучшение функции сокращения сердца через 2 месяца (рис. 4A). Иммуногистохимический анализ выявил бесшовную связь между привитыми клетками и миоцитами хозяина через интеркалированные диски, содержащие щелевые контакты (рис. 4Б).
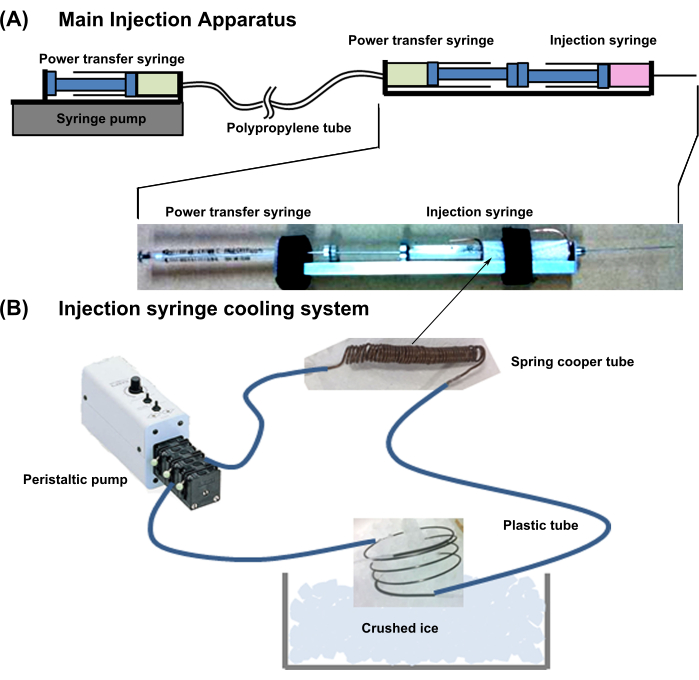
Рисунок 1: Схема всей системы впрыска . (А) Основной инжекторный аппарат. (B) Система охлаждения инъекционного шприца. Пожалуйста, нажмите здесь, чтобы увидеть увеличенную версию этого рисунка.
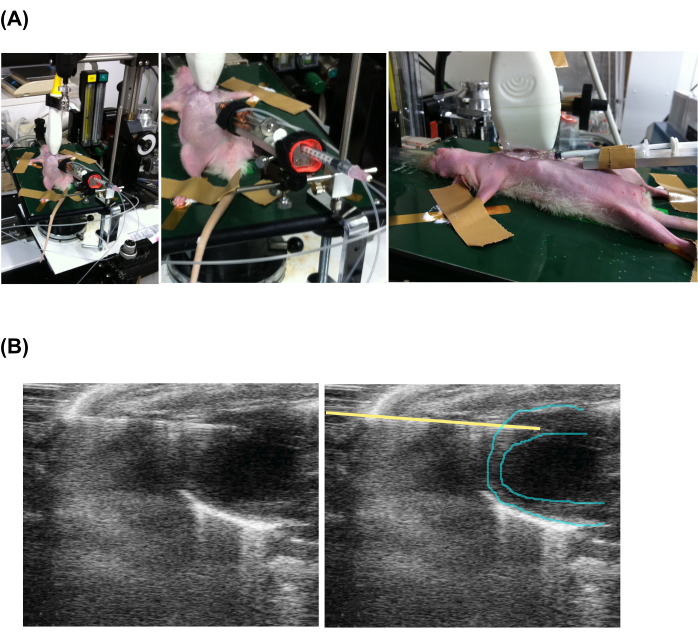
Рисунок 2: Чрескожная медленная инъекция под контролем эхокардиографии . (A) Настройка животного, эхо-зонда и инъекционного аппарата. (Б) Эхокардиографический снимок инъекционного шприца и сердца. Обратите внимание, что левая и правая картинки совпадают, но добавлена желтая линия для обозначения положения иглы. Пожалуйста, нажмите здесь, чтобы увидеть увеличенную версию этого рисунка.
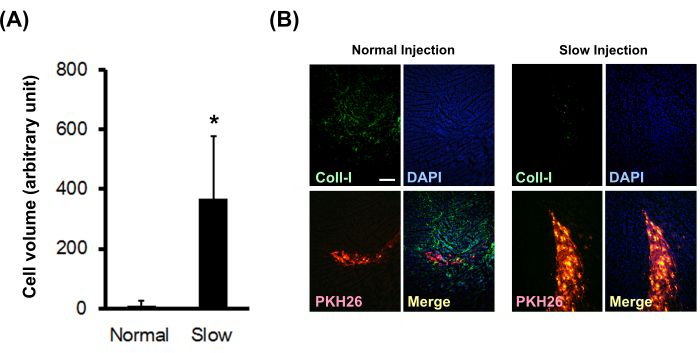
Рисунок 3: Влияние метода медленной инъекции на объем приживленных клеток и отложение коллагена. (A) Объемы привитых клеток (N = 3) рассчитывали по последовательным срезам. Столбцы погрешности показывают стандартные отклонения. *P < 0,01 в непарном t-критерии. (B) Иммуногистохимическое окрашивание коллагена I типа. Масштабная линейка показывает 200 мкм. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
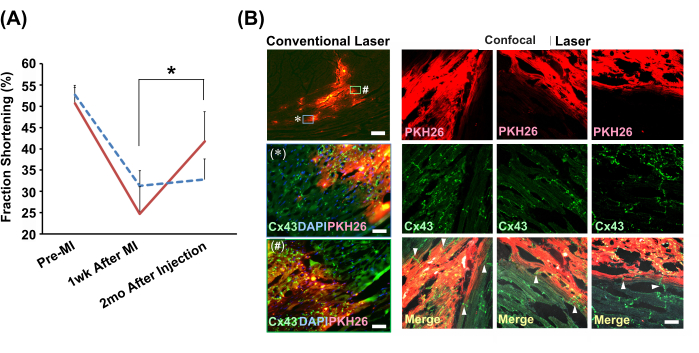
Рисунок 4: Улучшение функции сердца и гистологическая интеграция с шариками кардиомиоцитов, привитыми методом медленной инъекции. (A) Репрезентативные виды эхокардиографа в М-режиме. На графике показан переход укорочений фракций в группе кардиомиоцитарного шара, трансплантированного (сплошная красная линия; N = 4) и транспортная (клеточная суспензионная раствор для метода медленного впрыска) (пунктирная синяя линия; N = 3). Сокращения: ИМ = инфаркт миокарда; Cx43 = коннексин 43; DAPI = 4',6-диамидино-2-фенилиндол; PKH26 = красная флуоресцентная метка клеточной мембраны. Столбцы погрешности обозначают стандартные отклонения. *P < 0,01 в парном t-критерии. (Б) Иммуногистохимический анализ взаимосвязи между трансплантированными шариками кардиомиоцитов и кардиомиоцитами хозяина. В левой колонке показаны обычные лазерные микроскопические наблюдения с использованием объектива с 2-кратным увеличением. Увеличенные версии (с использованием объектива с 20-кратным увеличением) двух областей, показанных в рамке, помеченных * и #, представлены ниже. Масштабные линейки: верхнее изображение = 300 мкм; * и # = 30 мкм. Конфокальные лазерные микроскопические изображения с использованием 20-кратного объектива демонстрируются вместе для сравнения. Показаны три позиции. На объединенных изображениях стрелки указывают на существование щелевых контактов (Cx43), непосредственно соединяющих трансплантат и кардиомиоциты хозяина. Масштабная линейка показывает 30 мкм. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
Дополнительное видео 1: Метод медленного впрыска под эхо-контролем. На В-режиме эхокардиограммы в фронтальной проекции видно, что кончик инъекционной иглы продвинулся в миокард. Пожалуйста, нажмите здесь, чтобы загрузить этот файл.
Обсуждение
Одним из критических моментов успешного выполнения метода медленного впрыска является подготовка эффективной системы впрыска с использованием мощного шприцевого насоса и прочной трубки для перекачки давления. Для выталкивания геля из кончика тонкой иглы требуется система высокого давления. Второй критический момент – стабилизация работы сердца. Биение сердца о инъекционную иглу, введенную в миокард, может повредить ткань. В этом исследовании была проведена инъекция под эхо-контролем, чтобы избежать второй открытой травмы грудной клетки у животных и ввести инъекцию клеток в стабилизированное сердце с надутыми легкими. Более того, в некоторых случаях для более крупных животных или людей некоторые инъекционные устройства, прикрепленные к сердцу, следует рассматривать как часть стратегического дизайна приложения. Для открытых грудных инъекций в сердце мелких животных рекомендуется использовать длинную гибкую иглу, учитывая их более высокую частоту сердечных сокращений.
В данной работе метод медленной инъекции значительно увеличил объем сохранившихся кардиомиоцитов по сравнению с обычным инъекционным методом. Нормальный впрыск вызывает повреждение клетки из-за напряжения сдвига15. В отличие от этого, метод медленного впрыска теоретически не вызывает такого напряжения, потому что он использует неньютоновское решение в дополнение к медленному впрыскиванию.
Что касается локального фиброза, то интерстициальное пространство вокруг нормально введенных выживших кардиомиоцитов показало сильное и широкое отложение коллагена I типа. Напротив, сигналы коллагена I типа вокруг привитых кардиомиоцитов, пересаженных методом медленной инъекции, были намного слабее и ограниченнее. Это говорит о том, что метод медленного впрыска нанес значительно меньший ущерб. Медленное введение неонатальных кардиомиоцитов во взрослый миокард значительно улучшило сократительную функцию инфарктного сердца. Гистологический анализ показал, что пересадка кардиомиоцитов методом медленной инъекции приводит к прямым связям и функциональному сопряжению с кардиомиоцитами хозяина. Это явление объясняет механизм функционального восстановления миокарда хозяина. Насколько нам известно, это первое сообщение об инплантированных неонатальных кардиомиоцитах с крупномасштабными бесшовными соединениями с кардиомиоцитами взрослого хозяина. Функциональные связи с миокардом хозяина через электрическую и механическую связь могут сделать привитые кардиомиоциты зрелыми и позволить им действовать как функциональные миоциты, которые вносят свой вклад в функцию сердца хозяина. Длительные физические силовые взаимодействия между хозяином и кардиомиоцитами трансплантата имеют решающее значение для полного созревания. Таким образом, после инъекции может потребоваться 2 месяца для функционального восстановления инфаркта сердца. Зависящее от времени восстановление сердечной функции пациента может быть ожидаемым явлением в терапевтических приложениях, и это может быть отличительной чертой успешного установления функциональной связи de novo и интеграции между хозяином и трансплантированными кардиомиоцитами.
Метод медленной инъекции может быть выполнен во время открытой операции на грудной клетке. Кроме того, этот метод может быть применен к мышам. Для будущих применений в терапии человека нам все еще необходимо решить несколько вопросов. Скорость инъекции должна быть оптимизирована с учетом буферной емкости потока интерстициальной жидкости в каждом органе-мишени человека. Следует применять материалы, не содержащие ксено, такие как человеческий желатин или биоразлагаемые синтетические материалы. Необходимо разработать клинические аппараты для медленных инъекций в соответствии с требованиями GMP, такие как компактные одноразовые инструменты для специфических органов или многоразовые аппараты, применимые для широких органов.
Раскрытие информации
Автору нечего раскрывать.
Благодарности
Исследование выполнено при поддержке грантов JSPS KAKENHI (грант No 23390072 и 19K07335) и AMED (грант No A-149).
Материалы
| Name | Company | Catalog Number | Comments |
| 18-gauge needle & tuberculin, 1 mL | Terumo | NN1838R, SS-01T | |
| 29-gauge 50 mm-long needle | Ito Corporation, Tokyo, Japan | 14903 Type-A | |
| A copper tube | General Suppliers | outer diameter, 1 mm; inner diameter, 0.3 mm; thickness, 0.35 mm | |
| Ads Buffer | Each ingredient was purchased from Fuji Film Wako Chemical Inc., Miyazaki, Japan | Hand made, Composition: 116 mM NaCl, 20 mM HEPES, 12.5 mM NaH2PO4, 5.6 mM glucose, 5.4 mM KCl, 0.8 mM MgSO4, pH 7.35 | |
| alpha-MEM | Fuji Film Wako Chemical Inc., Miyazaki, Japan | 051-07615 | |
| Anti-collagen type I rabbit polyclonal antibody (H+L) | Proteintech | 14695-1-AP | using dilution 1:100 |
| Anti-Connexin-43 rabbit polyclonal antibody (H+L) | Sigma Aldrich | C6219 | using dilution 1:100 |
| Anti-rabbit IgG (H+L) donley polyclonal antibody-AlexaFluo488 | Thermo Scientific | A21206 | using dilution 1:300 |
| blocking solution (Blocking One) | Nacalai Tesque, Kyoto, Japan | 03953-95 | |
| collagenase | Fuji Film Wako Chemical Inc., Miyazaki, Japan | 034-22363 | |
| confocal laser microscope | Carl Zeiss Inc., Oberkochen, Germany | LSM510 META | |
| DNase I | Sigma-Aldrich | DN25 | |
| FACS Aria III | Becton Dickinson, Franklin Lakes, NJ, USA | ||
| fetal bovine serum | BioWest, FL, USA | S1820-500 | |
| fine movement device (Micromanipulator) | Narishige Co., Ltd., Tokyo, Japan | M-44 | |
| fluorescence microscope | Nikon Instruments, Tokyo, Japan | Eclipse Ti2 | |
| gelatin from bovine skin | Sigma-Aldrich | G9382 | dissolving in PBS (-) to 10%, and autoclaving it |
| Neonatal Sprague-Dawley (SD) rats | Japan SLC Inc., Shizuoka, Japan | 0–2 d after birth | |
| non-adhesive 96-well plates (spheloid plate) | Sumitomo Bakelite, Tokyo, Japan | MS-0096S | |
| Optimal Cutting Temperature (OCT) Compound | Sakura Finetek USA, Inc., CA, USA | Tissue-Tek OCT compound | |
| peristaltic pump (for cooling system) | As One Co., Osaka, Japan | SMP-23AS | |
| PKH26 | Sigma-Aldrich | PKH26GL | |
| Stir Bar, Micro, Magnetic, PTFE, Length x Dia. in mm: 5 x 2 | Chemglass life sciences LLC, NJ, USA | CG-2003-120 | |
| syringe | Ito Corporation, Tokyo, Japan | MS-N25 | |
| syringe pump with remote controller | As One Co., Osaka, Japan | MR-1, CT-10 | |
| tetramethylrhodamine methyl ester | Thermo Fisher Scientific, Waltham, MA, USA | T668 | |
| trypsin | DIFCO, Becton Dickinson, Franklin Lakes, NJ, USA | 215240 | |
| Tween-20 | Fuji Film Wako Chemical Inc., Miyazaki, Japan | 167-11515 | |
| veterinarian ointment | Fujita Pharmaceutical Co., Ltd. | Hibikusu ointment #WAK-95832 | |
| Vevo 2100 Imaging System | Fujifilm VisualSonics, Inc., Toronto, Canada | Vevo 2100 | |
| Vevo 2100 Imaging System software version 1.0.0 | Fujifilm VisualSonics, Inc., Toronto, Canada | Vevo 2100 | |
| Weakly curved needle with ophthalmic thread | Natsume Seisakusho Co., Ltd., Tokyo, Japan | C7-70 |
Ссылки
- Chavkin, N. W., et al. The cell surface receptors Ror1/2 control cardiac myofibroblast differentiation. Journal of the American Heart Association. 10 (13), e019904 (2021).
- Li, H., et al. The cell membrane repair protein MG53 modulates transcription factor NF-κB signaling to control kidney fibrosis. Kidney International. 101 (1), 119-130 (2022).
- Liu, X., Liu, Y., Khodeiry, M. M., Lee, R. K. The role of monocytes in optic nerve injury. Neural Regeneration Research. 18 (8), 1666-1671 (2023).
- Weber, F., Treeck, O., Mester, P., Buechler, C. Expression and function of BMP and activin membrane-bound inhibitor (BAMBI) in chronic liver diseases and hepatocellular carcinoma. International Journal of Molecular Sciences. 24 (4), 3473 (2023).
- Tohyama, S., et al. Distinct metabolic flow enables large-scale purification of mouse and human pluripotent stem cell-derived cardiomyocytes. Cell Stem Cell. 12 (1), 127-137 (2013).
- Hattori, F., Fukuda, K. Strategies for replacing myocytes with induced pluripotent stem in clinical protocols. Transplantation Reviews. 26 (3), 223-232 (2012).
- Hattori, F., et al. Nongenetic method for purifying stem cell-derived cardiomyocytes. Nature Methods. 7 (1), 61-66 (2010).
- Fernandes, S., et al. Human embryonic stem cell-derived cardiomyocytes engraft but do not alter cardiac remodeling after chronic infarction in rats. Journal of Molecular and Cellular Cardiology. 49 (6), 941-949 (2010).
- Shiba, Y., et al. Allogeneic transplantation of iPS cell-derived cardiomyocytes regenerates primate hearts. Nature. 538 (7625), 388-391 (2016).
- Wendel, J. S., et al. Functional effects of a tissue-engineered cardiac patch from human induced pluripotent stem cell-derived cardiomyocytes in a rat infarct model. Stem Cells Translational Medicine. 4 (11), 1324-1332 (2015).
- Hattori, F. Technology Platforms for Heart Regenerative Therapy Using Pluripotent Stem Cells. Stem Cells and Cancer Stem Cells, Volume 7: Therapeutic Applications in Disease and Injury. , 33-45 (2012).
- Tao, S., et al. Ablation lesion characterization in scarred substrate assessed using cardiac magnetic resonance. JACC: Clinical Electrophysiology. 5 (1), 91-100 (2019).
- Rutkowski, J. M., Swartz, M. A. A driving force for change: interstitial flow as a morphoregulator. Trends in Cell Biology. 17 (1), 44-50 (2007).
- Hattori, F., Fukuda, K., Yuasa, S. How to purify cardiomyocytes for research and therapeutic purposes. Cardiac Regeneration using Stem Cells. , (2013).
- Li, M., Tian, X., Zhu, N., Schreyer, D. J., Chen, X. Modeling process-induced cell damage in the biodispensing process. Tissue Engineering. Part C, Methods. 16 (3), 533-542 (2010).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены