Method Article
Une nouvelle méthode d’injection cellulaire avec un minimum d’invasion
Dans cet article
Résumé
Cette méthode permet d’éliminer toute invasion majeure lors des injections cellulaires provoquée par la solution de suspension cellulaire.
Résumé
L’injection directe de cellules dans les tissus est un processus nécessaire dans l’administration cellulaire et/ou la thérapie de remplacement. L’injection cellulaire nécessite une quantité suffisante de solution de suspension pour permettre aux cellules de pénétrer dans le tissu. Le volume de la solution de suspension affecte les tissus, ce qui peut provoquer des lésions invasives majeures à la suite de l’injection de cellules. Cet article fait état d’une nouvelle méthode d’injection cellulaire, appelée injection lente, qui vise à éviter cette blessure. Cependant, l’expulsion des cellules de la pointe de l’aiguille nécessite une vitesse d’injection suffisamment élevée selon la loi de Newton de la force de cisaillement. Pour résoudre la contradiction ci-dessus, un fluide non newtonien, tel qu’une solution de gélatine, a été utilisé comme solution de suspension cellulaire dans ce travail. Les solutions de gélatines sont sensibles à la température, car leur forme passe du gel au sol à environ 20 °C. Par conséquent, pour maintenir la solution de suspension cellulaire sous forme de gel, la seringue a été maintenue au frais dans ce protocole ; Cependant, une fois que la solution a été injectée dans le corps, la température corporelle l’a convertie en sol. L’écoulement du liquide tissulaire interstitiel peut absorber l’excès de solution. Dans ce travail, la technique d’injection lente a permis aux billes cardiomyocytaires de pénétrer dans le myocarde de l’hôte et de se greffer sans fibrose environnante. Cette étude a utilisé une méthode d’injection lente pour injecter des cardiomyocytes néonatals purifiés et en forme de boule de rat dans une zone éloignée d’infarctus du myocarde dans le cœur du rat adulte. À 2 mois après l’injection, les cœurs des groupes transplantés ont montré une amélioration significative de la fonction contractile. De plus, les analyses histologiques des cœurs injectés lentement ont révélé des connexions transparentes entre les cardiomyocytes de l’hôte et du greffon via des disques intercalés contenant des connexions de jonction lacunaire. Cette méthode pourrait contribuer aux thérapies cellulaires de nouvelle génération, en particulier en médecine régénérative cardiaque.
Introduction
L’administration et le remplacement cellulaires sont de nouvelles stratégies thérapeutiques prometteuses pour les organes fortement endommagés. Parmi ces nouvelles stratégies thérapeutiques, la médecine régénérative cardiaque a fait l’objet d’une attention considérable. Cependant, l’inflammation causée par les blessures médie la formation de cicatrices dans plusieurs organes 1,2,3,4. Le cœur humain se compose d’environ 10 à10 cardiomyocytes ; Par conséquent, théoriquement5,6, il doit être traité avec plus de 109 cardiomyocytes. L’administration d’un grand nombre de cardiomyocytes par des méthodes d’injection traditionnelles peut entraîner des lésions tissulaires importantes7. Cette méthode fournit une nouvelle méthode d’injection cellulaire avec une invasion tissulaire minimale.
L’administration de cellules dans le parenchyme de l’organe nécessite une ou plusieurs injections. Cependant, il existe une divergence dans la mesure où l’injection elle-même peut entraîner des lésions tissulaires. Les lésions tissulaires provoquent une inflammation locale et des cicatrices incurables dans les organes et les tissus, ainsi qu’une altération de la capacité de régénération 8,9,10. Le cœur des mammifères a une propension extrêmement élevée à développer des cicatrices au lieu de se régénérer, car il nécessite une réparation immédiate des blessures afin de supporter l’hypertension artérielle causée par sa fonction de pompage continu11. La thérapie d’ablation utilise cette forte propension à la formation de cicatrices et bloque le circuit susceptible de subir la formation de cicatrices à l’aide d’une arythmie12. Dans une étude précédente, il a été observé que le tissu cicatriciel isolait les cardiomyocytes injectés dans le myocarde de l’hôte. Il s’agit donc de la prochaine cible à surmonter pour obtenir une meilleure efficacité thérapeutique en médecine régénérative cardiaque.
L’écoulement du liquide interstitiel tissulaire joue un rôle essentiel dans le transport de l’oxygène et des nutriments vers les cellules et dans l’élimination des déchets excrétés des cellules. La vitesse physiologique d’écoulement du liquide interstitiel dans chaque tissu/organe est différente (la plage est de 0,01 à 10 μm/s)13. À la connaissance de l’auteur, il n’existe aucune donnée concernant la capacité des tissus/organes individuels à supporter des quantités supplémentaires de liquide sans œdème pathologique ; Cependant, cette expérience tente d’utiliser une vitesse d’injection lente pour éventuellement réduire les lésions tissulaires, et les résultats peuvent être utilisés pour déterminer la praticité de ce concept.
Protocole
Les expériences sur les animaux ont été menées conformément aux directives éthiques de l’Université médicale du Kansai pour l’expérimentation animale et ont été approuvées par les comités d’éthique (numéro d’approbation : 23-104). Tous les animaux ont été élevés sous un cycle constant lumière-obscurité dans un environnement spécifique exempt d’agents pathogènes. Tous les outils chirurgicaux stérilisés, tels que les ciseaux, les pinces et les écarteurs, ont été autoclavés et séchés soigneusement.
1. Préparation des boules cardiomyocytaires de rat néonatal
- Collection de cœurs de rats néonatals
- Pour le prélèvement cardiaque, suivez une procédure similaire à celle décrite dans un rapport précédent7.
- Immerger séquentiellement des rats Sprague-Dawley (SD) néonatals (0 à 2 jours après la naissance) dans des solutions de povidone iodée et d’éthanol à 70 %, puis les transférer dans un boîtier hermétique rempli d’isoflurane vaporisé (la concentration doit être supérieure à 10 % v/v) pour une anesthésie profonde.
- Après la confirmation de l’inconscience par une perte d’activité locomotrice, décapitez le rat en tenant le corps par l’arrière avec la main, puis coupez 2 à 4 mm de tissu du centre frontal de la cage thoracique à la caudale, puis dans le sens rostral à l’aide de ciseaux tranchants.
- Saisissez la peau du dos pour ouvrir la coupure et pousser le cœur hors de la cage thoracique. Coupez les ventricules à l’aide de ciseaux et plongez-les dans une solution saline tamponnée au phosphate (PBS) sans calcium ni magnésium (PBS(−)).
- Dispersion des cardiomyocytes néonatals de rat
- Émincer les ventricules collectés dispersés dans une quantité minimale de tampon Ads (tampon Ads : 116 mM NaCl, 20 mM HEPES, 12,5 mM NaH2PO 4, 5,6 mM glucose, 5,4 mM KCl, 0,8 mM MgSO4, pH 7,35) dans une verrerie concave autoclavée en petits morceaux (1 mm x 1 mm) à l’aide de ciseaux courbés.
- Transférez les tissus hachés et un agitateur micromagnétique dans un tube de centrifugation de 50 mL et dispersez les tissus dans des cellules individuelles contenant 0,1 % de collagénase, 0,1 % de trypsine, 20 μg/mL de DNase I et 50 nM d’ester méthylique de tétraméthylrhodamine dans un tampon Ads à 37 °C en remuant pendant 30 min.
- Séparez les agrégats et les cellules dispersées par sédimentation naturelle, ne collectez que les cellules dispersées dans un tube et digérez à nouveau les agrégats cellulaires résiduels avec le même milieu de digestion.
- Continuez cette procédure jusqu’à ce que toutes les cellules soient complètement dissociées. Pour confirmer la dispersion complète des cellules, observez les tubes au microscope (lentille d’objectif 4x).
- Prélever les cellules dispersées par centrifugation à 150 x g pendant 5 min et les dissocier dans 1 à 2 mL de tampon Ads.
- Tri cellulaire des cardiomyocytes activé par fluorescence
- Analysez les cellules à l’aide du tri cellulaire activé par fluorescence (FACS) à l’aide de filtres passe-bande de 556 à 601 nm pour détecter les signaux de fluorescence rouge.
- Effectuer soigneusement le pré-gating pour éliminer les fractions de doublet14. Les réglages de la porte pour l’élimination du doublet doivent être conformes aux instructions du fabricant.
- Définissez la diffusion vers l’avant sur l’axe des abscisses et le signal de fluorescence rouge sur l’axe des ordonnées. Trois populations ont été observées : une population inférieure contenant des érythrocytes et des cellules mortes, une population moyenne contenant des non-cardiomyocytes, y compris des fibroblastes et des cellules endothéliales, et une population supérieure contenant des cardiomyocytes ventriculaires purs7.
- Préparation de billes de cardiomyocytes marquées par fluorescence rouge
- Trier sélectivement les cardiomyocytes et centrifuger pendant 5 min à 150 x g. Dissoudre complètement les pastilles cellulaires dans 1 mL de milieu essentiel minimal alpha-modifié (alpha-MEM) contenant 10 % de sérum de veau fœtal inactivé par la chaleur (FBS).
- Mesurez la concentration cellulaire à l’aide d’un hémocytomètre et diluez la solution de suspension cellulaire à 3 000 cellules/mL avec de l’alpha-MEM FBS à 10 %.
- Distribuez-les dans des plaques cellulaires non adhésives à 96 puits (100 μL par puits), centrifugez-les pendant 5 min à 100 x g et mettez-les en culture pendant 2 à 3 jours dans un incubateur de culture cellulaire avec 5 % de CO2 à 37 °C.
- Avant les expériences d’injection, prélever une boule de cardiomyocytes dans chaque puits par aspiration avec le milieu de culture à l’aide d’une pipette de 1 000 μl et les recueillir dans un tube de 15 ml.
- Coloration avec PKH26 en suivant les instructions du fabricant pour le suivi après la greffe.
2. Préparations pour la méthode d’injection lente
- Préparation de la solution mère de gélatine
- Pesez la gélatine, dissolvez-la dans le tampon Ads pour obtenir une solution à 10 % p/v et autoclavez-la.
- Production d’un dispositif d’injection de cellules
- Conception globale de l’appareil : Préparez l’appareil illustré à la figure 1. Ce système est combiné à un appareil de refroidissement de la seringue et à un appareil d’injection principal.
- Préparez l’appareil d’injection principal décrit ci-dessous :
- Pour une injection néonatale d’une bille cardiomyocytaire, utilisez une aiguille de 29 G, 50 mm de long munie d’une seringue.
- Connectez une seringue de transfert d’énergie (18 G, 1 ml) dos à dos à l’aide d’une seringue d’injection de cellules (Figure 1). Connectez l’aiguille de la seringue de transfert de puissance à un tube mince en polypropylène à faible capacité d’expansion lumineuse.
- Ensuite, connectez l’autre côté du tube de transfert de puissance à l’aiguille de la même seringue (18G, 1 mL) et placez-le dans un pousse-seringue. Remplissez les deux seringues et les tubes de transfert de puissance avec de l’eau sans bulles d’air.
REMARQUE : Lorsqu’un piston de la seringue de transfert de puissance est enfoncé, la pression est directement transférée à l’autre seringue et le piston dépasse.
- Configurez le système de refroidissement de la seringue d’injection comme décrit ci-dessous.
- Enroulez un tube de cuivre (diamètre extérieur = 1 mm ; diamètre interne = 0,3 mm ; épaisseur = 0,35 mm) autour de la partie contenant la cellule de la seringue d’injection de cellules, en laissant 10 mm de tuyau excédentaire aux deux extrémités.
- Connectez le tube en cuivre à un tube en plastique flexible. De plus, connectez les autres extrémités du tube en plastique à une pompe externe, remplissez la conduite d’eau de refroidissement et refroidissez l’eau en immergeant l’excès de tube de cuivre dans de la glace pilée (Figure 1).
REMARQUE : Ce système de refroidissement maintient la solution de suspension cellulaire dans le cylindre à environ 2 °C.
3. Développement d’un modèle d’infarctus du myocarde chez le rat par occlusion obtuse de l’artère coronaire
- Anesthésier les rats nus mâles immunodéficients (F344/Njcl-rnu/rnu) avec de l’air contenant 3 % d’isoflurane. Insérez une canule dans la trachée et connectez-la au respirateur.
- Connectez une canule à un vaporisateur d’isoflurane avec un contrôleur pour maintenir une concentration d’isoflurane de 3 % et, ainsi, maintenir une anesthésie suffisante. Confirmer qu’il n’y a pas de réponse aux stimuli douloureux. Appliquez une pommade vétérinaire sur les yeux pour prévenir la sécheresse.
- Fixez les membres avec des rubans chirurgicaux coupés sur une plaque chirurgicale chauffée à 40 °C. Tournez le corps du rat vers la droite de l’axe du corps et utilisez l’aisselle gauche comme champ chirurgical.
- Épilez les poils dans le champ chirurgical à l’aide d’une crème dépilatoire et essuyez la peau avec de la povidone iodée. À l’aide de ciseaux bien aiguisés, faites une incision de 1,5 cm dans la peau et le muscle grand pectoral.
- Confirmez le troisième espace intercostal et déchirez les muscles intercostaux et la plèvre costale à l’aide de micro-pinces à pointes émoussées. Gardez la poitrine ouverte à l’aide d’un écarteur. Retirez délicatement le péricarde fin à l’aide d’une pince.
- Pour construire un modèle d’infarctus de la paroi latérale du cœur, trouvez la position caudale de 1 mm à l’extrémité de l’oreillette gauche pour identifier l’artère coronaire obtuse, passez une suture de soie 7-0, prélevez du tissu de 2,5 mm de large et 2,5 mm de profondeur du dorsal au ventral, et ligaturez fermement le tissu.
- Confirmer la ligature réussie par la faible contraction distale de la ligature. Après avoir retiré doucement l’écarteur, placez une suture de soie 5-0 entre le deuxième et le quatrième espace intercostal et fermez la thoracotomie.
- Diminuer la concentration d’isoflurane à 1 %. Suturez doucement le muscle et la peau avec de la soie 5-0. Diminuez la concentration d’isoflurane à 0 % et attendez environ 5 minutes jusqu’à ce que la respiration spontanée commence.
- Appliquer localement 2 mg/mL de lidocaïne dans une solution saline sur l’incision. Administrer 1 mL de solution saline par injection sous-cutanée. Appliquez une pommade vétérinaire par voie topique pour prévenir les infections.
- Retirez le rat du tube d’intubation et retournez-le dans la cage de l’animal ; Ensuite, élevez les rats dans des cages individuelles pendant 1 semaine.
- Analyser les changements dans la fonction de la pompe systolique cardiaque à l’aide de l’échocardiographie.
REMARQUE : La fonction cardiaque sera réduite en raison de l’infarctus latéral du myocarde.
4. Transplantation de cellules percutanées échoguidée par la méthode d’injection lente
- Préchauffer le bouillon de gélatine à 10 % à 37 °C jusqu’à ce qu’il devienne liquide.
- Diluer la gélatine à 10 % avec un tampon Ads préchauffé pour obtenir la solution de gélatine injectable finale à 5 % p/v (100 μL par animal).
- Suspendre 96 boules de cardiomyocytes (total : 28 800 cardiomyocytes/animal) dans 100 μL de solution injectable préchauffée.
- Chargez la suspension préparée à l’étape 4.3 dans la seringue d’injection de cellules, en évitant l’aspiration de l’excès d’air.
- Pour éliminer les bulles dans la seringue, maintenez-la verticalement avec l’aiguille vers le haut, tapotez la seringue et collectez les bulles au niveau de l’arête supérieure de la seringue.
REMARQUE : Au cours de cette étape, observez les billes cardiomyocytaires se déposer progressivement sur le joint en caoutchouc du piston. - Maintenez la position verticale de la seringue, poussez lentement le piston vers le haut et jetez les bulles et l’excès de solution de suspension cellulaire jusqu’à ce qu’il reste 20 μL de la suspension cellulaire dans la seringue. Poussez le piston avec précaution à une vitesse constante afin que la bille cardiomyocytaire reste posée sur le joint en caoutchouc du piston.
- Plongez la seringue bouchée directement dans un bain de glace pendant 5 min.
- Placez une seringue refroidie dans l’appareil d’injection. Fixez fermement l’appareil de seringue d’injection installé sur un dispositif de mouvement fin sur la scène de l’animal à l’aide d’une pince artisanale réglable en position X-Y-Z. Le dispositif de mouvement fin peut déplacer la position de l’aiguille à l’aide de la glissière de 20 mm dans la direction x, de l’oscillation dans la direction y et des mouvements d’inclinaison dans la direction z.
- Anesthésier les rats dans une boîte scellée remplie d’air contenant 3 % d’isoflurane. Confirmer l’anesthésie en ne répondant pas aux stimuli douloureux. Appliquez une pommade vétérinaire sur les yeux pour prévenir la sécheresse.
- Fixez les membres avec des rubans chirurgicaux coupés sur une plaque d’écho chauffée à 40 °C. Pour maintenir une anesthésie suffisante, assurez-vous que l’air inhalé contient une concentration d’environ 3 % d’isoflurane.
- Retirez les poils au niveau du champ d’injection (2 cm de diamètre) et de la poitrine avec de la crème dépilatoire et essuyez la peau avec de la povidone iodée.
- Appliquez l’écho-gel sur la poitrine et la sonde d’écho. Placez la sonde d’écho près de la poitrine le long des axes crânien et caudal et commencez à obtenir une échocardiographie en mode B en suivant le manuel du fabricant.
- Avancez la pointe de l’aiguille d’injection dans le myocarde en vue frontale (Figure 2 et vidéo supplémentaire 1).
- Pour activer le pousse-seringue principal, appuyez sur le bouton Start et tournez le cadran pour régler à un nombre prédéterminé pour une vitesse d’injection d’environ 0,02 μL/s. Appliquez une pommade vétérinaire par voie topique autour de la position d’aiguilletage pour prévenir les infections.
REMARQUE : Il est nécessaire de déterminer le numéro de numérotation approprié pour la vitesse d’injection prévue à l’aide d’une solution d’injection. Après l’injection, retirez l’aiguille d’injection à l’aide d’un système de mouvement exemplaire. - Diminuer la concentration d’isoflurane à 0 % et attendre environ 5 minutes jusqu’à ce que l’animal reprenne suffisamment conscience pour maintenir sa position couchée sternale.
5. Évaluation de la fonction cardiaque
- Anesthésier les rats dans une boîte scellée remplie d’air contenant 3 % d’isoflurane. Confirmer l’anesthésie en ne répondant pas aux stimuli douloureux. Appliquez une pommade vétérinaire sur les yeux pour prévenir la sécheresse.
- Appliquez une crème électrisante pour l’acquisition de l’ECG sur les pointes des membres. Fixez les membres avec des rubans chirurgicaux coupés sur une plaque d’écho chauffée à 40 °C. Utilisez un système de surveillance physiologique pour détecter l’ECG et la fréquence cardiaque en temps réel.
- Selon les instructions du fabricant, déterminez d’abord l’angle du grand axe à l’aide de l’image de l’écho en mode B montrant l’apex ventriculaire gauche jusqu’à la voie d’écoulement, puis faites pivoter l’échosonde de 90° pour passer à la vue de l’axe court.
- En utilisant uniquement le système de mouvement fin de l’axe caudal à rostral du stade animal, ajustez la vue de l’axe court au niveau du muscle papillaire. Ensuite, passez le mode image en mode M en appuyant sur le bouton M-mode et enregistrez une vidéo pendant 5 s en appuyant sur le bouton Cine-loop .
- Pour analyser et calculer le raccourcissement de la fraction à l’aide du logiciel, appuyez sur le bouton Mesurer et sur un outil de ligne verticale pour définir les dimensions internes du ventricule gauche en fin de systolique et en fin de diastolie. Le logiciel calcule automatiquement le pourcentage de raccourcissement de la fraction (FS).
- Diminuer la concentration d’isoflurane à 0 % et attendre environ 5 minutes jusqu’à ce que l’animal reprenne suffisamment conscience pour maintenir sa position couchée sternale.
6. Immunohistochimie
- Fixez le corps euthanasié (effectuez l’euthanasie comme à l’étape 1.1.3) sur la table à l’aide des rubans chirurgicaux coupés, excissez les cœurs, lavez-les avec du PBS et plongez le cœur dans du paraformaldéhyde/PBS à 4 %.
- Disséquez les cœurs en trois sections, plongez-les dans du saccharose à 40 % pour la cryoprotection, incorporez-les dans un composé à température de coupe optimale (OCT) et congelez-les à −80 °C.
- Fixez les tissus cryosectionnés (8 μm d’épaisseur) sur des lames de verre recouvertes d’aminosilane. Après un séchage suffisant à l’aide d’un vent non réchauffé généré par un sèche-cheveux général, plongez les lames de verre dans une solution saline tris-tamponnée contenant 0,2 % de Tween-20 (TBS-T).
- Plongez-les dans une solution bloquante pendant 30 min à 25 °C. Versez 100 μL de la solution bloquante primaire contenant des anticorps sur la lame et incubez toute la nuit à 4 °C avec un scellement à la paraffine pour maintenir la solution d’anticorps répartie sur le tissu.
REMARQUE : La concentration d’anticorps est indiquée dans le tableau des matériaux. - Posez les lames horizontalement dans une boîte à haute humidité faite à la main en utilisant la vapeur naturelle du papier humide pour éviter l’évaporation. Lavez les lames trois fois avec TBS-T.
- Traiter avec l’agent bloquant secondaire contenant des anticorps pendant 1 h à 25 °C de la même manière que l’anticorps primaire. Après trois lavages, observez les signaux de fluorescence à l’aide d’un microscope à fluorescence et d’un microscope laser confocal.
REMARQUE : La concentration d’anticorps est indiquée dans le tableau des matériaux. - Analyse statistique : Pour la comparaison du volume cellulaire, comme le montre la figure 3A, effectuez un test t non apparié ; pour évaluer la récupération fonctionnelle cardiaque après l’administration de cardiomyocytes à l’aide de la méthode d’injection lente, comme le montre la figure 4A, utilisez un test t apparié. Dans ce travail, les différences ont été considérées comme statistiquement significatives à P < 0,01. Les barres d’erreur représentent l’écart-type.
Résultats
Effets de l’injection lente sur la survie cellulaire et le dépôt de collagène
Des boules cardiomyocytaires de rat néonatal marquées avec PKH26 ont été injectées dans un myocarde de rat nu normal en utilisant une méthode d’injection normale ou lente. Les résultats ont montré que la méthode d’injection lente augmentait significativement le volume cellulaire greffé (Figure 3A) et diminuait significativement le dépôt de collagène de type I sur place (Figure 3B).
Effets de l’injection lente sur l’efficacité du traitement dans un modèle d’infarctus chez le rat
La méthode d’injection lente guidée par échocardiographe a été utilisée pour injecter des boules de cardiomyocytes de rat néonatal ou PBS(−) dans le cœur infarctus de rats modèles. Seul le groupe ayant reçu une injection de cellules a montré une amélioration significative de la fonction de contraction cardiaque après 2 mois (Figure 4A). Les analyses immunohistochimiques ont révélé une connexion transparente entre les cellules greffées et les myocytes de l’hôte via des disques intercalés contenant des jonctions lacunaires (Figure 4B).
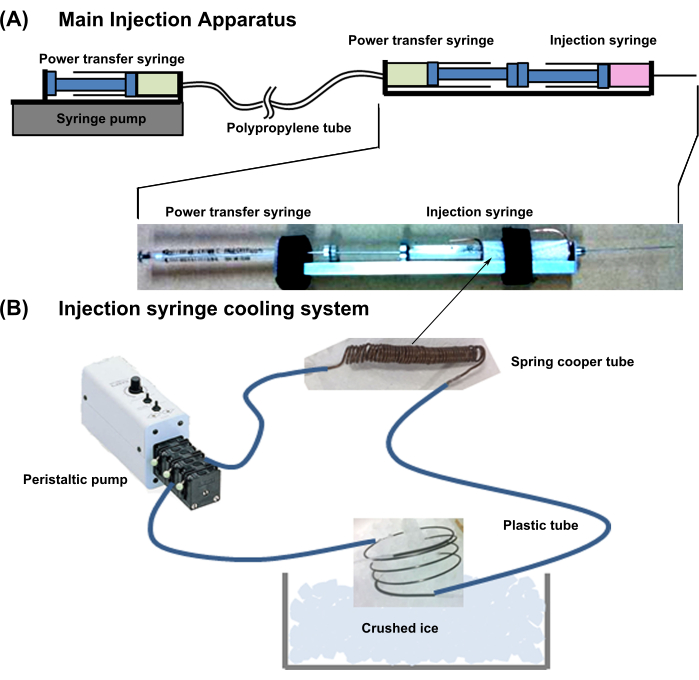
Figure 1 : Schéma de l’ensemble du système d’injection. (A) Appareil d’injection principal. (B) Système de refroidissement de la seringue d’injection. Veuillez cliquer ici pour voir une version agrandie de cette figure.
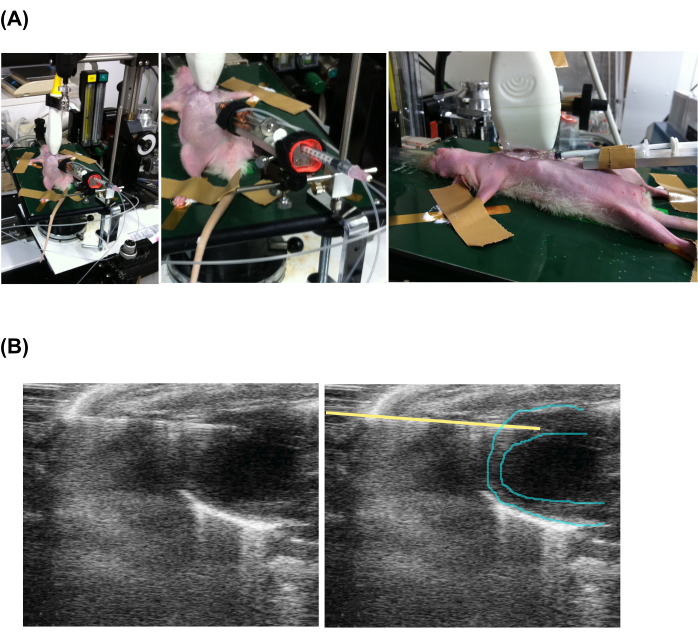
Figure 2 : Injection lente percutanée guidée par échocardiographie. (A) Réglage de l’animal, de l’échosonde et de l’appareil d’injection. (B) Vue échocardiographique de la seringue d’injection et du cœur. Notez que les images de gauche et de droite sont les mêmes, mais une ligne jaune a été ajoutée pour indiquer la position de l’aiguille. Veuillez cliquer ici pour voir une version agrandie de cette figure.
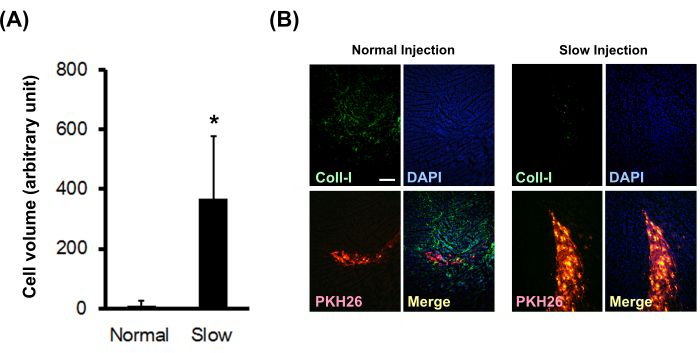
Figure 3 : Effet de la méthode d’injection lente sur le volume cellulaire greffé et le dépôt de collagène. (A) Les volumes cellulaires greffés (N = 3) ont été calculés à partir de coupes en série. Les barres d’erreur indiquent les écarts-types. *P < 0,01 dans un test t non apparié. (B) Coloration immunohistochimique du collagène de type I. La barre d’échelle indique 200 μm. Veuillez cliquer ici pour voir une version agrandie de cette figure.
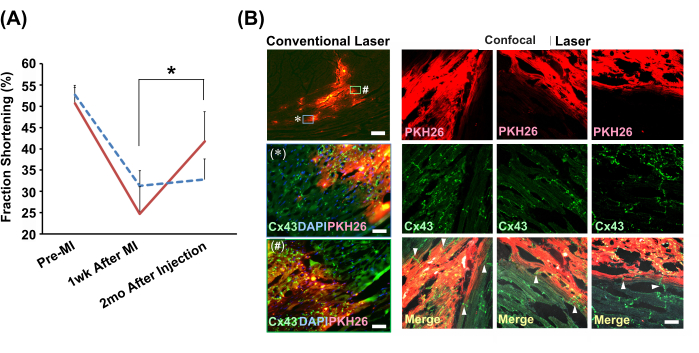
Figure 4 : Amélioration de la fonction cardiaque et de l’intégration histologique avec les boules de cardiomyocytes greffées par la méthode d’injection lente. (A) Vues représentatives du mode M de l’échocardiographe. Le graphique montre la transition des raccourcissements de fraction dans le groupe transplanté en boule de cardiomyocytes (ligne rouge continue ; N = 4) et le groupe véhicule (solution de suspension cellulaire pour la méthode d’injection lente) (ligne bleue pointillée ; N = 3). Abréviations : IM = infarctus du myocarde ; Cx43 = connexine 43 ; DAPI = 4',6-diamidino-2-phénylindole ; PKH26 = étiquette de membrane cellulaire fluorescente rouge. Les barres d’erreur indiquent les écarts-types. *P < 0,01 dans un test t apparié. (B) Analyses immunohistochimiques de la relation entre les boules cardiomyocytaires greffées et les cardiomyocytes de l’hôte. Les observations microscopiques laser conventionnelles à l’aide d’une lentille d’objectif 2x sont présentées dans la colonne de gauche. Des versions agrandies (à l’aide d’un objectif 20x) de deux zones illustrées dans l’encadré, étiquetées avec * et #, sont présentées ci-dessous. Barres d’échelle : image du haut = 300 μm ; * et # = 30 μm. Des images microscopiques confocales au laser à l’aide d’une lentille d’objectif 20x sont montrées le long de la comparaison. Trois positions sont affichées. Dans les images fusionnées, les pointes de flèches indiquent l’existence de jonctions lacunaires (Cx43) reliant directement les cardiomyocytes du greffon et de l’hôte. La barre d’échelle indique 30 μm. Veuillez cliquer ici pour voir une version agrandie de cette figure.
Vidéo supplémentaire 1 : Méthode d’injection lente guidée par écho. L’échocardiogramme en mode B en vue frontale montre la pointe de l’aiguille d’injection avancée dans le myocarde. Veuillez cliquer ici pour télécharger ce fichier.
Discussion
L’un des points critiques de la réussite de la méthode d’injection lente est la préparation d’un système d’injection efficace à l’aide d’un pousse-seringue puissant et d’un tube de transfert de pression solide. Un système à haute pression est nécessaire pour faire sortir le gel de la pointe d’une aiguille fine. Le deuxième point critique est la stabilisation du cœur. Les battements du cœur contre une aiguille d’injection avancée dans le myocarde peuvent blesser les tissus. Dans cette étude, une injection échoguidée a été effectuée pour éviter que les animaux ne subissent une deuxième blessure thoracique ouverte et pour administrer l’injection de cellules dans un cœur stabilisé avec les poumons gonflés. De plus, dans certaines applications destinées à des animaux de grande taille ou à des humains, certains dispositifs d’injection fixés sur le cœur doivent être pris en compte dans le cadre de la conception stratégique de l’application. Pour les injections thoraciques ouvertes dans le cœur des petits animaux, l’utilisation d’une aiguille longue et flexible est recommandée compte tenu de leur fréquence cardiaque plus élevée.
Dans ce travail, la méthode d’injection lente a considérablement augmenté le volume des cardiomyocytes survivants par rapport à la méthode d’injection normale. L’injection normale provoque des dommages cellulaires par contrainte de cisaillement15. En revanche, la méthode d’injection lente ne provoque pas de telles contraintes théoriquement car elle utilise une solution non newtonienne en plus de l’injection lente.
En termes de fibrose locale, l’espace interstitiel autour des cardiomyocytes survivants normalement injectés a montré un dépôt de collagène de type I fort et généralisé. En revanche, les signaux de collagène de type I autour des cardiomyocytes greffés à l’aide de la méthode d’injection lente étaient beaucoup plus faibles et plus limités. Cela suggère que la méthode d’injection lente a causé beaucoup moins de dégâts. L’injection lente de cardiomyocytes néonatals dans le myocarde adulte a considérablement amélioré la fonction contractile du cœur infarcat. Les analyses histologiques ont suggéré que la greffe des cardiomyocytes à l’aide de la méthode d’injection lente a permis d’obtenir des connexions directes et un couplage fonctionnel avec les cardiomyocytes de l’hôte. Ce phénomène explique le mécanisme de récupération fonctionnelle du myocarde de l’hôte. À notre connaissance, il s’agit du premier rapport de cardiomyocytes néonatals greffés avec des connexions transparentes à grande échelle avec les cardiomyocytes adultes hôtes. Les connexions fonctionnelles avec le myocarde de l’hôte via un couplage électrique et mécanique peuvent faire mûrir les cardiomyocytes greffés et leur permettre d’agir comme des myocytes fonctionnels qui contribuent à la fonction cardiaque de l’hôte. Les interactions de force physique à long terme entre l’hôte et les cardiomyocytes du greffon sont cruciales pour une maturation complète. Par conséquent, 2 mois après l’injection peuvent être nécessaires pour la récupération fonctionnelle du cœur infarcat. La récupération de la fonction cardiaque du patient en fonction du temps peut être un phénomène attendu dans les applications thérapeutiques, ce qui peut être une caractéristique de l’établissement réussi d’un couplage fonctionnel de novo et d’une intégration entre l’hôte et les cardiomyocytes greffés.
La méthode d’injection lente peut être réalisée lors d’une chirurgie thoracique ouverte. De plus, cette méthode peut être appliquée aux souris. Pour de futures applications en thérapie humaine, nous devons encore résoudre plusieurs problèmes. La vitesse d’injection doit être optimisée en tenant compte de la capacité tampon de l’écoulement du liquide interstitiel dans chaque organe cible humain. Des matériaux exempts de xéno, tels que la gélatine humaine ou des matériaux synthétiques biodégradables, doivent être appliqués. Des appareils d’injection lente de qualité GMP, tels que des outils jetables compacts spécifiques à un organe ou un appareil réutilisable applicable aux organes larges, devraient être développés.
Déclarations de divulgation
L’auteur n’a rien à révéler.
Remerciements
Cette étude a été financée par une subvention de JSPS KAKENHI (subvention n° 23390072 et 19K07335) et AMED (subvention n° A-149).
matériels
| Name | Company | Catalog Number | Comments |
| 18-gauge needle & tuberculin, 1 mL | Terumo | NN1838R, SS-01T | |
| 29-gauge 50 mm-long needle | Ito Corporation, Tokyo, Japan | 14903 Type-A | |
| A copper tube | General Suppliers | outer diameter, 1 mm; inner diameter, 0.3 mm; thickness, 0.35 mm | |
| Ads Buffer | Each ingredient was purchased from Fuji Film Wako Chemical Inc., Miyazaki, Japan | Hand made, Composition: 116 mM NaCl, 20 mM HEPES, 12.5 mM NaH2PO4, 5.6 mM glucose, 5.4 mM KCl, 0.8 mM MgSO4, pH 7.35 | |
| alpha-MEM | Fuji Film Wako Chemical Inc., Miyazaki, Japan | 051-07615 | |
| Anti-collagen type I rabbit polyclonal antibody (H+L) | Proteintech | 14695-1-AP | using dilution 1:100 |
| Anti-Connexin-43 rabbit polyclonal antibody (H+L) | Sigma Aldrich | C6219 | using dilution 1:100 |
| Anti-rabbit IgG (H+L) donley polyclonal antibody-AlexaFluo488 | Thermo Scientific | A21206 | using dilution 1:300 |
| blocking solution (Blocking One) | Nacalai Tesque, Kyoto, Japan | 03953-95 | |
| collagenase | Fuji Film Wako Chemical Inc., Miyazaki, Japan | 034-22363 | |
| confocal laser microscope | Carl Zeiss Inc., Oberkochen, Germany | LSM510 META | |
| DNase I | Sigma-Aldrich | DN25 | |
| FACS Aria III | Becton Dickinson, Franklin Lakes, NJ, USA | ||
| fetal bovine serum | BioWest, FL, USA | S1820-500 | |
| fine movement device (Micromanipulator) | Narishige Co., Ltd., Tokyo, Japan | M-44 | |
| fluorescence microscope | Nikon Instruments, Tokyo, Japan | Eclipse Ti2 | |
| gelatin from bovine skin | Sigma-Aldrich | G9382 | dissolving in PBS (-) to 10%, and autoclaving it |
| Neonatal Sprague-Dawley (SD) rats | Japan SLC Inc., Shizuoka, Japan | 0–2 d after birth | |
| non-adhesive 96-well plates (spheloid plate) | Sumitomo Bakelite, Tokyo, Japan | MS-0096S | |
| Optimal Cutting Temperature (OCT) Compound | Sakura Finetek USA, Inc., CA, USA | Tissue-Tek OCT compound | |
| peristaltic pump (for cooling system) | As One Co., Osaka, Japan | SMP-23AS | |
| PKH26 | Sigma-Aldrich | PKH26GL | |
| Stir Bar, Micro, Magnetic, PTFE, Length x Dia. in mm: 5 x 2 | Chemglass life sciences LLC, NJ, USA | CG-2003-120 | |
| syringe | Ito Corporation, Tokyo, Japan | MS-N25 | |
| syringe pump with remote controller | As One Co., Osaka, Japan | MR-1, CT-10 | |
| tetramethylrhodamine methyl ester | Thermo Fisher Scientific, Waltham, MA, USA | T668 | |
| trypsin | DIFCO, Becton Dickinson, Franklin Lakes, NJ, USA | 215240 | |
| Tween-20 | Fuji Film Wako Chemical Inc., Miyazaki, Japan | 167-11515 | |
| veterinarian ointment | Fujita Pharmaceutical Co., Ltd. | Hibikusu ointment #WAK-95832 | |
| Vevo 2100 Imaging System | Fujifilm VisualSonics, Inc., Toronto, Canada | Vevo 2100 | |
| Vevo 2100 Imaging System software version 1.0.0 | Fujifilm VisualSonics, Inc., Toronto, Canada | Vevo 2100 | |
| Weakly curved needle with ophthalmic thread | Natsume Seisakusho Co., Ltd., Tokyo, Japan | C7-70 |
Références
- Chavkin, N. W., et al. The cell surface receptors Ror1/2 control cardiac myofibroblast differentiation. Journal of the American Heart Association. 10 (13), e019904 (2021).
- Li, H., et al. The cell membrane repair protein MG53 modulates transcription factor NF-κB signaling to control kidney fibrosis. Kidney International. 101 (1), 119-130 (2022).
- Liu, X., Liu, Y., Khodeiry, M. M., Lee, R. K. The role of monocytes in optic nerve injury. Neural Regeneration Research. 18 (8), 1666-1671 (2023).
- Weber, F., Treeck, O., Mester, P., Buechler, C. Expression and function of BMP and activin membrane-bound inhibitor (BAMBI) in chronic liver diseases and hepatocellular carcinoma. International Journal of Molecular Sciences. 24 (4), 3473 (2023).
- Tohyama, S., et al. Distinct metabolic flow enables large-scale purification of mouse and human pluripotent stem cell-derived cardiomyocytes. Cell Stem Cell. 12 (1), 127-137 (2013).
- Hattori, F., Fukuda, K. Strategies for replacing myocytes with induced pluripotent stem in clinical protocols. Transplantation Reviews. 26 (3), 223-232 (2012).
- Hattori, F., et al. Nongenetic method for purifying stem cell-derived cardiomyocytes. Nature Methods. 7 (1), 61-66 (2010).
- Fernandes, S., et al. Human embryonic stem cell-derived cardiomyocytes engraft but do not alter cardiac remodeling after chronic infarction in rats. Journal of Molecular and Cellular Cardiology. 49 (6), 941-949 (2010).
- Shiba, Y., et al. Allogeneic transplantation of iPS cell-derived cardiomyocytes regenerates primate hearts. Nature. 538 (7625), 388-391 (2016).
- Wendel, J. S., et al. Functional effects of a tissue-engineered cardiac patch from human induced pluripotent stem cell-derived cardiomyocytes in a rat infarct model. Stem Cells Translational Medicine. 4 (11), 1324-1332 (2015).
- Hattori, F. Technology Platforms for Heart Regenerative Therapy Using Pluripotent Stem Cells. Stem Cells and Cancer Stem Cells, Volume 7: Therapeutic Applications in Disease and Injury. , 33-45 (2012).
- Tao, S., et al. Ablation lesion characterization in scarred substrate assessed using cardiac magnetic resonance. JACC: Clinical Electrophysiology. 5 (1), 91-100 (2019).
- Rutkowski, J. M., Swartz, M. A. A driving force for change: interstitial flow as a morphoregulator. Trends in Cell Biology. 17 (1), 44-50 (2007).
- Hattori, F., Fukuda, K., Yuasa, S. How to purify cardiomyocytes for research and therapeutic purposes. Cardiac Regeneration using Stem Cells. , (2013).
- Li, M., Tian, X., Zhu, N., Schreyer, D. J., Chen, X. Modeling process-induced cell damage in the biodispensing process. Tissue Engineering. Part C, Methods. 16 (3), 533-542 (2010).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationExplorer plus d’articles
This article has been published
Video Coming Soon