Method Article
一种侵袭性最小的新型细胞注射方法
摘要
该方法消除了细胞注射过程中由细胞悬液引起的任何重大侵袭。
摘要
将细胞直接注射到组织中是细胞给药和/或替代疗法的必要过程。细胞注射需要足够量的悬浮液才能使细胞进入组织。悬浮液的体积会影响组织,这会因细胞注射而造成严重的侵袭性损伤。本文报道了一种新型的细胞注射方法,称为慢速注射,旨在避免这种损伤。然而,根据牛顿剪切力定律,从针尖推出细胞需要足够高的注射速度。为了解决上述矛盾,本工作使用非牛顿流体(如明胶溶液)作为细胞悬浮液。明胶溶液具有温度敏感性,因为它们的形状在大约20°C时从凝胶变为溶胶。 因此,为了将细胞悬浮液维持在凝胶形式,注射器在该方案中保持冷却;然而,一旦溶液被注射到体内,体温就会将其转化为溶胶。间质组织液流动可以吸收过量的溶液。在这项工作中,慢速注射技术允许心肌细胞球进入宿主心肌并植入而不会出现周围纤维化。本研究采用慢速注射法,将纯化成球状的新生大鼠心肌细胞注射到成年大鼠心脏心肌梗死的偏远区域。注射后2个月,移植组的心脏收缩功能明显改善。此外,对缓慢注射心脏的组织学分析揭示了宿主和移植物心肌细胞之间 通过 包含间隙连接的插层椎间盘的无缝连接。这种方法可能有助于下一代细胞疗法,特别是在心脏再生医学中。
引言
细胞给药和置换是有希望为严重受损器官提供的新治疗策略。在这些新型治疗策略中,心脏再生医学引起了人们的广泛关注。然而,损伤引起的炎症介导多个器官的瘢痕形成 1,2,3,4。人体心脏由大约 1010 个心肌细胞组成;因此,理论上5,6,必须用109个以上的心肌细胞治疗。通过传统注射方法施用大量心肌细胞可能会导致严重的组织损伤7.该方法提供了一种新颖的细胞注射方法,具有最小的组织侵袭。
将细胞施用到器官实质中需要注射。然而,存在差异,因为注射本身可能导致组织损伤。组织损伤会导致器官和组织的局部炎症和无法治愈的瘢痕形成,以及再生能力受损8,9,10。哺乳动物的心脏极易形成疤痕而不是再生,因为它需要立即修复损伤,以忍受其连续泵血功能引起的高血压11。消融疗法利用这种对瘢痕形成的高倾向,并阻断可能因心律失常而形成瘢痕的回路12.在之前的一项研究中,观察到瘢痕组织在宿主心肌中分离了注射的心肌细胞。因此,这代表了需要克服的下一个目标问题,以获得改善心脏再生医学的治疗效果。
组织间质液流动在将氧气和营养物质输送到细胞以及清除细胞排泄的废物方面起着至关重要的作用。每个组织/器官中间质液流动的生理速度不同(范围为 0.01-10 μm/s)13。据作者所知,没有关于单个组织/器官在没有病理性水肿的情况下支持额外液体的能力的数据;然而,该实验试图使用较慢的注射速度来可能减少组织损伤,结果可用于确定该概念的实用性。
研究方案
动物实验根据关西医科大学动物实验伦理指南进行,并经伦理委员会批准(批准号:23-104)。所有动物均在特定的无病原体环境中在恒定的光暗循环下饲养。所有灭菌的手术工具,如剪刀、镊子和牵开器,都经过高压灭菌并彻底干燥。
1.新生大鼠心肌细胞球的制备
- 新生大鼠心脏采集
- 对于心脏采集,请遵循与先前报告7 中描述的程序类似的程序。
- 依次将新生儿(出生后0-2天)Sprague-Dawley(SD)大鼠浸入聚维酮碘和70%乙醇溶液中,然后将它们转移到充满汽化异氟烷(浓度应超过10%v / v)的气密箱中进行深度麻醉。
- 在通过运动活动丧失确认失去知觉后,用手从背部握住身体的同时将大鼠斩首,然后从胸腔的额部中心到尾部,然后用锋利的剪刀在喙部方向切割2-4毫米的组织。
- 握住背部皮肤,拉开切口,将心脏从胸腔中推出。用剪刀剪开心室,并将其浸入不含钙或镁(PBS(−))的磷酸盐缓冲盐水(PBS)中。
- 新生大鼠心肌细胞的分散
- 使用弯曲剪刀将收集的脑室切碎分散在极少量的Ads缓冲液(Ads缓冲液:116mM NaCl,20mM HEPES,12.5mM NaH2PO 4,5.6mM葡萄糖,5.4mM KCl,0.8mM MgSO4,pH 7.35)中,在高压灭菌的凹面玻璃器皿中切成小块(1mm x 1mm)。
- 将切碎的组织和微磁搅拌器转移到50mL离心管中,并通过搅拌30分钟将组织分散到单细胞中,在37°C的Ads缓冲液中加入0.1%胶原酶,0.1%胰蛋白酶,20μg/ mL DNase I和50nM四甲基罗丹明甲酯。
- 通过自然沉降分离聚集体和分散的细胞,仅将分散的细胞收集到管中,并用相同的消化培养基再次消化残留的细胞聚集体。
- 继续此过程,直到所有细胞完全解离。为了确认细胞的完全分散,在显微镜(4倍物镜)下观察试管。
- 以 150 x g 离心 5 分钟收集分散的细胞,并在 1-2 mL Ads 缓冲液中解离它们。
- 心肌细胞的荧光激活细胞分选
- 使用荧光激活细胞分选(FACS)分析细胞,使用556-601nm带通滤光片检测红色荧光信号。
- 小心地进行预设门以消除双峰馏分14。双峰消除的浇口设置应按照制造商的说明进行。
- 在 x 轴上设置前向散射,在 y 轴上设置红色荧光信号。观察到三个群体:包含红细胞和死细胞的最下群体,包含非心肌细胞(包括成纤维细胞和内皮细胞)的中间群体,以及包含纯心室心肌细胞的顶部群体7。
- 红色荧光标记心肌细胞球的制备
- 选择性地分选心肌细胞,并以150× g离心5分钟。将细胞沉淀完全溶解在含有 10% 热灭活胎牛血清 (FBS) 的 1 mL α 修饰最低必需培养基 (α-MEM) 中。
- 使用血细胞计数器测量细胞浓度,并用α-MEM 10%FBS将细胞悬浮液稀释至3,000个细胞/ mL。
- 将它们分布到细胞非粘附性96孔板(每孔100μL)中,以100× g离心5分钟,并在37°C下在5%CO2 的细胞培养箱中培养2-3天。
- 在注射实验之前,使用1,000μL移液管通过培养基抽吸从每个孔中收获心肌细胞球,并将它们收集在15mL管中。
- 按照制造商的说明用 PKH26 染色,以便在植入后进行跟踪。
2.慢速注射法的准备工作
- 明胶储备溶液的制备
- 称量明胶,将其溶解在Ads缓冲液中以产生10%w / v溶液,然后高压灭菌。
- 生产细胞注射装置
- 整体设备设计:准备 图1所示的设备。该系统与注射器冷却装置和主注射装置相结合。
- 准备下述主要注射装置:
- 对于新生儿心肌细胞球注射,使用配备注射器的 29 G、50 mm 长针头。
- 使用细胞注射器背靠背连接动力转移注射器(18G,1 mL)(图1)。将动力转移注射器的针头连接到具有低内腔膨胀性的薄聚丙烯管上。
- 然后,将动力传输管的另一侧连接到同一注射器(18G,1 mL)的针头上,并将其放入注射器泵中。将两个动力传输注射器和管子装满水,没有任何气泡。
注意: 当动力传输注射器的一个柱塞被推入时,压力直接传递到另一个注射器,并且柱塞突出。
- 如下所述设置注射器冷却系统。
- 将一根铜管(外径 = 1 mm;内径 = 0.3 mm;厚度 = 0.35 mm)紧紧缠绕在细胞注射器的含细胞部分周围,在两端留出 10 mm 的多余管。
- 将铜管连接到柔性塑料管。此外,将塑料管的另一端连接到外部泵,用冷却水填充管路,然后通过将多余的铜管浸入碎冰中来冷却水(图1)。
注意:该冷却系统将圆柱体内的细胞悬浮液保持在约2°C。
3. 钝性冠状动脉闭塞大鼠心肌梗死模型的建立
- 用含有3%异氟醚的空气麻醉雄性免疫缺陷裸鼠(F344 / Njcl-rnu / rnu)。将插管插入气管并将其连接到呼吸器。
- 将套管连接到带有控制器的异氟烷蒸发器,以保持 3% 的异氟烷浓度,从而维持足够的麻醉。确认对疼痛刺激无反应。将兽医软膏涂抹在眼睛上以防止干燥。
- 用切割的手术胶带将四肢固定在40°C加热的手术板上。将大鼠的身体扭到身体轴的右侧,并使用左腋窝作为手术区域。
- 使用脱毛膏去除手术区域的毛发,并用聚维酮碘擦拭皮肤。使用锋利的剪刀,在皮肤和胸大肌上切开一个 1.5 厘米的切口。
- 确认第三肋间隙,用钝尖的微型镊子撕裂肋间肌和肋胸膜。使用牵开器保持胸部打开。用镊子轻轻取出薄的心包。
- 构建心脏侧壁梗死模型,求左心房顶端尾部1mm位置识别钝冠状动脉,通过7-0丝线缝合,从背侧到腹侧舀起宽2.5mm、深2.5mm的组织,将组织结扎紧。
- 通过结扎远端的弱收缩确认结扎成功。轻轻取出牵开器后,在第二和第四肋间隙之间放置5-0丝线缝合线,并关闭开胸手术。
- 将异氟烷浓度降至1%。用 5-0 真丝轻轻缝合肌肉和皮肤。将异氟烷浓度降至0%,等待约5分钟,直到自主呼吸开始。
- 局部将 2 mg/mL 利多卡因溶于生理盐水中涂抹到切口处。 通过 皮下注射给予 1 mL 生理盐水。局部涂抹兽药膏以预防感染。
- 将大鼠从插管中取出,并返回动物笼;然后,将大鼠在单独的笼子中饲养1周。
- 使用超声心动图分析心脏收缩泵功能的变化。
注意:由于侧向心肌梗塞,心脏功能会降低。
4.采用慢速注射法的回声引导下经皮细胞移植
- 在37°C下预热10%明胶原料,直至其变成液体。
- 用预热的 Ads 缓冲液稀释 10% 明胶原液以获得最终可注射的 5% w/v 明胶溶液(每只动物需要 100 μL)。
- 将 96 个心肌细胞球(总计:28,800 个心肌细胞/动物)悬浮在 100 μL 预热注射液中。
- 将步骤4.3中制备的悬浮液装入细胞注射器中,避免吸入过多的空气。
- 要消除注射器中的气泡,请垂直握住注射器,针头朝上,轻敲注射器,然后收集注射器上脊处的任何气泡。
注意: 在此步骤中,观察心肌细胞球逐渐沉淀在柱塞的橡胶密封件上。 - 保持注射器的垂直位置,缓慢向上推柱塞,弃去气泡和过量的细胞悬浮液,直到20μL细胞悬液留在注射器中。以恒定速度小心地推动柱塞,使心肌细胞球保持在柱塞的橡胶密封件上。
- 将加盖的注射器直接浸入冰浴中5分钟。
- 将冷却的注射器放入注射装置中。使用X-Y-Z位置可调的手工夹具将注射器装置紧紧固定在动物载物台上的精细运动装置上。精细运动装置可以使用 x 方向 20 mm 滑动、y 方向摆动和 z 方向弓形运动来移动针位置。
- 在装有含有3%异氟醚的空气的密封盒中麻醉大鼠。通过对疼痛刺激无反应来确认麻醉。将兽医软膏涂抹在眼睛上以防止干燥。
- 用切割的手术胶带将四肢固定在40°C加热的回声板上。为了维持足够的麻醉,确保吸入的空气中含有大约 3% 浓度的异氟醚。
- 用脱毛膏去除注射区域(直径2厘米)和胸部的毛发,并用聚维酮碘擦拭皮肤。
- 在胸部和回声探头上涂抹回声凝胶。将回声探头沿颅轴和尾轴靠近胸部放置,并按照制造商的手册开始进行 B 型超声心动图检查。
- 将注射针的尖端推进到心肌中 view (图2 和 补充视频1)。
- 要激活主注射泵,请按下 开始 按钮,然后旋转刻度盘以调整到预定数字,注射速度约为 0.02 μL/s。在针刺位置周围局部涂抹兽药膏,以防止感染。
注意:有必要使用注射溶液确定预期注射速度的适当刻度盘号码。注射后,使用示例性运动系统取出注射针头。 - 将异氟醚浓度降低至0%,等待约5分钟,直到动物恢复足够的意识以维持胸骨卧位。
5.心功能评估
- 在装有含有3%异氟醚的空气的密封盒中麻醉大鼠。通过对疼痛刺激无反应来确认麻醉。将兽医软膏涂抹在眼睛上以防止干燥。
- 在肢体尖端涂抹用于心电图采集的电镜霜。用切割的手术胶带将四肢固定在40°C加热的回声板上。使用生理监测系统检测实时心电图和心率。
- 根据制造商的说明,首先使用显示左心室顶点到流出道的 B 型回波图像确定长轴角度,然后将回声探头旋转 90° 以更改为短轴视图。
- 仅使用动物阶段的尾轴到喙轴精细运动系统,将短轴视图调整到肌水平。然后,按 M 模式按钮将图像模式更改为 M 模式 ,并按 Cine-loop 按钮录制 5 秒的视频。
- 要使用软件分析和计算分数缩短,请按 "测量 "按钮和垂直线工具来定义左心室收缩末期和舒张末期的内部尺寸。软件自动计算馏分缩短百分比 (FS)。
- 将异氟醚浓度降低至0%,等待约5分钟,直到动物恢复足够的意识以维持胸骨卧位。
6. 免疫组化
- 使用切割的手术胶带将安乐死的尸体(如步骤1.1.3所示进行安乐死)固定在桌子上,切除心脏,用PBS清洗,并将心脏浸入4%多聚甲醛/ PBS中。
- 将心脏解剖成三部分,将它们浸入40%蔗糖中以进行冷冻保护,嵌入最佳切割温度(OCT)化合物中,并在-80°C下冷冻。
- 将冷冻切片组织(8μm厚度)附着在氨基硅烷包被的载玻片上。使用一般吹风机产生的非加热风充分干燥后,将载玻片浸入含有0.2%吐温-20(TBS-T)的tris缓冲盐水中。
- 将它们浸入封闭溶液中30分钟,在25°C下。 将100μL含一抗的封闭溶液倒在载玻片上,并在4°C下用石蜡密封孵育过夜,以保持抗体溶液在组织上铺展。
注:抗体浓度显示在 材料表中。 - 将载玻片水平放置在手工制作的高湿度盒子中,利用湿纸中的天然蒸汽防止蒸发。用TBS-T清洗载玻片三次。
- 用含有二抗的封闭剂在25°C下以与一抗相同的方式处理1小时。洗涤三次后,使用荧光显微镜和共聚焦激光显微镜观察荧光信号。
注:抗体浓度显示在 材料表中。 - 统计分析:对于细胞体积比较, 如图3A所示,进行非配对 t检验;要评估使用慢速注射方法( 如图 4A 所示)给予心肌细胞后的心脏功能恢复,请使用配对 t 检验。在这项工作中,差异被认为在 P < .01时具有统计学意义。误差线表示标准偏差。
结果
慢速注射对细胞存活和胶原沉积的影响
将标有PKH26的新生大鼠心肌细胞球注射到正常裸鼠心肌中,采用正常或慢速注射方法。结果表明,慢速注射方法显着增加了移植细胞的体积(图3A),并显着减少了现场I型胶原蛋白的沉积(图3B)。
慢速注射对大鼠梗死模型治疗效果的影响
采用超声心动图引导下慢速注射法将新生大鼠心肌细胞球或PBS(−)注射到模型大鼠梗死心脏中。2个月后,单独进行细胞注射的组心脏收缩功能明显改善(图4A)。免疫组织化学分析显示,通过含有间隙连接的插层盘,移植细胞和宿主肌细胞之间存在无缝连接(图4B)。
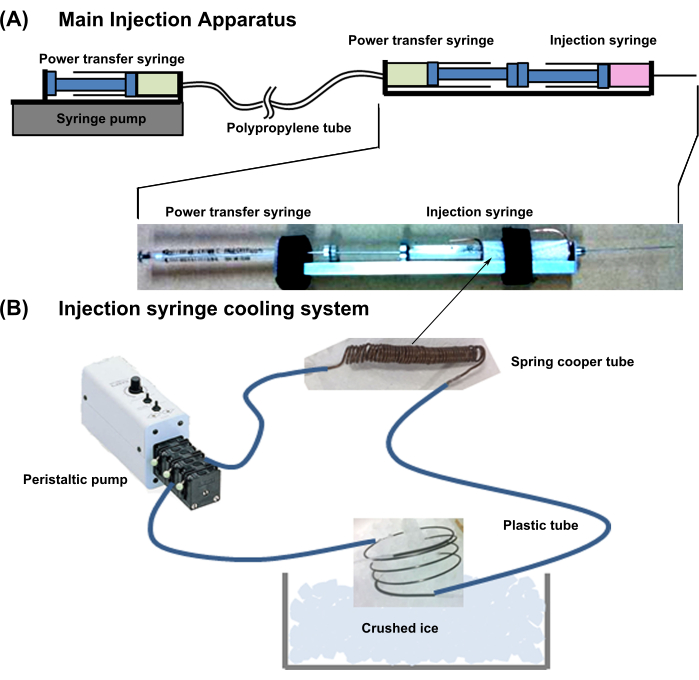
图1:整个喷射系统示意图 。 (一)主注射装置。(B)注射器冷却系统。 请点击这里查看此图的较大版本.
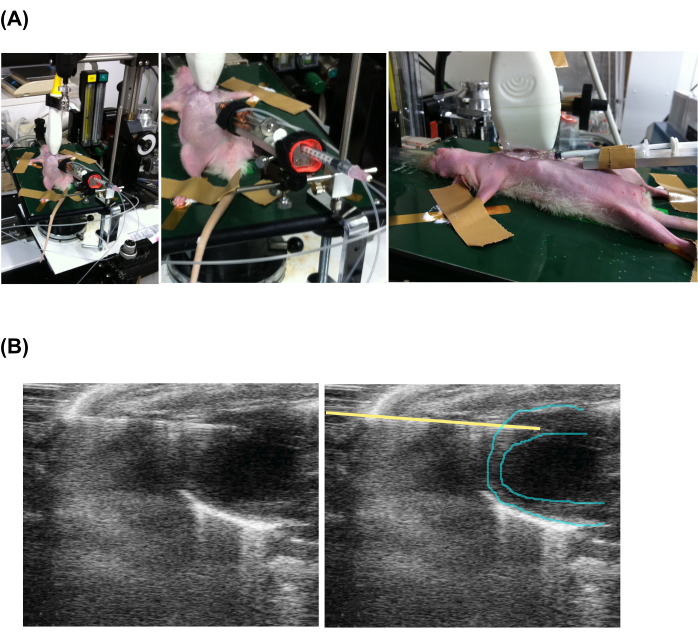
图 2:超声心动图引导下经皮慢速 注射。 (A) 动物、回声探头和注射装置的设置。(B) 注射注射器和心脏的超声心动图视图。请注意,左图和右图相同,但添加了一条黄线来指示针的位置。 请点击这里查看此图的较大版本.
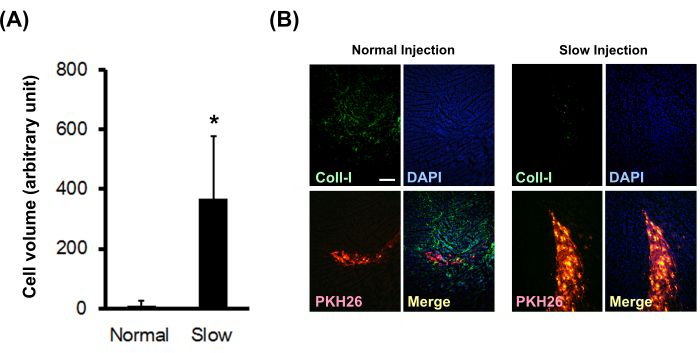
图 3:慢速注射方法对移植细胞体积和胶原沉积的影响。 (A) 移植细胞体积 (N = 3) 由连续切片计算。误差线表示标准偏差。*P < 0.01 在非配对 t 检验中。(B) I型胶原的免疫组化染色。比例尺表示 200 μm。 请点击这里查看此图的较大版本.
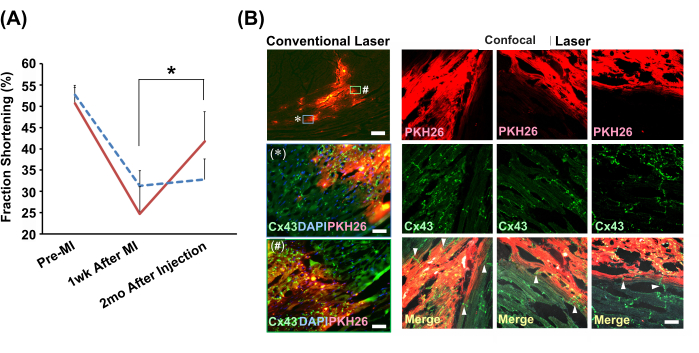
图 4:通过慢速注射方法移植的心肌细胞球改善心脏功能和组织学整合 。 (A) 代表性超声心动图 M 模式视图。该图显示了心肌细胞球移植组分数缩短的转变(红色实线;N=4)和载体(细胞悬浮液为慢速注射法)组(蓝线虚线;N = 3)。缩写:MI=心肌梗死;Cx43 = 连接蛋白 43;DAPI = 4',6-二脒基-2-苯基吲哚;PKH26 = 红色荧光细胞膜标记。误差线表示标准偏差。*P <配对 t 检验中为 0.01。(B)移植心肌细胞球与宿主心肌细胞之间关系的免疫组织化学分析。左栏显示了使用2倍物镜进行常规激光显微观察。下面显示了框中显示的两个区域的放大版本(使用 20 倍物镜),标有 * 和 #。比例尺:顶部图像 = 300 μm;* 和 # = 30 μm。使用20倍物镜的共聚焦激光显微图像显示为比较。显示了三个位置。在合并的图像中,箭头表示存在直接连接移植物和宿主心肌细胞的间隙连接(Cx43)。比例尺表示 30 μm。 请点击这里查看此图的较大版本.
补充视频1:回声引导的慢速注射方法。 正面视图中的 B 型超声心动图显示注射针尖进入心肌。 请点击这里下载此文件。
讨论
慢速注射方法成功执行的关键点之一是使用强大的注射泵和强大的压力传输管制备有效的注射系统。需要高压系统才能将凝胶从细针尖端推出。第二个关键点是心脏的稳定。心脏与进入心肌的注射针的跳动会损伤组织。在这项研究中,进行了回声引导注射,以避免动物经历第二次开胸损伤,并在肺部充气的稳定心脏中进行细胞注射。此外,在一些大型动物或人类的应用中,应将一些连接到心脏的注射装置视为应用战略设计的一部分。对于小动物的心脏进行开胸注射,建议使用长而灵活的针头,因为它们的心率较高。
在这项工作中,与正常注射方法相比,慢速注射方法显着增加了存活的心肌细胞体积。正常注射 通过 剪切应力引起细胞损伤15.相比之下,慢速注射方法在理论上不会引起这种应力,因为它除了慢速注射外还使用了非牛顿解。
在局部纤维化方面,正常注射的存活心肌细胞周围的间质空间显示出强烈而广泛的I型胶原沉积。相比之下,使用慢速注射方法移植的移植心肌细胞周围的I型胶原信号要弱得多,也更有限。这表明缓慢注射方法造成的损害要小得多。将新生儿心肌细胞缓慢注射到成人心肌中,可显著改善梗死心脏的收缩功能。组织学分析表明,使用慢速注射法移植心肌细胞可与宿主心肌细胞直接连接和功能偶联。这种现象解释了宿主心肌功能恢复的机制。据我们所知,这是首次报道移植的新生儿心肌细胞与宿主成人心肌细胞的大规模无缝连接。 通过 电和机械耦合与宿主心肌的功能连接可能使移植的心肌细胞成熟,并允许它们充当有助于宿主心脏功能的功能性肌细胞。宿主和移植物心肌细胞之间的长期物理力相互作用对于完全成熟至关重要。因此,注射后可能需要 2 个月才能恢复梗死心脏的功能。患者心脏功能的时间依赖性恢复可能是治疗应用中的预期现象,这可能是宿主和移植的心肌细胞之间成功建立 从头 功能偶联和整合的标志。
慢速注射方法可以在开胸手术期间进行。此外,这种方法可以应用于小鼠。对于未来在人体治疗中的应用,我们仍然需要解决几个问题。注射速度应通过考虑人体每个靶器官中间质液流动的缓冲能力来优化。应使用无异种成分的材料,例如人明胶或可生物降解的合成材料。应开发临床GMP级慢速注射器械,如紧凑型器官专用一次性工具或可重复使用的宽器官适用器械。
披露声明
作者没有什么可透露的。
致谢
这项研究得到了JSPS KAKENHI(批准号23390072和19K07335)和AMED(批准号A-149)的资助。
材料
| Name | Company | Catalog Number | Comments |
| 18-gauge needle & tuberculin, 1 mL | Terumo | NN1838R, SS-01T | |
| 29-gauge 50 mm-long needle | Ito Corporation, Tokyo, Japan | 14903 Type-A | |
| A copper tube | General Suppliers | outer diameter, 1 mm; inner diameter, 0.3 mm; thickness, 0.35 mm | |
| Ads Buffer | Each ingredient was purchased from Fuji Film Wako Chemical Inc., Miyazaki, Japan | Hand made, Composition: 116 mM NaCl, 20 mM HEPES, 12.5 mM NaH2PO4, 5.6 mM glucose, 5.4 mM KCl, 0.8 mM MgSO4, pH 7.35 | |
| alpha-MEM | Fuji Film Wako Chemical Inc., Miyazaki, Japan | 051-07615 | |
| Anti-collagen type I rabbit polyclonal antibody (H+L) | Proteintech | 14695-1-AP | using dilution 1:100 |
| Anti-Connexin-43 rabbit polyclonal antibody (H+L) | Sigma Aldrich | C6219 | using dilution 1:100 |
| Anti-rabbit IgG (H+L) donley polyclonal antibody-AlexaFluo488 | Thermo Scientific | A21206 | using dilution 1:300 |
| blocking solution (Blocking One) | Nacalai Tesque, Kyoto, Japan | 03953-95 | |
| collagenase | Fuji Film Wako Chemical Inc., Miyazaki, Japan | 034-22363 | |
| confocal laser microscope | Carl Zeiss Inc., Oberkochen, Germany | LSM510 META | |
| DNase I | Sigma-Aldrich | DN25 | |
| FACS Aria III | Becton Dickinson, Franklin Lakes, NJ, USA | ||
| fetal bovine serum | BioWest, FL, USA | S1820-500 | |
| fine movement device (Micromanipulator) | Narishige Co., Ltd., Tokyo, Japan | M-44 | |
| fluorescence microscope | Nikon Instruments, Tokyo, Japan | Eclipse Ti2 | |
| gelatin from bovine skin | Sigma-Aldrich | G9382 | dissolving in PBS (-) to 10%, and autoclaving it |
| Neonatal Sprague-Dawley (SD) rats | Japan SLC Inc., Shizuoka, Japan | 0–2 d after birth | |
| non-adhesive 96-well plates (spheloid plate) | Sumitomo Bakelite, Tokyo, Japan | MS-0096S | |
| Optimal Cutting Temperature (OCT) Compound | Sakura Finetek USA, Inc., CA, USA | Tissue-Tek OCT compound | |
| peristaltic pump (for cooling system) | As One Co., Osaka, Japan | SMP-23AS | |
| PKH26 | Sigma-Aldrich | PKH26GL | |
| Stir Bar, Micro, Magnetic, PTFE, Length x Dia. in mm: 5 x 2 | Chemglass life sciences LLC, NJ, USA | CG-2003-120 | |
| syringe | Ito Corporation, Tokyo, Japan | MS-N25 | |
| syringe pump with remote controller | As One Co., Osaka, Japan | MR-1, CT-10 | |
| tetramethylrhodamine methyl ester | Thermo Fisher Scientific, Waltham, MA, USA | T668 | |
| trypsin | DIFCO, Becton Dickinson, Franklin Lakes, NJ, USA | 215240 | |
| Tween-20 | Fuji Film Wako Chemical Inc., Miyazaki, Japan | 167-11515 | |
| veterinarian ointment | Fujita Pharmaceutical Co., Ltd. | Hibikusu ointment #WAK-95832 | |
| Vevo 2100 Imaging System | Fujifilm VisualSonics, Inc., Toronto, Canada | Vevo 2100 | |
| Vevo 2100 Imaging System software version 1.0.0 | Fujifilm VisualSonics, Inc., Toronto, Canada | Vevo 2100 | |
| Weakly curved needle with ophthalmic thread | Natsume Seisakusho Co., Ltd., Tokyo, Japan | C7-70 |
参考文献
- Chavkin, N. W., et al. The cell surface receptors Ror1/2 control cardiac myofibroblast differentiation. Journal of the American Heart Association. 10 (13), e019904 (2021).
- Li, H., et al. The cell membrane repair protein MG53 modulates transcription factor NF-κB signaling to control kidney fibrosis. Kidney International. 101 (1), 119-130 (2022).
- Liu, X., Liu, Y., Khodeiry, M. M., Lee, R. K. The role of monocytes in optic nerve injury. Neural Regeneration Research. 18 (8), 1666-1671 (2023).
- Weber, F., Treeck, O., Mester, P., Buechler, C. Expression and function of BMP and activin membrane-bound inhibitor (BAMBI) in chronic liver diseases and hepatocellular carcinoma. International Journal of Molecular Sciences. 24 (4), 3473 (2023).
- Tohyama, S., et al. Distinct metabolic flow enables large-scale purification of mouse and human pluripotent stem cell-derived cardiomyocytes. Cell Stem Cell. 12 (1), 127-137 (2013).
- Hattori, F., Fukuda, K. Strategies for replacing myocytes with induced pluripotent stem in clinical protocols. Transplantation Reviews. 26 (3), 223-232 (2012).
- Hattori, F., et al. Nongenetic method for purifying stem cell-derived cardiomyocytes. Nature Methods. 7 (1), 61-66 (2010).
- Fernandes, S., et al. Human embryonic stem cell-derived cardiomyocytes engraft but do not alter cardiac remodeling after chronic infarction in rats. Journal of Molecular and Cellular Cardiology. 49 (6), 941-949 (2010).
- Shiba, Y., et al. Allogeneic transplantation of iPS cell-derived cardiomyocytes regenerates primate hearts. Nature. 538 (7625), 388-391 (2016).
- Wendel, J. S., et al. Functional effects of a tissue-engineered cardiac patch from human induced pluripotent stem cell-derived cardiomyocytes in a rat infarct model. Stem Cells Translational Medicine. 4 (11), 1324-1332 (2015).
- Hattori, F. Technology Platforms for Heart Regenerative Therapy Using Pluripotent Stem Cells. Stem Cells and Cancer Stem Cells, Volume 7: Therapeutic Applications in Disease and Injury. , 33-45 (2012).
- Tao, S., et al. Ablation lesion characterization in scarred substrate assessed using cardiac magnetic resonance. JACC: Clinical Electrophysiology. 5 (1), 91-100 (2019).
- Rutkowski, J. M., Swartz, M. A. A driving force for change: interstitial flow as a morphoregulator. Trends in Cell Biology. 17 (1), 44-50 (2007).
- Hattori, F., Fukuda, K., Yuasa, S. How to purify cardiomyocytes for research and therapeutic purposes. Cardiac Regeneration using Stem Cells. , (2013).
- Li, M., Tian, X., Zhu, N., Schreyer, D. J., Chen, X. Modeling process-induced cell damage in the biodispensing process. Tissue Engineering. Part C, Methods. 16 (3), 533-542 (2010).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。