Method Article
Minimum İnvazyon ile Yeni Bir Hücre Enjeksiyon Yöntemi
Bu Makalede
Özet
Bu yöntem, hücre süspansiyon çözeltisinin neden olduğu hücre enjeksiyonları sırasında herhangi bir büyük istilayı ortadan kaldırır.
Özet
Hücrelerin doğrudan dokulara enjekte edilmesi, hücre uygulamasında ve/veya replasman tedavisinde gerekli bir işlemdir. Hücre enjeksiyonu, hücrelerin dokuya girmesine izin vermek için yeterli miktarda süspansiyon çözeltisi gerektirir. Süspansiyon çözeltisinin hacmi dokuyu etkiler ve bu, hücre enjeksiyonunun bir sonucu olarak büyük invaziv yaralanmalara neden olabilir. Bu makale, bu yaralanmayı önlemeyi amaçlayan yavaş enjeksiyon adı verilen yeni bir hücre enjeksiyon yöntemini bildirmektedir. Bununla birlikte, hücreleri iğne ucundan dışarı itmek, Newton'un kesme kuvveti yasasına göre yeterince yüksek bir enjeksiyon hızı gerektirir. Yukarıdaki çelişkiyi çözmek için, bu çalışmada hücre süspansiyon çözeltisi olarak jelatin çözeltisi gibi Newton olmayan bir sıvı kullanıldı. Jelatin çözeltileri, formları yaklaşık 20 °C'de jelden sola değiştiği için sıcaklık hassasiyetine sahiptir. Bu nedenle, hücre süspansiyon çözeltisini jel formunda tutmak için, şırınga bu protokolde soğutuldu; Bununla birlikte, çözelti vücuda enjekte edildikten sonra, vücut ısısı onu bir sol'a dönüştürdü. İnterstisyel doku sıvı akışı fazla çözeltiyi emebilir. Bu çalışmada, yavaş enjeksiyon tekniği, kardiyomiyosit toplarının konakçı miyokarda girmesine ve fibrozu çevrelemeden aşılanmasına izin verdi. Bu çalışmada, saflaştırılmış ve top şeklinde yenidoğan sıçan kardiyomiyositlerini yetişkin sıçan kalbindeki uzak bir miyokard enfarktüsü alanına enjekte etmek için yavaş bir enjeksiyon yöntemi kullanılmıştır. Enjeksiyonu takip eden 2 ayda, nakledilen grupların kalpleri önemli ölçüde iyileşmiş kasılma fonksiyonu gösterdi. Ayrıca, yavaş enjekte edilen kalplerin histolojik analizleri, boşluk bağlantı bağlantıları içeren interkalasyonlu diskler aracılığıyla konakçı ve greft kardiyomiyositleri arasında kesintisiz bağlantılar olduğunu ortaya çıkardı. Bu yöntem, özellikle kardiyak rejeneratif tıpta yeni nesil hücre tedavilerine katkıda bulunabilir.
Giriş
Hücre uygulaması ve replasmanı, ağır hasar görmüş organlar için umut verici yeni terapötik stratejilerdir. Bu yeni terapötik stratejiler arasında kardiyak rejeneratif tıp büyük ilgi görmüştür. Bununla birlikte, yaralanmaların neden olduğu iltihaplanma, çeşitli organlarda skar oluşumuna aracılık eder 1,2,3,4. İnsan kalbi yaklaşık 1010 kardiyomiyositten oluşur; Bu nedenle, teorik olarak5,6, 109'dan fazla kardiyomiyosit ile tedavi edilmelidir. Geleneksel enjeksiyon yöntemleriyle çok sayıda kardiyomiyosit verilmesi önemli doku yaralanmalarına yol açabilir7. Bu yöntem, minimal doku invazyonu ile yeni bir hücre enjeksiyon yöntemi sağlar.
Organ parankimine hücre uygulaması enjeksiyon(lar) gerektirir. Bununla birlikte, enjeksiyonun kendisinin doku hasarına yol açabileceği konusunda bir tutarsızlık vardır. Doku hasarı, organ ve dokularda lokal inflamasyona ve tedavi edilemez yara izine ve ayrıca bozulmuş rejeneratif yeteneğe neden olur 8,9,10. Memeli kalbi, sürekli pompalama işlevinin neden olduğu yüksek tansiyona dayanmak için acil yaralanma onarımına ihtiyaç duyduğundan, yenilenmek yerine yara izleri geliştirme eğilimi son derece yüksektir11. Ablasyon tedavisi, skar oluşumuna yönelik bu yüksek eğilimi kullanır ve aritmi12 kullanarak skar oluşumuna uğraması muhtemel devreyi bloke eder. Daha önce yapılan bir çalışmada, skar dokusunun konakçı miyokardda enjekte edilen kardiyomiyositleri izole ettiği gözlenmiştir. Bu nedenle, bu, kardiyak rejeneratif tıpta gelişmiş terapötik etkinlik elde etmek için üstesinden gelinmesi gereken bir sonraki hedef sorunu temsil eder.
Doku interstisyel sıvı akışı, oksijen ve besin maddelerinin hücrelere iletilmesinde ve atılan atıkların hücrelerden uzaklaştırılmasında hayati bir rol oynar. Her doku/organdaki interstisyel sıvı akışının fizyolojik hızı farklıdır (aralık 0.01-10 μm/s'dir)13. Yazarın bildiği kadarıyla, tek tek dokuların/organların patolojik ödem olmadan ekstra miktarda sıvıyı destekleme kapasitesine ilişkin hiçbir veri yoktur; Bununla birlikte, bu deney, doku hasarını azaltmak için yavaş bir enjeksiyon hızı kullanmaya çalışır ve sonuçlar, bu kavramın pratikliğini belirlemek için kullanılabilir.
Protokol
Hayvan deneyleri, Kansai-Tıp Üniversitesi hayvan deneyleri için etik yönergelere göre yürütülmüş ve etik kurullar tarafından onaylanmıştır (onay numarası: 23-104). Tüm hayvanlar, belirli bir patojen içermeyen ortamda sabit bir aydınlık-karanlık döngüsü altında yetiştirildi. Makas, forseps ve ekartör gibi sterilize edilmiş tüm cerrahi aletler otoklavlandı ve iyice kurutuldu.
1. Yenidoğan sıçan kardiyomiyosit toplarının hazırlanması
- Yenidoğan sıçan kalbi koleksiyonu
- Kalp toplanması için, önceki bir raporda7 açıklanana benzer bir prosedür izleyin.
- Yenidoğan (doğumdan 0-2 gün sonra) Sprague-Dawley (SD) sıçanlarını sırayla povidon-iyot ve% 70 etanol çözeltilerine daldırın ve daha sonra buharlaştırılmış izofluran ile doldurulmuş hava geçirmez bir kutuya aktarın (konsantrasyon% 10 v / v'nin üzerinde olmalıdır) derin anestezi için.
- Lokomotor aktivite kaybı ile bilinç kaybının doğrulanmasından sonra, vücudu arkadan el ile tutan sıçanın başını kesin ve daha sonra keskin bir makas kullanarak göğüs kafesinin ön merkezinden kaudal'a ve daha sonra rostral yönde 2-4 mm doku kesin.
- Kesiği açmak için arka deriyi kavrayın ve kalbi göğüs kafesinden dışarı doğru itin. Ventrikülleri makas kullanarak kesin ve kalsiyum veya magnezyum (PBS(-)) içermeyen fosfat tamponlu salin (PBS) içine daldırın.
- Yenidoğan sıçan kardiyomiyositlerinin dağılımı
- Toplanan karıncıklar minimum miktarda Ad tamponu (Ads tamponu: 116 mM NaCl, 20 mM HEPES, 12.5 mM NaH2PO 4, 5.6 mM glukoz,5.4 mM KCl, 0.8 mMMgS04, pH 7.35) içinde dağılmış halde otoklavlanmış içbükey cam kaplar içinde kavisli makas kullanarak küçük parçalar halinde (1 mm x 1 mm) doğrayın.
- Kıyılmış dokuları ve bir mikro-manyetik karıştırıcıyı 50 mL'lik bir santrifüj tüpüne aktarın ve dokuları 30 dakika karıştırarak 37 °C'de Ads tamponunda %0.1 kollajenaz, %0.1 tripsin, 20 μg/mL DNaz I ve 50 nM tetrametilrodamin metil ester ile tek hücrelere dağıtın.
- Agregaları ve dağılmış hücreleri doğal sedimantasyon yoluyla ayırın, sadece dağılmış hücreleri bir tüpte toplayın ve artık hücre agregalarını aynı sindirim ortamı ile tekrar sindirin.
- Tüm hücreler tamamen ayrılana kadar bu işleme devam edin. Hücrelerin tam dağılımını doğrulamak için, tüpleri mikroskop altında gözlemleyin (4x objektif lens).
- Dağılmış hücreleri 5 dakika boyunca 150 x g'da santrifüjleme kullanarak toplayın ve bunları 1-2 mL Ads tamponunda ayrıştırın.
- Kardiyomiyositlerin floresanla aktive edilen hücre sınıflandırması
- Kırmızı floresan sinyallerini algılamak için 556-601 nm bant geçiren filtreler kullanarak floresanla aktive edilen hücre sıralamasını (FACS) kullanarak hücreleri analiz edin.
- İkili kesirleri ortadan kaldırmak için dikkatlice ön geçitleme yapın14. İkili eleme için kapı ayarları, üreticinin talimatlarına göre yapılmalıdır.
- X ekseninde ileri saçılımı ve y ekseninde kırmızı floresan sinyalini ayarlayın. Üç popülasyon gözlendi: eritrositler ve ölü hücreler içeren en düşük popülasyon, fibroblastlar ve endotel hücreleri dahil olmak üzere kardiyomiyosit olmayan bir orta popülasyon ve saf ventriküler kardiyomiyositler içeren bir üst popülasyon7.
- Kırmızı floresan etiketli kardiyomiyosit toplarının hazırlanması
- Kardiyomiyositleri seçici olarak sıralayın ve 150 x g'da 5 dakika santrifüjleyin. Hücre peletlerini% 10 ısıyla inaktive edilmiş fetal sığır serumu (FBS) içeren 1 mL alfa modifiye minimal esansiyel ortam (alfa-MEM) içinde tamamen çözün.
- Bir hemositometre kullanarak hücre konsantrasyonunu ölçün ve hücre süspansiyon çözeltisini alfa-MEM% 10 FBS ile 3.000 hücre / mL'ye seyreltin.
- Bunları hücre yapışkan olmayan 96 oyuklu plakalara (oyuk başına 100 μL) dağıtın, 100 x g'da 5 dakika santrifüjleyin ve 37 ° C'de% 5 CO 2 içeren bir hücre kültürü inkübatöründe2-3 gün kültürleyin.
- Enjeksiyon deneylerinden önce, 1.000 μL'lik bir pipet kullanarak kültür ortamı ile aspirasyon yoluyla her bir oyuktan bir kardiyomiyosit topu toplayın ve bunları 15 mL'lik bir tüpte toplayın.
- Aşılamadan sonra izleme için üreticinin talimatlarını izleyerek PKH26 ile boyayın.
2. Yavaş enjeksiyon yöntemi için hazırlıklar
- Jelatin stok çözeltisinin hazırlanması
- Jelatini tartın, %10 w/v çözelti üretmek için Ads tamponunda çözün ve otoklavlayın.
- Hücre enjeksiyon cihazı üretimi
- Genel cihaz tasarımı: Şekil 1'de gösterilen aparatı hazırlayın. Bu sistem bir şırınga soğutma aparatı ve ana enjeksiyon aparatı ile birleştirilmiştir.
- Aşağıda açıklanan ana enjeksiyon aparatını hazırlayın:
- Yenidoğan kardiyomiyosit top enjeksiyonu için, bir şırınga ile donatılmış 29 G, 50 mm uzunluğunda bir iğne kullanın.
- Bir hücre enjeksiyon şırıngası kullanarak bir güç aktarım şırıngasını (18G, 1 mL) arka arkaya bağlayın (Şekil 1). Güç transfer şırıngasının iğnesini düşük lümen genişletilebilirliğine sahip ince bir polipropilen tüpe bağlayın.
- Ardından, güç transfer tüpünün diğer tarafını aynı şırınganın iğnesine (18G, 1 mL) bağlayın ve bir şırınga pompasına yerleştirin. İki güç aktarım şırıngasını ve tüpünü hava kabarcığı olmadan suyla doldurun.
NOT: Güç aktarım şırıngasının bir pistonu içeri itildiğinde, basınç doğrudan diğer şırıngaya aktarılır ve piston dışarı çıkar.
- Enjeksiyon şırınga soğutma sistemini aşağıda açıklandığı gibi kurun.
- Bir bakır boruyu (dış çap = 1 mm; iç çap = 0.3 mm; kalınlık = 0.35 mm) hücre enjeksiyon şırıngasının hücre içeren kısmının etrafına sıkıca sarın ve her iki ucunda 10 mm fazla boru bırakın.
- Bakır boruyu esnek plastik boruya bağlayın. Ayrıca, plastik borunun diğer uçlarını harici bir pompaya bağlayın, hattı soğutma suyuyla doldurun ve fazla bakır boruyu kırılmış buza batırarak suyu soğutun (Şekil 1).
NOT: Bu soğutma sistemi, silindirdeki hücre süspansiyon çözeltisini yaklaşık 2 °C'de tutar.
3. Geniş koroner arter tıkanıklığı ile sıçan miyokard enfarktüsü modelinin geliştirilmesi
- Erkek bağışıklık eksikliği olan çıplak sıçanları (F344 / Njcl-rnu / rnu)% 3 izofluran içeren hava ile uyuşturun. Trakeaya bir kanül yerleştirin ve solunum cihazına bağlayın.
- % 3'lük bir izofluran konsantrasyonunu korumak ve böylece yeterli anesteziyi sürdürmek için bir kanülü bir kontrolör ile bir izofluran buharlaştırıcıya bağlayın. Ağrı uyaranlarına yanıt vermediğinizi onaylayın. Kuruluğu önlemek için gözlere veteriner merhemi sürün.
- Uzuvları kesilmiş cerrahi bantlarla 40 °C ısıtılmış bir cerrahi plakaya sabitleyin. Sıçanın vücudunu vücut ekseninin sağına doğru bükün ve sol koltuk altını cerrahi alan olarak kullanın.
- Tüy dökücü bir krem kullanarak cerrahi alandaki tüyleri alın ve cildi povidon-iyot ile silin. Keskin bir makas kullanarak ciltte ve pektoralis majör kasında 1,5 cm'lik bir kesi kesin.
- Üçüncü interkostal boşluğu onaylayın ve künt uçlu mikro forseps kullanarak interkostal kasları ve kostal plevrayı yırtın. Bir ekartör kullanarak göğsü açık tutun. İnce perikardları forseps ile yavaşça çıkarın.
- Kalbin yan duvarının bir enfarktüs modelini oluşturmak için, geniş koroner arteri tanımlamak için sol atriyumun ucuna 1 mm kaudal pozisyonu bulun, 7-0 ipek sütür atın, dorsalden ventrale 2,5 mm genişliğinde ve 2,5 mm derinliğinde dokuyu alın ve dokuyu sıkıca bağlayın.
- Ligatürden distaldeki zayıf kasılma ile başarılı ligasyonu onaylayın. Ekartörü nazikçe çıkardıktan sonra, ikinci ve dördüncü interkostal boşluklar arasına 5-0 ipek sütür yerleştirin ve torakotomiyi kapatın.
- İzofluran konsantrasyonunu% 1'e düşürün. Kas ve cildi 5-0 ipek ile nazikçe dikin. İzofluran konsantrasyonunu% 0'a düşürün ve spontan solunum başlayana kadar yaklaşık 5 dakika bekleyin.
- Topikal olarak 2 mg / mL lidokaini salin içinde insizyona uygulayın. Deri altı enjeksiyonu ile 1 mL salin uygulayın. Enfeksiyonları önlemek için veteriner merhemini topikal olarak uygulayın.
- Fareyi entübasyon tüpünden çıkarın ve hayvan kafesine geri dönün; Ardından, fareleri 1 hafta boyunca ayrı kafeslerde büyütün.
- Ekokardiyografi kullanarak kardiyak sistolik pompa fonksiyonundaki değişiklikleri analiz edin.
NOT: Lateral miyokard enfarktüsü nedeniyle kardiyak fonksiyon azalacaktır.
4. Yavaş enjeksiyon yöntemi kullanılarak eko kılavuzluğunda perkütan hücre nakli
- %10 jelatin stoğunu sıvı hale gelene kadar 37 °C'de önceden ısıtın.
- Nihai enjekte edilebilir %5 w/v jelatin çözeltisini elde etmek için %10 jelatin stoğunu önceden ısıtılmış Ads tamponu ile seyreltin (hayvan başına 100 μL gereklidir).
- 96 kardiyomiyosit topunu (toplam: 28.800 kardiyomiyosit / hayvan) 100 μL önceden ısıtılmış enjeksiyon çözeltisinde askıya alın.
- Adım 4.3'te hazırlanan süspansiyonu, fazla hava aspirasyonunu önleyerek hücre enjeksiyon şırıngasına yükleyin.
- Şırıngadaki kabarcıkları ortadan kaldırmak için, iğne yukarı bakacak şekilde dikey olarak tutun, şırıngaya hafifçe vurun ve şırınganın üst sırtındaki kabarcıkları toplayın.
NOT: Bu adım sırasında, kardiyomiyosit toplarının yavaş yavaş pistonun lastik contasına yerleştiğini gözlemleyin. - Şırınganın dikey konumunu koruyun, pistonu yavaşça yukarı itin ve şırıngada 20 μL hücre süspansiyonu kalana kadar kabarcıkları ve fazla hücre süspansiyon çözeltisini atın. Pistonu, kardiyomiyosit topunun pistonun lastik contası üzerinde durması için sabit bir hızda dikkatlice itin.
- Kapaklı şırıngayı 5 dakika boyunca doğrudan bir buz banyosuna daldırın.
- Enjeksiyon aparatına soğutulmuş bir şırınga yerleştirin. X-Y-Z konumu ayarlanabilir el yapımı bir kelepçe kullanarak hayvan sahnesinde ince bir hareket cihazına yerleştirilmiş enjeksiyon şırınga aparatını sıkıca sabitleyin. İnce hareket cihazı, x yönünde 20 mm sürgü, y yönünde dönüş ve z yönünde eğilme hareketlerini kullanarak iğne konumunu hareket ettirebilir.
- Sıçanları% 3 izofluran içeren hava ile dolu kapalı bir kutuda uyuşturun. Ağrı uyaranlarına yanıt vermeden anesteziyi onaylayın. Kuruluğu önlemek için gözlere veteriner merhemi sürün.
- Uzuvları kesilmiş cerrahi bantlarla 40 °C ısıtılmış eko plakasına sabitleyin. Yeterli anesteziyi sürdürmek için, solunan havanın yaklaşık% 3 izofluran konsantrasyonu içerdiğinden emin olun.
- Enjeksiyon alanındaki (2 cm çapında) ve göğsündeki tüyleri tüy dökücü kremle alın ve cildi povidon-iyot ile silin.
- Göğse eko-jel uygulayın ve eko probu yapın. Eko probunu kraniyal ve kaudal eksenler boyunca göğse yakın bir yere yerleştirin ve üretici kılavuzunu izleyerek B-mod ekokardiyografi almaya başlayın.
- Enjeksiyon iğnesinin ucunu önden görünümde miyokardın içine ilerletin (Şekil 2 ve Ek Video 1).
- Ana şırınga pompasını etkinleştirmek için Başlat düğmesine basın ve yaklaşık 0.02 μL/s'lik bir enjeksiyon hızı için önceden belirlenmiş bir sayıya ayarlamak için kadranı çevirin. Enfeksiyonları önlemek için veteriner merhemini iğneleme pozisyonunun etrafına topikal olarak uygulayın.
NOT: Bir enjeksiyon solüsyonu kullanılarak amaçlanan enjeksiyon hızı için uygun arama numarasının belirlenmesi gerekir. Enjeksiyondan sonra, örnek bir hareket sistemi kullanarak enjeksiyon iğnesini çıkarın. - İzofluran konsantrasyonunu% 0'a düşürün ve hayvan sternal yaslığı korumak için yeterli bilinci yeniden kazanana kadar yaklaşık 5 dakika bekleyin.
5. Kardiyak fonksiyonun değerlendirilmesi
- Sıçanları% 3 izofluran içeren hava ile dolu kapalı bir kutuda uyuşturun. Ağrı uyaranlarına yanıt vermeden anesteziyi onaylayın. Kuruluğu önlemek için gözlere veteriner merhemi sürün.
- Uzuv uçlarına EKG alımı için elektriklendirici krem sürün. Uzuvları kesilmiş cerrahi bantlarla 40 °C ısıtılmış eko plakasına sabitleyin. Gerçek zamanlı EKG ve kalp atış hızını tespit etmek için fizyolojik bir izleme sistemi kullanın.
- Üreticinin talimatlarına göre, önce sol ventrikül apeksi çıkış yoluna gösteren B-modu yankı görüntüsünü kullanarak uzun eksen açısını belirleyin ve ardından kısa eksene geçmek için yankı probunu 90° döndürün.
- Hayvan aşamasının yalnızca kaudal-rostral eksen ince hareket sistemini kullanarak, kısa eksen görünümünü papiller kas seviyesine ayarlayın. Ardından, M modu düğmesine basarak görüntü modunu M moduna değiştirin ve Cine-loop düğmesine basarak 5 saniye boyunca bir video kaydedin.
- Yazılımı kullanarak fraksiyon kısalmasını analiz etmek ve hesaplamak için, sistolik sonu ve diyastol sonu sol ventrikül iç boyutlarını tanımlamak için Ölç düğmesine ve dikey çizgi aracına basın. Yazılım, yüzde kesir kısalmasını (FS) otomatik olarak hesaplar.
- İzofluran konsantrasyonunu% 0'a düşürün ve hayvan sternal yaslığı korumak için yeterli bilinci yeniden kazanana kadar yaklaşık 5 dakika bekleyin.
6. İmmünohistokimya
- Kesilen cerrahi bantları kullanarak ötenazi yapılmış vücudu (adım 1.1.3'teki gibi ötenazi yapın) masaya sabitleyin, kalpleri çıkarın, PBS ile yıkayın ve kalbi %4 paraformaldehit/PBS'ye daldırın.
- Kalpleri üç bölüme ayırın, kriyoproteksiyon için %40 sükroza daldırın, optimum kesme sıcaklığı (OCT) bileşiğine gömün ve -80 °C'de dondurun.
- Kriyoseksiyonel dokuları (8 μm kalınlığında) aminosilan kaplı cam slaytlara takın. Genel bir saç kurutma makinesi tarafından üretilen ısıtılmamış rüzgarı kullanarak yeterli kurutmadan sonra, cam slaytları %0,2 Tween-20 (TBS-T) içeren üç tamponlu tuzlu suya daldırın.
- Bunları 25 ° C'de 30 dakika boyunca bir engelleme solüsyonuna daldırın. Birincil antikor içeren bloke edici solüsyonun 100 μL'sini slayt üzerine dökün ve antikor solüsyonunun doku üzerinde yayılmasını sağlamak için gece boyunca 4 ° C'de parafin sızdırmazlığı ile inkübe edin.
NOT: Antikor konsantrasyonu Malzeme Tablosunda gösterilmiştir. - Buharlaşmayı önlemek için ıslak kağıttan gelen doğal buharı kullanarak slaytları el yapımı yüksek nemli bir kutuya yatay olarak yerleştirin. Slaytları TBS-T ile üç kez yıkayın.
- İkincil antikor içeren bloke edici ajan ile 25 ° C'de 1 saat boyunca birincil antikorla aynı şekilde tedavi edin. Üç yıkamadan sonra, bir floresan mikroskobu ve konfokal lazer mikroskobu kullanarak floresan sinyallerini gözlemleyin.
NOT: Antikor konsantrasyonu Malzeme Tablosunda gösterilmiştir. - İstatistiksel analiz: Hücre hacmi karşılaştırması için, Şekil 3A'da gösterildiği gibi, eşlenmemiş bir t-testi gerçekleştirin; Şekil 4A'da gösterildiği gibi yavaş enjeksiyon yöntemi kullanılarak kardiyomiyosit uygulamasını takiben kardiyak fonksiyonel iyileşmeyi değerlendirmek için eşleştirilmiş bir t-testi kullanın. Bu çalışmada farklılıklar P < .01'de istatistiksel olarak anlamlı kabul edilmiştir. Hata çubukları standart sapmayı temsil eder.
Sonuçlar
Yavaş enjeksiyonun hücre sağkalımı ve kollajen birikimi üzerindeki etkileri
PKH26 ile işaretlenmiş yenidoğan sıçan kardiyomiyosit topları, normal veya yavaş enjeksiyon yöntemi kullanılarak normal çıplak sıçan miyokardına enjekte edildi. Sonuçlar, yavaş enjeksiyon yönteminin aşılanmış hücre hacmini önemli ölçüde arttırdığını (Şekil 3A) ve yerinde tip I kollajen birikimini önemli ölçüde azalttığını (Şekil 3B) göstermiştir.
Sıçan enfarktüs modelinde yavaş enjeksiyonun tedavi etkinliği üzerine etkileri
Ekokardiyografi kılavuzluğunda yavaş enjeksiyon yöntemi, model sıçanların enfarktüslü kalplerine yenidoğan sıçan kardiyomiyosit topları veya PBS(-) enjekte etmek için kullanıldı. Tek başına hücre enjekte edilen grup, 2 ay sonra kalp kasılma fonksiyonunda önemli bir iyileşme gösterdi (Şekil 4A). İmmünohistokimyasal analizler, aşılanmış hücreler ve konakçı miyositler arasında boşluk bağlantıları içeren interkalasyonlu diskler aracılığıyla kesintisiz bir bağlantı olduğunu ortaya koydu (Şekil 4B).
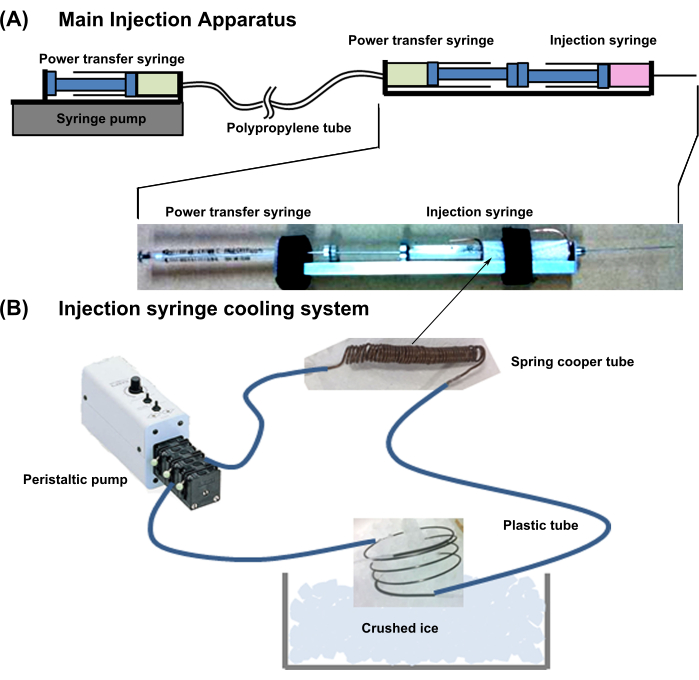
Şekil 1: Tüm enjeksiyon sisteminin şeması . (A) Ana enjeksiyon aparatı. (B) Enjeksiyon şırınga soğutma sistemi. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
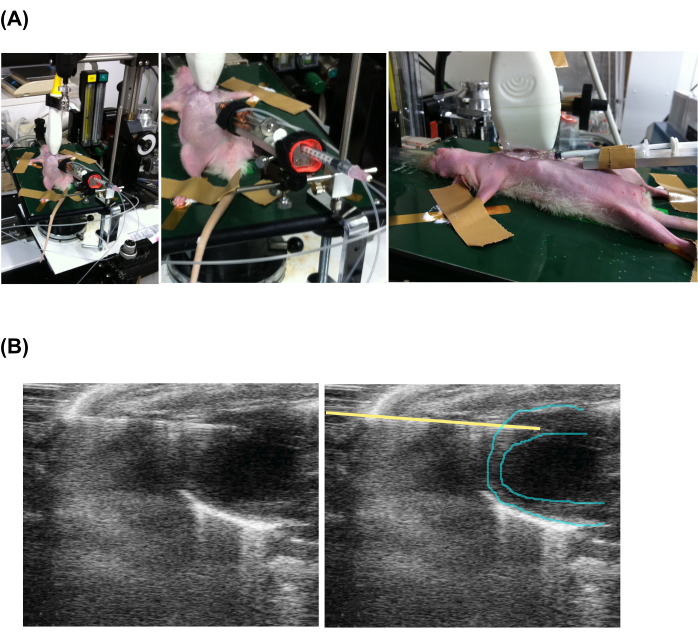
Şekil 2: Ekokardiyografi eşliğinde perkütan yavaş enjeksiyon. (A) Hayvanın, eko probunun ve enjeksiyon aparatının ayarlanması. (B) Enjekte eden şırınga ve kalbin ekokardiyografik görünümü. Sol ve sağ resimlerin aynı olduğunu, ancak iğne konumunu belirtmek için sarı bir çizgi eklendiğini unutmayın. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
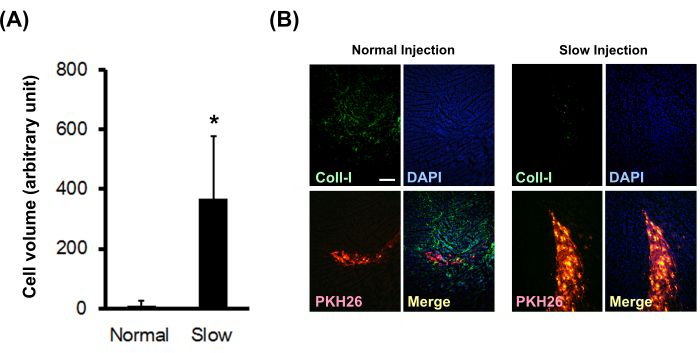
Şekil 3: Yavaş enjeksiyon yönteminin aşılanmış hücre hacmi ve kollajen birikimi üzerine etkisi. (A) Aşılanmış hücre hacimleri (N = 3) seri kesitlerden hesaplandı. Hata çubukları standart sapmaları gösterir. *P < eşlenmemiş bir t-testinde 0.01'dir. (B) Tip I kollajen için immünohistokimyasal boyama. Ölçek çubuğu 200 μm'yi gösterir. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
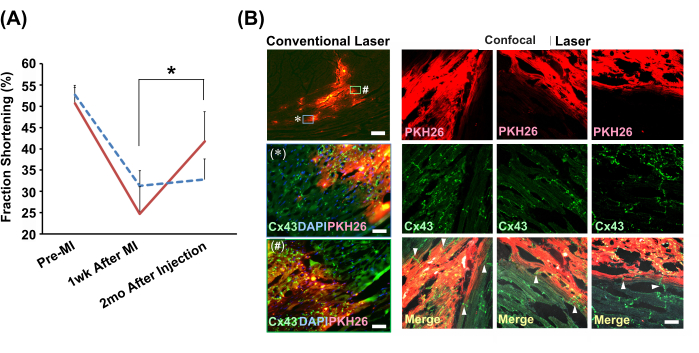
Şekil 4: Kalp fonksiyonundaki gelişmeler ve yavaş enjeksiyon yöntemi ile aşılanan kardiyomiyosit topları ile histolojik entegrasyon . (A) Temsili ekokardiyografi M-modu görünümleri. Grafik, kardiyomiyosit top nakli yapılan gruptaki fraksiyon kısalmalarının geçişini göstermektedir (düz kırmızı çizgi; N = 4) ve araç (yavaş enjeksiyon yöntemi için hücre süspansiyon çözümü) grubu (noktalı mavi çizgi; N = 3). Kısaltmalar: MI = miyokard enfarktüsü; Cx43 = bağlantı 43; DAPI = 4',6-diamidino-2-fenilindol; PKH26 = kırmızı floresan hücre zarı etiketi. Hata çubukları standart sapmaları gösterir. *P < eşleştirilmiş bir t-testinde 0.01'dir. (B) Aşılanmış kardiyomiyosit topları ile konakçı kardiyomiyositleri arasındaki ilişkinin immünohistokimyasal analizleri. 2x objektif lens kullanılarak yapılan geleneksel lazer mikroskobik gözlemler sol sütunda gösterilmiştir. Kutuda gösterilen, * ve # ile etiketlenmiş iki alanın yakınlaştırılmış versiyonları (20x objektif lens kullanılarak) aşağıda sunulmuştur. Ölçek çubukları: üstteki görüntü = 300 μm; * ve # = 30 μm. 20x objektif lens kullanan konfokal lazer mikroskobik görüntüler, komaparison için birlikte gösterilmiştir. Üç konum gösterilir. Birleştirilmiş görüntülerde, ok uçları, greft ve konakçı kardiyomiyositleri doğrudan birbirine bağlayan boşluk bağlantılarının (Cx43) varlığını göstermektedir. Ölçek çubuğu 30 μm'yi gösterir. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
Ek Video 1: Eko kılavuzluğunda yavaş enjeksiyon yöntemi. Önden görünümdeki B-mod ekokardiyogram, miyokardın içine ilerlemiş enjeksiyon iğnesi ucunu gösterir. Bu Dosyayı indirmek için lütfen buraya tıklayın.
Tartışmalar
Yavaş enjeksiyon yönteminin başarılı bir şekilde gerçekleştirilmesinde kritik noktalardan biri, güçlü bir şırınga pompası ve güçlü bir basınç transfer tüpü kullanılarak etkili bir enjeksiyon sisteminin hazırlanmasıdır. Jeli ince bir iğnenin ucundan dışarı itmek için yüksek basınçlı bir sistem gereklidir. İkinci kritik nokta, kalbin stabilizasyonudur. Kalbin miyokarda ilerletilen bir enjeksiyon iğnesine karşı atması dokuya zarar verebilir. Bu çalışmada, ikinci bir açık göğüs yaralanması geçiren hayvanlardan kaçınmak ve hücre enjeksiyonunu akciğerler şişirilmiş stabilize bir kalpte uygulamak için eko kılavuzluğunda bir enjeksiyon yapıldı. Ayrıca, daha büyük hayvanlar veya insanlar için yapılan bazı uygulamalarda, kalbe takılan bazı enjeksiyon cihazları, uygulamanın stratejik tasarımının bir parçası olarak düşünülmelidir. Küçük hayvanların kalplerine açık göğüs enjeksiyonları için, daha yüksek kalp atış hızları göz önüne alındığında uzun, esnek bir iğne kullanılması önerilir.
Bu çalışmada yavaş enjeksiyon yöntemi, normal enjeksiyon yöntemine göre hayatta kalan kardiyomiyosit hacmini önemli ölçüde arttırmıştır. Normal enjeksiyon, kesme gerilimi15 yoluyla hücre hasarına neden olur. Buna karşılık, yavaş enjeksiyon yöntemi, yavaş enjeksiyona ek olarak Newtonian olmayan bir çözelti kullandığı için teorik olarak böyle bir strese neden olmaz.
Lokal fibrozis açısından, normal olarak enjekte edilen hayatta kalan kardiyomiyositlerin etrafındaki interstisyel boşluk, güçlü ve yaygın tip I kollajen birikimi gösterdi. Buna karşılık, yavaş enjeksiyon yöntemi kullanılarak aşılanan aşılanmış kardiyomiyositlerin etrafındaki tip I kollajen sinyalleri çok daha zayıf ve daha sınırlıydı. Bu, yavaş enjeksiyon yönteminin önemli ölçüde daha az hasara neden olduğunu göstermektedir. Yenidoğan kardiyomiyositlerinin yetişkin miyokardına yavaş enjeksiyonu, enfarktüslü kalbin kasılma fonksiyonunu önemli ölçüde iyileştirdi. Histolojik analizler, kardiyomiyositlerin yavaş enjeksiyon yöntemi kullanılarak aşılanmasının, konakçı kardiyomiyositlerle doğrudan bağlantı ve fonksiyonel bağlantı ile sonuçlandığını göstermiştir. Bu fenomen, konakçı miyokardın fonksiyonel iyileşme mekanizmasını açıklar. Bildiğimiz kadarıyla, bu, konakçı yetişkin kardiyomiyositlere büyük ölçekli kesintisiz bağlantılara sahip aşılanmış neonatal kardiyomiyositlerin ilk raporudur. Elektriksel ve mekanik kuplaj yoluyla konakçı miyokard ile fonksiyonel bağlantılar, aşılanmış kardiyomiyositleri olgunlaştırabilir ve konakçı kalp fonksiyonuna katkıda bulunan fonksiyonel miyositler olarak hareket etmelerine izin verebilir. Konakçı ve greft kardiyomiyositleri arasındaki uzun süreli fiziksel kuvvet etkileşimleri tam olgunlaşma için çok önemlidir. Bu nedenle enfarktüslü kalbin fonksiyonel iyileşmesi için enjeksiyondan sonra 2 ay gerekebilir. Hastanın kalp fonksiyonunun zamana bağlı iyileşmesi, terapötik uygulamalarda beklenen bir fenomen olabilir ve bu, konakçı ve aşılanmış kardiyomiyositler arasında de novo fonksiyonel eşleşme ve entegrasyonun başarılı bir şekilde kurulmasının bir işareti olabilir.
Yavaş enjeksiyon yöntemi açık göğüs ameliyatı sırasında yapılabilir. Ek olarak, bu yöntem farelere uygulanabilir. İnsan terapisinde gelecekteki uygulamalar için hala birkaç sorunu çözmemiz gerekiyor. Enjeksiyon hızı, her bir insan hedef organındaki interstisyel sıvı akışının tampon kapasitesi dikkate alınarak optimize edilmelidir. İnsan jelatini veya biyolojik olarak parçalanabilen sentetik malzemeler gibi kseno içermeyen malzemeler uygulanmalıdır. Kompakt organa özgü tek kullanımlık aletler veya yeniden kullanılabilir geniş organa uygulanabilir bir aparat gibi klinik GMP dereceli yavaş enjeksiyon aparatı geliştirilmelidir.
Açıklamalar
Yazarın ifşa edecek hiçbir şeyi yok.
Teşekkürler
Bu çalışma, JSPS KAKENHI (Hibe No. 23390072 ve 19K07335) ve AMED (Hibe No. A-149) tarafından desteklenmiştir.
Malzemeler
| Name | Company | Catalog Number | Comments |
| 18-gauge needle & tuberculin, 1 mL | Terumo | NN1838R, SS-01T | |
| 29-gauge 50 mm-long needle | Ito Corporation, Tokyo, Japan | 14903 Type-A | |
| A copper tube | General Suppliers | outer diameter, 1 mm; inner diameter, 0.3 mm; thickness, 0.35 mm | |
| Ads Buffer | Each ingredient was purchased from Fuji Film Wako Chemical Inc., Miyazaki, Japan | Hand made, Composition: 116 mM NaCl, 20 mM HEPES, 12.5 mM NaH2PO4, 5.6 mM glucose, 5.4 mM KCl, 0.8 mM MgSO4, pH 7.35 | |
| alpha-MEM | Fuji Film Wako Chemical Inc., Miyazaki, Japan | 051-07615 | |
| Anti-collagen type I rabbit polyclonal antibody (H+L) | Proteintech | 14695-1-AP | using dilution 1:100 |
| Anti-Connexin-43 rabbit polyclonal antibody (H+L) | Sigma Aldrich | C6219 | using dilution 1:100 |
| Anti-rabbit IgG (H+L) donley polyclonal antibody-AlexaFluo488 | Thermo Scientific | A21206 | using dilution 1:300 |
| blocking solution (Blocking One) | Nacalai Tesque, Kyoto, Japan | 03953-95 | |
| collagenase | Fuji Film Wako Chemical Inc., Miyazaki, Japan | 034-22363 | |
| confocal laser microscope | Carl Zeiss Inc., Oberkochen, Germany | LSM510 META | |
| DNase I | Sigma-Aldrich | DN25 | |
| FACS Aria III | Becton Dickinson, Franklin Lakes, NJ, USA | ||
| fetal bovine serum | BioWest, FL, USA | S1820-500 | |
| fine movement device (Micromanipulator) | Narishige Co., Ltd., Tokyo, Japan | M-44 | |
| fluorescence microscope | Nikon Instruments, Tokyo, Japan | Eclipse Ti2 | |
| gelatin from bovine skin | Sigma-Aldrich | G9382 | dissolving in PBS (-) to 10%, and autoclaving it |
| Neonatal Sprague-Dawley (SD) rats | Japan SLC Inc., Shizuoka, Japan | 0–2 d after birth | |
| non-adhesive 96-well plates (spheloid plate) | Sumitomo Bakelite, Tokyo, Japan | MS-0096S | |
| Optimal Cutting Temperature (OCT) Compound | Sakura Finetek USA, Inc., CA, USA | Tissue-Tek OCT compound | |
| peristaltic pump (for cooling system) | As One Co., Osaka, Japan | SMP-23AS | |
| PKH26 | Sigma-Aldrich | PKH26GL | |
| Stir Bar, Micro, Magnetic, PTFE, Length x Dia. in mm: 5 x 2 | Chemglass life sciences LLC, NJ, USA | CG-2003-120 | |
| syringe | Ito Corporation, Tokyo, Japan | MS-N25 | |
| syringe pump with remote controller | As One Co., Osaka, Japan | MR-1, CT-10 | |
| tetramethylrhodamine methyl ester | Thermo Fisher Scientific, Waltham, MA, USA | T668 | |
| trypsin | DIFCO, Becton Dickinson, Franklin Lakes, NJ, USA | 215240 | |
| Tween-20 | Fuji Film Wako Chemical Inc., Miyazaki, Japan | 167-11515 | |
| veterinarian ointment | Fujita Pharmaceutical Co., Ltd. | Hibikusu ointment #WAK-95832 | |
| Vevo 2100 Imaging System | Fujifilm VisualSonics, Inc., Toronto, Canada | Vevo 2100 | |
| Vevo 2100 Imaging System software version 1.0.0 | Fujifilm VisualSonics, Inc., Toronto, Canada | Vevo 2100 | |
| Weakly curved needle with ophthalmic thread | Natsume Seisakusho Co., Ltd., Tokyo, Japan | C7-70 |
Referanslar
- Chavkin, N. W., et al. The cell surface receptors Ror1/2 control cardiac myofibroblast differentiation. Journal of the American Heart Association. 10 (13), e019904 (2021).
- Li, H., et al. The cell membrane repair protein MG53 modulates transcription factor NF-κB signaling to control kidney fibrosis. Kidney International. 101 (1), 119-130 (2022).
- Liu, X., Liu, Y., Khodeiry, M. M., Lee, R. K. The role of monocytes in optic nerve injury. Neural Regeneration Research. 18 (8), 1666-1671 (2023).
- Weber, F., Treeck, O., Mester, P., Buechler, C. Expression and function of BMP and activin membrane-bound inhibitor (BAMBI) in chronic liver diseases and hepatocellular carcinoma. International Journal of Molecular Sciences. 24 (4), 3473 (2023).
- Tohyama, S., et al. Distinct metabolic flow enables large-scale purification of mouse and human pluripotent stem cell-derived cardiomyocytes. Cell Stem Cell. 12 (1), 127-137 (2013).
- Hattori, F., Fukuda, K. Strategies for replacing myocytes with induced pluripotent stem in clinical protocols. Transplantation Reviews. 26 (3), 223-232 (2012).
- Hattori, F., et al. Nongenetic method for purifying stem cell-derived cardiomyocytes. Nature Methods. 7 (1), 61-66 (2010).
- Fernandes, S., et al. Human embryonic stem cell-derived cardiomyocytes engraft but do not alter cardiac remodeling after chronic infarction in rats. Journal of Molecular and Cellular Cardiology. 49 (6), 941-949 (2010).
- Shiba, Y., et al. Allogeneic transplantation of iPS cell-derived cardiomyocytes regenerates primate hearts. Nature. 538 (7625), 388-391 (2016).
- Wendel, J. S., et al. Functional effects of a tissue-engineered cardiac patch from human induced pluripotent stem cell-derived cardiomyocytes in a rat infarct model. Stem Cells Translational Medicine. 4 (11), 1324-1332 (2015).
- Hattori, F. Technology Platforms for Heart Regenerative Therapy Using Pluripotent Stem Cells. Stem Cells and Cancer Stem Cells, Volume 7: Therapeutic Applications in Disease and Injury. , 33-45 (2012).
- Tao, S., et al. Ablation lesion characterization in scarred substrate assessed using cardiac magnetic resonance. JACC: Clinical Electrophysiology. 5 (1), 91-100 (2019).
- Rutkowski, J. M., Swartz, M. A. A driving force for change: interstitial flow as a morphoregulator. Trends in Cell Biology. 17 (1), 44-50 (2007).
- Hattori, F., Fukuda, K., Yuasa, S. How to purify cardiomyocytes for research and therapeutic purposes. Cardiac Regeneration using Stem Cells. , (2013).
- Li, M., Tian, X., Zhu, N., Schreyer, D. J., Chen, X. Modeling process-induced cell damage in the biodispensing process. Tissue Engineering. Part C, Methods. 16 (3), 533-542 (2010).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiDaha Fazla Makale Keşfet
This article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır