Method Article
Un nuovo metodo di iniezione cellulare con un'invasione minima
In questo articolo
Riepilogo
Questo metodo elimina qualsiasi invasione importante durante le iniezioni cellulari causata dalla soluzione di sospensione cellulare.
Abstract
L'iniezione diretta di cellule nei tessuti è un processo necessario nella somministrazione cellulare e/o nella terapia sostitutiva. L'iniezione cellulare richiede una quantità sufficiente di soluzione in sospensione per consentire alle cellule di entrare nel tessuto. Il volume della soluzione in sospensione influisce sul tessuto e questo può causare gravi lesioni invasive a seguito dell'iniezione cellulare. Questo documento riporta un nuovo metodo di iniezione cellulare, chiamato iniezione lenta, che mira a evitare questa lesione. Tuttavia, l'espulsione delle cellule dalla punta dell'ago richiede una velocità di iniezione sufficientemente elevata secondo la legge di Newton della forza di taglio. Per risolvere la contraddizione di cui sopra, in questo lavoro è stato utilizzato un fluido non newtoniano, come la soluzione di gelatina, come soluzione di sospensione cellulare. Le gelatine hanno sensibilità alla temperatura, poiché la loro forma cambia da gel a sol a circa 20 °C. Pertanto, per mantenere la soluzione di sospensione cellulare sotto forma di gel, la siringa è stata mantenuta raffreddata in questo protocollo; Tuttavia, una volta che la soluzione è stata iniettata nel corpo, la temperatura corporea l'ha convertita in un sol. Il flusso di fluido tissutale interstiziale può assorbire la soluzione in eccesso. In questo lavoro, la tecnica dell'iniezione lenta ha permesso alle sfere di cardiomiociti di entrare nel miocardio ospite e di attecchire senza fibrosi circostante. Questo studio ha impiegato un metodo di iniezione lenta per iniettare cardiomiociti di ratto neonatale purificati e formati a sfera in un'area remota di infarto miocardico nel cuore di ratto adulto. A 2 mesi dall'iniezione, i cuori dei gruppi trapiantati hanno mostrato un miglioramento significativo della funzione contrattile. Inoltre, le analisi istologiche dei cuori a iniezione lenta hanno rivelato connessioni senza soluzione di continuità tra l'ospite e i cardiomiociti dell'innesto tramite dischi intercalati contenenti connessioni di giunzione gap. Questo metodo potrebbe contribuire alle terapie cellulari di prossima generazione, in particolare nella medicina rigenerativa cardiaca.
Introduzione
La somministrazione e la sostituzione delle cellule sono nuove strategie terapeutiche promettenti per gli organi gravemente danneggiati. Tra queste nuove strategie terapeutiche, la medicina rigenerativa cardiaca ha attirato una notevole attenzione. Tuttavia, l'infiammazione causata dalle lesioni media la formazione di cicatrici in diversi organi 1,2,3,4. Il cuore umano è costituito da circa 10,10 cardiomiociti; Pertanto, teoricamente5,6, deve essere trattato con più di 109 cardiomiociti. La somministrazione di un gran numero di cardiomiociti tramite metodi di iniezione tradizionali può portare a lesioni tissutali significative7. Questo metodo fornisce un nuovo metodo di iniezione cellulare con un'invasione di tessuto minima.
La somministrazione di cellule nel parenchima dell'organo richiede iniezioni. Tuttavia, esiste una discrepanza in quanto l'iniezione stessa può portare a lesioni tissutali. La lesione tissutale provoca infiammazione locale e cicatrici incurabili negli organi e nei tessuti, nonché una compromissione della capacità rigenerativa 8,9,10. Il cuore dei mammiferi ha una propensione estremamente elevata a sviluppare cicatrici invece di rigenerarsi perché richiede una riparazione immediata delle lesioni per sopportare l'ipertensione causata dalla sua funzione di pompaggio continuo11. La terapia di ablazione utilizza questa elevata propensione alla formazione di cicatrici e blocca il circuito che potrebbe subire la formazione di cicatrici utilizzando l'aritmia12. In uno studio precedente, è stato osservato che il tessuto cicatriziale isolava i cardiomiociti iniettati nel miocardio dell'ospite. Pertanto, questo rappresenta il prossimo problema target che deve essere superato per ottenere una migliore efficacia terapeutica nella medicina rigenerativa cardiaca.
Il flusso del fluido interstiziale tissutale svolge un ruolo fondamentale nel trasporto di ossigeno e sostanze nutritive alle cellule e nella rimozione dei rifiuti escreti dalle cellule. La velocità fisiologica del flusso di liquido interstiziale in ciascun tessuto/organo è diversa (l'intervallo è 0,01-10 μm/s)13. Per quanto a conoscenza dell'autore, non ci sono dati riguardanti la capacità dei singoli tessuti/organi di supportare quantità extra di liquidi senza edema patologico; Tuttavia, questo esperimento tenta di utilizzare una bassa velocità di iniezione per ridurre possibilmente il danno tissutale e i risultati possono essere utilizzati per determinare la praticità di questo concetto.
Protocollo
Gli esperimenti sugli animali sono stati condotti secondo le linee guida etiche della Kansai-Medical University per gli esperimenti sugli animali e sono stati approvati dai comitati etici (numero di approvazione: 23-104). Tutti gli animali sono stati allevati in un ciclo costante luce-buio in uno specifico ambiente privo di agenti patogeni. Tutti gli strumenti chirurgici sterilizzati, come forbici, pinze e divaricatori, sono stati sterilizzati in autoclave e asciugati accuratamente.
1. Preparazione delle palline di cardiomiociti neonatali di ratto
- Collezione di cuori di ratto neonatale
- Per il prelievo del cuore, seguire una procedura simile a quella descritta in un precedente rapporto7.
- Immergere i ratti neonatali (0-2 giorni dopo la nascita) Sprague-Dawley (SD) in soluzioni di iodio povidone ed etanolo al 70% in sequenza, quindi trasferirli in una custodia ermetica riempita con isoflurano vaporizzato (la concentrazione deve essere superiore al 10% v/v) per un'anestesia profonda.
- Dopo la conferma dell'incoscienza da parte di una perdita di attività locomotoria, decapitare il ratto mentre tiene il corpo dalla schiena con la mano, quindi tagliare 2-4 mm di tessuto dal centro frontale della gabbia toracica alla caudale e poi in direzione rostrale usando forbici affilate.
- Afferra la pelle posteriore per aprire il taglio e spingere fuori il cuore dalla gabbia toracica. Tagliare i ventricoli con le forbici e immergerli in soluzione salina tamponata con fosfato (PBS) senza calcio o magnesio (PBS(−)).
- Dispersione dei cardiomiociti neonatali di ratto
- Tritare i ventricoli raccolti dispersi in una quantità minima di tampone Ads (tampone ADS: 116 mM NaCl, 20 mM HEPES, 12,5 mM NaH2PO 4, 5,6 mM glucosio, 5,4 mM KCl, 0,8 mM MgSO4, pH 7,35) in una vetreria concava autoclavata in piccoli pezzi (1 mm x 1 mm) utilizzando forbici curve.
- Trasferire i tessuti tritati e un agitatore micromagnetico in una provetta di centrifugazione da 50 mL e disperdere i tessuti in singole cellule con collagenasi allo 0,1%, tripsina allo 0,1%, DNasi I da 20 μg/mL e estere metilico di tetrametilrodamina da 50 nM in tampone Ads a 37 °C agitando per 30 minuti.
- Separare gli aggregati e le cellule disperse attraverso la sedimentazione naturale, raccogliere solo le cellule disperse in una provetta e digerire nuovamente gli aggregati cellulari residui con lo stesso mezzo di digestione.
- Continuare questa procedura fino a quando tutte le cellule non sono completamente dissociate. Per confermare la completa dispersione delle cellule, osservare i tubi al microscopio (lente dell'obiettivo 4x).
- Raccogliere le cellule disperse mediante centrifugazione a 150 x g per 5 minuti e dissociarle in 1-2 mL di tampone Ads.
- Selezione cellulare dei cardiomiociti attivata dalla fluorescenza
- Analizza le cellule utilizzando il cell sorting attivato dalla fluorescenza (FACS) utilizzando filtri passa-banda 556-601 nm per rilevare i segnali di fluorescenza rossa.
- Eseguire con attenzione il pre-gating per eliminare le frazioni di doppietto14. Le impostazioni del cancello per l'eliminazione del doppietto devono essere conformi alle istruzioni del produttore.
- Impostare la dispersione diretta sull'asse x e il segnale di fluorescenza rossa sull'asse y. Sono state osservate tre popolazioni: una popolazione più bassa contenente eritrociti e cellule morte, una popolazione intermedia contenente non cardiomiociti, inclusi fibroblasti e cellule endoteliali, e una popolazione superiore contenente cardiomiociti ventricolari puri7.
- Preparazione di sfere cardiomiocitarie marcate con fluorescenza rossa
- Ordinare selettivamente i cardiomiociti e centrifugare per 5 minuti a 150 x g. Sciogliere completamente i pellet cellulari in 1 mL di terreno minimo essenziale alfa-modificato (alfa-MEM) contenente il 10% di siero fetale bovino (FBS) inattivato dal calore.
- Misurare la concentrazione cellulare utilizzando un emocitometro e diluire la soluzione di sospensione cellulare a 3.000 cellule/mL con FBS alfa-MEM al 10%.
- Distribuirli in piastre cellulari non adesive a 96 pozzetti (100 μL per pozzetto), centrifugare per 5 minuti a 100 x g e coltura per 2-3 giorni in un incubatore per colture cellulari con il 5% di CO2 a 37 °C.
- Prima degli esperimenti di iniezione, prelevare una sfera di cardiomiociti da ciascun pozzetto tramite aspirazione con il terreno di coltura utilizzando una pipetta da 1.000 μL e raccoglierli in una provetta da 15 mL.
- Colorare con PKH26 seguendo le istruzioni del produttore per l'inseguimento dopo l'attecchimento.
2. Preparativi per il metodo dell'iniezione lenta
- Preparazione della soluzione madre di gelatina
- Pesare la gelatina, scioglierla nel tampone Ads per produrre una soluzione al 10% p/v e sterilizzarla in autoclave.
- Produzione di un dispositivo per l'iniezione di cellule
- Progettazione generale del dispositivo: Preparare l'apparecchio mostrato nella Figura 1. Questo sistema è combinato con un apparato di raffreddamento a siringa e un apparato di iniezione principale.
- Preparare l'apparecchiatura di iniezione principale descritta di seguito:
- Per un'iniezione di palline cardiomiocitarie neonatali, utilizzare un ago da 29 G, lungo 50 mm, dotato di siringa.
- Collegare una siringa a trasferimento di potenza (18G, 1 mL) schiena contro schiena utilizzando una siringa per iniezione cellulare (Figura 1). Collegare l'ago della siringa di trasferimento di potenza a un sottile tubo di polipropilene con bassa espandibilità del lume.
- Quindi, collegare l'altro lato del tubo di trasferimento dell'alimentazione all'ago della stessa siringa (18G, 1 mL) e inserirlo in una pompa a siringa. Riempire le due siringhe e i tubi di trasferimento di potenza con acqua senza bolle d'aria.
NOTA: Quando uno stantuffo della siringa di trasferimento di potenza viene inserito, la pressione viene trasferita direttamente all'altra siringa e lo stantuffo sporge.
- Configurare il sistema di raffreddamento della siringa di iniezione come descritto di seguito.
- Avvolgere saldamente un tubo di rame (diametro esterno = 1 mm; diametro interno = 0,3 mm; spessore = 0,35 mm) attorno alla parte contenente la cellula della siringa per iniezione cellulare, lasciando 10 mm di tubo in eccesso ad entrambe le estremità.
- Collegare il tubo di rame al tubo di plastica flessibile. Inoltre, collegare le altre estremità del tubo di plastica a una pompa esterna, riempire la linea con acqua di raffreddamento e raffreddare l'acqua immergendo il tubo di rame in eccesso nel ghiaccio tritato (Figura 1).
NOTA: Questo sistema di raffreddamento mantiene la soluzione di sospensione delle celle nel cilindro a circa 2 °C.
3. Sviluppo di un modello di infarto miocardico di ratto mediante occlusione coronaria ottusa
- Anestetizzare ratti nudi maschi immunodeficienti (F344/Njcl-rnu/rnu) con aria contenente il 3% di isoflurano. Inserire una cannula nella trachea e collegarla al respiratore.
- Collegare una cannula a un vaporizzatore di isoflurano con un controller per mantenere una concentrazione di isoflurano del 3% e, quindi, sostenere un'anestesia sufficiente. Confermare l'assenza di risposta agli stimoli dolorosi. Applicare un unguento veterinario sugli occhi per prevenire la secchezza.
- Fissare gli arti con nastri chirurgici tagliati su una placca chirurgica riscaldata a 40 °C. Ruota il corpo del ratto a destra dell'asse del corpo e usa l'ascella sinistra come campo chirurgico.
- Rimuovere i peli nel campo chirurgico utilizzando una crema depilatoria e pulire la pelle con iodio povidone. Usando delle forbici affilate, taglia un'incisione di 1,5 cm nella pelle e nel muscolo grande pettorale.
- Confermare il terzo spazio intercostale e strappare i muscoli intercostali e la pleura costale utilizzando micro pinze con punte smussate. Tenere il torace aperto utilizzando un divaricatore. Rimuovere delicatamente il pericardio sottile con una pinza.
- Per costruire un modello di infarto della parete laterale del cuore, trovare la posizione caudale di 1 mm rispetto alla punta dell'atrio sinistro per identificare l'arteria coronaria ottusa, passare una sutura di seta 7-0, raccogliere il tessuto largo 2,5 mm e profondo 2,5 mm dalla dorsale alla ventrale e legare saldamente il tessuto.
- Confermare l'avvenuta legatura dalla debole contrazione distale dalla legatura. Dopo aver rimosso delicatamente il divaricatore, posizionare una sutura di seta 5-0 tra il secondo e il quarto spazio intercostale e chiudere la toracotomia.
- Diminuire la concentrazione di isoflurano all'1%. Suturare delicatamente il muscolo e la pelle con seta 5-0. Ridurre la concentrazione di isoflurano allo 0% e attendere circa 5 minuti fino all'inizio della respirazione spontanea.
- Applicare localmente 2 mg/mL di lidocaina in soluzione fisiologica sull'incisione. Somministrare 1 mL di soluzione fisiologica tramite iniezione sottocutanea. Applicare l'unguento veterinario per via topica per prevenire le infezioni.
- Rimuovere il ratto dal tubo di intubazione e tornare nella gabbia dell'animale; Quindi, alleva i ratti in gabbie individuali per 1 settimana.
- Analizzare i cambiamenti nella funzione della pompa sistolica cardiaca utilizzando l'ecocardiografia.
NOTA: La funzione cardiaca sarà ridotta a causa dell'infarto miocardico laterale.
4. Trapianto di cellule percutanee ecoguidate con il metodo dell'iniezione lenta
- Preriscaldare il brodo di gelatina al 10% a 37 °C fino a quando non diventa liquido.
- Diluire il brodo di gelatina al 10% con un tampone Ads preriscaldato per ottenere la soluzione finale iniettabile di gelatina al 5% p/v (sono necessari 100 μL per animale).
- Sospendere 96 sfere di cardiomiociti (totale: 28.800 cardiomiociti/animale) in 100 μL di soluzione iniettabile preriscaldata.
- Caricare la sospensione preparata al punto 4.3 nella siringa per iniezione cellulare, evitando l'aspirazione dell'aria in eccesso.
- Per eliminare le bolle nella siringa, tenerla verticalmente con l'ago rivolto verso l'alto, picchiettare la siringa e raccogliere eventuali bolle sulla cresta superiore della siringa.
NOTA: Durante questa fase, osservare le sfere di cardiomiociti che si depositano gradualmente sulla guarnizione in gomma dello stantuffo. - Mantenere la posizione verticale della siringa, spingere lentamente verso l'alto lo stantuffo ed eliminare le bolle e la soluzione di sospensione cellulare in eccesso fino a quando 20 μL della sospensione cellulare rimangono nella siringa. Spingere con cautela lo stantuffo a velocità costante in modo che la sfera cardiomiocitaria rimanga appoggiata sulla guarnizione in gomma dello stantuffo.
- Immergere la siringa con tappo direttamente in un bagno di ghiaccio per 5 minuti.
- Inserire una siringa raffreddata nell'apparecchio per l'iniezione. Fissare saldamente l'apparato della siringa per iniezione depositato su un dispositivo di movimento fine sullo stadio animale utilizzando un morsetto fatto a mano regolabile in posizione X-Y-Z. Il dispositivo di movimento fine può spostare la posizione dell'ago utilizzando il cursore da 20 mm in direzione x, l'oscillazione in direzione y e i movimenti di inchino in direzione z.
- Anestetizzare i ratti in una scatola sigillata riempita con aria contenente il 3% di isoflurano. Confermare l'anestesia senza rispondere agli stimoli dolorosi. Applicare un unguento veterinario sugli occhi per prevenire la secchezza.
- Fissare gli arti con nastri chirurgici tagliati su una piastra ecografica riscaldata a 40 °C. Per sostenere un'anestesia sufficiente, assicurarsi che l'aria inalata contenga una concentrazione di circa il 3% di isoflurano.
- Rimuovere i peli sul campo di iniezione (2 cm di diametro) e sul petto con una crema depilatoria e pulire la pelle con iodio povidone.
- Applicare l'eco-gel sul petto e sulla sonda eco. Posizionare la sonda ecografica vicino al torace lungo gli assi craniale e caudale e iniziare a ottenere l'ecocardiografia B-mode seguendo il manuale del produttore.
- Far avanzare la punta dell'ago per iniezione nel miocardio nella vista frontale (Figura 2 e video supplementare 1).
- Per attivare la pompa a siringa principale, premere il pulsante Start e ruotare la manopola per regolare un numero predeterminato per una velocità di iniezione di circa 0,02 μL/s. Applicare l'unguento veterinario localmente intorno alla posizione di agugliatura per prevenire le infezioni.
NOTA: È necessario determinare il numero di selezione appropriato per la velocità di iniezione prevista utilizzando una soluzione di iniezione. Dopo l'iniezione, rimuovere l'ago per iniezione utilizzando un sistema di movimento esemplare. - Ridurre la concentrazione di isoflurano allo 0% e attendere circa 5 minuti fino a quando l'animale riacquista una coscienza sufficiente per mantenere il decubito sternale.
5. Valutazione della funzione cardiaca
- Anestetizzare i ratti in una scatola sigillata riempita con aria contenente il 3% di isoflurano. Confermare l'anestesia senza rispondere agli stimoli dolorosi. Applicare un unguento veterinario sugli occhi per prevenire la secchezza.
- Applicare una crema elettrizzante per l'acquisizione dell'ECG sulle punte degli arti. Fissare gli arti con nastri chirurgici tagliati su una piastra ecografica riscaldata a 40 °C. Utilizza un sistema di monitoraggio fisiologico per rilevare l'ECG e la frequenza cardiaca in tempo reale.
- Secondo le istruzioni del produttore, determinare prima l'angolo dell'asse lungo utilizzando l'immagine dell'eco in modalità B che mostra l'apice ventricolare sinistro al tratto di deflusso, quindi ruotare l'ecosonda di 90° per passare alla vista dell'asse corto.
- Utilizzando solo il sistema di movimento fine dell'asse caudale e rostrale dello stadio animale, regolare la vista dell'asse corto a livello del muscolo papillare. Quindi, modificare la modalità immagine in modalità M premendo il pulsante della modalità M e registrare un video per 5 secondi premendo il pulsante Cine-loop .
- Per analizzare e calcolare l'accorciamento della frazione utilizzando il software, premere il pulsante Misura e uno strumento di linea verticale per definire le dimensioni interne del ventricolo sinistro end-sistolico e telediastolico. Il software calcola automaticamente l'accorciamento della frazione percentuale (FS).
- Ridurre la concentrazione di isoflurano allo 0% e attendere circa 5 minuti fino a quando l'animale riacquista una coscienza sufficiente per mantenere il decubito sternale.
6. Immunoistochimica
- Fissare il corpo sottoposto a eutanasia (eseguire l'eutanasia come al punto 1.1.3) sul tavolo utilizzando i nastri chirurgici tagliati, asportare i cuori, lavare con PBS e immergere il cuore in paraformaldeide/PBS al 4%.
- Sezionare i cuori in tre sezioni, immergerli in saccarosio al 40% per la crioprotezione, incorporarli in un composto a temperatura di taglio ottimale (OCT) e congelarli a -80 °C.
- Fissare i tessuti criosezionati (8 μm di spessore) a vetrini rivestiti di aminosilano. Dopo un'asciugatura sufficiente utilizzando il vento non riscaldato generato da un asciugacapelli generico, immergere i vetrini in soluzione salina tamponata tris contenente lo 0,2% di Tween-20 (TBS-T).
- Immergerli in una soluzione bloccante per 30 minuti a 25 °C. Versare 100 μL della soluzione bloccante contenente anticorpi primari sul vetrino e incubare per una notte a 4 °C con sigillante di paraffina per mantenere la soluzione anticorpale distribuita sul tessuto.
NOTA: La concentrazione di anticorpi è indicata nella tabella dei materiali. - Appoggia i vetrini orizzontalmente in una scatola ad alta umidità fatta a mano utilizzando il vapore naturale della carta bagnata per evitare l'evaporazione. Lavare i vetrini tre volte con TBS-T.
- Trattare con l'agente bloccante contenente anticorpi secondari per 1 ora a 25 °C allo stesso modo dell'anticorpo primario. Dopo tre lavaggi, osservare i segnali di fluorescenza utilizzando un microscopio a fluorescenza e un microscopio laser confocale.
NOTA: La concentrazione di anticorpi è indicata nella tabella dei materiali. - Analisi statistica: per il confronto del volume cellulare, come mostrato nella Figura 3A, eseguire un test t non accoppiato; per valutare il recupero funzionale cardiaco dopo la somministrazione di cardiomiociti con il metodo dell'iniezione lenta, come mostrato nella Figura 4A, utilizzare un test t accoppiato. In questo lavoro, le differenze sono state considerate statisticamente significative a P < 0,01. Le barre di errore rappresentano la deviazione standard.
Risultati
Effetti dell'iniezione lenta sulla sopravvivenza cellulare e sulla deposizione di collagene
Le palline di cardiomiociti neonatali di ratto marcate con PKH26 sono state iniettate nel miocardio di ratto nudo normale utilizzando un metodo di iniezione normale o lento. I risultati hanno mostrato che il metodo di iniezione lenta ha aumentato significativamente il volume delle cellule trapiantate (Figura 3A) e ha diminuito significativamente la deposizione di collagene di tipo I in loco (Figura 3B).
Effetti dell'iniezione lenta sull'efficacia del trattamento in un modello di infarto di ratto
Il metodo di iniezione lenta guidato dall'ecocardiografo è stato utilizzato per iniettare sfere di cardiomiociti di ratto neonatale o PBS(−) nei cuori infartuati di ratti modello. Il gruppo iniettato da solo ha mostrato un miglioramento significativo della funzione di contrazione cardiaca dopo 2 mesi (Figura 4A). Le analisi immunoistochimiche hanno rivelato una connessione senza soluzione di continuità tra le cellule trapiantate e i miociti dell'ospite tramite dischi intercalati contenenti giunzioni gap (Figura 4B).
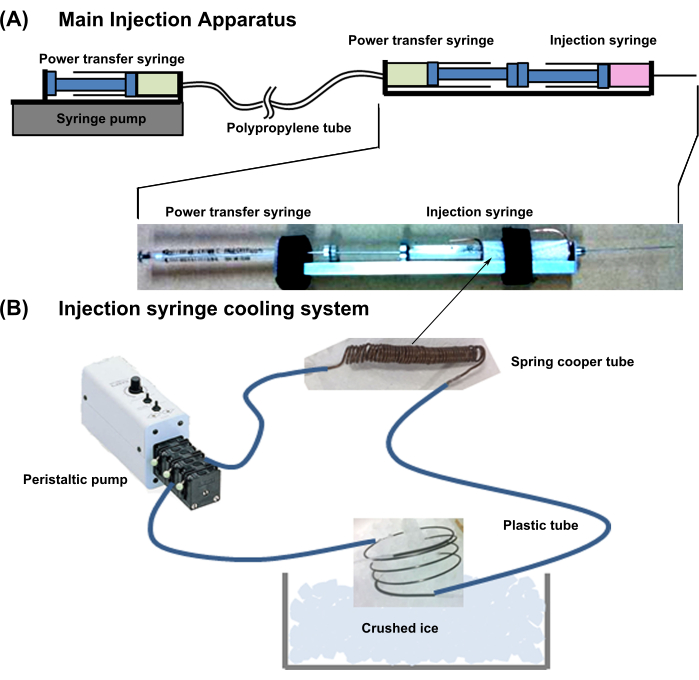
Figura 1: Schema dell'intero sistema di iniezione. (A) Apparecchiatura principale di iniezione. (B) Sistema di raffreddamento della siringa di iniezione. Fare clic qui per visualizzare una versione più grande di questa figura.
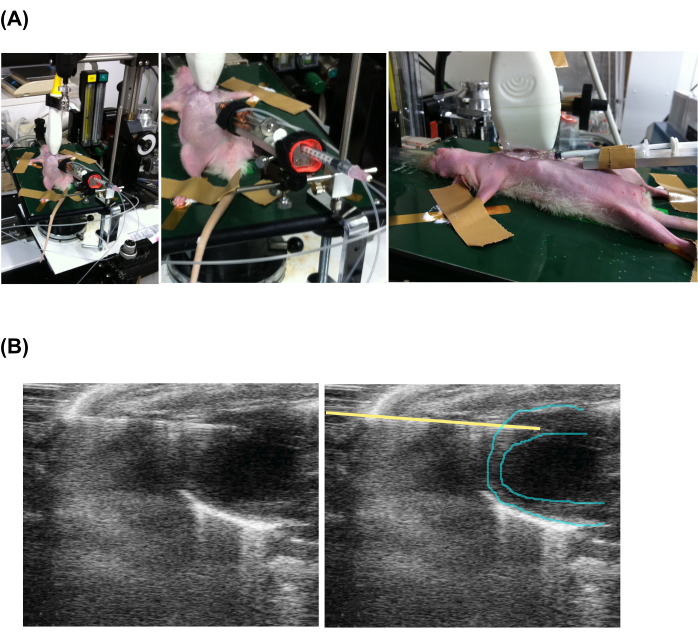
Figura 2: Iniezione percutanea lenta guidata da ecocardiografia . (A) Impostazione dell'animale, della sonda ecografica e dell'apparecchio di iniezione. (B) Vista ecocardiografica della siringa e del cuore che effettuano l'iniezione. Si noti che le immagini a sinistra e a destra sono le stesse, ma è stata aggiunta una linea gialla per indicare la posizione dell'ago. Fare clic qui per visualizzare una versione più grande di questa figura.
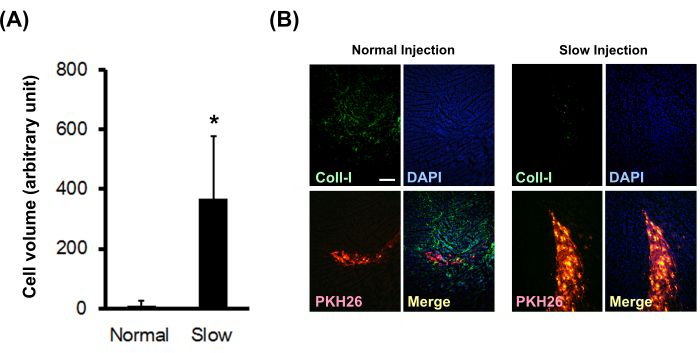
Figura 3: Effetto del metodo di iniezione lenta sul volume delle cellule trapiantate e sulla deposizione di collagene. (A) I volumi delle cellule trapiantate (N = 3) sono stati calcolati a partire da sezioni seriali. Le barre di errore indicano le deviazioni standard. *P < 0,01 in un test t non accoppiato. (B) Colorazione immunoistochimica per il collagene di tipo I. La barra della scala indica 200 μm. Fare clic qui per visualizzare una versione più grande di questa figura.
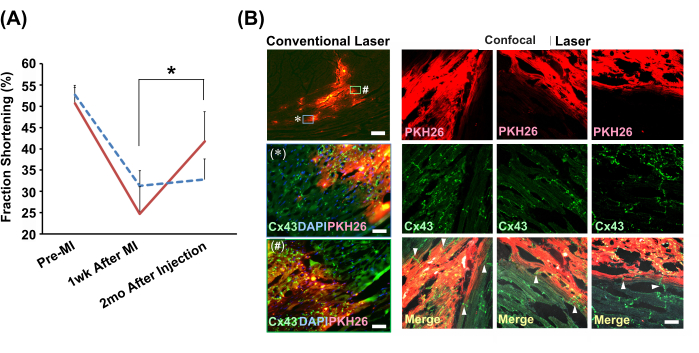
Figura 4: Miglioramenti nella funzione cardiaca e nell'integrazione istologica con sfere cardiomiocitarie innestate con il metodo dell'iniezione lenta . (A) Viste rappresentative dell'ecocardiografo in modalità M. Il grafico mostra la transizione degli accorciamenti delle frazioni nel gruppo trapiantato con palla di cardiomiociti (linea rossa continua; N = 4) e gruppo del veicolo (soluzione di sospensione cellulare per il metodo dell'iniezione lenta) (linea blu tratteggiata; N = 3). Abbreviazioni: MI = infarto del miocardio; Cx43 = connessina 43; DAPI = 4',6-diamidino-2-fenilindolo; PKH26 = etichetta fluorescente rossa della membrana cellulare. Le barre di errore indicano le deviazioni standard. *P < 0,01 in un test t accoppiato. (B) Analisi immunoistochimiche della relazione tra le sfere cardiomiocitarie innestate e i cardiomiociti dell'ospite. Le osservazioni microscopiche laser convenzionali utilizzando un obiettivo 2x sono mostrate nella colonna di sinistra. Di seguito sono presentate le versioni ingrandite (utilizzando un obiettivo 20x) di due aree mostrate nel riquadro, etichettate con * e #. Barre della scala: immagine in alto = 300 μm; * e # = 30 μm. Le immagini microscopiche laser confocali che utilizzano un obiettivo 20x sono mostrate insieme per il confronto. Vengono mostrate tre posizioni. Nelle immagini unite, le punte di freccia indicano l'esistenza di giunzioni gap (Cx43) che collegano direttamente i cardiomiociti dell'innesto e dell'ospite. La barra della scala indica 30 μm. Fare clic qui per visualizzare una versione più grande di questa figura.
Video supplementare 1: Metodo di iniezione lenta ecoguidato. L'ecocardiogramma B-mode nella vista frontale mostra che la punta dell'ago per l'iniezione è avanzata nel miocardio. Fare clic qui per scaricare il file.
Discussione
Uno dei punti critici per il successo del metodo di iniezione lenta è la preparazione di un sistema di iniezione efficace che utilizza una potente pompa a siringa e un robusto tubo di trasferimento della pressione. È necessario un sistema ad alta pressione per spingere il gel fuori dalla punta di un ago sottile. Il secondo punto critico è la stabilizzazione del cuore. Il battito del cuore contro un ago per iniezione avanzato nel miocardio può danneggiare il tessuto. In questo studio, è stata condotta un'iniezione ecoguidata per evitare che gli animali subissero una seconda lesione toracica aperta e per somministrare l'iniezione di cellule in un cuore stabilizzato con i polmoni gonfiati. Inoltre, in alcune applicazioni per animali di grandi dimensioni o per l'uomo, alcuni dispositivi di iniezione attaccati al cuore dovrebbero essere considerati come parte della progettazione strategica dell'applicazione. Per le iniezioni a torace aperto nel cuore di piccoli animali, si raccomanda l'uso di un ago lungo e flessibile data la loro frequenza cardiaca più elevata.
In questo lavoro, il metodo di iniezione lenta ha aumentato significativamente il volume dei cardiomiociti sopravvissuti rispetto al normale metodo di iniezione. L'iniezione normale provoca danni cellulari attraverso lo sforzo di taglio15. Al contrario, il metodo dell'iniezione lenta non causa teoricamente tale stress perché utilizza una soluzione non newtoniana in aggiunta all'iniezione lenta.
In termini di fibrosi locale, lo spazio interstiziale intorno ai cardiomiociti sopravvissuti normalmente iniettati ha mostrato una forte e diffusa deposizione di collagene di tipo I. Al contrario, i segnali di collagene di tipo I intorno ai cardiomiociti innestati con il metodo dell'iniezione lenta erano molto più deboli e più limitati. Ciò suggerisce che il metodo di iniezione lenta ha causato danni significativamente inferiori. L'iniezione lenta di cardiomiociti neonatali nel miocardio adulto ha migliorato significativamente la funzione contrattile del cuore infartuato. Le analisi istologiche hanno suggerito che l'innesto dei cardiomiociti con il metodo dell'iniezione lenta ha portato a connessioni dirette e accoppiamento funzionale con i cardiomiociti ospiti. Questo fenomeno spiega il meccanismo di recupero funzionale del miocardio ospite. Per quanto ne sappiamo, questa è la prima segnalazione di cardiomiociti neonatali trapiantati con connessioni senza soluzione di continuità su larga scala ai cardiomiociti adulti ospiti. Le connessioni funzionali con il miocardio ospite tramite accoppiamento elettrico e meccanico possono far maturare i cardiomiociti innestati e consentire loro di agire come miociti funzionali che contribuiscono alla funzione cardiaca dell'ospite. Le interazioni di forza fisica a lungo termine tra l'ospite e i cardiomiociti del trapianto sono cruciali per la piena maturazione. Pertanto, potrebbero essere necessari 2 mesi dopo l'iniezione per il recupero funzionale del cuore infartuato. Il recupero dipendente dal tempo della funzione cardiaca del paziente può essere un fenomeno atteso nelle applicazioni terapeutiche, e questo può essere un segno distintivo del successo dell'accoppiamento funzionale de novo e dell'integrazione tra l'ospite e i cardiomiociti trapiantati.
Il metodo di iniezione lenta può essere eseguito durante la chirurgia a torace aperto. Inoltre, questo metodo può essere applicato ai topi. Per le future applicazioni nella terapia umana, dobbiamo ancora risolvere diversi problemi. La velocità di iniezione deve essere ottimizzata considerando la capacità tampone del flusso di fluido interstiziale in ciascun organo bersaglio umano. Dovrebbero essere applicati materiali privi di xeno, come la gelatina umana o materiali sintetici biodegradabili. Dovrebbero essere sviluppati apparecchi clinici per iniezione lenta di grado GMP, come strumenti monouso compatti specifici per organo o apparecchi riutilizzabili applicabili a grandi organi.
Divulgazioni
L'autore non ha nulla da rivelare.
Riconoscimenti
Questo studio è stato sostenuto da una sovvenzione di JSPS KAKENHI (Grant No. 23390072 e 19K07335) e AMED (Grant No. A-149).
Materiali
| Name | Company | Catalog Number | Comments |
| 18-gauge needle & tuberculin, 1 mL | Terumo | NN1838R, SS-01T | |
| 29-gauge 50 mm-long needle | Ito Corporation, Tokyo, Japan | 14903 Type-A | |
| A copper tube | General Suppliers | outer diameter, 1 mm; inner diameter, 0.3 mm; thickness, 0.35 mm | |
| Ads Buffer | Each ingredient was purchased from Fuji Film Wako Chemical Inc., Miyazaki, Japan | Hand made, Composition: 116 mM NaCl, 20 mM HEPES, 12.5 mM NaH2PO4, 5.6 mM glucose, 5.4 mM KCl, 0.8 mM MgSO4, pH 7.35 | |
| alpha-MEM | Fuji Film Wako Chemical Inc., Miyazaki, Japan | 051-07615 | |
| Anti-collagen type I rabbit polyclonal antibody (H+L) | Proteintech | 14695-1-AP | using dilution 1:100 |
| Anti-Connexin-43 rabbit polyclonal antibody (H+L) | Sigma Aldrich | C6219 | using dilution 1:100 |
| Anti-rabbit IgG (H+L) donley polyclonal antibody-AlexaFluo488 | Thermo Scientific | A21206 | using dilution 1:300 |
| blocking solution (Blocking One) | Nacalai Tesque, Kyoto, Japan | 03953-95 | |
| collagenase | Fuji Film Wako Chemical Inc., Miyazaki, Japan | 034-22363 | |
| confocal laser microscope | Carl Zeiss Inc., Oberkochen, Germany | LSM510 META | |
| DNase I | Sigma-Aldrich | DN25 | |
| FACS Aria III | Becton Dickinson, Franklin Lakes, NJ, USA | ||
| fetal bovine serum | BioWest, FL, USA | S1820-500 | |
| fine movement device (Micromanipulator) | Narishige Co., Ltd., Tokyo, Japan | M-44 | |
| fluorescence microscope | Nikon Instruments, Tokyo, Japan | Eclipse Ti2 | |
| gelatin from bovine skin | Sigma-Aldrich | G9382 | dissolving in PBS (-) to 10%, and autoclaving it |
| Neonatal Sprague-Dawley (SD) rats | Japan SLC Inc., Shizuoka, Japan | 0–2 d after birth | |
| non-adhesive 96-well plates (spheloid plate) | Sumitomo Bakelite, Tokyo, Japan | MS-0096S | |
| Optimal Cutting Temperature (OCT) Compound | Sakura Finetek USA, Inc., CA, USA | Tissue-Tek OCT compound | |
| peristaltic pump (for cooling system) | As One Co., Osaka, Japan | SMP-23AS | |
| PKH26 | Sigma-Aldrich | PKH26GL | |
| Stir Bar, Micro, Magnetic, PTFE, Length x Dia. in mm: 5 x 2 | Chemglass life sciences LLC, NJ, USA | CG-2003-120 | |
| syringe | Ito Corporation, Tokyo, Japan | MS-N25 | |
| syringe pump with remote controller | As One Co., Osaka, Japan | MR-1, CT-10 | |
| tetramethylrhodamine methyl ester | Thermo Fisher Scientific, Waltham, MA, USA | T668 | |
| trypsin | DIFCO, Becton Dickinson, Franklin Lakes, NJ, USA | 215240 | |
| Tween-20 | Fuji Film Wako Chemical Inc., Miyazaki, Japan | 167-11515 | |
| veterinarian ointment | Fujita Pharmaceutical Co., Ltd. | Hibikusu ointment #WAK-95832 | |
| Vevo 2100 Imaging System | Fujifilm VisualSonics, Inc., Toronto, Canada | Vevo 2100 | |
| Vevo 2100 Imaging System software version 1.0.0 | Fujifilm VisualSonics, Inc., Toronto, Canada | Vevo 2100 | |
| Weakly curved needle with ophthalmic thread | Natsume Seisakusho Co., Ltd., Tokyo, Japan | C7-70 |
Riferimenti
- Chavkin, N. W., et al. The cell surface receptors Ror1/2 control cardiac myofibroblast differentiation. Journal of the American Heart Association. 10 (13), e019904 (2021).
- Li, H., et al. The cell membrane repair protein MG53 modulates transcription factor NF-κB signaling to control kidney fibrosis. Kidney International. 101 (1), 119-130 (2022).
- Liu, X., Liu, Y., Khodeiry, M. M., Lee, R. K. The role of monocytes in optic nerve injury. Neural Regeneration Research. 18 (8), 1666-1671 (2023).
- Weber, F., Treeck, O., Mester, P., Buechler, C. Expression and function of BMP and activin membrane-bound inhibitor (BAMBI) in chronic liver diseases and hepatocellular carcinoma. International Journal of Molecular Sciences. 24 (4), 3473 (2023).
- Tohyama, S., et al. Distinct metabolic flow enables large-scale purification of mouse and human pluripotent stem cell-derived cardiomyocytes. Cell Stem Cell. 12 (1), 127-137 (2013).
- Hattori, F., Fukuda, K. Strategies for replacing myocytes with induced pluripotent stem in clinical protocols. Transplantation Reviews. 26 (3), 223-232 (2012).
- Hattori, F., et al. Nongenetic method for purifying stem cell-derived cardiomyocytes. Nature Methods. 7 (1), 61-66 (2010).
- Fernandes, S., et al. Human embryonic stem cell-derived cardiomyocytes engraft but do not alter cardiac remodeling after chronic infarction in rats. Journal of Molecular and Cellular Cardiology. 49 (6), 941-949 (2010).
- Shiba, Y., et al. Allogeneic transplantation of iPS cell-derived cardiomyocytes regenerates primate hearts. Nature. 538 (7625), 388-391 (2016).
- Wendel, J. S., et al. Functional effects of a tissue-engineered cardiac patch from human induced pluripotent stem cell-derived cardiomyocytes in a rat infarct model. Stem Cells Translational Medicine. 4 (11), 1324-1332 (2015).
- Hattori, F. Technology Platforms for Heart Regenerative Therapy Using Pluripotent Stem Cells. Stem Cells and Cancer Stem Cells, Volume 7: Therapeutic Applications in Disease and Injury. , 33-45 (2012).
- Tao, S., et al. Ablation lesion characterization in scarred substrate assessed using cardiac magnetic resonance. JACC: Clinical Electrophysiology. 5 (1), 91-100 (2019).
- Rutkowski, J. M., Swartz, M. A. A driving force for change: interstitial flow as a morphoregulator. Trends in Cell Biology. 17 (1), 44-50 (2007).
- Hattori, F., Fukuda, K., Yuasa, S. How to purify cardiomyocytes for research and therapeutic purposes. Cardiac Regeneration using Stem Cells. , (2013).
- Li, M., Tian, X., Zhu, N., Schreyer, D. J., Chen, X. Modeling process-induced cell damage in the biodispensing process. Tissue Engineering. Part C, Methods. 16 (3), 533-542 (2010).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneEsplora altri articoli
This article has been published
Video Coming Soon