免疫沈殿ベースの技術:アガロースビーズを用いた内因性タンパク質の精製
概要
ソース: スザンナ C. シスラー1, トーニャ J. ウェッブ1
1メリーランド大学ボルチモア校微生物学・免疫学科、MD 21201
免疫沈殿(IP、また「プルダウンアッセイ」として知られている)は、様々な分野でアプリケーションを持っている広く使用されている技術です。1984年に初めて考案され、1988年(1、2)に精製されました。IPの基本的な目標は、そのタンパク質に対する抗体を用いた特定のタンパク質の精製と単離です。「免疫」という言葉は抗体の使用を指し、「沈殿」という言葉は溶液から特定の物質を引き下すことを指します。標的タンパク質は、内因性または組換えである可能性があります。ほとんどの組換えタンパク質は、その後の精製を簡素化するためにエピトープタグ(すなわちmycまたはフラグ)を付着しています。通常、組換えエピトープタグに対する抗体は非常に強力で効果的であるため、組換えタンパク質IPを最適化する方が簡単です。内因性タンパク質に対する抗体は非常に可変的な有効性を持ち、これらのIPの最適化がはるかに困難です。免疫沈殿後の必要なステップは、精製の検証です。単離されたタンパク質はSDS-PAGEを使用して解決され、その後、ウェスタンブロットによって純度を調べた(図1)。重要なコントロールは、正しいタンパク質のプルダウンを検証するために、ウェスタンブロット中に別の抗体を使用することです。IP と後続の手法の組み合わせは、強力な分析ツールです。精製後の目標は、NMR、質量分析、インビトロアッセイによるタンパク質自体の特徴付け、またはタンパク質の相互作用パートナー(タンパク質、DNA、RNA)の分析(3、4、5)であり得る。
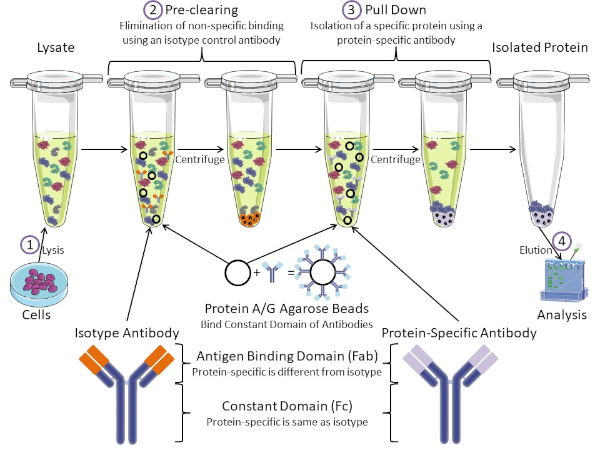
図1:免疫沈殿手順の概要免疫沈殿は、抗体を用いた特定のタンパク質の単離である。細胞からのリサートの生産後、2つの主要なステップがあります- 事前クリアとプルダウン。事前クリアステップの間、細胞分は、アイソタイプコントロール抗体を使用して非特異的に抗体に結合するタンパク質を事前に除去する。プルダウン工程では、標的タンパク質はタンパク質特異的抗体を用いてプルダウンされる。その後、単離されたタンパク質をウェスタンブロットで分析します。アイソタイプ抗体およびタンパク質特異的抗体は、同じ定常ドメインを持つが、異なる抗原結合ドメインを持つ。このプロトコルの重要な構成要素は、抗体の一定ドメインを結合するタンパク質A/Gアガロースビーズであり、標的タンパク質の免疫沈殿を可能にする。この図のより大きなバージョンを表示するには、ここをクリックしてください。
抗体は、他の形態のタンパク質精製(すなわちニッケル親和性カラム精製)と区別する免疫沈殿の重要な構成要素である。抗体は、特定のタンパク質エピトープを認識できるB細胞によって作られた分子です。抗体には、定数(Fc)と抗原結合(Fab)の2つのドメインがあります(図1)。定数ドメインは抗体の種類を識別し、生体内の機能を指示する。通常、IPに使用される抗体の一定ドメインは、マウス、ラット、またはウサギIgGである。抗体の抗原結合部は、特定のタンパク質の特異的なエピトープを認識する。抗体は、タンパク質が変性した場合に存在しない可能性のある折り畳まれたタンパク質上のエピトープを認識し、その逆も可能です。したがって、エピトープの利用可能性はタンパク質の折りたたみに依存し、IPの抗体および条件を選択する際に考慮すべき重要な要因を同定する。
原核生物系と真核生物系の両方が抗体結合タンパク質を持っています。真核生物系では、原核系では細菌からの免疫保護が目的であり、その目的は免疫系からの保護である。抗体結合タンパク質は、2つの方法でIP方法論に影響を与えます。まず、抗体を結合するタンパク質のライサートを取り除くために必要な事前清算工程(図1)があり、それによって最終製品における非特異的結合を減少させる。このステップでは、タンパク質特異的抗体とは異なる抗体結合ドメインと同じ定常ドメインを有するアイソタイプ抗体を使用します。細菌抗体結合タンパク質は、この方法の第2の重要な構成要素である。タンパク質特異的抗体が標的タンパク質と結合した後、抗体:タンパク質複合体をプルダウンする必要があります(図1)。タンパク質A、G、およびLは、抗体の一定ドメインに結合する細菌タンパク質である。細菌はこれを使用して免疫系を破壊しますが、研究者は抗体精製を容易にするためにこのシステムを共同で選択し、事前クリアとプルダウンの両方のステップで使用されます。これらのタンパク質は、異なる種と異なる定数ドメインサブタイプに対して異なる結合親和性を持っています - IPの条件を選択する際に考慮すべきもう一つの要因。多くの企業では、タンパク質A/Gラベルのアガロースビーズ(図1)、あらかじめ作られたスピンカラム、またはカラムを作る樹脂を販売しています。一般に、ビーズとスピンカラムはサンプルサイズが小さく、樹脂はバルク精製に使用されます。
このラボでは、タンパク質A/Gプラスアガロースビーズをベースにした基本的な免疫沈殿技術を用いて、原発性マウス甲状腺細胞から内因性タンパク質c-mycを精製する方法を示す。プロトコルは細胞リサート調製から始まり、ウェスタンブロット分析を用いて成功したタンパク質プルダウンの検証で終わります。
手順
1. タンパク質A/G PLUSアガロースビーズを用した免疫沈殿
細胞リサート製剤
- 遠心分離機108チモシグネタを13,000rpmのマイクロ遠心分離機で3分間、上清を除去する。
注:細胞数は、所望のタンパク質の発現レベルと選択した細胞タイプによって異なります。 - PMSFを使用して500 μLリシスバッファRIPAで細胞を再中断します。
- 渦でいくつかのクイックパルスを使用して細胞を破壊し、注射器に取り付けられた25G針で数回ライサートを吸引します。
注:バブルの作成は避けてください。より大きなセルタイプには、21G針などの大きな針を使用します。 - 細胞を氷上で10分間インキュベートします。
- 4°Cで15分間13,000rpmでリザートを遠心分離します。
- 上清を
結果
申請書と概要
参考文献
- Olliver, C. L. and Boyd, C. D. (1984). Immunoprecipitation of In Vitro Translation Products with Protein A Bound to Sepharose. In J. M. Walker (eds), Nucleic Acids. Methods in Molecular Biology (pp. 157-160). New Jersey: Humana Press.
- Thurston, C. F. and Henley, L. F. (1988). Direct Immunoprecipitation of Protein. In J. M. Walker (eds), New Protein Techniques. Methods in Molecular Biology (pp. 149-158). New Jersey: Humana Press.
- Anderson, N. G. (1998). Co-immunoprecipitation: Identification of Interacting Proteins. In R. A. Clegg (eds), Protein Targeting Protocols.Methods in Molecular Biology (pp. 35-45). New Jersey: Humana Press.
- Jackson, D. I. and Dickson, C. (1999). Protein Techniques: Immunoprecipitation, In Vitro Kinase Assays, and Western Blotting. In P.T. Sharpe and I. Mason (eds), Molecular Embryology. Methods in Molecular Biology (pp. 699-708). New Jersey: Humana Press.
- Trieu, E. P. and Targoff, I. N. (2015). Immunoprecipitation: Western Blot for Proteins of Low Abundance. In B. Kurien and R. Scofield (eds), Western Blotting. Methods in Molecular Biology (pp. 327-342). New York, NY: Humana Press.
タグ
スキップ先...
このコレクションのビデオ:

Now Playing
免疫沈殿ベースの技術:アガロースビーズを用いた内因性タンパク質の精製
Immunology
87.6K 閲覧数

フローサイトメトリーと蛍光活性化細胞選別(FACS):脾臓Bリンパ球の単離
Immunology
92.9K 閲覧数

磁気活性化細胞選別(MACS):胸腺Tリンパ球の単離
Immunology
22.9K 閲覧数

ELISAアッセイ:間接、サンドイッチ、競争力
Immunology
238.1K 閲覧数

ELISPOTアッセイ:IFN-γ分泌脾細胞の検出
Immunology
28.4K 閲覧数

免疫組織化学と免疫細胞化学:光顕微鏡による組織イメージング
Immunology
78.8K 閲覧数

抗体生成:ハイブリドーマを用いたモノクローナル抗体の産生
Immunology
43.5K 閲覧数

免疫蛍光顕微鏡:パラフィン埋め込組織切片の免疫蛍光染色
Immunology
53.8K 閲覧数

共焦点蛍光顕微鏡:マウス線維芽細胞におけるタンパク質の局在を決定する技術
Immunology
43.1K 閲覧数

細胞周期分析:CFSE染色と流れサイトメトリーを用いた刺激後のCD4およびCD8 T細胞増殖の評価
Immunology
24.2K 閲覧数

養子細胞移植:宿主マウスへのドナーマウス脾細胞導入とFACSによる成功評価
Immunology
22.3K 閲覧数

細胞死に対するアッセイ:細胞毒性能のクロム放出アッセイ
Immunology
151.4K 閲覧数
Copyright © 2023 MyJoVE Corporation. All rights reserved