Method Article
χCRAC를 사용하여 높은 시간 분해능에서 생체 내 단백질-RNA 상호 작용 역학 모니터링
Erratum Notice
요약
cDNA의 키네틱 가교 및 분석은 높은 시간 분해능에서 살아있는 세포에서 단백질-RNA 상호작용의 역학을 조사할 수 있는 방법입니다. 여기에서 프로토콜은 효모 세포의 성장, UV 가교, 수확, 단백질 정제 및 차세대 시퀀싱 라이브러리 준비 단계를 포함하여 자세히 설명됩니다.
초록
RNA 결합 단백질(RBP)과 RNA 기질 간의 상호 작용은 유동성과 복잡성을 나타냅니다. 수명 기간 동안 단일 RNA는 생산, 안정성, 활성 및 분해를 조절하는 다양한 RBP에 의해 결합될 수 있습니다. 따라서 이 두 유형의 분자 사이에 존재하는 역학을 이해하기 위해 많은 작업이 수행되었습니다. 특히 중요한 돌파구는 'cross-l inking and immunoprecipitation'(CLIP)의 출현과 함께 이루어졌습니다. 이 기술을 통해 어떤 RNA가 특정 RBP에 결합되어 있는지에 대한 엄격한 조사가 가능했습니다. 요컨대, 관심 단백질은 생체 내에서 RNA 기질에 UV 가교 결합되고 매우 엄격한 조건에서 정제된 다음 단백질에 공유 가교된 RNA를 cDNA 라이브러리로 변환하고 시퀀싱합니다. 개념 이후 CLIP을 특정 연구 분야에 적용 할 수 있도록 많은 파생 기술이 개발되었습니다. 그러나 자외선을 이용한 가교는 비효율적이기로 악명이 높습니다. 이로 인해 RBP-RNA 상호 작용에 대한 시간적 연구가 불가능해지는 노출 시간이 길어집니다. 이 문제를 극복하기 위해 우리는 최근에 훨씬 개선된 UV 조사 및 세포 수확 장치를 설계 및 구축했습니다. 이러한 새로운 도구를 사용하여 우리는 높은 시간 분해능에서 살아있는 세포의 RBP-RNA 상호 작용에 대한 시간 분해 분석을 위한 프로토콜을 개발했습니다: Kinetic CRoss-linking 및 CDNA의 Analysis(χCRAC). 우리는 최근에 이 기술을 사용하여 영양소 스트레스 적응에서 효모 RBP의 역할을 연구했습니다. 이 원고는 χCRAC 방법에 대한 자세한 개요를 제공하고 Nrd1 RBP로 얻은 최근 결과를 제시합니다.
서문
RNA는 종종 기능을 발휘하기 위해 RBP에 의존하기 때문에 이러한 분자 간의 역학을 이해하는 데 큰 관심을 갖게 되었습니다. 많은 RBP가 다양한 유기체에서 확인되었습니다. 그러나 생체 내에서 RBP-RNA 상호작용을 연구하는 것은 항상 어려운 것으로 악명이 높았습니다. 이러한 상호 작용을 연구하는 데 있어 중요한 돌파구는 CLIP1의 출현과 함께 이루어졌습니다. 이 방법은 자외선(UV, 254nm) 조사를 사용하여 RBP와 직접 결합된 RNA 사이의 공유 결합(즉, 제로 거리 가교)을 유도합니다. 이어서, 관심 있는 RBP는 단백질에 공유 가교된 RNA만 식별되도록 엄격한 조건 하에서 면역정제됩니다. 그런 다음 결합된 RNA는 RNase로 부분적으로 소화된 후 시퀀싱을 위해 cDNA 라이브러리로 변환됩니다. 높은 정제 엄격성은 단백질 및 RNA 회수의 특이성을 크게 증가시키기 때문에 중요하며, 이는 가교된 리보핵단백질(RNP) 복합체의 SDS-PAGE 정제를 통해 더욱 향상됩니다. CLIP 및 관련 방법은 또한 염기서열 분석 라이브러리를 준비하는 동안 RNA에 가교된 아미노산이 종종 역전사효소를 종결시키거나 효소가 이 부위에 돌연변이를 도입하도록 하기 때문에 단백질 결합 부위에 대한 뉴클레오티드 분해능 통찰력을 제공합니다 1,2,3.
도입 이후 오리지널 CLIP 프로토콜은 놀랍도록 다양한 파생 방법론을 만들어 냈습니다. 특히 중요한 돌파구는 고처리량 시퀀싱을 CLIP 접근 방식3과 병합하는 HITS-CLIP(또는 CLIP-seq)의 개발과 함께 이루어졌습니다. 이것은 이후 모든 CLIP 기반 방법론에서 채택되었습니다. iCLIP은 RBP 결합 부위의 보다 정확한 매핑을 용이하게 하는 RNase 매개 트리밍 및 어댑터 결찰 기술의 개선을 도입했습니다4. PAR-CLIP은 365 nm에서 가교결합과 함께 4thio-uridine / uracil 표지를 결합하여 T-C 치환을 분석하여 가교 부위를 매핑 할 수 있습니다5. CRAC, 요소-iCLIP, dCLIP 및 uvCLAP은 친화성 수지에 대한 배경 결합을 더욱 감소시키고 단백질 포획 2,6,7,8,9의 특이성을 더욱 증가시키는 변성 조건 및 이중 친화성 정제 단계를 도입했습니다. 또한 CRAC, uvCLAP 및 dCLIP은 관심 있는 RBP에 친화성 태그를 도입하여 특정 항체를 생성할 필요성을 극복했습니다.
CLIP 방법론을 촉진하기 위해 몇 가지 최적화가 이루어졌습니다. 원래의 CLIP 프로토콜은 SDS-PAGE 후 RBP-RNA 복합체를 시각화하기 위해 포획 된 RNA의 방사성 표지를 활용했습니다. 그러나 방사능의 사용은 그러한 작업을 위해 설정되지 않은 실험실에서 문제가 될 수 있습니다. irCLIP은 적외선 이미징(10 )을 통해 시각화를 용이하게 하는 형광단 결합 어댑터를 통합하고 sCLIP는 스트렙타비딘 결합 HRP(11)를 통해 시각화하기 위해 캡처된 RNA의 비오티닐화를 활용합니다. 또한 eCLIP은 RNA 라벨링을 완전히 포기합니다. 대신, 단백질은 알려진 크기12만을 기준으로 절제됩니다. 스트렙타비딘 기반 정제는 또한 FAST-iCLIP에서 라이브러리 준비 과정을 가속화하는 데 사용되어 왔으며, 여기서 비오티닐화된 3' 어댑터는 RNA에 연결되고 역전사 및 순환화 후 정제를 가능하게 하는 데 사용됩니다13. iCLIP 프로토콜에 대한 추가적인 개선은 또한 라이브러리의 복잡성을 크게 증가시켰다4.
마지막으로, CLIP는 상이한 세포 하위구획(14,15)으로부터 RBP를 포획할 수 있도록 수정되었고, 광활성가능한 리보뉴클레오시드(5,16,17)의 펄스 유도를 사용하여 새로 전사된 RNA를 시각화하고, 메틸화된 RNA를 포획(18,19,20), RNA-RNA 상호작용(21,22)을 조사하고, 3' 말단(23,24)을 매핑할 수 있도록 수정되었다.
RBP와 RNA 간의 상호 작용에 대한 이해를 돕는 데 CLIP 기반 기술이 크게 기여했음에도 불구하고 UV 가교의 비효율성으로 인해 제한되었습니다. 단층에서 성장한 배양 세포는 일반적으로 비교적 쉽게 가교할 수 있지만, 이는 조직 또는 용액 내 세포에서 훨씬 더 어렵습니다. 조직은 필요한 세포층에 침투하기 위해 여러 차례의 UV 노출이 필요할 수 있는 반면, 미생물 세포는 종종 방향족 자외선 흡수 화합물25을 포함하는 풍부한 배지에서 성장합니다. 실제로, 최대 30분의 UV 조사 시간은 이러한 샘플에 대해 RBP와 그의 결합된 RNA 사이에 충분한 가교결합을 생성하는 데 사용되었습니다(26,27,28). 이러한 연장된 UV 노출은 세포 내에서 스트레스 반응, 예를 들어 UV 유도 DNA 손상을 유도하며, 이는 일부 응용 분야에서 최종 데이터를 오염시킬 수 있습니다.
대부분의 CLIP 연구는 세포에서 특정 단백질-RNA 상호 작용의 단일 "스냅샷"을 생성하는 데 중점을 두었습니다. 그러나 단백질-RNA 상호 작용은 특히 세포가 환경 변화에 노출될 때 본질적으로 역동적입니다. 여기에는 필수 영양소의 급격한 가용성 감소 또는 급격한 온도 변화가 포함될 수 있습니다. 따라서 스트레스 중 RBP의 역할을 진정으로 이해하려면 스트레스 동안 RBP 목표의 전체 스펙트럼을 캡처하고 선택한 RBP가 활성화되는 스트레스 반응 단계를 결정할 수 있기 때문에 시간 분해 분석을 수행하는 것이 가장 좋습니다. 특히, 효모에 대한 연구에 따르면 적응의 처음 몇 분은 생존에 절대적으로 중요하며 박테리아의 RNA 반감기는 몇 분에서 몇 초까지 다양할 수 있습니다 29,30,31,32,33. 따라서 이러한 시간 분해 분석은 이상적으로 높은 시간 분해능에서 수행되어야 합니다. 그러나 긴 가교 시간은 초기 단계 적응 반응에 대한 연구를 특히 어렵게 만듭니다.
이러한 문제를 극복하기 위해 우리는 최근 분 길이의 시간 척도에서 세포를 가교 및 수확할 수 있는 개선된 방법을 개발했습니다. 당사의 χCRAC 방법을 사용하면 이전에 볼 수 없었던 분해능에서 RBP-RNA 상호 작용의 동적 변화를 정량적으로 측정할 수 있습니다. 이 방법의 결정적인 것은 용액 내 효모와 박테리아에서 필요한 가교 시간을 약 10배 단축하여 RBP-RNA 상호작용을 순간적으로 효과적으로 동결시키는 새로운 UV 조사 장치(32 )의 개발이었습니다. 또한, UV 조사 후 세포를 빠르게 수확하기 위해 0.5L 배양액에서 기하급수적으로 성장하는 효모를 30초32일 내외로 수확할 수 있는 진공 여과 장치를 개발했습니다. 이러한 기술 혁신을 통해 미세 분해능에서 RBP-RNA 역학을 연구할 수 있습니다. 또한 실용성을 높이기 위해 원래 CRAC 프로토콜2 에 몇 가지 최적화를 도입했습니다.
χCRAC를 사용하여 우리는 최근 포도당 결핍에 대한 반응으로 효모 핵 RBP인 Nab3의 표적체를 연구했습니다. Saccharomyces cerevisiae에서 Nab3는 Nrd1, RBP 및 RNA 헬리카제 Sen1과 복합체를 형성하여 NNS 복합체를 형성할 수 있습니다. RNA 중합효소 및 초기 전사체에 결합하는 NNS는 전사 종결을 촉발할 수 있다34. 이 복합체는 주로 비밀스러운 비암호화 RNA 전사체를 제거하는 데 관여하지만 단백질 코딩 유전자의 발현을 조절하는 것으로도 나타났습니다. 이 연구는 단 1분의 스트레스 후에 Nab3를 비암호화 및 코딩 전사체로 차등적으로 표적화하는 것으로 나타났습니다32. 우리는 Nab3에 의한 공동 전사 종결이 기존의 CLIP 기반 접근 방식을 사용하여 검출하기 어려웠을 레트로트랜스포존 유전자의 매우 일시적인 펄스와 유사한 발현을 초래한다는 것을 입증했습니다. 또한, UV 가교제의 짧은 UV 조사 시간은 수명이 짧은 비암호화 RNA의 회수율을 크게 증가시켰습니다32. χCRAC는 RBP가 즉각적인 시간 척도에서 스트레스에 대한 대응을 형성하는 방법뿐만 아니라 응답의 전체 수명 주기 동안 변화하는 역할을 설명하는 데 중요한 도구가 될 것입니다. 이 원고는 χCRAC 프로토콜의 모든 단계에 대한 자세한 개요를 제공합니다. 예시적인 목적을 위해, 상기 방법은 전사 종결 및 RNA 붕괴에 관여하는 효모 Nrd1 단백질 및 다수의 시점에 걸쳐 글루코스 결핍에 반응하는 그의 RNA 표적체를 연구하기 위해 사용되었다. 마지막으로, 우리는 또한 UV 조사 장치가 RBP를 HeLa 세포의 RNA에 빠르게 교차 연결하여 부착 세포에서 고분해능 시간 분해 분석을 수행할 수 있음을 입증합니다.
프로토콜
| TN150 시리즈 |
| 50mM 트리스 pH 7.8 |
| 150mM 염화나트륨 |
| 0.1% NP-40 |
| 1X 프로테아제 억제제 |
| TN1000 시리즈 |
| 50mM 트리스 pH 7.8 |
| 1M 염화나트륨 |
| 0.1% NP-40 |
| NP-PNK-PNK |
| 50mM 트리스-HCl pH 7.8 |
| 10 mMMgCl2 |
| 0.1% NP-40 |
| 5 mM 베타-메르캅토에탄올 |
| PNK 5개 |
| 250 mM 트리스-HCl pH 7.8 |
| 50 mMMgCl2 |
| 50mM 베타-메르캅토에탄올 |
| WB I |
| 50mM 트리스-HCl pH 7.8 |
| 300 mM 염화나트륨 |
| 10 mM 이미다졸 |
| 6M 구아니딘-HCl |
| 0.1% NP-40 |
| 5 mM 베타-메르캅토에탄올 |
| WB II |
| 50mM 트리스-HCl pH 7.8 |
| 50mM 염화나트륨 |
| 10 mM 이미다졸 |
| 0.1% NP-40 |
| 5 mM 베타-메르캅토에탄올 |
| 용출 완충액 |
| 50mM 트리스 pH 7.8 |
| 50mM 염화나트륨 |
| 250 mM 이미다졸 |
| 0.1% NP-40 |
| 5 mM 베타-메르캅토에탄올 |
| 프로테아제 K 완충액 |
| 50mM 트리스 |
| 0.1% NP-40 |
| 5 mM β-메르캅토에탄올 |
| 1% SDS |
| 5 mM EDTA |
| 50 mM 염화나트륨2 |
| 포유류 용해 완충액 |
| 50mM 트리스-HCl pH 8 |
| 100mM 염화나트륨 |
| 0.5% v/v 트리톤 X-100 |
| 0.25% w/v Na-데옥시콜레이트 |
| 0.1% w/v SDS |
| 5 mM EDTA |
| 1 mM DTT (신선한 첨가) |
| 1X 프로테아제 억제제 |
표 1: χCRAC 및 그 조성에 필요한 완충액.
1. UV 가교 및 용해물 생산
- 용액 속의 미생물
- 3.5 L의 원하는 배지를 0.05의 출발OD600 으로 하룻밤 배양으로부터의 효모로 접종한다. 30 °C에서 180 rpm으로 계속 진탕하여 성장시킵니다.
- 성장하는 동안 다른 필요한 재료를 준비하십시오.
- 액체 질소 용기를 준비하십시오.
- 3 L의 응력 유발 매체를 준비하고 수조에서 30 °C로 가온한다.
- 필터 장치를 설정하고 가교제를 켜고(그림 2A) 각 시점에 하나씩 50mL 원뿔형 튜브에 라벨을 붙입니다.
- 세포가 원하는 OD600에 도달하면 500mL의 세포를 가교제에 직접 붓고 250mJ의 254nm UV를 UV로 조사합니다. 가교제 사용에 대한 자세한 내용은 그림 2A 및 그림 3A를 참조하십시오.
참고: UV 조사 에너지는 관심 있는 각 단백질에 대해 신중하게 최적화되어야 합니다. 자세한 내용은 토론을 참조하십시오. - 가교 후 진공 여과 장치 중 하나를 사용하여 셀을 여과합니다(그림 2B, C). 여과된 세포로 멤브레인을 말아서 t = 0(시간 0) 50mL 원뿔형 튜브에 넣고 액체 질소에서 급속 동결합니다.
- 나머지 셀을 6개의 서로 다른 필터로 필터링합니다. 멤브레인을 배지에 떨어뜨리고 50초 동안 스트라이프와 격렬하게 혼합하여 이전에 데워진 스트레스 유발 배지 3L에 수집된 세포를 재현탁합니다. 50초 후, t=1 시료를 채취하기 위해 준비한다.
- 1분 후, 500mL의 세포를 가교결합하고 1.1.3–1.1.4단계와 같이 여과를 통해 수확합니다. 2분, 4분, 8분, 14분, 20분 후에 또는 필요에 따라 다른 시점에 반복합니다.
- 세포가 들어 있는 원뿔형 튜브를 -80°C에서 보관한다. 인산염 완충 식염수(PBS)를 밤새 4°C로 설정합니다.
- 다음날, 가교결합된 샘플이 들어 있는 각각의 원뿔형 튜브를 취하고, 격렬하게 흔들어 25mL의 차가운 PBS에 세포를 재현탁시킨다.
- 세포 현탁액을 새로운 원뿔형 튜브로 옮기고 4,600 x g에서 4°C에서 5분간 회전시킵니다.
- PBS를 붓고 빠르게 다시 회전시켜 잔류 PBS를 수집한 다음 피펫으로 남은 액체를 디캔팅합니다.
- 튜브에 있는 펠릿의 무게를 빈 튜브와 비교하여 계산하십시오.
- 얼음처럼 차가운 TN150 펠릿 부피 2개, DNase 1 60μL, RNase 억제제 10μL를 추가합니다. 얼음 위에서 30분 동안 배양합니다.
- 예를 들어, 400mg의 세포에 대해 800μL의 얼음처럼 차가운 TN150을 추가합니다.
- DNase의 첨가는 대부분의 가용성 단백질에 필수적인 것은 아니지만 RNA 중합효소와 같은 염색질 결합 단백질을 연구할 때 매우 중요합니다. 또한 박테리아 용해물의 점도를 감소시킵니다. 용해 완충액의 정확히 2 펠릿 부피를 사용하는 것이 매우 중요하며, 그렇지 않으면 용해 효율이 저하 될 수 있습니다.
- 3 개의 펠릿 부피 (mL)의 지르코니아 비드를 세포 현탁액에 첨가한다. 효모의 경우 직경 0.5mm의 구슬을 사용하고 박테리아의 경우 0.1mm를 사용합니다.
- 예를 들어, 400mg의 세포에 대해 1.5mL 튜브에서 1.2mL의 지르코니아 비드를 측정하고 용해 완충액에 재현탁된 세포에 추가합니다.
- 세포 현탁액을 1분 동안 소용돌이친 다음 1분 동안 얼음 위에 놓습니다. 총 5회 반복합니다.
- 두 개의 펠릿 부피의 TN150 버퍼를 추가하고 격렬하게 소용돌이치며 혼합합니다.
- 탁상형 원심분리기에서 4°C에서 20분 동안 4,600g의 원뿔형 튜브에 현탁액을 원심분리합니다.
- 원심분리 후, 전체 세포 단백질 발현을 검사하기 위해 향후 웨스턴 블롯 분석을 위해 상청액의 50 μL 샘플을 취한다.
- 상층액을 1.5mL 튜브로 옮기고 마이크로분리기에서 4°C에서 20,000 x g 에서 20분 동안 용해물을 회전시킵니다.
- 또는 5mL 튜브를 사용하는 경우 13,000 x g 에서 20분 동안 원심분리합니다.
- 원심분리 후, 단백질의 가용성 발현을 검사하기 위해 향후 웨스턴 블롯 분석을 위해 상청액의 50μL 샘플을 채취합니다.
- RBP 캡처(섹션 2)로 진행합니다.
- 배양된 부착 세포
- UV 가교 24시간 전에 페트리 접시에 부착 세포를 충분히 시드하여 다음날 80% 밀도에 도달할 수 있도록 합니다. 세포 배양 인큐베이터에서 원하는 배지를 37°C, 5%CO2에서 하룻밤 동안 성장시킨다.
참고: 석영 페트리 접시를 사용하는 경우 파종 2.5시간 전에 배양기구를 폴리-D-라이신(70,000–140,000wt) 및 태아 송아지 혈청(FCS)으로 처리하여 세포 부착을 촉진하는 것이 좋습니다. 전체 성장 표면을 덮을 만큼 충분한 폴리-D-라이신을 추가하고 실온(RT)에서 5분 동안 배양합니다. 다음으로, 석영 페트리 접시를 물로 완전히 헹구고 세포 배양 배양기에서 2 시간 동안 또는 완전히 건조 될 때까지 건조시켜야합니다. 그런 다음 성장 표면을 완전히 덮을 수 있도록 FCS를 충분히 추가하고 최소 30분 동안 인큐베이터에 넣습니다. 세포를 파종하기 전에 FCS를 완전히 제거해야 합니다. - 세포가 80% 밀도에 도달하면 배지를 제거하고 얼음처럼 차가운 PBS 15mL로 세척합니다. 그런 다음 남아있는 모든 액체를 완전히 제거하고 즉시 다음 단계로 진행하십시오.
- 페트리 디쉬를 부착 세포용 트레이로 옮기고(도 3B) UV를 254 nm UV의 300 mJ로 조사한다. 가교제 사용에 대한 자세한 내용은 그림 2A 및 그림 3B 를 참조하십시오.
참고: UV 조사 에너지는 관심 있는 각 단백질에 대해 신중하게 최적화되어야 합니다. 자세한 내용은 토론을 참조하십시오. - 가교 직후, 페트리 접시를 얼음 위에 놓고 얼음처럼 차가운 PBS 10mL를 첨가한다. 긁어서 세포를 수집하고 15mL 원뿔형 튜브로 옮깁니다. 4°C에서 5분 동안 300 x g 에서 원심분리를 통해 펠렛을 제조한다.
- PBS를 제거하고, 세포 펠릿을 1 mL의 빙냉 PBS에 재현탁하고, 1.5 mL 마이크로원심분리 튜브로 옮긴다. 펠렛 세포를 다시 4°C에서 300 x g 에서 5분 동안 원심분리하였다.
- PBS를 제거하고 세포 펠릿을 드라이 아이스에 급속 동결시킵니다. 필요할 때까지 세포 펠릿을 -80°C에서 보관합니다.
- 각 시점에 대해 1.2.3–1.2.6단계를 반복합니다.
- 세포 펠릿을 1mL의 용해 완충액에 재현탁하고 15mL 원뿔형 튜브로 옮깁니다. 그런 다음 용해 완충액 1mL를 추가하여 총 2mL를 만듭니다.
- 포유류 RNase 억제제 5μL를 추가합니다.
- 10 암페어에서 얼음 위에서 10 초 동안 5 배 초음파 처리합니다. 초음파 처리 라운드 사이에 30 초를 기다리십시오.
- 각 샘플의 단백질 농도를 계산하고 가장 낮은 농도로 정규화합니다.
- 용해물 1.98mL를 2mL 튜브로 옮깁니다.
- 10 μL의 DNase I을 첨가하고 1,200 rpm에서 진탕하면서 5 분 동안 37 °C에서 인큐베이션한다.
- 용해물을 4°C에서 20분 동안 16,000 x g 로 원심분리합니다.
- 원심분리 후, 단백질의 가용성 발현을 검사하기 위해 향후 웨스턴 블롯 분석을 위해 상층액의 50 μL 샘플을 채취한다.
- RBP 캡처(섹션 2)로 진행합니다.
- UV 가교 24시간 전에 페트리 접시에 부착 세포를 충분히 시드하여 다음날 80% 밀도에 도달할 수 있도록 합니다. 세포 배양 인큐베이터에서 원하는 배지를 37°C, 5%CO2에서 하룻밤 동안 성장시킨다.
2. RBP 캡처
- 자기 항-FLAG(샘플당 슬러리 75μL) 또는 IgG 아가로스(샘플당 슬러리 500μL) 비드를 5mL의 TN150으로 3배 세척합니다. 700 μL의 TN150의 최종 부피에 재현탁하고 세척된 비드 100 μL를 7개의 15 mL 원뿔형 튜브에 추가합니다.
- 필요할 때까지 얼음 위에 보관하십시오.
- 용해물이 정화되면 anti-FLAG/IgG 비드가 들어 있는 튜브에 상청액을 추가합니다.
- 4 °C에서 2시간 동안 너트테이트합니다.
참고: 일부 프로토콜은 비드를 사용한 하룻밤 배양을 설명하지만 긴 배양 시간이 가교된 RNA의 회수율을 크게 감소시킬 수 있으므로 권장하지 않습니다.
3. 태그의 비드 세척 및 TEV 절단
- 비드를 수확하고 용해물을 제거합니다.
- 포획되지 않은 단백질을 검사하기 위해 향후 웨스턴 블롯 분석을 위해 상청액 샘플 50μL을 채취합니다.
- 얼음처럼 차가운 TN1000에 비드를 재현탁하고 1.5mL 튜브로 옮깁니다. 너트와 함께 4°C에서 10분 동안 세척합니다. 총 세 번의 세척을 반복합니다.
- IgG 아가로스 비드를 사용하는 경우 5mL의 TN1000으로 세척하십시오. anti-FLAG 비드를 사용하는 경우 2mL를 사용하십시오.
- 다음으로, TN150으로 비드를 위와 같은 부피로 3배 세척한다.
- 3차 세척 후, 비드를 600 μL의 TN150에 재현탁시킨다.
- 홈메이드 GST-TEV 프로테아제 30U를 비드 현탁액에 넣고 RT에서 2시간 동안 회전합니다.
참고: 재조합 GST-TEV 프로테아제는 현재 상업적으로 이용 가능하지만 이 프로토콜로 테스트되지 않았습니다.- 분해하는 동안 각 샘플에 대해 3개의 1.5mL 튜브 컬럼을 설정하여 다음 단계를 준비합니다(즉, 7개 샘플의 경우 7개 컬럼으로 구성된 3개의 행이 있음).
- 튜브의 마지막 줄에 0.4g의 구아니듐 염산염, 27μL의 5M 염화나트륨 및 3μL의 2.5M 이미다졸(pH = 8)을 추가합니다. 이미다졸의 pH는 8이어야 합니다. 이는 RNA 무결성을 유지하는 데 중요합니다.
- 또한 필요한 양의 니켈 비드를 WB I 3x로 세척합니다. 시료당 100μL의 슬러리를 사용합니다. 최종 세척 후 비드를 동일한 원래 부피의 WB I에 재현탁하고 얼음에 보관하십시오.
- TEV 분해가 완료되면 anti-FLAG 비드용 마그네틱 랙 또는 IgG 비드용 원심분리를 사용하여 상청액을 수집하고 이전에 설정된 튜브의 첫 번째 줄로 옮깁니다.
- 웨스턴 블롯 분석을 위해 TEV 용출액 샘플 50μL를 채취합니다.
- 써모블록 인큐베이터를 37°C로 설정합니다. 튜브의 두 번째 줄에 1 μL의 RNase 칵테일 (1:50 희석)을 추가합니다.
- 튜브의 첫 번째 줄에서 550μL의 TEV 용출액을 꺼내 두 번째 줄(RNase 칵테일 포함)에 추가합니다. 혼합을 보장하기 위해 세게 피펫을 사용합니다.
- 첫 번째 샘플에 대해 이 작업을 완료한 후 즉시 튜브를 열 블록에 넣고 타이머를 시작합니다. 각 샘플이 엇갈리도록 후속 샘플로 이동합니다.
- 정확히 5분 동안 배양합니다. 완료되면 열 블록에서 첫 번째 샘플을 제거하고 용액을 튜브의 세 번째 줄(염산 구아니듐 분말 포함)로 옮깁니다.
참고: RNase 칵테일을 1:50 희석하여 5분 배양하는 것이 일반적으로 대부분의 단백질에 적합하지만, 이 단계는 가교된 RNA가 올바른 크기(30-100nt)인지 확인하기 위해 각 단백질에 대해 서로 다른 배양 시간 또는 농도로 신중하게 최적화해야 합니다. - 즉시 최고 속도로 몇 초 동안 소용돌이 치면 구아니듐 분말이 용해되고 다음 샘플로 넘어갑니다.
- 모든 샘플이 구아니듐 분말로 옮겨진 후, 모든 분말이 완전히 용해되도록 다시 와류합니다.
- 세척된 니켈 비드 100μL를 추가하고 4°C에서 밤새 회전합니다. 이 배양은 2 시간으로 단축 될 수 있습니다.
4. 온비드 알칼리성 포스파타제 처리
- 써모블럭을 37°C로 설정합니다.
- 정제 스핀 컬럼을 각 샘플에 대해 하나씩 2mL 튜브에 넣습니다. 니켈 비드를 컬럼으로 옮기고 상청액이 배출되도록 합니다. 그 후, WB I로 헹구고 컬럼에 적용하여 모든 니켈 비드가 1.5mL 튜브에서 제거되었는지 확인합니다.
- 샘플당 6개씩 2mL 튜브를 설정합니다(각 세척액을 수집하기 위해 하나씩). 흐름을 유지하기 위해 기둥 외부를 건조하게 유지하십시오. 비드를 500 μL의 WB I로 3배 세척한 다음 500 μL의 NP-PNK로 3배 세척합니다.
- 스핀 컬럼의 뚜껑을 닫고 비드를 짧게 회전시켜 과도한 버퍼를 제거합니다.
- 컬럼에 마개를 놓고 컬럼을 1.5mL 튜브에 넣고 표 2에 표시된 반응 혼합물 60μL를 추가합니다.
| 구성 요소 | 1배 | 7.5배 |
| 5 x PNK 버퍼 | 12 | 90 |
| 알칼리성 포스파타제 | 4 | 30 |
| RNase 억제제 | 2 | 15 |
| H2O | 42 | 315 |
| 최종 볼륨 | 60 μL | 450 μL |
표 2: 알칼리성 포스파타제 반응 혼합물.
- 비드를 37°C에서 1시간 동안 인큐베이션한다.
- 비드를 500 μL의 WB I로 1x 세척하여 알칼리성 포스파타제를 비활성화한 다음 500 μL의 NP-PNK 완충액으로 3x 세척합니다. NP-PNK 버퍼로 컬럼 내부를 철저히 헹구어 미량의 구아니듐을 제거하십시오.
5. RNA의 3' 말단에 대한 App-PE 링커의 On-bead ligation
- 나머지 버퍼를 스핀아웃하고 표 3에 명시된 혼합물 60μL(App-PE 시퀀스는 표 4 참조)를 컬럼에 추가합니다. 반응물을 25°C에서 6시간 동안 인큐베이션한다.
| 구성 요소 | 1배 | 7.5배 |
| 5 x PNK 버퍼 | 12 | 90 |
| App-PE 어댑터(100μM) | 0.6 | 4.5 |
| T4 RNA 리가아제 2 절단된 K227Q | 3 | 22.5 |
| RNase 억제제 | 1.5 | 11.25 |
| 50% 페그 8000 | 12 | 90 |
| H2O | 30.9 | 231.75 |
| 최종 볼륨 | 60 μL | 450 μL |
표 3: App-PE 링커 결찰 반응 혼합물.
| 올리고뉴클레오티드 이름 | 시퀀스 (5'-3') | |||
| L5Aa (영어) | invddT-ACACrGrArCrGrCrUrUrCrCrGrArCrCrGrUrUrNrNrNrUrArArGrCrN-OH | |||
| L5Ab | invddT-ACACrGrArCrCrUrUrCrCrGrArCrCrGrUrUrNrNrArUrUrArCrN-OH | |||
| L5Ac | invddT-ACACrGrArCrCrUrUrCrCrGrCrGrArCrCrUrNrNrGrCrArGrCrN-OH | |||
| L5광고 | invddT-ACACrGrArCrCrUrUrCrCrGrCrGrUrCrNrNrNrCrGrCrUrUrArCrN-OH | |||
| L5바 | invddT-ACACrGrArCrUrCrCrGrArCrGrUrCrNrNrArGrArGrCrN-OH | |||
| L5Bb | invddT-ACACrGrArCrUrUrCrCrGrArCrNrNrNrGrGrArGrCrN-OH | |||
| L5Bc | invddT-ACACrGrArCrCrUrUrCrCrGrCrGrUrCrNrNrNrCrArCrArCrCrN-OH | |||
| L5Bd | invddT-ACACrGrArCrCrUrUrCrCrGrCrGrUrUrCrCrNrNrUrUrCrN-OH | |||
| L5캘리포니아 | invddT-ACACrGrArCrCrUrUrCrCrGrGrCrCrGrUrCrCrNrNrNrCrUrArGrCrN-OH | |||
| L5Cb | invddT-ACACrGrArCrCrUrUrCrCrGrGrCrCrGrArCrCrNrNrNrUrGrArGrCrN-OH | |||
| L5Cc | invddT-ACACrGrArCrCrUrUrCrGrGrCrNrNrArCrCrArCrN-OH | |||
| L5Cd | invddT-ACACrGrArCrCrUrUrCrCrGrGrUrCrCrUrNrNrGrArCrUrUrArCrN-OH | |||
| L5다 | invddT-ACACrGrArCrUrUrCrCrGrArCrCrGrUrUrNrNrNrCrGrUrUrN-OH | |||
| L5Db | invddT-ACACrGrArCrCrUrUrCrCrGrArCrCrGrUrUrCrNrNrGrCrArCrUrArN-OH | |||
| L5Dc | invddT-ACACrGrArCrCrUrUrCrCrGrGrArCrNrNrNrUrArGrUrCrN-OH | |||
| L5Dd | invddT-ACACrGrArCrCrUrUrCrGrGrUrCrCrNrNrArUrCrArCrGrN-OH | |||
| L5Ea | invddT-ACACrGrArCrGrCrUrCrGrArCrCrUrNrNrNrCrArCrUrGrUrN-OH | |||
| L5Eb | invddT-ACACrGrArCrCrUrCrUrCrCrGrArCrGrUrCrCrNrNrNrGrGrArCrArN-OH | |||
| L5Ec | invddT-ACACrGrArCrUrUrCrCrGrArCrCrGrUrUrNrNrUrUrCrArCrN-OH | |||
| L5에드 | invddT-ACACrGrArCrCrUrUrCrCrGrArCrGrUrCrCrNrNrArCrArGrGrN-OH | |||
| App_PE | 앱-NAGATCGGAAGAGCACACGTCTG-ddC | |||
표 4: 포획된 RNA의 5' 및 3' 말단에 결찰하는 데 필요한 DNA 및 RNA 어댑터의 서열. 이들은 RNase-free HPLC를 통해 정제되었습니다.
- 500 μL의 WB I로 1x 및 500 μL의 NP-PNK 완충액으로 3x 비드를 세척합니다. 컬럼을 새 튜브에 넣고 나머지 버퍼를 회전시킵니다.
6. RNA의 5' 말단의 On-bead 인산화
- 표 5에 명시된 혼합물 80μL를 컬럼에 추가합니다. 반응물을 37°C에서 40분 동안 인큐베이션한다.
알림: 샘플은 이제 방사능이 높습니다. 따라서 모든 후속 작업은 보호 스크린 뒤에서 수행되어야하며 폐기물은 지역 보건 및 안전 규칙에 따라 처리해야합니다.
| 구성 요소 | 1배 | 7.5배 |
| 5 x PNK 버퍼 | 16 | 120 |
| 32P-ɣATP (10 μCi/μL) | 3 | 22.5 |
| T4 PNK | 3 | 22.5 |
| H2O | 58 | 435 |
| 최종 볼륨 | 80 μL | 600 μL |
표 5: 인산화 반응 혼합물.
- 100mM ATP 1μL를 추가하고 반응을 20분 더 진행합니다. 이렇게 하면 거의 모든 5' 말단에 5' 링커의 결찰을 용이하게 하는 인산염이 있습니다.
- 시료당 5개씩 2mL 튜브를 설정합니다.
- 500 μL의 WB I로 1x 및 500 μL의 NP-PNK 완충액으로 3x 비드를 세척합니다. 이러한 용출물은 방사성이 매우 높으므로 적절하게 폐기해야 합니다.
- 컬럼을 최종 튜브로 이동하고 나머지 버퍼를 회전시킵니다.
7. 5' 링커의 On-bead 결찰
참고: 5' 링커에는 시퀀싱 후 각 샘플을 식별하는 데 사용되는 RNA 바코드가 포함되어 있습니다. 따라서 어떤 링커가 어떤 샘플에 사용되는지 확인하는 것이 절대적으로 중요합니다.
- 표 6에 기술된 혼합물 78 μL를 컬럼에 첨가한다. 2 μL의 5' 어댑터(100 μM; 표 4 참조)를 각 튜브에 넣고 18°C에서 밤새 배양합니다.
| 구성 요소 | 1배 | 7.5배 |
| 5 x PNK 버퍼 | 16 | 120 |
| ATP (10 밀리엠) | 8 | 60 |
| RNase 억제제 | 2 | 15 |
| T4 RNA 리가아제 | 4 | 30 |
| H2O | 48 | 360 |
| 최종 볼륨 | 78 μL | 585 μL |
표 6: 5' 링커 라이게이션 반응 혼합물.
- 다음 날, 비드를 500 μL의 WB I로 1x, 500 μL의 WB II로 3x로 세척하고 컬럼을 새로운 2 mL 튜브로 옮깁니다.
8. 용출, SDS-PAGE 및 RNA 추출
- 원심분리기를 4°C로 설정합니다. 용출을 위해 샘플당 두 줄의 1.5mL 튜브를 준비합니다.
- 빠른 회전으로 니켈 비드로 컬럼의 공극 부피를 회전시킵니다. 용출 튜브의 첫 번째 줄에 컬럼을 놓고 200μL의 용출 버퍼를 추가합니다. 2분 정도 기다린 다음 빠른 회전으로 버퍼가 컬럼을 통과하도록 합니다.
- 컬럼을 튜브의 두 번째 행으로 이동하고 8.2단계를 반복합니다. 이제 각 샘플에는 총 400μL의 용출액이 두 개의 1.5mL 튜브에 걸쳐 분할됩니다.
- 모든 용출액을 취하여 5mL 튜브에 함께 옮깁니다. 20mg/mL의 글리코겐 2μL를 추가합니다. 따라서 7개의 샘플을 사용하는 경우 이제 5mL 튜브에 2.8mL의 풀링된 용리액이 있게 됩니다.
- 시료당 100μL의 트리클로로아세트산(TCA)[예: 7개의 시료에 대해 TCA 700μL(풀링된 용출액 2.8mL)]을 5mL 튜브에 넣고 30초 동안 잘 세척합니다.
- 얼음 위에서 20분 동안 배양합니다.
- 탁상용 원심분리기에서 17,000 x g, 4°C에서 30분 동안 원심분리합니다.
- 원뿔형 튜브에서 상층액을 조심스럽게 제거하고 가이거 계수기로 피펫을 확인하여 펠릿이 실수로 제거되지 않았는지 확인합니다. 그렇다면 상층액을 튜브로 되돌려 놓고 10분 더 원심분리합니다.
알림: 상층액은 여전히 방사능이 높을 수 있습니다. 적절한 차폐를 사용하십시오. - 얼음처럼 차가운 아세톤 2mL에 펠릿을 완전히 재현탁합니다.
- 17,000 x g, 4°C에서 15분 동안 원심분리합니다.
- P1000 피펫으로 가능한 한 많은 아세톤을 제거하십시오. 그런 다음 튜브를 짧게 돌려 작은 아세톤 방울을 모은 다음 P10 피펫으로 제거합니다. 흄 후드에서 2분 동안 건조시킵니다.
알림: 아세톤 상청액은 여전히 방사성일 수 있습니다. 적절한 차폐를 사용하십시오. - 30μL의 1x 단백질 로딩 완충액에 시료를 재현탁합니다. 펠릿이 적절하게 재현탁되었는지 확인하려면 P200 피펫에서 용액을 제거하고 가이거 계수기를 사용하여 1.5mL 튜브에 남아 있는 활성을 측정하여 대부분의 방사능이 로딩 버퍼에 존재하고 1.5mL 튜브에 남아 있지 않은지 확인합니다.
- 샘플을 65°C에서 10분 동안 가열합니다. 1 mm, 4–12% 프리캐스트 Bis-Tris 겔에 로드하고 MOPS 버퍼에서 125 V에서 1.5시간 동안 실행합니다.
- 젤 작동이 끝나면 젤 카세트를 엽니다. 젤은 바닥 판에 유지되어야합니다. 상단을 폐기하십시오.
- 젤을 접착 필름으로 감싼 다음 테이프를 사용하여 빛이 새지 않는 카세트 내부에 고정합니다. 카세트에 증폭 신호를 개선하기 위한 화면이 있습니다.
- 자가방사선 촬영 필름을 겔에 노출시키고 노광 동안 카세트를 -80°C에서 보관합니다. 노출 시간은 서로 다른 가교 효율을 가진 단백질마다 다릅니다.
- 필름을 배치할 때 후속 단계에서 관심 밴드를 잘라내기 위해 필름을 카세트에 다시 정렬하는 방법이 있어야 합니다. 이를 위해 형광등을 사용하고 젤이 카세트의 모서리에 있는지 확인한 다음 맨 위 모서리에 놓인 필름으로 덮습니다.
알림: 일반적으로 가이거 계수기에 표시될 때 최소 ~250cps의 판독값을 제공하는 로딩 버퍼의 용출액은 3시간 노출에 대한 충분한 신호를 제공합니다. 그렇지 않으면 야간 노출이 수행됩니다.
- 필름을 배치할 때 후속 단계에서 관심 밴드를 잘라내기 위해 필름을 카세트에 다시 정렬하는 방법이 있어야 합니다. 이를 위해 형광등을 사용하고 젤이 카세트의 모서리에 있는지 확인한 다음 맨 위 모서리에 놓인 필름으로 덮습니다.
- 필름을 현상합니다. 젤을 덮고 있는 접착 필름을 잘라내되 젤을 움직이지 마십시오. 그렇지 않으면 이미지가 젤에서 오프셋됩니다.
알림: 젤은 방사능이 높을 수 있습니다. 젤 슬라이스를 절단할 때 적절한 차폐를 사용해야 합니다. - 젤 위에 필름을 놓고 관심 밴드를 절제하십시오. 젤 슬라이스를 2mL 튜브에 넣습니다.
- P1000 피펫 팁을 사용하여 겔 슬라이스를 부수고 600μL의 프로테이나제 K 완충액과 200μg의 프로테이나제 K를 추가합니다(이 프로토콜은 20mg/mL 프로테이나제 K 용액 10μL을 사용함). 격렬하게 진탕하면서 55°C에서 2시간 동안 배양합니다.
- 그런 다음 깨끗한 메스로 P1000 팁의 끝을 잘라내고 상층액과 젤 조각을 2mL 튜브에 넣은 스핀 컬럼으로 옮깁니다.
- RT에서 17,000 x g 에서 1분 동안 컬럼을 회전합니다. 방사성 분리된 RNA를 포함하는 플로우 스루를 수집합니다.
- 페놀:클로로포름 추출을 수행합니다.
- 3M 아세트산나트륨 50μL, pH = 5.2, 페놀:클로로포름 500μL를 넣고 잘 소용돌이칩니다. 17,000 x g에서 5분간 돌립니다. 수성 최상층을 제거하고 새 1.5mL 튜브에 넣습니다.
- 500 μL의 클로로포름을 첨가하고 10-15 초 동안 격렬하게 소용돌이칩니다. RT에서 17,000 x g 에서 5분 동안 회전합니다. 수성 층을 제거하고 새 1.5mL 튜브에 넣습니다.
- 20mg/mL 글리코겐 1μL와 얼음처럼 차가운 96% 에탄올 1mL를 추가합니다. -80°C에서 30분 동안 또는 -20°C에서 하룻밤 동안 침전시킨다.
- 4°C, 17,000 x g에서 30분 동안 원심분리합니다. 상층액을 제거하고, 500 μL의 70% 에탄올을 첨가하고, 17,000 x g에서 4°C에서 5분 동안 원심분리한다. 모든 에탄올을 제거하고 빠른 회전을 수행하여 잔류물을 모으고 P10 피펫으로 과잉을 제거합니다.
- 흄 후드에서 ~3분 동안 펠릿을 건조시킵니다. DEPC 처리수 20μL에 재현탁합니다.
- RNA를 -80°C에서 하룻밤 동안 보관하거나 즉시 역전사 단계를 진행한다.
9. 역전사
- 20μL의 RNA에 10μL의 10μM RT 올리고(PE_reverse, 표 7 참조)와 4μL의 5mM dNTP를 추가합니다.
| 올리고뉴클레오티드 이름 | 시퀀스 (5'-3') | |||
| P5 앞으로 | AATGATACGGCGACCACCGAGATCTACACTCTTTCCCTACACGACGCTCTTCCGATCT | |||
| 기원전 1 | CAAGCAGAAGACGGCATACGAGATCGTGATGTGACTGGAGTTCAGACGTGTGCTCTTCCGATCT | |||
| 기원전 3 | CAAGCAGAAGACGGCATACGAGATGCCTAAGTGACTGGAGTTCAGACGTGTGCTCTTCCGATCT | |||
| 기원전 4 | CAAGCAGAAGACGGCATACGAGATTGGTCAGTGACTGGAGTTCAGACGTGTGCTCTTCCGATCT | |||
| 기원전 5 | CAAGCAGAAGACGGCATACGAGATCACTGTGTGACTGGAGTTCAGACGTGTGCTCTTCCGATCT | |||
| 기원전 7 | CAAGCAGAAGACGGCATACGAGATCAGATCGTGACTGGAGTTCAGACGTGTGCTCTTCCGATCT | |||
| 기원전 8년 | CAAGCAGAAGACGGCATACGAGATTAGCTTGTGACTGGAGTTCAGACGTGTGCTCTTCCGATCT | |||
| 기원전 9 | CAAGCAGAAGACGGCATACGAGATGATCAGGTGACTGGAGTTCAGACGTGTGCTCTTCCGATCT | |||
| 기원전 10 | CAAGCAGAAGACGGCATACGAGATATCACGGTGACTGGAGTTCAGACGTGTGCTCTTCCGATCT | |||
| PE_reverse | CAGACGTGTGCTCTTCCGATCT | |||
표 7: PCR 프라이머 (바코드 서열 포함) 및 역전사 프라이머.
- 85°C에서 3분 동안 예열된 써모블록으로 옮긴 다음 얼음에서 5분 동안 급속 냉각합니다. 간단한 원심분리로 튜브의 내용물을 수집한 다음 8μL의 5x 역전사효소 완충액, 2μL의 100mM DTT 및 2μL의 RNase 억제제를 추가합니다.
- 혼합물을 50°C에서 3분 동안 인큐베이션한 다음 역전사효소 2μL를 첨가하고 50°C에서 1시간 동안 인큐베이션합니다.
- 역전사효소를 65°C에서 15분 동안 인큐베이션하여 불활성화시킨다.
- 튜브를 37°C로 예열된 써모블록으로 옮기고 3분 동안 그대로 두어 순응시킵니다.
- 2 μL의 RNase H를 첨가하고 37°C에서 30분 동안 배양한다.
- SPRI 비드를 사용하여 cDNA를 분리합니다.
- 두 부피의 84μL 비드를 추가합니다. 15 분 동안 배양하십시오. 구슬을 마그네틱 랙에 놓고 1분 동안 그대로 두어 구슬을 수확합니다.
- 상청액을 제거하고 폐기하고 70% 에탄올 200μL를 추가합니다. 마그네틱 랙에서 비드를 제거하지 마십시오. 비드를 에탄올과 함께 30초 동안 배양합니다.
- 에탄올을 제거하고 세척 단계를 반복하십시오. P10 팁을 사용하여 잔류 에탄올을 모두 제거합니다.
- 구슬을 흄 후드에 2분 동안 넣어 건조시킵니다. 랙에서 비드를 제거하고 12μL의 물에 다시 현탁한 다음 비드를 랙에 다시 놓습니다. 11 μL의 상청액을 제거합니다.
- cDNA를 -20°C에서 동결시키거나 PCR 단계를 즉시 진행한다.
10. qPCR 반응
- cDNA의 증폭을 위한 최종 PCR 전에, 라이브러리의 과증폭을 방지하기 위해 cDNA를 증폭하기 위한 최적의 사이클 수를 확인하기 위해 정량적 중합효소 연쇄 반응(qPCR)을 수행합니다.
- 표 8에 따라 얼음 상에서 qPCR 반응을 설정한다. 모든 프라이머에 대해서는 표 7을 참조하십시오.
| 구성 요소 | 1배 |
| 2x qPCR 반응 마스터믹스 | 5 |
| 0.1 μM P5 프라이머(순방향) | 0.8 |
| 0.1 μM BC 프라이머(역방향) | 0.8 |
| cDNA(또는 음성 대조군으로서의 물) | 1 |
| H2O | 2.4 |
| 최종 볼륨 | 10 μL |
표 8: qPCR 반응 혼합물.
- 증폭에 필요한 주기의 적절한 정량화를 위해 cDNA에 대한 3개의 기술적 복제물과 3개의 음성(즉, 물) 대조군을 사용하십시오.
- 광학 투명 필름으로 플레이트를 밀봉하고 키트 제조업체의 지침에 따라 qPCR을 실행합니다.
- 절대 정량화 방법을 통해 샘플을 분석하여 지수 성장의 무릎에 도달하는 사이클 수(n)를 식별합니다(예를 들어 그림 4C 참조). 이 사이클 수는 나머지 cDNA의 최종 증폭에 사용됩니다.
11. PCR 반응 및 겔 추출
- 표 9에 따라 얼음 위에 PCR 반응을 설정한다. 모든 프라이머에 대해서는 표 7을 참조하십시오.
참고: 5μL의 cDNA 라이브러리만 사용됩니다.
| 구성 요소 | 1배 |
| 10 x 교정 판독 중합효소 버퍼 | 5 |
| 10 μM P5 프라이머(정방향) | 1 |
| 10 μM BC 프라이머(역방향) | 1 |
| 5mM dNTP | 2.5 |
| 증거 판독 중합효소 효소 | 1 |
| 씨디엔(cDNA) | 5 |
| H2O | 34.5 |
| 최종 볼륨 | 50 μL |
표 9: PCR 반응 혼합물.
- 다음과 같이 PCR을 실행하십시오: 95°C에서 2분; 20초 동안 98°C, 30초 동안 52°C, 1분 동안 72°C의 n 사이클; 및 72°C에서 5분 동안 반응합니다. χCRAC 라이브러리를 증폭하기 위한 사이클의 수(n)는 섹션 10에 기술된 qPCR에 의해 결정된다.
- 1 μL의 엑소뉴클레아제 I을 첨가하고, 37°C에서 60분 동안 인큐베이션한다.
- 2 부피의 비드 (즉, 100 μL)를 사용하여 전술한 바와 같이 SPRI 비드를 사용하여 증폭된 cDNA를 세척한다. 11 μL로 용리한다.
- 3μL의 6x 로딩 염료를 추가하고 1x TBE 버퍼에서 1시간 동안 100V에서 프리캐스트된 6% TBE 겔에서 실행합니다. 짧은 DNA 단편의 정량화에 적합한 사다리를 사용하십시오.
- 완료되면 카세트에서 젤을 제거하고 젤을 덮을 수 있을 만큼 충분한 1x TBE가 담긴 적절한 액체 밀폐 용기에 넣습니다(예: ~50mL). 적절한 양의 SYBR 안전 염료를 추가합니다(예: 50mL의 경우 10,000x 염료 5μL 사용).
- RT에서 15분 동안 부드러운 혼합을 통해 젤이 얼룩지도록 합니다. SYBR 함유 1x TBE를 배출하고 깨끗한 1x TBE로 교체합니다. RT에서 부드럽게 흔들면서 젤을 10 분 동안 씻으십시오.
- 1x TBE를 배출하고 젤을 투명 폴더에 넣습니다. 폴더를 적절한 크기로 자릅니다.
- 인광계와 같은 적절한 수단을 통해 겔을 이미지화합니다. ~175 bp에서 ~400 bp 사이의 DNA 단편을 소비합니다. 젤 슬라이스를 1.5mL 튜브에 넣습니다.
- P1000 팁을 사용하여 겔 슬라이스를 완전히 분쇄하고 400 μL의 H2O를 첨가하고 thermoblock에서 1 시간 동안 흔들면서 37 °C에서 인큐베이션합니다.
- 샘플을 드라이 아이스에서 10분 동안 동결한 다음 1시간 동안 진탕하면서 37°C의 써모블록에 다시 넣습니다.
- 필터 컬럼을 가져 와서 두 개의 유리 마이크로 화이버 필터를 내부에 삽입하여 필터 단위를 만듭니다. 장치를 1.5mL 튜브에 넣습니다.
- 깨끗한 메스로 P1000 팁의 끝을 잘라내고 으깬 TBE 겔 현탁액을 흡수한 다음 11.12단계에서 만든 필터 장치에 분배합니다. 17,000 x g 에서 30초 동안 회전합니다.
- 1 μL의 글리코겐과 40 μL의 아세트산 나트륨, pH = 5.2 및 1 mL의 96 % 에탄올을 상청액에 첨가합니다. -80°C에서 30분 동안 배양합니다.
- 17,000 x g, 4°C에서 30분 동안 원심분리합니다. 상청액을 버리고 500 μL의 70 % 에탄올로 세척하십시오.
- 5분 동안 회전하고 에탄올을 완전히 제거한 다음 흄 후드에서 펠릿을 3분 동안 건조시킵니다.
- 10 μL의H2O에 재현탁하고 DNA 농도를 측정한다.
결과
χCRAC 방법의 효능을 입증하기 위해, HTP-tagged Nrd1 단백질을 발현하는 효모 균주에 대한 시간 경과 실험을 수행하였다. 이 방법의 작동 방식을 설명하는 자세한 회로도는 그림 1에 나와 있습니다. Nab3와 마찬가지로, Nrd1은 다양한 RNA 전사체의 핵 RNA 붕괴에 관여한다37. Corden 연구실의 이전 연구에서는 세포가 포도당 기아에 노출될 때 RNA 표적에 대한 Nrd1 결합이 크게 변한다고 제안했습니다28,38. 이와 같이, 포도당을 함유한 배지(SD-TRP)에서 기하급수적으로 성장하는 세포는 Nrd1-RNA 상호작용의 동적 변화를 모니터링하기 위해 시간 경과에 따라 포도당이 없는 동일한 배지(S-TRP)로 이동되었습니다. 샘플을 채취하여 Vari-X-linker 챔버(그림 3A)에서 교대 전과 1, 2, 4, 8, 14 및 20분 후에 가교했습니다. 세포 성장에 사용된 배지는 이 방향족 아미노산에 의한 UV 흡수를 감소시키기 위해 의도적으로 트립토판이 결핍되었습니다. 배지를 고압 증기 멸균하면 설탕이 캐러멜 화 될 수 있으므로 필터 멸균 된 합성 배지를 사용하는 것이 가장 좋습니다. 그러면 가교 효율이 감소합니다.
도 4A 는 χCRAC 실험으로부터의 대표적인 자가방사선 사진을 나타낸다. 이 예제에서는 샘플이 함께 풀링되지 않았습니다. 대신에, 각각을 겔 상에서 개별적으로 실행하였다. 이것은 단백질이 테스트된 모든 시점에서 RNA에 효과적으로 가교된다는 것을 보여주기 위한 초기 실험 테스트에 권장됩니다. RBP의 예상 분자량에서 특히 강렬한 신호가 관찰되었는데, 이는 시퀀싱이 불가능한 매우 짧은 방사성 표지 RNA에 결합 된 단백질을 나타냅니다. 따라서, 더 긴 RNA 단편에 가교된 단백질인 이 밴드 위의 smeary signal이 분리되었습니다. 단편은 단백질 밴드 바로 위에서 약 30kDa를 더한 상태에서 절단되었습니다. 그림 4B 는 절제 후 자가방사선사진을 보여주며, 단백질은 겔에 남아 있는 짧은 RNA에 가교 결합되고 이전에 절제된 신호는 이제 절제되었습니다.
역전사 후 PCR을 사용하여 cDNA 라이브러리를 증폭해야 합니다. 그러나 라이브러리의 과증폭은 중합효소에 의해 우선적으로 증폭된 서열에 대한 편향을 도입하고 PCR 아티팩트를 생성할 수 있으므로 피해야 합니다. 과증폭된 라이브러리에는 시퀀서에서 읽기를 낭비하는 많은 수의 중복 시퀀스도 포함되어 있습니다. 최종 라이브러리의 증폭을 위한 이상적인 PCR 사이클 수를 계산하기 위해, cDNA의 분취량을 P5 및 BC 올리고뉴클레오티드를 사용하여 qPCR을 통해 증폭하였다. 라이브러리가 피크 형광에 도달한 첫 번째 주기가 PCR 주기 수로 선택되었습니다. 그림 4C 는 16의 피크 사이클 카운트를 산출한 일반적인 cDNA 라이브러리의 qPCR의 예를 제공합니다. 이어서, 이 값을 최종 χCRAC PCR에 사용하였다. 시퀀싱된 데이터를 처리하기 위해 실험실에서 이전에 개발한 소프트웨어(pyCRAC)와 키네틱 CRAC 데이터 분석을 위한 해당 파이프라인을 사용했습니다(Nues et al., 2017; https://git.ecdf.ed.ac.uk/sgrannem/pycrac, https://bitbucket.org/sgrann/kinetic_crac_pipeline/src/default/). 이러한 오픈 소스 소프트웨어 툴은 데이터의 역다중화 및 트리밍, PCR 중복의 제거, 통계적으로 유의한 피크의 식별, 연속적인 서열로의 클러스터 판독 및 결합 모티프의 식별을 가능하게 한다(39). 이러한 도구의 작동 방식에 대한 자세한 내용은 해당 웹 페이지에서 확인할 수 있습니다.
우리는 또한 포유류 세포에 대한 χCRAC 프로토콜을 개발하기 시작했습니다. 대부분의 포유류 세포주는 단층으로 성장하며 UV 투과성 백이 있는 가교제의 트레이는 부착 세포 실험에 적합하지 않습니다. 이 문제를 극복하기 위해 우리는 사용자가 부착 세포로 1-2개의 페트리 접시(직경 150mm, 깊이 25mm)에 UV를 조사할 수 있는 단계를 개발했습니다(그림 3B). 첫 번째 테스트로서, 포유류 세포에 대한 가교제의 효율은 항-GFP 항체 및 전통적인 CLIP 기반 정제를 사용하여 안정적으로 태그된 GFP-RBM7의 가교 및 포획을 통해 측정되었습니다. 도 5A에 나타낸 바와 같이, 가교제는 널리 사용되는 UV 조사 장치에 필적하는 효율로 254nm UV 조사를 사용하여 단층으로 성장한 포유동물 세포로부터 단백질-RNA 복합체를 회수할 수 있었다. 그러나 UV 가교 실험에 일반적으로 사용되는 표준 세포 배양 플라스틱웨어는 254nm UV까지 침투할 수 없습니다. 따라서 우리의 가교제에서 세포는 UV 램프의 상부 뱅크에서만 조사를받습니다. 이를 극복하기 위해 우리는 세포 성장과 가교를 위한 UV 투과성 석영 페트리 접시를 개발했습니다. 석영 배양기구를 사용하면 2초의 UV 조사만으로 단백질-RNA 복합체의 강력한 회수율이 나타났습니다(그림 5B). CLIP 기술과 같은 포유류 세포에 대한 RBP 포획 방법과 결합할 때, 이러한 짧은 가교 시간은 유전독성 스트레스 또는 단백질 인자의 급격한 고갈에 대한 반응으로 RBP의 시공간 RNA 결합 프로파일을 회복하기 위한 시간 경과에 따라 또는 전사 또는 세포 주기 동기화와 병행하여 사용할 수 있습니다.
그림 6 은 χCRAC 파이프라인에 의해 처리되는 Nrd1 데이터의 몇 가지 예를 보여줍니다. 이 그림은 파이프라인에서 생성된 베드그래프 파일과 python GenomeBrowser 패키지(https://pypi.org/project/GenomeBrowser/1.6.3/)를 사용하여 준비되었으며, 데이터의 출판 품질 게놈 브라우저 이미지를 간단하게 만들 수 있도록 설계되었습니다. 회색 직사각형은 CUT(cryptic unstable transcript), SUT(stable uncharacterized transcript)40 및 Xrn1 민감성 불안정 전사체(XUT)41와 같은 비암호화 RNA를 발현하는 게놈 영역을 나타냅니다. 도 6 의 데이터는 Nrd1이 이들 비암호화 RNA 전사체의 다수에 결합한다는 것을 보여주며, 이는 이 단백질이 이 부류의 전사체의 분해에 관여한다는 생각과 일치한다42. 그림 6A 는 염색체 IV의 ~15kb 영역을 보여줍니다. 여기에서 고친화성 글루코스 수송체 HXT6 및 HXT7을 코딩하는 전사체에 대한 Nrd1의 결합이 유의하게 증가되었으며, 둘 다 글루코스 기아 동안 상향조절됩니다. NNS 복합체에 의한 전사 종결은 포도당 기아 동안 이들 유전자의 유도 동역학에 영향을 미칠 수 있습니다. 도 6B 는 Nab3에 의해 조절되는 것으로 알려져 있는 Imd3 전사체에 대한 Nrd1 가교결합의 예를 나타낸다(43). 이 경우 데이터는 포도당 기아에 대한 결합의 현저한 감소를 보여주었습니다. 이전 연구는 포도당 기아 동안 Tye3 전사체에 대한 Nab7의 결합이 감소한 것으로 나타났습니다44. 이러한 관찰과 일관되게, χCRAC 데이터는 Nrd1의 결합이 포도당 결핍 동안 감소하고 Tye7에 대한 Nrd1 가교결합이 스트레스 8분 후에 가장 낮았다는 것을 시사한다(그림 4C). 그러나 이 효과는 14분의 포도당 결핍 후 Nrd1 결합이 시작 수준으로 돌아갔기 때문에 일시적인 것으로 보입니다.
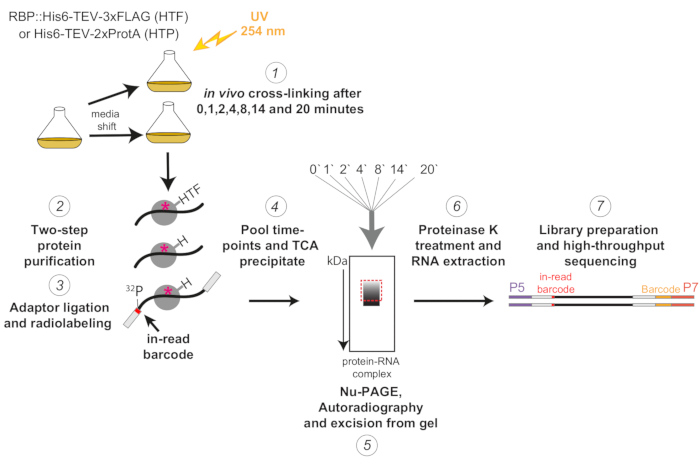
그림 1 : χCRAC 프로토콜의 개략도. 태그된 균주는 원하는 밀도가 될 때까지 성장시켰다. RBP는 RNA 결합 단백질을 나타냅니다. 그 후, 기준 샘플을 채취하여 254nm UV 광으로 가교시켰습니다. 나머지 세포는 여과에 의해 수확된 후 스트레스 유도 배지로 빠르게 이동되었습니다. 여기에 설명된 χCRAC 실험을 위해 샘플을 채취하여 교대 후 1, 2, 4, 8, 14 및 20분에 가교했습니다(1). 그런 다음 매우 엄격한 2단계 친화성 정제(2)를 사용하여 관심 RBP를 정제했습니다. 다음으로, 포획된 가교 결합된 RNA를 RNase로 부분적으로 소화하고, 5' 말단에서 방사성 표지하고, 어댑터를 그 위에 라이게이션했습니다(3). 5' 어댑터에는 고유한 "판독 중" 바코드 시퀀스가 포함되어 있어 시퀀싱 후 개별 샘플을 생물정보학적으로 분리할 수 있습니다. 그런 다음 RBP-RNA 복합체를 함께 용리, 풀링 및 침전시키고(4), SDS-PAGE로 분해하고, 자가방사선 촬영을 통해 시각화했습니다(5). 이어서, 자가방사선 촬영 이미지에서 빨간색 점선 상자로 표시된 주 대역 바로 위의 방사성 신호를 포함하는 단일 겔 슬라이스를 겔(5)에서 절단했습니다. 겔 슬라이스를 프로테아제 K로 처리하고 RNA를 연속적으로 추출하고(6), cDNA로 전환하고, PCR을 통해 증폭했습니다(7). PCR 단계에서는 추가 바코드(P7 oligo에 의해 도입된 노란색 블록)를 도입하여 많은 라이브러리를 단일 레인으로 다중화할 수 있었습니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.

그림 2: 가교 및 진공 여과. (a) 가교제. 세포 현탁액을 기계의 오른쪽 상단에 위치한 깔때기에 붓고(클로즈업은 그림 3A 참조) 중간 트레이에 있는 UV 투명 백에 보관합니다. 이 가방 옆에는 사용자가 조사 단계를 시작하도록 기계에 지시할 때까지 닫힌 상태로 유지되는 두 개의 셔터가 있습니다. 세포는 위와 아래 트레이에서 UV 광선을 조사합니다. 이 기계에는 254 및 365 nm UV 램프가 제공되며 후자는 PAR-CLIP 실험에 적용 할 수 있습니다. 기계는 오른쪽 상단에 있는 터치스크린 패널을 통해 작동되어 UV 복용량 또는 노출 시간을 제어할 수 있습니다. (B) 가교 후 셀은 기계의 왼쪽에서 배출됩니다. 세포 현탁액은 진공을 통해 회수되고 유리 플라스크로 배출되어 수확을 위해 진공 여과 장치에 부어 질 수 있습니다. (C) 진공 여과 장치. 이들은 클립을 통해 열리고 닫히며 그 사이에 필터가 삽입됩니다. 필터 교체로 인한 시간 손실이 없도록 매우 짧은 시계열 동안 4개의 여과 장치를 병렬로 사용했습니다. (D) 여과 후, 배지 상청액을 후속 폐기를 위해 플라스크 내로 배출하였다. 밸브는 필터가 제거될 때 시스템의 진공을 유지하기 위해 진공 여과 장치 아래에 설치되었습니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.

그림 3: 부유 세포와 부착 세포의 교차 결합. (a) 현탁 세포용 Vari-X-linker 챔버를 갖는 가교제. 세포 배양액을 트레이의 오른쪽 상단에 있는 샘플 주입구(깔때기)에 붓습니다. (B) 부착 세포 또는 소량의 현탁 세포를 가교하기 위한 플라스틱 또는 석영 페트리 접시를 담을 수 있는 트레이. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.

그림 4: 라이브러리 준비. (A) Nrd1-HTP χCRAC 실험의 자가방사선사진의 예. 강하고 농축된 신호는 매우 짧은 RNA에 가교된 단백질을 나타내는 반면, 위의 스미어는 시퀀싱에 충분한 길이의 RNA에 가교된 단백질을 나타냅니다. (B) 도말은 겔 절제 후 촬영한 자가방사선사진에 표시된 대로 절제되었습니다. (C) χCRAC cDNA 라이브러리의 대표적인 qPCR. 이 예에서, cDNA의 최대 증폭은 16 사이클에서 도달하였다. 따라서, 최종 증폭을 위해 16 사이클이 사용되었다. 오차 막대는 세 가지 기술 qPCR 반복실험의 표준 편차를 나타냅니다. (D) 6% TBE 겔 상의 cDNA 라이브러리로부터의 인광상의 예. (e) 칩 기반 모세관 전기영동으로부터의 cDNA 길이 및 품질 분석. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
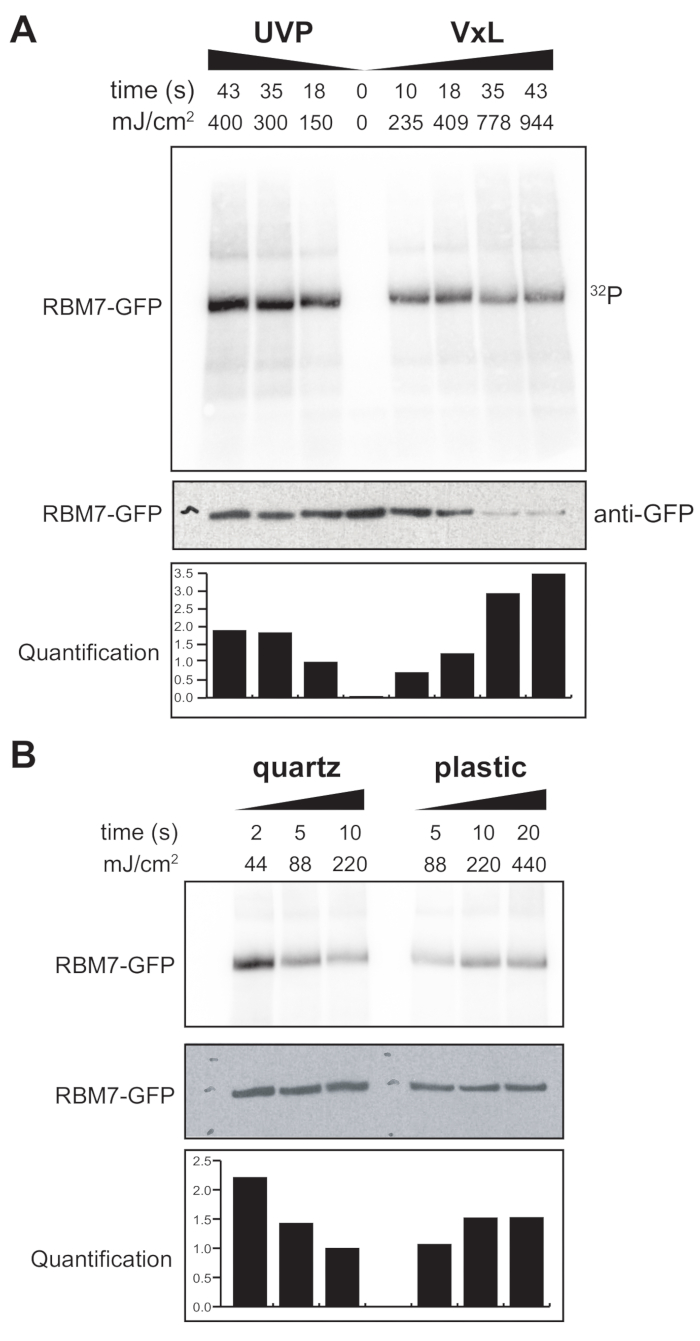
그림 5: 포유류 세포에서 가교를 테스트하기 위한 High RNase 테스트 iCLIP 실험. GFP-RBM7 iCLIP 실험의 자가방사선 사진은 다양한 가교 에너지에 걸쳐 RNP 회수 효율을 테스트한 것입니다. GFP-RBM7을 안정적으로 발현하는 가교 세포의 자성 비드에 결합된 항-GFP 항체를 사용하여 면역침전을 수행했습니다. 면역침전물은 관련 RNA를 짧고 균일한 길이로 트리밍하기 위해 고농도의 RNase I과 함께 배양되었습니다. RNP는 32P표지 및 SDS-PAGE에 의해 시각화되었고, 가교되지 않은 단백질의 이동에 가까운 정의된 밴드로 이동하였다. 정량화는 항 GFP 웨스턴 블롯 신호로 표준화 된 방사성 표지 된 RBM7-RNA 신호의 밀도 측정 분석 결과를 나타낸다. (a) 일반적으로 사용되는 UVP 가교제 대 당사의 가교제의 가교 시간 경과(Vari-X-linker; (B) 석영(왼쪽)과 플라스틱(오른쪽) 배양 기구에 대한 가교제의 가교 시간 경과. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
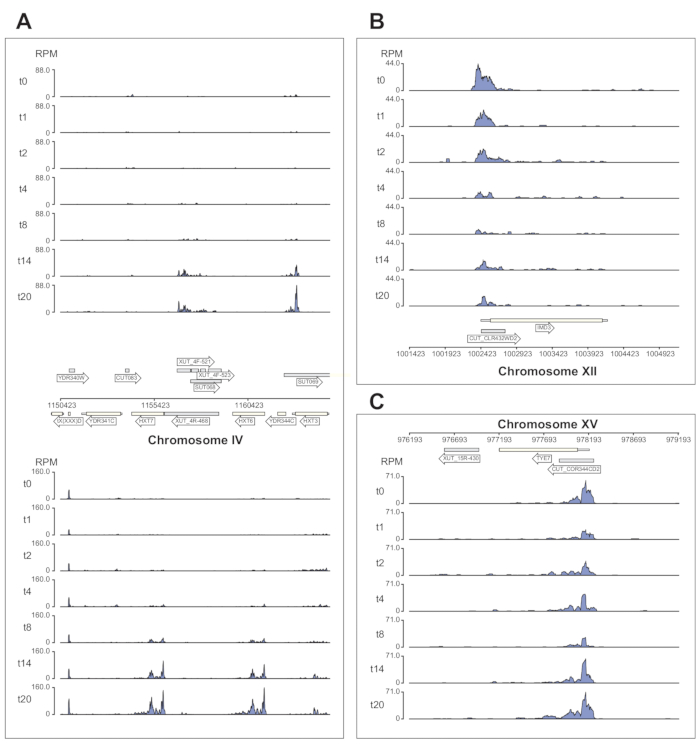
그림 6: 표적에 대한 Nrd1의 차등적, 시간적 결합을 보여주는 χCRAC의 힘을 보여주는 게놈 브라우저 플롯의 예. 각 상자에는 개별 게놈 영역에 대한 플롯이 표시됩니다. 화살표는 유전자가 인코딩되는 가닥을 나타냅니다(왼쪽 가리킴 화살표 = 마이너스 가닥, 오른쪽 가리킴 화살표 = 더하기 가닥). 시점(min)은 각 서브플롯의 y축에 t0, t1, t2 등으로 표시됩니다. 염색체와 좌표를 나타내는 로마 숫자가 표시됩니다. (A) 포도당 결핍 시, Nrd1은 두 개의 고친화성 포도당 수송체인 HXT6 및 HXT7에 결합하며, 둘 다 이 상태에서 상향 조절됩니다. (B) Nrd1은 이미 검증된 Nab344의 표적인 Imd3에 결합하는 것으로 관찰되며, 포도당 결핍 후 강도가 감소합니다. (C) Tye7의 Nrd1 결합은 역동적이고 일시적인 성질을 나타내며, 포도당 결핍 후 8 분의 스트레스 후 최소로 감소한다. 그러나 결합은 이후 14분 후에 기저 수준으로 돌아갑니다. 읽기는 "백만당 읽기 수"(RPM; y축)로 정규화되었습니다. 회색 상자는 비암호화 RNA를 인코딩하는 영역을 나타냅니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
토론
새로운 가교 및 세포 수확 장치와 결합된 χCRAC 방법은 광범위한 모델 유기체에 적용할 수 있고 따라서 RNA 분야에서 일반적으로 관심을 가져야 하기 때문에 큰 잠재력을 가지고 있습니다. χCRAC를 활용할 수 있는 영역이 많이 있습니다. 예를 들어, 이 방법은 종종 단백질과 RNA 분자 사이의 동적 상호작용을 포함하는 스플라이소좀 및 리보솜과 같은 큰 거대분자 복합체로 단백질의 계층적 조립을 측정하는 데 사용할 수 있습니다. 우리는 또한 세포가 다양한 종류의 스트레스를 받을 때 RNA 붕괴 인자와 기질 사이의 상호 작용을 모니터링하는 데 일상적으로 사용합니다. 이를 통해 우리는 이러한 요인이 가장 활동적인 적응 반응의 단계, 결합하는 기질 및 이러한 상호 작용이 얼마나 역동적인지 결정할 수 있습니다. 이러한 데이터를 통해 연구자는 환경 변화에 적응하는 데 있어 각 요소의 상대적 기여도를 결정할 수 있어야 합니다.
χCRAC는 이중 친화성 정제 태그(HTF 또는 HTP)를 사용하여 매우 엄격하고 변성되는 조건에서 단백질을 정제합니다. 이는 관심 단백질에 공유 가교된 RNA에 대해 공동정제된 RNA가 고도로 농축되도록 합니다. 그러나 선호도 태그에 의존하는 것은 단점이 있습니다. 예를 들어, 태그는 단백질 기능을 방해하여 RNA 결합 상호 작용체의 왜곡된 판독값을 제공할 수 있습니다. 또한 일부 모델 유기체의 경우 DNA 단편을 게놈에 통합하거나 발현 플라스미드를 변형시키는 유전 도구가 아직 제공되지 않기 때문에 태그를 활용하는 것이 항상 가능하지 않을 수 있습니다. 그러나 RBP의 정제를 위해 항체에 의존하는 CLIP 기반 프로토콜과 호환되도록 χCRAC 프로토콜의 일부를 변경하는 것은 간단합니다. 실제로 이 연구는 iCLIP 기반 정제를 당사의 가교제와 결합하는 것이 가능하다는 것을 보여주었습니다. 우리는 현재 인간 RNA 결합 단백질과 초기 RNA 전사체의 시간적 연관성을 연구하기 위한 CLIP 프로토콜을 개발하는 과정에 있습니다.
새로운 단백질에 대해 χCRAC를 수행할 때 최대 가교를 유도하기 위해 UV 노출을 최적화해야 합니다. 이는 높은 UV 노출이 정제 단계에서 RNA의 회수율을 감소시킬 수 있기 때문에 중요합니다. 재조합 RBP를 발현하는 세포를 다양한 UV 용량, 100 mJ/cm2, 250 mJ/cm2, 500 mJ/cm2 및 1 J/cm2에 노출시켰다. 그런 다음 RNP를 포획하고 RNA를 단편화하고 방사성 표지했습니다. 그 후, RNP는 SDS-PAGE에 의해 해결되었고 어떤 노출이 가장 강렬한 신호(즉, 최대 가교)를 제공했는지 추론하기 위해 자가방사선사진을 촬영했습니다.
실험 조건이 최적화되면 χCRAC를 수행할 때 몇 가지 제어 실험이 권장됩니다. 먼저, UV 조사된, 태그되지 않은 샘플을 사용하여 정제 비드에 대한 백그라운드 결합을 모니터링할 수 있습니다. 둘째, 교대 실험 중에 χCRAC를 적용할 때 세포가 원래 배지로 다시 이동하는 두 번째 시계열은 세포 자체의 여과가 RNA 수준 또는 단백질-RNA 상호 작용의 변화를 유도하는지 여부를 조사할 수 있습니다.
서론에서 언급했듯이 최근에 발표된 수많은 논문은 CLIP 프로토콜에 대한 여러 가지 최적화를 제안합니다. 여기에는 적외선 스캐닝(10)을 통해 단백질-RNA 복합체를 검출하기 위한 형광 표지된 어댑터의 사용뿐만 아니라 결과 라이브러리(12,45)의 복잡성을 증가시키는 것으로 나타난 다양한 핵산 정제 및 크기 선택 단계에 대한 최적화가 포함됩니다. 우리는 현재 χCRAC 프로토콜을 더욱 구체화하기 위해 이러한 개선 사항 중 일부를 구현하고 있습니다. 여기에 제시된 프로토콜에는 데이터의 복잡성을 증가시키는 원래 CRAC 및 χCRAC 프로토콜에 대한 여러 개선 사항이 이미 포함되어 있습니다. 예를 들어, 이전에는 SDS-PAGE 겔 상에서 가교 결합 된 방사성 단백질 - RNA 복합체를 분해 한 후, 니트로 셀룰로오스 막으로 옮기고 가교 된 RNA를 블롯으로부터 분리시켰다. 그러나, RNP의 전달 및 후속 RNA 추출은 특히 RNA 중합효소 서브유닛과 같은 큰 RBP를 다룰 때 매우 비효율적일 수 있다. 이는 가교된 RNA의 회수율을 현저히 감소시킬 수 있다. 현재 프로토콜에서 가교된 RNA는 그림 1과 같이 SDS-PAGE 겔 슬라이스에서 직접 추출됩니다. 이것은 가교 된 RNA의 회수율을 증가 시켰습니다. 또한, cDNA의 PCR 증폭 후 생성물은 원래 3%, 저융점 온도의 아가로스 겔에서 분해된 다음 겔에서 175-300bp PCR 산물을 추출했습니다. 그러나 이러한 젤은 쉽게 과부하가 걸릴 수 있으므로 DNA가 매우 잘 분리되지 않습니다. 아가로스 겔을 프리캐스트 TBE 겔로 대체하면 보다 일관된 크기 분리와 PCR 산물의 더 나은 회수율이 나타났습니다.
공개
A. Langford와 W. Worboys는 상업 회사인 UVO3에 소속되어 있습니다. 그들은 연구 설계, 데이터 수집 및 해석, 출판을 위해 작업을 제출하기로 한 결정에 아무런 역할도 하지 않았습니다.
감사의 말
이 연구는 Wellcome Trust(091549에서 SG로, 109093/Z/15/A에서 SM으로), Wellcome Trust Center for Cell Biology 핵심 보조금(092076) 및 Medical Research Council Non-Clinical Senior Research Fellowship(MR/R008205/1 to SG), 장기 박사후 연구원(ALTF 1070-2017에서 RC)의 유럽 분자 생물학 기구(ALTF 1070-2017 to R.A.C)의 보조금으로 지원되었습니다. 덴마크 독립 연구 기금 (THJ).
자료
| Name | Company | Catalog Number | Comments |
| 1,4-dithioreitol | Merck | 10708984001 | Buffer component in mammalian cell lysis |
| 1.5 mL tubes | Eppendorf | 0030 120.086 | General reaction tube |
| 2 mL tubes | Eppendorf | 0030 123.344 | For holding columns and collection of waste |
| 32P-yATP | Perkin Elmer | NEG502Z-250 | For radiolabelling the 5' end of the RNA |
| 4-12% Bis-Tris gel | Invitrogen | NP0321BOX | SDS-PAGE gel |
| 4X loading buffer | Novex | NP0008 | Protein loading dye concentrate |
| 50 bp ladder | New England Biolabs | N3236 | Reference ladder for excising region of interest from the amplified cDNA library |
| 50% PEG | NEB | B100045 | For the L5 linker ligation |
| 6% TBE gel | Invitrogen | EC6265BOX | For separation and purification of the cDNA library |
| Acetone | ACROS Organics | 423245000 | Washing of TCA-precipitated proteins |
| anti-FLAG beads | Sigma Aldrich | M8823-1ML | For purifcation of FLAG-tagged RBPs |
| ATP (100 mM) | Thermo Fisher Scientific | R0441 | For ligation of the L5 linker onto the 5' end of captured RNAs |
| Beta-mercaptoethanol | Sigma Aldrich | M3148-100ML | Buffer component |
| Biomax MS intensifying screen | Sigma Aldrich | Z363162-1EA | For intensifying the autoradiogram signal |
| Chloroform | Thermo Fisher Scientific | 1010219 | For phenol-chloroform extraction following RNA purification |
| cOmplete EDTA-free protease inhibitor cocktail | Roche | 11873580001 | For inhibition of cellular proteases after lysis |
| Complete supplement mixture -TRP | Formedium | DCS0149 | For preparation of synthetic defined medium |
| Costar Spin-X 0.22 µm filters | Sigma Aldrich | CLS8160 | For isolating the excised cDNAs following gel extraction |
| DNase RQ1 | Promega | M6101 | For DNA digest following cell lysis |
| dNTPs (10 mM) | Sigma Aldrich | 4638956001 | For reverse transcription and PCR |
| Ethanol | Thermo Fisher Scientific | 10041814 | For phenol-chloroform extraction following RNA purification and DNA precipitation |
| Ethylenediaminetetraacetic acid | Invitrogen | AM9261 | For protease K buffer |
| Exonuclease I | New England Biolabs | M0293 | For degradation of primers following PCR |
| Glass microfiber filters | Whatman | 1823-010 | For isolating the excised cDNAs following gel extraction |
| Glucose | Formedium | GLU03 | For preparation of glucose-containing, synthetic defined medium |
| Glycogen (20 mg/mL) | Roche | 10901393001 | Precipitation of proteins, RNA and DNA |
| GST-TEV | Homemade | Construct and purification protocol is available upon request | |
| Guanidium hydrochloroide | Thermo Fisher Scientific | 10071503 | Required for pulldown denaturing conditions and washing buffer |
| IgG beads | GE Healthcare | 17-0969-01 | For purification of protein A-tagged RBPs |
| Imidazole | Sigma Aldrich | I2399-100G | For elution of captured proteins from Nickel beads |
| Isoamyl alcohol | Thermo Fisher Scientific | A393-500 | For phenol-chloroform extraction following RNA purification |
| Luna Universal One-Step RT-qPCR | NEB | E3005S | For qPCR of the cDNA in order to calculate required number of PCR cycles |
| Magnesium chloride | Fluka Analytical | 63020-1L | For PNK buffer |
| Membrane filters | Millipore | AAWP09000 for yeast or HAWP09000 for bacteria | For vacuum filtration of cells |
| Micro bio-spin columns | Biorad | 732-6204 | For collecting eluate after gel extraction |
| Ni-NTA beads | Qiagen | 30210 | For secondary protein capture |
| NP-40 | Sigma Aldrich | I8896-100ML | Buffer component |
| Pfu polymerase | Promega | M7741 | For amplification of the cDNA library |
| Phenol | Sigma Aldrich | P4682-400ML | For phenol-chloroform extraction following RNA purification |
| Pierce spin columns | Thermo Fisher Scientific | 69725 | For on-column enzymatic reactions |
| Protease K | Roche | 3115887001 | For degradation of the RBP following gel extraction |
| Quartz Petri dish | UVO3 | N/A | For cross-linking of adherent cells. Available from https://www.vari-x-link.com for 400 GBP |
| Radiography films | Amersham | 28906843 | For autoradiography visualisation |
| RNAClean XP beads | Beckmann | A63987 | SPRI beads for clean up of RNAs and cDNAs |
| RNase H | New England Biolabs | M0297 | For degradation of RNAs following reverse transcription |
| RNase-It | Agilent | 400720 | For RNA digestion |
| rRNasin | Promega | N2511 | For inhibition of any contaminating RNases during enzymatic reaction |
| Sodium acetate | Sigma Aldrich | S2889-1KG | For phenol-chloroform extraction following RNA purification and DNA precipitation |
| Sodium chloride | Thermo Fisher Scientific | 7647-14-5 | Buffer component |
| Sodium deoxycholate | Sigma Aldrich | D6750-100G | Buffer component in mammalian cell lysis |
| Sodium dodecylsulfate | Sigma Aldrich | L3771-1KG | For protease K buffer |
| SUPERase-In | Invitrogen | AM2694 | For inhibition of cellular RNases after lysis |
| SuperScript IV | Thermo Fisher Scientific | 18090010 | For reverse transcription |
| T4 PNK | New England Biolabs | M0201 | For radiolabelling the 5' end of the RNA |
| T4 RNA ligase 1 | New England Biolabs | M0204 | For ligation of the L5 adaptor onto the RNA 5' end |
| T4 RNase ligase 2, truncated K222Q | NEB | M0351S | For ligation of the App_PE linker onto the 3' end of captured RNAs |
| TBE buffer (10X) | Invitrogen | 15581-028 | For running TBE gels |
| TEV protease | Homemade | For eluting captured proteins following FLAG capture | |
| Thermosensitive alkaline phosphatase | Promega | M9910 | For 5' and 3' dephosphorylation of RNAs |
| Trichloroacetic acid (100%) | Sigma Aldrich | T0699-100ML | For precipitation of RBP-RNA complexes |
| Tris hydrochloride | Invitrogen | 15504-020 | Buffer component |
| Triton X-100 | Sigma Aldrich | T8787-100ML | Buffer component in mammalian cell lysis |
| Vari Filter | UVO3 | N/A | Device for vacuum harvesting cells. Available from https://www.vari-x-link.com for 100 GBP |
| Vari-X-Linker | UVO3 | N/A | Cross-linker for cross-linking cells. Available from https://www.vari-x-link.com for 16,000 GBP |
| Yeast nitrogen base | Formedium | CYN0410 | For preparation of synthetic defined medium |
| Zirconia beads | Thistle | 11079105Z for yeast or 11079101Z for bacteria | For cell lysis via bead beating |
참고문헌
- Ule, J., et al. CLIP identifies Nova-regulated RNA networks in the brain. Science. 302 (5648), 1212-1215 (2003).
- Granneman, S., Kudla, G., Petfalski, E., Tollervey, D. Identification of protein binding sites on U3 snoRNA and pre-rRNA by UV cross-linking and high-throughput analysis of cDNAs. Proceedings of the National Academy of Sciences. 106 (24), 9613-9618 (2009).
- Licatalosi, D. D., et al. HITS-CLIP yields genome-wide insights into brain alternative RNA processing. Nature. 456 (7221), 464-469 (2008).
- König, J., et al. iCLIP reveals the function of hnRNP particles in splicing at individual nucleotide resolution. Nature Structural & Molecular Biology. 17 (7), 909-915 (2010).
- Hafner, M., et al. Transcriptome-wide Identification of RNA-Binding Protein and MicroRNA Target Sites by PAR-CLIP. Cell. 141 (1), 129-141 (2010).
- Aktaş, T., et al. DHX9 suppresses RNA processing defects originating from the Alu invasion of the human genome. Nature. 544 (7648), 115-119 (2017).
- Huppertz, I., et al. iCLIP: Protein–RNA interactions at nucleotide resolution. Methods. 65 (3), 274-287 (2014).
- Li, X., et al. Comprehensive in vivo RNA-binding site analyses reveal a role of Prp8 in spliceosomal assembly. Nucleic Acids Research. 41 (6), 3805-3818 (2013).
- Rosenberg, M., et al. Denaturing CLIP, dCLIP, Pipeline Identifies Discrete RNA Footprints on Chromatin-Associated Proteins and Reveals that CBX7 Targets 3′ UTRs to Regulate mRNA Expression. Cell Systems. 5 (4), 368-385 (2017).
- Zarnegar, B. J., et al. irCLIP platform for efficient characterization of protein–RNA interactions. Nature Methods. 13 (6), 489-492 (2016).
- Kargapolova, Y., Levin, M., Lackner, K., Danckwardt, S. sCLIP—an integrated platform to study RNA–protein interactomes in biomedical research: identification of CSTF2tau in alternative processing of small nuclear RNAs. Nucleic Acids Research. 45 (10), 6074-6086 (2017).
- Van Nostrand, E. L., et al. Robust transcriptome-wide discovery of RNA-binding protein binding sites with enhanced CLIP (eCLIP). Nature Methods. 13 (6), 508-514 (2016).
- Flynn, R. A., et al. Dissecting noncoding and pathogen RNA–protein interactomes. RNA. 21 (1), 135-143 (2015).
- Brugiolo, M., Botti, V., Liu, N., Müller-McNicoll, M., Neugebauer, K. M. Fractionation iCLIP detects persistent SR protein binding to conserved, retained introns in chromatin, nucleoplasm and cytoplasm. Nucleic Acids Research. 45 (18), 10452-10465 (2017).
- Sanford, J. R., et al. Identification of Nuclear and Cytoplasmic mRNA Targets for the Shuttling Protein SF2/ASF. PLOS ONE. 3 (10), e3369(2008).
- Garzia, A., Meyer, C., Morozov, P., Sajek, M., Tuschl, T. Optimization of PAR-CLIP for transcriptome-wide identification of binding sites of RNA-binding proteins. Methods. 118-119, 24-40 (2017).
- Windhager, L., et al. Ultrashort and progressive 4sU-tagging reveals key characteristics of RNA processing at nucleotide resolution. Genome Research. 22 (10), 2031-2042 (2012).
- Chen, K., et al. High-Resolution N6-Methyladenosine (m6A) Map Using Photo-Crosslinking-Assisted m6A Sequencing. Angewandte Chemie International Edition. 54 (5), 1587-1590 (2015).
- Ke, S., et al. A majority of m6A residues are in the last exons, allowing the potential for 3′ UTR regulation. Genes & Development. 29 (19), 2037-2053 (2015).
- Linder, B., et al. Single-nucleotide-resolution mapping of m6A and m6Am throughout the transcriptome. Nature Methods. 12 (8), 767-772 (2015).
- Kudla, G., Granneman, S., Hahn, D., Beggs, J. D., Tollervey, D. Cross-linking, ligation, and sequencing of hybrids reveals RNA–RNA interactions in yeast. Proceedings of the National Academy of Sciences. 108 (24), 10010-10015 (2011).
- Sugimoto, Y., et al. hiCLIP reveals the in vivo atlas of mRNA secondary structures recognized by Staufen 1. Nature. 519 (7544), 491-494 (2015).
- Hwang, H. W., et al. cTag-PAPERCLIP Reveals Alternative Polyadenylation Promotes Cell-Type Specific Protein Diversity and Shifts Araf Isoforms with Microglia Activation. Neuron. 95 (6), 1334-1349 (2017).
- Hwang, H. W., et al. PAPERCLIP Identifies MicroRNA Targets and a Role of CstF64/64tau in Promoting Non-canonical poly(A) Site Usage. Cell Reports. 15 (2), 423-435 (2016).
- Lee, F. C. Y., Ule, J. Advances in CLIP Technologies for Studies of Protein-RNA Interactions. Molecular Cell. 69 (3), 354-369 (2018).
- Beckmann, B. M. RNA interactome capture in yeast. Methods. 118-119, 82-92 (2017).
- Granneman, S., Petfalski, E., Tollervey, D. A cluster of ribosome synthesis factors regulate pre-rRNA folding and 5.8S rRNA maturation by the Rat1 exonuclease. The EMBO Journal. 30 (19), 4006-4019 (2011).
- Schaughency, P., Merran, J., Corden, J. L. Genome-Wide Mapping of Yeast RNA Polymerase II Termination. PLOS Genetics. 10 (10), e1004632(2014).
- Bernstein, J. A., Khodursky, A. B., Lin, P. H., Lin-Chao, S., Cohen, S. N. Global analysis of mRNA decay and abundance in Escherichia coli at single-gene resolution using two-color fluorescent DNA microarrays. Proceedings of the National Academy of Sciences. 99 (15), 9697-9702 (2002).
- Kresnowati, M. T. A. P., et al. When transcriptome meets metabolome: fast cellular responses of yeast to sudden relief of glucose limitation. Molecular Systems Biology. 2, 49(2006).
- Marguerat, S., Lawler, K., Brazma, A., Bähler, J. Contributions of transcription and mRNA decay to gene expression dynamics of fission yeast in response to oxidative stress. RNA Biology. 11 (6), 702-714 (2014).
- van Nues, R., et al. Kinetic CRAC uncovers a role for Nab3 in determining gene expression profiles during stress. Nature Communications. 8 (1), 12(2017).
- Selinger, D. W., Saxena, R. M., Cheung, K. J., Church, G. M., Rosenow, C. Global RNA Half-Life Analysis in Escherichia coli Reveals Positional Patterns of Transcript Degradation. Genome Research. 13 (2), 216-223 (2003).
- Tudek, A., Candelli, T., Libri, D. Non-coding transcription by RNA polymerase II in yeast: Hasard or nécessité? Biochimie. 117, 28-36 (2015).
- Lingaraju, M., et al. The MTR4 helicase recruits nuclear adaptors of the human RNA exosome using distinct arch-interacting motifs. Nature Communications. 10 (1), 1-11 (2019).
- Lubas, M., et al. Interaction Profiling Identifies the Human Nuclear Exosome Targeting Complex. Molecular Cell. 43 (4), 624-637 (2011).
- Conrad, N. K., et al. A yeast heterogeneous nuclear ribonucleoprotein complex associated with RNA polymerase II. Genetics. 154 (2), 557-571 (2000).
- Darby, M. M., Serebreni, L., Pan, X., Boeke, J. D., Corden, J. L. The Saccharomyces cerevisiae Nrd1-Nab3 Transcription Termination Pathway Acts in Opposition to Ras Signaling and Mediates Response to Nutrient Depletion. Molecular and Cellular Biology. 32 (10), 1762-1775 (2012).
- Webb, S., Hector, R. D., Kudla, G., Granneman, S. PAR-CLIP data indicate that Nrd1-Nab3-dependent transcription termination regulates expression of hundreds of protein coding genes in yeast. Genome Biology. 15 (1), R8(2014).
- Jensen, T. H., Jacquier, A., Libri, D. Dealing with Pervasive Transcription. Molecular Cell. 52 (4), 473-484 (2013).
- van Dijk, E. L., et al. XUTs are a class of Xrn1-sensitive antisense regulatory non-coding RNA in yeast. Nature. 475 (7354), 114-117 (2011).
- Thiebaut, M., et al. Futile Cycle of Transcription Initiation and Termination Modulates the Response to Nucleotide Shortage in S. cerevisiae. Molecular Cell. 31 (5), 671-682 (2008).
- Merran, J., Corden, J. L. Yeast RNA-Binding Protein Nab3 Regulates Genes Involved in Nitrogen Metabolism. Molecular and Cellular Biology. 37 (18), e00154-e00117 (2017).
- Bresson, S., Tuck, A., Staneva, D., Tollervey, D. Nuclear RNA Decay Pathways Aid Rapid Remodeling of Gene Expression in Yeast. Molecular Cell. 65 (5), 787-800 (2017).
- Buchbender, A., et al. Improved library preparation with the new iCLIP2 protocol. Methods. , (2019).
Erratum
Formal Correction: Erratum: Monitoring Protein-RNA Interaction Dynamics in vivo at High Temporal Resolution using χCRAC
Posted by JoVE Editors on 2/17/2023. Citeable Link.
An erratum was issued for: Monitoring Protein-RNA Interaction Dynamics in vivo at High Temporal Resolution using χCRAC. The Authors section was updated from:
Stuart W. McKellar1
Ivayla Ivanova1
Robert W. van Nues2
Ross A. Cordiner3
Will Worboys4
Andrew Langford4
Torben Heick Jensen3
Sander Granneman1
1Centre for Synthetic and Systems Biology, University of Edinburgh
2Institute of Cell Biology, University of Edinburgh
3Department of Molecular Biology and Genetics, Aarhus University, 4UVO3 Ltd.
to:
Stuart W. McKellar1
Ivayla Ivanova1
Robert W. van Nues2
Ross A. Cordiner3
Mehak Chauhan1
Niki Christopoulou1
Will Worboys4
Andrew Langford4
Torben Heick Jensen3
Sander Granneman1
1Centre for Engineering Biology, University of Edinburgh
2Institute of Cell Biology, University of Edinburgh
3Department of Molecular Biology and Genetics, Aarhus University, 4UVO3 Ltd.
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유