JoVE 비디오를 활용하시려면 도서관을 통한 기관 구독이 필요합니다. 전체 비디오를 보시려면 로그인하거나 무료 트라이얼을 시작하세요.
Method Article
플루오로겐 RNA 압타머에 대한 시험관 내 및 세포 턴온 역학 결정
요약
이 프로토콜은 플루오로 생성 RNA 압타머 시금치2 및 브로콜리의 동역학을 결정하는 두 가지 방법을 제시합니다. 첫 번째 방법은 플레이트 리더로 시험관 내에서 형광 발생 압타머 역학을 측정하는 방법을 설명하는 반면, 두 번째 방법은 유세포 분석에 의한 세포의 형광 발생 압타머 역학 측정을 자세히 설명합니다.
초록
플루오로제닉 RNA 앱타머는 살아있는 세포에 적용되어 RNA에 태그 및 시각화하고, 유전자 발현에 대해 보고하고, 대사 산물 및 신호 분자의 수준을 감지하는 형광 바이오센서를 활성화합니다. 이들 시스템 각각에서의 동적 변화를 연구하기 위해서는, 실시간 측정을 얻는 것이 바람직하지만, 측정의 정확도는 샘플링 주파수보다 빠른 형광 생성 반응의 동역학에 의존한다. 여기에서는 각각 샘플 주입기와 유세포분석기가 장착된 플레이트 리더를 사용하여 플루오로제닉 RNA 앱타머에 대한 시험관내 및 세포 턴온 동역학을 결정하는 방법을 설명합니다. 우리는 시금치2 및 브로콜리 압타머의 형광 활성화에 대한 시험관 내 동역학이 2상 연관 반응으로 모델링될 수 있고 각각 0.56 s-1 및 0.35 s-1의 다른 빠른 위상 속도 상수를 갖는다는 것을 보여줍니다. 또한, 우리는 그람 음성 박테리아로의 염료 확산에 의해 더욱 제한되는 대장균에서 시금치2의 형광 활성화를 위한 세포 역학이 분 시간 척도에서 정확한 샘플링 빈도를 가능하게 할 만큼 충분히 빠르다는 것을 보여줍니다. 형광 활성화 동역학을 분석하기 위한 이러한 방법은 개발된 다른 형광 RNA 앱타머에 적용할 수 있습니다.
서문
형광 생성 반응은 형광 신호를 생성하는 화학 반응입니다. 플루오로제닉 RNA 앱타머는 일반적으로 형광 양자 수율을 향상시키기 위해 소분자 염료를 결합하여 이 기능을 수행합니다(그림 1A)1. 상이한 플루오로겐 RNA 앱타머 시스템이 개발되었고, 특정 RNA 앱타머 서열 및 상응하는 염료 리간드1로 구성된다. 플루오로 제닉 RNA 앱타머는 mRNA 및 비 코딩 RNA 2,3,4의 라이브 셀 이미징을 가능하게하는 형광 태그로 RNA 전사체에 추가되었습니다. 그들은 또한 보고 기능이 RNA 수준 5,6이라는 점을 제외하고는 녹색 형광 단백질(GFP)을 리포터로 사용하는 것과 유사하게 유전자 발현의 형광 리포터로서 프로모터 서열 뒤에 배치되었습니다. 마지막으로, 플루오로 생성 RNA 압타머는 특정 소분자에 반응하여 형광 생성 반응을 유발하도록 설계된 RNA 기반 형광 바이오 센서에 통합되었습니다. RNA 기반 형광 바이오센서는 다양한 비형광 대사산물 및 신호 분자 7,8,9,10,11의 라이브 셀 이미징을 위해 개발되었습니다.
RNA 국소화, 유전자 발현 및 소분자 신호의 동적 변화를 시각화하기 위한 형광 RNA 압타머의 개발에 대한 관심이 높아지고 있습니다. 이러한 각 응용 분야에 대해 실시간 측정을 얻는 것이 바람직하지만 측정의 정확도는 샘플링 주파수보다 빠른 형광 발생 반응의 역학에 따라 달라집니다. 여기에서는 샘플 주입기가 장착된 플레이트 리더를 사용하여 형광 RNA 앱타머 시금치212 및 브로콜리13에 대한 시험관 내 동역학을 결정하고 유세포분석기를 사용하여 대장균에서 발현되는 시금치2에 대한 세포 턴온 동역학을 결정하는 방법을 설명합니다. 이 두 RNA 앱타머는 RNA 국소화연구 2,3,4에 적용되었기 때문에 선택되었으며, 리포터 5,6 및 바이오센서 7,8,9,10,11에 사용되었으며, 해당 염료 리간드(DFHBI 또는 DFHBI-1T)가 시판되고 있습니다. 문헌에서 결정된 이들의 시험관내 특성의 요약은 표 1 4,13,14에 주어지며, 이는 프로토콜 개발(예를 들어, 사용된 파장 및 염료 농도)을 알렸다. 이러한 결과는 RNA 앱타머에 의해 영향을 받는 형광 생성 반응이 빠르며 원하는 세포 생물학적 응용을 위한 정확한 측정을 방해해서는 안 된다는 것을 보여줍니다.
프로토콜
1. 체외 동역학 실험
- PCR에 의한 DNA 주형의 제조
- PCR 반응 설정: PCR 반응을 준비하려면 얇은 벽의 PCR 튜브에 다음 시약을 결합하십시오.
33 μL의 이중 증류수 (ddH2O)
고충실도 DNA 중합효소를 위한 10μL의 5x 버퍼
5 μL의 2 mM 각각 데옥시리보뉴클레오시드 트리포스페이트(dNTP)
0.5 μL의 40 μM 정방향 프라이머
0.5μL의 40μM 리버스 프라이머
0.5 μL (10-100 ng)의 DNA 주형 (시금치 2 PCR 만 해당; 브로콜리 프라이머 겹침)
0.5 μL의 고충실도 DNA 중합효소(마지막 추가)
참고: 합성 올리고뉴클레오티드는 종종 건조 상태로 배송됩니다. 저장 용액을 준비하려면 ddH2O의 알려진 부피 (100 μL 권장)를 추가하고 해당 용액의 A260 을 측정하여 맥주의 법칙에 따라 농도를 결정합니다. 그런 다음 이 스톡 용액을 사용하여 PCR에 사용하기에 적합한 희석액을 만들 수 있습니다. - 열순환기 프로토콜을 실행합니다.
- 다음 열순환기 프로토콜을 사용하여 전장 시금치2 및 브로콜리 DNA 주형을 증폭하십시오.
초기 변성: 2분 동안 98°C
35 사이클 :
변성:15초 동안 98°C 변성
어닐링: 30 s 동안 72 °C
연장 : 30 초 동안 72 ° C
최종 연장 : 5 분 동안 72 ° C. - 반응 후, 저분자량 사다리 (크기 범위 : 25-766 뉴클레오티드)와 함께 2 % 아가 로스 겔로 생성물의 작은 부분 표본을 분석하여 원하는 DNA 생성물의 존재를 확인한다.
- 시판되는 겔 추출 또는 PCR 클린업 키트로 생성물을 정제하고ddH2O또는 제조자가 제공한 완충액으로 용리시킨다.
참고: PCR 세척 키트를 선택할 때 컬럼 분자량 컷오프가 T7-브로콜리(81개 뉴클레오티드)를 보유할 수 있을 만큼 충분히 낮지 않으면 PCR 산물이 손실되는지 확인하십시오.
참고: 선택적 일시 중지 지점: DNA를 -20°C에 보관하십시오.
- 다음 열순환기 프로토콜을 사용하여 전장 시금치2 및 브로콜리 DNA 주형을 증폭하십시오.
- PCR 반응 설정: PCR 반응을 준비하려면 얇은 벽의 PCR 튜브에 다음 시약을 결합하십시오.
- 시험관 전사(IVT)에 의한 시금치2 및 브로콜리 RNA의 제조
- 전사 반응을 설정합니다.
- 100 μL 전사 반응을 준비하려면 1.5 mL 마이크로 원심분리 튜브에 다음 시약을 결합합니다 : 10 μL의 10x 전사 완충액 + 20 μL의 10 mM 리보 뉴클레오 시드 트리 포스페이트 (rNTP) + 1-64 μL의 DNA 주형 (총 1 μg) + 2 μL의 무기 피로 포스 파타 제 + ddH 2 O - 98 μL +2μL의 T7 RNA 중합 효소 (마지막 추가).
- 이 반응물을 37°C에서 4시간 동안 인큐베이션합니다. 20% 수크로스, 0.1% 나트륨 도데실 설페이트(SDS), 1x 트리스-보레이트-EDTA(1x TBE) 완충액 및 ~18M 요소로 구성된 100μL의 2x 요소 겔 로딩 완충액(2x ULB)을 추가하여 반응을 켄칭합니다.
알림: 선택적 일시 중지 지점: 담금질 반응을 -20°C에서 보관하십시오.
- 전사 반응을 설정합니다.
- RNA의 폴리아크릴아미드 겔 전기영동(PAGE) 정제
- 시금치2 및 브로콜리 RNA의 PAGE 정제
주의 : 비 중합 (액체 또는 분말) 아크릴 아미드는 매우 독성이 있습니다. 분말 아크릴아미드를 칭량하는 경우 흄 후드에서 계량하십시오. 항상 적절한 보호 장비를 착용하고 아크릴 아미드 분말 또는 용액으로 오염 된 장갑을 즉시 제거하고 손을 철저히 씻으십시오. 아크릴 아마이드가 피부에 직접 닿으면 비누와 물로 노출 된 부위를 최소 15 분 동안 씻으십시오. 아크릴아마이드가 눈에 직접 닿으면 물로 15분 동안 씻어내십시오.- PAGE 젤 준비: 전장 제품에서 원치 않는 유산 전사체 및 미반응 rNTP를 제거하려면 6% 요소-폴리아크릴아미드 겔을 준비합니다. 일반적으로 28cm x 16.5cm x 1.5mm 젤은 8웰 빗과 함께 사용할 수 있습니다. 1x TBE 버퍼를 사용하여 저장소를 채우기 위해 젤 및 전기 영동 장비를 설정합니다.
- PAGE 젤에 RNA 샘플 로드: 레인당 1회 퀀칭된 200μL 반응으로 겔을 로드합니다. 별도의 레인에서 2x ULB에 트래커 염료 자일렌 시아놀과 브로모페놀 블루를 로드하여 각각 106개 뉴클레오티드 및 26개 뉴클레오티드(15개)에서 겔 내에서 이동합니다. 다음 단계에서 잠재적인 오염을 방지하기 위해 각 샘플 사이에 빈 차선을 두십시오.
- PAGE 젤 실행: 각각의 잘린 제품에서 95-nt 시금치2 및 49-nt 브로콜리를 분리하려면 젤을 1.5W에서 2-2시간 동안 실행하면 브로모페놀 블루 염료가 젤 길이의 ~5/6로 이동합니다.
- PAGE 젤의 RNA 샘플 시각화: 젤 주변의 유리판을 분해하고 양쪽에 플라스틱 랩으로 젤을 덮고 랩의 레인에 라벨을 붙입니다. UV 광선 하에서 형광 TLC 플레이트에 랩핑된 젤을 배치하여 UV 섀도잉으로 어두운 방에서 RNA 밴드를 시각화합니다. 마커로 제품에 해당하는 RNA 밴드의 가장자리를 빠르게 윤곽을 그리고 UV 램프를 꺼서 UV 노출로 인한 손상을 최소화합니다.
- PAGE 젤에서 RNA 샘플 절제 및 추출: 각 샘플에 대해 새 면도날을 사용하여 원하는 제품 밴드를 절제하고 ~1mm 입방체로 깍둑썰기한 다음 젤 조각을 500μL의 크러쉬 소크 버퍼가 있는 2mL 미세 원심분리 튜브에 추가하여 실온(RT)에서 2시간 또는 4°C에서 밤새 회전기에서 RNA를 추출합니다.
참고: 선택적 일시 중지 지점: 샘플은 -20°C에서 보관할 수 있습니다. - RNA를 침전시킨다.
- 버퍼에서 추출된 RNA에서 겔 조각을 분리하려면 샘플을 13,000 x g 에서 4°C에서 20분 동안 원심분리한 다음 끝이 좁은 피펫을 사용하여 상청액을 추출하고 새로운 2mL 미세 원심분리 튜브에 넣습니다.
- RNA를 침전시키려면 1.5mL의 얼음처럼 차가운 에탄올과 1μL의 20mg/mL 글리코겐, 와류를 추가하고 -20°C 또는 -80°C에서 최소 1시간 동안 보관하십시오.
참고: 선택적 일시 중지 지점: RNA는 몇 달 동안 -20°C에서 보관할 수 있습니다.
- RNA 침전물의 수집: 침전된 RNA를 4°C에서 20분 동안 13,000 x g 에서 원심분리하여 펠렛합니다. 상청액을 제거하고 남은 에탄올이 야외(~1시간)에서 증발되도록 한 후 펠릿을 30μL의ddH2O또는 1x TE 완충액에 재현탁합니다.
참고: 이 과정은 일반적으로 ~10μM의 최종 RNA 농도를 초래합니다.
참고: 선택적 일시 중지 지점: RNA 샘플은 -20°C에서 몇 개월 동안 보관할 수 있습니다.
- RNA 스톡 농도를 결정합니다.
- 가수분해 반응을 위한 RNA 분취량을 준비한다.
- 이 분석을 수행하려면 먼저 UV/Vis 나노 분광 광도계를 사용하여 스톡 RNA 샘플의A260 을 결정하고 샘플의 희석된 분취량을ddH2O에서 ~10 흡광도 단위(AU)로 만듭니다.
- 0.5 mL PCR 튜브에서 다음의 반응을 준비한다: 16 μL의 ddH2O + 2 μL의 10xNa2CO3완충액 + 2μL의 RNA 분취량을 ~10 AU로 희석한다. 반응물을 95°C에서 90분 동안 인큐베이션한 다음, RT로 냉각시킨다.
- 뉴클레오티드 흡광도를 사용하여 RNA 농도 결정: UV/Vis 나노 분광 광도계로 이 샘플의 A260 을 측정하고 다음 공식을 사용하여 RNA 농도를 계산합니다.

여기서 c는 RNA의 농도, b는 경로 길이, i는 특정 뉴클레오티드 (A, C, G 또는 U), ni는 RNA 서열에서 뉴클레오티드 i의 빈도, ε i는 뉴클레오티드 i의 몰 흡광 계수입니다. 원래 스톡 RNA 농도를 결정하려면 c에 희석 계수를 곱하십시오.
참고: 선택적 일시 중지 지점: RNA는 몇 달 동안 -20°C에서 보관할 수 있습니다.
- 가수분해 반응을 위한 RNA 분취량을 준비한다.
- 시금치2 및 브로콜리 RNA의 PAGE 정제
- 수행 in vitro 플레이트 리더 동역학 분석
- RNA 재생 프로그램 설정: 저장을 누르기 전에 새 프로그램 만들기 > 새 단계 추가 > 새 단계 추가를 여러 번 선택하여 다음 단계를 추가하여 다음 열순환기 프로토콜을 만듭니다.
3분 동안 70 °C
45 초 동안 65 ° C
45초 동안 60 °C
45초 동안 55 °C
45초 동안 50 °C
45 초 동안 45 ° C
45초 동안 40 °C
45 초 동안 35 ° C
45초 동안 30 °C - RNA 재변성: 시금치2 및 브로콜리 RNA를 재변성하기 위해 0.5mL의 얇은 벽 PCR 튜브에서ddH2O에 각 RNA의 2μM 스톡을 준비한 다음 동일한 부피의 2x 재생 완충액(80mM hepes, pH 7.5[KOH], 250mM KCl, 6mMMgCl2)을 추가하여 1μM RNA 용액을 만듭니다. 열순환기에 튜브를 추가하고 저장된 재생 프로그램을 열고 실행을 누릅니다.
참고: 열순환기를 사용할 수 없는 경우 RNA를 대신 70°C 열 블록에서 3분 동안 배양한 다음 벤치에서 RT로 천천히 냉각할 수 있습니다. - 결합 반응 완충액 준비: 하나의 압타머-염료 결합 반응을 위한 완충액을 준비하기 위해, 완충액 성분(69.5μL의ddH2O+ 4μL의 1M Hepes, pH 7.5[KOH]+6.2μL의 2M KCl + 0.3μL의 1MMgCl2)을 함유하는 마스터 믹스를 만든다. 필요한 표본과 반복실험 횟수에 따라 이 값에 표본 수에 1을 더한 값을 곱합니다. 일반적으로 RNA 샘플 당 3 회 반복이 만족 스럽습니다.
- 플레이트 리더를 준비하십시오.
- 플레이트 리더 인젝터 프로그램 설정: 형광 플레이트 리더에서 온도를 선택하고 원하는 온도를 37°C로 설정하여 동역학 실험을 시작하기 전에 온도가 이 값으로 평형을 이루었는지 확인합니다. 플레이트 리더 소프트웨어를 열고 설정 > 획득 보기를 선택한 후 동역학 측정을 위해 다음 프로그램을 입력합니다.
루프: 각 웰에 대해
기준 설정: 60 기준 읽기
스마트인젝트 설정: 10μL 주입(기준선 판독 후 발생)
형광 (또는 FL)은 다음과 같습니다.
여기: 448 nm (대역폭: 9 nm)
방출: 506 nm (대역폭: 15 nm)
카트리지: 모노(s/n 3297)
타이밍:
총 읽기 시간: 10 분
읽기 간격: 0.5초
PMT 및 광학: 읽기당 6회 깜박임
루프: 다음 웰 - 인젝터 준비
- 인젝터 세척 및 흡인: 플레이트 리더 인젝터를 준비하려면 먼저 플레이트 리더에서 주입 을 선택하고 지시에 따라 플레이트 리더에 폐기물 수집 플레이트를 공급한 다음 세척을 선택하고 플레이트 리더의 지침에 따라 1mL 부피의ddH2O, ddH2O중 75% 에탄올, 그리고 ddH2O. 그런 다음 흡인을 선택하여 인젝터가 과도한 액체를 배출하도록 합니다.
- 주입기 프라이밍: 이전 화면으로 나간 후 Prime 을 선택하여 주입할 260μL 부피의 리간드로 주입기를 프라이밍하여 실험 중에 순수하고 농축된 리간드가 샘플에 추가되도록 합니다(이 경우 ddH2O에서 100μM DFHBI로 프라임).
- 플레이트 리더 인젝터 프로그램 설정: 형광 플레이트 리더에서 온도를 선택하고 원하는 온도를 37°C로 설정하여 동역학 실험을 시작하기 전에 온도가 이 값으로 평형을 이루었는지 확인합니다. 플레이트 리더 소프트웨어를 열고 설정 > 획득 보기를 선택한 후 동역학 측정을 위해 다음 프로그램을 입력합니다.
- 체외 동역학 실험 수행: 한 가지 동역학 실험을 수행하려면 먼저 이전에 준비된 결합 완충액 마스터 믹스 80μL를 96웰 투명 바닥 플레이트의 한 웰에 추가한 다음 10μL의 변성 RNA를 추가합니다. 이 플레이트와 인젝터의 DFHBI 용액이 플레이트 리더에서 15분 동안 37°C로 평형을 이루도록 합니다.
- 판독 영역 아래의 플레이트 리더 소프트웨어 설정에서 분석할 웰을 선택한 다음 홈 탭에서 실행을 선택하여 앞에서 설명한 동역학 프로그램을 실행합니다. 모든 실험이 완료될 때까지 이 과정을 반복합니다.
참고: 비판적으로, RNA 동역학이 반복과 샘플 간의 동일한 조건에서 측정되도록 하기 위해 동역학 실험을 한 번에 한 웰씩 수행해야 합니다. - 인젝터 세척: 주입 튜브에서 남아 있는 DFHBI 용액을 제거하려면 단계 1.4.4.2.1에 설명된 대로 주입 튜브를 1mL 부피의ddH2O, ddH2O 중 75% 에탄올로 세척한 다음ddH2O로 세척합니다.
참고: 선택적 일시 중지 지점입니다.
- RNA 재생 프로그램 설정: 저장을 누르기 전에 새 프로그램 만들기 > 새 단계 추가 > 새 단계 추가를 여러 번 선택하여 다음 단계를 추가하여 다음 열순환기 프로토콜을 만듭니다.
- 플루오로제닉 RNA 앱타머의 시험관내 동역학 분석.
- 분석 소프트웨어에 데이터 입력: 실험 데이터를 스프레드시트로 내보내 처리할 데이터를 쉽게 복사할 수 있습니다. 분석 소프트웨어에서 XY 형식으로 새 데이터 테이블을 생성합니다. X 열에 각 판독 시점을 입력하고 t = 0은 DFHBI 주입 시간입니다. Y 열에 t = 0에서 시작하는 해당 시점에서 반복실험 간의 평균 형광 값을 입력합니다.
- 데이터 정규화 및 그래프: 형광 값을 정규화하려면 분석 > 데이터 처리 > 정규화를 클릭한 다음 확인을 클릭합니다. 정규화를 위해 데이터 집합의 가장 작은 값과 가장 큰 값을 사용하고, 결과를 분수로 표시하고, 결과를 그래프로 표시하도록 선택한 다음 확인을 클릭합니다. 시간 경과에 따른 정규화된 평균 형광의 그래프를 만들려면 [데이터 세트 이름]의 정규화 아이콘을 클릭하고 그래프 패밀리: 포인트만 있는 XY를 선택합니다.
참고: 오차 막대는 적은 수의 시점이 그래프로 표시되는 경우에 유용하게 표시될 수 있습니다. 원하는 경우 XY 형식 데이터 테이블을 선택할 때 "Y" 아래의 옵션을 선택하여 나란히 열에 복제 값을 입력합니다. 기본 옵션을 선택한 결과 테이블을 그래프로 표시하면 오차 막대가 있는 그래프가 생성됩니다. - 곡선 피팅을 수행하여 운동 파라미터 얻기: 곡선을 동역학 데이터에 맞추려면 데이터 분석 > 분석을 클릭하고 XY 분석 탭에서 비선형 회귀(곡선 맞춤)를 선택합니다. 모형 탭에서 지수 > 2상 연관을 클릭하여 동역학 데이터를 다음 2상 연관 방정식에 맞춥니다.
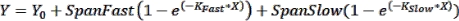
여기서 Y는 시간 X에서의 형광이고, Y0는 t=0에서의 형광이고, K Fast 및 K Slow는 각각 빠른 속도 및 느린 속도 상수이며, SpanFast 및 SpanSlow는 각각 빠른 속도와 느린 속도로 설명되는 형광 켜기 범위입니다(대표 결과, 그림 1 참조). Nonlin 피팅 탭을 클릭하여 비율 상수, t1/2 값 및 백분율 빠른 값을 봅니다.
참고: 이러한 모든 값에 대한 표준 편차를 얻기 위해 개별 플레이트 리더 실험 반복실험을 위에서 설명한 것과 동일한 방식으로 처리할 수 있습니다.
2. 세포 동역학 실험
- 대장균 균 주의 제조
- 제조업체의 프로토콜에 따라 ~100ng의 pET31b tRNA-시금치2 구조체로 BL2 스타(DE3) 대장균 세포를 변환합니다.
참고: 플라스미드 구축물은 상업적으로 입수가능하다(플라스미드 #79783). - 카르베니실린(탄수화물: 50mg/mL) 플레이트를 함유한 LB 한천에 세포를 플레이팅하고 37°C에서 12-16시간 동안 배양합니다. 플라스미드를 포함하는 세포는 플레이트 상에서 콜로니로 성장할 것이다.
알림: 선택적 일시 중지 지점: 플레이트에 형질전환된 BL21 Star 셀은 파라필름에 싸서 4°C에서 1주일 동안 보관할 수 있습니다.
- 제조업체의 프로토콜에 따라 ~100ng의 pET31b tRNA-시금치2 구조체로 BL2 스타(DE3) 대장균 세포를 변환합니다.
- 세포 성장 및 플루오로제닉 RNA 앱타머의 발현 유도
- 카르베니실린(탄수화물: 50mg/mL)을 함유한 비유도 배지(NI)의 2mL 배양액을 형질전환된 BL21 Star 세포의 단일 콜로니에 접종합니다. 적어도 세 번의 생물학적 복제에 대해 이것을 반복하십시오. 배양물을 37°C에서 250rpm의 인큐베이터/셰이커에서 22-24시간 동안 배양합니다.
참고: 선택적 일시 중지 지점: NI 배지에서 성장한 세포는 플라스미드를 유지하며 4°C에서 1주일 동안 보관할 수 있습니다. - NI 배지에서 성장시킨 후 배양액을 카베니실린(탄수화물: 50mg/mL)이 함유된 새로운 3mL의 ZYP-5052 자동 유도 배지(AI)에 100배 희석합니다. 세포를 37°C의 인큐베이터/셰이커에서 250rpm으로 16-18시간 동안 성장시켜 발현을 유도합니다.
참고: 배양에 대한 일반적인 OD600 은 18시간의 성장 후 2.0-3.3 범위입니다. 최적의 셀 밀도 범위는 2.5-3.0입니다.
- 카르베니실린(탄수화물: 50mg/mL)을 함유한 비유도 배지(NI)의 2mL 배양액을 형질전환된 BL21 Star 세포의 단일 콜로니에 접종합니다. 적어도 세 번의 생물학적 복제에 대해 이것을 반복하십시오. 배양물을 37°C에서 250rpm의 인큐베이터/셰이커에서 22-24시간 동안 배양합니다.
- 세포동역학 실험 수행
- 유세포분석기를 설정합니다.
- 기기에 연결된 유세포분석기와 컴퓨터를 켭니다. 유세포분석기용 소프트웨어에 로그인한 후 기기 탭에서 시작 아이콘을 클릭합니다. 소프트웨어 화면에 표시된 단계에 따라 계측이 올바르게 초기화되었는지 확인합니다.
알림: 일부 유세포분석기는 기기 시작 시퀀스 를 프라이밍이라고 합니다. 실험에 사용할 유세포분석기에 대한 제조업체의 프로토콜을 따라야 합니다. - 성능 테스트를 실행합니다(해당하는 경우). 메인 메뉴 탭에서 성능 테스트를 클릭합니다. 배양 튜브에서 제조업체의 성능 추적 비드 3방울을 포커싱 유체 3mL에 추가합니다.
- 배양 튜브를 샘플 튜브 리프터에 넣고 리프터를 들어 올립니다. 성능 테스트 실행을 클릭하기 전에 추적 비드 튜브의 로트 #이 성능 테스트 설정 화면에 표시된 것과 동일한지 확인하십시오. 성능 테스트를 클릭하여 테스트를 실행합니다.
- 단일 세포 형광에 대한 다음 획득 파라미터를 사용하여 이 실험을 위한 유세포분석기 소프트웨어를 설정하십시오.
여기 레이저: 488 nm
방출 채널: GFP(FITC라고도 함)
획득 부피: 40 μL(총 인발 부피 90 μL)
유속: 200 μL/분
각 측정에 대한 셀 수: 30,000
기기 설정:
전압:
FSC: 480 V
SSC: 400 V
BL1: 540 V
BL2: 392 V
BL3: 422 V
- 기기에 연결된 유세포분석기와 컴퓨터를 켭니다. 유세포분석기용 소프트웨어에 로그인한 후 기기 탭에서 시작 아이콘을 클릭합니다. 소프트웨어 화면에 표시된 단계에 따라 계측이 올바르게 초기화되었는지 확인합니다.
- 실험적 파일을 설정합니다.
- 실험 탐색기 탭에서 유세포분석기 사용자 이름을 마우스 오른쪽 버튼으로 클릭하여 새 실험 파일을 만듭니다. 드롭다운 창에서 새 실험을 선택합니다. 컴퓨터 화면에 새 창이 나타나면 확인을 선택합니다.
- 새 실험 파일에서 "그룹" 폴더를 마우스 오른쪽 버튼으로 클릭하고 새 샘플 튜브 추가를 선택합니다. 각 특정 시점에 대해 샘플 튜브에 레이블을 지정하고 샘플을 마우스 오른쪽 버튼으로 클릭하고 드롭다운 메뉴에서 이름 바꾸기를 선택하여 복제합니다. 연구의 의도된 시간 경과에 대한 총 반복실험 횟수 및 시점 수에 대해 이 단계를 반복합니다.
- 희석된 세포 용액 준비: 새 배양 튜브에 1.5mL의 1x PBS 용액을 추가합니다. 다음으로, AI 배지에서 유도 세포 3μL를 1x PBS 용액에 추가하여 희석된 세포 용액을 만듭니다. 다른 배양 튜브에서 각 생물학적 복제물에 대해 이 단계를 반복합니다.
- 세포의 배경 형광 측정: 염료를 추가하기 전에 1x PBS 용액에서 세포가 포함된 각 생물학적 복제 배양 튜브를 판독합니다. 이는 세포의 형광 배경이 측정되어 염료가 첨가되면 시간에 따른 폴드 턴온을 관찰하기 위함이다.
- 판독하려면 배양 튜브를 샘플 튜브 리프터에 넣고 리프터를 손으로 샘플 주입 바늘로 들어 올립니다. 컬렉션 패널 탭에서 적절한 샘플 파일을 선택하고 [기록]을 클릭합니다.
- 실행이 완료되면 배양 튜브로 샘플 튜브 리프터를 손으로 내립니다. 이렇게 하면 유체 시스템을 세척하고 각 생물학적 복제 샘플 간의 이월을 최소화하는 헹굼 단계가 시작됩니다. 데이터는 실행이 완료된 후 자동으로 컴퓨터에 저장됩니다.
- 2.3.4 내의 단계를 반복하여 최소 3개의 생물학적 복제에 대한 세포 형광 배경을 측정합니다. 다음 샘플 파일로 이동하려면 레코드 아이콘 아래의 샘플 튜브 이름 근처에 있는 오른쪽 화살표 아이콘을 클릭하여 다음 샘플 파일을 선택합니다.
- 염료가 있는 세포의 시점에서 형광을 측정합니다.
- 농축된 염료 스톡 1.4 μL(DMSO 중 50 mM DFHBI-1T)를 세포가 있는 1x PBS 용액에 첨가하여 50 μM DFBHI-1T의 최종 농도를 수득하였다. 다음으로, 배양 튜브 뚜껑을 고정한 다음 배양 튜브를 3x-5x 뒤집어 용액을 고르게 혼합한 후 첫 번째 시점 판독값을 취합니다.
참고: 대장균에 대한 배양 튜브 내 DMSO의 총 비율은 세포 생존율에 영향을 미칠 수 있으므로10%를 초과해서는 안 됩니다16. - 뚜껑을 제거하고 배양 튜브를 샘플 튜브 리프터에 넣습니다. 홀더를 손으로 샘플 주입 바늘에 올리고 적절한 샘플 파일 아래에서 기록 아이콘을 클릭합니다. 또한 실험에 대해 시작을 눌러 타이머를 시작합니다.
- 달리기가 완료된 후 튜브 리프터를 손으로 내리고 2.3.5.1-2.3.5.2단계를 반복합니다. (타이머 실행 시) 농축된 DFHBI-1T 1.4μL를 추가하고, 배양 튜브를 뒤집고, 나머지 모든 생물학적 복제물에 대한 판독값을 취합니다. 이 첫 번째 기록은 모든 생물학적 복제에 대해 0분에 얻은 판독값입니다. 각 생물학적 복제에 대해 한 번에 하나씩 이 작업을 수행합니다.
참고: 기록 유세포분석 획득을 누르는 시간을 기록해 둡니다. 실험 과정에서 시점을 시차를 두고 이 시간을 준수합니다. - 샘플 튜브 리프터의 배양 튜브를 샘플 주입 바늘로 올리고, 적절한 샘플 파일을 선택하고, 기록을 클릭하고, 각 실행이 완료된 후 손으로 리프터를 내려 판독을 계속합니다. 테스트 중인 모든 추가 시점 및 생물학적 복제물에 대해 이 작업을 수행합니다. 실험이 완료될 때까지 단계를 반복합니다.
알림: 샘플을 알루미늄 호일로 덮어 용액에서 DFHBI-1T의 광퇴색을 방지하기 위해 샘플을 빛에 노출시키지 마십시오.
- 농축된 염료 스톡 1.4 μL(DMSO 중 50 mM DFHBI-1T)를 세포가 있는 1x PBS 용액에 첨가하여 50 μM DFBHI-1T의 최종 농도를 수득하였다. 다음으로, 배양 튜브 뚜껑을 고정한 다음 배양 튜브를 3x-5x 뒤집어 용액을 고르게 혼합한 후 첫 번째 시점 판독값을 취합니다.
- 염료가 없는 세포에 대한 시점에서의 형광을 측정합니다(Control).
- 제조업체의 프로토콜에 따라 음성 대조군으로 실험을 다시 반복하기 전에 유세포 분석기에 대한 적절한 세척 프로토콜을 실행하십시오. 이는 이전 실험에서 제어 시점 분석 실험으로의 이월을 최소화하기 위해 수행됩니다. 다음은 실험 간 유세포 분석기에 대해 따라야 할 단계입니다.
- 빈 배양 튜브를 튜브 리프터에 손으로 놓고 튜브 홀더를 들어 올린 다음 기기 탭에서 Unclog 아이콘을 클릭합니다. 이렇게 하면 유체 시스템에서 백플러시를 실행하여 끈적끈적한 샘플을 청소합니다. 튜브 홀더를 손으로 내리고 Unclog 시퀀스가 완료되면 튜브를 제거합니다.
- 새 배양 튜브를 사용하여 10% 표백제 용액 3mL를 넣고 배양 튜브를 튜브 홀더에 넣고 홀더를 손으로 샘플 주입 바늘에 올립니다. 또한 유세포분석기에 해당하는 경우 깨끗한 96웰 플레이트를 자동 시료 주입기에 놓습니다.
- SIP 살균/자동 시료 주입기 SIP 살균 아이콘을 클릭하여 유체 시스템 전체에서 표백제가 10%인 세척 시퀀스를 실행합니다. 튜브 홀더를 내려 청소 순서를 완료합니다.
- 2.3.3단계의 지침에 따라 제어 시점 분석 실행을 위한 샘플 파일을 설정합니다.
- 새로운 배양 튜브에서 1.5mL의 1x PBS 용액에 희석된 세포 용액을 준비합니다. AI 배지에서 유도된 세포 3μL를 1x PBS 용액에 추가하여 희석된 세포 용액을 만듭니다. 각 생물학적 복제물에 대해 이 단계를 반복합니다.
- 1.4μL의 DMSO를 배양 튜브에 한 번에 하나씩 세포가 있는 1x PBS 용액에 추가하고 동일한 시점을 테스트합니다. 배양 튜브 뚜껑을 고정한 다음 배양 튜브를 3x-5x 뒤집어 첫 번째 시점 판독값을 취하기 전에 용액을 고르게 혼합합니다. 각 생물학적 복제에 대해 한 번에 하나씩 이 작업을 수행합니다.
- 2.3.5.2-2.3.5.4단계를 사용하여 염료가 있는 세포와 동일한 대조 세포 분석을 위해 동일한 프로토콜을 따릅니다.
- 제조업체의 프로토콜에 따라 음성 대조군으로 실험을 다시 반복하기 전에 유세포 분석기에 대한 적절한 세척 프로토콜을 실행하십시오. 이는 이전 실험에서 제어 시점 분석 실험으로의 이월을 최소화하기 위해 수행됩니다. 다음은 실험 간 유세포 분석기에 대해 따라야 할 단계입니다.
- 유세포분석기 종료: 기기의 적절한 종료를 위해 제조업체의 프로토콜을 따르십시오. 유세포분석기의 경우 기기는 다음과 같은 방식으로 종료할 준비가 됩니다.
- 2.3.6.1.1-2.3.6.1.3단계에 따라 유세포분석기에 대한 초기 세척 프로토콜을 수행합니다.
- 배양 튜브를 10% 표백제로 교체하고 3mL의 집중 유체가 있는 배양 튜브를 교체합니다. 튜브 홀더를 손으로 올리고 종료 아이콘 아래에서 드롭다운 메뉴를 클릭하고 Thorough를 선택합니다.
참고: 선택적 일시 중지 지점입니다.
- 유세포분석기를 설정합니다.
- 유세포 분석 데이터 분석
- 분석을 위해 모든 FCS 파일을 내보냅니다. 유세포 분석 소프트웨어로 FCS 파일을 엽니다.
- 셀 전용 FCS 파일 중 하나를 사용하여 두 로그 축을 사용하여 파편에서 신호를 제외하는 전방 산란(FSC) 및 측면 산란(SSC) 점도표(FSC 영역/SSC 영역)에서 게이트를 생성합니다. 이 게이트를 생성하려면 유세포 분석 소프트웨어에서 AutoGate 아이콘을 클릭하고 게이트 1로 이름을 지정합니다. 데이터 처리 작업 영역의 모든 샘플 탭에서 테스트한 모든 샘플 에 동일한 게이트를 적용합니다. 이렇게 하면 처리 중인 모든 FCS 파일 아래에 게이트 1 이 표시됩니다.
- 두 번 클릭하여 2.4.2단계에서 사용된 셀 전용 FCS 파일을 사용하여 새 하위 집합 파일을 만듭니다. 축 설정을 FSC 영역/FSC 높이로 변경하고 둘 다 로그 축을 사용합니다. 유세포 분석 소프트웨어에서 AutoGate 아이콘을 클릭하여 타원형 게이트를 생성하고 이름을 Gate 2로 지정합니다. 이 게이트를 2.4.2단계에서 설정한 게이트 아래의 하위 집합으로 테스트된 모든 샘플에 적용합니다. 이렇게 하면 모든 샘플에 게이트 1 > 게이트 2 가 각 FCS 파일과 연결됩니다.
- Gate 2를 두 번 클릭하여 2.4.2단계와 2.4.3단계에서 모두 게이트를 모두 적용한 다른 하위 집합 파일을 만듭니다. 축 설정을 FSC 영역/히스토그램으로 변경합니다. 이 히스토그램 게이트를 테스트된 모든 샘플에 하위 집합으로 적용하면 모든 샘플에 게이트 1 > 게이트 2 > 게이트 2가 각 FCS 파일과 연결됩니다.
참고: 히스토그램의 이름을 게이트 2 에서 히스토그램으로 변경하여 히스토그램 을 레이아웃 윈도우로 이동하고 데이터 처리로 더 많은 구성을 생성할 수 있습니다. - 평균 형광 강도(MFI) 값을 분석하려면 레이아웃 창을 엽니다. 각 시점의 히스토그램 게이트를 클릭하여 레이아웃 창으로 드래그합니다.
- 테스트된 각 샘플에 대해 "∑ 평균: BL1-A"(GFP)에 대한 통계 분석을 수행하여 레이아웃 창에 MFI 결과를 표시합니다.
- 최소 3개의 독립적인 생물학적 반복실험에 대한 시점 분석당 MFI 값의 표준 편차를 계산합니다.
- 레이아웃 창을 PDF 파일로 내보내 각 시점의 히스토그램 및 MFI 값을 저장합니다.
참고: 선택적 일시 중지 지점입니다.
- 그래프 유세포분석 데이터
- 각 시점의 히스토그램 및 MFI 값이 포함된 PDF 파일을 엽니다. MFI 값은 데이터 분석 소프트웨어로 복사됩니다. 데이터 그래프 소프트웨어에서 XY 형식으로 새 데이터 테이블을 생성합니다.
- 다음을 선택하여 XY 테이블을 작성하려면 선택합니다.
데이터 테이블: 새 테이블에 데이터를 입력하거나 가져오기
옵션:
X: 경과 시간
Y: 나란히 하위 열에 (3-4개) 반복 값 입력 - 실험 및 컨트롤 실행에 대한 모든 시점을 X축에 레이블을 지정합니다.
- 그룹 A에서, 염료가 첨가된 세포의 형광 분석을 위해 모든 생물학적 복제물에 대한 MFI 값을 각 시점에 입력한다.
- 그룹 B에서, 염료(DMSO)가 첨가되지 않은 세포의 분석을 위해 모든 생물학적 복제물에 대한 MFI 값을 각 시점에 입력한다.
- 결과를 관찰하려면 그래프 탭에서 [데이터 세트 이름 삽입]을 클릭합니다. 이렇게 하면 데이터 포인트가 평균으로 표시되고 오차 막대는 각 시점의 표준 편차(s.d.)를 나타냅니다. X축은 경과 시간을 나타내고 Y축은 MFI 값을 나타냅니다.
- 다음을 선택하여 XY 테이블을 작성하려면 선택합니다.
- 각 시점의 히스토그램 및 MFI 값이 포함된 PDF 파일을 엽니다. MFI 값은 데이터 분석 소프트웨어로 복사됩니다. 데이터 그래프 소프트웨어에서 XY 형식으로 새 데이터 테이블을 생성합니다.
결과
체외 동역학
합성 올리고뉴클레오티드로 구입한 DNA 주형 및 프라이머의 서열은 표 2 에 나와 있으며 시약 레시피는 보충 파일 1에 나와 있습니다. PCR 증폭은 후속 시험관 전사 (IVT) 반응에 필요한 T7 프로모터로 DNA 주형의 양을 확장하는 데 사용됩니다. 또한, PCR 증폭은 동일한 반응에서 두 가지 목적으로 사용될 수 있습니다: 프라이...
토론
시험관내 동역학 실험을 위해, 동일한 일반 프로토콜이 리간드-결합 및 형광단-결합 도메인8 둘 다를 함유하는 RNA-기반 형광 바이오센서의 시험관내 동역학을 측정하도록 변형될 수 있다. 이 경우, RNA는 리간드 반응 동역학을 얻기 위해 리간드 주입시 측정 전에 형광단과 함께 배양되어야 한다. 반복실험 간에 높은 변동성이 관찰되면 측정 전에 각 샘플이 96웰 플레?...
공개
저자는 이해 상충이 없음을 선언합니다.
감사의 말
이 작업은 MCH에 대한 NSF-BSF 1815508 및 NIH R01 GM124589에 대한 보조금으로 지원되었습니다. MRM은 훈련 보조금 NIH T32 GM122740에 의해 부분적으로 지원되었습니다.
자료
| Name | Company | Catalog Number | Comments |
| Agarose | Thermo Fischer Scientific | BP160500 | |
| Agarose gel electrophoresis equipment | Thermo Fischer Scientific | B1A-BP | |
| Alpha D-(+)-lactose monohydrate | Thermo Fischer Scientific | 18-600-440 | |
| Amber 1.5 mL microcentrifuge tubes | Thermo Fischer Scientific | 22431021 | |
| Ammonium persulfate (APS) | Sigma-Aldrich | A3678 | |
| Ammonium sulfate ((NH4)2SO4) | Sigma-Aldrich | A4418 | |
| Attune NxT Flow cytometer | Thermo Fischer Scientific | A24861 | |
| Attune 1x Focusing Fluid | Thermo Fischer Scientific | A24904 | |
| Attune Shutdown Solution | Thermo Fischer Scientific | A24975 | |
| Attune Performance Tracking Beads | Thermo Fischer Scientific | 4449754 | |
| Attune Wash Solution | Thermo Fischer Scientific | J24974 | |
| Boric acid | Sigma-Aldrich | B6768 | |
| Bromophenol blue | Sigma-Aldrich | B0126 | |
| Carbenicillin disodium salt | Sigma-Aldrich | C3416 | |
| Chlorine Bleach | Amazon | B07J6FJR8D | |
| Corning Costar 96-well plate | Daigger Scientific | EF86610A | |
| Culture Tubes, 12 mm x 75 mm, 5 mL with attached dual position cap | Globe Scientific | 05-402-31 | |
| DFHBI | Sigma-Aldrich | SML1627 | |
| DFHBI-1T | Sigma-Aldrich | SML2697 | |
| D-Glucose (anhydrous) | Acros Organics | AC410955000 | |
| Dimethyl sulfoxide (DMSO) | Sigma-Aldrich | D8418 | |
| Dithiothreitol (DTT) | Sigma-Aldrich | DTT-RO | |
| DNA loading dye | New England Biolabs | B7025S | |
| DNA LoBind Tubes (2.0 mL) | Eppendorf | 22431048 | |
| dNTPs: dATP, dCTP, dGTP, dTTP | New England Biolabs | N0446S | |
| EDTA, pH 8.0 | Gibco, Life Technologies | AM9260G | |
| Ethanol (EtOH) | Sigma-Aldrich | E7023 | |
| Filter-tip micropipettor tips | Thermo Fischer Scientific | AM12635, AM12648, AM12655, AM12665 | |
| FlowJo Software | BD Biosciences | N/A | FlowJo v10 Software |
| Fluorescent plate reader with heating control | VWR | 10014-924 | |
| Gel electrophoresis power supply | Thermo Fischer Scientific | EC3000XL2 | |
| Glycerol | Sigma-Aldrich | G5516 | |
| Glycogen AM95010 | Thermo Fischer Scientific | AM95010 | |
| GraphPad Prism | Dotmatics | N/A | Analysis software from Academic Group License |
| Heat block | Thomas Scientific | 1159Z11 | |
| HEPES | Sigma-Aldrich | H-4034 | |
| Inorganic pyrophosphatase | Sigma-Aldrich | I1643-500UN | |
| Low Molecular Weight DNA Ladder | New England Biolabs | N3233L | Supplied with free vial of Gel Loading Dye, Purple (6x), no SDS (NEB #B7025). |
| Magnesium chloride hexahydrate (MgCl2) | Sigma-Aldrich | M2670 | |
| Magnesium sulfate (MgSO4) | Fisher Scientific | MFCD00011110 | |
| Microcentrifuge tubes (1.5 mL) | Eppendorf | 22363204 | |
| Microcentrifuge with temperature control | Marshall Scientific | EP-5415R | |
| Micropipettors | Gilson | FA10001M, FA10003M, FA10005M, FA10006M | |
| Micropipettor tips | Sigma-Aldrich | Z369004, AXYT200CR, AXYT1000CR | |
| Millipore water filter with BioPak unit | Sigma-Aldrich | CDUFBI001, ZRQSVR3WW | |
| Narrow micropipettor pipette tips | DOT Scientific | RN005R-LRS | |
| PBS, 10x | Thermo Fischer Scientific | BP39920 | |
| PCR clean-up kit | Qiagen | 28181 | |
| PCR primers and templates | Integrated DNA technologies | ||
| PCR thermocycler for thin-walled PCR tubes | Bio-Rad | 1851148 | |
| PCR thermocycler for 0.5 mL tubes | Techne | 5PRIME/C | |
| pET31b-T7-Spinach2 Plasmid | Addgene | Plasmid #79783 | |
| Phusion High-Fidelity DNA polymerase | New England Biolabs | M0530L | Purchase of Phusion High-Fideldity Enzyme is supplied with 5x Phusion HF Buffer, 5x Phusion GC Buffer, and MgCl2 and DMSO solutions. |
| Polyacrylamide gel electrophoresis gel comb, C.B.S. Scientific | C.B.S. Scientific | VGC-1508 | |
| Polyacrylamide gel electrophoresis equipment | C.B.S. Scientific | ASG-250 | |
| Potassium chloride (KCl) | Sigma-Aldrich | P9333 | |
| Potassium phosphate monobasic | Sigma-Aldrich | P5655 | |
| Razor blades | Genesee Scientific | 38-101 | |
| rNTPs: ATP, CTP, GTP, UTP | New England Biolabs | N0450L | |
| SDS | Sigma-Aldrich | L3771 | |
| Short wave UV light source | Thermo Fischer Scientific | 11758221 | |
| Sodium carbonate (Na2CO3) | Sigma-Aldrich | S7795 | |
| Sodium chloride (NaCl) | Sigma-Aldrich | S7653 | |
| Sodium hydroxide (NaOH) | Sigma-Aldrich | S8045 | |
| Sodium phosphate dibasic, anhydrous | Thermo Fischer Scientific | S375-500 | |
| SoftMax Pro | Molecular Devices | N/A | SoftMax Pro 6.5.1 (platereader software) obtained through Academic Group License |
| Sterile filter units | Thermo Fischer Scientific | 09-741-88 | |
| Sucrose | Sigma-Aldrich | S0389 | |
| SYBR Safe DNA gel stain | Thermo Fischer Scientific | S33102 | |
| TAE buffer for agarose gel electrophoresis | Thermo Fischer Scientific | AM9869 | |
| Tetramethylethylenediamine (TEMED) | Sigma-Aldrich | T9281 | |
| Tris base | Sigma-Aldrich | TRIS-RO | |
| Tryptone (granulated) | Thermo Fischer Scientific | M0251S | |
| T7 RNA polymerase | New England Biolabs | M0251S | |
| Urea-PAGE Gel system | National Diagnostics | EC-833 | |
| UV fluorescent TLC plate | Sigma-Aldrich | 1.05789.0001 | |
| UV/Vis spectrophotometer | Thermo Fischer Scientific | ND-8000-GL | |
| Vortex mixer | Thermo Fischer Scientific | 2215415 | |
| Xylene cyanol | Sigma-Aldrich | X4126 | |
| Yeast Extract (Granulated) | Thermo Fischer Scientific | BP9727-2 |
참고문헌
- Su, Y., Hammond, M. C. RNA-based fluorescent biosensors for live cell imaging of small molecules and RNAs. Current Opinion in Biotechnology. 63, 157-166 (2020).
- Zhang, J., et al. Tandem spinach array for mRNA Imaging in living bacterial cells. Scientific Reports. 5, 17295 (2015).
- Wang, Z., et al. In spatial complementation of aptamer-mediated recognition enables live-cell imaging of native RNA transcripts in real time. Angewandte Chemie. 57 (4), 972-976 (2018).
- Strack, R. L., Disney, M. D., Jaffrey, S. R. A superfolding Spinach2 reveals the dynamic nature of trinucleotide repeat-containing RNA. Nature Methods. 10 (12), 1219-1224 (2013).
- Thavarajah, W., et al. Point-of-use detection of environmental fluoride via a cell-free riboswitch-based biosensor. ACS Synthetic Biology. 9 (1), 10-18 (2020).
- You, M., Litke, J. L., Jaffrey, S. R. Imaging metabolite dynamics in living cells using a Spinach-based riboswitch. Proceedings of the National Academy of Sciences of the United States of America. 112 (21), 2756-2765 (2015).
- Kellenberger, C. A., Wilson, S. C., Sales-Lee, J., Hammond, M. C. RNA-based fluorescent biosensors for live cell imaging of second messengers cyclic di-GMP and cyclic AMP-GMP. Journal of the American Chemical Society. 135 (13), 4906-4909 (2013).
- Manna, S., Truong, J., Hammond, M. C. Guanidine biosensors enable comparison of cellular turn-on kinetics of riboswitch-based biosensor and reporter. ACS Synthetic Biology. 10 (3), 566-578 (2021).
- Bose, D., Su, Y., Marcus, A., Raulet, D. H., Hammond, M. C. An RNA-based fluorescent biosensor for high-throughput analysis of the cGAS-cGAMP-STING pathway. Cell Chemical Biology. 23 (12), 1539-1549 (2016).
- Wang, X. C., Wilson, S. C., Hammond, M. C. Next-generation RNA-based fluorescent biosensors enable anaerobic detection of cyclic di-GMP. Nucleic Acids Research. 44 (17), 139 (2016).
- Paige, J. S., Thinh, N. -. D., Wenjiao, S., Jaffrey, S. R. Fluorescence imaging of cellular metabolites with RNA. Science. 335 (6073), 1194 (2012).
- Paige, J. S., Wu, K. Y., Jaffrey, S. R. RNA mimics of green fluorescent protein. Science. 333 (6042), 642-646 (2011).
- Filonov, G. S., Moon, J. D., Svensen, N., Jaffrey, S. R. Broccoli: Rapid selection of an RNA mimic of green fluorescent protein by fluorescence-based selection and directed evolution. Journal of the American Chemical Society. 136 (46), 16299-16308 (2014).
- Song, W., Strack, R. L., Svensen, N., Jaffrey, S. R. Plug-and-play fluorophores extend the spectral properties of spinach. Journal of the American Chemical Society. 136 (4), 1198-1201 (2014).
- Sambrook, J., Fritsch, E., Maniatis, T. . Molecular Cloning: A Laboratory Manual. , (1989).
- Basch, H., Gadebusch, H. H. In vitro antimicrobial activity of dimethylsulfoxide. Applied Microbiology. 16 (12), 1953-1954 (1968).
- Kallansrud, G., Ward, B. A comparison of measured and calculated single- and double-stranded oligodeoxynucleotide extinction coefficients. Analytical Biochemistry. 236 (1), 134-138 (1996).
- Wilson, S. C., Cohen, D. T., Wang, X. C., Hammond, M. C. A neutral pH thermal hydrolysis method for quantification of structured RNAs. RNA. 20 (7), 1153-1160 (2014).
- Szatmári, D., et al. Intracellular ion concentrations and cation-dependent remodelling of bacterial MreB assemblies. Scientific Reports. 10, 12002 (2020).
- Boulos, L., Prévost, M., Barbeau, B., Coallier, J., Desjardins, R. LIVE/DEAD® BacLightTM: Application of a new rapid staining method for direct enumeration of viable and total bacteria in drinking water. Journal of Microbiological Methods. 37 (1), 77-86 (1999).
- Huang, H., et al. A G-quadruplex-containing RNA activates fluorescence in a GFP-like fluorophore. Nature Chemical Biology. 10 (8), 686-691 (2014).
- Jeng, S. C. Y., Chan, H. H. Y., Booy, E. P., McKenna, S. A., Unrau, P. J. Fluorophore ligand binding and complex stabilization of the RNA Mango and RNA Spinach aptamers. RNA. 22 (12), 1884-1892 (2016).
- Han, K. Y., Leslie, B. J., Fei, J., Zhang, J., Ha, T. Understanding the photophysics of the Spinach-DFHBI RNA aptamer-fluorogen complex to improve live-cell RNA imaging. Journal of the American Chemical Society. 135 (50), 19033-19038 (2013).
- Wang, P., et al. Photochemical properties of Spinach and its use in selective imaging. Chemical Science. 4 (7), 2865-2873 (2013).
- Dao, N. T., et al. Photophysics of DFHBI bound to RNA aptamer Baby Spinach. Scientific Reports. 11, 7356 (2021).
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유