면역 조직 화학 및 면역 세포 화학: 광학 현미경을 통한 조직 이미징
Overview
출처: 마이클 S. 리1 과 토냐 J. 웹1
1 미생물학 및 면역학학과, 메릴랜드 의과 대학 및 말린과 스튜어트 그린바움 종합 암 센터, 볼티모어, 메릴랜드 21201
면역히스토화학(IHC) 및 면역세포화학(ICC)은 항체를 이용한 특정 항원들의 발현 및 국소화를 시각화하는 데 사용되는 기술이다. IHC의 첫번째 간행된 사용은 알버트 쿤스가 Pneumococcus에 감염된 마우스에서 조직 단면도에 있는 폐렴구균 항원의 존재를 구상하기 위하여 기술을 이용한 1941년에 이었습니다 (1). 이름, 면역 조직 화학, IHC에 사용되는 조직 섹션을 참조하여 항체 및 "히스토-"를 참조하여 뿌리 "면역-"에서 유래된다. 면역 세포화학의 뿌리 "사이토-"는 ICC와 IHC 의 주요 차이점을 강조합니다. IHC는 전체 조직의 섹션을 사용하는 반면, ICC는 조직에서 분리되거나 배양에서 자란 세포를 사용합니다. 사용된 샘플의 차이는 샘플 준비가 기술적으로 IHC와 ICC 간에 다르다는 것을 의미하지만, 그렇지 않으면 ICC와 IHC의 프로토콜은 동일하며 용어가 자주 상호 교환적으로 사용되는 것을 발견할 것입니다.
IHC와 ICC 모두에서, 각각 과산화제 또는 로다민과 같은 화학적 또는 형광 태그를 가진 항체는, 항원에 태그된 항체의 특정 결합을 통해 관심있는 어떤 항원든물의 분포를 시각화하기 위하여 이용된다. IHC의 경우, 조직의 얇은 조각은 염색되기 전에 조직의 구조를 유지하기 위해 슬라이드에 고정되어 전체 조직의 맥락에서 항원의 시각화를 허용한다(도 1). ICC의 경우, 세포는 염색되기 전에 슬라이드에 고르게 분포되어 개별 세포 내에서 항원 분포의 시각화를 허용하지만 특정 조직의 구조 내에는 허용되지 않습니다. 두 프로토콜 간의 유사성으로 인해 이 프로토콜은 IHC에 중점을 두어 IHC와 관련된 샘플 준비의 추가 복잡성을 해결합니다.
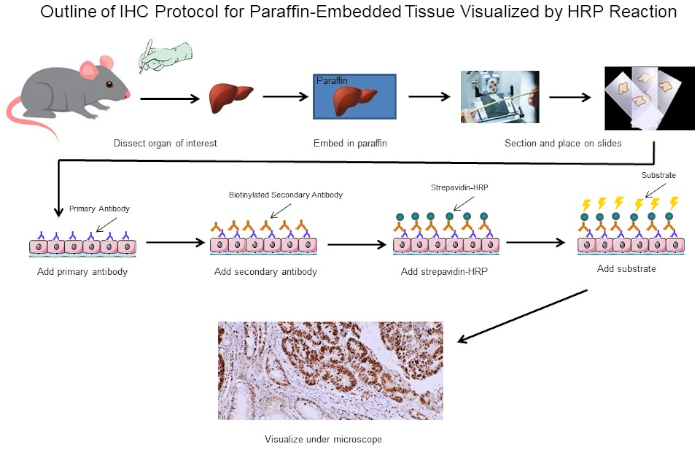
그림 1: IHC 프로토콜의 개요입니다. 마우스에서 해부된 파라핀 임베디드 조직을 위한 IHC 프로토콜의 시각적 윤곽선입니다. 이 프로토콜은 생체 분해된 이차 항체 및 스트레파비딘-HRP를 사용하여 항체 결합의 위치를 시각화합니다. 형광 태그 항체와 같은 다른 옵션도 가능합니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
IHC를 수행할 때 첫 번째 주요 결정은 염색 과정 전반에 걸쳐 조직의 구조를 유지하기 위해 조직 섹션을 준비하는 방법입니다. 두 가지 주요 선택은 파라핀 임베디드 조직의 포르말린 고정 섹션 또는 냉동 조직의 신선한 부분입니다. 어떤 다운스트림 분석이 수행될지에 따라 사용할 방법에 대한 간단한 대답은 없습니다. 파라핀 임베디드 조직의 포르말린 고정은 일반적으로 IHC 외부의 후속 분석약에 대한 단백질 기능을 보존할 수 있는 신선한 조직을 동결하는 동안 최적의 이미징을 위한 조직 형태를 더 잘 보존하는 것으로 생각됩니다. 또한, 신선한 냉동 조직 섹션은 유전자 발현 분석(2)에 더 적합한 것으로 나타났다. 세 번째 고려 사항은 관심있는 항원용 항체가 고정 또는 냉동 조직 섹션에 적합한지 여부이며, 일부 항체는 특정 유형의 단면에만 최적화되어 있고 다른 사람을 위해 작동하지 않을 수 있기 때문에. 마지막으로, 신선한 냉동 샘플을 -80°C로 유지해야 하고 고정 된 섹션이 실온에서 훨씬 더 오래 보관 할 수 있지만 1 년 이상 지속되지 않을 수 있기 때문에 조직 섹션을 저장하는 데 얼마나 걸리는지 결정해야합니다. 이들은 파라핀 임베디드 조직의 포르말린 고정 섹션 또는 냉동 조직의 신선한 부분을 사용할지 여부를 결정하기위한 주요 고려 사항 중 일부입니다. 궁극적으로, 하나는 충분 한 조직이 있는 경우, 그것은 단지 둘 다의 일부를 가지고 하는 것이 가장 좋을 수 있습니다.
본 실험에서, 우리는 림프종 발달의 자발적인 마우스 모델에서 확대된 비장에서 사이클린 D1 발현이 증가했는지 여부를 결정하기 위해 착수했다. 비장 조직 샘플은 림프종을 가지고 있지 않은 야생 형 마우스, 트랜스 제닉 마우스 또는 자발적으로 림프종을 개발한 형질 전환 마우스로부터 먼저 분리되었습니다. 비장 조직 샘플은 파라포름알데히드에 고정되었고, 파라핀에 내장되어, 절제되고, 마우스 항시클린 D1 1차 항체를 이용하여 염색하고, 말 항마우스 이차 항체를 거쳐 3,3-디아미노벤지딘(DAB)을 사용하여 개발하였다. 그 후 해리스 헤마톡슬린 솔루션에 섹션이 반소된 다음 섹션은 20배 배율로 이미지화되었습니다.
시약
파라핀 임베디드 섹션
- 4% 파라포름알데히드 (PFA)
- 에탄올 (무수성 변성, 조직학 등급 100%, 95%, 80%, 75%, 50%). 이중 증류수(ddH2O)를 사용하여 100% 스톡에서 희석할 수 있습니다.
- 자일렌 (동음이의)
- IHC 호환 유리 슬라이드는 조직 섹션이 전체 절차에 걸쳐 부착 된 상태로 유지되도록합니다. IHC 호환 유리 슬라이드는 특수 코팅을 가지고 있으며 여러 소매 업체에서 쉽게 사용할 수 있습니다. ICC를 수행하는 경우 챔버 슬라이드를 사용합니다. 챔버 슬라이드는 세포가 슬라이드에 부착하고 적절한 합류에 도달 할 때까지 챔버에서 세포를 시드하고 인큐베이터에 배치 할 수 있도록, 챔버를 제거하고 염색은 IHC와 같은 방식으로 진행 할 수 있습니다.
- 파라핀
- 과산화수소 0.3% (H 2 O2)/메탄올:준비하려면 1mL 30% H2O2 ~ 99mL 메탄올을 추가합니다. -20°C에 보관
- 항원 검색 버퍼: IHC 구연산 버퍼 pH 6.0
신선한 냉동 섹션
- 최적의 절삭 온도(10월) 포함 화합물
- 최적의 고정: -20°C로 냉각된 PFA 또는 아세톤 4%
얼룩
- 버퍼 차단: 사용자가 결정해야 합니다. 한 가지 예는 1X PBS로 희석된 말 혈청입니다.
- 희석 된 1 차 항체 : 제조 업체 사양 참조
- 희석 된 바이오티니드 이차 항체 : 제조업체 사양 참조
- 희석 된 아비딘 - 고추냉이 Peroxidase (HRP): 과산화제 시각화에 대해서만. 제조업체 사양을 참조하십시오.
- DAB 또는 다른 호환 기판
- 카운터스테인(선택 사항)
- 에탄올 (무수성 변성, 조직학 등급 100% 및 95%)
- 자일렌 (동음이의)
- 오가노/리모네 산
Procedure
1. 면역 세포 화학을위한 세포의 준비
- 24웰 배양판의 우물에 세포 현탁액의 0.5mL을 추가하여 챔버 슬라이드 또는 챔버 커버립에 관심의 종자 세포.
참고: 일부 세포는 폴리 리신으로 처리된 커버립과 같은 처리된 커버립에 성장을 요구할 수 있습니다. 최적의 치료 조건은 사용되는 세포 유형에 따라 사용자가 결정해야합니다. - 플레이트를 가습 된 CO2 인큐베이터에 넣고 세포가 50-70 % 컨할 때까지 37 ° C에서 성장할 수 있도록합니다.
- 세포가 최적의 합류성에 도달하면 각 우물에서 배양 매체를 제거하고 4 % PFA (1X PBS에서 희석)의 0.5 mL로 배양하여 세포를 수정하고 실온에서 20 분 동안 배양하십시오.
- 1x PBS 1mL로 고정을 제거하고 우물을 세 번 씻으시면 됩니다.
- 다음으로, 각각 의 0.5mL의 0.1% 트리톤-X
Results
Application and Summary
면역히스토화학(IHC) 및 면역세포화학(ICC)은 항체를 이용한 특정 항원들의 발현 및 국소화를 시각화하는 데 사용되는 기술이다. 조직은 조직 형태를 유지하고 슬라이드에 배치 얇은 섹션으로 먼저 잘라. 항체는 그 때 추가되고 관심있는 항원을 묶고 현미경의 밑에 그(것)들을 시각화할 수 있는 특정 꼬리표를 갖춰줍니다. 따라서, 이러한 기본 개념을 통해 조직 구조의 맥락에서 항원 분포를 시각화?...
References
- Coons, A. H. Creech, H. J., Jones, N. and Berliner, E. The Demonstration of Pneumococcal Antigen in Tissues by the Use of Fluorescent Antibody, The Journal of Immunology, 45 (3), 159-170 (1942).
- Ripoli, F. L., Mohr, A., Hammer, S. C., Willenbrock, S., Hewicker-Trautwein, M., Hennecke, S., Escobar, H. M. and Nolte, I. A comparison of fresh frozen vs. Formalin-fixed, paraffin-embedded specimens of canine mammary tumors via branched-DNA assay. International Journal of Molecular Sciences, 17 (5) (2016).
Tags
건너뛰기...
이 컬렉션의 비디오:

Now Playing
면역 조직 화학 및 면역 세포 화학: 광학 현미경을 통한 조직 이미징
Immunology
78.9K Views

유세포 분석 및 형광 활성화 세포 분류 (FACS): 비장 B 림프구의 분리
Immunology
93.0K Views

자기 활성화 세포 분류 (MACS): 흉선 T 림프구 분리
Immunology
22.9K Views

ELISA 분석: 간접, 샌드위치 및 길항
Immunology
238.5K Views

ELISPOT 분석: IFN-γ 분비 비장세포 검출
Immunology
28.5K Views

항체 생성: 융합 세포를 사용한 단일 클론 항체 생성
Immunology
43.6K Views

면역 형광 현미경 검사법: 파라핀이 내장 된 조직 절편의 면역 형광 염색
Immunology
53.9K Views

공 초점 형광 현미경: 쥐 섬유 아세포에서 단백질의 국소화를 결정하는 기술
Immunology
43.2K Views

면역침전반응 기반 기술: 아가로스 비즈를 사용한 내인성 단백질의 정제
Immunology
87.7K Views

세포주기 분석: 세포주기 CFSE 염색 및 유세포 분석을 사용한 자극 후 CD4 및 CD8 T 세포 증식 평가
Immunology
24.3K Views

입양 세포 전송: 기증자 쥐 비장 세포를 숙주 쥐에 도입 후 FACS를 통한 성공 평가
Immunology
22.3K Views

세포 사멸 분석: 세포 독성 능력의 크롬 방출 분석
Immunology
151.4K Views
Copyright © 2025 MyJoVE Corporation. 판권 소유