항체 생성: 융합 세포를 사용한 단일 클론 항체 생성
Overview
출처: 프랜시스 V. 자아스타드1,2,휘트니 스완슨2,3,토마스 에스 그리피스1,2,3,4
1 미생물학, 면역학 및 암 생물학 대학원 프로그램, 미네소타 대학교, 미니애폴리스, MN 55455
2 면역학 센터, 미네소타 대학, 미니애폴리스, MN 55455
3 미네소타 대학교 비뇨기과, 미니애폴리스, MN 55455
4 Masonic 암 센터, 미네소타 대학, 미니애폴리스, MN 55455
다각성 항체는 항원 또는 여러 항원(1)의 상이한 항원 결정제에 대하여 지시된 항체의 집합으로 정의됩니다. 다각성 항체는 생물학적 분자를 식별하기위한 강력한 도구이지만, 한 가지 중요한 한계가 있습니다 - 항원 결정제를 공유하는 항원을 구별 할 수 없습니다. 예를 들어, 소 혈청 알부민이 동물을 예방 접종하는 데 사용될 때, 다른 표면이 있는 B 세포는 소 세럼 알부민에 대한 상이한 항원 결정제에 반응하게 된다. 그 결과 항체의 혼합물이 항혈구에 혼합된다. 소 세럼 알부민은 단백질의 진화적으로 보존된 영역에서 인간 혈청 알부민과 일부 에피토페를 공유하기 때문에, 이 안티소빈 세럼 알부민 안티세럼은 또한 인간 혈청 알부민과 반응할 것이다. 따라서,이 항세럼은 소와 인간의 혈청 알부민을 구별하는 데 유용하지 않습니다.
다발성 항세라의 특이성 문제를 극복하기 위해 몇 가지 접근법이 취해졌습니다. 하나는 고정된 항원의 크로마토그래피 컬럼을 통해 항혈을 전달함으로써 원치 않는 항체를 흡수함으로써(2)이다. 이 방법은 지루하고 자주 완전히 원치 않는 항체를 제거 할 수 없습니다. 또 다른 접근법은 개별 항체 생산 B 세포를 분리하고 배양에서 확장하는 것입니다. 그러나, 대부분의 일반적인 변환되지 않은 세포같이, B 세포는 장기 배양에서 살아남지 않습니다.
배양에서 살아남기 위해 B 세포의 무능력을 극복하기 위해, 한 가지 방법은 골수종-B 세포 혼종을 준비하는 것이다. 1847년, 헨리 Bence-Jones는 림프성 종양인 다발성 골수종을 가진 환자가 다량의 항체(3)를 생산한다는 것을 발견했습니다. 이 환자에 있는 B 세포는 악성되고 통제할 수 없는 성장합니다. 악성 B 세포는 단일 클론으로부터 파생되기 때문에, 그들은 동일하고 항체의 단일유형(즉,단일 클론 항체 또는 mAb)만 생성한다. 그러나, 이러한 골수종 세포의 대부분은 알 수 없는 특이성의 항체를 생산. 1975년, 골수종 세포를 B 세포에 융합시킴으로써, 세자르 밀스타인과 조지 콜러는 시험관내에서 무기한 배양될 수 있는 혼종 생성에 성공하여 알려진 항원 특이성의 무제한 의 단일클론 항체를 생산한다(4). 그들의 접근의 뒤에 근거는 골수종 세포의 불멸의 속성 및 B 세포의 생성 하는 항체를 결합 하는. 그들의 기술은 항체 생산을 혁명화하고 단일 클론 항체를 사용하여 생물학적 분자의 식별 및 정화를위한 강력한 수단을 제공합니다.
일반적으로 단일 클론 항체를 준비하는 것은 몇 달이 필요합니다. 일반 절차에는 다음 단계가 포함됩니다.
- 항체 티터의 예방 접종 및 선별
- 항체 생성 B 세포 및 골수종 세포의 융합
- 혼종의 선택적 성장
- 원하는 단일 클론 항체를 생산하기위한 혼종 스크리닝
- 희석을 제한하여 복제 - 세포가 통계적으로 96웰 플레이트의 우물에 첨가될 1세포 미만을 허용하도록 농도로 희석되는 과정. 일부 우물은 0 세포로 끝나고 일부는 1 개의 세포가 있습니다. 1 세포와 함께 씨를 뿌렸던 우물은 결국 세포의 단일 클론 인구로 성장할 것입니다.
- 단일 클론 항체의 하이브리드 종의 성장 및 준비
이 프로토콜은 마지막 단계에 초점을 맞추고 - 혼성종의 성장과 단일 클론 항체의 준비. 항체는 암모늄 황산염 강수량(종종 염화아웃이라고도 함)에 의해 배양 상수로부터 정제된다 - 용액에서 단백질을 제거하는 일반적으로 사용되는 방법. 용액의 단백질은 노출된 극지 및 이온 그룹을 통해 물과 함께 다른 친수성 상호 작용과 함께 수소 결합을 형성합니다. 작고 고압이 많은 이온(예: 암모늄 또는 황산염)의 농도가 추가되면, 이들 그룹은 물에 결합하기 위한 단백질과 경쟁한다. 이것은 단백질에서 물 분자를 제거하고 그것의 용해도를 감소시켜 단백질의 강수량을 초래합니다.
Procedure
참고: 멸균 세포 배양 기술은 항체 정화 단계까지 혼성종 세포 및 미디어를 멸균 방식으로(예를 들어, 생물안전 캐비닛에서)로 처리할 때 유지되어야 한다.
1. 동결 된 혼종 세포를 해동
- 37°C 수조에서 냉동 혼종 세포를 함유한 바이알을 해동(약 2분)까지 배양합니다.
- 해동 된 세포를 완전한 RPMI10 mL (RPMI는 10 % 태아 소 세럼, 100 U /mL 페니실린, 100 μg /mL 연쇄 상감, 1mM 나트륨 pyruvate, 1x 비 필수 아미노산, 50 μ-10 μm)를 포함하는 15 mL 원추형 튜브에 추가하십시오.
- 1200 RPM에서 5분 동안 원심분리기를 사용하여 오염된 동결 매체를 씻어낼 수 있습니다.
- 원심 분리 후 액체 상체를 버리고 5mL의 신선한 완전 RPMI로 셀 펠릿을 다시 분리하십시오. 이어서, 15mL 완전 RPMI를 함유하는 T75 조직 배양 플라스크에 세포를 추가한다(RPMI의 최종 부피는 20mL이다).
- 표준 인큐베이터에서 5% CO2로세포를 37°C에서 성장시면 됩니다. 세포는 배양에 있는 동안 비 신봉입니다.
2. 하이브리드종 확장
- 플라스크가 ~80% 컨실수 될 때까지 세포가 약 3일 동안 팽창하도록 합니다.
참고: 이 시간의 양은 세포의 시작 수에 따라 다를 수 있습니다., 다른 세포의 성장 속도에 내재 된 차이 뿐만 아니라. 세포가 기하급수적 성장 단계에 있는 것이 중요합니다. - 초기 플라스크가 ~80%의 합류에 도달하면, 이 초기 T75 플라스크에서 세포를 제거하고 원추형 원심분리기 튜브에 넣고 스핀(1200 RPM for 5분)을 사용하여 세포를 펠릿합니다.
- 완전한 RPMI의 6mL에서 세포를 다시 중단한 다음 셀 서스펜션을 3개의 새로운 T75 플라스크(18mL RPMI를 함유한 2mL/플라스크)로 분배한다. 이 세 개의 T75 플라스크를 37°C에서 5% CO2로 배양하여 ~80% 컨할 때까지 배양합니다(약 3일이 소요됩니다).
3. 세럼이 없는 매체의 항체 생산
참고: 이 시점에서, 세포는 혼종 세포주의 성장을 위해 설계된 혈청없는 매체에서 그들의 성장을 계속할 준비가 되어 있습니다. 이 프로토콜에서는 HB101 보충 제품을 포함하는 즉시 사용 가능한 HB 기저 액체 매체를 사용합니다.
- 3개의 T75 플라스크(~80% 수렴)의 각각의 세포가 수집되고 원심분리(5분 동안 1200RPM).
- 각 T75 플라스크의 셀 펠릿은 10mL보충 HB101 세럼 프리 배지로 재주중단된 다음, 2개의 T225 플라스크보충 HB101 세럼 프리 배지(즉, 5mL 셀 서스펜션각각 ~220-240 mL HB101)를 함유하고 있다.
- 3주 동안 5%CO2로 T225 플라스크 및 HB101 미디어에서 세포를 계속 성장시키고, 세포가 죽기 시작할 때까지 계속 성장한다. 세포는 이 3 주 도중 mAb를 생성하고 배양 배지로 분비하고 있습니다. 세포가 죽기 시작하면 더 이상 mAb를 생성하지 않습니다.
4. 항체 정화 - 1일차
참고: 이 시점에서, 멸균은 유지될 필요가 없으므로 멸균 방식으로 미디어를 취급할 필요가 없습니다(예를 들어, 생물안전 캐비닛에서)는 필요하지 않다. 또한, hybridomas는 "BSL2 수준" 에이전트로 간주되지 않습니다.
- 고정 각도 로터를 위해 플라스크에서 미디어를 튜브에 붓습니다. 원심분리기에서 10,000 RPM의 고정 각도 로터로 튜브를 8분간 회전시합니다. 이 단계는 문화 상수에서 세포 이물질을 제거하도록 설계되었습니다.
참고: 튜브 크기는 사용되는 로터에 따라 다를 수 있습니다. 기억해야 할 중요한 것은 원심분리 전에 로터가 제대로 균형을 이루도록 튜브에 동일한 부피를 갖는 것입니다. 미디어의 전체 볼륨이 한 번에 원심분리기에 맞지 않을 가능성이 높습니다. 나머지 미디어는 동일한 튜브를 사용하여 나중에 원심 분리됩니다 (단계 4.5). - 얼음으로 둘러싸인 양동이에 스티어 바가 있는 2L 플라스틱 비커를 준비합니다. 교반 접시에 놓습니다.
- 1L 병에 500mL 필터 탑을 부착합니다. 적절한 튜브를 통해 진공을 수용하기 위해 병 상단 필터 장치를 부착하십시오.
- 4.1 단계 (여전히 하이브리드 종 세포에 의해 생성 된 mAb를 포함하는) 에서 상체를 필터 상단에 붓습니다.
- 동일한 튜브 세트를 사용하여 미디어에서 세포 이물질을 펠릿으로 계속 사용하십시오(펠릿은 계속 빌드됩니다). 필터 상단이 가득 차서 또 다른 상복부 배치가 쏟아질 준비가 될 때까지 진공을 실행하십시오. 필터를 건조시키거나 필터링이 매우 느려지게 하지 마십시오.
- 1L 병이 가득 차면 필터 상단을 제거하고 4.2 단계에서 준비된 2L 비커에 슈퍼나탄을 붓습니다. 필터 상단을 다시 연결합니다. 볼륨을 추적합니다.
- 모든 미디어가 처리될 때까지 원심분리 및 여과 단계를 반복합니다.
- 수집된 여과된 수퍼나탈의 1L당 295g의 황산암모늄을 측정합니다. 교반하는 동안, 앞으로 몇 시간(~25g마다 15분마다)에 걸쳐 상체에 황산암모늄을 천천히 추가하여 원치 않는 단백질이 침전될 수 있는 황산염의 국부화된 고농도를 방지합니다.
- 모든 암모늄 황산염이 추가되면 비커를 호일로 덮고 교반 판으로 4 °C (예 : 대형 냉장고 또는 차가운 방)로 이동하십시오. 하룻밤 저어주세요. 용액의 일정한 교반은 소금을 용해시키는 데 필요하지만, 장기간교반교는 표면/공기 인터페이스에서 용액에서 단백질의 저하로 이어질 수 있다.
- 고정 각도 로터를 사용하여 튜브를 세척합니다.
5. 항체 정화 - 2일차
- 2L 비커에서 상체가 함유된 암모늄-황산염을 튜브에 부어 고정 각도 로터를 넣습니다. 6500 RPM에서 6500 RPM의 고정 각도 로터로 원심분리기에서 브레이크 없이 20분 간 회전합니다.
- 진공 청소기는 부드러울 때 펠릿을 빨아들이지 않도록 주의하여 슈퍼에 흡인합니다. 동일한 튜브 세트를 사용하여 상체가 함유된 암모늄 황산염으로부터 펠릿을 수집합니다.
- 마지막 포부 후, 각 펠릿 (항체포함)을 ~1 ml PBS로 재보습하십시오.
- 많은 양의 PBS에 대한 투석에 의해 침전 된 mAb 용액에서 황산 암모늄을 제거하십시오. 이를 위해 먼저 mAb 솔루션의 각 mL에 대해 약 1인치의 투석 튜브(예: Membra-Cel MD25-14 MWCO 12,000-14,000 달튼 컷오프 셀룰로오스 투석 튜브)를 잘라냅니다. 튜브를 dH2O. 튜브의 한쪽 끝에 매듭을 묶고 dH2O로 채우기하여 매듭이 누출되지 않는지 확인합니다. 튜브에서 빈 dH2O.
- 파이펫 PBS/항체 용액을 튜브에 넣습니다. 0.25ml의 추가 로 튜브를 헹구고 튜브로 옮김합니다.
- 주황색 투석 클립으로 가능한 한 용액에 가깝게 튜브 상단을 고정합니다.
- 튜브 의 상단을 4L 비커의 외부 상단에 테이프. 튜브의 채워진 부분이 비커에 매달려 있도록 합니다. 비커를 PBS로 채우고 스터디 바를 추가합니다.
- 4°C에서 ~8시간 동안 밤새 저어줍니다.
- 비커의 PBS를 신선한 PBS로 교체하고 ~8시간 2회 더 저어줍니다.
- 항체를 튜브에서 15ml 또는 50ml 원문 튜브로 이송합니다. 1200 RPM에서 5분 동안 원심분리기는 형성되었을 수 있는 침전을 제거합니다. 상체를 신선한 튜브로 옮기.
- PBS (5 μl 항체 + 95 μl PBS)로 항체 1:20의 알리쿼트희석. 280 nm에서 분광계(PBS를 가진 공백)로 항체 농도를 양수합니다. 1.43의 소멸 계수(ε)를 사용하십시오. 농도는
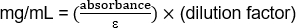
- 항체를 나사 캡 바이알에 알리쿼트와 -80°C에 보관합니다.
Results
이 프로토콜을 사용하여 다음과 같은 결과를 여러 가지 혼성종으로 얻었습니다.
하이브리드종: RB6-BC5 (쥐 안티 마우스 Ly6C/Ly6G (Gr1) IgG2b, θ mAb)
OD280 - 1.103
(1.103/1.43) (20) = 15.42 mg/mL
하이브리드종: GK1.5 (쥐 안티 마우스 CD4 IgG2b, θ mAb)
OD280 - 0.485
(0.485/1.43) (20) = 6.78 mg/mL
하이브리드종: 2.43 (쥐 안티 마우스 CD8 IgG2b, θ mAb)
OD280 - 0.209
(0.209/1.43) (20) = 2.92 mg/mL
이들은 모두 예제 결과이며, 동일한 hybridoma를 가진 각 생산 실행이 마지막에 유효한 mAb의 양에서 약간 다를 수 있다는 것을 주의하는 것이 중요합니다.
Application and Summary
위에서 설명한 절차는 혼종 배양 상수에서 단클론 항체를 정화하는 간단하고 직선적인 방법입니다. 하지만 황산암모늄은 문화상수퍼에 있을 수 있는 다른 단백질을 침전시킬 것이라는 점을 기억하는 것이 중요합니다. 따라서, 흡광도 측정에서 결정된 항체 농도는 추정치이다. 사용자는 SDS-폴리아크라이글라미드 젤에 소량을 실행하여 투석된 샘플의 순도를 평가할 수 있다. 이 방법론을 사용하여 일단 정제된 혼성종에 의해 생성된 mAb는 다양한 방법으로 사용될 수 있다. 전술한 RB6-BC5, GK1.5 및 2.43 mAb는 마우스에서 각각 호중구, CD4 T 세포 및 CD8 T 세포의 생체 고갈에 일반적으로 사용된다. 이 프로토콜을 사용하여 제조 및 정제된 다른 mAb는 유동 세포측정(플루오로포어에 공인되거나 보조 Ab와 함께), ELISA 또는 서양 블로팅에 사용될 수 있다.
References
- Lipman NS, Jackson LR, Trudel LJ, Weis-Garcia F. Monoclonal versus polyclonal antibodies: distinguishing characteristics, applications, and information resources. ILAR Journal, 46 (3), 258-268 (2005).
- Arora S, Ayyar BV, O'Kennedy R. Affinity chromatography for antibody purification Methods Mol Biol. 1129, 497-516 (2014).
- Henry BJ. On a new substance occurring in the urine of a patient with mollities ossium. Philosophical Transactions of the Royal Society of London. 138, 55-62 (1848).
- Köhler G and Milstein C. Continuous cultures of fused cells secreting antibody of predefined specificity". Nature. 256, 495-497 (1975).
Tags
건너뛰기...
이 컬렉션의 비디오:

Now Playing
항체 생성: 융합 세포를 사용한 단일 클론 항체 생성
Immunology
43.6K Views

유세포 분석 및 형광 활성화 세포 분류 (FACS): 비장 B 림프구의 분리
Immunology
93.2K Views

자기 활성화 세포 분류 (MACS): 흉선 T 림프구 분리
Immunology
23.0K Views

ELISA 분석: 간접, 샌드위치 및 길항
Immunology
239.0K Views

ELISPOT 분석: IFN-γ 분비 비장세포 검출
Immunology
28.7K Views

면역 조직 화학 및 면역 세포 화학: 광학 현미경을 통한 조직 이미징
Immunology
79.1K Views

면역 형광 현미경 검사법: 파라핀이 내장 된 조직 절편의 면역 형광 염색
Immunology
53.9K Views

공 초점 형광 현미경: 쥐 섬유 아세포에서 단백질의 국소화를 결정하는 기술
Immunology
43.3K Views

면역침전반응 기반 기술: 아가로스 비즈를 사용한 내인성 단백질의 정제
Immunology
87.8K Views

세포주기 분석: 세포주기 CFSE 염색 및 유세포 분석을 사용한 자극 후 CD4 및 CD8 T 세포 증식 평가
Immunology
24.3K Views

입양 세포 전송: 기증자 쥐 비장 세포를 숙주 쥐에 도입 후 FACS를 통한 성공 평가
Immunology
22.5K Views

세포 사멸 분석: 세포 독성 능력의 크롬 방출 분석
Immunology
151.4K Views
Copyright © 2025 MyJoVE Corporation. 판권 소유