Для просмотра этого контента требуется подписка на Jove Войдите в систему или начните бесплатную пробную версию.
Method Article
Индукция микропотоков несферическими пузырьковыми колебаниями в системе акустической левитации
В этой статье
Резюме
Предложена быстрая и надежная методика управления колебаниями формы одного захваченного акустического пузыря, основанная на технике коалесценции между двумя пузырьками. Стационарные, контролируемые симметрией колебания формы пузырьков позволяют анализировать поток жидкости, генерируемый в непосредственной близости от границы раздела пузырьков.
Аннотация
При расположении вблизи биологических барьеров колеблющиеся микропузырьки могут увеличивать проницаемость клеточной мембраны, обеспечивая интернализацию лекарств и генов. Экспериментальные наблюдения показывают, что временная пермеабилизация этих барьеров может быть связана с напряжением сдвига, которое оказывается на клеточные ткани при кавитационном микропотоке. Кавитационный микропоток - это генерация вихревых потоков, которые возникают вокруг колеблющихся ультразвуковых микропузырьков. Чтобы создать такие потоки жидкости, колебания пузырьков должны отклоняться от чисто сферических колебаний и включать либо поступательную неустойчивость, либо моды формы. Экспериментальные исследования пузырьковых течений и напряжений сдвига на близлежащих поверхностях часто ограничены по своему объему из-за трудности улавливания деформаций формы микропузырьков стабильным и контролируемым образом. Описана конструкция камеры акустической левитации для исследования управляемых симметрией несферических колебаний. Такой контроль осуществляется с помощью метода коалесценции между двумя приближающимися пузырьками в достаточно интенсивном ультразвуковом поле. Управление несферическими колебаниями открывает путь к управляемому кавитационному микропотоку свободного поверхностно-колеблющегося микропузырька. Камеры с высокой частотой кадров позволяют квазиодновременно исследовать динамику несферических пузырьков на акустическом временном масштабе и поток жидкости на более низком временном масштабе. Показано, что может быть получено большое разнообразие паттернов жидкости и что они коррелируют с модальным содержимым границы раздела пузырьков. Мы демонстрируем, что даже моды формы высокого порядка могут создавать жидкие паттерны на больших расстояниях, если динамика интерфейса содержит несколько мод, подчеркивая потенциал несферических колебаний для адресной и локализованной доставки лекарств.
Введение
В медицине вводимое лекарство должно преодолеть множество препятствий в живой системе, прежде чем достичь желаемых целей. Тем не менее, большинство лекарств быстро выводятся из кровотока. Эффективность таргетирования низкая, и они не могут легко пересекать клеточные мембраны, что приводит к неэффективной доставке лекарств. В настоящее время использование микропузырьков в сочетании с ультразвуком предложено в качестве инновационного метода неинвазивной, точной и целенаправленной доставки лекарственных препаратов и генов к патологическим тканям и клеткам1. В этом подходе микропузырьки могут играть роль носителей, когда свободные лекарства либо вводятся вместе с суспензией газовых пузырьков, либо загружаются на ее поверхность. Микропузырьки также могут выступать в качестве локального вектора для перефокусировки ультразвуковой энергии для взаимодействия с клетками. По сути, под ультразвуковым воздействием пузырьки стабильно сжимаются и расширяются, режим, называемый стабильной кавитацией, который генерирует потоки жидкости и, следовательно, напряжение сдвига на близлежащих объектах. Микропузырьки также могут колебаться нелинейно и расширяться до коллапса в режиме инерционной кавитации, создавая ударные волны, которые распространяются радиально от места коллапса2. Было показано, что кавитация, стабильная или инерционная, усиливает проникновение клеточных мембран и, таким образом, усиливает интернализацию лекарств в клетку3.
В терапевтических приложениях понимание механизма взаимодействия пузырьковых клеток очень важно, но есть несколько барьеров, как с научной, так и с технической стороны, которые мешают нашим знаниям продвигаться вперед. Во-первых, уловить динамику клеток в ответ на механические стимулы, вызванные пузырьками, очень сложно4. В акустическом масштабе времени колебания микропузырьков первого порядка могут приводить к активации мембранных каналов, облегчая молекулярное прохождение через биологические интерфейсы. Это происходит за счет прямого колебания клеточной мембраны, также называемого «клеточным массажем»5. Активация канала после прямого механического воздействия была подтверждена с использованием методов патч-зажима, которые измеряли электрофизиологические свойства клеточных мембран во время и после ультразвукового воздействия6. Измерение индуцированной пузырьками клеточной динамики (то есть полного поля деформации клеточной мембраны) в акустической шкале времени также даст представление о пороге расширения площади мембраны Δ A/A, необходимого для индуцирования пор в клеточной мембране7. Вторым барьером является контроль режима коллапса пузырьков, чтобы избежать лизиса клеток, вызванного микропузырьками. Схлопывание пузырьков и индуцированные микроструи были идентифицированы как механизм, посредством которого происходит перфорация мембраны 8,9. После проникновения клеточная мембрана восстанавливается за счет самогерметизации липидных бислоев кальция и слияния внутриклеточных везикул9. Возникновение схлопывания пузырьков также может привести к летальному повреждению клетки и вызвать ненужные побочные эффекты в окружающих. В чувствительных приложениях, таких как ультразвуковое опосредованное открытие гематоэнцефалического барьера, общепризнано, что следует избегать схлопывания инерционных пузырьков10.
Поэтому в настоящее время огромные усилия направлены на проектирование последовательностей ультразвукового излучения в сочетании с пассивным кавитационным мониторингом и контролем, чтобы обеспечить стабильные колебания микропузырьков11. В этом стабильном режиме была выдвинута гипотеза о том, что стабильно колеблющиеся пузырьки играют сильную роль в запуске пермеабилизации мембраны, способствуя пространственно-направленному напряжению сдвига на клеточной мембране7. Напряжение сдвига возникает из-за потоков жидкости, создаваемых в непосредственной близости от колеблющихся пузырьков. Эти потоки жидкости называются кавитационным микропотоком, и, как упоминалось выше, они являются одним из нескольких возможных механизмов, ответственных за усиленное поглощение внеклеточных молекул. При работе с суспензией пузырьков или клеток, таких как биологические трансфекции in vitroанализы 12, пермеабилизация путем микростриминга может быть гораздо более эффективной, чем пермеабилизация путем коллапса пузырьков. Это можно показать простым геометрическим соображением. В клеточных суспензиях сонопорация будет эффективной, если большинство взвешенных клеток подвергается достаточно большим механическим воздействиям (что приводит к пермеабилизации мембраны). Известно, что схлопывания пузырьков направлены вдоль направления нарушения изотропной симметрии, такой как ось13 пузырь-стенка или линия пузырь-пузырь и пузырьковая ячейка, соединяющая их центрмасс 14. Таким образом, полученная микроструя представляет собой пространственно-локализованное явление вдоль конечного числа линий, соединяющих клеточный и пузырьковый центры. В зависимости от концентрации клеток и пузырьков, а также расстояния между пузырьковыми клетками этот эффект может быть не самым эффективным для проникновения всего числа взвешенных клеток. Напротив, кавитационный микропоток — это явление, происходящее в медленном временном масштабе, с большим пространственным расширением по сравнению с радиусом пузырька. Кроме того, поток жидкости распределяется по всему пузырьку и, следовательно, может воздействовать на большее количество клеток на очень большом расстоянии. Таким образом, понимание генерируемого кавитационного микропотока вокруг колеблющегося пузырька является необходимым условием для контроля и количественной оценки напряжения сдвига, вызванного пузырьком, которое прикладывается к клеткам.
Для этого предварительный этап состоит в управлении сферическими и несферическими колебаниями пузырька, управляемого ультразвуком, поскольку генерируемые потоки жидкости индуцируются движением границы раздела15,16 пузырьков. В частности, колебания формы микропузырьков должны запускаться и поддерживаться стабильными. Кроме того, необходимо контролировать ориентацию колебаний формы пузырька, чтобы правильно проанализировать корреляцию между динамикой границы раздела пузырьков и индуцированным микропотоковым паттерном. При обобщении существующей литературы очевидно, что подробные экспериментальные результаты кавитационно-индуцированного микропотока доступны только для пузырьков, прикрепленных к поверхности. Микропузырьки, прикрепленные к стене, обычно используются для оценки точной динамики интерфейса и взаимодействия клеток в микрометровом масштабе в системе сверхбыстрой микроскопии. Эта конфигурация терапевтически актуальна при рассмотрении вибрирующих микропузырьков, расположенных на клеточной мембране17,18,19. Однако изучение пузырьков, прикрепленных к подложке, может усложнить анализ динамики пузырьков, отчасти из-за сложного характера динамики20 контактной линии и срабатывания мод21 асимметричной формы. В медицинских и биологических приложениях пузырьки, которые не прикреплены к стене, обычно встречаются в ограниченных геометрических формах, таких как небольшие сосуды. Это существенно влияет на динамику пузыря и нестабильность формы. В частности, наличие ближайшей стенки смещает порог давления для срабатывания режима формы на более низкие значения давления в зависимости от номера режима формы и размера пузырька22. Стенка также влияет на микропоток, индуцированный пузырьками, с возможно более высокой интенсивностью для создаваемого потока23.
Среди всех возможных сценариев, с которыми могут столкнуться микропузырьки (свободные или прикрепленные, близко к стене, коллапсирующие или стабильно колеблющиеся), мы предлагаем исследовать несферическую динамику одного пузыря вдали от любой границы. Экспериментальная установка основана на системе24 акустической левитации, в которой стоячая ультразвуковая волна используется для улавливания пузыря. Этот сценарий согласуется с медицинскими приложениями, в которых набор взвешенных пузырьков и клеток сосуществует, например, в камере сонотрансфекции. Поскольку пузырьки и ячейки расположены не слишком близко, предполагается, что наличие ячейки не влияет на динамику границы раздела пузырьков. Когда клетки следуют петлевым траекториям кавитационно-индуцированного микропотока, они циклически приближаются и отталкиваются от местоположения пузырька, и мы можем предположить, что присутствие клетки не влияет ни на картину потока, ни на его среднюю скорость. Кроме того, с теоретической точки зрения хорошо известны несферическая динамика и индуцированные микропотоки от одиночных пузырьков, удаленных от границы. Чтобы связать индуцированный пузырьками поток жидкости с динамикой контура пузырька, необходимо точно охарактеризовать динамику границы раздела пузырьков. Для этого предпочтительно адаптировать пространственно-временной масштаб в экспериментальных исследованиях по отношению к тем, которые используются в терапии, таким образом, чтобы сбор данных с помощью обычных высокоскоростных камер (менее 1 миллиона кадров в секунду) был возможен с использованием больших пузырьков, возбужденных на более низких частотах. При рассмотрении пузырьков без покрытия собственная частота ω n данной моды n связана с размером пузырька как 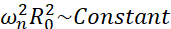 25. Это соотношение радиус-собственная частота несколько изменяется при рассмотрении оболочечных пузырьков26, но порядок величины собственной частоты ωn остается прежним. Таким образом, исследование пузырьков с равновесными радиусами ~ 50 мкм в ультразвуковом поле 30 кГц аналогично изучению покрытых пузырьков радиусом ~ 3 мкм в поле 1,7 МГц, как предложено Dollet et al.27. Таким образом, ожидаются аналогичные номера режимов формы и, следовательно, микропотоковые шаблоны.
25. Это соотношение радиус-собственная частота несколько изменяется при рассмотрении оболочечных пузырьков26, но порядок величины собственной частоты ωn остается прежним. Таким образом, исследование пузырьков с равновесными радиусами ~ 50 мкм в ультразвуковом поле 30 кГц аналогично изучению покрытых пузырьков радиусом ~ 3 мкм в поле 1,7 МГц, как предложено Dollet et al.27. Таким образом, ожидаются аналогичные номера режимов формы и, следовательно, микропотоковые шаблоны.
Для того, чтобы вызвать несферические колебания границы раздела пузырьков, необходимо превысить определенный порог давления, зависящий от радиуса, как показано на рисунке 1. Существующие экспериментальные методы основаны на увеличении акустического давления для запуска поверхностных мод (проиллюстрированных траекторией (1) на рисунке 1) либо путем ступенчатого повышениядавления 28 , либо путем возбуждения с модулированной амплитудой, ответственного за периодическое возникновение и исчезновение поверхностных мод29. Основными недостатками этих методов являются: (i) случайная ориентация оси симметрии поверхностных колебаний, которые не могут контролироваться в плоскости изображения, (ii) короткое время жизни колебаний в форме пузырьков, что затрудняет анализ индуцированных потоков жидкости в больших временных масштабах, и (iii) частое срабатывание неустойчивых мод формы. Мы предлагаем альтернативный метод пересечения порога давления при постоянном акустическом давлении на карте радиус/давление, как показано на пути (2) на рисунке 1. Для этого необходимо увеличить размер пузырька так, чтобы он находился в зоне нестабильности. Такое увеличение выполняется методом пузырьковой коалесценции. Слияние двух, первоначально сферически колеблющихся, микропузырьков используется для создания одного деформированного пузыря. Если акустическое давление и размер пузырьков слипшегося пузырька находятся в зоне неустойчивости, срабатывают поверхностные моды. Мы также доказали, что метод коалесценции индуцирует колебания устойчивой формы в установившемся режиме, а также управляемую ось симметрии, определяемую прямолинейным движением двух приближающихся пузырьков. Поскольку колебания стабильной формы обеспечиваются в течение нескольких минут, анализ потока жидкости, вызванного пузырьками, возможен путем засева жидкой среды флуоресцентными микрочастицами, освещенными тонким лазерным листом. Регистрация движения твердых микрочастиц в непосредственной близости от границы раздела пузырьков позволяет идентифицировать закономерность индуцированного потокажидкости 30. Общий принцип срабатывания колебаний в форме пузырьков, приводящих к стабильному по времени течению жидкости, проиллюстрирован на рисунке 2.
В следующем протоколе мы описываем шаги, необходимые для создания стабильных колебаний в форме пузырьков с помощью метода коалесценции, и описываем измерения потока жидкости. Это включает в себя проектирование системы акустической левитации, акустическую калибровку, зарождение пузырьков и метод коалесценции, измерение динамики границы раздела пузырьков и окружающего потока жидкости, а также обработку изображений.
протокол
1. Конструкция камеры акустической левитации
- Спроектируйте оптически прозрачный (похожий на ПММА) кубический резервуар (кромка 8 см и толщина 2,8 мм на грань) с модулем геометрии программного обеспечения для мультифизического моделирования (таблица материалов).
- Вставьте цилиндрическую поверхность (Ø = 35 мм) по центру в нижней части резервуара, чтобы смоделировать ультразвуковой преобразователь.
- Установите граничные условия равным нулевому давлению на каждую стенку с нормальным смещением амплитуды 1 мкм на поверхности преобразователя.
- Используя модуль частотной области, смоделируйте функцию частотной характеристики (FRF) резервуара в диапазоне частот [10 - 40] кГц в трех произвольных местах: loc1 = (0,01375, 0,01375, 0,04125), loc2 = (0, 0, 0,0088) и loc3 = (0,021725, 0,023375, 0,00935).
- Отрегулируйте размер бака таким образом, чтобы один из акустических режимов резонатора соответствовал номинальной частоте преобразователя (здесь 31,2 кГц). Таким образом, FRF содержит один резонансный пик, близкий к этой частоте, как показано на рисунке 3.
- Постройте поле давления внутри резервуара, как показано на рисунке 4. Выбранная резонансная мода должна содержать, по крайней мере, одну пучность давления во внутренней части контейнера, на которой будет захвачен акустический пузырь.
- При проектировании резервуара спроектируйте подвижную верхнюю поверхность с направляющей канавкой на каждом краю, чтобы плотно закрывать поверхности резервуара. Просверлите крошечное отверстие на верхней поверхности, чтобы заполнить резервуар жидкой средой.
- Поместите резервуар для воды на самодельную раму, содержащую ультразвуковой преобразователь (типа Ланжевена, номинальная частота 31,2 кГц). Используйте эхографический гель для соединения датчика с нижней стенкой резервуара.
- Поместите систему резервуара и рамы на стол смещения в трех направлениях с помощью микрометрических винтов.
- Наполните бак микрофильтрованной, деминерализованной и водой (не дегазированной, объемом ~ 500 мл, насыщение кислородом примерно 8 мг· Л-1).
ПРИМЕЧАНИЕ: Использование недегазированной воды вместо дегазированной позволяет поддерживать стабильные пузырьки на протяжении всего эксперимента. Использование дегазированной воды ускорит сжатие пузырьков из-за диффузии газа, даже если оно немного уравновешено ректифицированной (опосредованной ультразвуком) диффузией.
2. Генерация пузырьков и акустическая калибровка
- Подготовьте экспериментальную установку, используемую для лазерно-индуцированного зарождения пузырьков, акустического возбуждения и высокоскоростной записи (рис. 5a, b, c). Экспериментальная установка состоит из (A) системы акустической левитации, (B) источника питания лазера и (C) лазерной головки, (D) одной сферической вогнутой линзы, (E) одной плосковогнутой линзы и одной асферической линзы, (F) высокоскоростной камеры, (G) непрерывного светодиода. Позже, для измерений потоков жидкости (рис. 5d) (H) будет добавлен один непрерывный лазерный источник, (I) цилиндрическая плосковогнутая линза, за которой следует цилиндрическая плосковогнутая линза, вставленная за первой линзой и ориентированная на ортогональную ось.
- Подключите ультразвуковой преобразователь к генератору функций. Установите сигнал возбуждения как: синусоидальная форма волны, непрерывная волна, частота 31,2 кГц. Амплитуда является единственным переменным параметром.
- Поместите линзу (D) на расстоянии примерно 6 см перед лазерной головкой (C).
- Установите объектив (E) на расстоянии примерно 12 см перед объективом (D).
- Поместите резервуар для воды (A) таким образом, чтобы точка фокусировки лазера располагалась внутри резервуара для воды, что приводит к генерации искры для каждого лазерного импульса (5-10 мДж). Лазерная искра должна располагаться примерно на 3 см ниже целевого пучности давления.
ПРИМЕЧАНИЕ: Без ультразвука (УЗИ) пузырь с лазерным ядром поднимется на верхнюю поверхность из-за плавучести. - Включите ультразвуковой преобразователь. Увеличивайте приложенное напряжение до тех пор, пока пузырь не перестанет подниматься вертикально, а будет отклоняться в сторону пучности давления и, при достаточно высоком давлении, задерживаться.
- Установите подсветку (непрерывный светодиод) и высокоскоростную камеру, чтобы наблюдать за захваченным пузырем.
ПРИМЕЧАНИЕ: При зарождении нового пузырька лазерной искрой легко уловить траекторию пузырька, приближающегося к месту его захвата. - Переместите местоположение лазерной искры в резервуар для воды так, чтобы траектория пузырька оставалась внутри фокальной плоскости камеры.
- Поймайте один пузырь и захватите его радиальные колебания со следующими параметрами: размер кадра 128 x 128 пикселей, частота захвата 180 кГц. Пример радиальных колебаний большой амплитуды в течение двух акустических периодов приведен на рисунке 6. Типичный размер пузырьков газа колеблется от 30 до 80 мкм.
- Запишите радиальные колебания пузырьков в течение 3-30 миллисекунд, чтобы запечатлеть от сотен до тысяч колебаний пузырьков. Повторите эту запись для увеличения приложенных напряжений преобразователя. Типичные приложенные напряжения находятся в диапазоне от 0 до 8 В.
ПРИМЕЧАНИЕ: При изменении приложенного напряжения положение равновесия захваченного пузырька немного перемещается по вертикали. Чтобы следить за колебаниями, не перемещая подсветку и камеру, поместите систему (датчик и резервуар для воды) на подвижный стол в трех направлениях с микрометрической точностью. - Включите ультразвуковой датчик и сделайте одно изображение фона для последующего анализа.
- Обработайте серию видео, выполнив следующую процедуру:
- Запустите исполняемый файл VoltagePressure.exe. Интерфейс, показанный на рисунке 7 , должен открыться.
ПРИМЕЧАНИЕ: Сценарий доступен в качестве дополнительного документа. - Укажите физические и экспериментальные параметры в левом столбце (рис. 7А).
- Укажите значения приложенного напряжения для серии записей в таблице справа внизу (рис. 7B).
- На панели анализа радиуса пузыря нажмите на Загрузить параметры (рисунок 7C) и выберите папку, содержащую все файлы вашего видеоряда, а затем фоновое изображение (обязательно).
- Выбор разрешен между анализом всех видео сразу, нажатием « Авто» или поочередным нажатием « Шаг за шагом».
- Для каждого видеофайла эволюция радиуса пузырька строится на графике за один акустический период, и накладывается числовое соответствие. Красная кривая соответствует линеаризованному моделированию Рэлея-Плессета. Отображается радиус равновесного пузырька (рис. 7D).
- Согласно числовой подгонке, приложенное давление для этого напряжения отображается на панели графика «Давление (напряжение)» (рис. 7E). Значение приложенного давления также отображается в таблице в правом нижнем углу (рис. 7B). Типичные приложенные давления, соответствующие динамике напряжения 0 - 8 В, составляют 0 - 25 кПа.
- После того, как все видео будут обработаны, нажмите кнопку «Линейная регрессия», чтобы выполнить линейную подгонку кривой давления/напряжения. Данные (значения напряжения и давления) сохраняются в .txt файле, расположенном в текущем каталоге. Наклон подгонки предусмотрен.
- Запустите исполняемый файл VoltagePressure.exe. Интерфейс, показанный на рисунке 7 , должен открыться.
3. Техника коалесценции
- Включите ультразвуковой преобразователь. Установите приложенное напряжение достаточно высоким, чтобы соответствующее акустическое давление могло привести к возникновению поверхностной неустойчивости, в соответствии с числовой диаграммой давления/радиуса зон нестабильности, как показано на рисунке 8.
- Зародите пузырь, который затем мигрирует в место захвата. Если захваченный пузырь проявляет только сферические колебания, переходите к следующему шагу. При появлении несферических колебаний:
- Выключите питание ультразвука, чтобы пузырь поднялся на верхнюю поверхность.
- Измените энергию лазера (путем точной настройки на несколько мДж) или уменьшите напряжение преобразователя.
- Включите питание ультразвука.
- Зародышеобразно образуется новый пузырь.
- Повторяйте эту процедуру до тех пор, пока размер пузырьков не приведет к чисто сферическим колебаниям.
- Когда захваченный пузырь проявляет только сферические колебания, генерирует новую лазерную искру. Когда новый пузырь достигает места захвата, происходит слияние.
- Если слившийся пузырь проявляет только сферические колебания, создайте новый пузырь. Для достижения радиуса пузырька, при котором происходят несферические деформации, может потребоваться многократное слияние. Пример слияния пузырьков, приводящего к несферическим колебаниям, показан на рисунке 9.
- Как только слившийся пузырь проявляет несферические колебания, запишите колебания пузырька в течение примерно от 3 до 30 миллисекунд.
- Определите количество мод колебаний формы, см. рисунок 10.
4. Измерение расхода жидкости
- В случае кавитационных измерений микропотока частицы флуоресцентного индикатора должны быть добавлены в воду до зарождения пузырьков. В этом исследовании используются частицы размером 0,71 мкм (Таблица материалов). Они достаточно малы, чтобы быть акустически прозрачными (не подверженными влиянию силы акустического излучения) и точно следовать за потоком, а также достаточно большими, чтобы рассеивать лазерный свет. Используйте три капли для объема резервуара для воды, что примерно соответствует 2,104 частицы / мм3.
- Перед проведением измерений задайте следующие параметры для фиксации динамики пузырьков (с высокой временной шкалой) и (с низкой временной шкалой) потока жидкости:
- Создайте разбиение диска записи камеры на разделы.
- В качестве альтернативы определите параметры записи следующим образом:
- Частота кадров 180 кГц, размер кадра 128 x 128 пикселей и время экспозиции 1 мкс за одну запись динамики пузырькового интерфейса
- Частота кадров 600 Гц, размер кадра 1024 x 768 пикселей и время экспозиции 1 мс за одну запись движения индикаторов красителей.
- Используйте лазер непрерывного действия.
- Создайте тонкий лазерный лист, последовательно пропуская лазерный луч через цилиндрическую плосковогнутую линзу и цилиндрическую плоско-выпуклую линзу, ориентированную по ортогональной оси. Можно получить ширину луча около 160 мкм.
- Настройте лазерный лист так, чтобы он соответствовал плоскости изображения:
- Установите лазер на подвижное устройство так, чтобы лазерный лист можно было перемещать параллельно плоскости изображения.
- Отрегулируйте положение так, чтобы освещенные частицы были видны камере.
- Зародыше и ловушка пузыря.
- Отрегулируйте положение лазерного листа дальше, чтобы за пузырем стала видна тень. Пузырь теперь находится внутри лазерного листа, как показано на рисунке 11.
- Индуцируйте слияние пузырьков до тех пор, пока не станет очевиден стабильно колеблющийся режим формы.
- Сделайте несколько записей, переключаясь между динамикой пузырьков и микростримингом.
ПРИМЕЧАНИЕ: Выключайте лазер непрерывного действия, когда он не нужен. Нагрев может создавать нежелательные конвективные потоки. Кроме того, выключайте светодиод при выполнении измерений потокового потока.
5. Обработка изображений для визуализации кавитационных микропотоковых паттернов
- Установите программное обеспечение для визуализации ImageJ для обработки и анализа изображений на Java. Также установите плагин CINE File Reader для того, чтобы открывать файлы высокоскоростной камеры.
- Нажмите « Файл» | Импорт | CineFile и выберите видео *.cine, содержащее захват движения частицы.
- Выберите «Использовать виртуальный стек» в новом окне, теперь видео загружено.
- Для того, чтобы наблюдать за движением частиц без отображения картины потока, нажмите на Изображение | Отрегулируйте | Яркость/контрастность | Авто. Темный фон теперь заменяется автоматически оптимизированным изображением.
- Для того, чтобы отобразить полученный узор, нажмите на Изображение | Стеки | Z Project и выберите параметр «Максимальная интенсивность» для проекции изображения. Отображается выходное изображение с пикселями, содержащими максимальное значение по всем изображениям в стеке. При необходимости отрегулируйте контрастность изображения, как описано на шаге 5.4.
ПРИМЕЧАНИЕ: Получается потоковая картина, подобная показанной на рисунках 12b и 12d .
Результаты
Полная последовательность слияния пузырьков, приводящих к стабильным во времени, контролируемым симметрией несферическим колебаниям, представлена на рисунке 9. Приближающаяся фаза двух сферически колеблющихся пузырьков заканчивается, когда тонкая ?...
Обсуждение
Представленная процедура заключается в использовании пузырьковой коалесценции для того, чтобы вызвать стационарные, контролируемые симметрией колебания формы пузырьков, что позволяет изучать долгосрочный поток жидкости, индуцированный этими колебаниями. Основной проблемой в техни...
Раскрытие информации
Авторам раскрывать нечего.
Благодарности
Эта работа была поддержана LabEx CeLyA Лионского университета (ANR-10-LABX-0060 / ANR-11-IDEX-0007).
Материалы
| Name | Company | Catalog Number | Comments |
| Aspherical lens | Thorlabs | AL4050 | Lens of focus 40 mm |
| Continuous wave laser source | CNI | MLL6FN | DPSS laser of wavelength 532nm, energy 400 mW |
| Cylindrical plano-concave lens | Thorlabs | LJ1277L1-A | lens of focus -25?4mm |
| Cylindrical plano-concave lens | Thorlabs | LK1900L1 | lens of focus 250 mm |
| Fluorescent particles | Duke Scientific | R700 | Red polymer fluorescent microspheres |
| Function generator | Agilent | HP33120 | Generator of function feeding the ultrasound transducer |
| High-speed camera | Vision Research | Phantom v12.0 | High-speed recording up to 1 Mfps |
| Liquid medium | Carlo Erba | Water for analysis | Demineralized, undegassed water |
| Multiphysics software | Comsol | None | Softwate for simulating the acoustic field of the levitation chamber |
| Nd:Yag pulsed laser | New Wave Research | Solo III-15 | 5 ns pulse duration, λ=532 nm, 3.5 mm beam diameter, up to 50 mJ |
| Plano-concave lens | Thorlabs | N-BK7 | lens of focus 125 mm |
| Spherical concave lens | Thorlabs | N-SF11 | Bi-concave lens of focus -25mm |
| Ultrasound transducer | SinapTec | Custom-made | Nominal frequency 31kHz, active area 35mm diameter |
| Visualization software | NIH | ImageJ | Software for image processing and analysis in Java |
| XY Linear stage | Newport | M-406 | Displacement stage with micrometric screw |
| Z-axis linear stage | Edmund Optics | 62-299 | Vertical displacement stage with micrometric screw |
Ссылки
- Roovers, S., et al. The role of ultrasound-driven microbubble dynamics in drug delivery: from microbubble fundamentals to clinical translation. Langmuir. 35 (31), 10173-10191 (2019).
- Liu, H. L., Fan, C. H., Ting, C. Y., Yeh, C. K. Combining microbubbles and ultrasound for drug delivery to brain tumors: current progress and overview. Theranostics. 4 (4), 432-444 (2014).
- Lammertink, B. H. A., et al. Sonochemotherapy: from bench to bedside. Frontiers in Pharmacology. 6, 138 (2015).
- Lajoinie, G., et al. In vitro methods to study bubble-cell interactions: fundamentals and therapeutic applications. Biomicrofluidics. 10, 011501 (2016).
- Van Wamel, A., Bouakaz, A., Versluis, M., de Jong, N. Micromanipulation of endothelial cells: ultrasound-microbubble-cell interaction. Ultrasound in Medicine and Biology. 30, 1255-1258 (2004).
- Tran, T. A., Roger, S., Le Guennec, J. Y., Tranquart, F., Bouakaz, A. Effect of ultrasound-activated microbubbles on the cell electrophysiological properties. Ultrasound in Medicine and Biology. 33, 158-163 (2007).
- Marmottant, P., Hilgenfeldt, S. Controlled vesicle deformation and lysis by single oscillating bubbles. Nature. 423 (6936), 153-156 (2003).
- Prentice, P. A., Cuschieri, K., Dholakia, K., Prausnitz, M., Campbell, P. Membrane disruption by optically controlled microbubble cavitation. Nature Physics. 1, 107-110 (2005).
- Kudo, N., Okada, K., Yamamoto, K. Sonoporation by single-shot pulsed ultrasound with microbubbles adjacent to cells. Biophysical Journal. 96, 4866-4876 (2009).
- Novell, A., et al. A new safety index based on intrapulse monitoring of ultra-harmonic cavitation during ultrasound-induced blood-brain barrier opening procedures. Scientific Reports. 10, 10088 (2020).
- Cornu, C., et al. Ultrafast monitoring and control of subharmonic emissions of an unseeded bubble cloud during pulsed sonication. Ultrasonics Sonochemistry. 42, 697-703 (2018).
- Reslan, L., Mestas, J. L., Herveau, S., Béra, J. C., Dumontet, C. Transfection of cells in suspension by ultrasound cavitation. Journal of Controlled Release. 142 (2), 251-258 (2010).
- Reuter, F., Gonzalez-Avila, S. R., Mettin, R., Ohl, C. D. Flow fields and vortex dynamics of bubbles collapsing near a solid boundary. Physical Review Fluids. 2, 064202 (2017).
- Chew, L. W., Klaseboer, E., Ohl, S. W., Khoo, B. C. Interaction of two differently sized oscillating bubbles in a free field. Physical Review E. 84, 066307 (2011).
- Doinikov, A. A., Bouakaz, A. Acoustic microstreaming around a gas bubble. The Journal of the Acoustical Society of America. 127 (2), 703-709 (2010).
- Tho, P., Manasseh, R., Ooi, A. Cavitation microstreaming patterns in single and multiple bubble systems. Journal of Fluid Mechanics. 576, 191-233 (2007).
- Van Wamel, A., et al. Vibrating microbubbles poking individual cells: Drug transfer into cells via sonoporation. Journal of Controlled Release. 112, 149-155 (2006).
- Helfield, B., Chen, X., Watkins, S. C., Villanueva, F. S. Biophysical insight into mechanisms of sonoporation. PNAS. 113 (36), 9983-9988 (2016).
- Pereno, V., et al. Layered acoustofluidic resonators for the simultaneous optical and acoustic characterization of cavitation dynamics, microstreaming, and biological effects. Biomicrofluidics. 12, 034109 (2018).
- Shklyaev, S., Straube, A. V. Linear oscillations of a compressible hemispherical bubble on a solid substrate. Physics of Fluids. 20, 052102 (2008).
- Fauconnier, M., Bera, J. C., Inserra, C. Nonspherical modes non-degeneracy of a tethered bubble. Physical Review E. 102, 033108 (2020).
- Xi, X., Cegla, F., Mettin, R., Holsteyns, F., Lippert, A. Study of non-spherical bubble oscillations near a surface in a weak acoustic standing wave field. The Journal of the Acoustical Society of America. 135, 1731 (2014).
- Doinikov, A. A., Bouakaz, A. Effect of a distant rigid wall on microstreaming generated by an acoustically driven gas bubble. Journal of Fluid Mechanics. 742, 425-445 (2014).
- Cleve, S., Guédra, M., Inserra, C., Mauger, C., Blanc-Benon, P. Surface modes with controlled axisymmetry triggered by bubble coalescence in a high-amplitude acoustic field. Physical Review E. 98, 033115 (2018).
- Lamb, H. . Hydrodynamics. 6th ed. , (1932).
- Liu, Y., Wang, Q. Stability and natural frequency of nonspherical mode of an encapsulated microbubble in a viscous liquid. Physics of Fluids. 28, 062102 (2016).
- Dollet, B., et al. Nonspherical oscillations of ultrasound contrast agent microbubbles. Ultrasound in Medicine and Biology. 34 (9), 1465-1473 (2008).
- Versluis, M., et al. Microbubble shape oscillations excited through ultrasonic parametric driving. Physical Review E. 82, 026321 (2010).
- Guédra, M., Cleve, S., Mauger, C., Blanc-Benon, P., Inserra, C. Dynamics of nonspherical microbubble oscillations above instability threshold. Physical Review E. 96, 063104 (2017).
- Cleve, S., Guédra, M., Mauger, C., Inserra, C., Blanc-Benon, P. Microstreaming induced by acoustically trapped, non-spherically oscillating microbubbles. Journal of Fluid Mechanics. 875, 597-621 (2019).
- Doinikov, A. A., Cleve, S., Regnault, G., Mauger, C., Inserra, C. Acoustic microstreaming produced by nonspherical oscillations of a gas bubble. I. Case of modes 0 and m. Physical Review E. 100, 033104 (2019).
- Inserra, C., Regnault, G., Cleve, S., Mauger, C., Doinikov, A. A. Acoustic microstreaming produced by nonspherical oscillations of a gas bubble. III. Case of self-interacting modes n-n. Physical Review E. 101, 013111 (2020).
- Prabowo, F., Ohl, C. D. Surface oscillations and jetting from surface attached acoustic driven bubbles. Ultrasonics Sonochemistry. 18 (1), 431-435 (2011).
- Garbin, V., et al. Changes in microbubble dynamics near a boundary revealed by combined; optical micromanipulation and high-speed imaging. Applied Physics Letters. 90, 114103 (2007).
- Collis, J., et al. Cavitation microstreaming and stress fields created by microbubbles. Ultrasonics. 50, 273-279 (2010).
- Loughran, J., Eckersley, R. J., Tang, M. X. Modeling non-spherical oscillations and stability of acoustically driven shelled microbubbles. The Journal of the Acoustical Society of America. 131 (6), 4349-4357 (2012).
- Vos, H. J., Dollet, B., Bosch, J. G., Versluis, M., de Jong, N. Nonspherical vibrations of microbubbles in contact with a wall - a pilot study at low mechanical index. Ultrasound in Medicine and Biology. 34 (4), 685-688 (2008).
- Regnault, G., Mauger, C., Blanc-Benon, P., Inserra, C. Secondary radiation force between two closely spaced acoustic bubbles. Physical Review E. 102, 031101 (2020).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеThis article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены