Se requiere una suscripción a JoVE para ver este contenido. Inicie sesión o comience su prueba gratuita.
Method Article
Generación de Shear Adhesión Mapa Utilizando SynVivo redes microvasculares sintético
En este artículo
Resumen
Flow chambers used in adhesion experiments typically consist of linear flow paths and require multiple experiments at different flow rates to generate a shear adhesion map. SynVivo-SMN enables the generation of shear adhesion map using a single experiment utilizing microliter volumes resulting in significant savings in time and consumables.
Resumen
Ensayos de adhesión celular / partículas son fundamentales para la comprensión de las interacciones bioquímicas involucradas en la fisiopatología de la enfermedad y tienen importantes aplicaciones en la búsqueda del desarrollo de nuevas terapias. Los ensayos con condiciones estáticas no logran captar la dependencia de adherencia en cizalla, lo que limita su correlación con el medio ambiente en vivo. Cámaras de flujo de placas paralelas que cuantifican la adhesión bajo un flujo de fluido fisiológico necesitan múltiples experimentos para la generación de un mapa de adhesión por cizalladura. Además, no representan la escala in vivo y la morfología y requieren volúmenes grandes (~ ml) de reactivos para los experimentos. En este estudio, hemos demostrado la generación de cizalla mapa adhesión de un solo experimento utilizando una red microvascular basado en un dispositivo de microfluidos, SynVivo-SMN. Este dispositivo recrea el complejo en la vasculatura vivo incluyendo una escala geométrica, elementos morfológicos, las características de flujo y las interacciones celulares en unFormato in vitro, proporcionando de esta manera un ambiente biológicamente realista para la investigación básica y aplicada en el comportamiento celular, la administración de fármacos, y el descubrimiento de fármacos. El ensayo se demostró mediante el estudio de la interacción de las partículas de 2 micras de biotina-revestido con superficies recubiertas con avidina del microchip. Se obtiene toda la gama de cizallamiento observado en la microvasculatura en un único ensayo que permite la adhesión vs mapa de cizallamiento para las partículas en condiciones fisiológicas.
Introducción
Los ensayos actuales para estudiar a la célula-célula y las interacciones célula-partícula implican típicamente formato de placa de estática en la que las partículas o células se incuban en matrices de proteínas o células adherentes. Al final del tiempo de incubación especificado, los números de partículas adherentes o células se cuantifican mediante microscopía de 1. A pesar de que estos ensayos proporcionan una información valiosa sobre los procesos bioquímicos detrás de estas interacciones, una limitación clave es la falta de flujo de fluido fisiológico (típico de la microcirculación) y su impacto en la adherencia de partículas.
Para superar esta limitación, en cámaras de flujo in vitro se han desarrollado en los últimos años. Un elemento común de estas cámaras de flujo es un aparato transparente perfundido a bajos números de Reynolds para que coincida con velocidades de cizallamiento de pared observadas en los vasos sanguíneos in vivo 2. La pared del vaso se modela por cualquiera de recubrimiento de biomoléculas o crecimiento de células en una superficie del flujo Chamber 3. Las partículas de 4-7 o 8-16 células son luego fluyeron en al intervalo deseado de velocidades de flujo para cuantificar el número de adherirse partículas bajo diversas velocidades de cizallamiento.
Sin embargo, el uso de cámaras de flujo de placas paralelas para estudiar y validar los fenómenos bioquímicos es bastante caro y consume mucho tiempo. Esto se debe principalmente al hecho de que múltiples experimentos deben llevarse a cabo para generar un mapa de la cizalla de fluidos vs el número de partículas / células adheridas. Además, las cámaras de flujo placa requieren grandes volúmenes de reactivos debido a su gran tamaño (altura> 250 micras y la anchura> 1 mm). Finalmente, estos dispositivos no modelan con precisión las características geométricas (por ejemplo, bifurcaciones) y las condiciones de flujo (por ejemplo, convergentes vs flujos divergentes) que están presentes in vivo.
Los recientes avances en la litografía basada microfabricación 17-19 han acelerado el campo de lab-on-a-chipdispositivos 20-21. Estos dispositivos han sido fundamentales en el desarrollo de una versión en miniatura de la cámara de flujo de placas paralelas con las dimensiones en el régimen micrómetro. La reducción en la dimensión también produce beneficios significativos en términos de volúmenes de reactivos, células o de partícula requerido para los experimentos. Sin embargo, una limitación clave de los dispositivos actualmente disponibles es el uso de canales lineales para modelar microvasos, que no imitan la microvasculatura complejo observado in vivo.
Recientemente hemos desarrollado una nueva metodología para recrear las redes microvasculares sobre sustratos de plástico desechables resultantes en representación sintética de las condiciones in vivo. Estos dispositivos denominados redes microvasculares SynVivo-sintéticos (SMN) se desarrollan utilizando PDMS basado proceso de soft-litografía. Dispositivos SynVivo-SMN se pueden utilizar para obtener cizallamiento mapa de adhesión de la adhesión celular / de partículas 22, estudio dirigido de suministro de fármacos 23 y HAVE ha validado contra datos in vivo 24-25. En este trabajo, presentamos un protocolo que permite la generación del mapa de adhesión de cizallamiento de un solo experimento en volúmenes tan pequeños como 5.1 l que resulta en un ahorro significativo de recursos y tiempo.
Protocolo
1. Cebado del dispositivo de microfluidos SynVivo-SMN
- Cada puerto (entrada / salida) del dispositivo se compone de dos puertos paralelos - uno para hacer fluir en restos de revestimiento de superficies (moléculas de adhesión, matrices de crecimiento, etc) y / o células para la siembra y el otro para realizar el ensayo (Figura 1A ).
- Sumerja completamente el dispositivo de microfluidos SynVivo-SMN (Figura 1B) en una placa de Petri que contiene desionizada estéril (DI) y colocar el plato en un desecador de vacío. Permitir que el desecador a funcionar hasta que todo el aire se elimina de los canales del dispositivo. Esto debe tomar unos 15 min.
- Antes de extraer el dispositivo del agua, coloque la tubería de Tygon (OD de 0,06 "y el ID de 0,02") cebado con agua en cada puerto del dispositivo con una pinza de punta fina. El tubo debe ser de aproximadamente 1 pulgada de longitud. El dispositivo puede ahora ser retirado del agua. Figura 1C muestra la imagen de la DevicE con la tubería.
2. Revestimiento del dispositivo de microfluidos con proteína deseada (por ejemplo, avidina)
- Con una pipeta, coloque una gota de agua (aproximadamente 100 l) alrededor de la base del tubo de un puerto de entrada. Retire con cuidado la tubería usada para cebar el dispositivo. La gota de agua evitará que entre aire en el dispositivo.
- Preparar una jeringa de 1 ml cargado con avidina a una concentración de 20 mg / ml. Conectar la jeringa a un 24 T de la aguja y tubo de acero inoxidable. Inserte la tubería a uno de los puertos de entrada del dispositivo. Sujete el puerto de entrada que no se utiliza con una pinza mandíbula.
- Inyectar avidina a un caudal de 1 l / min durante 10 min para permitir la perfusión completa del dispositivo. Al final del tiempo de flujo, sujetar el tubo con la abrazadera de la mandíbula y colocar el dispositivo a 4 ° C durante la noche.
3. Transmitir el Biotinylated Partículas los estudios de adhesión
- Deje que el dispositivollegar a temperatura ambiente. Coloque el dispositivo en un microscopio de fluorescencia invertido equipado con una platina motorizada y una cámara de alto rendimiento.
- Preparar una solución de 2 micras partículas biotinilados a una concentración de 5 x 10 6 partículas / ml en tampón fosfato salino (PBS). Cargue las partículas en una jeringa de 1 ml. Preparar una segunda jeringa de 1 ml de PBS solo. Cargue cada jeringa en una bomba de jeringa y conectar con la aguja y el tubo.
- Con una pipeta, coloque una gota de agua (aproximadamente 100 l) alrededor de la base del tubo de orificio de entrada. Retire con cuidado el tubo utilizado para recubrir el dispositivo. La gota de agua evitará que entre aire en el dispositivo.
- Inserte con cuidado el tubo de partículas con biotina y PBS de la etapa 3.2 en cada uno de los puertos de entrada. Figura 2A muestra la imagen de la puesta a punto.
- Iniciar la inyección de partículas biotiniladas a un caudal de 2,5 l / min. Monitorear el puerto de entrada en el microscopio. A la primera señalde partículas, iniciar el temporizador y continuar flujo durante 3 min.
- Al final de los 3 minutos, detener el flujo de partículas biotiniladas, mientras que mirando simultáneamente el flujo de PBS a un caudal de 2,5 l / min. Permita PBS fluya en el dispositivo durante 3 min para lavar las partículas no unidas.
4. Adquisición de imágenes y realización de su área de interés (AOI) Mediciones Usando software de imágenes (NIKON Elementos)
- Utilice la función "imagen grande de exploración" en el software de imágenes para adquirir la imagen de todo el dispositivo.
- Número secuencialmente las bifurcaciones en el dispositivo y crear un AOI circular con dos veces el diámetro de los canales. En este caso, ajuste el diámetro AOI a 200 m desde el diámetro del canal es de 100 micras.
- Utilice la función de conteo automatizado en el software de imagen para exportar el número de partículas en cada AOI a una hoja de MS Excel.
- Del mismo modo, utilizar la función de conteo automatizado para exportar el número de partículas en todo eldispositivo.
5. Análisis de partículas de fundente Usando Dinámica de Fluidos Computacional (CFD) Modelos
- Simulaciones CFD se ejecutan mediante un software comercial (CFD-ACE +, ESI Inc.) para la topología de dispositivo SynVivo-SMN. Los resultados se almacenan en una base de datos para el análisis de observaciones experimentales. La información del almacén resultados de la simulación en las tasas de cizallamiento, velocidad, flujo de partículas, y la adhesión en el dispositivo.
- Los resultados de la simulación se utilizan para determinar el número de partículas que entran en cada AOI basado en una concentración de partículas de entrada dada.
6. Generación de cizallamiento Adhesión Mapa
- Calcular el% de adherencia dividiendo las partículas adheridas en la bifurcación por las partículas que fluyen en la bifurcación como se muestra en la ecuación 6.1.
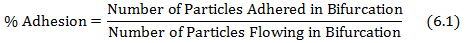
donde el número de partículas adheridas y las partículas que fluyen se obtienen a partir de protocol los pasos 4.3 y 5.2, respectivamente. - Trazar el mapa de adhesión por cizalladura usando la velocidad de cizallamiento en cada bifurcación de las redes obtenidas a partir de la base de datos en el paso (5.1) y los valores de adhesión% obtenidos a partir de la ecuación 6.1.
Resultados
La Figura 1A muestra una imagen de un campo brillante y esquemática de dispositivo de SynVivo-SMN. Figura 1B muestra el dispositivo SynVivo-SMN montado en un portaobjetos de vidrio. Figura 1C muestra el dispositivo con un tubo siguiente cebado con agua en un desecador de vacío.
La Figura 2A muestra una imagen de la-montaje experimental. Figura 2B muestra un típico dispositivo SynVivo-SMN avidina-revestido...
Discusión
Cámaras de flujo de placas paralelas, mientras que proporciona una mejor aproximación a las interacciones célula-célula y célula-partículas, sufren de varias limitaciones tales como el alto consumo de reactivos y la necesidad de múltiples corridas experimentales para generar un mapa de adhesión por cizalladura. El uso de redes microvasculares SynVivo-sintéticos (SynVivo-las SNM) permite la generación de un mapa de adhesión al cizallamiento de un solo experimento en condiciones que imitan las condiciones i...
Divulgaciones
Tasa de publicación de este artículo, patrocinado por CFD Research Corporation.
Agradecimientos
Tecnología SynVivo fue desarrollada bajo la concesión # 2R44HL076034 del NHLBI.
Materiales
| Name | Company | Catalog Number | Comments |
| SynVivo-SMN | CFD Research | SMN-001 | Exclusive at CFDRC |
| CFD-ACE+ | ESI Inc. | N/A | |
| Avidin | Invitrogen | 43-4401 | Any avidin source will work for this assay |
| Biotinylated Particles | Polysciences | 24173-1 | Any source of biotinylated particles will work for the assay |
| Tygon Tubing | VWR | 63018-044 | Size is typical for use with SynVivo-SMN |
| NIKON Elements | NIKON Instruments | N/A | Any other imaging software can be used |
Referencias
- Weitz-Schmidt, G., Chreng, S. Cell adhesion assays. Methods Mol Biol. 757, 15-30 (2012).
- Parsons, S. A., Jurzinsky, C., Cuvelier, S. L., Patel, K. D. Studying leukocyte recruitment under flow conditions. Methods Mol Biol. 946, 285-300 (2013).
- Luscinskas, F. W., Gimbrone, M. A. Jr Endothelial-dependent mechanisms in chronic inflammatory leukocyte recruitment. Annu Rev Med. 47, 413-421 (1996).
- Adriani, G., et al. The preferential targeting of the diseased microvasculature by disk-like particles. Biomaterials. 33, 5504-5513 (2012).
- Decuzzi, P., et al. Flow chamber analysis of size effects in the adhesion of spherical particles. Int J Nanomedicine. 2, 689-696 (2007).
- Zou, X., et al. PSGL-1 derived from human neutrophils is a high-efficiency ligand for endothelium-expressed E-selectin under flow. Am J Physiol Cell Physiol. 289, 415-424 (2005).
- Sakhalkar, H. S., et al. Leukocyte-inspired biodegradable particles that selectively and avidly adhere to inflamed endothelium in vitro and in vivo. Proc Natl Acad Sci U S A. 100, 15895-15900 (2003).
- Van Kruchten, R., Cosemans, J. M., Heemskerk, J. W. Measurement of whole blood thrombus formation using parallel-plate flow chambers - a practical guide. Platelets. 23, 229-242 (2012).
- Ganguly, A., Zhang, H., Sharma, R., Parsons, S., Patel, K. D. Isolation of human umbilical vein endothelial cells and their use in the study of neutrophil transmigration under flow conditions. J Vis Exp. 66 (66), (2012).
- Shirure, V. S., Reynolds, N. M., Burdick, M. M. Mac-2 binding protein is a novel E-selectin ligand expressed by breast cancer cells. PLoS One. 7, (2012).
- Ploppa, A., Schmidt, V., Hientz, A., Reutershan, J., Haeberle, H. A., Nohé, B. Mechanisms of leukocyte distribution during sepsis: an experimental study on the interdependence of cell activation, shear stress and endothelial injury. Crit Care. 14, 201 (2010).
- Oh, H., Diamond, S. L. Ethanol enhances neutrophil membrane tether growth and slows rolling on P-selectin but reduces capture from flow and firm arrest on IL-1-treated endothelium. J Immunol. 181, 2472-2482 (2008).
- Resto, V. A., Burdick, M. M., Dagia, N. M., McCammon, S. D., Fennewald, S. M., Sackstein, R. L-selectin-mediated lymphocyte-cancer cell interactions under low fluid shear conditions. J Biol Chem. 283, 15816-15824 (2008).
- Enders, S., Bernhard, G., Zakrzewicz, A., Tauber, R. Inhibition of L-selectin binding by polyacrylamide-based conjugates under defined flow conditions. Biochim Biophys Acta. 1770, 1441-1449 (2007).
- Prabhakarpandian, B., Goetz, D. J., Swerlick, R. A., Chen, X., Kiani, M. F. Expression and functional significance of adhesion molecules on cultured endothelial cells in response to ionizing radiation. Microcirculation. 8, 355-364 (2001).
- Brown, D. C., Larson, R. S. Improvements to parallel plate flow chambers to reduce reagent and cellular requirements. BMC Immunology. 2, 9 (2001).
- Zheng, W., Zhang, W., Jiang, X. Precise control of cell adhesion by combination of surface chemistry and soft lithography. Adv Healthc Mater. 2, 95-108 (2013).
- Qian, T., Wang, Y. Micro/nano-fabrication technologies for cell biology. Med Biol Eng Comput. 48, 1023-1032 (2010).
- Biswas, A., Bayer, I. S., Biris, A. S., Wang, T., Dervishi, E., Faupel, F. Advances in top-down and bottom-up surface nanofabrication: techniques, applications & future prospects. Adv Colloid Interface Sci. 170, 2-27 (2012).
- Whitesides, G. M., Ostuni, E., Takayama, S., Jiang, X., Ingber, D. E. Soft lithography in biology and biochemistry. Annu Rev Biomed Eng. 3, 335-373 (2001).
- McDonald, J. C., et al. Fabrication of microfluidic systems in poly(dimethylsiloxane). Electrophoresis. 21, 27-40 (2000).
- Prabhakarpandian, B., et al. Synthetic microvascular networks for quantitative analysis of particle adhesion. Biomed Microdevices. 10, 585-595 (2008).
- Rosano, J. M., et al. A physiologically realistic in vitro model of microvascular networks. Biomed Microdevices. 11, 1051-1057 (2009).
- Tousi, N., Wang, B., Pant, K., Kiani, M. F., Prabhakarpandian, B. Preferential adhesion of leukocytes near bifurcations is endothelium independent. Microvasc Res. 80, 384-388 (2010).
- Prabhakarpandian, B., et al. Bifurcations: focal points of particle adhesion in microvascular networks. Microcirculation. 18, 380-389 (2011).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados