Для просмотра этого контента требуется подписка на Jove Войдите в систему или начните бесплатную пробную версию.
Method Article
Седиментационного равновесия небольшой олигомер-формирования мембранного белка: Влияние гистидин ПРОТОНИРОВАНИЕ на пентамерного стабильности
В этой статье
Резюме
Sedimentation equilibrium (SE) can be used to study protein-protein interactions in a physiological environment. This manuscript describes the use of this technique to determine the effect of pH on the stability of a homo-pentamer formed by the small hydrophobic (SH) protein encoded by the human syncytial respiratory virus (hRSV).
Аннотация
Аналитический ультрацентрифугирования (AUC) может быть использован для изучения обратимые взаимодействия между макромолекул в широком диапазоне сильных взаимодействий и в физиологических условиях. Это делает AUC метод выбора для количественной оценки стехиометрии и термодинамика гомо- и гетеро-ассоциации, являются временными и обратимым в биохимических процессах. В модальности седиментационного равновесия (SE), баланс между диффузии и седиментации обеспечивает профиль как функцию радиального расстояния, которое зависит от конкретной модели объединения. При этом Подробный протокол SE описано для определения размера и мономера-мономера ассоциации энергию малой мембранного белка олигомера с использованием аналитического ультрацентрифугирования. AUC-ES является метка свободной, только на основе физических принципов, и могут быть использованы на обеих водорастворимых и мембранных белков. Пример показан последнего, небольшой гидрофобной (SH) белков в респираторно-синцитиальный вирус человека (РСВЧ), Полипептид 65-аминокислоты с одного домена α-спиральный трансмембранный (ТМ), который образует пентамерного ионные каналы. ЯМР основе структурного данные показывают, что белок SH имеет два протонируемых Его остатки в его трансмембранного домена, которые ориентированы, с которыми сталкиваются в просвет канала. SE эксперименты были разработаны, чтобы определить, как рН влияет на константу ассоциации и олигомерные размер SH белка. В то время как пентамерного форма была сохранена во всех случаях, его постоянным ассоциации была снижена при низком рН. Эти данные согласуются с аналогичным рН зависимости, наблюдаемой для деятельности SH канала, в соответствии с люменальной ориентации двух Своих остатков в SH белка. Последнее может возникнуть электростатическое отталкивание и снижает стабильность олигомеров при низком рН. Таким образом, этот метод применим, когда количественной информации о тонкие изменения белок-белковых ассоциаций в физиологических условиях должны быть измерены.
Введение
Аналитический ультрацентрифугирования 1-5 является одним из наиболее важных способов для изучения взаимодействия макромолекул в физиологических условиях, будучи доступной для обеих слабых и сильных взаимодействий. Метод без наклеек и использует поглощение света или вмешательства, и даже флуоресцентные оптические системы могут быть использованы для доступа диапазоны концентрации в течение нескольких порядков 6.
Этот метод особенно полезен, так как большинство биохимических процессов зависят от обратимых взаимодействий. Стехиометрии и прочность этих взаимодействий должны быть количественно охарактеризовать понимать биологические процессы, а также ряд методов существуют для этой цели 7, 8. Тем не менее, переходные взаимодействия трудно изучать 9.
Выбор метода для характеристики высокомолекулярные взаимодействия зависит от его статического или динамического характера. В первом случае, sedim ставление скорость (SV) используется, когда скорость радиального транспорта измеряется и комплексы фракционируют на основании различий в плавучей массы и формы.
В отличие от этого, динамические ассоциации, которые обратимо на временной шкале эксперимента не может быть физически отделена. В этом случае, само или гетеро-взаимодействия, ведущие к нековалентных взаимодействий в равновесии, которое зависит от общей концентрации белка. Эти динамические взаимодействия могут быть изучены как седиментационного равновесия (SE) и скорости оседания (SV) 10. Тем не менее, первый способ является более простым для выполнения и описано здесь. В SE, центрифугирование провод т при достаточно низкой скорости, так что не будет достигнуто равновесие между диффузии и седиментации. В этот момент, равновесный профиль оптического сигнала (UV-VIS) как функцию радиального расстояния, могут быть проанализированы с использованием заранее установить термодинамических моделей для ассоциаций 11.
ve_content "> В данной работе, седиментационного равновесия исследование представлено в самоассоциации вирусной мембранного белка, который образует ионные каналы. Из-за своей гидрофобности, эксперимент проводят в присутствии детергента, и в этом случае плотность Растворитель должен быть согласован с, что моющего средства. Однако, протокол, описанный будет идентична в случае растворимого белка воды, за исключением того, что нет соответствующего растворител плотность не потребуется.Белок, используемый кодируется в человеческом респираторно-синцитиальный вирус (РСВЧ), оболочечным пневмовирусов в семье Paramyxoviridae, что вызывает болезнь нижних дыхательных путей у младенцев, пожилых и престарелых, с ослабленным иммунитетом населения во всем мире 12. До 64 миллиона зарегистрированных случаев РСВЧ инфекции и 160000 смертей происходят каждый год.
РСВЧ геном транскрибирует 11 белков, в том числе три мембранных белков F, G, и малые гидрофобные (SH). SH белок участвуетв патогенезе инфекции RSV. РСВ отсутствует ген Sh (RSVΔSH) был жизнеспособным, вызвало образование синцитиев и росли, а также дикого типа (WT) вируса 13-16. Тем не менее, вирус RSVΔSH воспроизведены в 10 раз менее эффективно, чем WT в верхних дыхательных путей 15, 16. Кроме того, вирус RSVΔSH был ослаблен в естественных условиях мыши и моделей шимпанзе 13, 17.
SH белок 64 (RSV подгруппы А) или 65 (РСВ подгруппа B) аминокислот длиной Тип II интегральный мембранный белок, который накапливается в основном на мембранах отсека Гольджи 18. SH белок имеет одного предсказывали-спиральных трансмембранных (ТМ) домен 19, который высоко консервативен 20,21. С- и N-концевые extramembrane домены ориентированы lumenally / внеклеточно и в цитоплазме, соответственно.
Как синтетические, так ТМ домен (остатки 18-43) И в полный рост SH белок, как было показано, чтобы сформировать homopentamers в различных моющих средств. Homopentameric форма отвечает за активность канала в планарных липидных бислоев 22,23. Правильная ориентация ТМ мономеров в липидный бислой впервые определена с использованием сайт-специфическое инфракрасное дихроизм 23, который показал, His-22, чтобы быть в люменальной, близко к интер-цилиндрических, ориентации. Та же ориентация ТМ домен с помощью ЯМР исследований, реконструированных пентамерного А-спиральной расслоение полноразмерного белка в dodecylphosphocholine (DPC) мицеллы 22. В этой модели "мицеллы", одного а-домен спиральной ТМ бокам N-терминальной по а-спирали и С-конце с помощью расширенного б-шпильке. Два протонируемых остатки SH белка, His-22 и его-51, которые расположены в области ТМ (lumenally ориентированной), и в наконечнике extramembrane С-концевой β шпильку (недалеко от поры канала), соответственно. В bicellar ENVIROnment, однако, ТМ α-спираль проходит до His-51, и оба его остатки доступны в просвет канала 24. Структура канала принимает воронки, как архитектура 22, где узкий участок (Ser-Cys 29 с-45) 22 выровнена с гидрофобными боковыми цепями (Ile-32, Ile-36, Ile-40 и Leu-44), и Иле-36 определяет самом узком месте в канале просвета. Его-22 располагается на самом большом открытием этого воронку, в то время как His-51 находится в наконечнике маленького отверстия.
В настоящей работе, аналитическое центрифугирование с в режиме седиментационного равновесия была использована для определения, если его протонирования влияет на стабильность SH белка пентамер. В этом случае, SH белок солюбилизируют в С14-бетаина моющего средства, который был использован ранее, чтобы показать, что белок SH формы пентамерного олигомеры 22.
протокол
Этот протокол основан на следующих ресурсов, которые должны быть переданы для более подробной информации и специальных соображений 3, 25-28.
1. Плотность соответствие моющего средства мицеллы 2 H 2 O
Примечание: Плотность буферного раствора должна быть согласована с плотностью моющих мицелл. Общие плотности регулировки агенты включают 2 H 2 O, H 2 18 O, 2 H 2 18 O, глицерин и сахароза 29. H 2 18 O имеет ту же плотность, что и 2 H 2 O и может быть лучшим выбором, если дейтерирование сменными протонов в белке не требуется. В этой процедуре, плотность 3- (N, N-dimethylmyristylammonio) -propanesulfonate (C14SB) моющего средства в 50 мМ Трис рН 7,3, 100 мМ NaCl, будут согласованы с 2 H 2 O. В качестве начального приближения следующие концентрации2 H 2 O будет использоваться: 10, 30, и 50% об / об.
1.1. Пробоподготовка
- Подготовьте следующие растворы и фильтр стерилизуют через шприцевой фильтр 0,2 мкм: 50 мл 500 мМ Трис, рН 7,3 и 1 М NaCl (10X буферного раствора); 1 мл 250 мМ C14SB (50X раствор моющего средства).
- Подготовка 200 мкл раствора образца путем смешивания 20 мкл 10X буферного раствора, 4 мкл 50X моющий раствор, 20 мкл 2 H 2 O (99,9%), и 156 мкл деионизированной H 2 O. Подготовьте также 200 мкл стандартного раствора путем смешивания 20 мкл буферного раствора 10X, 20 мкл 2 Н 2 О (99,9%), и 160 мкл деионизированной H 2 O.
- Повторите шаг 1.1.2 для других 2 O концентраций 2 Н, т.е. 30% и 50%, регулируя количество 2 H 2 O и H 2 O соответственно.
1.2. Ассамблея 6-ти канальныйUC-клетки и загрузки образца в клетки.
Примечание: Существуют два типа AUC клетки в зависимости от способа загрузки образца. Клетки без внешнего заполнения должен быть загружен перед герметизацией ячейки, в то время как внешняя заполнения клетки могут быть загружены через клетки загерметизированы. Сборка внешнего заполнения AUC клетки было описано ранее 3. В этом протоколе, сборка 6-канального AUC клетки без внешнего наполнения описывается. Главное отличие в том, что он имеет винтовые кольца с обеих сторон, которые должны быть затянуты отдельно, и это не нужно жилье пробки (рис. 1). Разница в этапы сборки приводятся ниже.
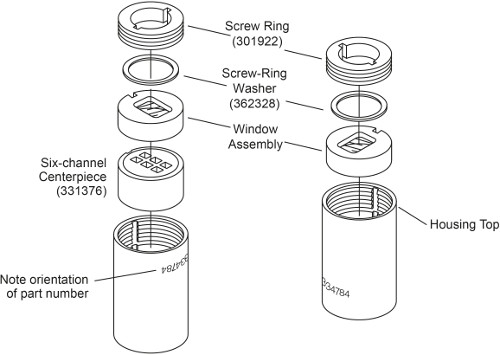
Рисунок 1. разобранном виде 6-канального AUC клетки без внешнего заполнения. Эта цифра была изменена с Beckman Coulter Ан-50 Ti и-60 Ti Analytiкал ротора, клетки и ручной автопогрузчик пользователь.
- Приготовьте два окна сборки для каждого AUC ячейки с сапфировым окном вместо кварцевого окна (рис. 2). Поместите окно прокладку в держатель стекла. Слегка согните лайнер окна и поместите его в держатель окна таким образом, что образуется зазор напротив держателя окно паз. Поместите сапфировое окно внутри лайнера окна, совместив метку с держателя Окно пазу.
Примечание:. Кварцевое окно является сжимаемым и, таким образом, будет производить более преломление света с высокой скоростью 28, 30 Поэтому для измерения помех выше 30000 оборотов в минуту, например, в этом эксперименте плотности соответствия, используются сапфировые окна. Сапфировое окно тяжелее кварцевым окном и имеет "X" запечатлелись на его стороне.
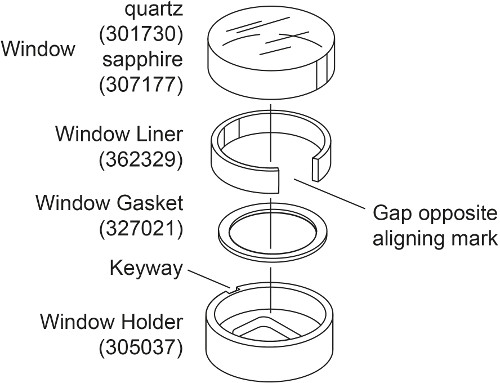
Рисунок 2. Изображение в разобранном виде оF оконной сборки. Эта цифра была изменена с Beckman Coulter-50 Ti и Ан-60 Ti аналитического ротора, клеток, и руководство пользователя противовес
- Поместите корпус ячейки с номером детали в обратном порядке. С пазами в соответствие с ключом жилья, скользить в корпус ячейки во-первых, центральным 6-сектора со скошенными стороной вниз, а затем одну оконного блока с окном вниз (рис. 1, слева).
- Слегка смажьте кольцо винта нити и винт кольца-шайбы с spinkote. Поставьте резьбовым кольцом шайбу на верхней части оконного блока. Установите кольцо винта в окне корпуса со словом "OUT" обращена наружу. Затянуть винт кольцо при помощи функции клеток выравнивания.
- Использование динамометрического ключа затянуть винт кольцо только 60 дюйм-фунт.
- Поставьте клетку с номером вертикальном и расположен на 12-полдень. LOAD 120 ссылка мкл в левую строк и 110 мкл образца в правый ряд. Убедитесь, что каждый образец и ссылки правильно паре.
Примечание: Точный объем образца не является критическим, но ссылка должна быть немного больше, чем объем образца (5-10 мкл) таким образом, что образец будет мениска различны. - Осторожно вставьте в корпус ячейки одного оконного с окна вниз (рис. 1, справа). Позаботьтесь, чтобы не нарушить клетки чрезмерно и разлить содержимое.
- Повторите шаг 1,2. 3 и 1,2. 4, ужесточение второй винт кольцо 120 дюйм-фунтов. Обратить ячейку и снова затяните первый винтовой кольцо 120 дюйм-фунтов.
- Загрузите клеток в ротор, установить ротор в центрифуги и установить монохроматор в соответствии с инструкциями изготовителя 28.
Примечание: Данные об этом стEP также можно найти в этой ссылке 3.
1.3. Настройка измерения помех
- Запустите программу пользовательского интерфейса для инструмента AUC и выполнять лазерной установки и радиальную калибровку для каждой ячейки в 3000 оборотов в минуту, в соответствии с инструкциями изготовителя, которые будут кратко в следующем шаге.
- 1.3.1.1 После достаточного вакуума было достигнуто (<100 мкм), запустите центрифугу на 3000 оборотах в минуту. Предварительный просмотр интерференционную картину в программном обеспечении пользовательского интерфейса и настроить параметры лазера для получения высочайшей контрастностью.
- Создайте новый настроить файл (File | New File) с указанием "Равновесие" и "Вмешательство" измерения. Настройка метода седиментационного равновесия (кнопка "Метод"), чтобы запустить на 45000 оборотов в минуту или высокой скорости ожидаемого для образцов белка, в зависимости от того, что больше, с температурой выполнения при 20 ° С и собирают 1 сканирование каждые 15 минут. MonitoR равновесие прогресс, открыв файлы данных в HeteroAnalysis и выбрав функцию "Матч" после по крайней мере 12 часов (приблизительно в течение ночи, рис. 3).
Примечание: Подобная функция также доступна в SEDFIT (Options | Загрузка параметров | Тест приближение к равновесию).

Рисунок 3. Результат от функции HeteroAnalysis матча. Функция Match может быть использован для мониторинга равновесия прогресс путем сравнения СКО между последовательными сканирования и время последнего сканирования. Этот пример показывает, достижение равновесия после 8 ч, как указано значений РДМС асимптотическим чтобы X-оси.
1.4. Анализ данных
- Для каждого набора образцов, построить наклон профиля радиального распределения против 2 H концентрации 2 O.
Примечание: распределение будет очень мелкой экспоненциальная, что аржается линейность. X-ось пересечения соответствует совпадающим 2 H концентрации 2 O. - Для получения более точных результатов проведения эксперимента в нескольких повторах. Кроме того, повторить эксперимент с более узким диапазоном 2 H 2 концентрации O.
2. Осаждение равновесие SH в C14SB мицелл
2.1. Параметры Запуска
- Рассчитать плотность буфера и вязкость, белок парциального удельного объема и скорости центрифугирования с помощью SEDNTERP. Для расчета плотности буфера и вязкость, выберите Compute в разделе "Буфер данных Select" и введите буферных компонентов соответственно, в том числе концентрации D 2 O.
- 2.1.1.1 Для расчета белков парциального удельного объема, выберите Compute в разделе "V-Bar" и введите последовательность белка аминокислот. Укажите высокая ожидаемая олигомерное размер в "Согласовать олигомера от этого мономера: N ="поле, в данном случае N = 5. Рассчитайте скорость вводя значения в поле RPM в главном окне до σ ≈ 1; это правило, чтобы обеспечить хорошую экспоненциальную форму профиля радиального распределения 25.
Примечание: Значения, рассчитанные для этого эксперимента была следующей: ρ = 1,03839 г / мл, η = 1,0267 сП = 0,7569 мл / г, ω 1 = 16000 оборотов в минуту. - Рассчитать последующие скорости следовать, чтобы обеспечить достаточную разницу между профилем распределения на одной скорости и в следующем 25.
Примечание: это также может быть сделано с помощью функции "Расчетный равновесие скорости вращения ротора функцию" в SEDFIT, которая принимает во внимание колонки решение (заполнение объема).
2.2. Примеры препараты
- Подготовка 1 мл эталонного раствора с 5 мМ C14SB и 32,3% 2 H 2 O, как определяется из сопоставления плотности эксперимента (раздел 1), путем смешивания 100 мкл 10X буфера SOLUTION (шаг 1.1.1), 20 мкл 50X моющего раствора (этап 1.1.1), 323 мкл 2 Н 2 О (99,9%) и 527 мкл деионизированной H 2 O.
- Растворить лиофилизированный, ВЭЖХ-очищенный SH пептидов (экспрессию и очистку, описанную ранее 31) в соответствующем растворителе, таком как метанол или 50% об / об водном ацетонитриле. Измерьте А280 растворенных пептидов в микролитровой масштаба УФ-Вид спектрофотометр и аликвоты / для трех образцов, чтобы дать 280 мм, 12 мм = 0,3, 0,5 и 0,8 (280, 10 мм = 0,25, 0,417 и 0,67), каждый при разбавлении в 130 мкл. Лиофилизации образцы в течение ночи и ресуспендируют в 130 мкл стандартного раствора (этап 2.2.1) с получением растворов образцов.
Примечание: SH белок может быть обнаружен с UV / VIS поглощение при 280 нм, так как он содержит Trp и Tyr остатков. Белки без ароматических остатков могут быть обнаружены с помощью мечения их с подходящим хромофором, с помощью Trp-содержащий мутант, или с помощью помехиNCE измерения вместо поглощения. - Выполните шаги в разделе 1.2, чтобы собрать 6-канальный AUC ячейку с кварцевыми окнами. Загрузите высокий образец концентрации (280 мм, 12 мм = 0,8) в канале ближайшего к центру ротора и низкой концентрации пробы (280, 12 мм = 0,3) дальше от центра ротора.
2.3. Настройка измерений оптической плотности
- Создайте новый настроить файл (File | New File) с указанием "равновесия" и измерение "абсорбцию". Укажите 280 нм, длина волны детектора.
- Выполните радиальную калибровку на 3000 оборотов в минуту проверки "Radial калибровку до первого сканирования" в опции проверки, указав сбора данных с низким разрешением, например, с радиальными шагом = 0,01 см, Копировщиков = 3 (низкое разрешение, быстро), и выполнения одного сканирования , После завершения сканирования, снимите флажок.
- Настройка метода седиментационного равновесия ("Methoд кнопку "), чтобы работать на первой скорости, вычисленной на этапе 2.1.3, при 20 ° С, и собирают 1 Сканировать каждые 30 минут. В каждой клеток «деталь», укажите сбора данных с низким разрешением, как в шаге 2.3.2. Монитор равновесия прогресс, открыв файлы данных в HeteroAnalysis и выбрав функцию "Матч" после по крайней мере 18 часов (приблизительно в течение ночи, рис. 4).
Примечание: достижение равновесия может занять существенно больше времени для первой скорости, в то время как последующие скорости займет меньше времени.
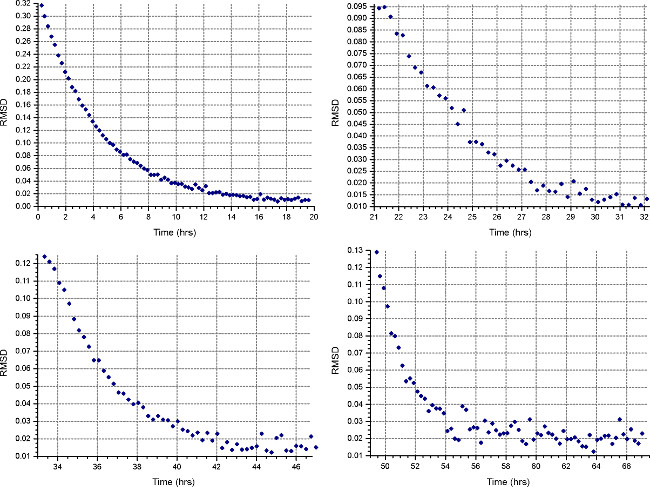
Рисунок 4. Результаты функции HeteroAnalysis матча. Первый и второй скорости (вверху слева и справа), похоже, достигла равновесия, но лучше подождать несколько часов, чтобы быть уверенным. Для сравнения, в третьем и четвертом скорости (внизу слева и справа) ясно достигли равновесияв более короткие сроки. Пожалуйста, нажмите здесь, чтобы увидеть увеличенную версию этой цифры.
- После того, как равновесие достигнуто, собрать единую сканирование с высоким разрешением, например, с радиальным размером шага = 0,001 см, Копировщиков = 10 (высокое разрешение, медленно).
- После завершения сканирования, повторите шаг 2.3.3 и 2.3.4 для следующего скорости.
- Возможно, в случае необходимости время для достижения равновесия для каждой скорости известна (рассчитана или из опыта), настроить метод седиментационного равновесия сканирование, чтобы включать в себя все скорости, вычисленной на этапе 2.1.3 и собрать 1 сканирование по истечении времени установления равновесия для каждого скорость. В этом случае укажите сбора данных с высоким разрешением в каждом клеток «деталь».
2.4. Анализ данных в SEDFIT и SEDPHAT
Примечание: Для получения более подробной информации и соображений в читателя анализа данных называется то следующем веб-сайте: www.analyticalultracentrifugation.com.
- Открытые Сканирование с высоким разрешением в SEDFIT (данные | нагрузка седиментационного равновесия данных) и разделяет данные на 3 каналов (они соответствуют различным концентрациям для каждого образца; опции | Загрузка параметров | Сохранить 6-канальный Raw Data в 3 подмножеств).
- Re-открытых файлов данных, которые принадлежат к той же выборке и той же концентрации, но с разными скоростями в SEDFIT. Отрегулируйте мениск (вертикальная красная линия), ячейка снизу (синяя линия) и фитингов пределы (вертикальные зеленые линии), а также экспортировать данные для использования в SEDPHAT (Data | экспорт данных в SEDPHAT). Вход параметрами, рассчитанными на этапе 2.1.1, а также роторного типа и вида главной центральной, как просили. Повторите этот шаг для каждого образца и концентрации.
- Откройте все данные из того же образца (все концентрации и ускоряет) в SEDPHAT и заполните параметры эксперимента; Пример показан на рис. 5.
Примечание: при D 2 O добавляют в буфере, Втор ие сменных протонов может значительно изменить молекулярную массу белка, особенно для водорастворимых белков. Мембранные белки, особенно маленькие, как SH белка, менее подвержены потому что мембранные встраиваемый регионы защищен от обмена. Чтобы исправить это, вход "буфер D мол фракции".
Примечание: На этом этапе рекомендуется сохранить отредактированный набор данных по отдельности, выбрав в меню Данные | скопировать все данные и сохранить как Нью-Config. - Выберите модель и заполнить глобальные параметры для этой модели.
Примечание: В качестве примера, модель "Мономер-н-Мер самоассоциация" и его параметры показаны на рис. 6.
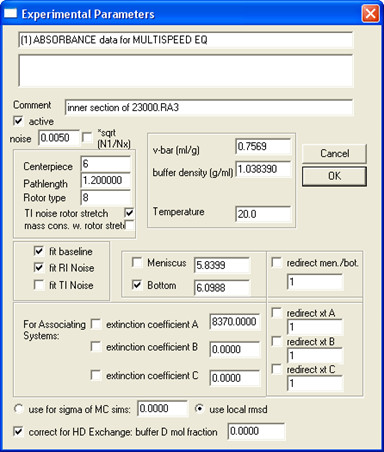
Рисунок 5. Пример того, как заполнить параметры эксперимента.
Файлы / ftp_upload / 52404 / 52404fig6.jpg "/>
Рисунок 6. Пример того, как заполнить глобальные параметры для мономера-н-Мер самоассоциация модели.
- Запуск Глобальный Fit, выбрав меню Fit | Глобальный Fit и подождите, пока подходят сходится. Примечание вниз (или сделайте скриншот) Пригоночные результаты, особенно глобальная уменьшается хи-квадрат и войти K значения. Выписка другие данные, такие как пригодные данных и фитинговых остаточных меню копирования и дисплей | Показать термодинамической информации.
- Вернуться в глобальные параметры и проверить M (1), чтобы соответствовать мономера молекулярную массу и повторите шаг 2.4.5. Запишите оборудованная молекулярную массу и глобального снижение хи-квадрат.
- Повторите шаг 2.4.3 для 2.4.6 Для каждой модели для тестирования и сравнения подходят качества каждой модели путем сравнения сократили мировое хи-квадрат значение, а также подходящие остатки.
Примечание: Малые и случайные монтажу остатки обычно указывает на хорошую подгонку, и модель, которая лучше всего подходит быимеют наименьший глобального снижение хи-квадрат. Оборудованная мономера молекулярная масса и ее хи-квадрат значение не должно существенно отличаться от фиксированного (теоретической) молекулярной массы. - Рассчитать доверительный интервал для полученного журнале кА значения, сначала выбрав Статистика | Critical хи-квадрат для поверхностных ошибка прогнозов и ввода нужного доверительный интервал. Затем перейдите к статистике | Создать 1-проекционных поверхности ошибок, и отменить войти Ка в диалоге Global Parameters, чтобы получить хи-квадрат значения для журнала Ка.
Примечание: читателям рекомендуется обратиться к следующим источникам (http://www.analyticalultracentrifugation.com/ sedphat / statistics.htm) для более подробной информации о методе 32, а в качестве иллюстрации этого метода 33.
Результаты
Радиальный профиль распределения C14SB моющих мицелл в 50 мМ Трис, 100 мМ NaCl pH 7,3, образует очень мелкой экспоненциальных, которые могут быть установлены на линейной модели (фиг.7А). Наклон этого распределения обратно пропорциональна D 2 концентрации O (рис 7В). Точка, в к?...
Обсуждение
Эта статья представляет собой экспериментальный протокол для подготовки и анализа олигомеризации малого мембранного белка в моющем средстве с помощью равновесной седиментации образца. Протокол, описанный в равной степени относится -А simpler- для растворимых белков, а соответствующий п...
Раскрытие информации
The authors have nothing to disclose.
Благодарности
This work has been funded by the National Research Foundation grant NRF-CRP4-2008-02 (J.T.) and Tier 1 grant RG 51/13.
Материалы
| Name | Company | Catalog Number | Comments |
| 3-(N,N-dimethylmyristylammonio)propanesulfonate | Sigma | T0807 | |
| Deuterium oxide 99.8% | Cambridge Isotope | DLM-4-99.8 | |
| An-50 Ti Rotor, Analytical, 8-Place | Beckman Coulter | 363782 | |
| An-60 Ti Rotor, Analytical, 4-Place | Beckman Coulter | 361964 | |
| Cell housing | Beckman Coulter | 334784 | |
| 12 mm six-channel centerpiece, epon charcoal-filled | Beckman Coulter | 331376 | |
| Window holder | Beckman Coulter | 305037 | |
| Window gasket | Beckman Coulter | 327021 | |
| Window liner | Beckman Coulter | 362329 | |
| Sapphire window | Beckman Coulter | 307177 | |
| Quartz window | Beckman Coulter | 301730 | |
| Screw-ring washer | Beckman Coulter | 362328 | |
| Screw ring | Beckman Coulter | 301922 | |
| Spinkote | Beckman Coulter | 306812 | |
| Torque stand assembly | Beckman Coulter | 361318 | |
| Counterbalance | Beckman Coulter | 360219 | |
| Cell alignment tool | Beckman Coulter | 362340 | |
| SEDNTERP | http://bitcwiki.sr.unh.edu/index.php/Main_Page | ||
| HeteroAnalysis | http://www.biotech.uconn.edu/auf/?i=aufftp | ||
| SEDFIT | http://www.analyticalultracentrifugation .com/sedfit.htm | ||
| SEDPHAT | http://www.analyticalultracentrifugation .com/sedphat/default.htm |
Ссылки
- Laue, T. M., Stafford, W. F. Modern applications of analytical ultracentrifugation. Annu. Rev. Biophys. Biomol. Struct. 28, 75-100 (1999).
- Lebowitz, J., Lewis, M. S., Schuck, P. Modern analytical ultracentrifugation in protein science: A tutorial review. Protein Sci. 11, 2067-2079 (2002).
- Balbo, A., Zhao, H., Brown, P. H., Schuck, P. . Assembly, Loading, and Alignment of an Analytical Ultracentrifuge Sample Cell. , e1530 (2009).
- Rivas, G., Stafford, W., Minton, A. P. Characterization of heterologous protein-protein interactions using analytical ultracentrifugation. Methods-a Companion to Methods in Enzymology. 19, 194-212 (1999).
- Howlett, G. J., Minton, A. P., Rivas, G. Analytical ultracentrifugation for association and assembly the study of protein. Curr. Opin. Chem. Biol. 10, 430-436 (2006).
- MacGregor, I. K., Anderson, A. L., Laue, T. M. Fluorescence detection for the XLI analytical ultracentrifuge. Biophys. Chem. 108, 165-185 (2004).
- Phizicky, E. M., Fields, S. Protein-Protein Interactions - Methods for Detection and Analysis. Microbiol. Rev. 59, 94-123 (1995).
- Alexandrov, A. A facile method for high-throughput co-expression of protein pairs. Mol. Cell. Proteomics. 3, 934-938 (2004).
- Nooren, I. M. A., Thornton, J. M. Structural characterisation and functional significance of transient protein-protein interactions. J. Mol. Biol. 325, 991-1018 (2003).
- Ebel, C. Sedimentation velocity to characterize surfactants and solubilized membrane proteins. Methods. 54, 56-66 (2011).
- Minton, A. P. Quantitative characterization of reversible macromolecular associations via sedimentation equilibrium: an introduction. Exp. Mol. Med. 32, 1-5 (2000).
- Dowell, S. F. Respiratory syncytial virus is an important cause of community-acquired lower respiratory infection among hospitalized adults. J. Infect. Dis. 174, 456-462 (1996).
- Bukreyev, A., Whitehead, S. S., Murphy, B. R., Collins, P. L. Recombinant respiratory syncytial virus from which the entire SH gene has been deleted grows efficiently in cell culture and exhibits site-specific attenuation in the respiratory tract of the mouse. J. Virol. 71, 8973-8982 (1997).
- Fuentes, S., Tran, K. C., Luthra, P., Teng, M. N., He, B. Function of the respiratory syncytial virus small hydrophobic protein. J. Virol. 81, 8361-8366 (2007).
- Jin, H. Recombinant respiratory syncytial viruses with deletions in the NS1, NS2, SH, and M2-2 genes are attenuated in vitro and in vivo. Virology. 273, 210-218 (2000).
- Karron, R. A. Respiratory syncytial virus (RSV) SH and G proteins are not essential for viral replication in vitro: clinical evaluation and molecular characterization of a cold-passaged, attenuated RSV subgroup B. Proc. Nat. Acad. Sci. USA. 94, 13961-13966 (1997).
- Whitehead, S. S. Recombinant respiratory syncytial virus bearing a deletion of either the NS2 or SH gene is attenuated in chimpanzees. J. Virol. 73, 3438-3442 (1999).
- Rixon, H. W. The small hydrophobic (SH) protein accumulates within lipid-raft structures of the Golgi complex during respiratory syncytial virus infection. J. Gen. Virol. 85, 1153-1165 (2004).
- Collins, P. L., Mottet, G. Membrane orientation and oligomerization of the small hydrophobic protein of human respiratory syncytial virus. J. Gen. Virol. 74, 1445-1450 (1993).
- Collins, P. L., Olmsted, R. A., Johnson, P. R. The small hydrophobic protein of human respiratory syncytial virus: comparison between antigenic subgroups A and B. J. Gen. Virol. 71, 1571-1576 (1990).
- Chen, M. D., Vazquez, M., Buonocore, L., Kahn, J. S. Conservation of the respiratory syncytial virus SH gene. J. Infect. Dis. 182, 1228-1233 (2000).
- Gan, S. W. The small hydrophobic protein of the human respiratory syncytial virus forms pentameric ion channels. J. Biol. Chem. 287, 24671-24689 (2012).
- Gan, S. W., Ng, L., Xin, L., Gong, X., Torres, J. Structure and ion channel activity of the human respiratory syncytial virus (hRSV) small hydrophobic protein transmembrane domain. Protein Sci. 17, 813-820 (2008).
- Li, Y. Inhibition of the Human Respiratory Syncytial Virus Small Hydrophobic Protein and Structural variations in a bicelle environment. J. Virol. 88 (22), 11899-914 (2014).
- Burgess, N. K., Stanley, A. M., Fleming, K. G. Determination of membrane protein molecular weights and association equilibrium constants using sedimentation equilibrium and sedimentation velocity. Meth. Cell. Biol. 84, 181-211 (2008).
- Cole, J. L., Lary, J. W., Moody, T. P., Laue, T. M. Analytical Ultracentrifugation: Sedimentation Velocity and Sedimentation Equilibrium. Meth. Cell. Biol. 84, 143-179 (2008).
- Fleming, K. G. Determination of membrane protein molecular weight using sedimentation equilibrium analytical ultracentrifugation. Curr. Protoc. Prot. Sci. 53, 17.12.11-17.12.13 (2008).
- . . An-50 Ti and An-60 Ti Analytical Rotor, Cells, and Counterbalance. , (2005).
- Mayer, G. Studying membrane proteins in detergent solution by analytical ultracentrifugation: Different methods for density matching. Prog. Colloid Polym. Sci. 113, 176-181 (1999).
- Laue, T. Ch. 20.3. Current Protocols in Protein Science. 20, 20.23.21-20.23.13 (2001).
- Gan, S. W. The Small Hydrophobic Protein Of The Human Respiratory Syncytial Virus Forms Pentameric Ion Channels. J. Biol. Chem. 287, 24671-24689 (2012).
- Bevington, P. R., Robinson, D. K. . Data reduction and error analysis for the physical sciences. 336, (1969).
- Schuck, P., Radu, C. G., Ward, E. S. Sedimentation equilibrium analysis of recombinant mouse FcRn with murine IgG1. Molecular Immunology. 36, 1117-1125 (1999).
- Gan, S. W., Vararattanavech, A., Nordin, N., Eshaghi, S., Torres, J. A cost-effective method for simultaneous homo-oligomeric size determination and monodispersity conditions for membrane proteins. Anal. Biochem. 416, 100-106 (2011).
- Montserret, R. NMR structure and ion channel activity of the p7 protein from hepatitis C virus). J. Biol. Chem. 285, 31446-31461 (2010).
- Stouffer, A. L., DeGrado, W. F., Lear, J. D. Analytical Ultracentrifugation Studies of the Influenza M2 Homotetramerization Equilibrium in Detergent Solutions. Progr Colloid Polym Sci. 131, 108-115 (2006).
- Sorkin, A., von Zastrow, M. Signal transduction and endocytosis: Close encounters of many kinds. Nat. Rev. Mol. Cell Biol. 3, 600-614 (2002).
- Gan, S. W., Ng, L., Lin, X., Gong, X., Torres, J. Structure and ion channel activity of the human respiratory syncytial virus (hRSV) small hydrophobic protein transmembrane domain. Protein science : a publication of the Protein Society. 17, 813-820 (2008).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены