È necessario avere un abbonamento a JoVE per visualizzare questo. Accedi o inizia la tua prova gratuita.
Method Article
Rapid One-step enzimatica Sintesi e All-acquosa Purificazione di trealosio analoghi
In questo articolo
Riepilogo
Trehalose analogues are emerging as important molecules for bio(techno)logical and biomedical applications. We describe an optimized protocol for enzymatically synthesizing and purifying trehalose analogues that is simple, efficient, fast, and environmentally friendly. Its application to the rapid production and administration of a probe for the detection of mycobacteria is demonstrated.
Abstract
versioni di trealosio, o analoghi trealosio modificati chimicamente, avere applicazioni in biologia, biotecnologia e scienza farmaceutica, tra gli altri campi. Per esempio, analoghi trealosio recanti tag rilevabili sono stati utilizzati per rilevare Mycobacterium tuberculosis e possono avere applicazioni come tubercolosi agenti di imaging diagnostico. versioni idroliticamente stabili di trealosio sono perseguiti a causa del loro potenziale per l'uso come dolcificanti non calorici e agenti bioprotettivi. Nonostante il ricorso di questa classe di composti per varie applicazioni, il loro potenziale rimane inutilizzato a causa della mancanza di un percorso robusto per la loro produzione. Qui riportiamo un protocollo dettagliato per la rapida ed efficiente di uno stadio di sintesi di analoghi biocatalitiche trealosio che aggira i problemi associati con la sintesi chimica. Utilizzando l'enzima termostabile trealosio sintasi (Tret) da Thermoproteus tenax, analoghi trealosio può essere generatEd in un unico passaggio da analoghi di glucosio e di glucosio uridina difosfato in alto rendimento (fino a conversione quantitativa) in 15-60 min. Un semplice e rapida protocollo di purificazione non-cromatografica, che consiste di rotazione dialisi e scambio ionico, in grado di fornire molti analoghi trealosio di concentrazione nota in soluzione acquosa in appena 45 min. Nei casi in cui non reagito analogo del glucosio rimane ancora, purificazione cromatografica del prodotto analogo trealosio può essere eseguita. In generale, questo metodo fornisce una piattaforma biocatalitico "verde" per la sintesi accelerato e purificazione di analoghi trealosio che sia efficiente e accessibile anche ai non farmacisti. Per esemplificare l'applicabilità di questo metodo, si descrive un protocollo per la sintesi, tutto-acquosa di purificazione, e la gestione di un clic sonda chimica trealosio-based per micobatteri, ognuno dei quali ha meno di 1 ora e ha consentito la rilevazione di fluorescenza dei micobatteri. In futuro, prevediamo che, tra OTHer le applicazioni, questo protocollo può essere applicato alla rapida sintesi di sonde trealosio-based per la diagnostica della tubercolosi. Per esempio, di breve durata analoghi radionuclide-modificato trealosio (ad esempio, 18 trealosio F-modificato) potrebbe essere usato per le modalità avanzate di imaging clinico come la tomografia a emissione di positroni tomografia computerizzata-(PET-CT).
Introduzione
Il trealosio è un disaccaride simmetrica non riducente consistente in due frazioni di glucosio che sono uniti da un 1,1-α, legame α-glicosidico (Figura 1A). Mentre trealosio è assente da esseri umani e altri mammiferi, si trova comunemente nei batteri, funghi, piante e invertebrati 1. Il ruolo primario di trealosio in molti organismi a proteggere dagli stress ambientali, come essiccazione 1. Inoltre, alcuni agenti patogeni umani richiedono trealosio per la virulenza, compresa la tubercolosi Mycobacterium tuberculosis causano, che utilizza trealosio come mediatore della biosintesi busta cellulare e come un blocco di costruzione per la costruzione di glicolipidi immunomodulanti 2.
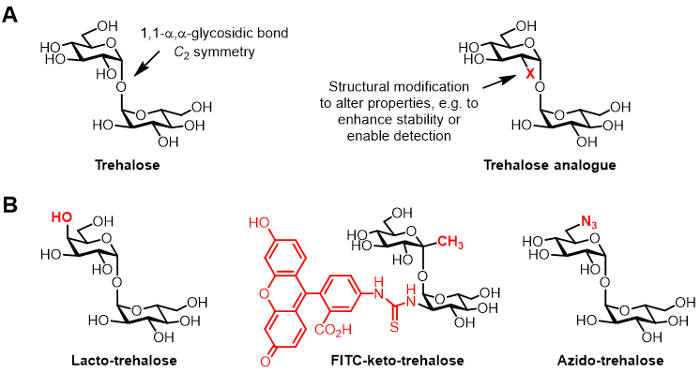
Figura 1: Il trealosio e analoghi trealosio. (A) Strutture di trealosio naturale e un analogo trealosio innaturale, dove X è una modifica strutturale. (B) Esempi di analoghi trealosio riportati in letteratura che hanno potenziali applicazioni in bioconservazione e bioimmagini.
Grazie alla sua struttura unica e funzioni fisiologiche, trealosio ha attirato grande attenzione per l'uso in bio (tecno) logici e applicazioni biomediche 3. Le proprietà protettive del trealosio osservati in natura- ad esempio, la sua capacità sorprendente per contribuire a sostenere la vita delle piante "Resurrezione", che sono stati sottoposti a disidratazione estrema 4 -hanno spronato il suo ampio uso in applicazioni bioconservazione. Trealosio è stato usato per conservare una vasta gamma di campioni biologici, come acidi nucleici, proteine, cellule e tessuti 3. Per esempio, trealosio viene utilizzato come additivo stabilizzante in un certo numero di prodotti farmaceutici tcappello sono sul mercato, tra cui diversi anticorpi monoclonali anti-cancro 3. Così, trealosio viene utilizzato come dolcificante nell'industria alimentare, ed è ampiamente usato per la conservazione del prodotto sia nell'industria alimentare e cosmetica. L'adozione di trealosio per questi tipi di applicazioni commerciali è stata inizialmente limitata dalla incapacità di ottenere grosse quantità di trealosio puro da fonti naturali o attraverso la sintesi. Tuttavia, è stato recentemente sviluppato un processo enzimatico efficiente per la produzione economica di trealosio da amido, che ha stimolato l'uso commerciale diffuso 5.
Derivati di trealosio chimicamente modificato, qui denominati analoghi trealosio, hanno guadagnato crescente attenzione per varie applicazioni (struttura generica mostrata in figura 1A, esempi specifici di analoghi trealosio illustrati nella Figura 1B) 6. Ad esempio, lacto-trealosio è un analogo trealosio con una sua unità di glucosio sostituito con galattosio, quindi il suo gruppo ossidrilico posizione 4 ha una configurazione stereochimica invertita. Lacto-trealosio ha le stesse proprietà stabilizzanti come trealosio, ma è resistente alla degradazione da parte degli enzimi intestinali, rendendolo attraente come un non-calorico additivo alimentare 6, 7.
l'interesse del nostro gruppo in analoghi trealosio si riferisce in primo luogo al loro valore come sonde e gli inibitori specifici per micobatteri. I gruppi di Barry e Davis hanno sviluppato un cheto-trealosio analogico fluoresceina coniugato, chiamato FITC-cheto-trealosio, che è stato mostrato al metabolicamente etichettare la parete cellulare di vivere M. tuberculosis, che consente il rilevamento da microscopia a fluorescenza 8. Il laboratorio Bertozzi sviluppato più piccolo azido-trealosio (TreAz) analoghi che potrebbero metabolicamente etichetta la parete cellulare e, successivamente, essere detette utilizzando clic chimica e analisi di fluorescenza 9. Questi progressi indicano la possibilità di utilizzare sonde trealosio-based come agenti di imaging diagnostico per la tubercolosi. Analoghi trealosio sono stati perseguiti come inibitori di M. tuberculosis a causa del loro potenziale di distruggere percorsi nel batterio che sono essenziali per la vitalità e la virulenza 10, 11, 12.
Finora, il principale ostacolo allo sviluppo di analoghi trealosio per bio (tecno) applicazioni logiche e biomediche è la mancanza di metodi di sintesi efficienti. I due percorsi tradizionali per produrre analoghi trealosio basano sulla sintesi chimica (Figura 2). Un percorso coinvolge desymmetrization / modifica di trealosio naturale, mentre l'altro comporta iniziano adeguatamente funzionalizzati blocchi monosaccaridi ed eseguendo glicosilazione chimicoforgiare la 1,1-α, legame α-glicosidico. Questi approcci, che sono stati recentemente discussi in articoli di revisione 13, 14, si sono dimostrati utili per compiere sintesi multistadio di piccole quantità di prodotti naturali trealosio contenenti complessi, come sulfolipid-1 da M. tuberculosis 15. Tuttavia, entrambi gli approcci sono generalmente inefficienti, tempo, inaccessibili ai non chimici, e, inoltre, non sono considerati essere rispettosi dell'ambiente. Così, per sintetizzare alcuni tipi di analoghi trealosio, queste strategie non sono ideali.
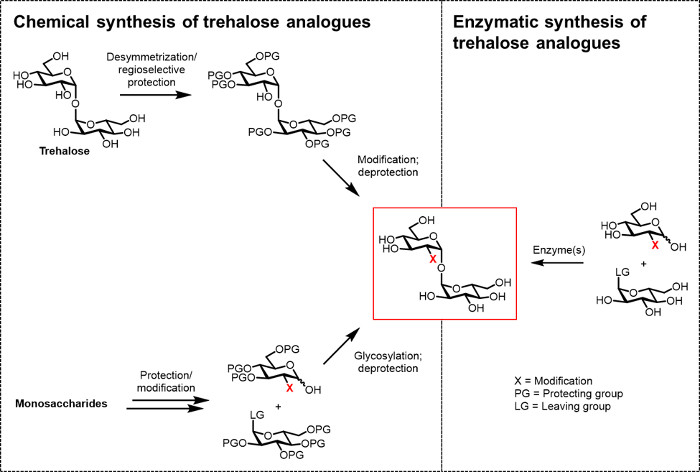
Figura 2: Approcci alla sintesi trealosio analogico. Chimica si avvicina alla sintesi trealosio analogico, mostrato a sinistra, utilizzare le procedure più fasi che coinvolgono Protec difficilepassi zione / deprotezione, desymmetrization, e / o glicosilazione. sintesi enzimatica, mostrata a destra, usa enzima (s) per convertire stereoselettiva semplici, substrati non protetti trealosio analoghi in soluzione acquosa. Il protocollo enzimatica qui riportate utilizza un enzima trealosio sintasi (Tret) per convertire analoghi di glucosio e UDP-glucosio in analoghi trealosio in un unico passaggio. Clicca qui per vedere una versione più grande di questa figura.
Un efficiente percorso biocatalitico agli analoghi trealosio faciliterebbe la produzione, la valutazione e l'applicazione di questa promettente classe di molecole. Mentre il processo enzimatico commerciale per la produzione di trealosio 5 non è adattabile a sintetizzare analoghi perché utilizza amido come substrato, ci sono altri percorso biosinteticomodi in natura che possono essere utilizzate per la sintesi analogica trealosio. Tuttavia, la ricerca in questo settore, che è stato recentemente rivisto 6, è stato limitato. Un rapporto ha usato un metodo ispirato al coli trealosio via biosintetica Escherichia per accedere a un singolo analogico fluoro-trealosio dal corrispondente fluoro-glucosio. Tuttavia, questo approccio richiede un sistema a tre enzima che ha limitato l'efficienza e generalità 8. Un altro approccio che è stato esplorato è usare trealosio fosforilasi (TRTP) in senso inverso, che in linea permette la sintesi one-step di analoghi trealosio da analoghi di glucosio e di glucosio-1-fosfato 6, 16, 17. Anche se questo approccio può avere promessa futura, sia invertenti e trattenere i TREP attualmente hanno svantaggi per la sintesi analogica. Ad esempio, i TREP inversione hanno un espe proibitivomolecola nsive donatore (β-D-glucosio 1-fosfato) e TREP ritegno hanno scarsa resa di espressione dell'enzima / stabilità e limitato la promiscuità substrato. Saranno necessari miglioramenti significativi (ad esempio, attraverso l'ingegneria enzima) prima di sintesi analogica TREP-mediata è pratico.
Allo stato attuale, l'approccio più pratico per la sintesi enzimatica di analoghi trealosio è usare un enzima trealosio sintasi (TRET), che converte il glucosio e uridina difosfato (UDP) Glucosio in trealosio in un unico passaggio 6. Recentemente abbiamo segnalato l'uso di Thermoproteus tenax Tret-un enzima termostabile e unidirezionale 18 -per sintetizzare analoghi trealosio da analoghi di glucosio e UDP-glucosio (Figura 3) 19. Questo enzima agisce solo nella direzione sintetica ed evita il problema del degrado trealosio trova nel sistema TREP. Questa reazione coul one-stepd essere completato in 1 ora, e una vasta gamma di analoghi trealosio sono stati accessibile in alto rendimento (fino a> 99% come determinato da alte prestazioni cromatografia liquida (HPLC)) da substrati analogo del glucosio prontamente disponibili (vedi tabella 1 nelle Rappresentante dei risultati sezione).
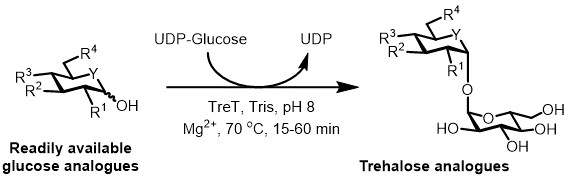
Figura 3: Tret-catalizzata sintesi one-step di analoghi trealosio. L'enzima Tret da T. tenax può stereoselettiva unirsi analoghi di glucosio prontamente disponibili e UDP-glucosio per formare analoghi trealosio in un unico passaggio. R 1 -R 4 = Variabile modifica strutturale, per esempio azido-, fluoro-, deoxy-, thio-, stereochimica, o modifiche di etichette isotopici; Y = eteroatomo variabile, ad esempio ossigeno o zolfo, o eteroatomo marcati con isotopi.
Qui, forniamo annuncioprotocollo Nell'odontoiatria per il processo di sintesi TRET, compresa l'espressione e la purificazione di Tret da E. coli, ottimizzato condizioni di reazione TRET, ed un metodo di purificazione perfezionato che viene eseguita interamente in fase acquosa. Questo protocollo modificato consente la sintesi opportuno ed efficiente e purificazione di diversi analoghi trealosio su scala semi-preparativa (10-100 mg). Dimostriamo anche l'uso di questo protocollo per la preparazione e la somministrazione di una sonda trealosio-based per micobatteri in meno di 1 ora, che ha permesso la rilevazione di fluorescenza rapida delle cellule micobatteri.
Protocollo
1. Espressione e purificazione di Tret da Top10 E. coli
NOTA: Si prega di contattare gli autori per richiedere la Tret-esprimendo ceppo di E. coli (pBAD Tret plasmide, contenente il gene Tret T. tenax sotto il controllo della proteina AraC, trasformato in Top10 E. coli 19) e l'accordo di trasferimento materiale allegato . Il protocollo che segue fornisce tipicamente una resa di proteine di circa 4 mg / L.
- Preparare una cultura durante la notte 3 ml di Tret che esprimono E. coli.
- Streak Top10 E. coli trasformato con pBAD-Tret vettore di espressione in un brodo lisogenia (LB) piastra di agar contenente 100 mg ampicillina / mL.
- Incubare la piastra a 37 ° C per circa 48 ore.
- Scegliere una singola colonia dalla piastra e inoculare 3 mL di terreno liquido LB contenente 100 mg ampicillina / mL in una provetta di coltura.
- Posizionare il tubo in un incubatore agitazione a 37 & #176; C x 175 giri al minuto durante la notte.
- Indurre l'espressione della proteina in Tret-esprimendo E. coli.
- Aggiungere 750 mL Terrific Broth completato con 100 mg / ml ampicillina a un pallone di coltura 2.800 ml Fernbach. Trasferire 1 ml di brodo dal pallone in una provetta per un uso successivo come bianco.
- Aggiungere la cultura durante la notte 3 ml generato nel passaggio 1.1.4 al pallone di coltura, quindi posizionare il pallone in un incubatore e agitare a 37 ° C x 200 giri al minuto. Controllare periodicamente l'assorbanza della cultura a 600 nm rispetto al vuoto rilevati nella fase 1.2.1.
- Una volta che l'assorbanza a 600 nm raggiunge tra 0,5-1,0, indurre l'espressione Tret con l'aggiunta di 750 ml di soluzione 1 M arabinosio (1 mM concentrazione finale) alla cultura. Riportare il pallone incubatore e agitare una notte a 37 ° C x 200 giri al minuto.
- Pellet e la lisi dei Tret-esprimono cellule di E. coli.
- Trasferire la cultura di un polipropilene Bottle e centrifugare per 15 min a 4000 xga 4 ° C.
- Eliminare il supernatante e risospendere il pellet in 15 ml di soluzione salina tamponata con fosfato (PBS).
- Trasferire la sospensione cellulare ad una provetta da 50 ml e centrifugare per 15 min a 4000 xga 4 ° C. Eliminare il surnatante e sia procedere alla lisi cellulare (fase 1.3.4) o conservare il pellet a tempo indeterminato a -80 ° C.
- Sciogliere mini tablet 1 inibitore della proteasi in 20 mL di tampone di lavaggio (50 mM NaH 2 PO 4, 500 mM NaCl, 20 mM imidazolo, pH 8,0) in una provetta da 50 ml.
- Trasferire il tampone di lavaggio inibitore contenente proteasi al tubo conico contenente il pellet. Vortex finché il pellet viene risospeso.
- Trasferire le cellule risospese in un becher da 100 ml e lisare le cellule mediante sonicazione (sequenza di impulsi di 45 secondi, 45 secondi con un tempo di esecuzione di 2 min e 15 secondi ad una ampiezza di 75 per cento).
- Trasferire il lisato in una provetta conica da 50 ml metalloe centrifugare per 60 min a 15.000 xg a 4 ° C.
- Chiarire il lisato dal passaggio attraverso un filtro a siringa da 0,2-0,45 micron in una provetta da 50 ml.
NOTA: La concentrazione tipica di lisato ottenuto è di 100 mg / mL.
- Purificare Tret da E. coli lisato cellulare utilizzando proteine veloce cromatografia liquida (FPLC).
- Impostare la FPLC con una colonna di nichel affinità (5 ml di volume del letto). Lavare la colonna con 10 mL di acqua deionizzata o finché la colonna è pulito da qualsiasi contaminante. Equilibrare la colonna con 20 mL di tampone di lavaggio (50 mM NaH 2 PO 4, 500 mM NaCl, 20 mM imidazolo, pH 8,0) ad una portata di 1 ml / min.
- Caricare il lisato (20 mL) ottenuto dalla fase 1.3.8 nella colonna e eluire le proteine senza tag con tampone di lavaggio ad un flusso di 1 mL / min finché l'assorbanza raggiunge livelli di fondo (tipicamente 80-100 ml di tampone di lavaggio sono necessari) .
- Eluire His-tag Tret utilizzando un lineare di ggardiente di tampone di eluizione (50 mM NaH 2 PO 4, 500 mM NaCl, 250 mM imidazolo, pH 8,0) 1-100% più di 60 min ad una velocità di flusso di 1 mL / min. Raccogliere 4 frazioni mL fino a Tret è eluito e l'assorbanza raggiunge livello di base.
NOTA: Tipicamente, 60 mL di tampone di eluizione sono necessari per eluire la proteina e la proteina eluisce nell'intervallo tampone di eluizione 60-100%. Circa il 10-15 ml di puro Tret nel tampone di eluizione si ottengono. - Determinare la concentrazione di Tret misurando l'assorbanza a 280 nm contro un bianco tampone di eluizione.
- Scambio Tret in tris (idrossimetil) aminomethane (Tris) tampone con la dialisi.
- Dopo aver preparato il tubo di dialisi secondo le istruzioni del produttore, riempire la risciacquando con acqua deionizzata e poi tampone Tris (50 mM Tris, 300 mM NaCl, pH 8,0).
- Caricare il campione di Tret nel tubo di dialisi con una siringa e l'ago smussato. Dializzare durante la notte unContro 2 L di tampone Tris.
- Determinare la concentrazione di Tret misurando l'assorbanza a 280 nm contro un bianco raccolto dal lavaggio dialisi.
- Trasferire la soluzione Tret ad una provetta da 50 ml e procedere alla sintesi analogica trealosio (fase 2) o conservare l'enzima a 4 ° C.
NOTA: Tret è una proteina termostabile. Il Tret è stato memorizzato in tampone Tris a 4 ° C per diversi mesi senza osservare significativa perdita di attività.
2. One-step sintesi di trealosio analoghi Utilizzando Tret Enzyme
NOTA: Il protocollo seguente descrive una scala reazione basato su 4 volumi mL, che può erogare circa 15-30 mg di trealosio analogico seconda dell'efficienza di reazione e del peso molecolare del prodotto. I componenti della reazione possono essere scalati per ottenere più o meno trealosio analogico se lo si desidera.
- Aggiungere analogo del glucosio (0,080 mmol, massa dipende dal peso molecolare), UDP-glucosio (0.160 mmol, 97,6 mg), e MgCl 2 (0,080 mmoli, 16,3 mg) ad un tubo da 15 ml. Le concentrazioni finali di questi componenti saranno 20 mm, 40 mm e 20 mm rispettivamente.
- Aggiungere Tret in tampone Tris (ottenuto dalla fase 1.5.4) e, se necessario, un volume adeguato di tampone Tris (50 mM Tris, 300 mM NaCl, pH 8,0) per ottenere una concentrazione enzimatico finale di 300 mg / ml e una finale volume di 4 ml. Pipettare la miscela su e giù delicatamente o invertire la provetta per sciogliere i solidi.
- Incubare la reazione a 70 ° C con agitazione a 300 rpm per 1 ora, quindi inserire il tubo in ghiaccio per raffreddare.
3. Purificazione di trealosio analoghi dal greggio miscela di reazione enzimatica
- Pre-risciacquare un'unità filtro centrifugo (nominale limite di peso molecolare (NWML) 10 kDa) per rimuovere tracce glicerolo nella membrana aggiungendo 3 mL di acqua deionizzata all'unità filtro centrifugo e centrifugazione a 3.000 xg fino a quando tutto il liquido passa attraverso il filtronel tubo (circa 20 min). Ripetere altre due volte. Completare questa fase immediatamente prima o durante la reazione (passo 2.3).
- Dopo raffreddamento la miscela di reazione enzimatica (ottenuto dalla fase 2.3), trasferire all'unità filtro centrifugo pre-risciacquato. Sciacquare il tubo di reazione con 1 ml di acqua deionizzata e trasferimento all'unità filtro centrifugo. Ripetere risciacquo del tubo di reazione per il massimo recupero del prodotto.
- Centrifugare l'unità filtro centrifugo a 3.000 xg fino a quando tutto il liquido passa attraverso il filtro nel tubo (circa 20 min). Risciacquare la camera superiore dell'unità filtro centrifugo con 3 mL di acqua deionizzata e centrifugare a 3000 xg fino a quando tutto il liquido passa attraverso il filtro nel tubo (circa 20 min). Ripetere risciacquo per il massimo recupero del prodotto.
- Eliminare la camera superiore dell'unità filtro centrifugo. Aggiungere a letto misto di resina a scambio ionico (3 g) al filtrato nella parte inferiore del tubo (tipico filtrato volume è 8-15 mL a seconda del numero di risciacqui). Mescolare a temperatura ambiente per 1 ora con ancoretta magnetica ad una velocità sufficiente a mantenere le perle di resina sospese nella soluzione.
- Decantare il surnatante e filtrare per rimuovere la resina. Aggiungere 5 ml di acqua deionizzata per lavare la resina rimanente. Decantare il surnatante e filtrare, combinandola con la soluzione di prodotto dalla prima decantazione. Ripetere risciacquo della resina per il massimo recupero del prodotto.
- Analizzare la reazione mediante cromatografia su strato sottile (TLC) o HPLC per determinare se è stata raggiunta la completa conversione del glucosio analogico materiale prodotto trealosio analogico partenza. Vedere il punto 4.1 per l'analisi TLC e passo 4.2 per l'analisi HPLC.
- Rimuovere l'acqua per liofilizzazione o evaporazione rotante per dare il prodotto essiccato. Se nessun analogo del glucosio non reagito è stato osservato durante TLC o HPLC, la purificazione mediante cromatografia è necessaria. Pesare il prodotto per ottenere la reazione Yield ed eseguire risonanza magnetica nucleare (NMR) spettroscopica analisi (passo 4.3) per confermare la struttura del prodotto e purezza.
- Se non reagito analogo del glucosio è stata osservata durante l'analisi TLC, separarlo dal analogico trealosio utilizzando una colonna dimensione di esclusione.
- Preparare una colonna 1 x 100 cm che contiene, media P2 di poliacrilamide dimensioni tallone di esclusione deionizzata saturi d'acqua extra-sottili in base alle istruzioni del produttore.
NOTA: La colonna esclusione dimensionale può essere riutilizzato dopo il lavaggio con acqua deionizzata. - Ridisciogliere il prodotto di reazione enzimatica essiccato (ottenuto dalla fase 3.7) in 0,5 mL di acqua deionizzata. Applicare la soluzione di prodotto alla colonna esclusione dimensioni manualmente oppure utilizzando un adattatore di flusso della colonna. Sciacquare la fiala che conteneva il prodotto grezzo con altri 0,5 ml di acqua deionizzata, e caricarlo nella colonna dimensione di esclusione.
- Eluire il prodotto con acqua deionizzata mediante flusso per gravità e raccogliere frazioni di circa 2 mil volume L.
- Analizzare le frazioni da TLC (passo 4.1). In comune le frazioni contenenti puro analogico trealosio.
- Rimuovere l'acqua per liofilizzazione o evaporazione rotante per dare il prodotto essiccato. Pesare il prodotto per ottenere la resa di reazione e procedere ad analisi NMR (vedi punto 4.3).
- Preparare una colonna 1 x 100 cm che contiene, media P2 di poliacrilamide dimensioni tallone di esclusione deionizzata saturi d'acqua extra-sottili in base alle istruzioni del produttore.
4. Analisi di trealosio analogici Prodotti
- Eseguire l'analisi cromatografia su strato sottile (TLC) di reazione Tret.
NOTA: Questa procedura può anche essere utilizzato per analizzare formato frazioni di colonna esclusione. Può essere necessario concentrare la miscela di reazione o di colonna frazioni prima dell'analisi TLC osservare colorazione composto sulla piastra TLC.- Mark corsie sulla superficie della piastra TLC con una matita e applicare analita (s) e dello standard pertinenti (s) per le corsie appropriate, compreso lo standard analogo del glucosio, lo standard trealosio analogico (se presente), la miscela di reazione (o frazioni raccolte dalla dimensioni exclusion colonna di purificazione), e un co-spot. Dopo l'applicazione ciascun campione alla piastra TLC, permettono la piastra si asciughi.
NOTA: Per l'analisi di reazione, tipicamente 2 ml di campione viene applicato alla piastra TLC. - Sviluppare la piastra TLC usando n -butanol / etanolo / acqua deionizzata (5: 3: 2).
- Asciugare la piastra TLC sviluppata, poi immergerlo in 5% H 2 SO 4 in etanolo (zucchero macchia) e il calore su un piatto caldo in alto impostazione fino spot contenenti zucchero possono essere visualizzate (in genere 5 min).
- Mark corsie sulla superficie della piastra TLC con una matita e applicare analita (s) e dello standard pertinenti (s) per le corsie appropriate, compreso lo standard analogo del glucosio, lo standard trealosio analogico (se presente), la miscela di reazione (o frazioni raccolte dalla dimensioni exclusion colonna di purificazione), e un co-spot. Dopo l'applicazione ciascun campione alla piastra TLC, permettono la piastra si asciughi.
- Eseguire l'analisi HPLC delle miscele di reazione Tret utilizzando qualsiasi sistema HPLC in grado di separare e rivelare carboidrati. Questo protocollo prevede la separazione di carboidrati usando una colonna HPLC amminopropil e rilevamento utilizzando indice di rifrazione.
- Attaccare amminopropil colonna (4,6 x 250 mm) contenente una guardia pre-colonna alla HPLC.
- Equilibrare amminopropil colonna con 80% acetonitrile in acqua deionizzata ad una velocità di flusso di 0,4mL / min.
- Caricare la soluzione del prodotto di reazione (o standard) sulla colonna amminopropil.
- Eluire il prodotto (o standard) con 80% acetonitrile in acqua deionizzata ad una velocità di flusso di 0,4 mL / min e una temperatura della colonna di 50 ° C. Tipicamente, il tempo di esecuzione utilizzata è 40 min.
NOTA: Sia il materiale di partenza analogo del glucosio e il prodotto analogo trealosio può essere rilevato da indice di rifrazione, anche se altri metodi come evaporativo rilevamento dispersione della luce (ELSD) potrebbero essere utilizzati. Utilizzando le condizioni descritte, gli analoghi di glucosio tipicamente eluiscano 10-15 min e trealosio analoghi eluiscano tra 15-25 min.
- Analisi NMR di analoghi trealosio purificati.
- Sciogliere purificata analogico trealosio in D 2 O (700 ml) e trasferire la soluzione di un tubo NMR.
- Acquisire 1 H e 13 C NMR secondo opportune protocolli impianto NMR.
5. L'applicazione di Tret-sintetizzato Trehalose analoghi, per il rilevamento di micobatteri
- Sintetizzare, purificare e amministrare 6-TreAz a M. smegmatis (Msmeg).
- Aggiungere 6-azido-6-deossi glucopiranosio (6-GlcAz, 0,020 mmol, 4,1 mg), UDP-glucosio (0,040 mmol, 24,4 mg), e MgCl 2 (0,020 mmol, 4,1 mg) ad un tubo da 15 ml.
- Aggiungere Tret in tampone Tris (ottenuto dalla fase 1.5.4) per ottenere una concentrazione enzimatico finale di 300 mg / ml e un volume finale di 1 ml. Pipettare la miscela su e giù delicatamente o invertire la provetta per sciogliere i solidi.
- Incubare la reazione a 70 ° C con agitazione per 15 min.
- Diluire la miscela di reazione enzimatica con 3 mL di acqua deionizzata e trasferirlo ad una unità filtro centrifugo pre-lavata (NMWL 10 kDa). Centrifugare l'unità filtro a 3.000 xg fino maggior parte del liquido passa attraverso il filtro nel tubo, di circa 10 min.
- Scartare °e camera superiore dell'unità filtro centrifugo. Aggiungere a letto misto di resina a scambio ionico (0,75 g) al tubo e mescolare / agitare a temperatura ambiente per 25 min. Decantare il surnatante e filtrare per rimuovere la resina.
NOTA: Procedura 5.1.1-5.1.5 forniscono una soluzione acquosa di 6-azido-trealosio (6-TreAz) a circa 5 mM concentrazione in meno di 1 ora. La concentrazione 5 mM stima basata sulla conversione quantitativa del substrato nel prodotto e della diluizione che si svolge durante le fasi di purificazione, assumendo minima perdita di prodotto durante queste fasi. La soluzione può essere filtrata sterile prima dell'addizione di un campione biologico, se desiderato. - Aggiungere il volume appropriato di soluzione di prodotto 6-TreAz ad una cultura di log-fase del M. smegmatis (Msmeg), in genere per ottenere un volume di coltura di 100-1.000 ml e una concentrazione finale 6-TreAz di ~ 25 micron. Incubare le cellule a 37 ° C per il tempo desiderato, tipicamente 60 min.
- Eseguire clicca chimica di coniugare un fluoroforo alle cellule azide marcato. In questo protocollo, utilizzare Cu-catalizzata cicloaddizione azide-alchino (CuAAC) per fornire un fluoroforo per azidi superficie cellulare in Msmeg.
- Centrifugare le cellule a 3.900 xg per 5 minuti, e poi lavare le cellule con PBS contenente 0,5% di albumina di siero bovino. Ripetere due volte.
- Risospendere le cellule in pellet in 4% para-formaldeide in PBS per risolverli. Dopo incubazione per 10 minuti, ripetere il passaggio 5.2.1 per lavare le cellule.
- Risospendere le cellule in pellet in 138 microlitri di PBS.
- Aggiungere 3 ml di ± 1 mm soluzione madre di alchini-carboxyrhodamine 110 (Acetilene-488) in DMSO.
- Aggiungere 3 ml di un 60 mm appena preparato di soluzione di ascorbato di sodio in acqua deionizzata.
- Aggiungere 3 ml di 6,4 mM di soluzione di Tris [(1-benzil-1H-1,2,3-triazol-4-il) metil] ammina (TBTA) in terz -butanol / dimetilsolfossido (DMSO) 4: 1.
- Aggiungere 3 & #956; L di 50 mM di soluzione di CuSO 4 in acqua deionizzata.
- Pipettare la cella di sospensione su e giù, poi incubare al buio a temperatura ambiente per 30 min.
- Ripetere il passaggio 5.2.1 per lavare le cellule. Risospendere le cellule in 150 microlitri di PBS.
- Eseguire l'analisi della fluorescenza cellulare. In questo protocollo, utilizzare la microscopia a fluorescenza di visualizzare la fluorescenza cellulare di etichetta Msmeg.
- Aggiungere 10 ml di cellule batteriche sospese in PBS ad un vetrino da microscopio e leggermente diffondere il liquido in uno strato sottile con il bordo di un vetrino. Lasciare asciugare all'aria nel buio.
- Aggiungere 10 ml di mezzo di montaggio sopra il campione essiccato, quindi posizionare la copertura scivola sul campione e applicare l'adesivo (ad esempio, smalto per unghie) per immobilizzare.
- Immagine le diapositive utilizzando un microscopio a fluorescenza a ingrandimento 100X.
Risultati
T. tenax Tret è stata ottenuta da E. coli in una resa di circa 4 mg / L utilizzando tecniche di espressione proteica e purificazione standard. Una singola fase di cromatografia di affinità nichel era sufficiente per purificare Tret da E. coli lisato (una traccia FPLC rappresentativo è mostrato in Figura 4). Come stabilito nella nostra pubblicazione iniziale sul processo di sintesi Tret, ricombinante T. tenax Tret è in grado di conv...
Discussione
Analoghi trealosio hanno il potenziale di impatto vari campi, dalla conservazione dei prodotti alimentari e farmaceutici per la diagnosi e il trattamento delle infezioni microbiche 6. Esistenti metodi di sintesi più fasi chimiche sono utili per la produzione di analoghi trealosio complessi con più siti di modifica (ad esempio, in natura complesse glicolipidi micobatteri). Tuttavia, questi metodi sono sempre lungo e inefficiente, anche se applicato alla sintesi di relativamente semplici...
Divulgazioni
The authors have nothing to disclose.
Riconoscimenti
This work was funded by a grant from the National Institutes of Health (R15 AI117670) to B.M.S and P.J.W, as well as a Cottrell College Scholar Award from the Research Corporation (20185) to P.J.W. L.M.M. was supported by a Provost's Fellowship from CMU.
Materiali
| Name | Company | Catalog Number | Comments |
| LB agar | Research Products International | L24021 | |
| Ampicillin sodium salt | Sigma Aldrich | A9518 | |
| Luria broth | Research Products International | L24045 | |
| Terrific Broth | Research Products International | T15050 | |
| L-(+)-Arabinose | Sigma Aldrich | A3256 | |
| Phosphate-buffered Saline | GE Healthcare | SH30256 | |
| Imidazole | Sigma Aldrich | I5513 | |
| Sodium chloride | BDH | BDH9286 | |
| Sodium phosphate, | Fisher Scientific | S374 | |
| monobasic | |||
| Syringe filter, 0.45 µm | Fisher Scientific | 09719D | |
| Protease Inhibitor mini-tablets, EDTA-free | Thermo Scientific | 88666 | |
| HisTrap HP nickel affinity column, 5 mL | GE Healthcare | 17-5248-02 | |
| TRIS base ultrapure | Research Products International | T60040 | |
| Dialysis tubing, MWCO 12–14,000 | Fisher Scientific | 21-152-16 | |
| Glucose analogues | CarboSynth, | Examples of vendors that offer numerous glucose analogues | |
| Sigma Aldrich, | |||
| Santa Cruz Biotechnology, American Radiolabeled Chemicals | |||
| 6-Azido-6-deoxy glucopyranose (6-GlcAz) | CarboSynth | MA02620 | |
| UDP-Glucose | abcam Biochemicals | ab120384 | |
| Magnesium chloride hexahydrate | Fisher Scientific | M33 | |
| Amicon Ultra-15 centrifugal filter unit | EMD Millipore | UFC901008 | |
| Bio-Rex RG 501-X8 mixed-bed ion-exchange resin | Bio-Rad | 444-9999 | |
| Extra-Fine Bio-Gel P2 media | Bio-Rad | 150-4118 | |
| Glass-backed silica gel thin-layer chromatography plates | EMD Millipore | 1056280001 | |
| n-Butanol | Fisher Scientific | A399 | |
| Ethanol | Fisher Scientific | S25310A | |
| Sulfuric acid | Fisher Scientific | A300 | |
| Acetonitrile | EMD Millipore | AX0145 | |
| Deuterium oxide, 99.8% | Acros Organics | 351430075 | |
| Aminopropyl HPLC column | Sigma Aldrich | 58338 | |
| Bovine serum albumin | Sigma Aldrich | 5470 | |
| Para-formaldehyde | Ted Pella | 18505 | |
| Alkyne-488 | Sigma Aldrich | 761621 | |
| Sodium ascorbate | Sigma Aldrich | A7631 | |
| Tris[(1-benzyl-1H-1,2,3-triazol-4-yl)methyl]amine (TBTA) | Click Chemistry Tools | 1061 | |
| tert-Butanol | Sigma Aldrich | 360538 | |
| Dimethylsulfoxide | Sigma Aldrich | W387520 | |
| Copper(II) sulfate | Sigma Aldrich | C1297 | |
| Fluoromount-G mounting medium | Southern Biotechnology | 10001 |
Riferimenti
- Elbein, A. D., Pan, Y. T., Pastuszak, I., Carroll, D. New insights on trehalose: a multifunctional molecule. Glycobiology. 13, 17-27 (2003).
- Tournu, H., Fiori, A., Van Dijck, P. Relevance of trehalose in pathogenicity: some general rules, yet many exceptions. PLoS Pathog. 9, 1003447 (2013).
- Ohtake, S., Wang, Y. J. Trehalose: Current use and future applications. J. Pharm. Sci. 100, 2020-2053 (2011).
- Adams, R. P., Kendall, E., Kartha, K. K. Comparison of free sugars in growing and desiccated plants of Selaginella lepidophylla. Biochem. Syst. Ecol. 18, 107-110 (1990).
- Kubota, M., Ohnishi, M. . Glycoenzymes. , (2000).
- Walmagh, M., Zhao, R., Desmet, T. Trehalose analogues: latest insights in properties and biocatalytic production. Int. J. Mol. Sci. 16, 13729-13745 (2015).
- Kim, H. -. M., Chang, Y. -. K., Ryu, S. -. I., Moon, S. -. G., Lee, S. -. B. Enzymatic synthesis of a galactose-containing trehalose analogue disaccharide by Pyrococcus horikoshii trehalose-synthesizing glycosyltransferase: Inhibitory effects on several disaccharidase activities. J. Mol. Catal. B: Enzym. 49, 98-103 (2007).
- Backus, K. M., et al. Uptake of unnatural trehalose analogs as a reporter for Mycobacterium tuberculosis. Nat. Chem. Biol. 7, 228-235 (2011).
- Swarts, B. M., et al. Probing the mycobacterial trehalome with bioorthogonal chemistry. J. Am. Chem. Soc. 134, 16123-16126 (2012).
- Rose, J. D., et al. Synthesis and biological evaluation of trehalose analogs as potential inhibitors of mycobacterial cell wall biosynthesis. Carbohydr. Res. 337, 105-120 (2002).
- Wang, J., et al. Synthesis of trehalose-based compounds and their inhibitory activities against Mycobacterium smegmatis. Bioorg. Med. Chem. 12, 6397-6413 (2004).
- Gobec, S., et al. Design, synthesis, biochemical evaluation and antimycobacterial action of phosphonate inhibitors of antigen 85C, a crucial enzyme involved in biosynthesis of the mycobacterial cell wall. Eur. J. Med. Chem. 42, 54-63 (2007).
- Sarpe, V. A., Kulkarni, S. S. Regioselective protection and functionalization of trehalose. Trends in Carbohydr. Res. 5, 8-33 (2013).
- Chaube, M. A., Kulkarni, S. S. Stereoselective construction of 1,1-alpha,alpha-glycosidic bonds. Trends in Carbohydr. Res. 4, 1-19 (2013).
- Leigh, C. D., Bertozzi, C. R. Synthetic studies toward Mycobacterium tuberculosis sulfolipid-I. J. Org. Chem. 73, 1008-1017 (2008).
- Chaen, H., et al. Efficient enzymatic synthesis of disaccharide, alpha-D-galactosyl-alpha-D-glucoside, by trehalose phosphorylase from Thermoanaerobacter brockii. J. Appl. Glycosci. 48, 135-137 (2001).
- Vander Borght, J., Soetaert, W., Desmet, T. Engineering the acceptor specificity of trehalose phosphorylase for the production of trehalose analogs. Biotechnol. Progr. 28, 1257-1262 (2012).
- Kouril, T., Zaparty, M., Marrero, J., Brinkmann, H., Siebers, B. A novel trehalose synthesizing pathway in the hyperthermophilic Crenarchaeon Thermoproteus tenax: the unidirectional TreT pathway. Arch. Microbiol. 190, 355-369 (2008).
- Urbanek, B. L., et al. Chemoenzymatic synthesis of trehalose analogues: rapid access to chemical probes for investigating mycobacteria. ChemBioChem. 15, 2066-2070 (2014).
- Rostovtsev, V. V., Green, L. G., Fokin, V. V., Sharpless, K. B. A stepwise Huisgen cycloaddition process: copper(I)-catalyzed regioselective "ligation" of azides and terminal alkynes. Angew. Chem. Int. Ed. 41, 2596-2599 (2002).
- Tornøe, C. W., Christensen, C., Meldal, M. Peptidotriazoles on solid phase: [1,2,3]-triazoles by regiospecific copper(I)-catalyzed 1,3-dipolar cycloadditions of terminal alkynes to azides. J. Org. Chem. 67, 3057-3064 (2002).
- Kalscheuer, R., Weinrick, B., Veeraraghavan, U., Besra, G. S., Jacobs, W. R. Trehalose-recycling ABC transporter LpqY-SugA-SugB-SugC is essential for virulence of Mycobacterium tuberculosis. Proc. Natl. Acad. Sci. U. S. A. 107, 21761-21766 (2010).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneThis article has been published
Video Coming Soon