Для просмотра этого контента требуется подписка на Jove Войдите в систему или начните бесплатную пробную версию.
Method Article
Подход к выборке с четырьмя сосудами для интегративных исследований физиологии плаценты человека
В этой статье
Резюме
Мы представляем подробный метод изучения физиологии плаценты человека in vivo в терминах. Метод объединяет отбор проб крови с входящих и исходящих сосудов на материнской и плодовой сторонах плаценты с помощью ультразвуковых измерений объемного кровотока и отбора проб плацентарной ткани.
Аннотация
Плацента человека крайне недоступна для исследований, но все еще в матке . В настоящее время понимание физиологии плаценты человека in vivo в значительной степени основано на исследованиях на животных, несмотря на большое разнообразие среди видов в плацентарной анатомии, гемодинамике и продолжительности беременности. Подавляющее большинство исследований плаценты человека - это исследования перфузии ex vivo или исследования трофобластов in vitro . Хотя исследования in vitro и модели животных являются существенными, экстраполяция результатов таких исследований на плаценту человека in vivo является неопределенной. Мы стремились изучать физиологию плаценты человека in vivo в терминах и представить подробный протокол метода. Эксплуатация внутрибрюшного доступа к маточной вене непосредственно перед разрезом матки во время запланированного кесарева сечения, мы собираем образцы крови из входящих и исходящих сосудов на материнской и эмбриональной сторонах плаценты. При объединении conЦентровые измерения из образцов крови с объемными измерениями кровотока, мы можем количественно оценить потребление плаценты и эмбриона и высвобождение любого соединения. Кроме того, образцы плацентарной ткани из тех же пар матерей-плод могут обеспечивать измерения плотности и активности транспортера и других аспектов функций плаценты in vivo . Благодаря этому интегральному использованию метода выборки с четырьмя сосудами мы можем протестировать некоторые из современных концепций переноса и метаболизма плацентарного питательного вещества in vivo как при нормальной, так и при патологической беременности. Кроме того, этот метод позволяет идентифицировать вещества, секретируемые плацентой, к материнскому кровообращению, что может быть важным вкладом в поиск биомаркеров дисфункции плаценты.
Введение
По данным Национального института здоровья США, плацента является наименее понятным органом в организме человека 1 , 2 , 3 . Трудно получить доступ и изучить плаценту человека in vivo без наложения неэтичных рисков на текущую беременность. Поэтому исследования плацентарной функции у человека в значительной степени основаны на моделях in vitro и ex vivo . Большинство предыдущих исследований in vivo плацентарного транспорта и метаболизма были выполнены у животных 4 , 5 , 6 . Однако, поскольку структура и функции плаценты значительно различаются между видами, экстраполяция результатов от животных к людям должна осуществляться с осторожностью. Только несколько небольших человеческих исследований in vivo исследовали поглощение плаценты и эмбриона и перенос при нормальных физиологическихА ни один из них не исследовал интегральную передачу нескольких соединений 7 , 8 , 9 , 10 , 11 , 12 , 13 . Эти фундаментальные исследования показывают, что in vivo исследования плаценты человека являются выполнимыми и что они могут служить нескольким целям. Во-первых, современные концепции плацентарных функций, в основном полученные из исследований in vitro , ex vivo и животных, могут быть протестированы в условиях человека и, таким образом, обеспечить новое и более конкретное понимание плаценты человека. Во-вторых, свойства дисфункциональной плаценты, связанные с аберрантным ростом плода, преэклампсией, диабетом матери, метаболическим синдромом и другими нарушениями метаболизма у матери, могут быть лучше охарактеризованы. В-третьих, исследования человека in vivo дают возможность разрабатывать диагнозыТические и прогностические инструменты плацентарной функции.
На этом фоне мы стремились создать всеобъемлющий сбор физиологических данных для исследования плацентарной функции человека in vivo. Во время запланированного кесарева сечения мы используем внутриабдоминальный доступ к маточной вене, чтобы собирать образцы крови из входящих и исходящих сосудов на материнской и эмбриональной сторонах плаценты (метод отбора проб на 4 сосуда). Эти образцы используются для расчета парных артериовенозных различий концентрации питательных веществ и других веществ 14 . Кроме того, мы измеряем объемный кровоток по обе стороны плаценты ультразвуком. Следовательно, плацентарное и эмбриональное поглощение любого соединения может быть количественно определено. Кроме того, можно определить вещества, высвобождаемые плацентой, в циркуляции матери и эмбриона 15 , 16 , 17 . При объединенииD с клиническими параметрами матери и ребенка и анализом плацентарных и других соответствующих тканей, этот метод обладает захватывающим потенциалом для интеграции многих аспектов плацентарных функций in vivo в те же пары матерей-плод.
протокол
Исследование было одобрено должностными лицами по защите данных в университетской больнице Осло и Региональным комитетом по этике исследований в области медицины и здравоохранения, Южная Норвегия, 2419/2011. Все участники подписали письменное информированное согласие при включении.
1. Препараты
ПРИМЕЧАНИЕ. Временная шкала процедур описана на рисунке 1 .
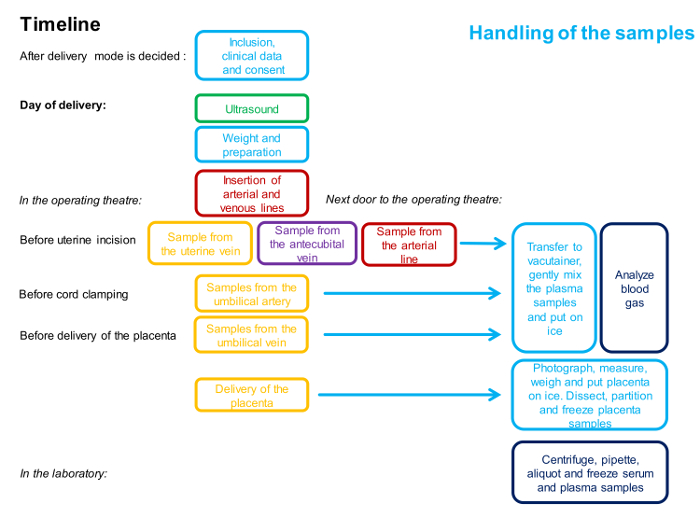
Рисунок 1 : Блок-схема, описывающая синхронизацию и персонал, задействованный в процедуре отбора проб на 4 сосуда.
Один цвет - один человек. Подробное описание метода приведено в протоколе. Нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
- Сотрудники
- Удостоверьтесь, что имеется весь необходимый персонал: высококвалифицированный специалист по плодной медицине, проводящий ультразвуковые измерения, два акушера, проводящих операцию, один из акушеров и две медсестры, собирающие образцы, один помощник, занимающийся анализом крови и один помощник, Другие образцы последовательно и сразу после сбора.
ПРИМЕЧАНИЕ. В случае более продвинутого сбора плацентарной ткани требуется дополнительный человек.
- Удостоверьтесь, что имеется весь необходимый персонал: высококвалифицированный специалист по плодной медицине, проводящий ультразвуковые измерения, два акушера, проводящих операцию, один из акушеров и две медсестры, собирающие образцы, один помощник, занимающийся анализом крови и один помощник, Другие образцы последовательно и сразу после сбора.
- Оборудование
- Подготовьте оборудование, 50 мл ледяного 1 М фосфатно-буферного солевого раствора (PBS), 25 мл раствора для стабилизации холодной РНК и 5 х 0,5 мл оптимального состава для резки (OCT). Обозначьте вакуутеры и трубки. См. Предварительный список оборудования.
2. Материнские характеристики
- Запишите материнские клинические и неклинические характеристики при включении и повторите соответствующие вопросы и меняАксессуаров, включая вес, на момент доставки. Запишите продолжительность периода поста до кесарева сечения и любые гипотензивные эпизоды, возникающие во время операции.
Примечание. Включите минимальный набор данных о материнской клинической практике, о котором сообщалось в недавней публикации от Global Patricancy CoLaboratory (COLAB). Эта статья также включает некоторые очень важные аспекты в выборе исследуемых групп населения и должна решаться при планировании исследования 18 . - Рассмотрите возможность учета характеристик отцовства, включая этническую принадлежность, возраст и индекс массы тела (ИМТ).
3. Ультразвуковое исследование
- Выполните допплеровское ультразвуковое исследование в день доставки, с женщинами в состоянии голодания. Выполните обследование в течение периода покоя плода, с женщиной в положении полу лежа, слегка наклоненной в поперечном направлении напротив интересующей области, чтобы избежать сжатия аорты и полой вены. Контролируйте выход вПо механическим и тепловым показателям на дисплее.
- Пупочная вена
- Визуализируйте пупочную вену в сагиттальной или косой перегородке брюшной полости плода. Измерьте внутренний диаметр сосуда в прямой части внутрибрюшной пупочной вены перед любыми видимыми ветвями. Используйте обычный B-режим и визуализируйте сосуд в перпендикулярном углу инсоляции для измерения диаметра и сохраните несколько оптимальных кадров для последующих измерений, чтобы минимизировать влияние изменения пульсирующего диаметра.
- Повторите измерения пять-десять раз 19 .
- На том же участке используйте допплеровское ультразвуковое исследование и отрегулируйте зонд, чтобы получить как можно меньший угол инсонизации (всегда <30 °), чтобы измерить среднюю максимальную скорость (TAMX). Получите скорость в течение 3 - 5 с (непульсирующий поток).
- Визуализируйте пупочную вену в сагиттальной или косой перегородке брюшной полости плода. Измерьте внутренний диаметр сосуда в прямой части внутрибрюшной пупочной вены перед любыми видимыми ветвями. Используйте обычный B-режим и визуализируйте сосуд в перпендикулярном углу инсоляции для измерения диаметра и сохраните несколько оптимальных кадров для последующих измерений, чтобы минимизировать влияние изменения пульсирующего диаметра.
- Маточная артерия
- Использовать допплерУльтразвук для визуализации маточной артерии, когда он пересекает внешнюю подвздошную артерию, сразу после того, как он отходит от внутренней подвздошной артерии. Отрегулируйте зонд на этом сайте, чтобы получить низкий угол инсоляции (всегда <30 °) и измерить TAMX. Получите скорость как среднюю скорость трех сердечных циклов.
- Поскольку маловероятно получить перпендикулярный угол в том же месте, где измеряется TAMX, следуйте за судном дистально, чтобы получить правильный угол для измерения диаметра, как можно ближе к местам измерений диаметра. Исключить измерения диаметра, если какие-либо видимые сосуды отходят перед этим участком, как оценивается с помощью цветного допплеровского ультразвука.
- Используйте обычный B-режим и визуализируйте сосуд в перпендикулярном углу инсоляции для измерения диаметра и сохраните несколько оптимальных кадров для последующих измерений, чтобы минимизировать влияние изменения пульсирующего диаметра.
- Повторите измерения пять-десять раз 19 .
- Обратите внимание на положение плаценты.
4. Отбор крови на 4 сосуда
ПРИМЕЧАНИЕ. Временная шкала процедур описана на рисунке 1, а обзор образцов показан на рисунке 2 .
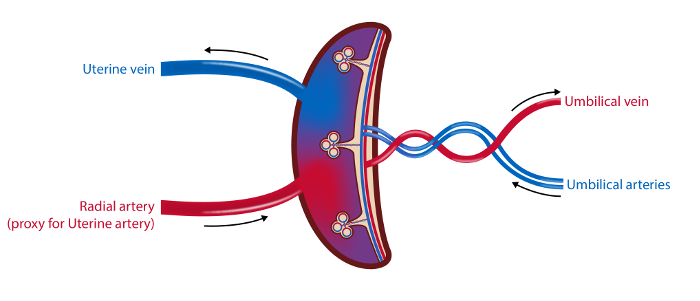
Рисунок 2 : Схематическая иллюстрация сосудистой сети плаценты и мест отбора проб.
В методе отбора проб из четырех сосудов образцы крови выводятся из маточной вены, радиальной артерии (как прокси для маточной артерии) и пупочных артерий и вены. Поток крови в маточной артерии и пупочной вены измеряется ультразвуком. Собирают образцы тканей из плаценты. Иллюстрация: Øystein H. Horgmo, Университет Осло.5847fig2large.jpg "target =" _ blank "> Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
- Безопасные процедуры
- Обеспечьте весь персонал в операционном зале перчатками, хирургическими скрабами, масками и головными уборами.
- Обеспечьте, чтобы хирурги и исследовательский персонал контактировали с операционным полем с костюмами для хирургического скраба, масками, головными уборами, халатами и двойными перчатками. Очки необязательны.
- Обеспечить персонал, перевозящий образцы крови перчатками.
- Обеспечить персонал, обрабатывающий образцы плаценты перчатками и хирургической маской. Гомогенизация требует использования вытяжек.
- Подготовка в операционном зале
- Дайте брифинг и передайте оборудование всему персоналу, который поможет отбор проб до начала операции.
- Обратитесь к анестезиологу и анестезиологической медсестре, которая поможет с необходимым периферическим артериальным и венозным доступом и обеспечит, чтобыБез отбора проб жидкости не вводят внутривенно.
- Дайте три шприца (10 мл) без игл человеку, помогающему с образцом антекубитальной вены и двумя шприцами (один 20 мл и один 10 мл) и одним шприцем для крови (с гепарином) человеку, который помогает в радиальной артерии.
- Подготовьте два стерильных шприца (20 мл), пять стерильных шприцев (10 мл), три «иголки бабочки» и два шприца для крови для операционного поля.
- Доступ к кровеносным сосудам.
- Следуйте стандартной процедуре перед кесаревым сечением, чтобы обеспечить периферийный внутривенный (iv) доступ.
ПРИМЕЧАНИЕ. Анцебабиальная вена предпочтительнее, потому что легче извлечь образцы с этого сайта. - Локализовать радиальную артерию на запястье ультразвуком или пальпацией. После 0,5 мл подкожной лидокаиновой аналгезии поместите артериальную линию в лучевую артерию. Отменить выборку с этого сайта в случае трех неудачных вставок илиЕсли женщина испытывает боль во время вставки.
ПРИМЕЧАНИЕ. Выполните хирургическую процедуру кесарева сечения в соответствии со стандартной процедурой. Ниже приводятся только корректировки, необходимые для процедуры отбора проб.
- Следуйте стандартной процедуре перед кесаревым сечением, чтобы обеспечить периферийный внутривенный (iv) доступ.
- Образцы материнской крови
ПРИМЕЧАНИЕ. Получите все три образца материнской крови (маточная вена, лучевая артерия и антикубитальная вена) одновременно до разреза матки.- Для маточной вены после открытия брюшной полости используйте втягивающее устройство для подъема брюшной стенки и выставляйте основные ветви маточных вен на передне-боковых сторонах матки. Получите кровь из ветвей маточной вены на той же стороне, что и плацента, по возможности, или используйте наиболее заметное венозное сплетение, если плацента расположена в средней линии матки.
- Вставьте иглу бабочки на шприц для крови в маточной вене под углом около 30 градусов и собирайте кровь через нежную аспирацию, чтобы избежатьгемолиз. При тщательном закреплении iv положения иглы бабочки замените заполненный шприц для крови газом через 20 мл и 10 мл шприца последовательно.
ПРИМЕЧАНИЕ. Оптимальный доступ лучше всего обеспечивается при стоянии на контралатеральной стороне выбранной маточной вены.
- Вставьте иглу бабочки на шприц для крови в маточной вене под углом около 30 градусов и собирайте кровь через нежную аспирацию, чтобы избежатьгемолиз. При тщательном закреплении iv положения иглы бабочки замените заполненный шприц для крови газом через 20 мл и 10 мл шприца последовательно.
- Для лучевой артерии аспирируют из внутриартериальной линии. Отбросьте первые 5 мл и затем аспирируйте 3 мл в гепариновый шприц для анализа крови, затем 3 мл в два шприца (20 + 10 мл).
- Для антекубитальной вены осторожно аспирируйте из внутривенного катетера. Отбросьте первые 5 мл, а затем аспирируйте 30 мл тремя шприцами (10 мл).
- Проведите окончательную проверку места отбора проб на маточной вене перед тем, как начать закрывать живот.
- Для маточной вены после открытия брюшной полости используйте втягивающее устройство для подъема брюшной стенки и выставляйте основные ветви маточных вен на передне-боковых сторонах матки. Получите кровь из ветвей маточной вены на той же стороне, что и плацента, по возможности, или используйте наиболее заметное венозное сплетение, если плацента расположена в средней линии матки.
- Фетальные образцы крови
- Когда ребенок рождается, немедленно аспирируйте кровь из пупочной артерии, не зажимая пуповину или не доставляя плаценту. НачалоH шприц для анализа газов крови, и, если возможно, следуйте с тремя 10 мл шприцами.
- Когда артериальные пробы закреплены, закрепите шнур и передайте ребенка акушерке перед взятием проб из пупочной вены (кровь и 20 + 10 мл шприцев).
ПРИМЕЧАНИЕ. Получите все пупочные образцы в течение нескольких секунд после доставки и с плацентой на месте, если она не отсоединилась спонтанно. - Следуйте норвежским рекомендациям по затягиванию шнура. В случае несчастного ребенка зажмите и вырежьте шнур немедленно, а руку - ребенку акушерке и неонатологу.
- Обращение с образцами крови
- Поместите газовые шприцы крови на лед при подготовке остальной части образцов крови и проанализируйте их в анализе газового газа в течение 5 мин.
- Немедленно перенесите образцы крови в вакуумеры и поместите плазменные трубки на качалку в течение 1 - 2 мин, прежде чем положить их на лед. Оставьте сывороточные трубки на рабочем местеЧтобы выдерживать 30 минут.
ПРИМЕЧАНИЕ. Это важный шаг в процедуре, требующей дополнительного внимания, поскольку образцы из всех пяти сайтов должны быть подготовлены одновременно для обеспечения хорошего качества. - Центрифугируйте образцы плазмы как можно скорее и в течение 30 минут при 6 ° C, 2500 xg в течение 20 минут.
- Через 30 мин центрифугируют образцы сыворотки при комнатной температуре в течение 10 мин при 2500 x g.
- Аликвоту супернатантов тщательно до 2 мл крио-пробирки, оставляя 0,5 мл супернатанта над гранулой, чтобы обеспечить отсутствие тромбоцитов плазмы.
- Храните образцы при -80 ° C.
5. Сбор плацентарной ткани
- Поместите плаценту на ледяной поддон для резки как можно скорее после того, как она была доставлена. Фотографируйте и измерьте самый длинный диаметр и диаметр на 90 градусов.
- Взвесьте плаценту.
- Запишите вес, два диаметра, любой gРодовая патология, количество сосудов в корме и временной интервал от доставки до того момента, когда плацента была помещена на лед.
ПРИМЕЧАНИЕ. Отправляйте плаценту к патологическому осмотру, если клинически указано. - Поместите плаценту с материнской поверхностью вверх и определите 4 - 5 мест отбора проб, случайно расположенных в каждом квадранте плаценты, избегая областей откровенной патологии. Удалите децидую, используя ножницы, чтобы отрезать 3 - 5 мм от материнской поверхности. Соберите 1 - 2 см 3 ворсистой ткани с каждого участка.
- Промойте собранную ткань мягко в 50 мл холодной 1 М PBS. Разделите на несколько частей с каждого места отбора проб и аликвоты.
Примечание. Размер кусочков плаценты будет зависеть от запланированных анализов. - Добавьте аликвоты образцов ткани размером 0,1 - 0,5 см 3 в 5 криовых пробирок и замораживание замораживания в жидком азоте.
- Добавьте небольшие кусочки 0,1-0,2 см 3 в пробирку с 25 мл раствора для стабилизации РНК. Магазин в 46; С в течение 24 ч отбрасывают раствор стабилизации РНК и заменяют его. Замораживание.
- Добавьте кусочки 0,5 см 3 к 5 криограммам с 0,5 мл ОКТ, долейте ОКТ, смешайте и замораживайте.
- Храните образцы при -80 ° C до анализа.
ПРИМЕЧАНИЕ: Burton et al. Обеспечивает отличный обзор практических аспектов отборки плаценты в зависимости от запланированных анализов. 20 Приготовьте оставшуюся ткань для выделения микроворсиальных и базальных мембран и для сбора децидуальной ткани методом вакуумного всасывания. 21 , 22
6. Неонатальные характеристики
- Запишите характеристики новорожденных, в том числе апгар-баллы (1, 5 и 10 мин), пол, вес, длину, возраст гестации и прием в отделение интенсивной терапии новорожденных (длина и исход пребывания).
- Рассмотрите измерение состава тела новорожденных антропометрическими измерениями, смещение воздухаПлетизмографа или двойной рентгеновской абсорбциометрии. 23 , 24
7. Расчеты
- Предположите аналогичный состав крови в радиальной и маточной артериях и вычислите разницу концентраций маточно-плацентарного артериовенозного.
Разность концентраций маточно-плацентарной артериовеноз = C A - C V
Пупочная венозно-артериальная концентрация концентрации = C v - C a
Где C - концентрация с индексами: A, радиальная артерия; V, маточная вена; V пупочная вена и a, пупочная артерия. - Рассчитайте объемный кровоток, мл / мин (Q):
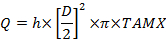
Где D - диаметр сосуда (см), TAMX - это усредненная по времени максимальная скорость, а h - коэффициент для профиля пространственной скорости крови. Используйте 0,5 в качестве коэффициента для пупочной вены и0,6 для маточной артерии 25 , 26 . - Рассчитайте поглощение и освобождение плаценты в соответствии с принципом Фика:
Утероплацентарное поглощение = ( C A - C V ) x Qm
Поглощение плода = ( C v - C a ) X Q f
Подстрочные индексы: m, материнская и f, эмбриональные.
Результаты
Метод отбора проб с 4 сосудами применим в клинической практике, и мы успешно получили образцы крови от 209 пар матери / младенца. В 128 из них мы также достигли измерения объемного кровотока. Полная выборка из четырех сосудов и качественные измерения потока как материнско?...
Обсуждение
Метод отбора проб 4-сосуда с плацентой имеет значение для трех основных целей. Во-первых, его можно использовать для изучения того, как специфические вещества поглощаются плацентой на материнской стороне и, возможно, переносятся в пупочный кровоток и плод, о чем свидетельствуют наши...
Раскрытие информации
Авторам нечего раскрывать.
Благодарности
Прежде всего, мы искренне благодарим матерей, которые участвовали в этом проекте. Затем мы признаем весь персонал, который помог и облегчил процедуру отбора проб, анестезиолог, анестезиолог-медсестра и хирургические медсестры. Проект не был бы возможен без финансирования из Регионального управления здравоохранения Юго-Восточной Норвегии и Норвежской консультативной группы по вопросам здоровья женщин, Университета Осло и местного финансирования, предоставляемого Университетской больницей Осло.
Материалы
| Name | Company | Catalog Number | Comments |
| Maternal body composition | |||
| Impedance scale | Tanita | or similar | |
| Ultrasound measurements | |||
| Sequoia 512 ultrasound machine | Acuson | equipped with a curved transducer with colour and pulsewave Doppler (frequency bandwidth 2-6 MHz) | |
| Blood samples | |||
| Arerial cannula | BD Medical | 682245 | or similar |
| 20cc Eccentric Luer Tip Syringe without Needle | Termo | SS-20ES | or similar. 3 needed. |
| 10cc Eccentric Luer Tip Syringe without Needle | Termo | SS-10ES | or similar. 9 needed. |
| 5cc 6% Luer Syringe without Needle | Termo | SS-05S1 | or similar. 2 needed. |
| Arterial blood gas syringe | Radiometer Medical | or similar. 4 needed. | |
| Sterile winged needle connected to flexible tubing, 21 gauge | Greiner Bio-One | 450081 | (intended for single use).3 needed. |
| Vacutainer tube 6 mL EDTA | Greiner Bio-One | 456043 | or similar. Label with sample site. 10 needed. |
| Vacutainer tube 5 ml LH Lithium Heparin Separator | Greiner Bio-One | 456305 | or similar. Label with sample site. 5 needed. |
| Vacutainer tube 6 mL Serum Clot Activator | Greiner Bio-One | 456089 | or similar. Label with sample site. 5 needed. |
| Vacutainer tube 3 ml 9NC Coagulation sodium citrate 3,2% | Greiner Bio-One | 454334 | or similar. Label with sample site. 5 needed. |
| Cryogenic vials, 2.0 mL | Corning | 430488 | or similar. Label with sample site, serum/type of plasma and ID. 90 needed. |
| Marked trays to transport the syringes | to transport the blood samples in the operation theatre | ||
| Rocker | for gentle mixing of the samples | ||
| Ice | in styrofoam box | ||
| Liquid nitrogen | in appropriate container | ||
| Placenta samples | |||
| Metal tray | |||
| Ice | in styrofoam box | ||
| Calibrated scale | |||
| Metal ruler | |||
| 1 M Phosphate buffered saline | Sigma | D1408 | or similar. Dilute 10 M to 1M before use |
| RNA stabilization solution | Sigma | R0901-500ML | or similar |
| Optimal Cutting Temperature (O.C.T.) compound | vwr | 361603E | or similar |
| Cryogenic vials, 2.0 mL | Corning | 430488 | or similar. Label with sample site. content and ID. 10 needed. |
| Centrifuge tubes, conical bottom 50 mL | Greiner Bio-One | 227,285 | or similar. Label with "RNA later", sample site and ID. 2 needed. |
| Liquid nitrogen | in appropriate container | ||
| Fetal body composition | |||
| Calibrated scale | |||
| Measuring tape |
Ссылки
- Jansson, T., Powell, T. L. Role of the placenta in fetal programming: underlying mechanisms and potential interventional approaches. Clin Sci (Lond). 113 (1), 1-13 (2007).
- Hanson, M. A., Gluckman, P. D. Early developmental conditioning of later health and disease: physiology or pathophysiology. Physiol Rev. 94 (4), 1027-1076 (2014).
- Guttmacher, A. E., Spong, C. Y. The human placenta project: it's time for real time. Am J Obstet Gynecol. 213, 3-5 (2015).
- Battaglia, F. C., Regnault, T. R. Placental transport and metabolism of amino acids. Placenta. 22 (2-3), 145-161 (2001).
- Hay, W. W. Placental-fetal glucose exchange and fetal glucose metabolism. Trans Am Clin Climatol Assoc. 117, 321-339 (2006).
- Woollett, L. A. Review: Transport of maternal cholesterol to the fetal circulation. Placenta. 32, 218-221 (2011).
- Prenton, M. A., Young, M. Umbilical vein-artery and uterine arterio-venous plasma amino acid differences (in the human subject). J Obstet Gynaecol Br Commonw. 76 (5), 404-411 (1969).
- Cetin, I., et al. Plasma and erythrocyte amino acids in mother and fetus. Biol Neonate. 60 (2), 83-91 (1991).
- Filshie, G. M., Anstey, M. D. The distribution of arachidonic acid in plasma and tissues of patients near term undergoing elective or emergency Caesarean section. Br J Obstet Gynaecol. 85 (2), 119-123 (1978).
- Haberey, P. P., Schaefer, A., Nisand, I., Dellenbach, P. The fate and importance of fetal lactate in the human placenta -a new hypothesis. J Perinat Med. 10 (2), 127-129 (1982).
- Prendergast, C. H., et al. Glucose production by the human placenta in vivo. Placenta. 20 (7), 591-598 (1999).
- Metzger, B. E., Rodeck, C., Freinkel, N., Price, J., Young, M. Transplacental arteriovenous gradients for glucose, insulin, glucagon and placental lactogen during normoglycaemia in human pregnancy at term. Placenta. 6 (4), 347-354 (1985).
- Zamudio, S., et al. Hypoglycemia and the origin of hypoxia-induced reduction in human fetal growth. PLoS One. 5 (1), 8551 (2010).
- Holme, A. M., Roland, M. C., Lorentzen, B., Michelsen, T. M., Henriksen, T. Placental glucose transfer: a human in vivo study. PLoS One. 10 (2), 0117084 (2015).
- Holme, A. M., Roland, M. C., Henriksen, T., Michelsen, T. M. In vivo uteroplacental release of placental growth factor and soluble Fms-like tyrosine kinase-1 in normal and preeclamptic pregnancies. Am J Obstet Gynecol. 215 (6), 781-782 (2016).
- Paasche Roland, M. C., Lorentzen, B., Godang, K., Henriksen, T. Uteroplacental arterio-venous difference in soluble VEGFR-1 (sFlt-1), but not in soluble endoglin concentrations in preeclampsia. Placenta. 33 (3), 224-226 (2012).
- Brar, H. S., et al. Uteroplacental unit as a source of elevated circulating prorenin levels in normal pregnancy. Am J Obstet Gynecol. 155 (6), 1223-1226 (1986).
- Myatt, L., et al. Strategy for standardization of preeclampsia research study design. Hypertension. 63 (6), 1293-1301 (2014).
- Kiserud, T., Rasmussen, S. How repeat measurements affect the mean diameter of the umbilical vein and the ductus venosus. Ultrasound Obstet Gynecol. 11 (6), 419-425 (1998).
- Burton, G. J., et al. Optimising sample collection for placental research. Placenta. 35 (1), 9-22 (2014).
- Illsley, N. P., Wang, Z. Q., Gray, A., Sellers, M. C., Jacobs, M. M. Simultaneous preparation of paired, syncytial, microvillous and basal membranes from human placenta. Biochim Biophys Acta. 1029 (2), 218-226 (1990).
- Staff, A. C., Ranheim, T., Khoury, J., Henriksen, T. Increased contents of phospholipids, cholesterol, and lipid peroxides in decidua basalis in women with preeclampsia. Am J Obstet Gynecol. 180 (3), 587-592 (1999).
- Catalano, P. M., Thomas, A. J., Avallone, D. A., Amini, S. B. Anthropometric estimation of neonatal body composition. Am J Obstet Gynecol. 173 (4), 1176-1181 (1995).
- Ellis, K. J., et al. Body-composition assessment in infancy: air-displacement plethysmography compared with a reference 4-compartment model. Am J Clin Nutr. 85 (1), 90-95 (2007).
- Haugen, G., Kiserud, T., Godfrey, K., Crozier, S., Hanson, M. Portal and umbilical venous blood supply to the liver in the human fetus near term. Ultrasound Obstet Gynecol. 24 (6), 599-605 (2004).
- Acharya, G., et al. Experimental validation of uterine artery volume blood flow measurement by Doppler ultrasonography in pregnant sheep. Ultrasound Obstet Gynecol. 29 (4), 401-406 (2007).
- Wu, X., et al. Glutamate-glutamine cycle and exchange in the placenta-fetus unit during late pregnancy. Amino Acids. 47 (1), 45-53 (2015).
- Tuckey, R. C. Progesterone synthesis by the human placenta. Placenta. 26 (4), 273-281 (2005).
- Simmons, M. A., Meschia, G., Makowski, E. L., Battaglia, F. C. Fetal metabolic response to maternal starvation. Pediatr Res. 8 (10), 830-836 (1974).
- Simmons, M. A., Jones, M. D., Battaglia, F. C., Meschia, G. Insulin effect on fetal glucose utilization. Pediatr Res. 12 (2), 90-92 (1978).
- Bujold, E., et al. Evidence supporting that the excess of the sVEGFR-1 concentration in maternal plasma in preeclampsia has a uterine origin. J Matern Fetal Neonatal Med. 18 (1), 9-16 (2005).
- Jansson, T., Aye, I. L., Goberdhan, D. C. The emerging role of mTORC1 signaling in placental nutrient-sensing. Placenta. 33, 23-29 (2012).
- Cetin, I. Placental transport of amino acids in normal and growth-restricted pregnancies. Eur J Obstet Gynecol Reprod Biol. 110, 50-54 (2003).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеThis article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены