È necessario avere un abbonamento a JoVE per visualizzare questo. Accedi o inizia la tua prova gratuita.
Method Article
Quantificare la dinamica infrarosso del potere spettrale e della frequenza cardiaca nei topi addormentati
In questo articolo
Riepilogo
Qui presentiamo procedure sperimentali e analitiche per descrivere le dinamiche temporali delle variabili neurali e cardiache del sonno non REM nei topi, che modulano la risposta al sonno agli stimoli acustici.
Abstract
Tre stati di vigilanza dominano la vita dei mammiferi: la veglia, il sonno non rapido (non REM) e il sonno REM. Poiché sono stati identificati più correlati neurali del comportamento negli animali in libertà di movimento, questa suddivisione a tre livelli diventa troppo simile. Durante la veglia, gli esempi delle attività corticali globali e locali, insieme ai parametri periferici come il diametro pupillare e l'equilibrio simpatico, definiscono diversi gradi di eccitazione. Rimane ancora chiaro la misura in cui il sonno forma anche un continuum di stati cerebrali, all'interno del quale il grado di resilienza agli stimoli sensoriali e l'arousabilità, e forse altre funzioni del sonno, variano gradualmente, e come gli stati fisiologici periferici co-variano. La ricerca che avanza i metodi per monitorare più parametri durante il sonno, nonché attribuire alle costellazioni di questi attributi funzionali, è fondamentale per raffinare la nostra comprensione del sonno come un processo multifunzionale durante il quale molti effetti benefici devono essere exeseguita sempre. L'individuazione di nuovi parametri che caratterizzano gli stati di sonno aprirà opportunità per nuovi percorsi diagnostici nei disturbi del sonno.
Presentiamo una procedura per descrivere le variazioni dinamiche degli stati di sonno non-REM del mouse attraverso il monitoraggio e l'analisi combinati di elettroencefalogrammi (EEG) / electrocorticogram (ECoG), elettromiogramma (EMG) e segnali elettrocardiogrammi (ECG) usando tecniche standard di registrazione polisomnografiche. Utilizzando questo approccio, abbiamo scoperto che il mouse non-REM sonno è organizzato in cicli di oscillazioni neurali e cardiache coordinate che generano intervalli di 25 secondi di alta e bassa fragilità agli stimoli esterni. Pertanto, i sistemi nervosi centrali e autonomi sono coordinati per formare stati di sonno comportamentali distinti durante il sonno non consolidato REM. Presentiamo manipolazioni chirurgiche per il monitoraggio polisomnografico ( cioè EEG / EMG combinato con ECG) per monitorare questi cicli nel mouse liberamente addormentato, l'analisi a quantiFy la loro dinamica e i protocolli di stimolazione acustica per valutare il loro ruolo nella probabilità di svegliarsi. Il nostro approccio è stato già esteso al sonno umano e promette di svelare i principi comuni di organizzazione di stati di sonno non-REM nei mammiferi.
Introduzione
Il sonno dei mammiferi è uno stato comportamentale di riposo e di resistenza agli stimoli ambientali. Nonostante questa apparente uniformità, i parametri polisomnografici e autonomi indicano che il sonno si muove tra stati nervosi e somatici qualitativamente e quantitativamente diversi su varie scale temporali e spaziali 1 . Durante i minuti a decine di minuti, si verifica il passaggio tra il sonno non REM e REM. Il sonno non REM è accompagnato da un'ampia ampiezza e bassa frequenza nell'EEG, con un picco spettrale intorno a ~ 0,5-4 Hz, mentre il sonno REM mostra un'attività regolare di EEG nella banda theta (6-10 Hz), insieme a Muscolo atonia 2 . All'interno del sonno non REM, gli esseri umani attraversano la luce (S2) e il sonno profondo dell'onda lenta (SWS). Come indica la loro denominazione, queste due fasi mostrano rispettivamente soglie di aroazione inferiori e superiori 3 , 4 e differiscono in primo luogo dalla densità di bassa frequenzaEnte corticale EEG, indicata come attività a onde lente (SWA, 0,75-4 Hz). La non uniformità persiste durante i singoli attacchi di S2 e SWS dal minuto al sotto secondario, come documentato ampiamente dalla presenza variabile di SWA nel corso di un incontro 5 , 6 , ma anche da EEG e dai ritmi potenziali in campo Frequenze superiori, comprese le onde del mandrino nella banda sigma (10-15 Hz) e ritmi gamma (80-120 Hz) (per una recensione, vedi 7 , 8 , 9 , 10 ).
Piuttosto che essere sottili, queste variazioni spostano lo stato corticale del sonno negli esseri umani agli estremi dello spettro. Per il sonno non REM, questi variano da una predominanza di SWA a stati che approssimano l'attività sveglia perché contengono una parte sostanziale di componenti ad alta frequenza 11 , 12 . Nei roditori e nei gatti, anche se il sonno non-REM non è suddiviso in fasi, emerge un breve periodo chiamato sonno intermedio (IS) prima dell'insorgenza del sonno REM 13 . Durante IS, le funzioni di sonno REM, come l'attività ippocampale theta e le onde ponto-geniculo-occipitali, iniziano, mentre le firme del sonno non-REM, come le onde mandrino e SWA, sono ancora presenti, indicando un mix tra i due stati di sonno 14 , 15 . Tuttavia, l'IS potrebbe essere funzionalmente distinto poiché è modulata dagli antidepressivi 16 e attraverso una nuova presentazione di oggetti durante la veglia precedente 17 e contribuisce a impostare la soglia di eccitazione 18 . Inoltre, i diagrammi dello spazio statale dei parametri EEG e EMG di ratti liberamente in movimento mostrano un gruppo di punti 14 che è continuo tra il sonno non REM, il sonno REM e la veglia. Ci sono anche discontinuità sporadiche in SWA, senza entrare nella sveglia o nel sonno REM, che porta a notevoli fluttuazioni nella presenza relativa dei componenti a bassa e alta frequenza durante un incontro non letto REM non consolidato 14 , 19 e 20 . Infine, i rapporti variabili di SWA e ritmi di frequenza più alti durante il sonno non REM si verificano non solo nel tempo, ma mostrano anche differenze regionali in ampiezza e sincronizzazione tra aree corticali 19 .
Il sonno non-REM del mammifero è ben lungi dall'essere uniforme. Tuttavia, se tale non uniformità porta a stati che differiscono per funzioni e attributi comportamentali, non è chiaro. In diversi tipi di disturbi del sonno, il sonno continuo viene interrotto da risvegli spontanei e comportamenti motori inappropriati. Inoltre, le analisi spettrali mostrano alterazioni nella presenza relativa di frequenze più alte nell'EEG 21E in parametri autonomi, come i tassi di respirazione e battito cardiaco 22 . La sequenza ordinata di stati di sonno stabili è perciò turbata e gli elementi di eccitazione corticale e / o autonomica intrudono in maniera incontrollata. Pertanto, la comprensione del continuum degli stati di sonno è di una possibile rilevanza per la malattia. Inoltre, la perturbazione del sonno da rumore ambientale negli ambienti urbani è associata a rischi sanitari generali, rendendo cruciale identificare momenti di maggiore vulnerabilità durante il sonno 23 .
Gli esperimenti di arousal comportamentali nel sonno degli esseri umani indicano che è più difficile svegliarsi dal sonno non-REM dominato da SWA (fase S3), mentre il sonno non-REM leggero (fase S2) e il sonno REM mostrano soglie comparabili e inferiori di stimolazione 4 . L'elaborazione corticale di stimoli sonori corti varia sensibilmente tra il sonno REM, S2 e S3 24 ,25 , indicando che i modelli di attività corticali specifici dello stato modulano le prime fasi dell'elaborazione sensoriale. Per il sonno non REM nell'uomo, la propensione a svegliarsi in risposta al rumore varia con la presenza di onde mandrino e ritmi alfa nell'EEG 26 , 27 , 28 . La ritmicità talamocorticale durante i mandrini è accompagnata da una maggiore inibizione sinaptica sia ai livelli talamici che a quelli corticali, che si suppone contribuiscano all'attenuazione dell'elaborazione sensoriale 7 .
Come sono i periodi di sonno resistenti ai rumori e vulnerabili organizzati nel tempo e quali sono i loro determinanti? In entrambi i topi e umani, abbiamo recentemente individuato una oscillazione infrarossa, 0,02-Hz nei ritmi neurali. A seconda della fase di questa oscillazione di 0,02-Hz, i topi hanno mostrato una reattività variabile agli stimoli esterni, sia svegliarsi o dormireIl rumore. È interessante notare, questa oscillazione è stata correlata con il tasso del battito cardiaco, indicando che il sistema nervoso autonomo partecipa nella modulazione della vulnerabilità del sonno agli stimoli esterni 1. Durante questo ritmo sono stati organizzati anche ritmi ippocampali correlati alla memoria e, in modo più sorprendente, la sua forza è correlata alla qualità del consolidamento della memoria negli esseri umani. L'oscillazione di 0,02 Hz sembra quindi essere un principio organizzativo di sonno non umano REM e rodente che modula sia la sensibilità all'ambiente che l'elaborazione della memoria interna. Ciò sottolinea nuovamente la necessità di valutazioni multiparametriche e continue di stati di sonno per riconoscere la loro funzionalità e per individuare siti di potenziale vulnerabilità.
Ecco una procedura per estrarre la forma d'onda di queste dinamiche, incluso l'impianto chirurgico dei topi per le misure combinate EEG / ECoG e EMG-ECG, l'esposizione a stimoli sensoriali,Rutine di analisi. Questa procedura fornisce una base per la visualizzazione del sonno come uno stato di vigilanza continuamente variabile ma altamente organizzato durante il quale vengono eseguite diverse funzioni fondamentali del sonno in sequenza. Più in generale, la procedura è applicabile agli approcci che mirano ad estrarre le caratteristiche spettrali e autonome che precedono un esito comportamentale durante il sonno sia negli stati di salute che nelle malattie.
Protocollo
Tutte le procedure sperimentali sono state eseguite in conformità con il comitato per la cura degli animali di Losanna e il Servizio di Consummazione e Affari Vétérinari del Cantone di Vaud.
1. Chirurgia per le registrazioni EEG / EMG-ECG
- Alloggiamento e selezione degli animali.
- Tenere gli animali (C57Bl / 6J, 7-9 settimane, 25-30 g) in un ciclo scuro / leggero 12: 12 h, alloggiati singolarmente e in condizioni standard (umidità del 40%, 22 ° C), con alimenti e acqua Disponibile ad libitum .
- Utilizzare solo soggetti maschi per evitare tutte le influenze del ciclo ormonale nel sonno.
- Preparazione degli elettrodi.
- Creare elettrodi EEG / ECoG (utilizzati nel passo 1.3.11) utilizzando pezzi di filo d'oro di circa 0,5 cm (75% Au, 13% Ag e 12% Cu; diametro 0,2 mm), ciascuno saldato in cima ad un oro vite in acciaio plated (3 lunghezza mm 1,1 mm diametro alla base; vedere FigurE 1). Preparare 2 elettrodi EEG per animale e pulirli in etanolo al 70%.
- Preparare elettrodi EMG-ECG con cavi oro da 3 a 4 cm (75% Au, 13% Ag e 12% Cu; diametro: 0,2 mm). Piegare i fili ad un angolo di 90 ° da 1 cm da un'estremità e preparare una bobina (1 - 2 mm ø) all'altra estremità ( Figura 1 ). Tra le due estremità, piegare il filo per creare una piccola curvatura che corrisponda al profilo di superficie dell'osso tra il cervelletto e l'lambda.
- Preparare 2 elettrodi EMG-ECG per animale.
- Preparare un connettore a testa a 6 canali da femmina a maschio (raster: 2,54 mm x 2,54 mm, dimensioni: 5 mm x 8 mm x 9 mm, dimensioni pin: 5 mm, vedi figura 1 ).
- Coprire il connettore alla base di entrambi i pin femminili e maschi con nastro.
- Aggiungere una piccola quantità di filo di saldatura alle punte di 4 dei 6 perni maschi per aiutare con la saldatura degli elettrodi EEG e EMG-ECG durante l'intervento(Vedere passo 1.3.16).
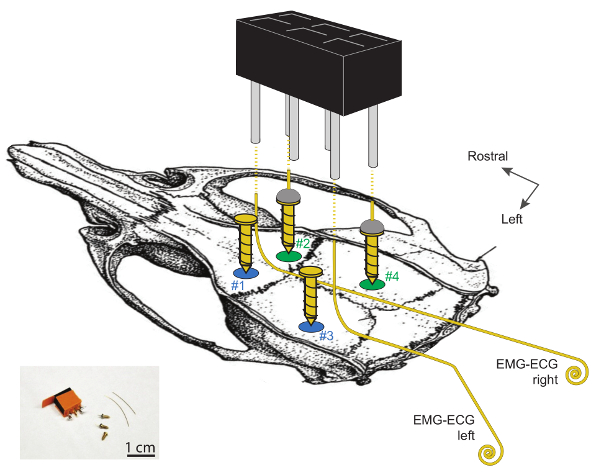
Figura 1 . Visualizzazione schematica dei siti per l'impianto di elettrodi EEG e EMG sul cranio del mouse.
Craniotomie # 1 e # 2 si trovano ~ 2 mm laterali alla linea mediana e ~ 2 mm rostral a bregma. Le craniotomie # 3 e # 4 sono situate ~ 2 mm da rostral a lambda e sono rispettivamente 4 e 2 mm laterali alla linea mediana. I due elettrodi EEG, realizzati dalla saldatura di un filo d'oro alla cima di una vite in acciaio placcato in oro (2 e 4), si trovano sull'emisfero destro. Le 2 viti a sinistra (# 1 e # 3) servono come supporti. Si noti che gli elettrodi EMG-ECG non dovrebbero essere a contatto con queste 2 viti di supporto. Gli elettrodi EMG-ECG sono fili d'oro di lunghezza da 3 a 4 cm, piegati ad angoli di 90 ° oltre 1 cm sulle loro estremità rostrali e avvolti (1 - 2 mm ø) sulle estremità caudali. I 2 EEG e 2 elettrodi EMGS sono collegati al connettore a testa a 2 canali a 3 canali saldando un filo a un perno angolare, come mostrato dalle linee tratteggiate. Ulteriori informazioni dettagliate su questi elettrodi e sul loro impianto possono essere trovate Nel 29 . Clicca qui per visualizzare una versione più grande di questa figura.
- Chirurgia dell'impianto.
- Anestetizzare l'animale in una camera di induzione isoflurana (4 - 5% isoflurano + O 2 a 1 - 2 L / min per 3 - 4 minuti). Iniettare 5 μg / g di carprofene intraperitonealmente (ip) durante la rimozione del topo dalla camera, prima della fissazione stereotassiale.
- Seguire le procedure standard per fissare il mouse sull'apparecchio stereotaxic. Mantenere l'anestesia isoflurana attraverso una maschera a gas (3% isoflurano + O 2 durante la fissazione a 1 L / min). Mantenere la temperatura corporea durante l'intervento a 37 ° C usinGa riscaldamento.
- Proteggere gli occhi da essiccare applicando unguento di vitamina A. Controllare il livello di tolleranza chirurgica dell'animale verificando il riflesso di ritiro della zampa.
- Fissare la testa posizionando le barre d'orecchio sul cranio con le loro estremità opposte, anziché le punte (senza entrare nei canali d'orecchio) 29 . Posizionare la barra della bocca (come al solito) per assicurare l'orizzontalità della testa.
NOTA: La fissazione minimizza i danni alle orecchie, importante per gli esperimenti di arousal acustico (vedere la sezione 4 di questa procedura). - Monitorare la respirazione dell'animale durante la procedura, che dovrebbe rimanere a ~ 2 - 3 respiri / 2 s. Se necessario, regolare la concentrazione di isoflurano nell'erogatore di gas; Dovrebbe diminuire poco a poco durante l'intervento chirurgico, dal 3% durante la fissazione a 1,0-1,5% verso la fine della procedura.
- Iniettare 100 μl di 0,9% NaCl ip una volta al giorno utilizzando un insulino ultrafiniN siringa per mantenere l'animale idratata.
- Assicurarsi che la testa dell'animale sia illuminata da una sorgente luminosa luminosa.
- Pulire l'area con 70% EtOH e disinfettante a base di iodio (pelliccia umida impedisce ai capelli di entrare nella finestra chirurgica).
- Sollevare la pelle al centro del cranio con le pinze Adson e tagliare delicatamente la porzione sollevata della pelle lungo la linea mediana, dalla cima del collo al livello degli occhi, utilizzando forbici belle. Rimuovere il cuoio capelluto (~ 1 cm anteroposterior, ~ 0.5 - 0.8 cm laterale).
- Assicurarsi che la finestra sia abbastanza grande (verso entrambi i lati) per vedere chiaramente il bregma e le fessure lambda del cranio. Fissare la pelle da entrambi i lati con serrefine bulldog per garantire l'accesso all'osso.
- Rimuovere il tessuto congiunto (periostato) accuratamente graffiando con un bisturi. Pulire l'area con disinfettante a base di iodio e asciugare il cranio con un tampone antisettico.
- Utilizzando una lama a scalpello tagliente (dimensione 15), graffi la sKull per ottenere una superficie ossea pulita e mattificata. Utilizzando solo la punta del bisturi, graffiare un reticolo a griglia di groove, con una distanza di circa 1-2 mm tra le scanalature.
NOTA: questo migliora l'attaccamento della colla epossidica bicomponente al cranio al punto 1.3.15. - Utilizzare un microdrillo con una trapezia da 1/005 per eseguire 4 craniotomie (~ 0,7 mm ø) nel cranio in posizioni specifiche ( figura 1 , vedi anche passo 1.3.11.3). Sfregare la polvere ossea usando una pipetta Pasteur e pulire qualsiasi sanguinamento con tamponi antisettici.
- Se si verifica il sanguinamento, assicurarsi che sia interrotto completamente prima di riprendere il processo. Utilizzare una spugna emostatica per accelerare l'emostasi.
- Utilizzare le due craniotomie sull'emisfero destro per inserire gli elettrodi a vite (craniotomie # 2 e # 4).
- Utilizzare le due craniotomie sull'emisfero sinistro per inserire viti di ancoraggio che stabilizzeranno l'impianto (craniotomie # 1 e # 3).
NOTA: per aumentareSe sono state utilizzate fino a 4 viti di ancoraggio 29 .
NOTA: Le precise coordinate stereotossiche sono: 2 mm dalla linea mediana su entrambi gli emisferi e 2 mm di rostral da bregma (craniotomie # 1 e # 2), 2 mm di rostral da lambda e 4 mm di sinistra laterale dalla linea mediana (craniotomia # 3) 2 mm rostral da lambda e 2 mm lateralmente a destra dalla linea mediana (craniotomia # 4). Vedere la Figura 1 .
- Sull'emisfero sinistro, avvitare due viti dorate attraverso le craniotomie per il supporto.
- Fissare la vite in un morsetto emostatico e tenerlo verticalmente sopra la craniotomia. Avvicinatevi attentamente alla parte inferiore della vite sulla parte superiore della craniotomia. Ruotarla mentre non deviare dalla posizione verticale.
NOTA: solo 1,5 rotazioni sono sufficienti per ottenere una buona stabilità meccanica e segnali di alta qualità, minimizzando la pressione sul tessuto sottostante 25 . - A destra, avvitare il preElettrodi (descritti nel passaggio 1.2.1.) Attraverso le craniotomie.
- Fissare la vite in un morsetto emostatico e tenerlo verticalmente sopra la craniotomia. Avvicinatevi attentamente alla parte inferiore della vite sulla parte superiore della craniotomia. Ruotarla mentre non deviare dalla posizione verticale.
- Con l'aiuto di pinze, sollevare con cautela il bordo della pelle dai muscoli del collo. Inserire i fili EMG-ECG, con le estremità avvolte all'interno dei muscoli (sinistra e destra). Incollare le parti intermedie al cranio, in modo che l'EMG-ECG sinistro esca accanto alla vite di ancoraggio posteriore sinistra, mentre la destra EMG-ECG è posizionata accanto alla vite anteriore di ancoraggio anteriore.
- Per rilevare i segnali ECG dal cuore durante il sonno, accertarsi che i fili EMG-ECG siano inseriti nel muscolo ad una profondità di ~ 0,8-1 cm, con il loro ciclo finito il più lontano l'uno dall'altro possibile.
- Utilizzare una spatola rivestita con colla epossidica bicomponente per applicare la colla al cranio tra le viti e intorno alle viti. Lasciare asciugare nella luce, ma proteggere gli occhi dell'animale da un fulmine eccessivo.
NOTA: Le basi delle viti devono essere coperte e solo i cavi dovrebbero essere accessibili, emergenti frLa colla. - Assicurarsi che la colla riempia lo spazio tra i due elettrodi EMG-ECG che si estendono dalla superficie, in modo tale che non ci siano contatti elettrici fra loro e le viti di supporto. Prestare attenzione meticolosa per non incollare la pelle al cranio; La pelle dovrebbe rimanere libera di muoversi intorno alla colla.
- Tagliare i cavi EEG e EMG-ECG in modo che raggiungano circa 0,5 mm dalla colla. Saldare i quattro perni all'angolo del connettore preparato al punto 1.2.3. Ai quattro fili che emergono dalla colla ( Figura 1 ).
- Provare a posizionare i perni del connettore il più vicino possibile per ridurre al minimo l'altezza dell'impianto; Utilizzare un piccolo morsetto di coccodrillo attaccato al supporto stereotassico che mantiene la posizione del connettore. Ridurre al minimo il tempo a contatto con la punta di saldatura, poiché questo riscalda rapidamente le viti.
- Riempire lo spazio tra la colla e il connettore con il cemento dentale per coprire le parti saldate. Crea smooE evitare spigoli vivi che potrebbero danneggiare l'animale. Inoltre, evitare di toccare la pelle, in quanto ciò provoca prurito.
- Rimuovere le serrefine bulldog. Se necessario, chiudere la ferita utilizzando un filo di sutura sterile (fibra di sutura assorbibile) davanti e dietro il connettore, creando semplici modelli di chiusura interrotti e due nodi quadrati (ago 5-0 FS-3, filamento da 45 cm).
- Monitorare l'animale fino a quando non è completamente sveglio. Pesare l'animale dopo l'intervento e riportarlo alla sua gabbia per ripristinare.
- Cura post-operatoria e connessione al sistema.
- Monitorare l'animale ogni giorno per una settimana. Cercare perdita di peso, attività ridotta o anomala e segni di infezioni. Seguire la procedura di punteggio stabilita dalle autorità veterinarie.
- 5-6 giorni dopo l'intervento chirurgico, collegare il cavo di registrazione al connettore di testa sull'animale, lasciandolo nella sua gabbia. Attendere ancora 4 - 5 giorni prima dell'inizio del recorIn modo che l'animale sia abituato alla condizione e dorme naturalmente.
2. Valutazione base dei dati EEG / EMG-ECG per la determinazione dello stato di vigilanza
- Registrare i dati EEG e EMG-ECG per 48 ore con un software polisomnografico commerciale ( ad esempio, Somnologica, SleepSign o Sirenia). Utilizzare impostazioni tipiche, come il guadagno di 2.000x; Una frequenza di campionamento di 2.000 Hz all'acquisizione, scesa a 200 Hz dopo l'acquisizione; E un filtro passa-alto da 0,7 Hz per EEG e un filtro passa-alto a 10 Hz per EMG-ECG.
- Esportare i dati nel formato file ".edf".
- Apri i file ".edf" con un software personalizzato ( ad esempio in Matlab) che classifica semi-automaticamente ogni epoca di 4 anni come sveglio, sonno non REM, sonno REM e corrispondenti manufatti.
NOTA: In alternativa, sono disponibili diversi software di punteggio semiautomatico. Questa procedura descrive alcuni dei passi fondamentali che devono essere fatti per impostare il punteggio wCon il software di punteggio utilizzato qui; Altri sistemi di punteggio semi-automatico potrebbero essere basati su altri parametri. - Usando il software, separare i file ".edf" in 4 volte 12 ore di registrazioni.
- Rimuovere gli artefatti che derivano dall'attività EMG-ECG presente nel segnale EEG o da uno stato comportamentale non assegnabile 1 , 29 .
- Calcolare la media dei valori assoluti di EEG ( media EEG) e EMG ( media EMG) nei 12 h delle registrazioni dall'EEG e dalle tracce EMG-ECG, rispettivamente.
- Identificare i valori medi di EEG / EMG di ogni epoca 4 (EEG Epoch / EMG Epoch ).
- Classificare le epoche come "Wake" quando EEG Epoch significa e EMG Epoch > EMG significa "Non-REM sleep" quando EEG Epoch > EEG significa e EMG Epoch significa.
- Classificare le epoche che non s Applicare questi criteri con un algoritmo di correzione basato sulle epoche precedenti e successive.
- Classificare le epoche come sonno REM quando EEG Epoch significa e EMG Epoch significa .
- Raffinare i punti critici, come le transizioni da sonno non remoto a risveglio, epoche di sonno REM e microarrosi durante il sonno non REM. Ispezionare visivamente il punteggio per garantire la determinazione appropriata dello stato di vigilanza 29 , 30 .
NOTA: Effettuare sempre un'ispezione visiva finale e validazione del punteggio.
3. Analisi della oscillazione infrarosso per EEG e Heartbeats
- Per questa analisi, selezionare solo periodi di sonno non REM che durano ≥ 96 s ( cioè almeno 24 epoche di 4 s); Vedere la Figura 2 .
NOTA: Le routine personalizzate sono disponibili su richiesta 1 .

Figura 2 . Determinazione della dinamica di potenza di Sigma durante il sonno non disturbato di REM.
( A ) Top, EEG (nero) e EMG-ECG (grigio) tracce durante i primi 100 minuti della fase leggera in un solo topo. Gli stati di vigilanza sono indicati dalla barra colorata in cima alle tracce grezze. Medio, tipico esempio di un incontro continuo di non-REM continuo (> 96-s). In basso, un intervallo di 16 anni scelto in modo casuale che illustra la suddivisione in epoche a quattro. La fase successiva dell'analisi viene mostrata solo per queste quattro epoche, ma è valida per ogni epoca contenuta nel periodo. ( B ) In alto, quattro FFT successive generate dalle epoche di 4 mostrate nel pannello inferiore di A. La banda sigma (10-15 Hz) è ombreggiata in rosso. In alto a destra, 1 inserto dall'ultima epoca che mostra le onde R presenti nel quadrato EMG-ECG segnale. In basso, il corso del tempo del Il potere sigma estratto dallo spettro corrispondente sopra. Le linee tratteggiate illustrano la continuazione dei valori di potenza prima e dopo i quattro attacchi non REM selezionati per la visualizzazione. ( C ) Corsi temporali normalizzati del segnale (rosso) e battito cardiaco (in BPM) (grigio), con la porzione illustrata in (B) situata tra le linee tratteggiate verticalmente. Di seguito è riportato il corrispondente segnale EEG filtrato nella banda sigma (10 - 15 Hz). ( D ) Risultato del FFT calcolato sul corso del tempo di potenza sigma mostrato in (C), dimostrando un picco dominante a 0,016 Hz. Clicca qui per visualizzare una versione più grande di questa figura.
- Estrarre i valori di potenza per la potenza spettrale della banda di frequenza sigma (10-15 Hz) nei cestelli a 4 ( Figura 2 A e B ) utilizzando i calcoli delle trasformazioni FFT (Fourier Fast)"> 1.
- Calcolare la potenza spettrale di base per il sonno non-REM, misurando i valori in ogni cassetta di frequenza per tutte le epoche di sonno non-REM (gli artefatti e le epoche di transizione tra gli stati di vigilanza sono esclusi da questa media). Normalizzare i valori di potenza sigma di ogni epoca alla potenza media della banda sigma durante il sonno non REM durante il periodo di interessi. Trama contro il tempo ( Figura 2 C ).
- Calcola l'FFT del corso del tempo di sigma con Hamming windowing per rivelare le componenti della frequenza oscillatoria della dinamica di potenza ( Figura 2 D ) 1 .
- Si noti che poiché i periodi di sonno non-REM hanno diverse durate, i FFT risultanti hanno diverse risoluzioni di frequenza. Interpolate per regolare la risoluzione a quella più alta ottenuta dal più lungo periodo di sonno non-REM e la media dei FFT di tutti gli attacchi.
- Continuare questi analisiPer descrivere le relazioni di fase tra le dinamiche dei segnali EEG e ECG.
- Estrarre i dati del battito cardiaco dal segnale quadrato EMG-ECG dopo filtraggio passa-alto a 30 Hz, utilizzando routine appropriate per la rilevazione di picco dell'onda R.
NOTA: limitare l'intervallo di tempo minimo tra due onde R successive a 80 ms aiuta ad evitare l'inserimento di picchi occasionali artificiali a causa di torsioni muscolari 1 . - Misurare gli intervalli RR e calcolare la frequenza cardiaca media in battiti al minuto (BPM) ogni 4 bin ( fig. 2 B e C ).
4. Esposizione al rumore
- Genera rumori (cioè rumore bianco) attraverso un software scritto personalmente. Impostare la durata a 20 s e l'intensità a 90 dB SPL (misurata all'interno della gabbia). Riprodurre i rumori con gli altoparlanti attivi standard 1 .
- Dopo l'intervento chirurgico, durante l'abitudine al recorDing, riproduce i suoni sperimentali in modo casuale, più volte durante il giorno e in momenti diversi 1 .
- Nella condizione sperimentale (durante la registrazione di dati EEG / EMG / ECG), durante il primo 100 minuti all'insorgenza della luce (ZT0), si riproduca pseudo-casuale. Per riprodurre il rumore, soddisfare le seguenti condizioni 1 :
- Assicurarsi che il mouse sia stato in stato di non-REM per> 40 s.
- Assicurarsi che l'esposizione precedente si è verificata più di 4 minuti prima.
NOTA: Ciò provoca ~ 15 esposizioni per sessione.
- Segna l'inizio del tempo di registrazione e l'inizio di ogni esposizione del rumore. Tenere il sperimentatore ciechi alla composizione spettrale di sonno non REM durante la procedura.
- Acquisire tutti i dati con il software polisomnografico 1 , 29 .
5. Analisi retrospettiva del sonno basata sul risultato comportamentale duranteEsposizione al rumore
- Valutare manualmente le tracce EEG / EMG-ECG in una risoluzione di 4, senza conoscere i tempi di esposizione al rumore 1 .
- Utilizzare uno script scritto personalizzato per estrarre i dati di esposizione EEG / EMG-ECG / noise 1 .
- Punteggio come sonno quando entrambi i segnali EEG e EMG rimangono inalterati durante l'esposizione al rumore ( Figura 3A ). Si consideri un risveglio quando l'ampiezza EEG diminuisce e la frequenza EEG aumenta, in combinazione con l'attività muscolare rilevata sull'elettrodo EMG-ECG ( Figura 3B ).
- Eliminare le prove in cui gli animali si sono svegliati durante il periodo pre-stimolo o nelle prime 4 s dell'esposizione al rumore ( Figura 3D ).
- Definire il tasso di successo di arousal come la proporzione di prove di sveglia all'interno di tutti i trial inclusi ("Wake-up" e "Sleep-through").
- In tutte le prove incluse, esaminare la dinamica del potere sigma durante la thE periodo di pre-stimolo ( Figura 3 E ) 1 .

Figura 3 . Risultati comportamentali in risposta all'insorgenza del rumore: risultati rappresentativi che sono stati mantenuti o esclusi dall'analisi.
( AD ) Le tracce grezze dell'EEG (nero) e dei corrispondenti segnali EMG-ECG (grigio) per 40 s prima dell'insorgenza del rumore e durante i 20 s del rumore, rappresentati dalla zona azzurra. Gli stati di vigilanza sono indicati nel codice colore. Per illustrare i dati che sono stati inclusi nell'analisi, vengono visualizzati gli eventi rappresentativi "Sleep-through" ( A ) e "Wake-up" ( B ). I risultati scartati contenevano le transizioni al sonno REM ( C ) e una precoce risposta "Wake-up" ( D ). L'insetto mostra un espansioneParte di EEG e EMG-ECG tracce caratteristiche del sonno REM. ( E ) Esempi tipici delle dinamiche di potenza del sigma nella finestra di 40 anni prima dell'insorgenza di rumore durante un "Sleep-through" (a sinistra) e un evento "Wake-up" (destro). Viene mostrato sopra la banda passante EEG traccia filtrata per la banda sigma. L'area blu rappresenta l'inizio del rumore. Clicca qui per visualizzare una versione più grande di questa figura.
Risultati
La figura 2 A (pannello superiore) mostra 100 min di tratti spontanei di sonno-sveglia, registrati mediante elettrodi polisomnografi impiantati come descritto (vedi Figura 1 ). Gli aumenti e le diminuzioni dell'ampiezza di EEG e EMG all'insorgenza del sonno non-REM sono chiaramente visibili. Il sonno intermittente REM è segnato da una diminuzione dell'ampiezza di EEG e da una ulteriore diminuzione d...
Discussione
Qui mostriamo come stabilire un profilo temporale continuo di sonno non REM che integra le variabili EEG, EMG e ECG. Questo è un primo passo verso lo sviluppo di una descrizione integrativa del sonno del mouse, che può aiutare a identificare la scadenza temporale non riconosciuta in precedenza in cui sono organizzate elevate e basse resistenze al rumore durante il sonno non REM 1 . Una struttura temporale simile è stata descritta anche nel sonno non-REM umano attraverso un'analisi analoga ...
Divulgazioni
Gli autori dichiarano di non avere interessi finanziari concorrenti.
Riconoscimenti
Ringraziamo tutti i membri del laboratorio per il loro contributo alla scrittura e attenta lettura di questo manoscritto. Siamo grati a Paul Franken per stimolare le discussioni, il Dr. Gisèle Ferrand per i commenti utili sul protocollo chirurgico e il dottor Jean-Yves Chatton per fornire i file eseguibili Labview originale per l'esposizione al rumore. Il finanziamento è stato fornito dalla Fondazione nazionale della scienza nazionale (Grants 31003A_146244 e 31003A_166318) e l'Etat de Vaud.
Materiali
| Name | Company | Catalog Number | Comments |
| 2-components epoxy glue | Henkel | Loctite EA 3450 | |
| Absorbable Suturing Fiber (Prolene) | Ethicon | 5-0 FS-3 | |
| Adson Forceps | FST | 11006-12 | |
| Antiseptic swab | VWR | 149-0332 | |
| Attane Isoflurane | Piramal | Isoflurane 250mL | |
| Connectors 3x2-channels | ENA AG | 2.316 | Raster 2.00 x 2.00 mm; size 5x8x9 mm; pin size 5mm; http://www.ena.ch/ |
| Dragonfly commutator | Dragonfly | Model #SL-10 | |
| EMBLA amplifier | EMBLA | A10 amplifier | |
| Fine scissors | FST | 14108-09 | |
| Flat Head Gold-plated steel screw | J.I. Morris | FF00CE125 | https://jimorrisco.com/ |
| Gold wire | CMSA | T.69 5gr | http://www.cmsa.ch/en/ |
| Hemostatic sponge | Pfizer | Gelfoam | |
| iodine-based disinfectant (Betadine) | Mundipharma | standart solution 60mL | |
| Komet drill steel 1/005PM104 | UNOR AG | 22310 | |
| Matlab Analysis Software | MathWorks | R2016b | https://ch.mathworks.com/products/matlab.html |
| Microdrill | Fine Science Tools | 96758 | |
| Mouse Gas Anesthesia Head Holder | Kopf Instruments | Model 923-B | http://kopfinstruments.com/product/model-923-b-mouse-gas-anesthesia-head-holder/ |
| Ophtalmic ointment | Pharmamedica | VITA-POS | |
| Paladur (liquid) | UNOR AG | 2260215 | for dental cement |
| Palavit (powder) | UNOR AG | 5410929 | for dental cement |
| Small Animal Stereotaxic Frame | Kopf Instruments | Model 930 | http://kopfinstruments.com/product/model-930-small-animal-stereotaxic-frame-assembly/ |
| Soldering wire | Stannol | 593072 | |
| Temperature controller - Mini rectal probe | Phymep | 4090502 | http://www.phymep.com/produit/dc-temperature-controller/ |
| Temperature controller- heating pad | Phymep | 4090205 | http://www.phymep.com/produit/dc-temperature-controller/ |
Riferimenti
- Lecci, S., et al. Coordinated infra-slow neural and cardiac oscillations mark fragility and offline periods in mammalian sleep. Sci Adv. 3 (2), 1602026 (2017).
- Rechtschaffen, A., Kales, A. A manual of standardized terminology, techniques and scoring system for sleep of human subjects. U.S. Department of Health, Education, and Welfare. , (1968).
- Blake, H., Gerard, R. W. Brain potentials during sleep. Am J Physiol. 119, 692-703 (1937).
- Rechtschaffen, A., Hauri, P., Zeitlin, M. Auditory awakening threshold in REM and NREM sleep stages. Percept Mot Skills. 22 (3), 927-942 (1966).
- Achermann, P., Borbély, A. A. Low-frequency (< 1 Hz) oscillations in the human sleep electroencephalogram. Neuroscience. 81 (1), 213-222 (1997).
- Aeschbach, D., Borbély, A. A. All-night dynamics of the human sleep EEG. J. Sleep Res. 2 (2), 70-81 (1993).
- Astori, S., Wimmer, R. D., Lüthi, A. Manipulating sleep spindles--expanding views on sleep, memory, and disease. Trends Neurosci. 36 (12), 738-748 (2013).
- Brown, R. E., Basheer, R., McKenna, J. T., Strecker, R. E., McCarley, R. W. Control of sleep and wakefulness. Physiol Rev. 92 (3), 1087-1187 (2012).
- Buzsáki, G., Wang, X. J. Mechanisms of gamma oscillations. Annu Rev Neurosci. 35, 203-225 (2012).
- Rasch, B., Born, J. About sleep's role in memory. Physiol Rev. 93 (2), 681-766 (2013).
- Halász, P., Bòdizs, R. . Dynamic structure of NREM sleep. , (2013).
- Terzano, M. G., Parrino, L., Spaggiari, M. C. The cyclic alternating pattern sequences in the dynamic organization of sleep. Electroencephalogr Clin Neurophysiol. 69 (5), 437-447 (1988).
- Gottesmann, C. Detection of seven sleep-waking stages in the rat. Neurosci Biobehav Rev. 16 (1), 31-38 (1992).
- Benington, J. H., Kodali, S. K., Heller, H. C. Scoring transitions to REM sleep in rats based on the EEG phenomena of pre-REM sleep: an improved analysis of sleep structure. Sleep. 17 (1), 28-36 (1994).
- Sullivan, D., Mizuseki, K., Sorgi, A., Buzsáki, G. Comparison of sleep spindles and theta oscillations in the hippocampus. J Neurosci. 34 (2), 662-674 (2014).
- Vas, S., et al. Differential adaptation of REM sleep latency, intermediate stage and theta power effects of escitalopram after chronic treatment. J Neural Transm (Vienna). 120 (1), 169-176 (2013).
- Schiffelholz, T., Aldenhoff, J. B. Novel object presentation affects sleep-wake behavior in rats. Neurosci Lett. 328 (1), 41-44 (2002).
- Wimmer, R. D., et al. Sustaining sleep spindles through enhanced SK2-channel activity consolidates sleep and elevates arousal threshold. J Neurosci. 32 (40), 13917-13928 (2012).
- Fernandez, L. M. J., et al. Highly dynamic spatiotemporal organization of low-frequency activities during behavioral states in the mouse cerebral cortex. Cereb Cortex. , (2016).
- Franken, P. Long-term vs. short-term processes regulating REM sleep. J Sleep Res. 11 (1), 17-28 (2002).
- Feige, B., et al. The microstructure of sleep in primary insomnia: an overview and extension. Int J Psychophysiol. 89 (2), 171-180 (2013).
- Parrino, L., Halasz, P., Tassinari, C. A., Terzano, M. G. CAP, epilepsy and motor events during sleep: the unifying role of arousal. Sleep Med Rev. 10 (4), 267-285 (2006).
- Akinseye, O. A., et al. Sleep as a mediator in the pathway linking environmental factors to hypertension: a review of the literature. Int J Hypertens. 2015, 926414 (2015).
- Campbell, K., Muller-Gass, A. The extent of processing of near-hearing threshold stimuli during natural sleep. Sleep. 34 (9), 1243-1249 (2011).
- Nir, Y., Vyazovskiy, V. V., Cirelli, C., Banks, M. I., Tononi, G. Auditory responses and stimulus-specific adaptation in rat auditory cortex are preserved across NREM and REM sleep. Cereb Cortex. 25 (5), 1362-1378 (2015).
- Dang-Vu, T. T., et al. Interplay between spontaneous and induced brain activity during human non-rapid eye movement sleep. Proc Natl Acad Sci USA. 108 (37), 15438-15443 (2011).
- Elton, M., et al. Event-related potentials to tones in the absence and presence of sleep spindles. J Sleep Res. 6 (2), 78-83 (1997).
- McKinney, S. M., Dang-Vu, T. T., Buxton, O. M., Solet, J. M., Ellenbogen, J. M. Covert waking brain activity reveals instantaneous sleep depth. PLoS One. 6 (3), 17351 (2011).
- Mang, G. M., Franken, P. Sleep and EEG phenotyping in mice. Curr Protoc Mouse Biol. 2 (1), 55-74 (2012).
- Borbély, A. A., Tobler, I., Hanagasioglu, M. Effect of sleep deprivation on sleep and EEG power spectra in the rat. Behav Brain Res. 14 (3), 171-182 (1984).
- Jurysta, F., et al. The impact of chronic primary insomnia on the heart rate--EEG variability link. Clin Neurophysiol. 120 (6), 1054-1060 (2009).
- Silvani, A., Calandra-Buonaura, G., Benarroch, E. E., Dampney, R. A. L., Cortelli, P. Bidirectional interactions between the baroreceptor reflex and arousal: an update. Sleep Med. , (2015).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneThis article has been published
Video Coming Soon