Se requiere una suscripción a JoVE para ver este contenido. Inicie sesión o comience su prueba gratuita.
Method Article
Un microcontrolador funciona dispositivo para la generación de extractos líquidos de Aerosol de humo y electrónicos cigarrillo cigarrillo convencional
En este artículo
Resumen
Aquí, describimos un aparato de laboratorio programable que puede utilizarse para crear extractos de aerosol de humo y electrónicos del cigarrillo del cigarrillo convencional. Este método proporciona una herramienta útil para hacer comparaciones directas entre cigarrillos convencionales y los cigarrillos electrónicos y es un punto de entrada accesibles a la investigación de cigarrillo electrónico.
Resumen
Los cigarrillos electrónicos son el producto de tabaco más popular entre medio y secundaria y son el producto de tabaco alternativa más popular entre los adultos. Alta calidad, investigación reproducible sobre las consecuencias del uso del cigarrillo electrónico es esencial para la comprensión emergentes problemas de salud pública y elaboración de pruebas basado en normativa. Mientras un número creciente de trabajos discuten los cigarrillos electrónicos, hay poca consistencia en los métodos a través de grupos y muy poco consenso en los resultados. Aquí, describimos un aparato de laboratorio programable que puede utilizarse para crear extractos de aerosol de humo y electrónicos del cigarrillo del cigarrillo convencional. Este protocolo detalla las instrucciones para el montaje y operación de dicho dispositivo y muestra el uso del extracto generado en dos aplicaciones de ejemplo: una en vitro ensayo de viabilidad celular y cromatografía de gases-espectrometría de masas. Este método proporciona una herramienta para hacer comparaciones directas entre cigarrillos convencionales y los cigarrillos electrónicos y es un punto de entrada accesibles a la investigación de cigarrillo electrónico.
Introducción
A pesar de un esfuerzo concentrado por las organizaciones de salud, consumo de productos de tabaco sigue siendo la principal causa de muerte evitable en todo el mundo, con la mayoría de estas muertes atribuidas al cigarrillo fumar1. Desde su incursión en el mercado en 2003, los cigarrillos electrónicos han ido creciendo en popularidad entre usuarios de productos de tabaco. En la actualidad, los cigarrillos electrónicos son la alternativa más popular a los cigarrillos convencionales entre los estadounidenses adultos (~ 5%)2 y el sistema de entrega de nicotina más popular entre medio (~ 5,3%) y secundaria (~ 16%)3. Si continúan las tendencias actuales, los cigarrillos electrónicos pueden esperarse para sustituir cigarrillos convencionales para las generaciones futuras. Sin embargo, las consecuencias para la salud del uso del cigarrillo electrónico todavía no están claros.
Investigación sobre los cigarrillos electrónicos no comenzó en serio hasta que el cigarrillo electrónico renombre aumentó rápidamente en 20133,4. Desde entonces, se han empleado un número de diferentes modelos para abordar la cuestión de su toxicidad. Sin embargo, los resultados de muchos estudios son contradictorios, y si bien parece que los cigarrillos electrónicos son generalmente menos tóxicos que los cigarrillos convencionales, no hay ningún consenso actual sobre las consecuencias para la salud del cigarrillo electrónico utilizar5, 6 , 7. nuestros estudios anteriores indican que los cigarrillos electrónicos son significativamente menos tóxicos para el endotelio vascular que los cigarrillos convencionales, a pesar de su capacidad de causar daños en el ADN y la inducción de oxidativa estrés y muerte celular8 . Sin embargo, más investigación es necesaria antes de que podemos sacar conclusiones firmes sobre las consecuencias para la salud del uso del cigarrillo electrónico.
Como los cigarrillos convencionales son una causa importante de enfermedad vascular puede prevenir9, hay un creciente interés en el riesgo para la salud vascular del cigarrillo electrónico uso10,11,12. Para estudiar los efectos de los cigarrillos electrónicos en el sistema vascular, nuestro laboratorio desarrolló un microcontrolador funcionado fumar/vaping dispositivo (figura 1)8. Este dispositivo es capaz de generar extractos líquidos de cualquier aerosol de humo o electrónicos cigarrillo cigarrillo convencional en solventes orgánicos o acuosos. Flujo de aire es controlada por la combinación de un regulador de flujo de aire ajustable y un programa de sincronización de PBASIC, el dispositivo puede utilizarse para generar extractos según cualquier número de protocolos definidos por el usuario. Aquí detallamos el montaje y funcionamiento de este dispositivo, así como dos posibles aplicaciones: en vitro evaluación de viabilidad celular y cromatografía de gases-espectrometría de masas.
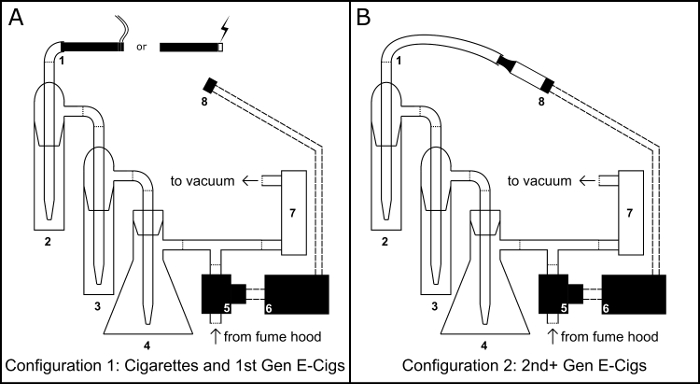
Figura 1: dispositivo de fumar/Vaping. Esquema para el montaje físico del dispositivo de fumar/vaping cigarrillo como cigarrillo electrónico (e-cig) configuración (A) y la configuración del cigarrillo electrónico de depósito (B). Componente clave: 1) Puerto de inhalación; 2) impactor de colección primaria; 3) impactor desbordamiento; 4) trampa vacío del frasco Buchner; 5) normalmente abierta válvula de solenoide; 6) microcontrolador BS1; 7) regulador de caudal de aire; 8) 510 rosca base de tanque de cigarrillo electrónico. Haga clic aquí para ver una versión más grande de esta figura.
Protocolo
1. montaje del dispositivo
- Garantizar un 100 mL frasco de Buchner (figura 1, #4) a un anillo de acero soporte y crear una trampa de vacío relleno con 50 g de cloruro de calcio como un desecante. Sellar el frasco con un tapón de goma por el agujero, envuelva a la Unión del tapón con la película de parafina y ejecutar una pipeta por el orificio.
- Utilizando tubería de vinilo, conectar la pipeta que se extiende desde el tapón a un conector de manguera t-intersección.
- Con tubería del vinilo, conectar entre sí los dos impinger (figura 1, #2 y #3) y conecte la salida de impactor segundo a conector de la manguera de intersección t.
- Con tubería del vinilo, conecte el puerto de entrada de la primer impactor para servir como puerto de inhalación (figura 1, #1).
- Con tubería del vinilo, conecte el brazo lateral del matraz Buchner al puerto de entrada de un regulador de flujo de aire (figura 1, #7) y el puerto de salida del regulador de flujo de aire a una bomba de vacío.
- Montar el circuito según el esquema en la figura 2A.
- Cargar el programa PBASIC SVL.bs1 (figura 2B, también disponible en https://github.com/ChastainAnderson/SVL) para el microcontrolador BS1 (figura 1, #6) por medio de un adaptador serial y software del fabricante.
- Lugar del 510 base roscada (figura 1 #8) en un anillo de soporte de abrazadera.
- Con tubería del vinilo, conecte la válvula de solenoide (figura 1, #5) para liberar el extremo del conector de la manguera de la t-intersección.
Nota: El dispositivo debe ser completo y listo para funcionar, comprobar todas las juntas para asegurarse de que son herméticas y aplique abrazaderas y grasa para vacío según sea necesario.
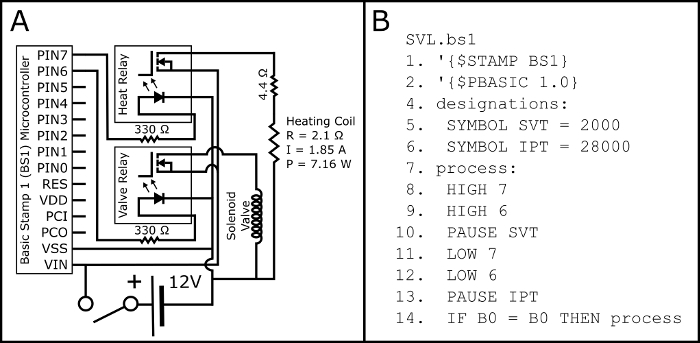
Figura 2: esquema eléctrico y código PBASIC. Figura 2A muestra el esquema eléctrico para el montaje del circuito eléctrico necesario para activar la válvula de solenoide normalmente abierto y el serpentín de calentamiento botón activado cigarrillos electrónicos (a través de la 510 roscado electrónico cigarrillo el tanque base). Los parámetros eléctricos de la bobina de calefacción (P: potencia; R: resistencia; y I: corriente) se proyectan y deberá verificarse empíricamente con una multímetro post Asamblea. Figura 2B muestra el programa de sincronización de PBASIC necesario para controlar el circuito de la figura 2A (también disponible en https://github.com/ChastainAnderson/SVL). Las constantes de tiempo SVT & IPT (#5 y #6) están en unidades de ms y se establecen para proporcionar un tiempo de activación de 2 segundos y un tiempo de inactividad de 28 s. haga clic aquí para ver una versión más grande de esta figura.
2. almacenamiento y preparación de la muestra
- Guarde todas las muestras de cigarrillos convencionales y electrónicos sin abrir en la oscuridad en bolsas de plástico herméticas a temperatura ambiente.
- Una vez abierto, guardar las muestras en bolsas de plástico herméticas a 4 º c, con una toalla de papel para absorber el exceso de humedad.
- Pre-equilibrar todas las muestras en un humidor de temperatura ambiente en ~ 60% de humedad de por lo menos 30 minutos antes de usarlo.
3. general funcionamiento del dispositivo de extracción de cigarrillo cigarrillo electrónico humo Aerosol
- Determinar la masa de cada cigarrillo del cartomizer/tanque pre-vaping utilizando una balanza analítica. La diferencia en peso de pre/post post vaping se utilizará para determinar la dosificación apropiada.
Nota: se supone que contiene 0,7 mg de nicotina los cigarrillos de referencia 3R4F, y el contenido de nicotina de marcas de cigarrillos comerciales puede ser determinado por métodos analíticos convencionales13. - Para la aplicación de ejemplo 1, llene el depósito de impactor primaria con 4,3 mL de medio de cultivo de células endoteliales. Para la aplicación de ejemplo 2, llene el depósito con 5 mL de acetona.
-
La preparación del cigarrillo electrónico o cigarrillo convencional para la extracción:
- Si utiliza un cigarrillo convencional, aplique un trozo de cinta adhesiva transparente alrededor del filtro y poner una marca fácilmente visible donde el papel de cigarrillo se une con el filtro.
- Si se usa un cigarrillo electrónico-cigarrillo, asegúrese de que la batería está bien cargada y el cartomizador firmemente atornillada a la batería.
- Si utiliza un tanque de cigarrillo electrónico, asegúrese de que un volumen adecuado de líquido de cigarrillo electrónico en el tanque y atornille el tanque en la base de rosca 510.
- Inserte la punta del cigarrillo convencional o electrónica en el puerto de inhalación (figura 1, #1) y asegúrelos con una abrazadera de manguera.
- Encienda la bomba de vacío.
- Ajustar el medidor de flujo para tirar de 1,65 L/minuto para asegurar un soplo 55 mL durante 2 segundos.
- Gire en el microcontrolador. Si se usa un cigarrillo convencional, enciende el cigarrillo en la primera bocanada.
- Ejecutar hasta que proyecta deseada concentración (en partes por millón o % peso/volumen) se logra.
-
Determinar la masa de cada tanque cartomizer cigarrillo electrónico después de la vaporización utilizando una balanza analítica. Comparar esta medida para la medida tomada en el paso 3.1 para determinar el total de masa consumida. Calcular la concentración del consumo masa/volumen de solvente. Utilizar la concentración molar de la nicotina consumida para normalizar entre los productos.
- Si se consumía una masa insuficiente, retomar el cigarrillo electrónico en el dispositivo y consumir más.
- Si se consumía una masa suficiente o exceso, proceder.
4. filtración y almacenamiento
- Si el extracto es utilizado para el cultivo celular, filtrar con un filtro de jeringa PES de 0,22 μm.
- Utilice los extractos inmediatamente o almacenar a-80 º c. Como parte de la preparación de Anderson, et al. 8, aerosol de cigarrillo electrónico fue demostrada para ser estable durante al menos dos semanas, y la estabilidad del cigarrillo humo hasta por dos años se ha establecido por estafadores, et al. 13.
5. limpieza del dispositivo
- Después de cada extracción, enjuague la tubería y depósitos del dispositivo con etanol al 70% y agua desionizada para evitar llevan entre muestras.
- Después de enjuagar, brevemente el equipo puede utilizar vacío para permitir el flujo de aire para el secado de las líneas.
6. ejemplo de aplicación 1: Captación de rojo neutro análisis de viabilidad de la célula
- Realizar el extracto como arriba en 4,3 mL de medio de cultivo de células endoteliales.
- Un día antes, sembrar las células endoteliales de vena umbilical humana en 96 placas de pozos a una densidad de 1 x 104 células/wellin 100 μl de medio de cultivo de células endoteliales.
- Tratar las células sustituyendo el viejo medio de cultivo de células endoteliales por cada 100 μl de medio de cultivo fresco de células endoteliales para servir como un control o 75 μl de medio de cultivo de células endoteliales mezclado con 25 μl de un extracto de concentración de nicotina de 2 mM consumido (1,4 mg consumir nicotina en medio de cultivo de células endoteliales 4,3 mL) para una concentración final de 500 μm a servir como tratamiento.
- Como muchos de los componentes de ambas cigarrillo cigarrillo electrónico y humo en aerosol son volátiles, use un sello para mantener los pozos herméticos.
- Incubar la placa de 18 – 24 h a 37 ° C y 5% CO2.
-
Preparar el rojo neutro solución de tinción:
- Crear una solución stock rojo neutro 100 x disolviendo 33 mg de colorante rojo neutro en 10 mL de solución salina tamponada.
- Poco antes de su uso, diluir 100 x 1: 100 de solución madre en medio de cultivo celular para crear 1 x rojo neutro solución de tinción.
- Incubar el rojo neutro solución a 37 ° C por al menos 30 min antes de uso y el uso de tinción inmediatamente.
Nota: Es normal que algunos cristales que precipitan durante la incubación. Debe tenerse cuidado para evitar la aplicación de estos cristales a los pozos de la cultura de célula. Si es necesario, puede utilizarse un filtro de.22 μm para filtrar el stock de rojo neutro y soluciones de tinción.
- Extracto de quitar y añadir 100 μl de rojo neutro solución por exceso de uso, para crear al menos tres pozos en blanco para la correcta cuantificación de la coloración.
- Incube la placa en 2 – 4 h a 37 ° C y 5% CO2.
- Saque neutral red solución de tinción y lavar 3 veces por inmersión en PBS.
- Rojo neutro se aplica la solución (agua desionizada de 50%, 49% de etanol, ácido acético al 1%) de la mancha.
- Incubar al menos 10 min a temperatura ambiente con agitación.
- Leer absorbancia a 540 nm.
- Analizar datos, restando el valor promedio de los pocillos del blanco y la normalización a la media del valor bien control ajustado en blanco.
7. ejemplo de aplicación 2: cromatografía de gases espectrometría de masas
- Realizar extracción como por encima en 5 mL de acetona.
- El equipo puede utilizar para lograr una concentración final de ~ 100 partes por millón (peso del e-líquido consumido/volumen de acetona) de la muestra.
- Utilizando una jeringa de vidrio de precisión, inyectar 1 μl del inyector de un dispositivo de GC-MS. Inyectar a 250 ° C con un 1:20 dividir la relación en un sistema de cromatografía de gas/cuadrupolo acoplado espectrómetro equipado con una columna de ZB-5 con el siguiente protocolo de horno: 1 min a 50 ° C; rampa de 10 ° C/min a 140 ° C; rampa de 20 º C/min a 300 ° C y mantener durante 10 minutos.
- Coincidir con espectros de masas resultantes a la biblioteca de destino para identificar los componentes del aerosol.
Resultados
Dentro de las 24 horas de la exposición de la vena umbilical humana las células endoteliales a Extracto de humo de cigarrillo convencional (CSE) o aerosol de cigarrillo electrónico extracción (EAE), hay un significativo (control vs CSE P < 0.001; control vs EAE P < 0,01; n = 6) reducción de la viabilidad de las células (Figura 3A). Los extractos fueron generados con un perfil que sopla de 2, 2 segundos, soplos de 55 mL por minuto y nor...
Discusión
Los elementos más críticos de este protocolo asegurando que el dispositivo es limpiar al inicio y fin de cada extracción, y asegurando que todos los sellos se mantengan así ese flujo de aire permanece constante. Si el aparato no se limpia correctamente, hay un riesgo de llevar sobre entre las muestras. Además, si el dispositivo se deja impuro durante un largo período de aerosol condensado tiempo y secado solvente puede bloquear el sistema. Tenga en cuenta que es normal que allí para ser una caída de presión al s...
Divulgaciones
El programa de beca de investigación en ciencia reguladora tabaco producto administrado por la Universidad de Tulane es financiado por Altria cliente servicios asuntos regulatorios.
Agradecimientos
Los autores reconocen la asistencia del Dr. Robert Dotson de la Tulane University Departamento de biología celular y Molecular para su asistencia en editar el manuscrito y el Dr. James Bollinger de Tulane University Departamento de química por su ayuda con diseño de protocolo de espectrometría de masas. Los autores más reconocen el Departamento de Universidad de Tulane de celular y Biología Molecular y Tulane University Departamento de química por su apoyo y el uso de espacio y equipo. Este trabajo fue financiado por una beca de investigación ciencia reguladora de tabaco productos a C. Anderson de la Universidad de Tulane Escuela de Ciencia e ingeniería.
Materiales
| Name | Company | Catalog Number | Comments |
| 12 V AC/DC Wall Mount Adaptor | Digi-Key | T1099-P5P-ND | |
| 2.2 Ohm Resistors | Digi-Key | A105635-ND | Used in tandem to generate the 4.4 Ohm resistance in Figure 2A |
| 330 Ohm Resistors | Digi-Key | 330QBK-ND | |
| 510 Threaded Base | NJoy | N/A | Recovered by dismantalling a second generation NJoy electronic cigarette |
| Acetic Acid, Glacial | Sigma-Aldritch | A6283 | |
| Acetone (Chromatography Grade) | Sigma-Aldritch | 34850 | |
| Basic Stamp Project Board | Digi-Key | 27112-ND | This board contains the BS1 Microcontroller, serial adaptor, power switch, and a barrel pin connector for the AC/DC Wall Mount Adaptor |
| Basic Stamp USB to Serial Adapter | Digi-Key | 28030-ND | An optional component to allow the BS1 serial adaptor to communicate through USB |
| Buchner Flask (Vacuum Flask) 250 mL | VWR | 10545-854 | |
| Clear Tape | 3M | S-9783 | |
| Clear Vinyl Tubing, 3/8" ID | Watts | 443064 | |
| EGM-2 Endothelial Cell Culture Medium | Lonza | CC-3162 | |
| Ethanol | Pharmco-Aaper | 111000200 | |
| Flow Regulator | Dwyer | VFA-23-BV | |
| Gas Chromatograph | Varian | 450-GC | |
| Glass Syringe, 10 mL | Sigma-Aldritch | Z314552 | |
| Glass Syringe, 10 µL | Hamilton | 80300 | |
| High Vacuum Silicon Grease | Dow Corning | 146355D | |
| Hose Clamp | Precision Brand | 35125 | |
| Human Umbilical Vein Endothelial Cells | ATCC | PCS-100-013 | |
| Mass Spectrometer | Varian | 300-MS | |
| Midget Impinger | Chemglass | CG-1820-01 | |
| Neutral Red | Sigma-Aldritch | N4638 | |
| Paraffin Film | 3M | PM-992 | |
| Plate Seal Roller | BioRad | MSR0001 | |
| Plate Seal; Foil | Thermo | 276014 | |
| Ring Stand 20" | American Educational Products | 7-G15-A | |
| Solenoid Valve (normally open) | US Solid | USS2-00081 | |
| Solid State Relay | Digi-Key | CLA279-ND | |
| Stand Clamp | Eisco | CH0688 | |
| Syringe Filter, PES, 0.22 um | Millipore | SLGP033RS | |
| Syringe, 10 mL | BD Syringe | 309604 | |
| Through Hole Stopper, Size 6 | VWR | 59581-287 | |
| Vacuum Pump | KNF Neuberger | N86KTP |
Referencias
- World Health Organization. . WHO Report on the Global Tobacco Epidemic, 2011. , (2011).
- Weaver, S. R., Majeed, B. A., Pechacek, T. F., Nyman, A. L., Gregory, K. R., Eriksen, M. P. Use of electronic nicotine delivery systems and other tobacco products among USA adults, 2014: results from a national survey. Int. J. Public Health. 61 (2), 177-188 (2016).
- Singh, T., et al. Tobacco Use Among Middle and High School Students - United States, 2011–2015. MMWR Morb. Mortal. Wkly. Rep. 65 (14), 361-367 (2016).
- Corey, C. G., Ambrose, B. K., Apelberg, B. J., King, B. A. Flavored Tobacco Product Use Among Middle and High School Students--United States, 2014. MMWR Morb. Mortal. Wkly. Rep. 64 (38), 1066-1070 (2015).
- Pisinger, C., Døssing, M. A systematic review of health effects of electronic cigarettes. Prev. Med. 69, 248-260 (2014).
- Callahan-Lyon, P. Electronic cigarettes: human health effects. Tob. Control. 23 (Suppl 2), ii36-ii40 (2014).
- Dinakar, C., O'Connor, G. T. The Health Effects of Electronic Cigarettes. N. Engl. J. Med. 375 (14), 1372-1381 (2016).
- Anderson, C., Majeste, A., Hanus, J., Wang, S. E-cigarette aerosol exposure induces reactive oxygen species, DNA damage, and cell death in vascular endothelial cells. Toxicol. Sci. Off. J. Soc. Toxicol. , (2016).
- U.S. Department of Health and Human Services. . The Health Consequences of Smoking: 50 Years of Progress. A Report of the Surgeon General. , (2014).
- Farsalinos, K., et al. Comparison of the Cytotoxic Potential of Cigarette Smoke and Electronic Cigarette Vapour Extract on Cultured Myocardial Cells. Int. J. Environ. Res. Public. Health. 10 (10), 5146-5162 (2013).
- Schweitzer, K. S., et al. Endothelial disruptive proinflammatory effects of nicotine and e-cigarette vapor exposures. Am. J. Physiol. - Lung Cell. Mol. Physiol. 309 (2), L175-L187 (2015).
- Putzhammer, R., et al. Vapours of US and EU Market Leader Electronic Cigarette Brands and Liquids Are Cytotoxic for Human Vascular Endothelial Cells. PLOS ONE. 11 (6), e0157337 (2016).
- Crooks, I., Dillon, D. M., Scott, J. K., Ballantyne, M., Meredith, C. The effect of long term storage on tobacco smoke particulate matter in in vitro genotoxicity and cytotoxicity assays. Regul. Toxicol. Pharmacol. 65 (2), 196-200 (2013).
- Roemer, E., et al. Mainstream Smoke Chemistry and in Vitro and In Vivo Toxicity of the Reference Cigarettes 3R4F and 2R4F. Beitr. Zur Tab. Contrib. Tob. Res. 25 (1), (2014).
- International Organization for Standards. . ISO 3088:2012 Routine analytical cigarette smoking machine – Definitions and standard conditions. , (2012).
- World Health Organization. . Standard Operating Procedure for Intense Smoking of Cigarettes. , (2012).
- Brown, C. J., Cheng, J. M. Electronic cigarettes: product characterisation and design considerations. Tob. Control. 23 (Suppl 2), ii4-ii10 (2014).
- Cooperation Centre for Scientific Research Relative to Tobacco. . CRM No. 81 - Routine Analytical Machine for E-Cigarette Aerosol Generation and Collection - Definitions and Standard Conditions. , (2015).
- Thorne, D., Adamson, J. A review of in vitro cigarette smoke exposure systems. Exp. Toxicol. Pathol. 65 (7-8), 1183-1193 (2013).
- Klus, H., Boenke-Nimphius, B., Müller, L. Cigarette Mainstream Smoke: The Evolution of Methods and Devices for Generation, Exposure and Collection. Beitr. Zur Tab. Contrib. Tob. Res. 27 (4), (2016).
- Baker, R. The Development and Significance of Standards for Smoking-Machine Methodology. Beitr. Zur Tab. Contrib. Tob. Res. 20 (1), (2014).
- Thorne, D., Crooks, I., Hollings, M., Seymour, A., Meredith, C., Gaca, M. The mutagenic assessment of an electronic-cigarette and reference cigarette smoke using the Ames assay in strains TA98 and TA100. Mutat. Res. Toxicol. Environ. Mutagen. 812, 29-38 (2016).
- Thorne, D., Larard, S., Baxter, A., Meredith, C., Gaҫa, M. The comparative in vitro assessment of e-cigarette and cigarette smoke aerosols using the γH2AX assay and applied dose measurements. Toxicol. Lett. 265, 170-178 (2017).
- Herrington, J. S., Myers, C. Electronic cigarette solutions and resultant aerosol profiles. J. Chromatogr. A. 1418, 192-199 (2015).
- Yu, V., et al. Electronic cigarettes induce DNA strand breaks and cell death independently of nicotine in cell lines. Oral Oncol. 52, 58-65 (2016).
- Ji, E. H., et al. Characterization of Electronic Cigarette Aerosol and Its Induction of Oxidative Stress Response in Oral Keratinocytes. PLOS ONE. 11 (5), e0154447 (2016).
- Morgan, D. L., et al. Chemical Reactivity and Respiratory Toxicity of the -Diketone Flavoring Agents: 2,3-Butanedione, 2,3-Pentanedione, and 2,3-Hexanedione. Toxicol. Pathol. 44 (5), 763-783 (2016).
- Cooperation Centre for Scientific Research Relative to Tobacco. . CRM No. 84 - Determination of Glycerin, Propylene Glycol, Water, and Nicotine in the Aerosol of E-Cigarettes by Gas Chromatographic Analysis. , (2017).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados