A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
Nanosensors כדי לאתר פרוטאז פעילות In Vivo אבחון לא פולשנית
In This Article
Summary
פרוטאזות הם מוסדרים בחוזקה אנזימים המעורבים התהליכים הביולוגיים הבסיסיים, והתקדמות dysregulated פרוטאז פעילות כוננים של מחלות מורכבות כגון סרטן. בשיטה זו המטרה היא ליצור nanosensors המודדים פרוטאז פעילות ויוו על ידי ייצור לאות המחשוף שקיימים משתן מארח ומפלה המחלה.
Abstract
פרוטאזות הם אנזימים תפקודי מתמחים הידרוליזה של חלבון שליטה ובקרה רחבה תהליכים ביולוגיים כולל הומאוסטזיס ו- allostasis. יתר על כן, dysregulated פרוטאז פעילות כוננים פתוגנזה ומהווה סמן פונקציונלי של מחלות כמו סרטן; לכן, היכולת לזהות פרוטאז פעילות ויוו עשויים לספק מידע הרלוונטית קלינית למחקר ביו-רפואי. המטרה של פרוטוקול זה היא ליצור nanosensors זה מנצלים פרוטאז פעילות ויוו על ידי ייצור אות הניתנת לכימות בשתן. אלה nanosensors פרוטאז מורכב משני רכיבים: ננו-חלקיק בעלת המצע. הפונקציות nanoparticle כדי להגדיל את זרימת הדם half-life, המצע משלוח לאתרים המחלה היעד. המצע הוא רצף פפטיד קצר (6-8 AA), אשר נועד להיות ספציפי פרוטאז היעד או לקבוצה של פרוטאזות. המצע היא מצומדת השטח של ננו-חלקיק, על-ידי כתב, כגון סמן פלורסנט, לצורך זיהוי. כפי dysregulated פרוטאזות קליב המצע פפטיד, הכתב סוננו לתוך השתן על כימות כמו סמן של פעילות פרוטאז. במסמך זה אנו מתארים את בניית ננו-חיישן עבור מטריקס מטאלו-פרוטאינאז 9 (MMP9), אשר מזוהה עם התקדמות הגידול, גרורות, גילוי של סרטן המעי הגס במודל של עכברים.
Introduction
פרוטאזות הם אנזימים תפקודי מתמחים הידרוליזה של אג ח פפטיד, יש שליטה משמעותית על תהליכים ביולוגיים רבים, כולל הומאוסטזיס, allostasis של המחלה1. יש כבר בקורלציה מצב פעילות פרוטאז למגוון רחב של מחלות, כולל סרטן ומחלות לב וכלי דם, שהופך מועמדים אטרקטיביים פרוטאזות פיתוח לתוך סמנים קליניים2,3. יתר על כן, פעילות פרוטאז היא פונקציונלית מקושר ברורים pathogeneses, תוצאות המטופל ואת הפרוגנוזה של המחלה4. באופן כללי, ביולוגיים פותחו כדי לזהות תופעות ביולוגיות שונות ומעבד מחלות, כגון סרטן, מחלות ניווניות, העברת-אלקטרונים5,-6,-7,-8 , 9. ליתר דיוק, חיישנים פרוטאז המבוסס על המצע יש פותחה כדי לזהות פעילות פרוטאז, כולל fluorogenic זונדי אבחון הדמיה10 , isotopically עם התווית פפטיד מצעים עבור חוץ גופית בתוך הזיהוי באמצעות ספקטרומטר מסה11. בנוסף, המבוסס על פעילות הגששים פותחו, אשר מכילים אזורים כמו המצע לקשור או לשנות את היעד פרוטאז12. בשיטה זו, היעד פרוטאז מעוכבת בלתי הפיך כאשר האתר הפעיל הוא שונה, שדורש ניתוח קצירת רקמות, אשר מגביל את היישומים ויוו . עם זאת, חשוב לחוש פרוטאז פעילות ויוו, כי ויסות פעילות פרוטאז תלויה במידה רבה בהקשר של פעילויות ביולוגיות אחרות כגון הנוכחות של מעכבי אנדוגני.
מטרת עבודה זו היא לתאר את ניסוח של nanosensors מבוססי פעילות המאתרות פרוטאז פעילות ויוו על ידי ייצור אות מדיד בשתן. פלטפורמה זו משמשת בדיקה לא פולשנית להפלות מורכבים מחלות כמו סרטן באמצעות פעילות פרוטאז dysregulated כמו סמן פונקציונלי. הפלטפורמה ננו-חיישן שלנו מורכב חלקיקי תחמוצת ברזל (IONP) מצומדת כדי פרוטאז סובסטרטים. מצעים אלה מנוטרלים על ידי עיתונאי פלורסנט אשר שוחרר כאשר פרוטאזות קליב המצע IONPs אלה הפיצו ויוו, בתרגום אתרי המחלה ולחשוף סובסטרטים כדי פרוטאזות הקשורים במחלה פעילה. לאחר מחשוף, כתבים פלורסנט משתחררים, בשל גודלם הקטן, מסוננים לתוך השתן, בעוד סובסטרטים uncleaved על IONP להישאר בגוף. לכן, תגרום לעלייה פרוטאז פעילויות ויוו ריכוז גבוה של הכתב בשתן (איור 1). מאז הפלטפורמה שלנו היא בדיקת שתן, אין פלטפורמה הדמיה נדרש, אותות אבחון מועשרים בשתן.
פלטפורמה זו ניתן לתכנן לאיתור מגוון רחב של מחלות כולל סרטן, פיברוזיס של פקקת13,14 כאן נתאר את העיצוב של nanosensors לזהות הגבהים metallopeptidase מטריקס 9 (MMP9) פעילות כמו סמן של סרטן המעי הגס. סרטן המעי הגס הוא הסיבה המובילה השניה מקרי המוות מסרטן בארצות הברית, עם מקרים חדשים 136,800 משוער ותמותה 50,300 בשנת 2014 לבד15. גידול המעי הגס מפרישים MMP9, אשר הוכח לנהוג התקדמות ממאיר, מטריקס השפלה, כמו גם גרורות16. בנוסף, זיהינו מצע מתאים פפטיד (PLGVRGK) עבור MMP9 מן הספרות ה-17. פלטפורמה זו עשויה לשמש עבור גילוי מוקדם של סרטן, בעלות נמוכה בשלב של טיפול אבחון13,14,18,19,20,21.
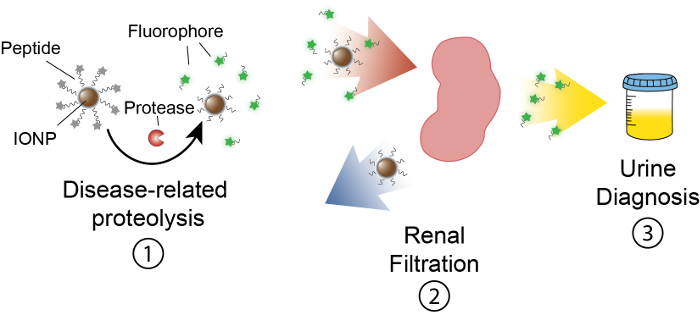
איור 1: סכימטי של ננו-חיישן פעילות vivo ב. Nanosensors לזרום דרך הגוף, בתרגום אתרים של המחלה. לאחר מכן, פרוטאזות הקשורים למחלות קליב סובסטרטים פפטיד שהוצגו על-ידי IONPs. הגודל של שברי cleaved מאפשר סיווג הכליה, גורם להם להתאים לשפה בשתן. אחרי החיה משתין, ניתן לנתח קטעים פפטיד אלה על ידי מולקולה הכתב שלהם. אנא לחץ כאן כדי להציג גירסה גדולה יותר של הדמות הזאת.
Protocol
אישור מוסדי אכפת לי חיה מוסדיים ועל שימוש הוועדה (IACUC) במוסד של החוקר יש צורך לבצע את הניסויים בבעלי חיים הבאים. בנוסף, מתקני טיפול בבעלי חיים רגיל (למשל, דיור צ'יימברס, וקולטי בעלי חיים סטרילי, לשכות isofluorane ההרדמה ו CO2 לשכות euthanization קצה אתית) יש צורך לבצע כראוי את אלה ניסויים. ניתן לספק הכשרה מיוחדת וסיוע עם מתקנים אלה על-ידי פיזיולוגיים מחקר מעבדה (PRL) במוסד אחד. כל העבודה בעלי חיים אושרה על-ידי IACUC ג'ורג'יה טק (פרוטוקול: A14100).
1. תחמוצת ברזל סינתזה ננו-חלקיק (IONP)
הערה: בטיחות: הסינתזה תחמוצת ברזל Nanoparticle כולה צריכה להתבצע באמצעות ציוד מגן אישי, מתחת כימית מנדף.
- צינור חרוטי 15 מ"ל, מקררים מ 1 ל 30% אמוניום מימה ב דלי קרח למשך 30 דקות.
- לשטוף 250 מ ל Erlenmeyer את הבקבוק עם מים יונים ולהוסיף 10 מ"ל מים מזוקקים כפול (ddH2O). להטביע החיצוני של הבקבוק באמבט קרח נח על צלחת מערבבים/חום. להשתמש על פיפטה פלסטיק זרימת N2 גז לתוך ddH2O ב- הבקבוקון. בועה במשך 15 דקות עם N2 כדי deoxygenate.
- שוקל µmol 224 (4.5 גרם) של לתוספי (משקל מולקולרי (MW) = 20 kDa) לתוך צינור חרוטי 50 מ ל. הוסף H2O כך שאמצעי האחסון הסופי של התערובת, כולל את לתוספי, 20 מ"ל. מערבולת נמרצות כדי להמיס את לתוספי.
- שוקל µmol 290 (78.5 גרם) של iron(III) כלוריד hexahydrate, להוסיף לתוספי פתרון של מערבולת להתמוסס.
- לסנן הפתרון שיתקבל דרך מסנן 0.2 µm.
- להעביר 1 מ"ל מקורר אמוניה מימית 9 מ של דם לא מחומצן המים. לחזור 4 ° C.
- שוקל µmol 367 (73.0 גרם) של iron(II) כלוריד tetrahydrate, להמיס 1 מ"ל של ddH ללא חמצן-2O, לסנן דרך מסנן 0.2 µm.
- להעביר את הפתרון dextran-iron(III) 250 מ ל Erlenmeyer את הבקבוק, deoxygenate עם N2 במשך 15 דקות על קרח. מערבבים עם מהומה מגנטי בר ספינינג בשעה 1600 סיבובים בדקה.
- כדי ליצור אווירה חנקן הומוגנית, קאפ את הבקבוק עם מחיצת גומי. לנקב במחיצה עם-18 למדוד המחט זרימת N2 לתוך הבקבוק. להוסיף מחט נפרדת מד 18 פורקן זרימה.
- להוסיף µL 467 של הפתרון iron(II) הפתרון dextran-iron(III) עם מזרק 1 מ"ל, לערבב עם בר מגנטי stir ב 1600 סיבובים בדקה. היחס הזה של iron(II) כדי iron(III) גורמת לתגובה מאוזנת אשר יפיקו מגנטיט או Fe3או4.
- הוסף שצוננת לדלל אמוניה מימית dropwise לתוך הפתרון לתוספי ברזל (II) - ברזל (III) - ליזום את התהליך התגרענות21. ודא כי לכל droplet מתערבב היטב לפני שחרור אחרת. סיום התגובה לאחר התוספת של 1-2 מ של. אמוניה מימית.
- לעצור את הזרימה של N2 ולהסיר מחצה גומי. הסר את אמבטיית קרח והחלף אמבט של מים חמים, תוך לעורר את הפתרון. לוודא הטמפרטורה של הפתרון יגיע 75 ° C, תקופת דגירה של 75 דקות.
- הסר את הבקבוקון מהצלחת חמות/מערבבים, כפליים לסנן את הפתרון באמצעות מיקרומטר ואז 0.1 0.2 µm מסננים כדי להסיר חלקיקי גס.
- מאגר exchange החלקיקים לתוך ddH2O, באמצעות 100 משקל מולקולרי kDa לחתוך את ריכוז (m.w.c.o.) כדי להסיר עודפי לתוספי הפתרון, שאמור להיות מאוד צמיגה. החלפת מסננים אם הזרימה נשאר שחור גם אחרי 2-3 מהדורות, המציינת כי ייתכן לשבור המסנן.
- מאגר exchange עם ספין מסננים, צנטריפוגה ב 4 ° C ב 4800 X g למשך 15 דקות, למחוק את הזרימה דרך, ולהוסיף למאגר הפתרון IONP. חזור על 3 - 5 פעמים.
- לקבוע את הריכוז של חלקיקים שימוש בקורא ספקטרופוטומטרים/צלחת. לקחת מדידות ספיגת-400 nm ושימוש absorptivity טוחנת של IONP ובאורך הגל הזה (חדוה = 2.07 x 106 ס מ-1 מ'-1) כדי לקבוע את הריכוז של קלט/פלט חלקיקים.
- Resuspend את IONPs כדי 10 מ"ג/מ"ל ב- ddH2O (בדרך כלל הנפח הכולל הוא ~ 3 מ ל), הקפד להשתמש צינורות פוליפרופילן בשלב זה לתאימות כימי. להוסיף 1.6 כרכים של 5 M NaOH ולאחר מכן להוסיף 0.65 כרכים של epichlorohydrin. מערבבים בקפדנות על צלחת מטרף בטמפרטורת החדר במשך 12 שעות כדי לתוספי crosslink.
- השתמש מזרק 20 מ עם מחט בקוטר 18 להעביר את הפתרון IONP לתוך קרום דיאליזה 50 kDa m.w.c.o.. למקם את קרום דיאליזה 4 L ddH2O ולהחליף H2O כמה פעמים (כל 2-3 שעות). דגירה בין לילה.
- למדוד את הריכוז ולהביא IONPs 5 מ"ג/מ"ל (ראה שלב 1.15). הוספת אמוניה מימית כדי להגיע 20% (v/v), לנער בטמפרטורת החדר > 12 שעות כדי aminate את פני השטח של IONPs. מאגר exchange באמצעות 30 kDa m.w.c.o. מסננים (ראה 1.14).
- לכוון את עוצמת הקול עד 2.5-3.5 מ"ל לפני טיהור סופית על ידי מהר חלבון כרומטוגרפיה נוזלית (FPLC; ראה טבלה של חומרים עבור עמודה סינון ג'ל).
- השתמש פיזור אור דינאמי (DLS) כדי לקבוע את הרדיוס hydrodynamic של IONPs (לטווח הצפוי 10-100 ננומטר, גודל ממוצע 40-50 ננומטר). עושים זאת על ידי aliquoting 1 מ"ל של 100 X מדולל מדגם IONP cuvette, למקם את המחשב ולהשתמש התוכנה של היצרן לקחת את המידה.
הערה: מכלל האוכלוסייה של IONPs יהיה בין 10 ו- 100 ננומטר על ידי מדידות DLS, אך הרוב המכריע של האוכלוסייה הוא סביב הקוטר ממוצעת, אשר נע בין 40-50 ננומטר. אם אדם רוצה להגביל את הטווח בגודל, אחד באפשרותך להשתמש בגודל אי-הכללה של כרומטוגרפיה נוספת כדי לבודד שברים עם קטרים שונים. IONPs צריך להיות מאוחסן ב 4 º C.
2. פפטיד עיצוב, ההטיה IONP ולאחר אימות במבחנה
- לסנתז מצע פפטיד (למשל, על ידי מתקן ליבה או מסחרית) עבור פרוטאז היעד עם הכתב פלורסנט של N-מסוף כגון Fluorescein isothiocyanate (FITC) משקע ציסטאין מסוף C כדי לאפשר צימוד בתיווך תיול.
הערה: במקרה של מחקר זה עבור MMP9, פפטיד בשימוש היה FITC-PLGVRGK-C, עם kהחתול/Km ~ 2.0 x 105 ז-1s-1. - Aliquot 0.5 מ ג של IONP (ב 1 מ"ג/מ"ל), מאגר exchange לתוך צימוד מאגר (50 מ מ נתרן בוראט עם 1 מ מ EDTA, pH = 8.5) באמצעות 10 kDa m.w.c.o. ספין לסנן (ראה שלב 1.14).
- להמיס Succinimidyl iodoacetate (SIA) dimethylformamide (DMF) כדי להגיע ריכוז ~ 30 מ"ג/מ"ל, ולהוסיף SIA IONP ביחס השומה של 500 SIA:IONP.
הערה: SIA הוא heterobifunctional צלב מקשר המעביר צימוד של אמינים על IONPs לקבוצות sulfhydryl על המצע פפטיד. - תקופת דגירה של 1-2 שעות בטמפרטורת החדר בחושך. אם עוזב בן לילה, דגירה ב 4 º C.
- מאגר exchange באמצעות מסנן ספין 10 kDa m.w.c.o. לתוך צימוד המאגר כדי להסיר unreacted SIA (ראה שלב 1.14).
- להביא את הפתרון המוצר הסופי 1 מ"ג/מ"ל (0.5 mL פתרון). מערבבים את פפטיד עניין ביחס טוחנת של תהלים צ' א (פפטיד: IONP) עם 20 kDa המסתיימת תיול פוליאתילן גליקול (PEG) ביחס של שן טוחנת של 20:1 (פג: IONP). מערבבים את פתרון פפטיד-יתד זה עם IONP.
- דגירה ללילה בטמפרטורת החדר על מטרף צלחת על מהירות הגבוהה ביותר, כיסוי צינורות בנייר כדי למנוע photobleaching של מולקולות פלורסנט.
- הוסף L-ציסטאין ביחס טוחנת של 500:1 (C:IONP) כדי לנטרל. את כל המולקולות SIA unreacted. תקופת דגירה של 1 שעה 25 ° c-מטרף במהירות הגבוהה ביותר בטמפרטורת החדר.
- לטהר ויה FPLC (ראו 1.1.19). השתמש ספקטרופוטומטרים כדי למדוד את ספיגת של הפתרון מדגם ולחשב את היחס פפטיד: IONP על פי הבאות. לאחר טיהור, לאחסן את המוצר לפי 1 מ"ג/מ"ל ב 4 ° C ב- PBS.
- להשתמש ספקטרופוטומטרים כדי למדוד את ספיגת של הפתרון מדגם 400 nm (לדוגמה, 400), אורך הגל של ספיגת המרבי עבור fluorophore משתמשים בו, אשר הוא 488 ננומטר עבור FITC (לדוגמה, 488). למדוד את ספיגת של פתרון IONP אמין מניות ב זהה בין שני אורכי הגל (400 nm ו 488 ננומטר), אשר מיוצגים בהתאמה שלNP, 400 ו שלNP, 488.
- השתמש משוואות 1 ו- 2 כדי לחשב את מנורמל A400 וערכים488 .
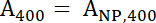 משוואה 1
משוואה 1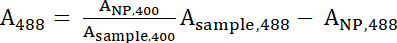 משוואה 2
משוואה 2 - 400 ו של488 מייצג את הערכים המנורמל של המדגם. השתמש בערכים אלה כדי לחשב את היחס בין פפטיד: IONP עם משוואה 3.
 משוואה 3
משוואה 3 - איפה
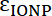 ,
, 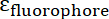 הם absorptivities טוחנת את IONP, את fluorophore, בהתאמה. עבור החלקיקים
הם absorptivities טוחנת את IONP, את fluorophore, בהתאמה. עבור החלקיקים 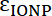 = 2.06 x 106 מ-1ס מ-1 , FITC
= 2.06 x 106 מ-1ס מ-1 , FITC 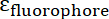 = 72,000 מ-1ס מ-1, אז הערך של
= 72,000 מ-1ס מ-1, אז הערך של  צריך להיות 28.75. פפטיד טיפוסי: IONP יחס צריך להיות בטווח של 20:1 ל 50:1.
צריך להיות 28.75. פפטיד טיפוסי: IONP יחס צריך להיות בטווח של 20:1 ל 50:1.
- אמת הפונקציונליות של הגששים על ידי ביצוע של assay המחשוף במבחנה .
- עם PBS (1% BSA), להפוך את פתרון nanoparticle 18 µL עם 200 nM ריכוז של פפטיד. מערבבים עם 2 µL של פרוטאז עניין (MMP9; 0.1 - 1 מ"ג/מ"ל).
- דגירה של קורא צלחת ב 37 מעלות צלזיוס במשך שעה, פלורסצנטיות מדידה (באמצעות המתאימים עירור פליטה אורכי גל, אשר הם 485 nm ו 528 nm עבור FITC, בהתאמה) כל 1-2 דקות כדי לפקח על המחשוף.
3. מינהל Nanosensors וזיהוי שתן של סרטן
הערה: לקבלת פרטים נוספים על הדגם דוגמה, ראה דו ח הקודם שלנו13.
- ליצור כלוב מטבולית לאיסוף שתן באמצעות אבטחת שרוול גלילי לחלק העליון של צלחת טוב 96. במהלך איסוף שתן, במקום עכבר בתוך השרוול מכסה עם כיסוי פטרי כדי למנוע בריחה של החיה.
- הכן פתרון הזרקה (200 נפח מרבי µL) המכילה nanosensors-ריכוז של 3000 מ"ג/ק"ג (~ 50 µmol) באמצעות פפטיד בתוך תמיסת מלח סטרילית.
- בעכברים הנשי, 8 - בן שבועיים, עירום הנושאת את xenograft LS174T גידולים המעי הגס-נטל של ~ 100-300 מ מ3, אשר צריך להתרחש על יום 10, לנהל ננו-חיישן פתרון באמצעות הזרקת וריד הזנב. מיד לאחר ההזרקה, להכניס עכברים בתוך כלובים מטבוליים ושים לב בזמן ההזרקה עבור כל עכבר.
- ב- 60-90 דקות לאחר ההזרקה, הסר שרוול גלילי 96-ובכן צלחת. לרסן את העכבר והפעילו לחץ קל על שלפוחית השתן לזירוז עכברים כדי לשלול כל השתן הנותר לצלחת. איסוף שתן (200-500 µL).
- לנתח דגימות שתן ידי immunoprecipitation כדי לטהר FITC מן השתן להגביר את הרגישות. השתמש beads מגנטי בשילוב עם נוגדנים אנטי-FITC.
- ראשית, לשטוף 25 מ ג של חרוזים מגנטי 3 פעמים עם ציפוי מאגר, ולהביא את עוצמת הקול הסופי 225 µL.
הערה: חשוב להכין את מאגר ציפוי (0.1 M נתרן בוראט, pH 9.5), מאגר חסימה (PBS, 0.5% BSA, 0.05% Tween-20, pH 7.4), מאגר כביסה (PBS BSA 0.1%, 0.05% Tween-20, pH 7.4) טרי שכל הזמן, כ 20 מ ל כל אחד הכרחי. - להוסיף 200 µL של אנטי-FITC (5 מ"ג/מ"ל) ו- µL 200 של אמוניום סולפט (3 מ'). תקופת דגירה של 16-24 שעות ב 37 C-מסובב.
- להוסיף את הפתרון מפריד מגנטי, להסיר את תגובת שיקוע, החלף 625
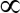 Λ חוסם מאגר, דגירה ב 37 צלזיוס למשך הלילה. ואז לשטוף 3 פעמים עם שטיפת מאגר ולאחסן במאגר שטיפת 1.25 מ.
Λ חוסם מאגר, דגירה ב 37 צלזיוס למשך הלילה. ואז לשטוף 3 פעמים עם שטיפת מאגר ולאחסן במאגר שטיפת 1.25 מ. - דגירה µL 2 של שתן עם 5 µL של beads מגנטי (20 מ"ג/מ"ל) ולהביא הנפח הכולל כדי µL 50 עם PBS (0.01% Tween 20). תקופת דגירה של 60 דקות.
- תשטוף פעמיים עם 50 µL PBS (0.01% Tween 20) באמצעות מפריד מגנטי כדי לאסוף beads מגנטי לשטוף אחרי זה.
- Elute פעמיים עם 32.5 µL של חומצה אצטית 5%. לנטרל במאגר • תנאי (70 µL) עם µL 35 של 2 מ' טריס להשגת pH הסופי של ~ 7.
- לקרוא על קורא צלחת (ראה טבלה של חומרים) באורכי גל המתאימים עירור, פליטה לכמת שתן קרינה פלואורסצנטית. לחשב את הריכוז של פלורסנט כתב נגד סולם של ריכוזים ידועים של fluorophore חינם.
- ראשית, לשטוף 25 מ ג של חרוזים מגנטי 3 פעמים עם ציפוי מאגר, ולהביא את עוצמת הקול הסופי 225 µL.
תוצאות
הרוב המכריע של האוכלוסייה IONPs הוא סביב הקוטר ממוצעת, אשר נע בין 40-50 ננומטר. אחרי pegylation, הטווח בגודל זה יש מחזור זמן מחצית חיים של 6 שעות13 ויוו (ראה איור 2 א). אם אדם רוצה לבחור את טווח בגודל מסוים, אחד באפשרותך להשתמש בגודל אי-הכללה של כרומטוג?...
Discussion
שיטה זו מתארת את התפתחות nanosensors מבוססי פעילות בהיקף של סובסטרטים פרוטאז מצומדת אל ליבה של ננו-חלקיק. האירוע של פצילות הפרוטאוליטי שכונתה "הבורר פרמוקוקינטיים", כי פפטיד cleaved מוצרים קטנים יותר ממגבלת גודל הכליות סינון של 5 nm23 ו מסנן לתוך השתן כדי לייצר אות לא פולשנית. לכן, חשוב לה...
Disclosures
ד ר וואנג הנו מייסד, והוא משמש יועץ ביו Glympse, אשר מפתחת מוצרים הקשורים המחקר המתואר במאמר זה. מחקר זה עשוי להשפיע על מעמדם הכלכלי האישי שלו. תנאי ההסדר הזה יש כבר נבדקו ואושרו על-ידי ג'ורג'יה טק מדיניותה ניגוד אינטרסים
Acknowledgements
עבודה זו מומן על ידי פרס חדשן חדשה (פרס מס ' של מנהל NIH DP2HD091793). Q.D.M. נתמך על ידי ה-NSF מחקר מלגות לתוכנית לבוגרים (מענק מס ' DGE-1650044). B.A.H נתמך על ידי נבחרת מוסדות של בריאות GT BioMAT אימונים המענק תחת מספר פרס 5T32EB006343, כמו גם מלגת הנשיא ג'ורג'יה טק. G.A.K. מחזיק פרס הקריירה ב הממשק מדעי מהקרן ברוכים הבאים בורוז. התוכן הוא אך ורק באחריות המחברים, ואינם מייצגים בהכרח את הנופים הרשמי של מכוני הבריאות הלאומיים.
Materials
| Name | Company | Catalog Number | Comments |
| 0.2 µm syringe filters | VWR | 4652 | |
| 18G needle | VWR | 89134-024 | |
| 15 mL conicals | VWR | 89039-670 | |
| 250 mL Erlenmeyer flask | VWR | 89000-362 | |
| Stir bar | VWR | 58949-006 | |
| Hot Plate/Magnetic Stirrer | VWR | 97042-634 | |
| Glacial acetic acid | VWR | 97064-482 | |
| Albumin from Bovine Serum (BSA) | Thermo Fisher | A13100 | |
| Iron (III) chloride hexahydrate | Sigma | 236489 | |
| Iron (II) chloride tetrahydrate | Sigma | 44939 | |
| Epichlorohydrin | Sigma | 45340-500ML-F | |
| DMF | Sigma | D4551 | |
| Ammonium Hydroxide | Sigma | 320145-500ML | |
| Sodium Hydroxide pellets | Sigma | 221465-500G | |
| EDTA | Sigma | E9884 | |
| Sodium Borate | Sigma | B9876 | |
| L-Cysteine | Sigma | 168149-100G | |
| Tris-HCl | Sigma | T5941 | |
| Tris base | Sigma | T6066 | |
| PBS tablets | Sigma | P4417 | |
| Dextran | Pharmacosmos | 5510 0020 9006 | |
| Amicon 15 mL 10k filters, 24 pk | Millipore | UFC901024 | |
| Amicon 15 mL 30k filters, 24 pk | Millipore | UFC903024 | |
| Amicon 15 mL 100k filters, 24 pk | Millipore | UFC910024 | |
| Zetasizer Nano ZS | Malvern Panalytical | NanoZS | |
| Slide-A-Lyzer Dialysis Cassette | LifeTech | 66130 | |
| Dynabeads MyOne Tosylactivated | LifeTech | 65501 | |
| SIA | Life Tech | 22349 | |
| PEG 20k | Laysan Bio | MPEG-SH-20K-1g | |
| Fluorescein Antibody [2A3] | GeneTex | GTX10257 | |
| Hiload 16/600 superdex 200 | GE Healthcare | 45-002-490 | |
| Plate Reader | Fisher | BTCYT5M | |
| BD Insulin Syringes | Fisher | NC0872854 |
References
- Lopez-Otin, C., Bond, J. S. Proteases: Multifunctional enzymes in life and disease. Journal of Biological Chemistry. 283 (45), 30433-30437 (2008).
- Hua, Y., Nair, S. Proteases in cardiometabolic diseases: Pathophysiology, molecular mechanisms and clinical applications. Biochimica et Biophysica Acta. 1852 (2), 195-208 (2015).
- Koblinski, J. E., Ahram, M., Sloane, B. F. Unraveling the role of proteases in cancer. Clinica Chimica Acta. 291 (2), 113-135 (2000).
- Lilja, H., Vickers, A., Scardino, P. Measurements of proteases or protease system components in blood to enhance prediction of disease risk or outcome in possible cancer. Journal of Clinical Oncology. 25 (4), 347-348 (2007).
- Jin, H., et al. Flexible surface acoustic wave resonators built on disposable plastic film for electronics and lab-on-a-chip applications. Scientific Reports. 3, 2140 (2013).
- Ma, W., Liu, H. -. T., Long, Y. -. T. Monitoring dopamine quinone-induced dopaminergic neurotoxicity using dopamine functionalized quantum dots. ACS Applied Materials & Interfaces. 7 (26), 14352-14358 (2015).
- Zhang, W. -. H., Ma, W., Long, Y. -. T. Redox-mediated indirect fluorescence immunoassay for the detection of disease biomarkers using dopamine-functionalized quantum dots. Analytical Chemistry. 88 (10), 5131-5136 (2016).
- Ma, W., et al. Investigating electron-transfer processes using a biomimetic hybrid bilayer membrane system. Nature Protocols. 8 (3), 439-450 (2013).
- Holt, B. A., et al. Fc microparticles can modulate the physical extent and magnitude of complement activity. Biomaterials science . 5, 463-474 (2017).
- Edgington, L. E., Verdoes, M., Bogyo, M. Functional imaging of proteases: Recent advances in the design and application of substrate-based and activity-based probes. Current Opinion in Chemical Biology. 15 (6), 798-805 (2011).
- Kleifeld, O., et al. Identifying and quantifying proteolytic events and the natural N terminome by terminal amine isotopic labeling of substrates. Nature Protocols. 6 (10), 1578-1611 (2011).
- Sanman, L. E., Bogyo, M. Activity-based profiling of proteases. Annual Review of Biochemistry. 83 (1), 249-273 (2014).
- Kwong, G. A., et al. Mass-encoded synthetic biomarkers for multiplexed urinary monitoring of disease. Nature Biotechnology. 31 (1), 63-70 (2013).
- Dudani, J. S., Buss, C. G., Akana, R. T. K., Kwong, G. A., Bhatia, S. N. Sustained-release synthetic biomarkers for monitoring thrombosis and inflammation using point-of-care compatible readouts. Advanced Functional Materials. 26 (17), 2919-2928 (2016).
- Meester, R. G. S., et al. Public health impact of achieving 80% colorectal cancer screening rates in the United States by 2018. Cancer. 121 (13), 2281-2285 (2015).
- Mehner, C., et al. Tumor cell-produced matrix metalloproteinase 9 (MMP-9) drives malignant progression and metastasis of basal-like triple negative breast cancer. Oncotarget. 5 (9), 2736-2749 (2014).
- Bremer, C., Tung, C. H., Weissleder, R. In vivo molecular target assessment of matrix metalloproteinase inhibition. Nature Medicine. 7 (6), 743-748 (2001).
- Warren, A. D., et al. Disease detection by ultrasensitive quantification of microdosed synthetic urinary biomarkers. Journal of the American Chemical Society. 136 (39), 13709-13714 (2014).
- Warren, A. D., Kwong, G. A., Wood, D. K., Lin, K. Y., Bhatia, S. N. Point-of-care diagnostics for noncommunicable diseases using synthetic urinary biomarkers and paper microfluidics. Proceedings of the National Academy of Sciences of the United States of America. 111 (10), 3671-3676 (2014).
- Kwong, G. A., et al. Mathematical framework for activity-based cancer biomarkers. Proceedings of the National Academy of Sciences of the United States of America. 112 (41), 12627-12632 (2015).
- Dudani, J. S., Jain, P. K., Kwong, G. A., Stevens, K. R., Bhatia, S. N. Photoactivated spatiotemporally-responsive nanosensors of in vivo protease activity. ACS Nano. 9 (12), 11708-11717 (2015).
- Palmacci, S., Josephson, L. Synthesis of polysaccharide covered superparamagnetic oxide colloids. US patent. , (1991).
- Choi, H. S., et al. Renal clearance of nanoparticles. Nature Biotechnology. 25 (10), 1165-1170 (2007).
- Harris, T. J., von Maltzahn, G., Derfus, A. M., Ruoslahti, E., Bhatia, S. N. Proteolytic actuation of nanoparticle self-assembly. Angewandte Chemie (International edition in English). 45 (19), 3161-3165 (2006).
- Kwon, E. J., Dudani, J. S., Bhatia, S. N. Ultrasensitive tumour-penetrating nanosensors of protease activity. Nature Biomedical Engineering. 1, (2017).
- Villanueva, J., Nazarian, A., Lawlor, K., Tempst, P. Monitoring Peptidase activities in complex proteomes by MALDI-TOF mass spectrometry. Nature Protocols. 4 (8), 1167-1183 (2009).
- Villanueva, J., et al. Differential exoprotease activities confer tumor-specific serum peptidome patterns. The Journal of Clinical Investigation. 116 (1), 271-284 (2006).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved