Method Article
Markierungsfreie Imaging der einzelnen Proteine abgesondert von lebenden Zellen über iSCAT Mikroskopie
In diesem Artikel
Zusammenfassung
Wir präsentieren ein Protokoll für die Echtzeit-optische Erkennung von einzelnen unbeschriftete Proteine, wie sie von lebenden Zellen abgesondert werden. Grundlage hierfür ist interferometrischen Streuung (iSCAT) Mikroskopie, die auf eine Vielzahl von unterschiedlichen biologischen Systemen und Konfigurationen angewendet werden können.
Zusammenfassung
Wir zeigen interferometrischen Streuung (iSCAT) Mikroskopie, eine Methode in der Lage, einzelne unbeschriftete Proteine aus einzelnen lebenden Zellen in Echtzeit abgesondert zu erkennen. In diesem Protokoll decken wir die grundlegenden Schritte, um eine iSCAT Mikroskop erkennen und ergänzen es mit zusätzlichen bildgebenden Sendern, die Lebensfähigkeit einer Zelle unter Studie zu überwachen. Im Anschluss daran verwenden wir die Methode für Echtzeit-Erkennung von einzelnen Proteinen, wie sie von einer lebenden Zelle abgesondert werden, die wir mit einem verewigt B-Zell-Linie (Laz388) zeigen. Notwendigen Schritte in Bezug auf die Vorbereitung des Mikroskops und Probe sowie die Analyse der aufgezeichneten Daten werden diskutiert. Das video Protokoll zeigt, dass iSCAT Mikroskopie bietet eine einfache Methode um Sekretion der Einzelmolekül-Ebene zu untersuchen.
Einleitung
Sekretierten Proteine spielen eine bedeutende Rolle in verschiedenen physiologischen Prozesse1. Aus diesem Grund werden sie routinemäßig als eine kollektive Ensemble (Proteomics) oder als einzelne Elemente2,3untersucht. Proteomics untersucht traditionell die Gesamtheit der Proteine in einem bestimmten biologischen System durch z. B. Enzym-linked Immunosorbentprobe Assays (ELISA), Durchflusszytometrie oder Massenspektrometrie4,5, 6. Einzelne Proteine, auf der anderen Seite, werden in der Regel erkannt mit einer Vielzahl von Techniken, die auf Fluoreszenz7,8, Plasmonik9,10oder kryogene Elektron11 Microscopies. Alle diese Techniken verwenden komplexe Instrumente, Kennzeichnung, oder beides und oft keine Dynamik Informationen, wie sie nur langfristige Informationen zum System unter Studie liefern.
Hier verwenden wir iSCAT12,13 Mikroskopie, Sinn einzelne Sekretorische Proteine mit unter einer Sekunde zeitlicher Auflösung14. Wichtig ist, erkennt die Technik der verstreuten schwach untrennbar mit jedem Protein12,14. Die Lichtmenge, die eine kleine Bioparticle streut skaliert mit der Polarisierbarkeit. Geht man davon aus, dass die Form eines Proteins durch eine effektive Streuung Kugel14,15,16, und dass verschiedene angenähert werden kann kann Proteine haben sehr ähnliche Brechungsindizes, das gemessene Signal direkt das Molekulargewicht (MW) des Proteins verbunden. Die empirischen Kalibrierung des iSCAT Kontrast im Vergleich zu Molekulargewicht von Referenzmessungen erlaubt es, Proteine in verschiedenen Größen zu unterscheiden. iSCAT Experimente können leicht durch Fluoreszenz-Mikroskopie17,18, Immunosorbentprobe Reagenzien sowie fluoreszierende oder Streuung Etiketten ermöglichen eine spezifische Erkennung von jedem Protein des Interesses14 ergänzt werden , 17 , 19.
Im Prinzip funktioniert iSCAT durch die Verstärkung des Proteins schwach gestreute Licht über interferometrischen mischen mit einer sekundären Referenz-Welle. Die ermittelte Intensität (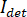 ) in eine iSCAT Mikroskop wird beschrieben durch
) in eine iSCAT Mikroskop wird beschrieben durch
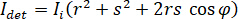
wo 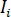 ist die einfallende Intensität,
ist die einfallende Intensität,  ist ein Koeffizient für den Beitrag der Referenz-Welle
ist ein Koeffizient für den Beitrag der Referenz-Welle  steht für die Stärke der Streuung des Nano-Objekts unter Studie, und
steht für die Stärke der Streuung des Nano-Objekts unter Studie, und 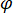 ist die Phasenverschiebung zwischen den verstreuten und verweisen "Wellenlinien"14. Entweder die übertragenen oder Rückseite reflektiert einfallendes Licht dient in der Regel als Referenz Welle, wo in jedem Fall
ist die Phasenverschiebung zwischen den verstreuten und verweisen "Wellenlinien"14. Entweder die übertragenen oder Rückseite reflektiert einfallendes Licht dient in der Regel als Referenz Welle, wo in jedem Fall 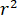 entfallen die Transmissivität oder Reflektivität der Probenkammer, beziehungsweise. Der Begriff
entfallen die Transmissivität oder Reflektivität der Probenkammer, beziehungsweise. Der Begriff 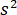 ist proportional zu des Proteins Streuung Querschnitt und im Vergleich zu dem Kreuz Begriff vernachlässigt werden kann. Und setzt damit,
ist proportional zu des Proteins Streuung Querschnitt und im Vergleich zu dem Kreuz Begriff vernachlässigt werden kann. Und setzt damit, 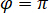 für komplette destruktive Interferenz der detektierten Lichts ergibt sich aus
für komplette destruktive Interferenz der detektierten Lichts ergibt sich aus 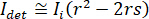 wo
wo 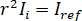 ist die Referenz-Intensität und
ist die Referenz-Intensität und 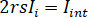 ist die Intensität der Störung.
ist die Intensität der Störung.
iSCAT Mikroskopie bietet eine hervorragende Methode, um biologische Prozesse auf der Einzelmolekül-Ebene zu studieren. Als Beispiel, wir untersuchen Laz388 Zellen – eine Epstein - Barr-Virus (EBV) verwandelt sich B-Lymphozyten Zelle Zeile20,21 — wie sie Proteine wie IgG Antikörper16absondern. Aber die Methode ist allgemein und kann auf eine Vielzahl von anderen biologischen Systemen angewendet werden. iSCAT ist von Natur aus unspezifischen und erkennt kein Protein oder Nanopartikel oder es kann mit herkömmlichen Oberfläche Funktionalisierung Methoden für spezifische oder Multiplex-Erkennung erweitert werden. Seine Einfachheit und die Fähigkeit, mit anderen optischen Techniken, wie die Fluoreszenz-Mikroskopie, kombinierbar zu machen iSCAT ein wertvolles ergänzendes Instrument in der Zellbiologie.
Protokoll
Achtung: Lesen Sie bitte alle relevanten Sicherheitsdatenblätter (SDB) vor der Verwendung von Chemikalien, beobachten Sie, alle entsprechenden Sicherheitsmaßnahmen und tragen Sie persönliche Schutzausrüstung (Laser-Schutzbrille, Handschuhe, Augenschutz Labor Mäntel) je nach Bedarf.
1. Aufbau der iSCAT Mikroskop16,18
Hinweis: ISCAT Mikroskop besteht typischerweise aus einem modifizierten inversen Mikroskop-Setup. In Kürze ein Laser konzentriert sich auf die zurück Brennebene ein hoher numerischer Apertur (NA)-Ziel und eine Image-Objektiv wird verwendet, um das Teilchen zurückgestreute Licht auf ein Kamerachip zu konzentrieren. Im Allgemeinen kann diese Weitfeld-Mikroskop von Grund auf neu gebaut oder basierend auf einem vorhandenen inversen Mikroskop. Dieses Protokoll umfasst die wesentlichen Schritte, um das Setup zu realisieren, während Änderungen in der verwendeten Hardware möglich sind. Eine ausführlichere Beschreibung der Versammlung von einem iSCAT Mikroskop finden Sie in der Arbeit von Arroyo Et al. 18.
Achtung: Eine iSCAT Mikroskop beinhaltet eine Klasse IIIB, Klasse IV Laser-Lichtquelle. Geeigneten Augenschutz ist notwendig bei der Montage und Ausrichtung der Mikroskop-Optics. Während des Zusammenbaues Mikroskop stellen Sie sicher, dass der Laser Strahlengang gerade bleibt und nicht abgelenkt wird, wenn neue optische Komponenten hinzugefügt werden.
-
Richten Sie den Pfad der Beleuchtung des Mikroskops.
- Mit einem gedämpften optischen Tisch und eine starre Metall-Block bauen ein Mikroskop Probe Bühne18 , das ein hoher numerischer Apertur (NA) Ziel beinhaltet (100 X / 1,46 NA) und eine Übersetzungseinheit, die seitlichen Probeübersetzung sowie Verlagerung des Schwerpunkts ermöglicht Position für das Ziel.
Hinweis: Betrieb von einem iSCAT Mikroskop an der Grenze der Nachweis einzelner Proteine ist sehr anfällig für externe Vibrationen. Eine Centrosymmetric Piezo-Bühne, die die Probe von allen Seiten unterstützt wird empfohlen, akustische Erregungen der Probe zu begrenzen, die anderweitig zu fokalen und seitliche Stabilität gefährden würde. Abbildung 1 zeigt eine geeignete Probentisch, einschließlich der Piezo Übersetzungseinheit und das Ziel. Darüber hinaus wird empfohlen, dass massive und stabile Halterungen für alle optischen Komponenten, die in den folgenden Schritten erläutert verwendet werden. Solche Komponenten sind leicht zugänglich von kommerziellen Optik Lieferanten. - Verwenden Sie eine 50 cm Singulett Brennweite (Weitfeld-Objektiv) und eine 45° (vertikal) Kupplung Spiegel, um das Licht von einem Diodenlaser bei Wellenlänge 445 nm auf zurück Brennebene des Ziels konzentrieren. Dies schafft einen kollimierten Strahl auf das Ziel nach vorne konzentrieren und wird der iSCAT Beleuchtungsquelle geworden. Bei Bedarf Filtern des Lasers räumlich vor der 50 cm Linse über einen 30 µm Lochkamera oder single-Mode-Faser.
- Wenden Sie einen Tropfen Immersionsöl auf das Ziel an und ein Glas-Deckglas in der Probe-Ebene der Mikroskoptisch. Dies führt in einem Strahl, der wieder nach unten durch die bildgebenden Ziel widerspiegelt.
Hinweis: Die Reflexion ergibt sich aus der Luft-Glas-Schnittstelle an der oberen Oberfläche der Probe Deckglas und dienen als Grundlage für die iSCAT Referenzstrahl. Restlichen Schmutz oder Staub auf der Oberfläche das Deckglas wird zu Streuung Punktquellen, führen, die helfen, die richtige Fokussierung der bildgebenden Ziel in den nächsten Schritten.
Achtung: Die Mehrheit des Laserlichts überträgt durch das Deckglas und reist gerade nach oben aus dem Ziel. Legen Sie einen undurchsichtigen spiegelnden Diffusor (zB., eine Papierkarte) über das Deckglas zur Minimierung des Risikos von Verletzungen durch das Laserlicht.
- Mit einem gedämpften optischen Tisch und eine starre Metall-Block bauen ein Mikroskop Probe Bühne18 , das ein hoher numerischer Apertur (NA) Ziel beinhaltet (100 X / 1,46 NA) und eine Übersetzungseinheit, die seitlichen Probeübersetzung sowie Verlagerung des Schwerpunkts ermöglicht Position für das Ziel.

Abbildung 1: iSCAT Probentisch. Das Foto zeigt die massiven Aluminium-Block auf dem Piezo Übersetzungseinheit (schwarz), sowie die zentrierte 100 montiert ist x Ziel. Die 3-Achsen-Piezo-Stufe erlaubt für die genaue Positionierung der Probe in der Brennebene des Objektivs. Grobe Fokussierung erfolgt durch Drehen ein Gewinde Rohr auf dem das Ziel montiert ist (nicht abgebildet). Der Block wird auf dem optischen Tisch mit vier Stahl-Sockel über dem 45° Kupplung Spiegel aufgestellt. Bitte klicken Sie hier für eine größere Version dieser Figur.
-
Richten Sie den bildgebenden Pfad des Mikroskops.
- Einführung einer Antireflection (AR)-Strahlteiler (70 % Reflexion, 30 % Transmission) in einem Winkel von 45° relativ zum einfallenden Strahl und ca. 10 cm nach dem Weitfeld-Objektiv beschichtet. Richten Sie die AR-Beschichtung auf der Laserquelle. Dies überträgt den einfallenden Strahl und spiegelt die Referenz und Balken in einem 90° Winkel zum einfallenden Strahl verteilt.
Hinweis: AR-beschichtet und/oder eingekeilt Strahlteiler werden empfohlen, da deutliche Geisterbilder und Fringe Effekte auftreten können, wenn mit Strahl Würfel oder unbeschichtete planar Strahlteiler aufteilen. Siehe die Diskussion für mehr Details. Auf Wunsch kann jede unerwünschte reflektierten Strahl aus der Rückseite der Strahlteiler durch Verwendung von eine Irisblende blockiert werden. - Ein dicken Strahlteiler wird eine signifikante Strahl Verschiebung einführen, so dass der Laser nicht mehr gerade das Ziel eingeben kann. Falls erforderlich, neu ausrichten Sie, Laser Strahlengang vor den Strahlteiler Sicherstellung der korrekte Vermehrung durch das Ziel.
Hinweis: Der Strahlteiler könnte auch vor dem Weitwinkelobjektiv Feld hinzugefügt werden und der Mikroskoptisch positioniert ist (Schritt 1.1.2.), so dass der Strahl nicht später verschoben wird. - An dieser Stelle konzentrieren Sie den bildgebenden Arm des Interferometers und dafür sorgen Sie, dass die Probe Flugzeug und Kamera parfokal sind. Legen Sie eine konkave f =-45 cm Objektiv an einer Stelle 5 cm nach dem Weitfeld-Objektiv im einfallenden Strahlengang. Dies führt zu einem kollimierten Strahl in die hintere Öffnung des Ziels.
- Bewegen Sie mit einem Bildschirm platziert in den reflektierten Arm des Interferometers das Ziel in vertikaler Richtung, die groben Fokuslage zu finden. Das Ziel steht im Fokus, wenn der Balken auf dem Bildschirm kollimiert ist.
Hinweis: Abbildung 2 zeigt eine schematische Darstellung dieses Prozesses. - Entfernen Sie die beiden f =-45 cm Objektiv und dem Bildschirm, wenn grobe Fokussierung abgeschlossen ist.
Hinweis: Anstatt eine negative Brennweite Weitfeld-Linse selbst werden auf einer beweglichen Halterung platziert und verschoben aus dem Strahlengang für diesen Schritt. Um die stabilsten Mikroskopkonfiguration zu erreichen, wird empfohlen die Weitfeld-Linse in einer festen Position zu halten. - Fügen Sie eine zweite f = 50 cm Singulett Objektiv das Streulicht zu fokussieren und das reflektierte Licht auf den Sensor einer CMOS-Kamera zu lassen. Stellen Sie sicher, dass das Objektiv 50 cm von der wieder Fokalebene des Objektivs sitzt um erneut Kollimation der Referenzstrahl und das Streulicht zu konzentrieren.
- Ort der CMOS chip 50 cm weg von der f = 50 cm Linse und positionieren Sie den Strahl direkt in der Mitte des Chips.
Hinweis: Die folgenden Parameter werden in der Regel für die Bildgebung verwendet. Die Ausgangsleistung des Lasers (Wellenlänge 445 nm) befindet sich auf 100 mW. Lochkamera und Beam Splitter dämpfen das transmittierte Licht, so dass die Wirkleistung in das Ziel ca. 9 mW. Der Strahldurchmesser an der Probenposition beläuft sich auf 6 µm. Mit dem verwendeten bildgebenden Objektiv ist die effektive Vergrößerung des Systems etwa 300 X. Die Größe des Bildes auf dem CMOS-Chip ist auf 128 × 128 Pixel innerhalb der beleuchteten Fläche, wodurch ein Sichtfeld von etwa 5 × 5 µm2festgelegt. Abbildung 3 zeigt eine schematische Darstellung des fertig montierten iSCAT Mikroskop.
- Einführung einer Antireflection (AR)-Strahlteiler (70 % Reflexion, 30 % Transmission) in einem Winkel von 45° relativ zum einfallenden Strahl und ca. 10 cm nach dem Weitfeld-Objektiv beschichtet. Richten Sie die AR-Beschichtung auf der Laserquelle. Dies überträgt den einfallenden Strahl und spiegelt die Referenz und Balken in einem 90° Winkel zum einfallenden Strahl verteilt.
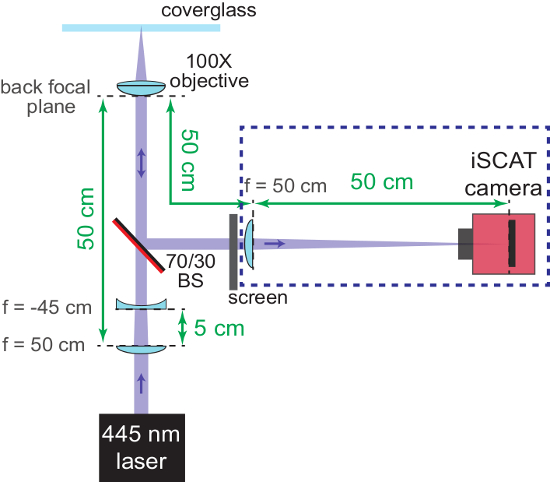
Abbildung 2: grobe Fokussierung des Mikroskops iSCAT. Der Schaltplan zeigt die Anordnung der Optik zu helfen, das System in den Mittelpunkt zu Rücken. Der AR-beschichtete Rückseite der Strahlteiler (70/30 BS) ist rot markiert. Wichtige Entfernungen sind in grün zur Verfügung gestellt. Die Brennweiten (f) der verwendeten Objektive sind gekennzeichnet. Komponenten in blau gestrichelten Kasten sind in Schritten 1.2.6 - 1.2.7 hinzugefügt. Die konkave Linse (verwendet, um den konvergierenden iSCAT Strahl wieder lassen) und der Bildschirm werden später entfernt. Bitte klicken Sie hier für eine größere Version dieser Figur.

Abbildung 3: iSCAT Mikroskop. Der Schaltplan zeigt die fertig montierten iSCAT Mikroskop. Der AR-beschichtete Rückseite der Strahlteiler (70/30 BS) ist rot markiert. Wichtige Entfernungen sind in grün zur Verfügung gestellt. Die Brennweiten (f) der verwendeten Objektive sind gekennzeichnet. Bitte klicken Sie hier für eine größere Version dieser Figur.
-
Richten Sie zusätzliche bildgebende Kanäle.
Hinweis: Dieser Abschnitt fügt einen anderen bildgebenden Weg, das Mikroskop, das ermöglicht die Beobachtung eines großen Gebietes rund um den iSCAT Laser über Hellfeld Mikroskopie und Zellviabilität per Fluoreszenz-Mikroskopie zu überwachen.- Paar die Ausgabe einer LED-Lichtquelle (ca. 500 nm < λ < 580 nm) in eine lange Distanz 20 X / 0.4 NA Ziel arbeiten, und installieren Sie mechanische Komponenten über die Probenkammer, mit denen für die Fokussierung und seitliche Positionierung der LED-Ausgabe auf der Probe.
- Stellen Sie sicher, dass die LED-Ausgang des Spektrum deckt die Erregung der Zelle Tod Marker (Propidium Jodid (PI)) und die Fluoreszenz (λ > 600 nm) nicht stört. Verwenden Sie optische Filter bei Bedarf.
- Bewegen Sie das obere Ziel seitlich, so dass die oberen (Weitfeld) und unteren (iSCAT) Ziele kollinear sind. Dies wird bestimmt, indem ein Bildschirm unter die untere Ziel und die Intensität der übertragenen LED-Licht auf dem Bildschirm zu maximieren. Legen Sie ein λ = 550 nm kurz-Pass dichroitische Spiegel (SPDM) die übertragene LED Licht vom iSCAT Laser Weg aufgeteilt.
- Dieser Strahl in zwei Kanäle mit einer 8 % reflective/92% transmissive Strahlteiler (BS) aufgeteilt. 92 %-Pfad ist der Fluoreszenz-Kanal und der 8 % Pfad wird verwendet für Hellfeld Bildgebung.
- Bild den Hellfeld Kanal auf einer CMOS-Kamera mit einem f = 5 cm achromatisch Doublet Linse.
- Bild den Fluoreszenz-Kanal auf einer separaten CMOS-Kamera mit einem f = 5 cm achromatisch Doublet Objektiv und ein λ = 600 nm lang-Pass-Filter um das Anregungslicht zu blockieren. Abbildung 4a zeigt eine schematische Darstellung des fertig montierten Mikroskop einschließlich aller bildgebenden Kanäle.
- Paar die Ausgabe einer LED-Lichtquelle (ca. 500 nm < λ < 580 nm) in eine lange Distanz 20 X / 0.4 NA Ziel arbeiten, und installieren Sie mechanische Komponenten über die Probenkammer, mit denen für die Fokussierung und seitliche Positionierung der LED-Ausgabe auf der Probe.

Abbildung 4: iSCAT Mikroskopie von Proteinen, die von einzelnen Zellen abgesondert. (a) schematische des Mikroskops im Protokoll beschrieben. Abschnitt 1 für weitere Informationen. Abkürzungen: LED, Light Emitting Diode; SPF, kurz-Pass-Filter; Obj, Ziel; SPDM, kurz-Pass dichroitischen Spiegel; BS, Strahlteiler; LPF, lang-Pass-Filter; BF, Hellfeld; Fluor, Fluoreszenz; C1-C3, Kamera 1-3. (b) Bright-Feld Bild eines einzigen Laz388 Zelle ca. 4 µm vom iSCAT Sichtfeld (dargestellt durch ein weißes Quadrat). Aufnahme von Kamera C3, Maßstabsleiste: 10 µm. (c) Fluoreszenzbild derselben Region gezeigt (b) mit der Position der Zelle mit einem weißen Kreis gekennzeichnet. Das Fehlen der Fluoreszenz zeigt, dass die Zelle lebensfähig ist. Aufnahme von Kamera C2, Maßstabsleiste: 10 µm. (d) Raw iSCAT Kamera Bild Momentaufnahme mit 80 µs Belichtungszeit. Bild von Kamera C1. (e) iSCAT Bild der gleichen Region nach raumzeitlichen Hintergrundabzug wie im Diskussion Abschnitt beschrieben. Das Bild wurde über 1000 sequentielle raw Bilder (d) mit einer letzten Frame-Zeit von 400 ms integriert und zeigt die Rauheit der Oberfläche von Glas-Deckglas. (f) entsprechende differenzielle iSCAT Bild, das die verbindliche Veranstaltung 2-Proteine auf dem Deckglas zeigt. Das Bild entstand durch Subtraktion von zwei aufeinander folgenden gefilterte Bilder (e). Bars in (d), skalieren (e) und (f): 1 µm. Diese Zahl wurde angepasst von McDonald, M.P. Et al. 16. Copyright 2018 American Chemical Society. Bitte klicken Sie hier für eine größere Version dieser Figur.
-
Richten Sie den Computer und Software.
- Alle Kameras an einen Computer anschließen. Installieren Sie jeweiligen Treiber-Pakete zu und zu erhalten/Schreib-Software für ihre Kontrolle.
Hinweis: Geeigneter Hardware ist erforderlich für High-Speed-Akquisitionen. Mindestens ein multi-Core-Prozessor, 16 GB RAM, eine Frame-Grabber-Karte und einer Solid-State-Disk für die Datenspeicherung empfohlen. - Beobachten Sie das iSCAT Bild auf die CMOS-Kamera und sicherstellen Sie, dass es im Fokus ist, von der Suche nach ein passives Staub oder Schmutz Partikel auf die Glas-Deckglas. Stellen Sie sicher, dass das Teilchen-Bild ist ein Zirkular symmetrischer Punkt Funktion (PSF) zu verbreiten.
Hinweis: Der Hauptgrund für eine nicht kreisförmig symmetrischen PSF ist, dass der Laserstrahl nicht das Ziel direkt, sondern in einem kleinen Winkel bezüglich der optischen Achse geben. Dies wird korrigiert durch Anpassung der Winkel und die Position des einfallenden Strahls mit dem 45°-Kupplung-Spiegel. - Vergleichen Sie die Kamerabilder der Hellfeld und die Fluoreszenz-Kanäle. Sicherstellen Sie, dass beide im Mittelpunkt stehen und die gleichen Anzeigebereich. Stellen Sie sicher, dass die Position des Lasers iSCAT ungefähr in der Mitte des Bildes und beachten Sie die Position für den späteren Gebrauch. Abbildung 4 b-4f für typische Kamerabilder anzeigen
Hinweis: Verwenden Sie eine Zellprobe oder fluoreszierenden Perlen in den Fokus der beiden Kanäle zu finden. Entfernen Sie vorübergehend die Fluoreszenz-lang-Pass-Filter um das System anpassen. Der Schwerpunkt für die konventionelle Bildgebung der Zellen muss etwas höher als der iSCAT Brennebene. Um dies auszugleichen ohne bewegliche Ziel, verdrängen die Kameras aus ihren Positionen in den Fokus der beiden jeweiligen f = 5 cm Objektive. - Die notwendige Kameraparameter einstellen. Verwenden Sie eine feste Framerate und deaktivieren Sie Softwaretools Gain und Korrektur zu.
Hinweis: Die folgenden Parameter werden verwendet: die iSCAT Kamera befindet sich auf 5000 Bilder pro Sekunde (fps) mit einer Belichtungszeit von 80 µs. Wie bereits erwähnt, ist die Bildgröße 128 × 128 Pixel. Hellfeld und Fluoreszenz-Kameras arbeiten mit full-Frame-Größe (1280 × 1024 Pixel). Bright-Feld Bildgebung erfolgt mit einer Belichtungszeit von 20 ms. Die Fluoreszenz-Kamera auf 750 ms Belichtungszeit festgelegt ist, und 5 aufeinander folgende Frames werden gesammelt, um eine endgültige Bild zu bilden. Bright-Feld und Fluoreszenz Bilder sind in festen 20 s Zeitintervallen akquiriert.
- Alle Kameras an einen Computer anschließen. Installieren Sie jeweiligen Treiber-Pakete zu und zu erhalten/Schreib-Software für ihre Kontrolle.
2. Vorbereitung des Experiments
-
Bereiten Sie das Lager Mikroskopie-Medium.
- Fügen Sie 25 mL HEPES-Puffer-Lösung (1 Mol/L) bis 975 mL RPMI 1640 Medium um eine endgültige 1 L 25 Mmol/L HEPES Lösung zu erhalten. Alternativ können Sie ein Puffermedium mit HEPES bereits enthalten.
Hinweis: HEPES wird verwendet, um den pH-Wert des Mediums während einer Messung bei Umgebungsbedingungen (z. B. außerhalb Inkubator und ohne ständige CO2 -Versorgung) zu erhalten. - Ein Aliquot der Lösung benötigt für ein Experiment zu nehmen und auf Raumtemperatur aufwärmen lassen. 2 mL des Mediums ist ausreichend. Halten Sie die restlichen Stammlösung bei 4 ° C.
- Fügen Sie 25 mL HEPES-Puffer-Lösung (1 Mol/L) bis 975 mL RPMI 1640 Medium um eine endgültige 1 L 25 Mmol/L HEPES Lösung zu erhalten. Alternativ können Sie ein Puffermedium mit HEPES bereits enthalten.
-
Bereiten Sie die Mikroskop-Küvette.
Hinweis: Die folgenden Schritte beschreiben die Vorgehensweise für eine kundenspezifische Probenhalter, bestehend aus einem Aluminium-Grundplatte und eine Acryl Küvette Gericht, die sowohl das Deckglas behebt und es an den piezoelektrischen 3D Stellungsregler koppelt. Handelsüblichen sterilen Kultur Gerichte mit einem Glasboden können auch verwendet werden.
Hinweis: Abbildung 5 zeigt Fotografien von der Custom-Built Probenhalter.- Nehmen Sie eine neue Mikroskopie-Deckglas und spülen Sie ihn mit entionisiertem Wasser (VE-Wasser) und Ethanol. Luft trocknen die Folie mit Stickstoff oder Druckluft.
- Reinigen Sie das Deckglas in einer Sauerstoffatmosphäre Plasma (0,3 Mbar Gasdruck) für 10 min bei 500 W HF-Leistung. Dies entfernt alle organische Verunreinigungen von der Oberfläche.
- Reinigen Sie das Acryl Küvette Gericht durch Eintauchen in 0,2 Mol/L NaOH Lösung für ca. 10 min. Spülen mit VE-Wasser.
- Montieren Sie der Probenhalter und bedecken Sie es mit einem Kunststoff Petrischale bis in das Experiment benötigt.

Abbildung 5: Custom-Built Probenhalter. (a) probieren Halterkomponenten: (1) Acryl Küvette Gericht; (2) Aluminium Grundplatte; (3) Halteschrauben; (4) Silikon o-Ring; (5) Deckglas. (b) komplett montiert Probenhalter. Bitte klicken Sie hier für eine größere Version dieser Figur.
-
Bereiten Sie das Mikroskop.
- Schalten der iSCAT Beleuchtung Laser, hell-Feld/Fluoreszenz Beleuchtung LED, Kameras und Datenerfassungs-Computer/Software. Blockieren Sie den Laserstrahl auf eine Position vor dem Ziel.
- Sicherstellen, dass die 100 X / 1,46 NA Ziel ist sauber. Wenn dies nicht der Fall ist, Objektiv Reinigung Tücher und Ethanol verwenden, um das Ziel gemäß Herstellervorgaben zu reinigen.
- Tragen Sie einen Tropfen Immersionsöl auf das Mikroskopobjektiv.
- Nehmen Sie der Probenhalter (montiert in Abschnitt 2.2) zu und montieren Sie es sorgfältig auf der Piezo-Bühne des Mikroskops iSCAT zu, so dass die Probe Deckglas auf das Mikroskopobjektiv zentriert ist. Seien Sie aufmerksam und vorsichtig, um nicht das Objektiv zu beschädigen. Befestigen Sie das Gerät an der piezoelektrischen Positionierer mit Rändelschrauben und gleichzeitig, die der Hersteller angegeben, dass maximale Drehmoment nicht überschritten wird.
- Fügen Sie 1 mL Lager Mikroskopie Medium (vorbereitet in Abschnitt 2.1.) in die Küvette.
- Geben Sie 2 Tropfen Propidium Jodid Fleck auf das Medium als eine Zelle Tod Marker16,22.
- Den Laser zu entsperren und das System in den Vordergrund zu bringen. Als erstes überprüfen Sie, dass das Ziel im richtigen Abstand von dem Deckglas positioniert ist, durch Wiederholung der Schritte 1.2.3. – 1.2.5. (Abbildung 2). Dann, eine Feinabstimmung des Fokus mit der z-Achse der Piezo-Bühne.
- Bestätigen Sie, dass alle Einstellungen für die Lichtquellen, Kameras und Software korrekt eingestellt sind. Dazu gehören Parameter wie Laserleistung, LED-Intensität, Kamera-Frame-raten, Belichtungszeiten der Kamera oder Software Strecken speichern.
Hinweis: Speichern von Videos bei hohen Frameraten produzieren große Dateigrößen. Sorgen Sie für genügend freien Speicherplatz auf dem Computer. - Blockieren Sie den Laserstrahl wieder. Das Mikroskop ist jetzt bereit für ein Experiment.
-
Bereiten Sie die Zellen.
Hinweis: Laz388 Zellen20 kultiviert in RPMI 1640 Medium mit 10 % fetalen Kälberserum (FCS), Pyruvat, Aminosäuren und Antibiotika ergänzt. Die Zellen werden bei 37 ° C und 5 % CO2 inkubiert und aufgeteilt und mit frischem Medium alle 2-3 Tage23zur Verfügung gestellt.- Die Zelle-Kultur-Flasche aus dem Inkubator nehmen und ca. 1 x 106 -Zellen-haltigem Medium Aspirieren. Um das korrekte Volumen zu bestimmen, die Konzentration der Zellkultur durch Einsatz von einem Hemocytometer zu quantifizieren.
- Mischen Sie die Zelle-Lösung mit 10 mL RPMI 1640 Medium bei Raumtemperatur und Zentrifugieren Sie die Probe bei 300 X g für 7 min.
- Sorgfältig zu extrahieren und entsorgen des Überstands dabei sicherzustellen, dass die Pellets von konzentrierten Zellen ungestört bleibt.
- Wiederholen Sie die Schritte 2.4.2. -2.4.3. mit der konzentrierten Pellet von Zellen.
- Wieder aussetzen der Zellen in 0,5 mL Lager Mikroskopie Medium (vorbereitet in Abschnitt 2.1.) und sofort in einem Experiment zu verwenden.
3. iSCAT Mikroskopie sezernierenden Zellen
- Stellen Sie sicher, dass der Laserstrahl blockiert wird, um zu verhindern, dass die Zellen direkt das iSCAT Laserlicht ausgesetzt.
- Injizieren Sie die Zellen in der Probe-Küvette.
- Injizieren Sie ca. 3 µL die Zellprobe (vorbereitet in Abschnitt 2.4) leicht außermittig in die Küvette Probe. Berühren Sie sanft die Pipettenspitze auf das Deckglas und injizieren Sie langsam die Zelle-Lösung. Lassen Sie die Zellen auf dem Deckglas zu Regeln.
Hinweis: Verwenden Sie kleine Volumen Pipettenspitzen (10 µL) oder langen, flexiblen Gel-laden-Tipps. - Sicherstellen Sie, dass die Dichte der Zellen unterhalb etwa 1 Zelle pro 500 µm² ist, so dass einzellige Messungen nicht von mehreren Zellen in der Umgebung des iSCAT Lasers beeinflusst werden.
- Wenn die Anzahl der Zellen zu niedrig, wiederholen Sie Schritt 3.2.1 ist. bis eine ausreichende Anzahl zur Verfügung steht.
- Wenn die Abdeckung der Zellen zu dicht ist, verwenden Sie eine Injektion von ca. 20 µL zusätzliche Mikroskopie Medium die Zellen über das Deckglas zu zerstreuen.
- Injizieren Sie ca. 3 µL die Zellprobe (vorbereitet in Abschnitt 2.4) leicht außermittig in die Küvette Probe. Berühren Sie sanft die Pipettenspitze auf das Deckglas und injizieren Sie langsam die Zelle-Lösung. Lassen Sie die Zellen auf dem Deckglas zu Regeln.
- Der Piezo-Positionierer, bewegen Sie mit Hilfe die Probe seitlich, eine Zelle in der Nähe (ca. 10 µm) iSCAT Sichtfeld zu positionieren. Stellen Sie sicher, dass die Zelle nicht das Sichtfeld iSCAT wie direkte Einwirkung von 445 nm-Laser-Licht für die Zelle schädlich sein könnte.
- Verwenden Sie Hellfeld und Fluoreszenz Bilder zum suchen und überprüfen die Zelle überleben25.
Hinweis: Eine lebensfähige Zelle hat eine Runde Form im Hellfeld Bild und nicht fluoreszierende, Zelltod durch starke Fluoreszenz Signale aus der Anwesenheit von Propidium Jodid im Inneren der Zelle22angegeben ist. - Entsperren des iSCAT Laserstrahls und sicherzustellen, dass die Deckglas Oberfläche noch im Fokus. Schließen Sie die Isolierung Tabelle zur Minimierung von Drift und akustische Kopplung aus der Umgebung.
Hinweis: Diese wird mit schweren optischen Vorhängen oder Acryl-Paneele rund um die optischen Tisch erreicht. - Starten Sie die Messung durch den Erwerb von Bilder der Fluoreszenz iSCAT und Hellfeld Kameras. Automatisieren Sie und Steuern Sie den Prozess durch Software, experimentelle Effizienz zu maximieren. Regelmäßig die Lebensfähigkeit der Zelle und der Schwerpunkt des Systems.
Hinweis: Abhängig von der Laserintensität, optischen Komponenten und Zeit Belichtungseinstellungen der Kamera, kann der iSCAT Laser Fluoreszenz Kamera beeinträchtigen. Sollten Sie dieses Verhalten beobachtet wird, Schalung iSCAT Laser vorübergehend bei Fluoreszenz Bild Akquisitionen.
(4) Datenanalyse
Hinweis: Experimentelle Daten ist von Natur aus laut und iSCAT Bilder sind nicht anders. Es gibt mehrere Quellen von Lärm in einer typischen iSCAT Messung, einschließlich Wavefront Verzerrungen in der einfallenden Lichtquelle, Oberflächenrauhigkeit des Deckglases und Kamera Rauschen. Folgenden Abschnitt stellt einige Möglichkeiten, in denen diese Lärmquellen über Nachbearbeitung beseitigt werden. Zusätzlich seitliche mechanische Instabilitäten des Setups zu verrauschten Daten führen und müssen daher, wie beschrieben im Abschnitt Diskussion angesprochen werden. Die beschriebenen Analysen werden mit benutzerdefinierten MATLAB Skripts ausgeführt.
- Minimieren Sie Kamera Lärm durch Filterung der raw-Daten mit einem zweidimensionalen Fourier-Filter, der hohen Ortsfrequenzen ausschließt. Die Größe des Filters muss die spezifische experimentelle Konfiguration (hauptsächlich bestimmt durch das System numerische Apertur) angepasst werden.
Hinweis: Funktionen im Bild mit höheren räumlichen Frequenzen als das optische System stammen aus fremden Quellen (z. B. Kamera Ausleserauschen) und können vernachlässigt werden. - Konvertieren Sie die Bilder von Kamera-raw zählt in iSCAT Kontrast.
Hinweis: Das Signal von der Kamera erkannt ist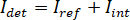 . iSCAT Kontrast ist definiert als
. iSCAT Kontrast ist definiert als 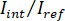 wo
wo 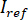 ist die Lichtstärke der Referenz, in diesem Fall reflektiert im Teil durch das Deckglas und
ist die Lichtstärke der Referenz, in diesem Fall reflektiert im Teil durch das Deckglas und 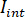 ist die Interferenz zwischen
ist die Interferenz zwischen 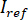 und die verstreuten Intensität (
und die verstreuten Intensität (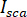 ).
).- Trennen Sie das Signal in
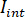 und
und 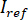 durch Berechnung den zeitliche Mittelwert der Einzelbilder, in denen die Partikel von Interesse nicht vorhanden sind. Das resultierende Bild bietet das Referenzsignal
durch Berechnung den zeitliche Mittelwert der Einzelbilder, in denen die Partikel von Interesse nicht vorhanden sind. Das resultierende Bild bietet das Referenzsignal 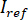 .
.
Hinweis: Alternativ kann ein aktiver Hintergrund Subtraktion Schritt durchgeführt werden wie in der Diskussion weiter unten beschrieben. - Berechnen Sie Kontrast nach
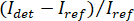 12,14,16.
12,14,16.
- Trennen Sie das Signal in
- Erstellen Sie ein rollende differenzierte Bild durch Subtraktion jeder aufeinanderfolgenden Rahmen von dessen Nachfolger.
Hinweis: Restwert Signale von der Oberflächenrauhigkeit der Deckglas und Wavefront Verzerrungen sind effektiv in diesem Schritt entfernt, da sie in aufeinanderfolgenden Rahmen konstant sind. Das rollende Differential entfernt diese verbleibende Signale, so dass nur die Protein-Bindungen, die von einem Frame zum nächsten auftreten. Diese dynamische Hintergrundabzug ist vorteilhaft, da es nicht empfindlich auf langfristige Probe Drifts ist. - Wenden Sie einen Peak-suchende Algorithmus zu erkennen und einzelne Teilchen für jeden Frame index und ihre spezifischen Kontrast und Position zu bestimmen.
- Verwenden Sie die Informationen gesammelt im Schritt 4.4 Histogramme Protein Bindung Ereignisse erstellen und beziehen ihre extrahierten Kontraste zu Protein Masse durch eine Eichkurve, zusammengestellt vom bekannten Protein Proben14,24.
Ergebnisse
Abbildung 4azeigt eine schematische Darstellung eines iSCAT Mikroskop. Repräsentative Hellfeld, Fluoreszenz und rohe iSCAT Bilder sind in Abbildung 4 b, 4 cund 4D, bzw.16gezeigt. Abbildung 4e und 4f zeigen die Ergebnisse der Hintergrund entfernen und differenzielle Nachbearbeitung; zwei Proteine adsorbiert werden als Beugung begrenzte Flecken in Abbildung 4fangezeigt. Abbildung 6 zeigt ein Histogramm der gefundenen Proteine im Verlauf von 125 s. Diese Daten wurden durch die Anwendung eines Peak-suchenden Algorithmus auf den aufgenommenen Bildern zählen die verbindliche Ereignisse und katalogisieren ihre Kontrast16erhalten. Eine Gesamtanzahl von 503 Proteine wurden erkannt.
Nächste, sekretierte Arten sind im Vergleich zu Referenzmessungen durchgeführt auf gereinigtes Protein-Lösungen oder durch zusätzliche Messungen mit funktionalisierten Glas Oberflächen14,16gekennzeichnet. Die iSCAT Daten visualisieren so direkt zelluläre Sekretion Dynamik auf ein Atemanhalten Skala16. Als Beispiel haben wir bereits festgestellt, dass IgG-Antikörper einen wichtigen Teil der Laz388 Secretome stellen und aus der Zelle mit einer Rate von ca. 100 Moleküle pro zweite16freigegeben werden. Darüber hinaus sind andere Partikel, die ein Spektrum von 100 kDa - 1000 kDa durch die Zellen16abgesondert. Das beschriebene Verfahren kann weitere Arbeitnehmer z. B. das räumliche Konzentrationsgefälle von Sekreten, die Umgebung einer Zelle16zu untersuchen oder die zeitliche Dynamik des zellulären Lyse16bestimmen werden.
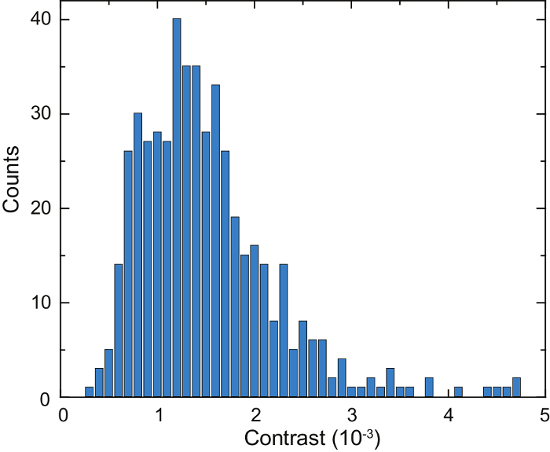
Abbildung 6: Quantifizierung der sekretierten Proteine von einer Einzelzelle Laz388. Das Histogramm zeigt die gefundenen Proteine während eines Zeitraums von 125 S. Kontrast Werte in 1 x 10-4 Kontrast Lagerplätze (blaue Balken) angesammelt werden. Insgesamt 503 einzelne Proteine wurden gezählt, während dieser Messung. Das Experiment wurde mit ähnlichen Ergebnissen 10 Mal wiederholt. Diese Zahl wurde angepasst von McDonald, M.P. Et al. 16. Copyright 2018 American Chemical Society. Bitte klicken Sie hier für eine größere Version dieser Figur.
Diskussion
Einer der wichtigsten Aspekte zur Gewinnung von Daten nützlich iSCAT ist die Fähigkeit, die richtige Fokuslage an der Oberfläche des Deckglases und darüber hinaus zu finden halten Sie diese Position für längere Zeit. Nichtbeachtung führt zu verbreiterte PSFs, schwache iSCAT Signale und Drift-assoziierten Artefakte im Dynamik-Analysen. Herausstellt, dass die Suche nach der Brennebene auf einem sauberen, blanken Deckgläschen Oberfläche nicht leichte Aufgabe ist da Oberflächen-Features nicht vor dem großen Referenz Strahl Hintergrund sichtbar sind (siehe Abbildung 4-d).
Rohe iSCAT Bilder sind oft verdeckt durch Hintergrund Signale, die von Wavefront Verunreinigungen in die Anregungsquelle entstehen, und kann behindern die Fähigkeit, die richtigen Abbildungsebene zu finden. Aktive Wavefront Subtraktion ist eine nützliche Methode, um dieses Problem zu umgehen und überwachen anschließend die iSCAT Fokus während einer Messung16. Eine Möglichkeit, dies zu erreichen ist durch räumliche Muster Modulation. In Kürze gilt ein Funktionsgenerator ein Rechtecksignal 50 Hz für externe Ansteuerung Hafen der Piezo-Bühne, wodurch eine räumliche Muster Modulation bei der angelegten Frequenz (290 nm Amplitude). Synchrone Kamera Akquisitionen werden aus der gleichen Quelle, und wenn durch Rastpositionen Grundsätze, Ergebnis in einem Wavefront kompensiert Bild14,16kombiniert ausgelöst. Das resultierende Bild zeigt in der Regel die Oberflächenrauigkeit des Deckglases (Abb. 4e). Kleine Features, die noch auf das Glas nach der Reinigung lässt sich das Mikroskop in den Mittelpunkt zu Rücken. Parameter für diesen aktiven Hintergrund Subtraktion Schritt können entsprechend der Bildrate, Belichtungszeit oder Hardware geändert werden.
Wie oben erwähnt, die einen qualitativ hochwertigen Strahlteiler im iSCAT Setup (Schritt 1.2.1.) wird empfohlen, als bildgebende Artefakte wie Ghosting oder Störungen aus dünnen planar Strahlteiler wird das Image beeinflussen und stören die Messung. Abbildung 7 zeigt einen Vergleich zwischen einer qualitativ hochwertigen und qualitativ minderwertige Strahlteiler. Beide roh iSCAT Bilder zeigen den gleichen Bereich auf das Deckglas, enthält einige Restpartikel. Das gleiche iSCAT-Setup wurde verwendet, um beide Bilder aufnehmen, nur der Strahlteiler wurde ausgetauscht. Abbildung 7a zeigt das Bild auf der Kamera durch Verwendung von dickeren (5 mm), gebildet AR-beschichtet und verkeilten Strahlteiler. Bauartbedingt eingekeilt der reflektierte Strahl von der Hinterfläche der Strahlteiler ist antiparallel zur Reflexion aus der vorderen Oberfläche und geht nicht ins Ziel. Keine Interferenzen Artefakte auftreten. Abbildung 7 zeigt die gleiche Sichtfeld auf die Probe, aber diesmal ein dünner (1 mm) planare Strahlteiler verwendet wurde. Die zwei Reflexionen von Vorder-und Rückseite der Strahlteiler sind parallel und werden auf die Kamera übertragen. Interferenz-Artefakte sind deutlich sichtbar.
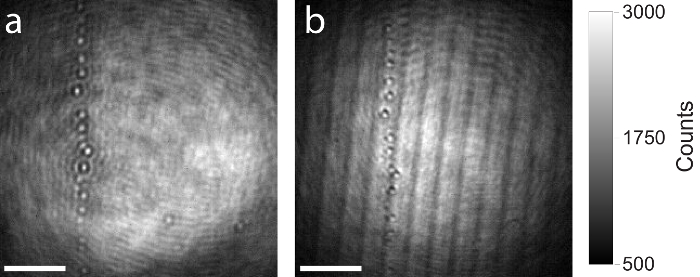
Abbildung 7: Vergleich der iSCAT Bilder produziert mit hoher und niedriger Qualität Strahlteiler. (a) resultierende roh iSCAT Bild durch Verwendung einer 5 mm dicken, AR-beschichtet und verkeilten Strahlteiler. (b) resultierende roh iSCAT Bild des gleichen Gebietes durch Verwendung von einer 1 mm dicken planar Strahlteiler. Beide Strahlteiler haben das gleiche splitting-Verhältnis (50 % Reflexion, Transmission 50 %). Störungen Artefakte aus Fresnel Reflexionen sind eindeutig in das Bild mit dem 1 mm dicken planar Strahlteiler produziert beobachtet. Skalieren Sie Bars: 2 µm. Bitte klicken Sie hier für eine größere Version dieser Figur.
In diesem Protokoll beschreiben wir ein Weitfeld-Beleuchtung Schema für iSCAT, wie es ist schnell, einfach zu realisieren und ermöglicht die parallele Erfassung über eine große Fläche14. Eine andere Möglichkeit ist zu verwenden akusto-optischen Deflektoren (Bevollmächtigten) und Scannen Sie einen konfokalen Balken über der Probe12,17. Dieser Ansatz vermeidet die Notwendigkeit einer qualitativ hochwertigen Wellenfronten aber ist mehr experimentell Komplex als herkömmlicher Weitfeld-Bildgebung. Außerdem ist die Geschwindigkeit der konfokalen Beleuchtung von der Anweisungsbefugten beschränkt. Je nach der gewünschten Versuchsparameter können, entweder konfokale oder Weitfeld-Beleuchtung-Systeme im Prinzip genutzt werden, um einzelne Proteine, die aus lebenden Zellen abgesondert zu erkennen.
Wie im gesamten Protokoll erwähnt, ist es unerlässlich, seitliche mechanische Schwankungen in der Probe-Bühne des Mikroskops zu minimieren. Sogar Nanometer Abweichungen in der Position der Probe zu Variationen in aufeinander folgenden Kamera Rahmen führen und verursachen erhebliche äußere Rauschen im differenzierten Bild. Es empfiehlt sich daher, eine mechanisch stabile Mikroskoptisch und eine gedämpfte optischen Tisch (Schritt 1.1.1.) zu verwenden und das Setup mit optischen Vorhänge oder Paneele während eines Experiments (Schritt 3.5.) zu decken.
Eine aktive Fokus Stabilisierung Schema auch für Langzeitmessungen in Erwägung gezogen werden. Bei diesem Ansatz ist ein zweiter Laser integriert das Mikroskop in einer Totalreflexion (TIR) Anordnung und anschließend auf eine Photodiode Quadranten abgebildet. Änderungen in den Systemfokus übersetzen in seitlichen Verschiebungen des TIR Lasers vor Ort auf die Quadranten-Diode, die dann in ein aktives Feedback-Schleife verwendet werden kann, um die z-Achse der Piezo Stufe26zu steuern. Vertikale Drift Langzeitwirkungen sind somit ausgeschlossen.
Mehrere Änderungen und Erweiterungen können die vorgestellten Technik auf experimentelle Bedürfnisse Adresse zugewiesen werden. Zum Beispiel gibt es kommerzielle Mikroskop Bühne Inkubatoren, könnte leicht in iSCAT Mikroskop zur langfristigen Sicherung von Zellen aufgenommen werden. Andere Techniken können auch ergänzend iSCAT bildgebende Verfahren, wie z. B. umgesetzt werden konfokale oder TIR Fluoreszenz Microscopies17. Anpassung auf dem System unter Studie, iSCAT Sekretion, die Messungen in anderen Zelle Medien wie z. B. DMEM oder DPBS, durchgeführt werden können, sollte jedoch pH Indikator Phenol rot vermieden werden, da das Experiment durch Absorption des Laserlichts gestört werden kann. Darüber hinaus enthalten Ergänzungen wie fetalen Kälberserum (FCS) oder menschlichen Thrombozyten lysate (hPL) Proteine, die iSCAT Erkennung stören können. Abhängig von der gewünschten Empfindlichkeit des Experiments sollte diese Ergänzungen aus der Mikroskopie Medium ausgeschlossen werden.
iSCAT stützt sich auf ein Analyt Fähigkeit zu streuen Licht – eine Eigenschaft, die untrennbar mit allen Proteinen ist – und ist somit von Natur aus unspezifisch. Dennoch ist ein gewisses Maß an Spezifität als iSCAT Signale Skala linear mit Eiweiß Masse14,27,28möglich. Dies ermöglicht die Kalibrierung eines iSCAT Systems mit standard Proteinproben wie Rinderserumalbumin (BSA) und Fibrinogen14,27,28. In der Tat, vor kurzem junge Et al. 28 haben auf der Arbeit von Piliarik & Sandoghdar14 erweitert und haben gezeigt, dass iSCAT verwendet werden kann, um festzustellen, das Molekulargewicht der Proteine so klein wie Streptavidin (53 kDa) mit einer Massenauflösung 19 kDa und einer Genauigkeit von ca. 5 kDa. Mehrere konventionelle Ansätze können weitere iSCAT ergänzen, indem ein zusätzliches Maß an Spezifität. Als ein Beispiel, Enzym-linked Immunosorbentprobe Assays (ELISA) und/oder anderen Oberflächenmodifikationen Schränken Sie Protein Bindung Ereignisse so ein, dass nur das Zielprotein erkannten16ist.
In diesem Protokoll haben wir beschrieben, wie iSCAT Mikroskopie verwendet werden kann, zu untersuchen, zelluläre Sekrete auf einzelne Proteinebene mit Atemanhalten Zeitauflösung16. Die Technik ist allgemein und auf alle gewerblichen oder selbst gebaute Mikroskop umgesetzt werden kann. Im Gegensatz zu Einzelmolekül-Fluoreszenz die Methode leidet nicht Immunofluoreszenz oder Effekte, aber es blinkt immer noch Single-Protein Empfindlichkeit erreicht. Diese Eigenschaften machen iSCAT ein mächtiges Werkzeug im Bereich Biosensoren und Mikroskopie. Zukünftige Anwendungen konzentriert sich auf die Aufklärung von komplexen zellulärer Interaktionen z. B. immunologische Reaktion auf einen Stimulus oder zelluläre Kommunikation.
Offenlegungen
Die Autoren haben nichts preisgeben.
Danksagungen
Diese Arbeit wurde von der Max-Planck-Gesellschaft, eine Alexander-von-Humboldt-Professur und der Deutschen Forschungsgemeinschaft (CRC 1181) unterstützt. Wir danken Stefanie Schaffer am Universitätsklinikum Erlangen, für die Laz388 Zellen und nützliche Diskussionen. Wir danken Simone Ihloff und Maksim Schwab bei MPL für den technischen Support.
Materialien
| Name | Company | Catalog Number | Comments |
| Item/Device | |||
| 100x / 1.46 NA objective | Zeiss | 420792-9800-000 | alpha Plan Apochromat oil immersion |
| 20x / 0.4 NA objective | Leica | 566049 | N Plan |
| Piezo Stage | PI | P-517k020 | 3-axis stage with 100x100x10µm range |
| Diode laser (445 nm) | Lasertack | PD-01236 | |
| Optics/Optomechanics | Thorlabs/Newport | - | lenses, mirrors, posts, mounts |
| Pinhole | Thorlabs | P30H | |
| LED light source | Thorlabs | MCWHL5 | |
| Shortpass filter (580 nm) | Omega Optical | 580SP | to modify the spectrum of the LED for fluorescence excitation |
| Longpass filter (500 nm) | Thorlabs | FEL0500 | to modify the spectrum of the LED for fluorescence excitation |
| 70R/30T beam splitter | Newport | 20Q20BS.1 | |
| Economy beam splitter | Thorlabs | EBS1 | used for the comparison of fringe effects |
| Wedged plate beam splitter | Thorlabs | BSW26 | used for the comparison of fringe effects |
| Shortpass dichroic mirror (550 nm) | Edmund Optics | 66249 | |
| 8R/92T beam splitter | Thorlabs | BP108 | |
| CMOS camera | Photonfocus | MV1-D1024E-160-CL | for iSCAT aquisition |
| CMOS cameras | Mightex | SCE-B013-U | for bright field / fluorescence aquisition |
| Longpass filter (600 nm) | Thorlabs | FELH0600 | |
| Computer | Fujitsu Siemens | - | Core i7 Processor, 16 GB RAM, SSD |
| Acquisition Software | LabVIEW | - | LabVIEW 2016 Suite |
| Analysis Software | Matlab | - | Matlab 2014 Suite |
| Plasma Cleaner | Diener | Diener pico | |
| Incubator | Binder | Model CB | |
| Centrifuge | Eppendorf | 5810R | |
| Reagent/Material | |||
| RPMI 1640 medium | Gibco | 11835063 | without phenol red |
| HEPES Buffer Solution (1M) | Sigma Aldrich | 59205C | |
| Cover slides | Marienfeld | 107052 | |
| Glass bottom culture dishes | ibidi | 81158 | |
| Fluorescent Microspheres | Invitrogen | F8821 | used for calibration |
| Immersol immersion oil | Zeiss | 444960 | |
| Propidium iodide stain | Invitrogen | R37108 | |
| Small pipette tips | Eppendorf | 30075005 | |
| Flexible pipette tips | Eppendorf | 5242956003 | |
| Ethanol, 99.8% | Fisher Scientific | E/0650DF/15 | |
| Sodium hydroxide, pellets | Sigma Aldrich | 221465 | for preparing 0.2M NaOH solution |
Referenzen
- Hathout, Y. Approaches to the study of the cell secretome. Expert Review of Proteomics. 4 (2), 239-248 (2007).
- Pandey, A., Mann, M. Proteomics to study genes and genomes. Nature. 405 (6788), 837-846 (2000).
- Makridakis, M., Vlahou, A. Secretome proteomics for discovery of cancer biomarkers. Journal of Proteomics. 73 (12), 2291-2305 (2010).
- Bantscheff, M., Schirle, M., Sweetman, G., Rick, J., Kuster, B. Quantitative mass spectrometry in proteomics: a critical review. Analytical and Bioanalytical Chemistry. 389 (4), 1017-1031 (2007).
- MacBeath, G. Protein microarrays and proteomics. Nature Genetics. 32, 526-532 (2002).
- Seder, R. A., Darrah, P. A., Roederer, M. T-cell quality in memory and protection: implications for vaccine design. Nature Reviews Immunology. 8 (4), 247-258 (2008).
- Moerner, W. E., Fromm, D. P. Methods of single-molecule fluorescence spectroscopy and microscopy. Review of Scientific Instruments. 74 (8), 3597-3619 (2003).
- Borisov, S. M., Wolfbeis, O. S. Optical biosensors. Chemical Reviews. 108 (2), 423-461 (2008).
- Dantham, V. R., Holler, S., Barbre, C., Keng, D., Kolchenko, V., Arnold, S. Label-Free Detection of Single Protein Using a Nanoplasmonic-Photonic Hybrid Microcavity. Nano Letters. 13 (7), 3347-3351 (2013).
- Zijlstra, P., Paulo, P. M. R., Orrit, M. Optical detection of single non-absorbing molecules using the surface plasmon resonance of a gold nanorod. Nature Nanotechnology. 7 (6), 379-382 (2012).
- Rickgauer, J. P., Grigorieff, N., Denk, W. Single-protein detection in crowded molecular environments in cryo-EM images. eLife. 6, e25648 (2017).
- Lindfors, K., Kalkbrenner, T., Stoller, P., Sandoghdar, V. Detection and Spectroscopy of Gold Nanoparticles Using Supercontinuum White Light Confocal Microscopy. Physical Review Letters. 93 (3), 037401 (2004).
- Jacobsen, V., Stoller, P., Brunner, C., Vogel, V., Sandoghdar, V. Interferometric optical detection and tracking of very small gold nanoparticles at a water-glass interface. Optics Express. 14 (1), 405 (2006).
- Piliarik, M., Sandoghdar, V. Direct optical sensing of single unlabelled proteins and super-resolution imaging of their binding sites. Nature Communications. 5, 4495 (2014).
- Roux, K. H. Immunoglobulin Structure and Function as Revealed by Electron Microscopy. International Archives of Allergy and Immunology. 120 (2), 85-99 (1999).
- McDonald, M. P., et al. Visualizing Single-Cell Secretion Dynamics with Single-Protein Sensitivity. Nano Letters. 18 (1), 513-519 (2018).
- Kukura, P., Ewers, H., Müller, C., Renn, A., Helenius, A., Sandoghdar, V. High-speed nanoscopic tracking of the position and orientation of a single virus. Nature Methods. 6 (12), 923-927 (2009).
- Ortega Arroyo, J., Cole, D., Kukura, P. Interferometric scattering microscopy and its combination with single-molecule fluorescence imaging. Nature Protocols. 11 (4), 617-633 (2016).
- Spindler, S., et al. Visualization of lipids and proteins at high spatial and temporal resolution via interferometric scattering (iSCAT) microscopy. Journal of Physics D: Applied Physics. 49 (27), 274002 (2016).
- Lazarus, H., et al. Characterization of a unique cell line (LAZ 221) from human acute lymphocytic ("null" cell) leukemia. Cancer Research. 38 (5), 1362-1367 (1978).
- Mackensen, A., et al. Evidence for in situ amplification of cytotoxic T-lymphocytes with antitumor activity in a human regressive melanoma. Cancer Research. 53 (15), 3569-3573 (1993).
- Crowley, L. C., Scott, A. P., Marfell, B. J., Boughaba, J. A., Chojnowski, G., Waterhouse, N. J. Measuring cell death by propidium iodide uptake and flow cytometry. Cold Spring Harbor Protocols. 2016 (7), 647-651 (2016).
- Freshney, R. I. Primary Culture. Culture of Animal Cells. , (2005).
- Dahmardeh, M., et al. . Unpublished data. , (2018).
- Majno, G., Joris, I. Apoptosis, oncosis, and necrosis. An overview of cell death. American Journal of Pathology. 146 (1), 3-15 (1995).
- Bellve, K., Standley, C., Lifshitz, L., Fogarty, K. Design and Implementation of 3D Focus Stabilization for Fluorescence Microscopy. Biophysical Journal. 106 (2), 606a (2014).
- Liebel, M., Hugall, J. T., Van Hulst, N. F. Ultrasensitive Label-Free Nanosensing and High-Speed Tracking of Single Proteins. Nano Letters. 17 (2), 1277-1281 (2017).
- Young, G., et al. Quantitative mass imaging of single biological macromolecules. Science. 360 (6387), 423-427 (2018).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten