Zum Anzeigen dieser Inhalte ist ein JoVE-Abonnement erforderlich. Melden Sie sich an oder starten Sie Ihre kostenlose Testversion.
Method Article
Synthese von Estern über ein grüner Steglich-Veresterung in Acetonitril
In diesem Artikel
Zusammenfassung
Eine modifizierte Steglich-Veresterung-Reaktion wurde verwendet, um eine kleine Bibliothek von Ester-Derivaten mit primären und sekundären Alkoholen zu synthetisieren. Die Methodik verwendet einen halogenfreien und grüner Lösungsmittel, Acetonitril und Produkt Isolierung in hohe Erträge ohne die Notwendigkeit für die chromatographische Reinigung ermöglicht.
Zusammenfassung
Die Steglich-Veresterung ist eine weit verbreitete Reaktion für die Synthese von Estern aus Carbonsäuren und Alkoholen. Effiziente und mild, ist die Reaktion häufig ausgeführte mit Chlor oder Amid Lösungsmittel Systeme, die gefährlich für die menschliche Gesundheit und die Umwelt sind. Unsere Methodik nutzt Acetonitril als eine grünere und weniger gefährlichen Lösungsmittelsystem. Dieses Protokoll stellt Zinssätze und Renditen, die herkömmliche Lösungsmittel Systeme vergleichbar sind und beschäftigt ein Absaug- und waschen-Sequenz, die eliminiert die Notwendigkeit für die Reinigung von Ester Produkt über Säulenchromatographie. Diese allgemeine Methode lässt sich eine Vielzahl von Carbonsäuren paar mit 1° und 2° aliphatische Alkohole, benzylic und allylic Alkohole und Phenole, reine Ester in hohen Ausbeuten zu erhalten. Das Ziel des hier beschriebenen Protokolls soll eine umweltfreundlichere Alternative zu einer gemeinsamen Veresterung Reaktion zur Verfügung zu stellen, die in akademischen und industriellen Anwendungen nützlich für Ester Synthese dienen könnten.
Einleitung
Ester-Verbindungen sind für Anwendungen wie Aromastoffe, Arzneimittel, Kosmetika und Materialien verbreitet. Im Allgemeinen ist Carbodiimide Koppelung Reagenzien verwendet, eine Ester-Bildung aus einer Carbonsäure und ein Alkohol-1zu erleichtern. Z. B. in der Steglich-Veresterung Dicyclohexylcarbodiimide (DCC) ist reagierte mit einer Carbonsäure in Gegenwart von 4-Dimethylaminopyridine (DMAP) zu einer aktivierten Säure Ableitung bilden in der Regel in einem chlorierten Lösungsmittel-System oder Dimethylformamid (DMF)2,3,4. Die aktivierte Säure Ableitung durchläuft dann eine nucleophilen Acyl-Substitution mit einem Alkohol Ester Produkt bilden, die in der Regel per Chromatographie gereinigt wird. Die Steglich-Veresterung ermöglicht eine milde Kopplung von großen, komplexen Carbonsäuren und Alkohole, einschließlich sterisch behindert sekundäre und tertiäre Alkohole2,5,6. Das Ziel dieser Arbeit ist es, Steglich Veresterung das Standardprotokoll um eine grünere synthetische Option für diese gemeinsame Veresterung Reaktion zu ändern.
Ein wichtiger Aspekt bei der Gestaltung der neuen synthetischen Methodik soll versuchen, die Verwendung und die Bildung von gefährlichen Stoffen zu minimieren. Die zwölf Prinzipien der grünen Chemie7 kann verwendet werden, um einen Leitfaden für die Erstellung sicherer Synthesen bieten. Einige von Ihnen gehören die Prävention von Abfallaufkommen (Grundsatz 1) und die Verwendung sicherer Lösungsmittel (Prinzip 5). Insbesondere entfallen Lösungsmittel 80-90 % der nichtwässrigen Masse des Materials in der Arzneimittelherstellung8. So kann ein Protokoll, um eine weniger gefährliche Lösungsmittel verwenden ändern einen großen Einfluss auf das Grün einer organische Reaktion zu machen.
Steglich-Veresterung Reaktionen verwenden oft wasserfreie chlorierte Lösungsmittel Systeme oder DMF; Allerdings sind diese Lösungsmittel zur Sorge für die Umwelt und die menschliche Gesundheit. Dichlormethan (CH2Cl2) und Chloroform (KCHL3) sind wahrscheinlich menschlichen Karzinogene und DMF hat Reproduktionstoxizität Bedenken9. Darüber hinaus ist CH2Cl2 ozonschädigenden10. So würde eine weniger gefährliche Lösungsmittel für die Steglich-Veresterung von großem Nutzen sein. Es gibt, zwar nicht als Ersatz für polare aprotische Lösungsmittel noch grün wird Acetonitril als umweltfreundlicher Ersatz für CH2Cl2, KCHL3und DMF9empfohlen. Acetonitril wird derzeit als Nebenprodukt bei der Herstellung von Acrylnitril hergestellt; jedoch werden wurde eine grüne Synthese von Acetonitril aus Biomasse auf akademischer Ebene berichtet11, und mögliche Optionen für die Wiederverwendung und Verwertung von Abfallströmen untersuchten12. Acetonitril wurde zuvor als eine umweltfreundlichere Alternative Lösungsmittel für Carbodiimide Kupplung Reaktionen in der Festphasen-Peptidsynthese verwendet Amid Gestänge13zu bilden. Die Verwendung von Acetonitril als Lösungsmittel-System für Steglich Esterifications wurde gezeigt14,15,16,17,18,19, 20,21; Allerdings haben diese Methoden nicht auf der grüne Aspekt des Lösungsmittels und beschäftigen auch zusätzliche Reinigung durch Säulenchromatographie.
Verringerung des Bedarfs an Säulenchromatographie als Reinigungsschritt auch minimiert gefährliche Lösungsmittel Abfall8. Neben der Verwendung von weniger gefährlichen Reaktionslösungsmittel, ermöglicht die Methodik die Isolation der hochreines Produkt ohne die Notwendigkeit für die Chromatographie. Die traditionell verwendeten Dicyclohexylcarbodiimide (DCC) Kupplung Reagenz wird ersetzt mit 1-Ethyl - 3-(3-Dimethylaminopropyl) Carbodiimide Hydrochlorid (EDC). Die grundlegende funktionelle Amingruppe auf dieses Reagenz ermöglicht die Nebenprodukte der Reaktion und alle verbleibenden Reagenzien über saure und basische Wäsche Schritte entfernt werden.
Das Protokoll enthaltenen kann mit einer Vielzahl von Partnern von Säure und Alkohol (Abbildung 1) verwendet werden. Es wurde verwendet, um eine kleine Bibliothek von Cinnamyl Ester Derivate mit Primar-, Sekundar-, Benzyl und Allyl Alkohole und Phenole22zu synthetisieren. Darüber hinaus die Rate der Veresterung Reaktion in Acetonitril ist vergleichbar mit dem in der chlorierten und DMF Lösungsmittel Systeme, ohne eine Notwendigkeit zu trocknen oder Acetonitril vor der Reaktion22zu destillieren. Ester aus tertiären Alkoholen synthetisiert wurden nicht isoliert, das ist derzeit eine Einschränkung der Methode im Vergleich zu den traditionellen Steglich-Veresterung in chlorierte Lösungsmittel23. Darüber hinaus könnte andere Säure-labile Gruppen der Acid-Waschung, betroffen werden möglicherweise erfordern Säulenchromatographie zur Reinigung nach Acetonitril Entfernung. Trotz dieser Einschränkungen ist die Reaktion eine einfache und allgemeine Methode für die Synthese von Estern in hohe Erträge mit einer Reihe von Alkohol und die Carbonsäure Komponenten. Die Verwendung einer grüneren Lösungsmittelsystem und hoher Reinheit ohne die Notwendigkeit für Chromatographie Schritte machen dies eine attraktive Alternative zu einem traditionellen Steglich-Veresterung zu Protokoll.
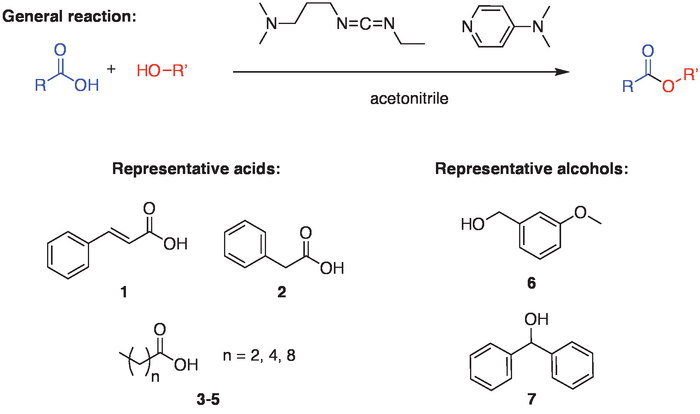
Abbildung 1: Allgemeine Reaktionsschema. Das allgemeine Schema für die Reaktion beinhaltet die Kopplung von einer Carbonsäure und ein Alkohol, der durch eine Carbodiimide Kupplung Reagenz erleichtert wird (1-Ethyl - 3-(3-Dimethylaminopropyl) Carbodiimide Hydrochlorid oder EDC) und 4-Dimethylaminopyridine () DMAP) in Acetonitril. Um die Reaktion Breite zu demonstrieren, wurden Ester gebildet mit verschiedenen Säuren (1-5) mit einem primären (6) oder sekundären (7) Alkohol. Bitte klicken Sie hier für eine größere Version dieser Figur.
Protokoll
Achtung: Konsultieren Sie Sicherheitsdatenblätter (SDB) vor dem Gebrauch von Chemikalien in diesem Verfahren. Verwendung geeigneter persönlicher Schutzausrüstung (PSA) einschließlich Splash goggles, Laborkittel und Nitril oder Butyl Handschuhe als viele der Reagenzien und Lösungsmitteln sind ätzend oder entzündlich. Führen Sie alle Reaktionen in einer Dampfhaube. Es ist unnötig, trockene Gläser oder Stickstoff-Atmosphäre für dieses Protokoll verwenden.
1. Carbodiimide Kupplung Reaktion für primäre Alkohole
- In ein 50 mL Runde untere Kolben kombinieren (E)-Cinnamic Acid (151 mg, 1,02 Mmol, 1,2 Equiv), DMAP (312 mg, 2,55 Mmol, 3 Equiv) und EDC (244 mg, 1,28 Mmol, 1,5 Equiv). Die Mischung zusammen mit Stir Bar Acetonitril (15 mL) und 3-Methoxybenzyl Alkohol (98 μL, 0,85 Mmol, 1 Equiv) hinzufügen.
Achtung: Acetonitril ist eine brennbare Lösungsmittel. - Klemmen Sie die Küvette in einem 40 ° C-Wasserbad und rühren Sie die Reaktion.
Hinweis: Wenn die Reaktion ein aromatischen Alkohols beinhaltet, überwachen Sie die Reaktion für den Verlust des Alkohols durch Dünnschichtchromatographie (TLC) mit 1:3 Ethylacetat/Hexan. Die Reaktion ist abgeschlossen, wenn der Alkohol-Spot nicht mehr auf die TLC Platte durch Bestrahlung mit UV-Licht sichtbar ist.
2. Gewinnung Aufarbeitung
- Sobald die Reaktion abgeschlossen, wie von TLC oder nach 45 min angegeben ist, entfernen Sie die Acetonitril unter vermindertem Druck mit einem Drehverdampfer, um festem Untergrund Rohöl zu erhalten.
Hinweis: Finden Sie zusätzliche Ressourcen für Informationen über die Verwendung einer Drehverdampfer24,25. - Der Rückstand fügen Sie hinzu, Diethylether (20 mL) und 1 M HCl (20 mL). Schwenken Sie die Flasche um die Rückstände in die Lösungsmittel Schichten aufzulösen.
Achtung: Diethylether ist ein Lösungsmittel, Leichtentzündlich.
Hinweis: Um die Lösungsmittel Gefahr zu verringern, kann Ethylacetat anstelle der Diethylether verwendet werden; Allerdings gibt es ein größeres Potenzial für Emulsionsbildung während der Extraktion und waschen Schritte. - Gießen Sie die Lösung in einem separatory Trichter. Spülen Sie den verdampfenden Kolben mit zusätzlichen Diethylether (5 mL) und den separatory Trichter fügen Sie die Spülung hinzu.
- Schütteln Sie den separatory Trichter um das Produkt in den Äther-Layer, Entlüftung in regelmäßigen Abständen zu extrahieren. Ermöglichen Sie die Schichten zu trennen, und entfernen Sie dann die wässrige Schicht durch Entwässerung es heraus von der Unterseite des Trichters in einen Erlenmeyerkolben oder Becher.
Hinweis: Finden Sie zusätzliche Ressourcen für Informationen bezüglich Extraktionen und die Verwendung einer separatory Trichter24,25.
(3) Waschvorgang
- Die organische Schicht noch in den separatory Trichter hinzugeben Sie 1 M HCl (20 mL) und schütteln Sie vorsichtig separatory Kolben, regelmäßig entlüften. Ermöglichen Sie die Schichten zu trennen, und entfernen Sie dann die wässrige Schicht durch Entwässerung es heraus von der Unterseite des Trichters in einen Erlenmeyerkolben oder Becher.
- Wiederholen Sie den Waschvorgang mit gesättigten Natriumbikarbonat Lösung (2 x 20 mL) und dann mit gesättigten Natriumchlorid-Lösung (20 mL).
- Ausgießen der organische Schicht von der Spitze des separatory Trichter in einem sauberen Erlenmeyerkolben Trocknen der Schicht mit Magnesiumsulfat und Schwerkraft filter die Lösung durch Filterpapier in einem massierten Verdampfungskolben.
Hinweis: Finden Sie zusätzliche Ressourcen für Informationen bezüglich Extraktionen und der Einsatz von Magnesium-Sulfat als eine Trocknung Agent24,25. - Entfernen Sie das Lösungsmittel Diethylether unter vermindertem Druck mit einem Drehverdampfer.
- Analysieren Sie eine Probe des Produktes von 1H und 13C-NMR-Spektroskopie in CDCl3 und durch Massenspektrometrie.
Hinweis: Finden Sie zusätzliche Ressourcen für Informationen über die Vorbereitung der Proben für NMR-Analyse24,25.
4. Carbodiimide Kupplung Reaktion für Sekundär- und Elektron-defizienten Alkohole
- In ein 50 mL Runde untere Kolben kombinieren (E)-Cinnamic Acid (151 mg, 1,02 Mmol, 1,2 Equiv), DMAP (312 mg, 2,55 Mmol, 3 Equiv) und EDC (244 mg, 1,28 Mmol, 1,5 Equiv). Die Mischung zusammen mit Stir Bar Acetonitril (15 mL) und Diphenylmethanol (157 mg, 0,85 Mmol, 1 Equiv) hinzufügen.
Achtung: Acetonitril ist eine brennbare Lösungsmittel. - Klemmen Sie den Kolben und rühren Sie der Reaktion bei Raumtemperatur für 24 h einfügen ein Luft-Kondensator in den Hals der Flasche Lösungsmittel verdampfen zu minimieren.
- Folgen Sie die Extraktion Aufarbeitung und Waschverfahren in Schritte 2 und 3 oben beschriebenen.
5. Carbodiimide Kupplung Reaktion für langkettige oder hydrophoben Carbonsäuren
- Kombinieren Sie in ein 50 mL Runde untere Kolben Decanoic Säure (146 mg, 0,85 Mmol, 1 Equiv), DMAP (312 mg, 2,55 Mmol, 3 Equiv) und EDC (244 mg, 1,28 Mmol, 1,5 Equiv). Die Mischung zusammen mit Stir Bar Acetonitril (15 mL) und Diphenylmethanol (157 mg, 0,85 Mmol, 1 Equiv) hinzufügen.
Achtung: Acetonitril ist eine brennbare Lösungsmittel. - Klemmen Sie den Kolben und rühren Sie der Reaktion bei Raumtemperatur für 24 h einfügen ein Luft-Kondensator in den Hals der Flasche Lösungsmittel verdampfen zu minimieren. Wenn ein primärer Alkohol verwendet wird, rühren Sie die Reaktion in einem Wasserbad bei 40 ° C für 1 h.
- Folgen Sie die Extraktion Aufarbeitung und Waschverfahren in Schritte 2 und 3 oben beschriebenen.
Ergebnisse
Mit der veränderten Steglich-Veresterung in Acetonitril, gefolgt von einer Säure-Base-Extraktion-Aufarbeitung, erhielt 3-Methoxybenzyl Cinnamate (8) als hellgelbe Öl (205 mg, 90 % Ausbeute) ohne die Notwendigkeit der Säulenchromatographie. 1 H und 13C-NMR-Spektren sind in Abbildung 2 zu bestätigen, die Struktur und Reinheit anzuzeigen vorgestellt.
Verbindu...
Diskussion
Die hier vorgestellte Methodik wurde entwickelt, um die Gefahren von Lösungsmittel, die im Zusammenhang mit einer traditionellen Steglich-Veresterung mithilfe einer grüneren Lösungsmittelsystem und reduzieren die Notwendigkeit für Spalte Chromatographie8,9zu minimieren. Vergleichbare Reaktion Erträge und Preise können mit dem Einsatz von Acetonitril anstelle von trockenen chlorierte Lösungsmittel oder DMF22erreicht werden.
Offenlegungen
Die Autoren haben nichts preisgeben.
Danksagungen
Diese Forschung wurde von Siena College und das Zentrum für Undergraduate Research und schöpferische Tätigkeit unterstützt. Wir bedanken uns bei Dr. Thomas Hughes und Dr. Kristopher Kolonko für hilfreiche Gespräche, Frau Allycia Barbera für frühen Stadium arbeiten auf dieser Methodik, und die Siena College Stewart erweiterte Instrumentierung und Technologiezentrum (SAInT) für Instrumentierung Ressourcen.
Materialien
| Name | Company | Catalog Number | Comments |
| trans -cinnamic acid | Acros Organics | 158571000 | |
| butyric acid | Sigma-Aldrich | B103500 | Caution: corrosive |
| hexanoic acid | Sigma-Aldrich | 153745-100G | Caution: corrosive |
| decanoic acid | Sigma-Aldrich | 21409-5G | Caution: corrosive |
| phenylacetic acid | Sigma-Aldrich | P16621-5G | |
| 3-methoxybenzyl alcohol | Sigma-Aldrich | M11006-25G | |
| diphenylmethanol | Acros Organics | 105391000 | Benzhydrol |
| chloroform-d | Acros Organics | 166260250 | 99.8% with 1% v/v tetramethylsilane, Caution: toxic |
| hexane | BDH Chemicals | BDH1129-4LP | Caution: flammable |
| ethyl acetate | Sigma-Aldrich | 650528 | Caution: flammable |
| diethyl ether | Fisher Scientific | E138-500 | Caution: flammable |
| acetonitrile | Fisher Scientific | A21-1 | ACS Certified, >99.5%, Caution: flammable |
| 4-dimethylaminopyridine | Acros Organics | 148270250 | Caution: toxic |
| magnesium sulfate | Fisher Scientific | M65-3 | |
| hydrochloric acid, 1 M | Fisher Scientific | S848-4 | Caution: corrosive |
| sodium chloride | BDH Chemicals | BDH8014 | |
| sodium bicarbonate | Fisher Scientific | S25533B | |
| 1-ethyl-3-(3-dimethylaminopropyl)carbodiimide hydrochloride | Chem-Impex | 00050 | Caution: skin and eye irritant |
| thin layer chromatography plates | EMD Millipore | 1055540001 | aluminum backed sheets |
| Note: All commercially available reagents and solvents were used as received without further purification. |
Referenzen
- Williams, A., Ibrahim, I. T. Carbodiimide chemistry: recent advances. Chemical Reviews. 81 (6), 589-636 (1981).
- Höfle, G., Steglich, W., Vorbrüggen, H. 4-Dialkylaminopyridines as Highly Active Acylation Catalysts. [New synthetic method (25)]. Angewandte Chemie International Edition in English. 17 (8), 569-583 (1978).
- Neises, B., Steglich, W. Simple Method for the Esterification of Carboxylic Acids. Angewandte Chemie International Edition in English. 17 (7), 522-524 (1978).
- Tsvetkova, B., Tencheva, J., Peikov, P. Esterification of 7-theophyllineacetic acid with diethylene glycol monomethyl ether. Acta pharmaceutica. 56 (2), 251-257 (2006).
- Tsakos, M., Schaffert, E. S., Clement, L. L., Villadsen, N. L., Poulsen, T. B. Ester coupling reactions - an enduring challenge in the chemical synthesis of bioactive natural products. Natural Product Reports. 32 (4), (2015).
- Morales-Serna, J., et al. Using Benzotriazole Esters as a Strategy in the Esterification of Tertiary Alcohols. Synthesis. 2010 (24), 4261-4267 (2010).
- Anastas, P., Eghbali, N. Green Chemistry: Principles and Practice. Chemical Society Reviews. 39 (1), 301-312 (2010).
- Constable, D. J. C., Jimenez-Gonzalez, C., Henderson, R. K. Perspective on solvent use in the pharmaceutical industry. Organic Process Research and Development. 11 (1), 133-137 (2007).
- Byrne, F. P., et al. Tools and techniques for solvent selection: green solvent selection guides. Sustainable Chemical Processes. 4 (1), 7 (2016).
- Hossaini, R., Chipperfield, M. P., Montzka, S. A., Rap, A., Dhomse, S., Feng, W. Efficiency of short-lived halogens at influencing climate through depletion of stratospheric ozone. Nature Geoscience. 8 (3), (2015).
- Corker, E. C., Mentzel, U. V., Mielby, J., Riisager, A., Fehrmann, R. An alternative pathway for production of acetonitrile: ruthenium catalysed aerobic dehydrogenation of ethylamine. Green Chemistry. 15 (4), 928-933 (2013).
- McConvey, I. F., Woods, D., Lewis, M., Gan, Q., Nancarrow, P. The Importance of Acetonitrile in the Pharmaceutical Industry and Opportunities for its Recovery from Waste. Organic Process Research & Development. 16 (4), 612-624 (2012).
- Jad, Y. E., et al. Peptide synthesis beyond DMF: THF and ACN as excellent and friendlier alternatives. Organic & Biomolecular Chemistry. 13 (8), 2393-2398 (2015).
- Williams, J., et al. Quantitative method for the profiling of the endocannabinoid metabolome by LC-atmospheric pressure chemical ionization-MS. Analytical Chemistry. 79 (15), 5582-5593 (2007).
- Benmansour, F., et al. Discovery of novel dengue virus NS5 methyltransferase non-nucleoside inhibitors by fragment-based drug design. European Journal of Medicinal Chemistry. 125, 865-880 (2017).
- Maier, W., Corrie, J. E. T., Papageorgiou, G., Laube, B., Grewer, C. Comparative analysis of inhibitory effects of caged ligands for the NMDA receptor. Journal of Neuroscience Methods. 142 (1), 1-9 (2005).
- Schwartz, E., et al. Water soluble azido polyisocyanopeptides as functional β-sheet mimics. Journal of Polymer Science Part A: Polymer Chemistry. 47 (16), 4150-4164 (2009).
- Hangauer, M. J., Bertozzi, C. R. A FRET-Based Fluorogenic Phosphine for Live-Cell Imaging with the Staudinger Ligation. Angewandte Chemie International Edition. 47 (13), 2394-2397 (2008).
- Hsieh, P. -. W., Chen, W. -. Y., Aljuffali, I., Chen, C. -. C., Fang, J. -. Y. Co-Drug Strategy for Promoting Skin Targeting and Minimizing the Transdermal Diffusion of Hydroquinone and Tranexamic Acid. Current Medicinal Chemistry. 20 (32), 4080-4092 (2013).
- Moretto, A., et al. A Rigid Helical Peptide Axle for a [2]Rotaxane Molecular Machine. Angewandte Chemie International Edition. 48 (47), 8986-8989 (2009).
- Hanessian, S., McNaughton-Smith, G. A versatile synthesis of a β-turn peptidomimetic scaffold: An approach towards a designed model antagonist of the tachykinin NK-2 receptor. Bioorganic & Medicinal Chemistry Letters. 6 (13), 1567-1572 (1996).
- Lutjen, A. B., Quirk, M. A., Barbera, A. M., Kolonko, E. M. Synthesis of (E)-cinnamyl ester derivatives via a greener Steglich esterification (In Press). Bioorganic & Medicinal Chemistry. , (2018).
- Wang, Z. Steglich Esterification. Comprehensive Organic Name Reactions and Reagents. , (2010).
- Padias, A. B. . Making the Connections: A How-To Guide for Organic Chemistry Lab Techniques. , (2011).
- Zubrick, J. W. . The Organic Chem Lab Survival Manual: A Student's Guide to Techniques. , (2015).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten