Method Article
Função de receptores nicotínicos de acetilcolina em fatias de cérebro de rato através de Laser Flash fotólise de nicotina Photoactivatable de sondagem
Neste Artigo
Resumo
Este artigo apresenta um método para estudar os receptores nicotínicos de acetilcolina (nAChRs) em fatias de cérebro de rato por nicotina uncaging. Quando acoplado com gravação de braçadeira do remendo simultânea e 2-fóton laser, microscopia eletrônica de varredura, nicotina uncaging conecta a função do receptor nicotínico com morfologia celular, proporcionando uma compreensão mais profunda da neurobiologia colinérgico.
Resumo
A acetilcolina (ACh) age através de receptores para modular uma variedade de processos neuronais, mas isso tem sido desafiador para ligar a função de receptor de ACh com Localização subcellular dentro das células onde esta função é desempenhada. Para estudar a Localização subcellular de receptores nicotínicos da ACh (nAChRs) no tecido cerebral nativo, um método óptico foi desenvolvido para lançamento preciso de nicotina em locais discretos perto membranas neuronais durante gravações eletrofisiológicas. Patch-fixada neurônios no cérebro fatias são preenchidas com tingem para visualizar sua morfologia durante a microscopia do laser 2-fóton, e uncaging de nicotina é executado com um flash de luz, concentrando-se um feixe de laser 405 nm perto de uma ou mais membranas celulares. Celulares atuais deflexões são medidos, e uma imagem tridimensional de alta resolução de (3D) do neurônio gravado é feita para permitir a reconciliação do nAChR respostas com morfologia celular. Este método permite a análise detalhada da distribuição funcional nAChR em preparações de tecido complexo, prometendo para melhorar a compreensão da neurotransmissão colinérgico.
Introdução
Sinalização colinérgicos modula numerosos processos cerebrais, incluindo controle de atenção, movimento volitivos e recompensa1,2. Drogas que melhoram a transmissão da acetilcolina (ACh) são usadas para tratar o impairment cognitive associado com a doença de Alzheimer, sugerindo um papel importante para sistemas colinérgicos na cognição3. Uma melhor compreensão dos receptores colinérgicos e circuitos nos Estados saudáveis e doentes pode levar a melhor abordagens terapêuticas para várias doenças/distúrbios neurológicos.
Receptores nicotínicos da ACh (nAChRs) são uma família de canais iônicos ligante que flux cações em resposta a ACh endógena ou exógena nicotina de produtos do tabaco. Dado o fato de que eles estavam entre os receptores de neurotransmissores primeiros ser descrito4, nAChR farmacologia e localização em fibras musculares é bem compreendida pelos receptores do tipo muscular. Por outro lado, comparativamente pouco é conhecido sobre a farmacologia e a distribuição subcellular de nativo nAChRs no cérebro. Esta lacuna no conhecimento recentemente foi abordada através do desenvolvimento de uma sonda de romance química que permite a ativação rápida e espacialmente restrita do nAChRs no tecido cerebral durante cellular imaging e gravação eletrofisiológicas5. Aqui, são descritas as etapas envolvidas nesta abordagem metodológicas, com o objectivo geral de reforçar a capacidade de conectar nAChR função com estrutura neuronal.
Photoactivatable nicotina (PA-Nic; nome químico: 1-[7-[bis(carboxymethyl)-amino] cumarina-4-yl] metil-nicotina) pode ser photolyzed com ~ 405 nm laser flashes eficientemente liberar a nicotina5,6. Antes da uncaging, PA-Nic é estável em solução e exibe sem características farmacológicas ou fotoquímicos desagradável5. Após a fotólise, nicotina liberada previsivelmente ativa nAChRs e os uncaging subprodutos são farmacologicamente inerte5. Um laser assemelhace é usado como a fonte luminosa fotólise com uma potência de saída > 1 mW medido na amostra. Quando localizado, alvo de foto-estimulação é combinada com a capacidade de localizar as membranas celulares com laser 2-fotão microscopia (2PLSM), e as duas principais vantagens desta abordagem são plenamente realizadas: fotólise velocidade e precisão espacial.
Em muitos aspectos, a fotólise do PA-Nic é superior aos outros métodos de entrega de nAChR ligantes aos receptores dentro de fatias de cérebro. Essas abordagens incluem banho aplicação7 e drogas local entrega através de uma pipeta de baiacu8. Considerando que a primeira abordagem tende a super enfatizar os efeitos a longo prazo da droga aplicada, a última abordagem pode sofrer de variabilidade na cinética de resposta entre ensaios e através de células. Nenhuma dessas abordagens alternativas adequadamente pode distinguir as atividades do receptor em locais diferentes de celulares do mesmo neurônio. Optogenetically-ativado a liberação de ACh tem sido utilizada para investigação de nativo nAChRs9,10,11, mas não tem sido útil para locais de mapeamento nAChR subcellular. Além disso, a maioria dos estudos utilizando esta abordagem têm invocado um ChR2-expressando cromossomo artificial bacteriano transgénico mouse com transmissão colinérgicas anormal12,13,14, 15 , 16 , 17.
PA-Nic fotólise não é a abordagem apenas ótica para estudar os receptores colinérgicos. Um enjaulado carbacol foi usado funcionalmente mapear atividades de receptores ACh em pilhas cultivadas18 e cérebro fatias19, mas não era comercialmente disponível para estudos comparativos durante o desenvolvimento do PA-NIC. Um bis de rutênio (bipiridina)-complexo de nicotina (RuBi-nicotina) foi relatada para permitir a nicotina uncaging20, mas estudo de preparações comerciais de RuBi-nicotina provou ser inferior ao PA-Nic em uma comparação Head-to-5. Pode ser útil repetir tais experimentos comparativos com não-comercial, altamente purified RuBi-nicotina, como sua absorção visível poderia elogiar características do PA-Nic para estudos colinérgicos. Finalmente, nAChRs têm também sido opticamente manipulados usando uma combinação de foto-comutável ligantes e receptores geneticamente modificados21. Esta abordagem é complementar a fotólise de PA-Nic no tecido cerebral, com a capacidade/exigência do alvo genético do nAChR modificado, visto como uma vantagem e uma desvantagem.
Devem notar-se vários requisitos chaves desta abordagem. Primeiro, um método de visualização adequada é necessária para localizar com precisão a membrana neuronal. Imagem com microscopia de fluorescência-epi convencional pode ser suficiente quando estudar culturas de células, mas para a gravação de neurônios em fatias de cérebro ou outras preparações de tecido grosso, 2PLSM ou a microscopia confocal é uma exigência. Em segundo lugar, um método adequado é necessário para posicionar o feixe de laser de fotólise. Esta abordagem utiliza uma cabeça de digitalização dual-galvanômetro com dois espelhos de independente x-y para a digitalização de varredura do feixe de imagem e ponto photoactivation usando o uncaging do laser feixe22,23,24. Outras soluções mais limitadas são possíveis, tais como (1) uma cabeça de varredura de single-galvanômetro que alternativamente raster faz a varredura do feixe de imagem e o feixe de uncaging ou (2) simplesmente dirigir o feixe de uncaging para o centro do campo de visão tal que a célula é trazida Esta posição por fotólise de flash. Em terceiro lugar, um sistema é necessário para simultânea eletrofisiológicos gravação se deseja coletar sinais fisiológicos durante as experiências. As condições acima mencionadas podem ser atendidas com uma técnica de imagem todos-óptico adequada, como recentemente descrito5. Abaixo, um protocolo detalhado está incluído que descreve as principais etapas desta abordagem.
Protocolo
Trabalhos relativos à preparação de fatia do cérebro foi revisto e aprovado pelo Comitê de uso (protocolo #IS00003604) e cuidado de Animal Universidade Northwestern.
Atenção: Lasers usados para ponto de foto-estimulação são visível laser classe IIIb que têm potencial para causar danos aos olhos. 2PLSM requer o laser infravermelho próximo (NIR) classe IV (> 500 mW), que tem o potencial de causar sérios danos aos olhos e até mesmo queimaduras em outros tecidos. Contenção do feixe de laser adequado, bloqueios de sistema, além de controles de engenharia e administrativos são necessários para assegurar a operação segura de equipamentos baseados em laser. Sempre procure o pessoal de segurança do laser local quando se trabalha com lasers.
1. calibração e verificação de Laser(s) a Uncaging
-
Quantificar a potência do laser para ser entregue para a amostra.
- Ligue o laser 405 nm (100 mW potência máxima com o sinal de controle 5 V) e deixar o sistema de laser aquecer por cerca de 10 min.
Nota: O laser ainda é fechado (com 0 V drive) e não há nenhum poder de saída até que o laser é enviado a uma tensão de controle para modular a energia de saída. - Coloque um medidor de energia no plano de amostra de tecido ou no lugar da lente do condensador. Centro manualmente o medidor em relação ao caminho óptico/objectiva.
- Defina o medidor para o intervalo de comprimento de onda correto (400-1100 nm). Zero o medidor pressionando o botão apropriado.
- Usando controles de software, selecione 100 (fora do máximo 1000; 1000 = 5 V) para a potência de laser 405 nm, que define o laser para 10% da potência máxima. Se desejado, a tensão de controle do laser também pode ser alimentada na PrairieView sistema através de VoltageRecord para fornecer um registro digital do comando timing e nível de potência do sinal.
- Grave a leitura do medidor de energia.
- Selecione 150 (15% do máximo 1000) para a 405 nm laser potência de saída e gravar a leitura do medidor de energia. Repita isto para os seguintes poderes de saída coletar uma curva de potência do laser: 200, 250, 300, 350, 400, 450, 500, 550, 600, 650, 700, 750, 800, 850, 900, 950 e 1000.
- Ligue o laser 405 nm (100 mW potência máxima com o sinal de controle 5 V) e deixar o sistema de laser aquecer por cerca de 10 min.
-
Calibre o Galvanómetro de laser uncaging. Execute as etapas a seguir, sempre que houver uma alteração de componentes ópticos do sistema, sempre que há uma preocupação sobre o posicionamento exato do local, ou regularmente todos os meses.
- Instale o 60 x água-mergulho microscópio lente objetiva que será usado em photostimulation e experimentos de imagem. No software de aquisição/imagem, selecione a 60 x lente objetiva e uma configuração de zoom óptico de 1 (consulte a etapa 3.1.4.2.).
- Marque um círculo preenchido numa lâmina de microscopia de vidro limpo com um marcador permanente vermelho. Coloque o slide no palco, microscópio com marcador em direção ao objetivo.
- Pré-foco o microscópio na região do marcador vermelho com um objetivo de 10x ou 4x. Adicionar 1 a 2 mL de água para o topo do marcador vermelho ponto/ponto e em seguida, alterne para o objectivo de 60 x e mergulhe o objectivo da água. Foco da lente objetiva na região fina marcador vermelho.
- Alternar para varredura a laser 2-fóton. Para a maioria dos sistemas, mover a torre para a posição #1, mover o prisma trinocular fora do caminho de luz, mova o espelho de varredura cabeça para frente e definir o comprimento de onda do laser para ~ 900 nm. Selecione a opção caixa de 512 x 512 pixels para os parâmetros de aquisição de imagem, que é o elemento de pixel do padrão para a rotina de calibração de espelho de estimulação.
- Inicie o sistema de digitalização com um poder do laser de imagem maior do que o mínimo e afinar o foco objetivo para a camada de fluorescência fina marcador vermelho. Escolha um campo no campo de fluorescência claro de detritos e uniformemente revestido com marcador.
Nota: A instalação neste protocolo usa software de aquisição/imagens de PrairieView 5.4. - Abra a função de Uncaging do Galvo calibração dentro do menu ferramentas – calibração/alinhamento do software. Atravesse o tutorial queimar pontos para a calibração espacial do segundo par de espelho do galvanômetro.
- O tutorial de queimar as manchas , escolher a 405 nm do laser, selecione um poder de estimulação do laser de 400 e uma duração de estimulação de 20 ms. isso deve render pequeno (~ 1-5 µm de diâmetro) furos no marcador vermelho.
Nota: Configurações como ~ 2-4 mW e 1-10 ms são normalmente usadas, mas as configurações são determinadas pela amostra. As configurações de energia de foto-estimulação PA-Nic são prováveis ser muito menor do que a energia necessária durante a calibração para ablate um buraco visível no slide marcador vermelho. Esta rotina de calibração é útil para localizar pontos de photostimulation, mas não deve ser usada para inferir a volumes photostimulation absoluto durante respostas fisiológicas. - Selecione atualização para estimular e refrescar a imagem após o ponto de centro queima e mova o indicador vermelho redondo para a localização real do local. Fazer isso para o local do centro, o ponto de centro direita, no ponto inferior do centro e finalmente para uma grade de nove pontos (todos os cantos e bordas mais o centro da imagem).
Nota: A centralizar e locais de ponto corrigidos inferiores determinam as tensões do galvanômetro de estimulação para definir o verdadeiro centro e X e Y fatores de escala para combinar com o par de espelho de estimulação para o par de imagens de espelho. O software irá escalar e atualizar, todos os experimentos de MarkPoints subsequentes realizados em configurações de zoom diferentes do zoom de calibração espacial.
- O tutorial de queimar as manchas , escolher a 405 nm do laser, selecione um poder de estimulação do laser de 400 e uma duração de estimulação de 20 ms. isso deve render pequeno (~ 1-5 µm de diâmetro) furos no marcador vermelho.
- Teste a calibração abrindo a janela de MarkPoints e ativar manualmente os parâmetros de estimulação em spot(s) definidos em uma nova área da amostra. Certifique-se de que o arquivo de calibração correta, mais recentes é carregado na janela de MarkPoints . Ative o recurso MarkPoints/grupo ou Série de MarkPoints em um spot(s) definido ou utilizar o recurso Live/ablação para direita/esquerda clique com o mouse em qualquer lugar da imagem durante a varredura ao vivo para aplicar um pulso de teste e para verificar a calibragem correta.
Nota: A queimadura de laser ponto agora deve ser perfeitamente centrada no indicador de MarkPoints . - Monitorar e registrar a ativação do poder do pulso do laser e duração temporal tocando fora a tensão de unidade no programa VoltageRecord (consulte a etapa 1.1.4). Da mesma forma, grave a posição de cada ponto de estimulação usando um sinal de tensão reduzida dos sinais de realimentação derivado o par de espelhos do galvanômetro de foto-estimulação.
2. preparação da nicotina Photoactivatable (PA-Nic)
- Recupere uma parte alíquota do liofilizado photoactivatable droga de armazenamento.
Nota: O seguinte protocolo é específico para o PA-Nic; ajuste conforme necessário para outras drogas photoactivatable. Embora PA-Nic demonstra estabilidade excepcional5, tome precauções razoáveis para protegê-lo da exposição à luz brilhante durante a preparação e/ou experiências. Isto pode ser realizado por simplesmente trabalhar com pouca luz; Não é necessário restringir a vermelho luz filtrada. -
Executar a aplicação local de PA-NIC.
- Puxe uma micropipeta de vidro com uma abertura de diâmetro de 20-40 µm com um puxador de pipeta programável.
- Filtro ~ 1 mL de solução de gravação com um filtro de 0,22 µm. Resuspenda uma quantidade de PA-Nic na solução filtrada de gravação para produzir uma concentração final de 2 mM. Por exemplo, dissolva uma alíquota de 100 nmol liofilizado em 50 µ l de solução filtrada da gravação.
Nota: Uma composição de solução de gravação sugerido pode ser encontrada em recentes publicações5,6 empregando PA-Nic fotólise. - Costas-encha a pipeta de aplicação local com 50 µ l de 2 mM PA-NIC.
- Fixe a pipeta de aplicação local em um suporte de pipeta montado em um micromanipulador. Conecte o suporte pipeta através do tubo apropriado para um sistema de ejeção de pressão capaz de aplicação baixa pressão sustentada (1-2 libras por polegada quadrada).
- Usando o micromanipulador, manobre a pipeta de aplicação local para a solução de gravação extracelular e posição, a ponta da pipeta ligeiramente acima do tecido de cérebro de rato localizado ~ 50 μm da célula de interesse. Consulte um relatório anterior para um protocolo detalhado de preparação de fatia de cérebro de rato e remendo braçadeira gravações8.
- Verifique os parâmetros de aplicação, brevemente, aplicando pressão (psi de 1-2). Lá deve ser mínima para nenhum deslocamento da célula de interesse. Se ocorrer movimento significativo, reposicione a pipeta de aplicação local mais afastado (no sentido lateral e/ou axial) da célula de interesse.
- Depois de alcançar a braçadeira do remendo celular estável (detalhes para os quais estão incluídas em uma publicação prévia8), transformar-se na aplicação de pressão baixa (1-2 p.s.i) usando o interruptor manual apropriado sobre o dispositivo de ejeção de pressão. Sature o tecido circundante a célula com PA-Nic por 1-2 min antes de prosseguir para a próxima etapa.
-
Execute a aplicação de banho (superfusion) da PA-Nic para a fatia do cérebro.
- Dissolva uma quantidade de PA-Nic em um volume de solução apropriada para recirculação contínua produzir uma concentração final de 100 μM de gravação. Por exemplo, dissolva um 1 μmol alíquota em 10 mL de solução de gravação usando um tubo padrão de 15 mL.
- Começa recirculação da solução PA-Nic em uma taxa de 1,5-2 mL/min por abrir o controle de fluxo apropriado no sistema de perfusão. Recirculação ocorre para a duração da gravação. Para conservar a droga valiosa, minimize o volume de recirculação usando o tubo com um diâmetro interno mínimo e/ou encurtando o comprimento total da tubulação usada no sistema de perfusão.
Nota: Ao tomar estes passos, o volume para recirculação de banho pode ser reduzido a 5 mL de solução de PA-Nic. PA-Nic soluções muitas vezes podem ser usadas para consecutivos dois dias dentro da mesma semana de gravação se armazenado protegido da luz a 4 ° C. - Durante recirculação, continuamente bolha a solução com carbogênio (5% O2, 95% CO2) e manter a temperatura do banho a 32 ° C.
- Manter a fatia de cérebro em solução de gravação enquanto estiver trabalhando com PA-Nic em condições de pouca luz.
3. os neurônios com 2-Photon Laser, microscopia eletrônica de varredura de imagem
- Execute a visualização ao vivo da célula.
- Identificar/Visualizar um neurônio habenula medial (MHb) usando luz transmitida ou interferência diferencial infravermelho de contraste (IR/DIC) óptica e uma câmera de vídeo e estabelecer uma gravação de braçadeira do remendo celular estável. Referem-se a um protocolo anterior para obter detalhes sobre as gravações de braçadeira do remendo de neurônios em cérebro de rato agudamente preparada fatias8.
- Depois de estabelecer a alta resistência (> 1 GΩ) configuração de conexão celular, mas antes da invasão, mudar o set-up e software para o modo de digitalização a laser.
- Após a invasão, usar varredura a laser para verificar se um corante de imagem (diluído a uma concentração final de 100-200 µM em uma solução de pipeta intracelular padrão descrito anteriormente8) é passivamente (por difusão) enchendo o neurônio. Permitir que o corante (por exemplo, Alexa Fluor 488 em canal de verde photomultiplier tubo [PMT], pgto 2; ou Alexa Fluor 568 ou 594 no canal vermelho de PGTO, pgto 1) para encher os compartimentos celulares pelo menos 20-30 min antes de tentar experimentos que requerem a visualização do quaisquer compartimentos celulares fora do soma.
Nota: Compartimentos distais (estruturas dendríticas, espinhos, axônios, etc..) pode exigir 30-40 min para preencher completamente a25. - Use o software Live Scan função para visualizar o neurônio e compartimento subcelular de interesse. Escolha imagens parâmetros que permitem a exatos vivem visualização das características neuronais. Manipular várias configurações para afetar ou alterar a exibição visualização (contraste), resolução, taxa de sinal-ruído (S/N) e tempo de aquisição de quadro de imagem:
-
Tabela Look-up (LUT). Abra a janela LUT usando o ícone apropriado na lateral de qualquer janela de imagem. Uma vez aberto, ajustar o chão LUT (min) e teto (máx.) configuração do canal de imagem específica para melhorar a Visualização do contraste do sinal mostrado na tela. Baixe o valor máximo de ~ 1000 (fora de 4096, deteção de 12-bit), que irá ajudar a retirar o redutor sinais ao primeiro procurar células, sinal e estrutura.
Nota: Essas configurações afetam somente o sinal exibido, não os valores detectado/registrado. Olhos humanos podem normalmente só faça contraste de níveis de cinza de ~ 5026. -
Zoom óptico. Use controles de software para selecionar 1 X zoom óptico e uso garimpando controles para localizar a área desejada no tecido. Esta configuração de zoom produz a maior praça, digitalizada campo de visão e envia os maiores ângulos de tensões/digitalizar, com os espelhos do galvanômetro.
Nota: A configuração padrão é de 12 x 12 mm campo de vista dentro da cabeça de digitalização que se traduz em 12 mm dividido por ampliação objetiva dentro da amostra. Portanto, um 60 x lente objetiva rendimentos imagens digitalizadas de 200 µm cada lado a 1 x zoom óptico. Valores mais altos de zoom óptico menos área de digitalização. 2 x zoom óptico é muitas vezes a configuração mais útil para a visualização de todo neurônios. 4 x pode ser útil para a visualização de aspectos subcellular de neurônios. -
Número de pixels. Para complementar 1 x zoom óptico, selecione 1024 x 1024 pixels por linha, usando controles de software. Defina o número de pixels por linha na imagem capturado e exibido para não perder a possível detalhes a partir da lente objetiva. Use os seguintes valores de pixel prático para um x 60 / 1.0 objetivo abertura numérica (NA): 1024 x 1024 para zoom 1, para zoom 2 de 512 x 512 e 256 x 256 para zoom 4. O tamanho do pixel de fim (~0.17 µm; 12 mm/ampliação/zoom/pixels) deve ser metade, ou menos, da resolução lateral definida pela lente objetiva.
Nota: A resolução de imagem somente é definida pelo comprimento de onda do laser e a objectiva NA (resolução de 0,4 µm de dois fotões animado [2PE] com 920 nm e um objectivo de nd 1,0)27. Os critérios para a excitação completa at, conforme listado na lente, que é a intensidade de2 1/e as correspondências de diâmetro de feixe laser (ou "preenche") a pupila de entrada (2 x tubo focal da lente x at / ampliação) da lente da objetiva. A lente de tubo no sistema descrito aqui tem uma distância focal de 180 mm. -
Tempo de interrupção de pixel . Use controles de software para selecionar 4 µs para o tempo de interrupção de pixel, um valor padrão útil.
Nota: Alterar o tempo de permanência de pixel não muda o mau sinal detectado; Ela afeta somente o intra-pixel com média e essas mudanças podem ser visualizadas através da qualidade de imagem através do S/N. O tempo de interrupção de pixel de imagem é sempre um múltiplo de 0,4 µs unidades, e para maior Habitai vezes a intensidade de 12-bit-limitada valor de cada pixel da imagem é a média das amostras 0,4 µs. Desde que a relação S/N melhora como a raiz quadrada do número de amostras por tempo de permanência do pixel (4 µs é igual a dez amostras, ou 3.16-fold melhoria em S/N), a melhoria na qualidade da imagem atinge rendimentos decrescentes para valores muito maiores do que 12 µs. -
Verificação de rotação e a região de interesse (ROI). Defina o ângulo de imagem de rotação 0° usando controles de software (nenhuma ação pode ser necessário, como rotação 0° é a configuração padrão para a maioria dos sistemas de imagem). Se a amostra é colocada em uma orientação de "upside-down", selecione a rotação de 180° para "inverter" a imagem.
Nota: Rodar a imagem, em qualquer ângulo dado, pode fornecer um ajuste melhor para toda a área de interesse de uma célula preenchida. Rotação também pode render uma base mais clara para o alinhamento de mudanças estruturais e para a realização de análises posteriores. Selecionando uma região de interesse dentro da imagem digitalizada em uma configuração de determinado zoom (etapa 3.1.4.2) mantém o número de pixel nativo (etapa 3.1.4.3), mas a restrição no número total de área e pixels pode aumentar drasticamente a taxa de quadros, proporcionando melhor resolução temporal de alterações de sinal. -
Uma média de frame. Selecione uma configuração de quadro inicial média de 2 quadros usando controles de software.
Nota: O contraste da imagem final (S/N) é definido pelo totais fótons coletados/detectado dentro os pixels do sinal da imagem. Com uma média de vários quadros de imagem pode melhorar a relação S/N, desde que a amostra não se move ou não é descorada durante a imagem latente. O sinal de interesse permanece o mesmo valor durante uma média de quadro enquanto o ruído da imagem é reduzido pela raiz quadrada do número de quadros em média. Pequenas estruturas em imagens de fluorescência exigem muitas vezes inter pixel média, combinando pixels dentro da imagem (muitas vezes chamado de ROIs), e/ou quadro em média. Quadro com média aumenta o tempo de digitalização pelo número de imagens escolhe a média.
-
Tabela Look-up (LUT). Abra a janela LUT usando o ícone apropriado na lateral de qualquer janela de imagem. Uma vez aberto, ajustar o chão LUT (min) e teto (máx.) configuração do canal de imagem específica para melhorar a Visualização do contraste do sinal mostrado na tela. Baixe o valor máximo de ~ 1000 (fora de 4096, deteção de 12-bit), que irá ajudar a retirar o redutor sinais ao primeiro procurar células, sinal e estrutura.
- Use as ferramentas de Controle de Pan, Varredura de rotaçãoe Zoom óptico para orientar a localização da amostra durante a digitalização. Se a manipulação do motor de fase é necessária posicionar a amostra, evitar tamanhos grande passo ao eixo X, Y e Z para evitar colisões de objectivo/condensador, vibrações ou exposição do raio laser para superfícies reflexivas.
- Recolha uma pilha-Z. Usando a ferramenta Z-series , selecione um iniciar e parar a posição que contém a célula de interesse. Selecione um tamanho de etapa (1 µm) e em seguida da imagem consecutivamente o neurônio em cada Z-plano que contém a célula.
Nota: Configurações de aquisição de Z-pilha irão variar entre o tipo de neurônio e tintura de enchimento. Parâmetros ideais para aquisição de Z-pilha devem ser determinados independente dos parâmetros utilizados para a geração de imagens ao vivo. Aquisição de Z-pilha pode ser realizada antes ou depois de experiências optopharmacology. Se possível, realize a aquisição de Z-pilha após optopharmacology para evitar qualquer dano celular induzida de 2PLSM e para permitir o enchimento de tintura ideal de pequenos compartimentos celulares.
4. laser Flash fotólise durante gravações eletrofisiológicas
Nota: Aplicando a 405 nm ou 473 nm laser poderesde ≥ 1 mW produz fosforescência dentro do vidro das lentes do condensador e objetiva. Esta luz gerado está diretamente relacionado com a potência de iluminação do laser; a emissão está presente nas janelas espectrais verdes e vermelhas e tem estado excitado vidas na faixa de ms. Este artefato de estimulação de fundo é visto em todas as lentes testadas e em água-mergulho de lentes objetivas de todos os principais fabricantes de lentes objetivas. As lentes do condensador produzem muita fosforescência maior do que lentes objetivas. Este "sinal" motiva o uso de cofragem mecânico para proteção dos cátodos de PGTO sensível arsenieto de gálio Fosfeto (GaAsP) durante eventos de foto-estimulação. Usar um obturador mecânico normalmente fechado (fechado quando não ativamente digitalização) representa a melhor solução para proteção de refrigeração GaAsP PMTs.
- Para uma geometria do feixe de ampulheta-tipo photostimulation, remova as lentes de focalização na óptica do feixe luminoso que seria caso contrário estreito/se contraem o feixe de laser que entra a pupila de entrada objectiva.
- Usando MarkPoints, selecione a configuração de ponto única.
Nota: Outras configurações de foto-estimulação (múltiplas manchas, uma grade de pontos, espiral de varredura) são possíveis dentro de MarkPoints. Único ponto é o mais simples. Objetivos experimentais e diferenças biológicas podem exigir uma configuração diferente. - Atualize a imagem usando a opção Live Scan para brevemente de imagem e localize a área subcellular de interesse. Periodicamente atualize a imagem para identificar qualquer potenciais pequenos desvios em foco.
- Use controles de software para aumentar o zoom óptico (ou seja, selecione uma configuração de zoom óptico maior do que o atual), se necessário, para visualizar pequenas estruturas (ou seja, espinhos ou dendrites distais).
- Coloque a MarkPoints único ponto mira imediatamente adjacentes (~0.5 μm) a membrana celular. Não a foto-estimulação lugar diretamente sobre um recurso de celular, como isto poderia levar a Fotodano.
- Definir os parâmetros para a foto-estimulação usando controles de software em MarkPoints. Aplicar as orientações da partida da seguinte forma: 1-50 ms de duração, 1-4 mW de potência do laser e ≥ 1 experimental.
- Selecione Executar MarkPoints para iniciar o protocolo de MarkPoints e observar a aquisição de dados de eletrofisiologia em tempo real.
- Repita as etapas 4.2-4.7 várias vezes para avaliar a consistência e estabilidade, ou a falta dela, da amplitude de resposta e cinética.
Resultados
Por fotólise a estimulação, a dose de exposição (intensidade e tempo), local de exposição e geometria do feixe são variáveis-chave. O sistema descrito neste artigo é capaz de dois feixes diferentes photostimulation, ajustável através de mover uma lente em/fora do caminho luz photostimulation antes que o raio entra no sistema do galvanômetro. Sem essa lente, o feixe de photostimulation preenche a pupila de entrada do x 60 / 1,0 NA água-mergulho [60 x WD] objetivo, produzindo uma perto-difração-limitada, lugar de sub-µm no plano focal dentro da amostra. Isto é associado com photostimulation de luz com uma forma de ampulheta, estendendo-se acima e abaixo do ponto focal simétrico com o eixo óptico. Com a lente inserida o caminho, photostimulation de luz de laser está orientada para a pupila de entrada da lente objetiva e em seguida, sai como um feixe de lápis-como. Este feixe, o que é esperado para ser ~ 10 µm de diâmetro para atingir um objetivo de 60 x, estende-se uniformemente/verticalmente em toda a amostra. Neste modo, a intensidade da luz em qualquer local determinado dentro do ponto de estimulação será ~ 1% da intensidade local pequena perto-difração-limitada. Assim, maiores potências do laser são normalmente necessárias quando usando ~ 10 µm estimulação local. Para todas as experiências relatadas neste artigo, utilizou-se um feixe de ampulheta-tipo photostimulation.
O poder de amostra entregue pode ser plotado contra a configuração da tensão de entrada, depois de medir a potência do laser na amostra usando um medidor de energia. Estes estudos utilizam um 60 x objetivo WD com uma distância de trabalho de 2 mm, mas não está submersa na água para medições de potência evitar possíveis danos ao elemento detector. Quando os objectivos com listados NA > 0,95 são medidos no ar (sem líquido de imersão), pode haver perdas de reflexão interna total no elemento frontal lente devido o índice mais baixo (ar). Neste caso, para uma medição de energia de amostra mais precisa (para corrigir as perdas da reflexão interna total), aumentar a potência medida pela 1,0 NA objetiva (1.0/0.95)2 medida no ar. A Figura 1a mostra uma trama típica de entrada/saída para 405 nm e 473 lasers de nm visível que são incorporadas a laser lançam sistema neste estudo. Estes sistemas de laser são ideais para controle de dose de exposição de foto-estimulação pelas seguintes razões: (1) são previamente calibrados para fornecer potência diretamente linear em relação à tensão de entrada (0-5 V), (2) fornecem uma operação do obturador silencioso (com nenhum laser de saída), e (3) têm rápida, controle de duração do pulso de intensidade sub-ms (0,1 ms resposta). Ao usar o ponto de foto-estimulação com um sistema de laser/galvo, calibração de rotina dos pontos MarkPoints é uma tarefa essencial. Figura 1b (painel esquerdo) demonstra um sistema que está fora de calibração (ponto desejado para estimular a foto não resulta em estimulação exata desse ponto, conforme indicado pelo local queimadura-furo), com um retorno para o posicionamento exato do local depois da calibração ( Figura 1b, painel direito).
PA-Nic é modestamente fluorescente (pico de emissão em ~ 510 nm), exibindo a excitação eficaz entre 350-450 nm (1 fóton excitação) ou 700-900 nm (2-fóton excitação)5. Para visualizar os PA-Nic durante aplicação local, PA-Nic (1 mM) foi aplicado perto de tecido cerebral seguido por imagem simultânea de contexto de transmissão óptica secionado de tecido (1) cérebro via Dodt contraste e (2) a fluorescência emitida de excitação (900 nm) de PA-NIC. PA-Nic 2PE fluorescência foi facilmente detectável durante a ejeção de pressão de uma pipeta de aplicação local (Figura 2a). Nicotina e um monoalkylcoumarin, 7-carboximetilamino-4-metil cumarina, são os principais produtos fotoquímicos do PA-Nic fotólise reação5. Usando as mesmas configurações/parâmetros que foram usados para PA-Nic de imagem de imagem, o tecido foi fotografado durante a entrega de nicotina (1 mM) ou 7-carboximetilamino-4-metil cumarina (1 mM). Não foi detectado nenhum sinal fluorescente (Figura 2a, painéis de médios e baixos), demonstrando a especificidade dos resultados PA-Nic. Finalmente, PA-Nic foi aplicado no tecido cerebral e emissão de fluorescência PA-Nic foi fotografada (Figura 2b). Esta abordagem confirma que PA-Nic está presente dentro de 100-200 µm da pipeta aplicação local. Juntos, esses dados confirmam que PA-Nic é efetivamente entregue ao cérebro tecido através do aplicativo local.
Gravações de eletrofisiologia com 2PLSM simultânea para visualização das estruturas celulares exige o investigador para considerações de equilíbrio para ambos os componentes do experimento, e muitas vezes uma janela de tempo estreita (~ 20 min) está disponível para válido aquisição de dados de amostra em uma célula de remendado. Sem considerar a visualização celular, é prática recomendada para começar a gravar logo que possível após a invasão porque gravação estabilidade tende a diminuir com o tempo. No entanto, quando a imagem é uma exigência, considerações eletrofisiológicas devem permitir um tempo adequado para aumentos de concentração de fluorescência em estruturas pequenas/remoto. Isto é exemplificado, examinando uma concentração de corante de enchimento curva28, que às vezes é útil para derivar quando um novo tipo de célula de imagem. A Figura 3 mostra vários neurónios de exemplo como Z-pilhas através de 2PLSM e foi recolhido em uma projeção de intensidade máxima para fins de apresentação. A figura 3a mostra imagens de alta qualidade onde morfologia neuronal parece estar completa, ruído é minimizado e detritos não interfere com a interpretação da morfologia celular. Figura 3b mostra imagens de baixa qualidade, devido a uma menor taxa de sinal-para-fundo e detritos substancial. Este detritos frequentemente aparece como bolsos esféricos de fluorescência intensa, decorrentes da ejeção da tintura da pipeta remendo de imagem enquanto se aproximava da célula. Notavelmente, inclusão de 100 µM PA-Nic no banho (ao executar a aplicação de banho) tende a reduzir a taxa de sinal-para-fundo e leva ao contraste da imagem abaixo do ideal. Alexa Fluor 568 ou 594 costuma ser bastante útil em experimentos de aplicação local como um corante de localizador ou como um sinal de referência/normalização 2PE normalizando. Um comprimento de onda efetivo para a excitação de dois fotões destes corantes é ~ 780 nm27, que permite a visualização simultânea de PA-Nic e identificação dos compartimentos celulares. Este comprimento de onda, no entanto, não totalmente evita dois fotões fotólise de PA-Nic5. Alexa Fluor 488 é vantajosa em experimentos de banho-aplicativo PA-Nic; Quando animado com um comprimento de onda apropriado ≥900 nm, dois fotões fotólise de PA-Nic5 pode ser evitado mantendo ainda a visualização adequada dos compartimentos celulares.
A Figura 4 mostra os dados de exemplo para PA-Nic localizadas do laser flash fotólise MHb neurônios em fatias de cérebro. Figura 4a (painéis superior) mostra um exemplo de uma imagem de "referência", que é uma captura de tela da última 2PLSM imagem tirada antes do protocolo de MarkPoints foi executado, sobreposto com o local de ponto de foto-estimulação. Figura 4a (inferior a painéis de imagem) mostra uma visão ampliada da foto-estimulação ponto sobreposto na morfologia celular. A resposta eletrofisiológica correspondente tempo-correlacionados a fotólise de PA-Nic é mostrada nos painéis inferiores da figura 4a. Trabalhos anteriores demonstraram que estas correntes são sensíveis à nAChR antagonistas5. Figura 4b mostra dados representativos de diferentes células onde fotólise de ponto único foi realizada em um intervalo de 1 s ou 10 s. Considerando que um intervalo de 10 s permitido tempo suficiente de recuperação para a linha de base segurando atual, um intervalo mais curto de s 1 levou a uma aumento gradual da posição atual como o protocolo prosseguiu. O aumento da atual sugere que a nicotina não teve tempo suficiente para difundir longe do sistema com o intervalo de 1 Hz29. Tal resposta temporal análises devem ser realizada de novo em qualquer novo tipo de célula, sendo estudado, como a Neurofarmacologia de nAChRs pode diferir entre tipos de células.
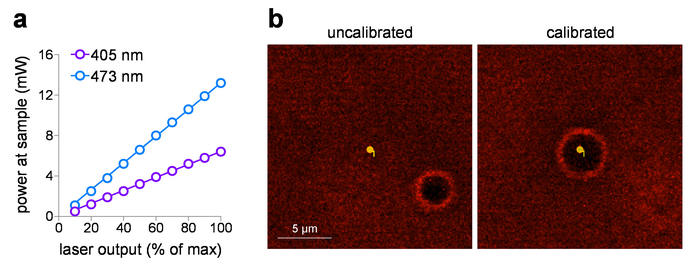
Figura 1: calibração do laser de Photostimulation. (uma) saída de poder do laser foto-estimulação. Poder no plano da amostra (através de um x 60 / 1.0 objetivo de água-mergulho at) foi medido para 405 nm e 473 lasers de foto-estimulação de nm no ajuste de saída indicado. (b) calibração do laser de foto-estimulação. Imagens de captura de tela mostram a relação espacial entre o ponto de foto-estimulação pretendido e o local correspondente onde foto-estimulação ocorreu (queimadura-buraco) antes (esquerda) e depois (direita) executando calibração em MarkPoints. Clique aqui para ver uma versão maior desta figura.
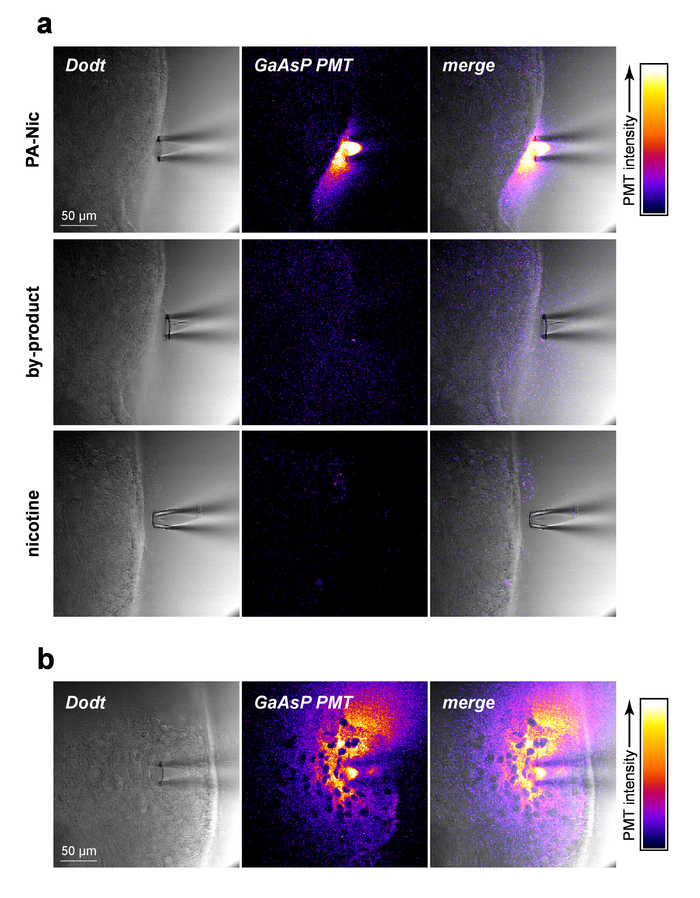
Figura 2: aplicação local PA-Nic. (um) deteção de PA-Nic de um local aplicativo pipeta. 1 mM PA-Nic, subproduto de fotólise ou nicotina foram dissolvidos em ACSF, carregado em uma pipeta de aplicação local e dispensada no tecido cerebral durante 2PLSM (excitação de 900 nm) de imagem usando as mesmas configurações de imagem para cada droga. Imagem de transmissão Dodt contraste de exploração do laser mostra a tecido/pipeta enquanto um cátodo GaAsP PGTO foi usado para capturar a emissão de fluorescência. (b), PA-Nic (1 mM) foi perfundido em tecido cerebral e fotografada através de 2PLSM como em (um) para mostrar a propagação lateral do PA-Nic usando sua fluorescência intrínseca. Clique aqui para ver uma versão maior desta figura.
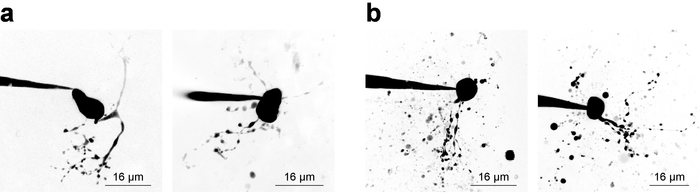
Figura 3: aquisição de imagens de microscopia de varredura a laser 2-fóton. (a) Z-pilhas de 2PLSM ideal. Dois exemplos de projeções de intensidade máxima do 2PLSM Z-pilha são exibido por neurônios MHb com dendritos bem resolvidos e pouca ou nenhuma interferência detritos. (b) 2PLSM sub-ótimo Z-pilhas. Dois exemplos de projeções de intensidade máxima do 2PLSM Z-pilha são mostrados para os neurônios de MHb rodeados por detritos (tintura expelido da pipeta durante a aproximação da célula). Tais imagens são mais difíceis de interpretar do que imagens como as mostradas em (um). Clique aqui para ver uma versão maior desta figura.
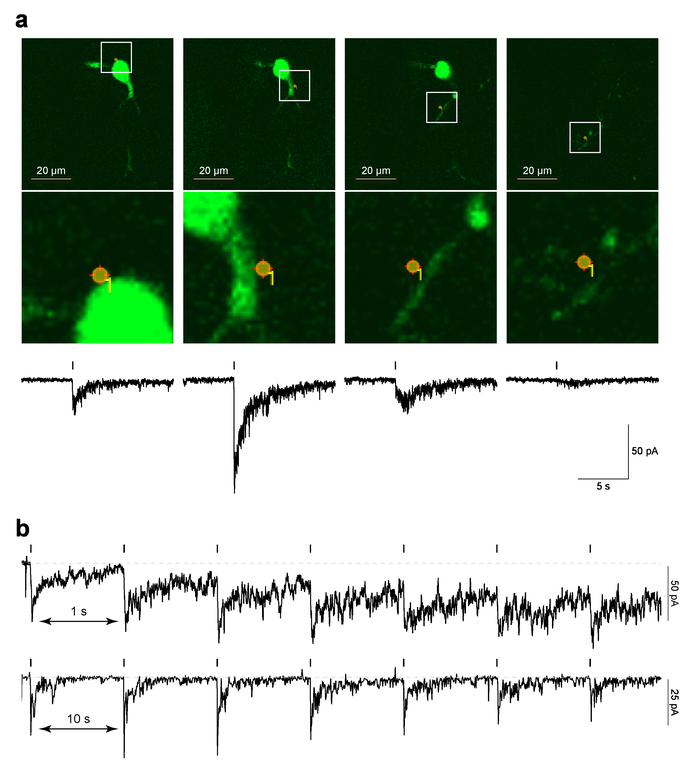
Figura 4: Laser flash fotólise do PA-NIC. (uma) referência MarkPoints imagens e correntes para dentro, evocadas por fotólise PA-Nic. Para um neurônio de MHb, imagens de referência crus são mostradas para ensaios de foto-estimulação MarkPoints em um único local de celular (indicado). Note que para alguns locais de foto-estimulação (a imagem de extrema direita nesta série), a estrutura dendrítica está em foco, mas a soma e o dendrito proximal não são. Abaixo de cada imagem de referência, nicotina uncaging-evocada aperfeiçoamento activo corrente é plotado. (b) estímulo inter intervalos para PA-Nic fotólise. Gravações de exemplar são mostradas para os neurônios de MHb onde a nicotina foi uncaged repetidamente no mesmo local perisomatic com um intervalo de estímulo Inter de 1 s ou 10 s. , por favor clique aqui para ver uma versão maior desta figura.
Discussão
A escolha do método de aplicação/entrega de PA-Nic é o passo mais crítico nesta técnica de foto-estimulação localizadas. Os dois métodos, aplicação de banho e perfusão local, cada um para oferecer limitações e vantagens distintas. A escolha em grande parte é afetada pelo nível de expressão funcional de nAChR no tipo de célula de interesse. Muitas vezes é preferível usar aplicativo de banho quando os níveis de expressão funcional são elevados, como aplicação de banho permite uma concentração de sonda uniforme em torno da célula gravada, facilitando a interpretação dos dados. Aplicação de banho também elimina a necessidade de uma segunda pipeta de perfusão do tecido, facilitando todo o processo. No entanto, aplicação de banho de caro compostos custos mais por experiência.
Comumente, solução de problemas envolve tentando entender por que nenhuma ativação nAChR é visto seguir fotólise de flash. Ao trabalhar com um tipo de célula que não foi previamente estudado com PA-Nic, o investigador deve executar sopro-aplicação local de ACh ou nicotina para determinar se os receptores suficientes são funcionalmente expressa5. Para validar que o sistema é capaz de detectar respostas de fotólise, experimentos de controle deve ser feitos nos neurônios habenula medial que expressam grandes quantidades de receptores30. Nesta área do cérebro, aplicação de banho PA-Nic é possível, que é preferível para experimentos de validação. Somente após a realização desses experimentos de validação deve um passar para um tipo de célula espontâneo. Se o sistema experimental foi validado e respostas permanecem indetectáveis ou muito pequeno, pode ser garantido para aumentar a concentração de PA-Nic, aumentar a intensidade do flash ou duração do pulso, adicionar um modulador alostérico positivo de nAChR realçar nAChR atividade6, ou alguma combinação destes.
Ocasionalmente, uncaging respostas são grandes demais..., com ativação de nAChR significativa, resultando em tensão indireta gated at+ canal ativação e destravadas correntes para dentro devido a braçadeira espaço pobre. Esses artefatos, que completamente obscurecem nAChR correntes para dentro e impossibilitam a interpretação dos dados, podem ser eliminados pela inclusão de QX-314 (2mm) na gravação de pipeta. Eles também podem ser eliminados, reduzindo a concentração de PA-Nic ou reduzindo a intensidade do flash ou duração do pulso. Em todos os experimentos de foto-estimulação de luz visível, deve ter cuidado ao selecionar locais de estimulação para evitar estimulação involuntária/fotólise acima ou abaixo do plano focal desejado. Além disso e quando aplicável, a potência do laser deve ser sempre titulada para reproduzir respostas fisiológicas. É especialmente importante estar ciente do eixo z photostimulation ao trabalhar com ligantes enjaulados, como ligantes são ativadas acima/abaixo do ponto focal podem ainda difusa e interagir com o sistema biológico (ou seja, receptores de, ), em estudo.
PA-Nic do laser flash fotólise pode não ser apropriado para todos os investigadores, como existem várias limitações. O primeiro é o custo relativamente alto de uma configuração adequada. Ao trabalhar com fatias de cérebro intacto, uncaging perto de estruturas de pequeno diâmetro como dendrites requer um sistema de visualização sofisticados, tais como um microscópio 2-fóton. Além do alto custo de um Ti:sapphire, sintonizável laser pulsado de IR para desempenho 2-fotão microscopia, um sistema de dual-galvanômetro capaz de forma independente posicionamento dois feixes de laser mais aumenta o custo do sistema. Os custos do sistema total podem ser reduzidos usando um sistema de repouso-construído, se o investigador tem suficientes conhecimentos e tempo para construir, solucionar problemas e manter um sistema desse tipo. Uma segunda limitação muitas vezes envolve nAChR baixa expressão funcional, que pode ser parcialmente atenuado, dando passos como mencionado acima, mas isto não pode garantir o sucesso. Normalmente, se um não pode medir correntes ligante ativado após o sopro-aplicação dos agonistas, fotólise de flash PA-Nic sob grampo de tensão não pode produzir resultados aceitáveis. Uma terceira limitação envolve o intrínseco fluorescência de PA-NIC. PA-Nic absorve luz de ~ 405 nm e emite em uma faixa similar como proteína verde fluorescente (GFP) ou Alexa 4885. Quando PA-Nic concentrações excedem ~ 1 mM, esta propriedade de fluorescência pode torná-lo difícil de Visualizar simultaneamente estruturas neuronais. Para atenuar isso, é fundamental para ser capaz de controlar facilmente o fluxo de PA-Nic da pipeta perfusão. Periodicamente, o fluxo de PA-Nic foi interrompido para permitir moléculas fluorescentes difundir afastado. Isto permitiu re-imagem latente do neurônio para verificar a posição do feixe de uncaging. Uma quarta limitação potencial mencionar envolve o uso de luz de nm 405 por fotólise. Comprimentos de onda mais curtos tais como 405 nm são mais propensas a dispersão no tecido complexo como uma fatia do cérebro. Assim, em um determinado flash intensidade e duração, amplitudes de resposta uncaging e cinética de decomposição podem ser diferencialmente afectadas pela profundidade do foco uncaging dentro da fatia. Conclusões sobre aspectos biológicos de nAChRs devem considerar esta advertência importante.
Esta técnica de fotólise flash laser localizada recentemente serviu para descobrir novos detalhes sobre neurobiologia nAChR. Por exemplo, exposição crônica de nicotina aumenta a perisomatic e função nAChR dendríticas em habenula medial neurônios5. Ele também foi usado para ajudar a demonstrar, pela primeira vez, que os neurônios glutamato de área tegmental ventral expressam nAChRs funcional em suas perisomatic e compartimentos celulares dendríticas6. Existem que muitos potencial futuro usa essa técnica, e a abordagem poderia ser aplicada a outros tipos de neurônio de chave que são conhecidos por nAChRs expressa, tais como os neurônios piramidais corticais31 ou interneurônios no córtex cerebral32, striatum33 e o hipocampo19. Esta técnica também pode ser combinada com gene farmacologia e/ou nAChR edição34 para localizar subtipos de receptores específicos para diferentes compartimentos neuronais. A abordagem pode ser facilmente adaptada para outros compostos de cumarina-enjaulado, incluindo, mas não limitado a, aqueles desenvolvidos em paralelo com PA-Nic5. Finalmente, PA-Nic flash fotólise um de pode dia ser usado em um animal acordado/se comportando para estudar a ação da nicotina em paradigmas de romance farmacologia comportamental.
Divulgações
D.L.W. serve como um consultor pago por microscopia de fluorescência Bruker Nano.
Agradecimentos
Os autores agradecer laboratório membros dos seguintes investigadores principais noroeste: Ryan Drenan, D. James Surmeier, Yevgenia Kozorovitskiy e empreiteiro de Anis. Este trabalho foi apoiado pela nos National Institutes of Health (NIH) (subsídios, DA035942 e DA040626 para R.M.D.), a Fundação PhRMA (comunhão para M.C.A) e HHMI.
Materiais
| Name | Company | Catalog Number | Comments |
| Instruments, Consumables, and Miscellaneous Chemicals | |||
| Multiclamp 700B | Molecular Devices Corp. | Patch clamp amplifier | |
| Pneumatic Picopump | World Precision Instruments | PV820 | |
| Micropipette puller | Sutter Instrument Co | P-97 | |
| Temperature Controller | Warner Instruments | TC-324C | |
| Vibrating blade microtome | Leica Biosystems | VT1200S | |
| Ultrafree-MC Centrifugal Filter | MilliporeSigma | UFC30GV0S | internal solution filter |
| Borosilicate Glass Capillaries | World Precision Instruments | 1B150F-4 | patch and local application pipette |
| (-)-Nicotine hydrogen tartrate salt | Glentham | GL9693 | nicotine salt |
| 7-carboxymethylamino-4-methyl coumarin | Janelia Research Campus | PA-Nic by-product | |
| 1-[7-[bis(carboxymethyl)- amino]coumarin-4-yl]methyl-nicotine | Janelia Research Campus | PA-Nic | |
| Euthasol (Pentobarbital Sodium and Phenytoin Sodium) | Virbac | ANADA #200-071 | |
| Alexa FluorTM 488 Hydrazide | ThermoFisher | A10436 | green fill dye |
| Alexa FluorTM 568 Hydrazide | ThermoFisher | A10437 | red fill dye |
| 6-carboxy-AF594 (Alexa Fluor 594) | Janelia Research Campus | red fill dye | |
| QX 314 chloride | Tocris | 2313 | voltage-gated sodium channel blocker |
| Power Meter | ThorLabs | S120C | |
| Name | Company | Catalog Number | Comments |
| Chemicals for Solutions | |||
| N-Methyl-D-glucamine | Sigma | M2004 | |
| Potassium chloride | Sigma | P3911 | |
| Sodium phosphate monobasic monohydrate | Sigma | S9638 | |
| Sodium bicarbonate | Sigma | S6014 | |
| HEPES | Sigma | H3375 | |
| D-(+)-Glucose | Sigma | G5767 | |
| (+)-Sodium L-ascorbate | Sigma | A4034 | |
| Thiourea | Sigma | T8656 | |
| Sodium pyruvate | Sigma | P2256 | |
| Magnesium sulfate heptahydrate | Sigma | 230391 | |
| Calcium chloride dihydrate | Sigma | 223506 | |
| Sodium chloride | Sigma | S9625 | |
| Ethylene glycol-bis(2-aminoethylether)-N,N,N′,N′-tetraacetic acid | Sigma | E3889 | |
| Adenosine 5′-triphosphate magnesium salt | Sigma | A9187 | |
| Guanosine 5′-triphosphate sodium salt hydrate | Sigma | G8877 | |
| Name | Company | Catalog Number | Comments |
| Components of 2-Photon Microscope | |||
| Ultima Laser Scanner for Olympus BX51 Microscope | Bruker Nano, Inc. | imaging software and galvos | |
| Imaging X-Y galvanometers | Cambridge Technology | ||
| Mai Tai HP1040 | Spectra-Physics | Tuneable IR laser | |
| Pockels cell M350-80-02-BK with M302RM Driver | Conoptics, Inc. | for IR laser attenuation | |
| Integrating Sphere Photodiode Power Sensor | Thorlabs, Inc | laser power pick-off photodiode | |
| Uncaging X-Y galvanometers | Cambridge Technology | ||
| Helios 2-Line Laser Launch | Bruker Nano, Inc. | uncaging laser components | |
| OBIS LX/LS 405 nm (100 mW) | Coherent, Inc. | ||
| OBIS LX/LS 473 nm (75 mW) | Coherent, Inc. | ||
| Point-Photoactivation / Fiber Input Module for Limo Sidecar - Uncaging | Bruker Nano, Inc. | ||
| Name | Company | Catalog Number | Comments |
| Upright Microscope | Olympus | BX51WIF | Upright microscope chasis |
| Objective: Olympus M Plan FL 10x; NA 0.3 WD 11 mm | Olympus | 10x objective | |
| Objective: Olympus M Plan Fluorite 60x/1.0 WD=2mm NIR | Olympus | 60x water-dipping objective | |
| X-Cite 110, four-LED LLG coupled epi-fluorescence light source | Excelitas Technologies | LED Light Source | |
| Epi-Fluorescence Filter: ET-GFP (FITC/CY2) for Epi-Turret | Chroma Technologies | LED Filter for blue light excitation | |
| Epi-Fluorescence Filter: ET-DsRed (TRITC/CY3) for Epi-Turret | Chroma Technologies | LED Filter for green light excitation | |
| B&W CCD camera; Watec, 0.5in B/W CCD | Watec Co., LTD. | CCD camera for patch clamp recording | |
| Name | Company | Catalog Number | Comments |
| External Detectors - Dual Reflected Emission - Olympus Upright (Multi-Alkali, GaAsP) | Bruker Nano, Inc. | ||
| Multi-alkali side-on PMT | Hamamatsu | R3896 | red channel PMT |
| 595/50m | Chroma Technologies | red channel emission filter | |
| 565lpxr | Chroma Technologies | dichroic beam splitter | |
| GaAsP end-on PMT | Hamamatsu | 7422PA-40 | green channel PMT |
| 525/70m | Chroma Technologies | green channel emission filter | |
| High-Speed Shutter for Hamamatsu H7422 PMT | Vincent Associates / Bruker | 517329 | PMT shutter mount |
| Name | Company | Catalog Number | Comments |
| Dodt Gradient Contrast Transmission Detection Module | Bruker Nano, Inc. | ||
| Multi-alkali side-on PMT | Hamamatsu | R3896 | Dodt PMT |
Referências
- Zhang, C., et al. Cholinergic tone in ventral tegmental area: Functional organization and behavioral implications. Neurochemistry International. 114, 127-133 (2018).
- Sarter, M., Parikh, V., Howe, W. M. Phasic acetylcholine release and the volume transmission hypothesis: time to move on. Nature Reviews Neuroscience. 10 (5), 383-390 (2009).
- Coyle, J. T., Price, D. L., DeLong, M. R. Alzheimer's disease: a disorder of cortical cholinergic innervation. Science. 219 (4589), 1184-1190 (1983).
- Katz, B., Thesleff, S. A study of the desensitization produced by acetylcholine at the motor end-plate. Journal of Physiology. 138 (1), 63-80 (1957).
- Banala, S., et al. Photoactivatable drugs for nicotinic optopharmacology. Nature Methods. 15 (5), 347-350 (2018).
- Yan, Y., et al. Nicotinic Cholinergic Receptors in VTA Glutamate Neurons Modulate Excitatory Transmission. Cell Reports. 23 (8), 2236-2244 (2018).
- Engle, S. E., Shih, P. Y., McIntosh, J. M., Drenan, R. M. α4α6β2* nicotinic acetylcholine receptor activation on ventral tegmental area dopamine neurons is sufficient to stimulate a depolarizing conductance and enhance surface AMPA receptor function. Molecular Pharmacology. 84 (3), 393-406 (2013).
- Engle, S. E., Broderick, H. J., Drenan, R. M. Local application of drugs to study nicotinic acetylcholine receptor function in mouse brain slices. Journal of Visualized Experiments. (68), (2012).
- Ren, J., et al. Habenula "cholinergic" neurons co-release glutamate and acetylcholine and activate postsynaptic neurons via distinct transmission modes. Neuron. 69 (3), 445-452 (2011).
- Koppensteiner, P., Melani, R., Ninan, I. A Cooperative Mechanism Involving Ca(2+)-Permeable AMPA Receptors and Retrograde Activation of GABAB Receptors in Interpeduncular Nucleus Plasticity. Cell Reports. 20 (5), 1111-1122 (2017).
- Zhang, J., et al. Presynaptic Excitation via GABAB Receptors in Habenula Cholinergic Neurons Regulates Fear Memory Expression. Cell. 166 (3), 716-728 (2016).
- Chen, E., et al. Altered Baseline and Nicotine-Mediated Behavioral and Cholinergic Profiles in ChAT-Cre Mouse Lines. The Journal of Neuroscience. 38 (9), 2177-2188 (2018).
- Nagy, P. M., Aubert, I. Overexpression of the vesicular acetylcholine transporter increased acetylcholine release in the hippocampus. Neuroscience. 218, 1-11 (2012).
- Ting, J. T., Feng, G. Recombineering strategies for developing next generation BAC transgenic tools for optogenetics and beyond. Frontiers in Behavioral Neuroscience. 8, 111 (2014).
- Crittenden, J. R., Lacey, C. J., Lee, T., Bowden, H. A., Graybiel, A. M. Severe drug-induced repetitive behaviors and striatal overexpression of VAChT in ChAT-ChR2-EYFP BAC transgenic mice. Frontiers in Neural Circuits. 8, 57 (2014).
- Kolisnyk, B., et al. ChAT-ChR2-EYFP mice have enhanced motor endurance but show deficits in attention and several additional cognitive domains. The Journal of Neuroscience. 33 (25), 10427-10438 (2013).
- Nagy, P. M., Aubert, I. Overexpression of the vesicular acetylcholine transporter enhances dendritic complexity of adult-born hippocampal neurons and improves acquisition of spatial memory during aging. Neurobiology of Aging. 36 (5), 1881-1889 (2015).
- Denk, W. Two-photon scanning photochemical microscopy: mapping ligand-gated ion channel distributions. Proceedings of the National Academy of Sciences of the United States of America. 91 (14), 6629-6633 (1994).
- Khiroug, L., Giniatullin, R., Klein, R. C., Fayuk, D., Yakel, J. L. Functional mapping and Ca2+ regulation of nicotinic acetylcholine receptor channels in rat hippocampal CA1 neurons. The Journal of Neuroscience. 23 (27), 9024-9031 (2003).
- Filevich, O., Salierno, M., Etchenique, R. A caged nicotine with nanosecond range kinetics and visible light sensitivity. Journal of Inorganic Biochemistry. 104 (12), 1248-1251 (2010).
- Tochitsky, I., et al. Optochemical control of genetically engineered neuronal nicotinic acetylcholine receptors. Nature Chemistry. 4 (2), 105-111 (2012).
- Wokosin, D. L., Squirrell, J. M., Eliceiri, K. W., White, J. G. Optical workstation with concurrent, independent multiphoton imaging and experimental laser microbeam capabilities. Review of Scientific Instruments. 74 (1), 193-201 (2003).
- Plotkin, J. L., Day, M., Surmeier, D. J. Synaptically driven state transitions in distal dendrites of striatal spiny neurons. Nature Neuroscience. 14 (7), 881-888 (2011).
- Galtieri, D. J., Estep, C. M., Wokosin, D. L., Traynelis, S., Surmeier, D. J. Pedunculopontine glutamatergic neurons control spike patterning in substantia nigra dopaminergic neurons. Elife. 6, (2017).
- Yasuda, R., et al. Imaging calcium concentration dynamics in small neuronal compartments. Science STKE. (219), pl5 (2004).
- Inoue, S., Spring, K. . Video microscopy: The fundamentals. , 163-186 (1997).
- Zipfel, W. R., Williams, R. M., Webb, W. W. Nonlinear magic: multiphoton microscopy in the biosciences. Nature Biotechnology. 21 (11), 1369-1377 (2003).
- Maravall, M., Mainen, Z. F., Sabatini, B. L., Svoboda, K. Estimating intracellular calcium concentrations and buffering without wavelength ratioing. Biophysical Journal. 78 (5), 2655-2667 (2000).
- Wathey, J. C., Nass, M. M., Lester, H. A. Numerical reconstruction of the quantal event at nicotinic synapses. Biophysical Journal. 27 (1), 145-164 (1979).
- Shih, P. Y., et al. Differential expression and function of nicotinic acetylcholine receptors in subdivisions of medial habenula. The Journal of Neuroscience. 34 (29), 9789-9802 (2014).
- Verhoog, M. B., et al. Layer-specific cholinergic control of human and mouse cortical synaptic plasticity. Nature Communications. 7, 12826 (2016).
- Koukouli, F., et al. Nicotine reverses hypofrontality in animal models of addiction and schizophrenia. Nature Medicine. 23 (3), 347-354 (2017).
- Xiao, C., et al. Chronic nicotine selectively enhances α4β2* nicotinic acetylcholine receptors in the nigrostriatal dopamine pathway. The Journal of Neuroscience. 29 (40), 12428-12439 (2009).
- Peng, C., et al. Gene Editing Vectors for Studying Nicotinic Acetylcholine Receptors in Cholinergic Transmission. European Journal of Neuroscience. , (2018).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados