このコンテンツを視聴するには、JoVE 購読が必要です。 サインイン又は無料トライアルを申し込む。
Method Article
共同血管や脂肪組織における神経線維を染色
要約
新しい血管の形成と交感神経支配は、脂肪組織リモデリングの極めて重要な役割を果たします。しかし、可視化と脂肪組織を定量的測定の技術的な問題が残っています。ここで正常にラベルを付け、血管や脂肪組織における神経線維の密度を定量的に比較するためのプロトコルを提案する.
要約
最近の研究では、血管新生、脂肪組織の肥満の開発中に改造の交感神経支配の重要な役割を強調しています。したがって、脂肪組織に動的な変更を文書化する簡単で効率的な手法の開発が必要です。ここでは、効率的に汚れ血管や脂肪組織における神経線維の共同修正蛍光アプローチについて述べる。伝統的なと最近開発された方法と比較して、我々 のアプローチは比較的わかりやすいより効率良く血管と神経線維の密度は高く、少ない背景をラベリングします。さらに、さらに画像の高解像度では、オープン ソース ソフトウェアによって血管、分岐、量、繊維の長さの領域を正確に測定することが出来ます。提案手法を用いて実証、その褐色脂肪組織 (BAT) に血管や神経線維の白色脂肪組織 (WAT) と比較してより高い金額が含まれているを示す.さらに、間で WATs、皮下ワット (sWAT) はより多くの血管や精巣上体のワット (eWAT) と比較して神経線維を見つける。本手法は、したがって脂肪組織リモデリングを調査するための便利なツールを提供します。
概要
脂肪組織はキー代謝と内分泌機能1。それを動的に拡大または縮小に対して異なる栄養強調2。複数の生理学的なパス/ステップ成っているプロセスを改造するアクティブな組織血管新生、線維化、ローカル炎症性微小2,3,4の形成など。いくつかの物理的な刺激、寒冷、運動などは、最終的に新しい血管の形成と脂肪組織5,6の交感神経支配につながる交感神経活性化を引き起こす可能性があります。これらの改造のプロセスは、インスリン感受性、2 型糖尿病の2型の特徴を含む全身の代謝の結果にしっかりとリンクされます。したがって、これらの病理組織学的変化の可視化は、全体の脂肪組織の健康状態を理解する大切です。
血管新生は、新しい血管の形成のプロセスです。血管新生は、さまざまなテクニック6,7,と記載されているが脂肪組織のリモデリングにおける重要なステップと考えられている血管は、酸素、栄養素、ホルモン、および組織に成長因子を提供するので8,9,10,11,12,13。 ただし、イメージの解像度、免疫染色と血管密度の定量化法の効率についての質問が残っています。新しい血管の形成に比べると、脂肪質ティッシュの神経支配は、長い時間の過小に評価されています。最近では、曽ら.14使用生体 2 光子励起顕微鏡と脂肪細胞が神経線維14の層で囲まれていることを示した。それ以来、研究者は脂肪組織の生理機能の調節に交感神経支配の重要な役割を理解し始めています。したがって、ドキュメント脂肪神経に簡単で実用的なアプローチを開発する重要です。
ここでは、血管と神経線維の私達の以前のプロトコルに基づいて共同の汚損のための最適化手法を報告する.この方法では、血管と神経線維騒々しい背景なしの鮮明な画像を実現します。さらに、我々 は、オープン ソース ソフトウェアと密度の定量的測定を実行するために十分に高い解像度を取得します。この新しいアプローチを使用して、構造体と血管と異なる脂肪拠点における神経線維の密度正常に比較できます。
プロトコル
動物の主題を含むすべてのプロシージャは、ヒューストン動物福祉委員会のテキサス大学健康科学センターによって承認されている (動物のプロトコル番号: AWC-18-0057)。
1. 試薬の準備
- リン酸緩衝生理食塩水 (PBS、pH 7.4) x 1: 1 × PBS の 1 L をするためには、800 mL の蒸留水で KH2PO4 0.24 g の Na2HPO4、1.44 g、KCl の 0.2 g 塩化ナトリウム 8 g を溶解します。7.4 と蒸留水 1 L の最終巻を達成するために記入するために pH を調整します。
- 1 × PBS (1 %pfa、wt/巻) で 1% パラホルムアルデヒド: 50 mL の最終的なボリュームを達成するために 16% の 3.125 mL を加える PFA (材料表参照) 46.875 mL の 1x PBS に。よく混合し、後で使用するための 4 ° C で保存します。
注意:パラホルムアルデヒドは有毒であります。すべてのプロシージャは、ヒューム フード吸入を避けるために、皮膚の下に実施されなければなりません。 - 1 × PBS (PBST、pH 7.4 の巻/巻 × 1) で 0.1% ポリソルベート 20 (材料の表参照): 50 mL の最終的なボリュームを達成するためにポリソルベート 20 に 49.95 mL の 1x PBS の 0.05 mL を加えます。渦と 4 ° C、1 ヶ月でストア。
- 1 %octoxynol-9 (材料の表を参照) 1 × PBS (PBS テキサス州、pH 7.4 の巻/巻 × 1) で: 9.9 mL の 1x PBS に 0.1 mL octoxynol 9 を追加 10 mL の最終的なボリュームを達成するために。渦と 4 ° C、1 ヶ月でストア。
- 2% アジ化ナトリウム (wt/巻): 2% アジ化ナトリウム 10 mL を生成するためのアジ化ナトリウム 0.2 g を 10 mL の 1x PBS に追加。よく混合し、後で使用するための 4 ° C で保存します。
- 1 × PBS (巻/巻) で 90% のグリセロール: グリセロールの 9 mL に 1 mL の 1x PBS を追加 10 mL の最終的なボリュームを達成するために。渦と部屋の温度 (RT) 後で使用するためにストアします。
2. 動物 Ddissection と脂肪組織のコレクション
- 6 週齢の c57bl/6 j 男性マウスを使用します。イソフルラン (誘導の 4-5%、維持のため 1-2%) とマウスを麻酔します。麻酔、一度つま先ピンチ反射ペダル反射の欠如から判断すると、麻酔の深さを確認するを実行します。マウスは麻酔が深く、一度以前に発行された15としてプロトコル、マウスを解剖します。
- 鋏は使いよう 】 と胸 (髪の毛を剃る必要はありません) の外科領域を消毒します。横隔膜と鋏は使いよう 】 を使用した 〜 2 cm のサイズと外側面に沿って肋骨を切断することによって胸を開きます。止血と胸のフラグをクランプし、頭の上、止血を置くことによってそれを反映します。
- アイリス ハサミで左心室 (~0.5 cm) に小切開を確認します。切開サイトを通じてオリーブ先端灌流針を挿入し、止血の場所に針の先端をクランプします。針を含むパラホルムアルデヒド固定液 (1 %pfa、pH 7.4) 50 mL シリンジに接続します。
- セクションの切断によって灌流のコンセントのアイリス ハサミで右心房を開きます。によって血流を穏やかにスタートし、出口を出る流体が血のクリアを押し込むを止めます 10 mL/分連続灌流速度で近くに注射器を押します。全体のプロセスは、~ 5 分必要です。
注意:PFA から毒性を防ぐためにヒューム フードの下でこれらの手順を実行します。 - マウスから白と茶色の脂肪組織を解剖します。はさみを使用して、組織サンプルを塊約 5 × 5 × 3 mm3の小さな断片に分割します。小さな塊を滅菌ピンセットでカセットをカセットに組織サンプルの適切なラベリングで埋め込み組織に移転します。
- 固定の解決に組織サンプルを含む埋め込みカセットを浸す (1 %1 × PBS、pH 7.4 で PFA) 24-48 h の 4 ° C で。
注:固定の解決および固定時間の組織16,17,18のサイズも異なります。 - (0.5 mL/ウォッシュ) 回 x 3 PBS バッファー新鮮な 1 サンプルを洗います。
注意:ヒューム フードの下でこの手順を実行します。パラホルムアルデヒドの廃棄物は、有害廃棄物の廃棄手順によると適切に処理する必要があります。
注:組織は、さらなる処理のための 4 ° C で 1 × PBS に格納できます。
3. 抗体の孵化
- 固定ティッシュ サンプルを約 2 mm3キューブに滅菌はさみでカットします。透過性、1 の 1 mL を含む 1.5 mL チューブにサンプルを転送 PBS テキサス州 x (1 × PBS で 1% octoxynol 9 参照用テーブル、pH 7.4) と優しく 18 rpm で 1 h の RT でチューブを回転します。
- 丁寧に、1 x の吸引によってテキサス州の PBS。サンプル 3 を洗って同じ管 (チューブを変更する必要はありません) に直接 1 × PBS を加えることによって x。各洗浄中に何回かチューブを反転します。
- ブロック、0.5 mL のブロック バッファー (資材表) をサンプルに追加し、RT で緩やかな回転で 2 時間インキュベートします。
- 一次抗体溶液 0.4 mL を準備、希釈する反 - endomucin (血管のマーカー) 5 (1: 200) の 2 μ L とアンチの 2 μ L-チロシン水酸化酵素 (TH、神経線維のマーカー) 5 (1: 200、1 μ G/ml) 抗体 (材料表抗体について) ブロック バッファーの 396 μ L に。渦とスピン回復ボリューム ダウン。
- 最初の抗体の孵化の組織塊からブロック バッファーを慎重に取り外します。チューブに手順 3.4 で一次抗体溶液の 100 μ L を追加し、4 ° C で一晩インキュベートします。
注:異なる抗体抗体の希釈と潜伏期間が異なる場合があります。微生物の増殖を防ぐために抗体溶液を 0.02% アジ化ナトリウムを追加することをお勧めします。アジ化ナトリウムと一次抗体溶液 0.4 mL を準備するには、ブロック バッファーの 392 μ L に抗体 (それぞれの 1 μ L) の 4 μ L と 2% アジ化ナトリウムの 4 μ L を追加します。 - 必要な場合、慎重に再利用のための一次抗体ソリューションを収集します。1 サンプルを洗う x PBST (pH 7.4 では、100 μ L/ウォッシュ) 18 rpm で緩やかな回転で (各 30 分) を 3 回します。
- 二次抗体の解決、fluorophore (波長さ 495 nm) の 2 μ L 希釈調製共役抗やぎ igg 抗体 (レバレッジ) と蛍光 (波長さ 650 nm) の 2 μ L 共役抗うさぎ IgG (1: 200) (材料の表を参照してください) の 396 μ L にバッファーを妨げる。渦とすべての液体を収集するために、簡単にスピンします。
注:以下の手順で、光からサンプルを保護します。 - 2 番目の抗体の孵化のサンプルから最後の洗浄バッファーを削除します。チューブに二次抗体溶液 100 μ L を追加し、, RT で 2 h 18 rpm で緩やかな回転で。
- 二次抗体溶液を慎重に取り外します。サンプル 3 を洗って 1 x 18 rpm で緩やかな回転で x PBST (pH 7.4 では、各 30 分)。
注:一次抗体、組織によってもたらされる微量で汚染する可能性があります、この二次抗体の解決を再利用しません。 - 光のクリアランスのため 90% のグリセロールの 1 mL に試料を浸すし、透明になるまで、4 ° C で暗闇の中でサンプルを保ちます。
注:浸漬時間は、組織の種類とサイズによって異なります。通常、白色脂肪組織の 2 mm3キューブは、同じサイズ褐色脂肪組織サンプル ニーズ長い間の一晩インキュベートを必要があります。 - ボリューム イメージングのための井戸を作成するスライドにシリコーン アイソレータを遵守します。また、スライドに透明テープのいくつかの層を添付し、井戸を作成する中間の正方形をカット(図 2).
注:サンプル サイズに合わせて、井戸の深さを調整します。このプロトコルでは 1 mm も深さが使用されます。 - 慎重に井戸にサンプルを転送し、メディアをマウントでそれを埋める (材料の表を参照してください)。表面のカバー スリップを置くし、高粘度の媒体とカバー スリップの隅をシール (材料の表を参照してください)。暗闇の中で常温 24 h の取付中治療をしましょう。
注:サンプルとカバー スリップの領域が残っていないことを確認します。カバー スリップの下で泡を避けるため。サンプルに過度の圧力を配置しないでください。
4. 画像の取得
- 共焦点顕微鏡/ソフトウェアの 20 × 対物 z 画像 (4.2 – 4.7 の手順を参照) を取得します。
- システムを起動します。<設定> タブをクリックし、アルゴン レーザーや 633 HeNe レーザーをアクティブにします。<取得>] タブをクリックします。<表示> レーザー線パネルの上に移動対応する強度スライダー 488 のレーザー ラインを選択する nm と 633 nm。当初は、強度は 20-30% を設定できます。488/561/633 トリプル dichoric ミラーを選択します。タマを 633 nm レーザーの励起 488 nm レーザーと PMT3 による排出の PMT1 を選択する <アクティブ> のチェック ボックスをクリックしてアクティブにします。500-550 nm に PMT3 のための PMT1 と 650-750 nm の波長範囲を設定します。ダブル各 PMT の横に色付きの四角形をクリックすると、ポップアップ メニューから色を選択することによって、イメージの表示に使用する psudocolor を選択します。
- <ライブ> サンプルの画像をチェックするをクリックします。Z 位置のノブを使ってな XY 領域内でフォーカスの面を選択します。レーザー光源の強度、スマートのゲインとオフセットの調整によって、画像の明るさを調整します。各蛍光チャネル <QLUT> (クイック Look Up Table) ディスプレイ モードでこの調整を実行します。適切な明るさの設定を支援するために青色で表示される飽和ピクセルの QLUT モードを入力するには、<QLUT> ボタンをクリックします。擬似カラー表示モードに戻るに <QLUT> ボタンを 2 回クリックします。
注:設定の数値は、各実験の間で異なる場合があります。 - スキャン中に回して Z 位置ノブにフォーカスの計画を興味のボリュームの一方の端に移動し、[スキャンの終了位置を設定するのには <終了> 矢印をクリックします。時計回りに関心のボリュームのもう一方の端に試料をフォーカスの面を移動する Z 位置のノブを入れます、スキャンの開始位置を設定する <開始> 矢印上をクリックします。
注:異なるサンプル間の比較、異なるサンプルの同じ Z ボリュームを定義します。 - 3 μ m 1024 x 1024 の形式を選択することにより画像の品質の変更、100 Hz の速度と 2 の線のなかに z ステップ サイズを調整します。
- 選択 <開始 > z スタック画像集録を開始します。
- 取得した画像のスタックの最大投影の <プロセス> タブをクリックし、[<ツール> <3 D 投影> を選択し、入力 X に <最大> 変更せずメソッド リスト Y と Z. セット<しきい値> 0 に。<適用> をクリックします。Z ボリュームの最大強度は、(図 4 a) 表示される 2D イメージに積み上げされます。
5. 血管と神経線維ネットワークの解析
-
オープン ソース ソフトウェアを介して画像の 2次元解析 (材料の表を参照)19
- ソフトウェアのスタックのイメージを開きます。容器構造を正しくすることができますすべての選択 (図 4 b) まで血管径と強度を調整します。
- 分析を実行を選択し、ソフトウェアのガイダンスに従ってデータをエクスポートします。
-
ライセンスされたソフトウェアを介して画像 3 D の解析 (材料の表を参照)
- ソフトウェアと画像の raw データを開きます。Z ボリュームのそれぞれの層で血管構造が正しく選択されるまで、しきい値およびその他のパラメーターを調整する (詳細については、ソフトウェアのユーザー ガイドを参照してください) (図 4)。
- 選択したセグメント文字を分析し、ソフトウェアのガイダンスに従ってデータをエクスポートします。
結果
精巣上体の白色脂肪組織 (eWAT) の遠位領域、内側部硬度皮下白色脂肪組織 (sWAT)、肩甲骨間褐色脂肪組織 (BAT) の内側の領域が採集されました。これらの組織を収集するための場所は、図 1に示されます。
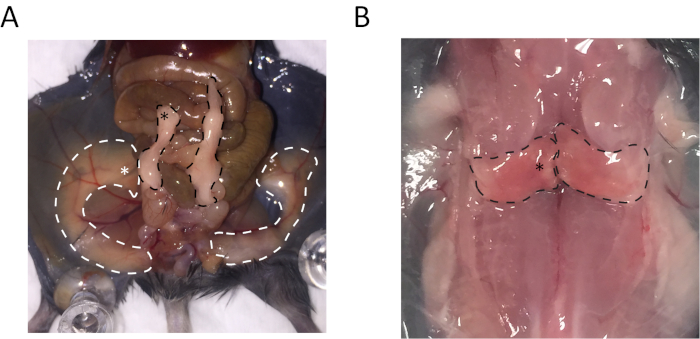
図 1: 皮下白色脂肪組織 (sWAT)?...
ディスカッション
肥満の開発1,2の間に代謝不全に直接リンクは脂肪組織リモデリングします。血管新生と交感神経支配は、動的な改造プロセス2,12のために不可欠です。したがって、非常に重要なは、神経線維と同様、新しい血管を可視化に適用可能なアプローチを開発します。以前の方法は、脂肪組織の血管新生を文書?...
開示事項
著者は、彼らは競合する金銭的な利益があることを宣言します。
謝辞
この研究は、(k. s.)、健康 (NIH) 助成金 R01DK109001 の国立研究所によって支えられました。
資料
| Name | Company | Catalog Number | Comments |
| Alexa Fluor 488 AffiniPure Bovine Anti-Goat IgG (H+L) | Jackson ImmunoResearch | 805-545-180 | Lot: 116969 |
| Alexa Fluor 647 AffiniPure Donkey Anti-Rabbit IgG (H+L) | Jackson ImmunoResearch | 711-605-152 | Lot: 121944 |
| Amira 6.0 | Thermo Fisher Scientific | Licensed software | |
| Angio tool | National Institutes of Health | Open source software https://ccrod.cancer.gov/confluence/display/ROB2/Home | |
| Anti-mouse endomucin antibody | R&D research system | AF4666 | Lot: CAAS0115101 |
| Anti-tyrosine hydroxylase antibody | Pel Freez Biologicals | P40101-150 | Lot: aj01215y |
| Cover glasses high performance, D = 0.17 mm | Zeiss | 474030-9020-000 | |
| Cytoseal 280 | Thermo Fisher Scientific | 8311-4 | High-viscosity medium |
| Glycerol | Fisher | G33-500 | |
| Paraformaldehyde,16% | TED PELLA | 170215 | |
| Press-to-Seal Silicone Isolator with Adhesive, eight wells, 9 mm diameter, 1.0 mm deep | INVITROGEN | P24744 | Silicone isolator |
| ProLong Diamond Antifade Mountant | Thermo Fisher Scientific | P36965 | Mounting medium |
| SEA BLOCK Blocking Buffer | Thermo Fisher Scientific | 37527X3 | |
| Sodium azide | Sigma-Aldrich | S2002-100G | |
| Tissue Path IV Tissue Cassettes | Thermo Fisher Scientific | 22-272416 | |
| Triton Χ-100 | Sigma-Aldrich | X100 | Generic term: octoxynol-9 |
| Tube rotator and rotisseries | VWR | 10136-084 | |
| Tween-20 | Sigma-Aldrich | P1379 | Generic term: Polysorbate 20 |
参考文献
- Rosen, E. D., Spiegelman, B. M. What we talk about when we talk about fat. Cell. 156 (1-2), 20-44 (2014).
- Sun, K., Kusminski, C. M., Scherer, P. E. Adipose tissue remodeling and obesity. Journal of Clinical Investigations. 121 (6), 2094-2101 (2011).
- Sun, K., et al. Endotrophin triggers adipose tissue fibrosis and metabolic dysfunction. Nature Communication. 5, 3485 (2014).
- Zhao, Y., et al. Divergent functions of endotrophin on different cell populations in adipose tissue. American Journal of Physiology-Endocrinology and Metabolism. 311 (6), E952-E963 (2016).
- Zhao, Y., et al. Transient Overexpression of VEGF-A in Adipose Tissue Promotes Energy Expenditure via Activation of the Sympathetic Nervous System. Molecular and Cellular Biology. , (2018).
- Xue, Y., et al. Hypoxia-independent angiogenesis in adipose tissues during cold acclimation. Cell Metabolism. 9 (1), 99-109 (2009).
- Chen, S., et al. LncRNA TDRG1 enhances tumorigenicity in endometrial carcinoma by binding and targeting VEGF-A protein. BBA Molecular Basis of Disease. 1864 (9 Pt B), 3013-3021 (2018).
- Sun, K., et al. Dichotomous effects of VEGF-A on adipose tissue dysfunction. Proceedings of the National Academy of Sciences of the United States of America. 109 (15), 5874-5879 (2012).
- During, M. J., et al. Adipose VEGF Links the White-to-Brown Fat Switch With Environmental, Genetic, and Pharmacological Stimuli in Male Mice. Endocrinology. 156 (6), 2059-2073 (2015).
- Elias, I., et al. Adipose tissue overexpression of vascular endothelial growth factor protects against diet-induced obesity and insulin resistance. Diabetes. 61 (7), 1801-1813 (2012).
- Sung, H. K., et al. Adipose vascular endothelial growth factor regulates metabolic homeostasis through angiogenesis. Cell Metabolism. 17 (1), 61-72 (2013).
- Cao, Y. Angiogenesis and vascular functions in modulation of obesity, adipose metabolism, and insulin sensitivity. Cell Metabolism. 18 (4), 478-489 (2013).
- Sun, K., et al. Brown adipose tissue derived VEGF-A modulates cold tolerance and energy expenditure. Molecular Metabolism. 3 (4), 474-483 (2014).
- Zeng, W., et al. Sympathetic neuro-adipose connections mediate leptin-driven lipolysis. Cell. 163 (1), 84-94 (2015).
- Gage, G. J., Kipke, D. R., Shain, W. Whole animal perfusion fixation for rodents. Journal of Visualized Experiments. (65), (2012).
- Berry, R., et al. Imaging of adipose tissue. Methods in Enzymology. 537, 47-73 (2014).
- Jiang, H., Ding, X., Cao, Y., Wang, H., Zeng, W. Dense Intra-adipose Sympathetic Arborizations Are Essential for Cold-Induced Beiging of Mouse White Adipose Tissue. Cell Metabolism. 26 (4), 686-692 (2017).
- Chi, J., et al. Three-Dimensional Adipose Tissue Imaging Reveals Regional Variation in Beige Fat Biogenesis and PRDM16-Dependent Sympathetic Neurite Density. Cell Metabolism. 27 (1), 226-236 (2018).
- Zudaire, E., Gambardella, L., Kurcz, C., Vermeren, S. A computational tool for quantitative analysis of vascular networks. PLoS One. 6 (11), e27385 (2011).
- An, Y. A., et al. Angiopoietin-2 in white adipose tissue improves metabolic homeostasis through enhanced angiogenesis. eLife. 6, (2017).
- Chi, J., Crane, A., Wu, Z., Cohen, P. Adipo-Clear: A Tissue Clearing Method for Three-Dimensional Imaging of Adipose Tissue. Journal of Visualized Experiments. (137), (2018).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved