このコンテンツを視聴するには、JoVE 購読が必要です。 サインイン又は無料トライアルを申し込む。
Method Article
マイクロピペット吸引による電気形成による巨大ユニラメラハイブリッド小胞の閉塞と機械的性質の測定
要約
プロトコルの目的は、マイクロピペット吸引によって巨大小胞の膜機械的特性を確実に測定することである。
要約
リン脂質と共重合体から得られる巨大小胞は、制御および標的薬物送達、診断のためのバイオセンサー内の生体分子認識、人工細胞の機能膜、バイオインスピレーションマイクロ/ナノ反応器の開発など、さまざまな用途で利用できます。これらのすべてのアプリケーションにおいて、膜特性の特徴付けは基本的に重要である。既存の特性評価技術の中でも、E.Evansによって開拓されたマイクロピペット吸引は、領域圧縮率率、曲げ弾性率および溶解応力および歪みなどの膜の機械的特性の測定を可能にする。ここでは、脂質または共重合体(またはその両方)の薄膜から巨大小胞を得るためのすべての方法論と詳細な手順、マイクロピペットの製造および表面処理、および前述したすべてのパラメータの測定につながる吸引手順を提示する。
概要
リン脂質から得られる巨大小胞(リポソーム)は、1970年代から塩基性細胞膜モデル1として広く用いられている。1990年代後半には、共重合体の自己集合から得られた小胞形態は、脂質類似体2、3を参照してポリマーソームと命名され、機械的安定性が弱く、モジュラー化学機能が悪いリポソームに代わる興味深い代替手段として急速に登場した。しかし、後者は細胞膜の主成分であるリン脂質から構成されているため、細胞バイオミメティックキャラクターはリポソームに比べてかなり限定的である。さらに、膜透過性が低い場合は、膜を介した種の拡散を制御する薬物送達のような一部の用途で問題となる可能性があります。近年、ハイブリッドポリマー脂質小胞および膜を設計するブロック共重合体とリン脂質の会合は、研究の数が増加している4、5である。主なアイデアは、各成分の利点(脂質二重層の生体機能性と透過性とポリマー膜の機械的安定性および化学的多様性)を相乗的に組み合わせたエンティティを設計することです。
今日、異なる科学コミュニティ(生化学者、化学者、生物物理学者、物理化学者、生物学者)は、より高度な細胞膜モデルの開発に対する関心が高まっています。ここで、我々の目標は、可能な限り詳細に、既存の方法論(電気形成、マイクロピペット吸引)を提示し、ハイブリッドポリマー脂質巨大小胞である最近の「高度な」細胞膜モデルと巨大小胞の機械的特性を得て特徴付ける。
これらの方法の目的は、膜の領域圧縮性および曲げモジュライならびに溶解応力およびひずみの信頼性の高い測定を得るすることである。巨大小胞の曲げ剛性を測定するために存在する最も一般的な技術の1つは、直接ビデオ顕微鏡観察に基づく変動分析6、7です。しかし、これは大きな目に見える膜の変動を必要とし、厚い膜(例えばポリマーソーム)上で体系的に得られません。エリア圧縮率係数は、ラングミュア・ブロジェット技術を使用して実験的に決定できますが、ほとんどの場合、単層8上で。マイクロピペット吸引技術は1つの実験の二重層形成巨大な二重小胞小胞(GUV)の両方のモジュライの測定を可能にする。
以下の方法は、二重層を形成できるすべての両親媒性分子または高分子に対して適切であり、その結果、電気形成によって小胞が生じる。これは、電気形成の温度で二重層の流体特性を必要とします。
プロトコル
1. マイクロピペットの製造
注:ここでは、内径が6~12μmのマイクロピペットと、約3~4mmのテーパ長が必要です。マイクロピペットの製造方法の詳細な方法を以下に説明する。
- ホウケイ酸ガラスキャピラリーをプーラーのドローバーに入れ、ノブを締めて両端を固定します。
- ヒーター室の側面の穴からガラスを慎重にスライドさせます。
- もう一方の端の締め付けノブを締めます。
- チップのサイズとテーパの長さを制御して、目的の仕様を実現します。そのためには、加熱温度、プル、速度、遅延、圧力などの技術的パラメータを最適化します。使用するプログラムの例を次に示します。
熱:550°C
プル:10(機械の範囲:任意の単位で0-255)
速度:30(範囲:任意の単位で0-255)
遅延: 1 (範囲: 0 から 255 任意の単位)
圧力:500(範囲:任意の単位で0-999) - PUL Lをクリックして、プログラムによって定義されたイベントを実行します。毛細血管は2つのマイクロピペットに分けられ、その寸法はマイクロフォージを使用して調整する必要があります。
- マイクロピペットをマイクロフォージの金属ピペットホルダーに挿入します(図1を参照)。10倍の目的を使用して、ピペット先端がガラスビーズ表面に近づくまで、顕微鏡ステージとピペットマニピュレータ(垂直および水平移動)を調整します。
- フットスイッチを押してガラスビーズを溶かします。先端を下げ、溶融ガラスビーズに合わせます。溶融ガラスは毛細血管作用によりピペットに流れ込みます。図 1の挿入に示すように、溶融ガラスのレベルが特定の高さに達するまで数秒待ちます。
- フットスイッチの圧力を取り除いて加熱を停止し、垂直ピペットマニピュレータを使用して先端を素早く引き離して急激なブレークを引き起こします。
- 目的の直径(6~12μm)が得られるまで、手順1.7と1.8を繰り返します。
注:直径測定の精度を向上させるには、最後のステップで、レチクルを装備した32倍の目的を使用します。
2.BSA(ウシ血清アルブミン)でピペットチップをコーティング
- 純水中に1%重量BSAを含むグルコースの0.1M溶液を調製した。
- 180mgのブドウ糖粉末の重量を量り、15 mLポリプロピレン円錐チューブに入れ、10 mLの純水を完備した。
- 0.1gのBSA粉末を加え、試験管回転式ミキサーを使用して溶解(約4時間)になるまで穏やかに振ります。
- 針を取り付けた10 mL使い捨てルアー注射器で溶液を取ります。充填したら、針を取り外し、0.22μmの酢酸セルロースフィルターを取り付けます。先端を浸すのに使用するいくつかのポリプロピレンマイクロ遠心管(1.5 mL)を充填します。
- 毛細血管をホルダーに垂直に配置します。ホルダーを下げ、チップをブドウ糖/BSA溶液に一晩浸します。溶液は、毛細血管作用によって約1cm高く上昇する必要があります。
- ブドウ糖/BSA溶液からピペットチップを取り外します。0.1Mグルコース溶液(純水5mLで90mgのグルコース粉末を希釈)の5mLを調製し、0.22μmの酢酸セルロースフィルターを通して濾過する。
- 柔軟な融合シリカキャピラリーを装備した500°Lガラスシリンジを使用して、ピペットにブドウ糖溶液を充填します。次に、すべてのグルコース溶液を吸い戻して取り除き、廃棄します(図2)。この手順を数回繰り返して、無制限の BSA を削除します。
3. 電気形成によるGUVとGHUVの形成
注:電気形成は、アンジェロバ9によって開発された一般的に使用される技術です。電気形成チャンバを得る手順は、脂質またはポリマーフィルム(またはGHUV(ジャイアントハイブリッドユニラメラ小胞)の両方)を堆積させ、代替電界の下でフィルムを水和する手順を以下に説明する。得られたGUVを収集する手順についても説明する。
- 両親媒性、スクロースおよびグルコース溶液調製
- 1mg/mLの濃度で両親媒性溶液を調製する。10mgの両親媒性物質を重量を量り、クロロホルムの10mLに溶解する。溶剤の蒸発を避けるために、溶液を密閉されたバイアルに保管してください。
- 1,2-ジオレオイル-sn-グリセロ-3-ホスホエタノールアミン-N-(リサミンロダミンBスルホニル)(DOPE-Rhod)のストック溶液をクロロホルム中の1mg/mLで調製する。
- 両親媒性溶液に10μLの蛍光脂質溶液を加えます。溶剤の蒸発を避けるために、溶液を密閉されたバイアルに保管してください。
- スクロースとグルコース溶液をそれぞれ0.1Mの濃度で調製し、それぞれ342mgと180mgのスクロースとグルコースを調製し、純水10mLに溶解する。
- 電気形成室の準備
注:異なる導電性材料は、電気形成装置(例えば、白金線10、ステンレス針11)を作るために使用することができる。電気形成チャンバは、開口部を作成するために片側に切断されたOリングゴムスペーサーによって分離された2つのITOスライドで構成されています。スライドは、2本の電線を介して電圧発生器に接続されています(図3と図4A)。- ITOスライドを有機溶媒(例えば、クロロホルム)で洗浄します。オームメーターを使用して導電性表面を識別します。
- 粘着テープを使用して導電面に電線を取り付けます。
- 両親媒性溶液沈着
- 毛細血管作用によってレベルが上がるまで溶液中に毛細血管を浸し、溶液の約5°Lを収集します。
- 毛細血管をITOガラス板の中心に接触させ、溶液をゆっくりと広げます。10 秒間待って、完全な溶媒蒸発を確認します (図 4A)。
- 両側に対してこの手順を 3 回繰り返します。
- 開いたOリングスペーサーの両側にシリコンフリーグリースの層を追加します。堆積の領域の周りにそれを置きます。2 番目の ITO ガラスプレートの導電面をスペーサーの上部に配置します。
- 電気形成チャンバを真空下に3時間置き、有機溶媒の痕跡を除去します。
- 電気形成手順
- 電線を発電機に差し込みます。
- ジェネレータには次の設定を使用します。
代替弦波張力
周波数:10 Hz
振幅:2Vピークツーピーク
メモ:最適な電圧周波数と持続時間は、各システムに対して見つかる必要があります。 - チャンバー内の溶液を注入する前に電圧が印加されていることを確認します。
- 0.8mmの内径針を用いた注射器を使用して1mLの溶液を注入し、チャンバーを充填します。最終的な気泡を削除します。
- 75分間、印加電圧/周波数の下のチャンバを75分間使用します(図4B)。
- GUVの収穫
- 発電機の電源を切ります。
- 0.8 mmの内径針で1 mLシリンジを使用して、チャンバー内の気泡を生成するために溶液の小さな部分を吸引します。この気泡がチャンバー内を移動させるためにチャンバーをわずかに傾けます。これは、GUV が ITO サーフェスからデタッチするのに役立ちます(図 4C)。
- すべての溶液を吸い、1 mLのプラスチックチューブに移します。
- ワイヤーを取り外し、有機溶媒(トルエン、クロロホルム)でITOスライドをきれいにします。
4. マイクロマニピュレーションの設定
注:マイクロピペット吸引の原理は、うつ病を適用することによってガラスマイクロピペットを介して単一の小胞を吸引することです。ピペット内部の舌の長さは吸引圧力の関数として測定される。前述のBSAによるピペットコーティングは、小胞膜とピペットとの間の接着を防止または最小化するために不可欠です。
プロトコルを次に示します。
- ピペットおよび水満たされた貯水池の関係
メモ:水満タンクとマイクロメータはスライディングプレートに固定されています。マイクロメータヘッド付きのデジタルカウンタは、0~2.5cmの範囲でデバイスの垂直方向の変位を可能にし、アルミニウム光学レールに沿った1μmの変位の精度を可能にし、長さ1メートルまで可能です。シリコンチューブは、貯蔵所と毛細血管ホルダーを接続します(図5A)。- タンクに純水を入れます。使い捨て5 mLシリンジをシリコーンチューブを介してキャピラリーメタルホルダーに接続し、吸引してタンクからホルダーへの水の流れを作り出します。
- 気泡を除去するためにチューブをわずかにタッチします。同時に、水タンクを上げて正の圧力を作り出します。5 mL シリンジはホルダーに取り付けられています。
- 前に説明したコーティングおよび洗浄工程(ステップ2を参照)の後、最後に滴が形成されるまで、毛細血管にブドウ糖溶液を充填する。金属ホルダーからシリンジチューブを取り外し、端にわずかな水の流れを作ります。
- 毛細血管を逆さまにし、グルコースドロップをホルダーからの水の流れと接続します。毛細血管とホルダーをねじ込んで固定します。
- ピペットを配置する
注:この操作中、水タンクは正の圧力を維持するためにアルミニウムレールにまだ置かれます。- 2枚のガラススライド(以前はエタノールで洗浄)を備えた自家製のアルミニウムステージを取り、両側に真空グリースで接着します。顕微鏡ステージに設置し、図5B,Cに示すように0.1Mのグルコースを含む1mLシリンジを用いて2つのスライド間にメニスカスを形成する。
- ピペットとそのホルダーをマイクロマニピュレータのモーターユニットに置き、クランプノブを締めます。
- コントロールパネルのジョイスティックを粗いモードで使用して、グルコース半月板の近くのマイクロピペットを下げます。ファインモードを使用して、先端の位置をメニスカスの中心に調整します。
- チップをブドウ糖に数分間浸して外面と内面を清掃します(正圧が維持されると、水の流れがピペットの内面をすすいで未塗布のBSAを除去します)。
- マイクロマニピュレータキーボードに先端の位置を保存し、半月板から引き出します。
- ブドウ糖半月板を取り除き、新鮮なものに置き換えます。20μLマイクロピペットを使用して0.1MスクロースでGUVの2μLを吸引し、新鮮なグルコースメニスカスに入れます。DICモード(差動干渉コントラスト)で、スクロース(主にGUV内部)とグルコース(主にGUVの外側)の密度の違いにより、下部に位置するGUVを観察します。
- 小胞がわずかに膨張したら、吸引ピペットを挿入し直し、先端に焦点を合わせる。圧力がほぼ0である水タンクの高さH0を設定します。そのためには、溶液中に自然に存在する小胞または粒子を利用し、これらの粒子の動きが止まるまで水槽の高さを調整する。
- この時点で、水蒸発を防ぐためにメニスカスをミネラルオイルで囲み、図5Dを参照してください。
メモ:室温は、エアコンを使用して20〜22°Cの間で制御する必要があります。
- マイクロピペット吸引実験
- ピペット先端(直径6~12μm)を下げ、小さな吸引(-1cm)を作成して小胞(直径15~30μm)を吸引します。選択した小胞の膜はわずかに変動する必要があり、目に見える欠陥(芽やフィラメントなし)を示してはならない(図6)。
- ピペットをより高いレベルに上げて、マイクロマニピュレータを使用して他の小胞から吸引された小胞を分離し、実験全体の間にこの位置を維持します。
- 水満タンクを約-10cmに下げて小胞を予め応力し、その後、圧力を下げて初期値(-1cm)に戻します。この手順を数回繰り返して、膜から膜過剰および小さな欠陥を除去します。
- 水タンクの位置によって定義される-0.5cmの高さから、マイクロメータで吸引圧力をゆっくりと下げ、膜が変動する体制に到達する。次に、圧力を上げ、先端の舌をかなりの投影長(数ミクロン)で明確に視覚化します。
注: 最も小さい膜投影長(L0)を吸い上げることができる最も低い加圧(P0)は、基準点α0(図7A)を定義します。曲線のすべての点は、この基準に従って測定されます (ΔL = L-L0および ΔP = P-P0)。 - マイクロメータで吸引圧力を0.5-0.8 mN/mに達するまで段階的に高めます。各ステップで、5 s を待って、舌のスナップショットを取ります。低張力でのこのプロシージャは曲げ弾性率の決定を可能にする。
- レール上でスライディングする水の高さを調整して、吸引圧力を0.5 mN/mから破裂張力まで上げ続けます(図7B-D)。高張力体制におけるこの実験から、領域圧縮率、溶解緊張および溶解株が測定される。
- 有意な統計を得るために約15-20小胞を伸ばす。各マイクロピペット吸引実験は7〜10分かかります。LASAFソフトウェアを使用して、舌の投影長、小胞の直径、毛細血管の半径を測定するための画像解析を行います。
- 曲げ弾性率、面積圧縮率、溶解張力、溶解株の測定
- これらのパラメータにアクセスするには、E. Evans12によって確立された形式主義を使用します。方程式 1 から膜上に適用される吸引圧力を計算します。
Δ P = εwg (h-h0) (1)
ここで、gは重力加速度(9.8 m∙s−2)、εwは水の密度(ε = 1 g∙cm−3)、hは水タンクの位置、h0は圧力がゼロに等しい初期位置です。 - ラプラス方程式から膜張力を計算します。
 (2)
(2)
ここでΔPはマイクロピペットの吸引圧力であり、RpおよびRvはそれぞれマイクロピペットおよび小胞半径(マイクロピペットの外側)である。膜の表面積ひずみ(α)は次のように定義されます。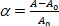 (3)
(3)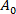 より低い吸引圧力の小胞の膜区域である。
より低い吸引圧力の小胞の膜区域である。 - 式412に従って毛細管先端内の小胞の投影長ΔLの増加からαを計算する:
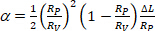 (4)
(4) - 非常に低い張力体制の下で、熱曲げうねりの平滑化は明らかな膨張を支配する。プロット ln(σ) と α をプロットします。低 σ 値(通常 0.001 ~0.5 mN.m-13)では、傾きが曲げ弾性率にリンクされた直線、Kb (方程式 5 の最初の項)14:
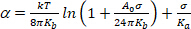 (5)
(5)
メモ:高張力(>0.5 mN.m−1)では、膜のうulationが完全に抑制され、分子間の間隔が大きくなった結果、膜面積が増加します。この体制では、方程式5の第2項が支配し、面積圧縮率Ka (図8と図9)へのアクセスを与える。
- これらのパラメータにアクセスするには、E. Evans12によって確立された形式主義を使用します。方程式 1 から膜上に適用される吸引圧力を計算します。
結果
前述のプロトコルでは、 我々は、異なる合成巨大ユニラメラ小胞(GUV)を研究し、リン脂質から得られる:2-オレオロイル-1-パルミトイル-sn-グリセロ-3-ホスホコリン(POPC)、三重黒分子:ポリ(エチレキシド)-b-ポリ(ジメチルシロキサン)-b-ポリ(エチレオキシド)(PEO12-b-PDMS43-b-PEO12)以前の研究で合成された13、...
ディスカッション
マイクロピペットのコーティングは信頼できる測定を得るための重要なポイントの1つである。小胞のマイクロピペットへの付着を防止する必要があり、コーティングは、BSA、β-カゼインまたはサーファシルを用いて文献17、18、19、20、21で一般的に使用される。塗布手順...
開示事項
著者たちは何も開示する必要はない。
謝辞
著者たちは、ANRの財政支援(ANR Sysa)を感謝して認めた。
資料
| Name | Company | Catalog Number | Comments |
| Required equipment and materials for micropipette design | |||
| Borosilicate Glass Capillaries | World Precision Instruments | 1B100-4 | external and internal diameter of 1mm and 0.58 mm respectively. |
| Filament installed | Sutter Instrument Co. | FB255B | 2.5mm*2.5mm Box Filament |
| Flaming/Brown Micropipette Puller | Sutter Instrument Co. | Model P-97 | |
| Microforge | NARISHGE Co. | MF-900 | fitted with two objectives (10x and 32x) |
| Materials for coating pipette tips with BSA | |||
| Bovine Serum Albumin Fraction V (BSA) | Sigma-Aldrich | 10735078001 | |
| Disposable 1 ml syringe Luer Tip | Codan | 62.1612 | |
| Disposable 10 ml syringe Luer Tip | Codan | 626616 | |
| Disposable 5 ml syringe Luer Tip | Codan | 62.5607 | |
| Disposable acetate cellulose filter | Cluzeau Info Labo | L5003SPA | Pore size: 0.22µm, diameter: 25mm |
| Flexible Fused Silica Capillary Tubing | Polymicro Technologies. | TSP530660 | Inner Diameter 536µm, Outer Diameter 660µm, |
| Glucose | Sigma-Aldrich | G5767 | |
| Syringe 500 µL luer Lock GASTIGHT | Hamilton Syringe Company | 1750 | |
| Test tube rotatory mixer | Labinco | 28210109 | |
| Micromanipulation Set up | |||
| Aluminum Optical Rail, 1000 mm Length, M4 threads, X48 Series | Newport | ||
| Damped Optical Table | Newport | used as support of microscope to prevent external vibrations. | |
| Micromanipulator | Eppendorf | Patchman NP 2 | The module unit (motor unit for X, Y and Z movement) is mounted on the inverted microscope by the way of an adapter. |
| Micrometer | Mitutoyo Corporation | 350-354-10 | Digimatic LCD Micrometer Head 25,4 mm Range 0,001 mm |
| Plexiglass water reservoir (100 ml) | Home made | ||
| TCS SP5 inverted confocal microscope (DMI6000) equipped with a resonant scanner and a water immersion objective (HCX APO L 40x/0.80 WU-V-I). | Leica | ||
| X48 Rail Carrier 80 mm Length,with 1/4-20, 8-32 and 4-40 thread | Newport | ||
| Materials for sucrose and amphiphile solution preparation | |||
| 2-Oleoyl-1-palmitoyl-sn-glycero-3-phosphocholine | Sigma-Aldrich | ||
| Chloroform | VWR | 22711.244 | |
| L-α-Phosphatidylethanolamine-N-(lissamine rhodamine B sulfonyl) | Sigma-Aldrich | 810146C | Rhodamine tagged lipid |
| Sucrose | Sigma-Aldrich | S7903 | |
| Electroformation set up | |||
| 10 µL glass capillary ringcaps | Hirschmann | 9600110 | |
| Disposable 1 ml syringe Luer Tip | Codan | 62.1612 | |
| H Grease | Apiezon | Apiezon H Grease | Silicon-free grease |
| Indium tin oxide coated glass slides | Sigma-Aldrich | 703184 | |
| Needle | Terumo | AN2138R1 | 0.8 x 38 mm |
| Ohmmeter (Multimeter) | Voltcraft | VC140 | |
| Toluene | VWR | 28676.297 | |
| Voltage generator | Keysight | 33210A |
参考文献
- Bangham, A. D., Standish, M. M., Watkins, J. C. Diffusion of univalent ions across the lamellae of swollen phospholipids. Journal of Molecular Biology. 13 (1), (1965).
- Discher, D. E., Eisenberg, A. Polymer vesicles. Science. 297 (5583), 967-973 (2002).
- Hammer, D., et al. Polymersomes: vesicles from block copolymers. Annals of Biomedical Engineering. 28 (SUPPL. 1), (2000).
- Le Meins, J. F., Schatz, C., Lecommandoux, S., Sandre, O. Hybrid polymer/lipid vesicles: state of the art and future perspectives. Materials Today. 16 (10), 397-402 (2013).
- Schulz, M., Binder, W. H. Mixed Hybrid Lipid/Polymer Vesicles as a Novel Membrane Platform. Macromolecular Rapid Communications. 36, 2031-2041 (2015).
- Schneider, M. B., Jenkins, J. T., Webb, W. W. Thermal fluctuations of large quasi-spherical bimolecular phospholipid vesicles. Journal De Physique. 45 (9), 1457-1472 (1984).
- Dimova, R. Recent developments in the field of bending rigidity measurements on membranes. Advances in Colloid and Interface Science. 208, 225-234 (2014).
- Rodríguez-García, R., et al. Polymersomes: smart vesicles of tunable rigidity and permeability. Soft Matter. 7 (4), 1532-1542 (2011).
- Angelova, M. I., Dimitrov, D. S. Liposome electroformation. Faraday Discussions of the Chemical Society. 81, 303-311 (1986).
- Dao, T. P. T., et al. Membrane properties of giant polymer and lipid vesicles obtained by electroformation and pva gel-assisted hydration methods. Colloids and Surfaces A: Physicochemical and Engineering Aspects. 533, 347-353 (2017).
- Pereno, V., et al. Electroformation of Giant Unilamellar Vesicles on Stainless Steel Electrodes. ACS omega. 2 (3), 994-1002 (2017).
- Evans, E., Rawicz, W. Entropy-driven tension and bending elasticity in condensed-fluid membranes. Physical Review Letters. 64 (17), 2094-2097 (1990).
- Dao, T. P. T., et al. Modulation of phase separation at the micron scale and nanoscale in giant polymer/lipid hybrid unilamellar vesicles (GHUVs). Soft Matter. 13 (3), 627-637 (2017).
- Helfrich, W. Elastic properties of lipid bilayers: theory and possible experiments. Z Naturforsch C. 11 (11), 693-703 (1973).
- Dao, T. P. T., et al. The combination of block copolymers and phospholipids to form giant hybrid unilamellar vesicles (GHUVs) does not systematically lead to "intermediate'' membrane properties. Soft Matter. 14 (31), 6476-6484 (2018).
- Shoemaker, S. D., Kyle Vanderlick, T. Material Studies of Lipid Vesicles in the Lα and Lα-Gel Coexistence Regimes. Biophysical Journal. 84 (2), 998-1009 (2003).
- Longo, M. L., Ly, H. V., Dopico, A. M. . Methods in Membrane Lipids. , 421-437 (2007).
- Chen, D., Santore, M. M. Hybrid copolymer-phospholipid vesicles: phase separation resembling mixed phospholipid lamellae, but with mechanical stability and control. Soft Matter. 11 (13), 2617-2626 (2015).
- Mabrouk, E., et al. Formation and material properties of giant liquid crystal polymersomes. Soft Matter. 5, 1870-1878 (2009).
- Henriksen, J., et al. Universal behavior of membranes with sterols. Biophysical Journal. 90 (5), 1639-1649 (2006).
- Ly, H. V., Block, D. E., Longo, M. L. Interfacial Tension Effect of Ethanol on Lipid Bilayer Rigidity, Stability, and Area/Molecule: A Micropipet Aspiration Approach. Langmuir. 18 (23), 8988-8995 (2002).
- Bermudez, H., Hammer, D. A., Discher, D. E. Effect of Bilayer Thickness on Membrane Bending Rigidity. Langmuir. 20, 540-543 (2004).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved