È necessario avere un abbonamento a JoVE per visualizzare questo. Accedi o inizia la tua prova gratuita.
Method Article
Imaging a cellule vive time-lapse in vitro per esplorare la migrazione cellulare verso l'organo di Corti
* Questi autori hanno contribuito in egual misura
In questo articolo
Riepilogo
In questo studio, presentiamo un metodo di imaging in tempo reale utilizzando la microscopia confocale per osservare le cellule che si muovono verso il tessuto danneggiato mediante incubazione ex vivo con l'epitelio cocleare contenente l'organo di Corti.
Abstract
Per studiare gli effetti delle cellule staminali mesenchimali (CSC) sulla rigenerazione e sul trattamento cellulare, questo metodo tiene traccia della migrazione MSC e dei cambiamenti morfologici dopo la co-coltura con epitelio cocleare. L'organo di Corti è stato immobilizzato su un coverslip di plastica premendo una porzione della membrana del Reissner generata durante la dissezione. I CSC confinati da un cilindro di vetro migrarono verso l'epitelio cocleare quando il cilindro fu rimosso. La loro localizzazione predominante è stata osservata nel modiolo dell'organo di Corti, allineato in una direzione simile a quella delle fibre nervose. Tuttavia, alcuni CSC erano localizzati nell'area limbus e mostravano una forma allungata orizzontalmente. Inoltre, la migrazione nell'area delle cellule cieche è stata aumentata e la morfologia dei CSC è cambiata in varie forme dopo il trattamento con kanamicina. In conclusione, i risultati di questo studio indicano che la cocultura dei CSC con epitelio cocleare sarà utile per lo sviluppo di terapie attraverso il trapianto cellulare e per studi di rigenerazione cellulare in grado di esaminare varie condizioni e fattori.
Introduzione
La perdita dell'udito può verificarsi congenitamente o può essere causata progressivamente da diversi fattori, tra cui invecchiamento, farmaci e rumore. La perdita dell'udito è spesso difficile da trattare perché è molto difficile ripristinare la funzione compromessa una volta che le cellule ciliate responsabili dell'udito sonodanneggiate 1. Secondo l'Organizzazione Mondiale della Sanità, si stima che 461 milioni di persone in tutto il mondo abbiano ipoacusia, che rappresenta il 6,1% della popolazione mondiale. Di coloro che hanno ipoacusia, il 93% sono adulti e il 7% sono bambini.
Sono stati tentati diversi approcci per trattare la perdita dell'udito; in particolare, un approccio di rigenerazione che utilizza i CTC è emerso come un trattamento promettente. Quando il tessuto è danneggiato, i CSC vengono naturalmente rilasciati nel sistema circolatorio e migrano verso il sito della lesione dove secernono varie molecole per formare un microambiente che promuove larigenerazione 2. Pertanto, è importante sviluppare un metodo per trattare i tessuti danneggiati attraverso la migrazione dei CBC impiantati esternamente agli organi bersaglio e la loro successiva secrezione di molecole che causano una potente regolazione immunitaria, angiogenesi e anti-apoptosi per migliorare il ripristino della funzionecellulare danneggiata 3,4,5.
Il processo di homing in cui i CSC migrano verso tessuti danneggiati può essere l'ostacolo più importante da superare. Gli MSC hanno un meccanismo sistemico di homing con passaggi sequenziali di tethering/rolling, attivazione, arresto, trasmigrazione/diapedesi e migrazione6,7,8. Attualmente sono in corso sforzi per individuare modi per migliorare questi passaggi. Varie strategie, tra cui la modificazione genetica, l'ingegneria delle superfici cellulari, l'adescamento in vitro e la guida magnetica,sono state testate 6,7. Inoltre, sono stati fatti diversi tentativi per promuovere la protezione e la rigenerazione delle cellule ciliate uditivi affinando i CTC nel sito della coclea danneggiata. Tuttavia, tenere traccia dei CSC in vivo richiede molto tempo e manodopera e richiede competenze altamente specializzate9.
Per risolvere questo problema, è stato messo a punto un metodo per osservare l'affinamento dei CFC nella coclizione attraverso la microscopia confocale time-lapse che fotografa la migrazione delle cellule per diverse ore (Figura 1). È stato sviluppato all'inizio del XX secoloed è recentemente diventato un potente strumento per studiare la migrazione di cellule specifiche.
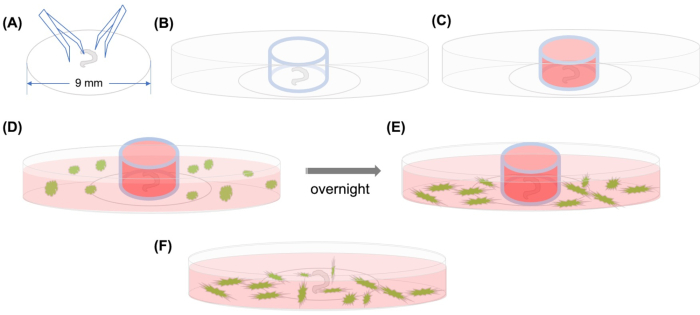
Figura 1: Astratto grafico. (A) Dopo che l'organo sezionato di Corti è stato aderito su un copripasta di plastica con forcep, il copripasta viene posizionato su un piatto microscopico confocale con fondo di vetro da 35 mm e (B) il cilindro di vetro è posizionato. (C) Dopo aver riempito l'interno del cilindro di vetro con CCC con etichetta GFP media,(D)con mezzo vengono aggiunti con attenzione all'esterno del cilindro. (E) Dopo l'incubazione durante la notte,(F)il cilindro di vetro viene rimosso e le immagini vengono scattate con un microscopio confocale. Abbreviazioni: GFP = proteina fluorescente verde; MSC = cellule staminali mesenchimali. Clicca qui per visualizzare una versione più grande di questa figura.
Protocollo
Tutti i protocolli di ricerca che coinvolgono topi ICR sono stati approvati dall'Institutional Animal Care and Use Committee (IACUC) della Yonsei University presso il Wonju College of Medicine. Gli esperimenti sono stati eseguiti secondo il Codice Etico della World Medical Association. In questo protocollo, i topi ICR in gravidanza sono stati tenuti in un ciclo chiaro / scuro di 12/12 h con libero accesso a cibo e acqua.
1. Dissezione delle cocche
- Sterilizzare la cappa di coltura del tessuto di flusso laminare accendendo la luce ultravioletta per ~ 30 minuti e spruzzare tutte le superfici con il 70% di etanolo prima dell'uso. Lasciare asciugare le superfici.
- Posizionare gli strumenti di dissezione in etanolo al 70% per 10 minuti e asciugare prima dell'uso.
- Utilizzare una lama operativa per decapitare topi postnatali di 3-4 giorni (Figura 2A).
- Posizionare il cranio sotto uno stereomicroscopio nella cappa di flusso laminare e immergere il tessuto in etanolo al 70%.
- Immergere rapidamente il tessuto nella soluzione di dissezione tissutale (1x soluzione di sale bilanciato di Hank, 1 mM HEPES) per rimuovere l'etanolo.
- Tagliare l'altura del cranio con una lama chirurgica(Figura 2B,C).
- Esporre il cranio tirando la pelle anteriormente e tagliando il canale uditivo esterno dell'orecchio (Figura 2D).
- Tagliare dalla parte anteriore a quella posteriore del cranio attraverso la linea degli occhi (Figura 2E).
- Aprire il cranio e rimuovere ilencefalo, il cervelletto e il tronco encefalico con forcep smussate (Figura 2F,G).
- Utilizzando micro forcep, separare i coclea dall'osso temporale (Figura 2H).
- Trasferire le cocche in una piastra di Petri contenente soluzione di dissezione tissutale.
- Sezionare con cura tutta la capsula otica cocleare, lasciando solo il tessuto molle cocleare interno(Figura 2I,J).
- Tenere il modiolo delle coclee con le flessori e il condotto cocleare con un'altra coppia di forcelle e separare lentamente i due tessuti (Figura 2K).
- Rimuovere la vascolarizzazione della striata e la membrana tectoriale staccandole delicatamente(Figura 2L,M).
- Posizionare un coverslip di plastica sterilizzato in una nuova soluzione di dissezione tissutale, quindi posizionare l'organo di Corti su un coverslip di 9 mm di diametro, assicurandosi che la membrana basilare sia rivolta verso il basso(Figura 2N-P).
- Immobilizzare il tessuto premendo la membrana del Reissner e il tessuto di modiolo rimanente sul copriletto con pinze(Figura 2N-P).
- Trasferire il copriletto con il tessuto incorporato al centro di un piatto confocale di 35 mm di diametro.
- Posizionare il cilindro di clonazione del vetro sul piatto, con l'espianto cocleare posizionato al centro del piatto, e aggiungere 100 μL di mezzo di coltura di espianto (DMEM/F12, 10% siero bovino fetale (FBS), 1% di integratore N2, ampicillina (10 μg/mL))10 all'interno del cilindro(Figura 2Q).
- Piastra 5 × 103 cellule di MSC con proteina fluorescente verde derivata dal midollo osseo del topo (GFP) in 2 mL di mezzo di coltura (45% DMEM + 45% DMEM/F12, 10% FBS, 1% supplemento N2, 10 μg/mL di ampicillina) al di fuori del cilindro divetro (Figura 2R).
- Quando gli MBC sono confluenti all'80-90%, passare loro staccandoli con acido tetraacetico tripsideina-etilendiammina.
- Trasferire con cura il piatto confocale in un incubatore umidificato e incubare durante la notte a 37 °C in un'atmosfera di CO2 al 5%.
- Aspirare tutto il mezzo all'interno e all'esterno del cilindro, quindi rimuovere il cilindro di vetro dal piatto confocale.
- Aggiungere 2 mL di mezzo di coltura fresco al piatto confocale e incubare il piatto di coltura tissutale in un incubatore umidificato fino a quando non è pronto per l'analisi.

Figura 2. Dissezione di una coclea di topo e cocultura dell'organo di Corti e MSC. (A) Decapitazione del topo, (B) e (C) dissezione saligittale mediana della testa, (D) e(E) dissezione coronale del cervello, (F) e (G) rimozione del cervello e dell'osso temporale, (H) coclea, (I) rimozione della parete cocleare ossea, (J) isolamento della coclea, (K) separazione del condotto cocleare dal modiolo, (L) separazione della vascolarizzazione della striata (SV) e legamento a spirale (SL) dall'organo di Corti, (M) rimozione della membrana tectoriale, (N-P) fissazione della coccina su un foglietto di copertura di plastica, (Q) posizione di coverslip e cilindro di vetro nella piastra confocale,(R)inoculazione di MSC. Barra in scala bianca (A-E) = 1 cm; barra di scala arancione (F, G, P) e gialla (H,I) = 1 mm; barra in scala verde (J-O) = 0,5 mm.
2. Imaging time-lapse
- Per gli esperimenti qui presentati, utilizzare un sistema di microscopia confocale con un sistema di incubazione superiore dello stadio.
- Accendere il microscopio confocale, la luce fluorescente e il computer.
- Impostare le condizioni dell'incubatore stage-top posto sul palco del microscopio confocale a 37 °C e al 5% di atmosfera di CO2.
- Posizionare il piatto campione sul recipiente di fissaggio del piatto, coprire con il coperchio di fissaggio del piatto e chiudere la camera con il coperchio del riscaldatore superiore.
- Regola lo zoom e lo stato attivo per localizzare l'organo di Corti e MSC nel campo visivo.
- Aprire il software di elaborazione delle immagini. Nell'opzione di individuazione selezionare un obiettivo Plan-Apochromat 20x (apertura numerica 0.8) e una superficie di ritaglio 0,5x.
- In Acquisizionefare clic su configurazione intelligente e selezionare EGFP.
- Aprire la linguetta del canale in Acquisizionee impostare la potenza laser su 0,2%, il foro stenopeica a 44 μm, il guadagno principale a 750 Ve il guadagno digitale su 1,0.
- Fare clic su ESID in fase di configurazione dell'imaging e impostare il guadagno ESID su 4 e il guadagno digitale su 7.5.
- Clicca su Tessere e palo per produrre 210 tessere.
- Aprire la strategia focus e selezionare la modalità messa a fuoco.
- In serie temporaliimpostare la durata su 24 h e l'intervallo su 10 min.
- In Acquisizioneimpostare la dimensione del fotogramma su 512 x 512 pixel, la velocità di scansione su 8, la direzione in bidirezionale, la media su 4x e i bit per pixel su 16.
- Clicca sull'esperimento iniziale per iniziare l'esperimento.
3. Modifica del file di immagine
- In elaborazionefare clic su cucituree impostare la sovrapposizione minima sul 5% e il passaggio massimo al 10%.
- Fare clic sull'esportazionedei film , impostare uncompressoe impostare la velocità su 7.5.
4. Immunostaining
- Aspirare il mezzo con attenzione e lavare il campione due volte con soluzione salina tamponata da fosfati (PBS) per 5 minuti.
- Fissare il campione con formalina al 4% in PBS per 15 minuti e lavare il campione 3 volte con PBS per 5 minuti.
- Permeabilizzare il campione nello 0,1% di Tritone X-100 in PBS per 10 minuti e lavare 3 volte con PBS per 5 minuti.
- Aggiungere 250 μL di reagente phalloidin-iFluor 647 (diluizione 1:1000 in PBS) e incubare il campione per 1 h a temperatura ambiente sullo shaker.
- Lavare il campione 3 volte con PBS per 5 minuti.
- Trasferire il coverslip sullo scivolo di vetro e aggiungere 2 gocce di soluzione di montaggio.
- Posizionare delicatamente una coverlip sullo scivolo.
- Sigillare il copripago con smalto chiaro e conservare a 4 °C al buio fino a quando non si osservano le cellule.
- Immagina la diapositiva usando un microscopio confocale con un filtro appropriato a eccitazione/emissione (Ex/Em)=650/665 nm per la filloidina e a Ex/Em=488/507 nm per EGFP.
Risultati
La migrazione in vitro dei CSC in modalità tridimensionale è stata valutata da un sistema Transwell o dal tradizionale metodo di guarigione delle ferite per osservare la migrazione in modalità bidimensionale (2D)11. L'organo di Corti è una struttura complessa composta da varie cellule come cellule boettcher, cellule claudio, cellule deiters, cellule di pilastro, cellule di Hensen, cellule ciliate esterne, cellule ciliate interne, fibre nervose, membrana basiola...
Discussione
Il trapianto di MBC in siti danneggiati per promuovere la rigenerazione delle cellule danneggiate è stato ampiamente studiato e l'effetto terapeutico è evidente. Il trapianto e la successiva differenziazione dei CSC sono stati segnalati per ripristinare l'udito nei ratti con perdita dell'udito indotta da acido 3-nitropropionico13. Sebbene Lee et al. Fino a poco tempo fa, quasi 12 esperimenti sono stati condotti per ripristinare l'udito nel modello di roditore mediante tra...
Divulgazioni
Gli autori non hanno nulla da rivelare.
Riconoscimenti
Questo lavoro è stato supportato da borse di ricerca (NRF-2018-R1D1A1B07050175, HURF-2017-66) della National Research Foundation (NRF) della Corea e del Fondo di ricerca universitaria Hallym.
Materiali
| Name | Company | Catalog Number | Comments |
| 10X PBS Buffer | GenDEPOT | P2100-104 | |
| 4% Formalin | T&I | BPP-9004 | |
| Ampicillin | sigma | A5354-10ml | |
| BSA | sigma | A4503-100G | |
| confocal dish | SPL | 200350 | |
| confocal microscope | ZEISS | LSM800 | |
| coverslip | SPL | 20009 | |
| DMEM/F12 | Gibco | 10565-018 | |
| Fetal Bovine Serum | Thermo Fisher scientific | 16140071 | |
| Fluorsheild with DAPI | sigma | F6057 | |
| Forcep | Dumont | 0508-L5-P0 | |
| HBSS | Thermo Fisher scientific | 14065056 | |
| HEPES | Thermo Fisher scientific | 15630080 | |
| N2 supplement | Gibco | 17502-048 | |
| Phalloidin-iFluor 647 Reagent | abcam | ab176759 | |
| Stage Top Incubator | TOKAI HIT | WELSX | |
| Strain C57BL/6 mouse messenchymal stem cells with GFP | cyagen | MUBMX-01101 | |
| Triton X-100 | sigma | T8787 |
Riferimenti
- Brown, C. S., Emmett, S. D., Robler, S. K., Tucci, D. L. Global hearing loss prevention. Otolaryngologic Clinics of North America. 51 (3), 575-592 (2018).
- Chamberlain, G., Fox, J., Ashton, B., Middleton, J. Concise review: mesenchymal stem cells: their phenotype, differentiation capacity, immunological features, and potential for homing. Stem Cells. 25 (11), 2739-2749 (2007).
- Fu, X., et al. Mesenchymal stem cell migration and tissue repair. Cells. 8 (8), (2019).
- Uder, C., Brückner, S., Winkler, S., Tautenhahn, H. M., Christ, B. Mammalian MSC from selected species: Features and applications. Cytometry A. 93 (1), 32-49 (2018).
- Rojewski, M. T., et al. Translation of a standardized manufacturing protocol for mesenchymal stromal cells: A systematic comparison of validation and manufacturing data. Cytotherapy. 21 (4), 468-482 (2019).
- Ullah, M., Liu, D. D., Thakor, A. S. Mesenchymal stromal cell homing: Mechanisms and strategies for improvement. iScience. 15, 421-438 (2019).
- Ahn, Y. J., et al. Strategies to enhance efficacy of SPION-labeled stem cell homing by magnetic attraction: a systemic review with meta-analysis. International Journal of Nanomedicine. 14, 4849-4866 (2019).
- Alon, R., Ley, K. Cells on the run: shear-regulated integrin activation in leukocyte rolling and arrest on endothelial cells. Current Opinion in Cell Biology. 20 (5), 525-532 (2008).
- Sykova, E., Jendelova, P. In vivo tracking of stem cells in brain and spinal cord injury. Progress in Brain Research. 161, 367-383 (2007).
- Landegger, L. D., Dilwali, S., Stankovic, K. M. Neonatal murine cochlear explant technique as an in vitro screening tool in hearing research. Journal of Visualized Experiments. (124), e55704 (2017).
- Pijuan, J., et al. In vitro cell migration, invasion, and adhesion assays: From cell imaging to data analysis. Frontiers in Cell and Developmental Biology. 7, 107 (2019).
- Rask-Andersen, H., et al. Human cochlea: anatomical characteristics and their relevance for cochlear implantation. The Anatomical Record. 295 (11), 1791-1811 (2012).
- Kamiya, K., et al. Mesenchymal stem cell transplantation accelerates hearing recovery through the repair of injured cochlear fibrocytes. The American Journal of Pathology. 171 (1), 214-226 (2007).
- Lee, H. S., Kim, W. J., Gong, J. S., Park, K. H. Clinical safety and efficacy of autologous bone marrow-derived mesenchymal stem cell transplantation in sensorineural hearing loss patients. Journal of Audiology and Otology. 22 (2), 105-109 (2018).
- Vanden Berg-Foels, W. S. In situ tissue regeneration: chemoattractants for endogenous stem cell recruitment. Tissue Engineering Part B: Reviews. 20 (1), 28-39 (2014).
- Parker, M., Brugeaud, A., Edge, A. S. Primary culture and plasmid electroporation of the murine organ of Corti. Journal of Visualized Experiments. (36), e1685 (2010).
- Ogier, J. M., Burt, R. A., Drury, H. R., Lim, R., Nayagam, B. A. Organotypic culture of neonatal murine inner ear explants. Frontiers in Cellular Neuroscience. 13, 170 (2019).
- Oshima, K., et al. Mechanosensitive hair cell-like cells from embryonic and induced pluripotent stem cells. Cell. 141 (4), 704-716 (2010).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneThis article has been published
Video Coming Soon