このコンテンツを視聴するには、JoVE 購読が必要です。 サインイン又は無料トライアルを申し込む。
Method Article
特殊地中海リグノセルロース残基からの超高速リグニン抽出
要約
深いユーテク系溶媒ベースのマイクロ波アシスト前処理は、リグノセルロース分画および高純度リグニン回収のための、緑色で迅速かつ効率的なプロセスです。
要約
前処理は、リグノセルロース性バイオリファイナリープロセスにおける最も高価なステップです。化学要件を最小限に抑え、電力や熱の消費を最小限に抑え、環境にやさしい溶剤を使用することで、コスト効率が高くならなければなりません。深い共生溶剤(DES)は、持続可能なバイオリファイナリーの重要な、緑、低コストの溶剤です。それらは、少なくとも1つの水素結合ドナーおよび1つの水素結合アクセクターから生じる低い凝固点によって特徴づけられる透明混合物である。DESは有望な溶剤ですが、競争力を持つ利益のためには、マイクロ波照射などの経済加熱技術と組み合わせる必要があります。マイクロ波照射は、適切な温度を迅速に達成できるため、加熱時間を短縮し、分画を高める有望な戦略です。本研究の目的は、低コストで生分解性溶媒を用いたバイオマス分画およびリグニン抽出のための一段階の迅速な方法を開発することであった。
本研究では、3種類のDESを用いて、800Wで60sのマイクロ波支援DES前処理を行った。DES混合物は、コリンクロリド(ChCl)および3つの水素結合ドナー(HBD)からファシリティ的に調製した:モノカルボン酸(乳酸)、ジカルボン酸(シュウ酸)、および尿素。この前処理は、海洋残基(ポジドニア葉およびエーガグロパイル)、アグリフード副産物(アーモンド殻およびオリーブポマ、森林残留物(松ぼっくり)、および多年生リグノセルロース草(スティパ・テナシシマ)からのバイオマス分別およびリグニン回収に使用された。さらに分析を行い、回収されたリグニンの収率、純度、および分子量分布を決定した。さらに、抽出されたリグニン中の化学官能基に対するDESの効果は、フーリエ変換赤外線(FTIR)分光法によって決定された。結果は、ChCl-シュウ酸混合物が最高のリグニン純度と最低収率を与える可能性があることを示しています。本研究は、DES-マイクロ波プロセスがリグノセルロース系バイオマス分画のための超高速で効率的でコスト競争力のある技術であることを示しています。
概要
持続可能なバイオリファイナリープロセスは、バイオマス処理、その分画を目的の分子に統合し、付加価値製品への転換を1.第二世代のバイオリファイニングにおいて、前処理はバイオマスをその主成分2に分画するために不可欠であると考えられる。化学的、物理的、または生物学的戦略を利用した従来の前処理方法は、広く適用されてきた3.しかし、このような前処理は、バイオリファイニングにおいて最も高価な工程と考えられており、処理時間が長く、高熱・消費電力、溶剤不純物4などの他の欠点がある。最近では、イオン液体3の特性が類似したDESは、生分解性、環境配慮、合成の容易さ、および処理後の回復などの利点により緑色の溶媒として出現している5。
DESは、乳酸、リンゴ酸、またはシュウ酸などの少なくとも1つのHBDと、ベタインまたはコリンクロリド(ChCl)6などの水素結合アクセプター(HBA)との混合物である。HBA-HBD相互作用は、化学結合の切断を可能にする触媒機構を可能にし、バイオマス分画およびリグニン分離を引き起こす。多くの研究者は、トウモロコシのコブ上のChCl-グリセロール、ストーバー7、8、ChCl-シュウレア、小麦ストロー9のChCl-シュウ酸、ユーカリのおがず10のChCl乳酸、およびChCl酢酸11およびChCl-ethlグリコールなどのリグノセルロース系原料のDESベースの前処理を報告している。DES効率を向上させるためには、前処理をマイクロ波処理と組み合わせてバイオマス分画を加速する必要があります5.多くの研究者は、木材8とトウモロコシストーバー、スイッチグラス、ミスカンサス5のこのような組み合わせ前処理(DESと電子レンジ)を報告しており、短期間で1回の簡単なステップでリグノセルロース分画およびリグニン抽出のためのDESの容量に関する新しい洞察を提供しています。
リグニンは、バイオポリマーの製造原料として評価されるフェノール型高分子であり、芳香族モノマーやオリゴマー12などの化学物質の製造に代わる代替物を提示する。また、リグニンは、抗酸化作用および紫外線吸収活性13を有する。いくつかの研究は、化粧品のリグニンの用途を報告しています14,15.市販の日焼け止め製品におけるその統合は、わずか2重量%リグニンと10重量%リグニン16の添加とSPF 50までの追加でSPF 15からSPF 30に製品の日焼け防止因子(SPF)を改善しました。本論文は、地中海の生物群集のDES-マイクロ波前処理を組み合わせることによって助け、リグニン炭水化物切断のための超高速アプローチを記述する。これらの生物塊は、アグリフードの副産物、特にオリーブポマとアーモンドの殻で構成されています。調査された他の生物は、海洋起源(ポジドニアの葉とエーガグロパイル)と森林(松ぼっくりと野生の草)に由来するものであった。本研究の焦点は、この組み合わせ前処理が原料分別に及ぼす影響を評価し、リグニンの純度と収率に及ぼす影響を調査し、抽出されたリグニン中の分子量および化学官能基に及ぼす影響を研究するために、低コストの緑色溶媒を試験することであった。
プロトコル
1. 生物の調製
- バイオマス乾燥
- ポジドニアの葉とアエガグロパイルボール(ポジドニアオセアニカ)を地中海のビーチから収穫し、40°Cのオーブンに72時間置きます。
- アーモンドの殻(プルナス・ダルチス)、食品産業から生成された、オリーブオイル工場から得られたオリーブポマエース(オレア・エウロパエアーL.)を40°Cのオーブンに72時間置きます。
- 森から採取した松ぼう(ピヌス・ハレペンシス)、および地中海南部の盆地から採取したアルファ葉(スティパ・テナシシマ)を40°Cのオーブンに72時間置きます。
注:バイオマスに砂が含まれている場合は、オーブンに入れる前に蒸留水ですすいする必要があります。バイオマスは 図1A-Fに示されています。
- バイオマス研削
- 1mmふるいを装備したハンマーカッターに各バイオマス20gを入れる。0.25 Lビーカーで得られた粉末を収集し、0.5ミリメートルふるいを装備したハンマーカッターに供給します。0.25 Lビーカーに粉末を集める。
2. マイクロ波アシスト、超高速リグニン抽出
- 深いエセクステ系溶剤(DES)調製
- 500 mLラウンドボトムフラスコに126gのシュウ酸二水和物を174gのChClと混合し、均質で透明な液体が形成されるまで70°Cの浴槽で4時間溶かして、1:1のモル比でDES1(ChCl-シュウ酸)を調製します。
- 500 mLラウンドボトムフラスコに90gの乳酸を含むChClの174gを混合し、均質で透明な液体が形成されるまで70°Cの浴槽で4時間溶かして、1:1のモル比でDES2(ChCl-乳酸)を調製します。
- 500 mL 丸底フラスコに120gの尿素を174gのChClと混合し、均質で透明な液体が形成されるまで70°Cの浴槽で4時間溶かして、1:12のモル比でDES3(ChCl-urea)を調製します。
注:500 rpmでかき混ぜる棒でこれらの混合物を連続的にかき混ぜます。
- マイクロ波-DES処理を組み合わせた
- 閉じたポリテトラフルオロエチレン反応器の電子レンジに原料の5gを置きます。DESの50 mLを加え、サンプルに攪拌棒を入れる。マイクロ波容器を適切なキャップで閉じ、温度キャップを取り付けます。
- 電子レンジ容器をターンテーブルの端に置き、常に攪拌されるようにします。マイクロ波の電源を800 Wに1分間設定します。適切な手袋を使用して、電子レンジから容器を取り出し、混合物を冷まします。バイオマスサンプルごとに3つのDESを使用して、この処理を繰り返します。
メモ:温度プローブが正しく配置されていること、およびマイクロ波容器が均質な温度であることを確認してください。
- リグニン分離
- 50:50(v:v)比でエタノール:水を混合して均質な反溶媒溶液を調製します。処理された原料に50mLの抗溶媒溶液を加え、遠心分離容器(250mL)に入れ、遠心分離器を3,000×gで5分間遠心分離機とした。
- 遠心分離後、ガラスフィルターるつぼ(気孔率4、10~16μm、直径10mm)を使用して上清(リグニン分画)をフィルター処理します。25 mLの抗溶媒溶液で遠心分離後に回収した残りのセルロース残渣を洗浄する。
- 3,000×gで、洗浄後5分間遠心分離機。4倍の反復を行い、ガラスフィルターのるつぼ(気孔率N4、10~16μm、直径10mm)を通して、このスミッシュを回収してフィルタリングします。
- ステップ 2.3.2 からフィルター処理されたリグニンが豊富な分率を、500 mL ラウンド底フラスコのステップ 2.3.3 からフィルター処理されたスリーチに追加します。ロータリーエバポレーターを使用して、50°Cおよび110mbarでエタノールを蒸発させます。
- 濃縮液(リグニンが豊富な分画)に150mLの脱イオン水を加え、遠心分離によってリグニンを沈殿させます。ペレットとしてリグニンを収集し、蒸留水の25 mLでそれを洗浄します。4倍のすきを繰り返します。リグニンを凍結乾燥し、40°Cでオーブンで乾燥させた。
注:必要に応じて、リグニン>4xを洗浄して、ソルベントから塩を取り除きます。 - 歩留まりを決定するには、次の式を使用します。
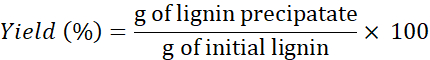
注:リグニン抽出は、他の2つのDESで行われました: コリン塩化物 + レソルシノールとコリン塩化物 + 酪酸 1 分で.しかし、これらのDESを使用して回収されたリグニンの量は、他の3つのDESを使用して得られた量と比較して非常に少ない(そして回復不能)であった。
3. クラソンによるリグニン抽出の純度測定
- クラソン加水分解のサンプル調製
- 550°Cのマフル炉にフィルターるつぼ(気孔率4、直径4.5mm)を4時間(2時間、25°Cから)配置します。オーブンが150°Cに冷却されたらるつぼを取り出し、乾燥剤に入れ、冷却し、重量を量ります。
- 約30mgのリグニンをホウケイ酸ガラス管に加え(材料表参照)、サンプルの重量に注意してください。サンプルに72%の硫酸(H2SO4)の1mLを加え、サンプルを60分間30°Cの浴槽に入れ、10分ごとに渦を混ぜます。
- サンプルを取り出し、100 mLのガラス瓶に移し、28mLの蒸留水を加え、酸を4%の濃度に希釈します。121 °Cのオートクレーブにガラス瓶を60分間置きます。ガラス瓶を取り出し、冷まします。
- 酸不溶性リグニンの分析
- 真空下でるつぼを使用して加水分解物をろ過します。脱イオン水を含むガラス瓶内のすべての固体を収集します。50mLの脱イオン水でるつぼをすすいでください。
- 固体を含むるつぼを105°Cのオーブンに16時間置いて乾燥させます。オーブンからるつぼを取り出し、デシケータに入れ、冷まします。サンプルの重量を量ります。
- 550°Cのマフル炉に4時間(2時間ランプ)のるつぼを入れます。それを取り外し、デシケータに入れてください。サンプルの重量を量ります。
- 次の式を使用して、酸不溶性残基(AIR)の割合を計算します。
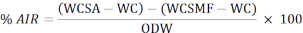
WCSA:オーブンからそれらを除去した後、るつぼ+サンプルの重量
WC: るつぼの重量
WCSMF:マッフル炉から取り外した後のるつぼの重量
ODW:サンプルのオーブン乾燥重量
- 酸溶性リグニンの分析
- クォーツキュベットを用いて、205 nmの分光光度計を用いてステップ3.2.1で得られた濾液の吸光度を測定する。蒸留水をブランクとして使用します。
- 次の式を使用して、酸溶性残基 (ASL) の割合を計算します。
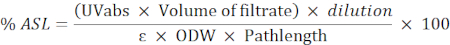
注: 吸光度は 0.2 ~ 0.7 の間にする必要があります。必要に応じてサンプルを希釈します。
UVabs: 205 nm で吸光度
パスの長さ:測定セルの光路(cm単位)
ε:特定波長のバイオマスの吸収性
4. 抽出リグニン中の窒素含有量
- アルカリ溶液の調製
- 2.5 Lの体積フラスコで、1kgの水酸化ナトリウム(NaOH)を計量し、脱イオン水をマークまで加えます。フラスコに磁棒を入れ、NaOHが完全に溶解するまでかき混ぜます。
- 硫酸溶液調製物
- 5 Lの容積フラスコに0.1 NH2SO4(材料表を参照)を取り、5 Lマークまで脱イオン水を加え、磁気棒を入れ、内容物が溶解するまでかき混ぜます。
- 受け入水の準備
- 5L体積フラスコに、100gのH3BO3(ホウ酸)を脱イオン水に溶解し、その体積をマークに持ち上げる。
- 100 mLの体積フラスコに100mgのブロモトレゾールグリーンの重量を量り、マークに技術的なメタノールを加えます。
- 100 mLの体積フラスコに100mgのメチルレッドを秤量し、技術的なメタノールをマークに加えます。
- ステップ4.3.1から5LのH3BO3溶液、ステップ4.3.2からブロモクレゾールグリーン溶液の100 mL、ステップ4.3.3からメチル赤溶液の70mL、および5 Lの脱イオン水を容器に注ぎます。受け取った溶液を30分間よく振ります。
注: ソリューションの最終的な色は緑にする必要があります。色が緑でない場合は、1 N NaOH溶液の50 mLを加えます。
- サンプル準備
- ケルダール管に、窒素フリー紙に計量したリグニン100mgを置き、ケルダール(1.5g硫酸カリウム(K2SO 4)+0.045g硫酸銅五水和物(CuSO4.5H2O)+0.045 g二酸化チタン(TiO2))を加え、2.7M2Lを濃縮します。
注:(サンプルなし)窒素フリーの用紙のみを含む4つのチューブをブランクとして使用してください。
- ケルダール管に、窒素フリー紙に計量したリグニン100mgを置き、ケルダール(1.5g硫酸カリウム(K2SO 4)+0.045g硫酸銅五水和物(CuSO4.5H2O)+0.045 g二酸化チタン(TiO2))を加え、2.7M2Lを濃縮します。
- サンプル消化
- 360 °Cで1時間前に消化器のサーモスタットのスイッチを入します。
- サンプルチューブをラックの上に置き、4つのブランクチューブをラックの四隅に置き、ラックの穴(ある場合)を空のチューブで埋めます。
- ラックを予熱した消化器に入れ、吸引システムを覆い、水ポンプを開きます。
注:煙を避けるために注意してください。煙が出る場合、水の流れを増加させます。 - 2時間後、加熱をオフにし、サンプルを取り出し、金属支持体に置きます。吸引システムをオンにして、ラックを約40分間冷却します。
- ケルドハル蒸留法
- ケルダール蒸留所のスイッチを入れる。画面に[選択]が表示されるまで、自己テストを実行できるようにします。手動モードに切り替え、空のチューブを挿入し、スライドドアを閉じます。
- Titrant ビュレット (0.02 N H2SO4)を下と上に数回押してパージ (カバーを持ち上げる) と H2SO4 ボトルのチューブを絞ってパイプから気泡を除去します。フードを閉じます。
- H3BO3 受信ソリューション 3x をパージします。
- 水3倍を加え、アクティブスチーム(10分)に切り替えます。ケルダール1分析プログラムに切り替えます。結果ラインレベルの矢印を使用してブランコを入力します。
- チューブを挿入します。4 つのブランクから始め、その平均を計算します。 ブランコ 行に値を入力します。
メモ:チューブが挿入されると、デバイスはH2Oの30 mL、H 3 BO3の30mL、および10 N NaOHの40 mLを自動的に連続的に追加します。 - 結果行での titrant の mLに切り替えます。チューブを挿入し、使用するH2SO4の量をメモします。
注意:ケルダール蒸留所をテストするために、グリセリンの50mgが%Nの5%±18.60%に相当することを考慮してください。各滴定の終わりに、装置は自動的に管を空にし、きれいにする。 - Nの割合を計算します。

V s.a : 硫酸の体積
T s.a : 0.02 N H2SO4
S: サンプル質量
5. 抽出リグニン中の灰含有量
- セラミックのるつぼを105°Cで1時間乾燥させます。 デシケータで冷却するためにそれらを残します。
- るつぼの重量を量り、その数を書き留めます。サンプルパウダーを約1g加えます。次のプログラムでマフル炉にるつぼを置きます: 2時間ランプ 575 °Cまで;575 °Cで4時間の高原。
- オーブンを100°Cに冷却します。 るつぼを取り出し、デシケータに入れ、重量を量ります。
6. 炭水化物の含有量
- ホウ水素化ナトリウム(NaBH4)/ジメチルスルホキシド(DMSO)溶液の調製
- NaBH4 の2gを100mLの体積フラスコに入れ、DMSOでマークに充填します。市長風呂で100°Cに熱し、完全に溶解するまで溶液をかき混ぜます。
- MIX溶液の調製
- キシロース、アラビノース、ラムノース、グルコース、ガラクトース、マンノース、および2-デオキシグルコースを100 mL体積フラスコにそれぞれ20mg入れ、100mLのマークまで脱イオン水で満たします。
- サンプルの加水分解
- ホウケイ酸ガラス管にリグニンの50mgのサンプルを計量し、1 MH2SO4の3 mLを加え、100°Cで3時間加熱します。
- サンプルを冷却し、15 M水酸化アンモニウム(NH4OH)を1mL加え、pHをチェックして中性またはアルカリ性であることを確認します。各サンプルに正確に1mLの内部標準(2-デオキシグルコース)を加えます。
注:内部標準として追加された2-デオキシグルコースは、サンプル中に存在する各用量の量を定量化することを可能にする。
- 単糖類のアルジトル酢酸への還元とアセチル化
- ステップ6.3.2から400 μLの溶液を取り、特別な管に入れてください。コントロールMIX溶液の400 μLを取り、特別なチューブに入れてください。
注: MIX ソリューションを使用すると、応答因子(RF)と単糖のパーセンテージの計算が容易になります。 - セクション6.1で準備されたNaBH4/DMSO溶液の2 mLを追加します。チューブを閉め、水浴中に40°Cで90分間インキュベートします。水浴からチューブを取り出し、0.6mLの氷酢酸を加えます。
注:これは発熱反応であるため、泡と煙が現れます。 - 約0.4mLの1-メチルイミダゾールと約4mLの無水酢酸を加えます。15分後、蒸留水10mLを加え、冷却し、ジクロロメタン(CH2Cl2)を〜3mL加える。
- 少なくとも2時間後、下側(有機)相の1mLを回収し、火炎イオン化検出器キャピラリーカラム、HP1-メチルシロキサン(30m(長さ)×320μm(内径)、0.25μm(膜厚)を備えたガスクロマトグラフに注入する。データを分析します。
- 次の式を使用して、応答係数 (RF) を計算します。
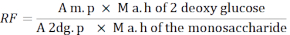
M. p: MIX溶液中の単糖ピークの面積の平均
M a. h 2 - デオキシグルコース: 加水分解後の2-デオキシグルコースの質量
2dg。p:MIX溶液中の2-デオキシグルコースピークの面積の平均
単糖のM a.h:加水分解後の単糖の質量
注: アンヒドロ補正はラムノースでは 0.8、アラビノースとキシロースの場合は 0.8、マンノース、グルコース、ガラクトースは 0.9 です。加水分解後の質量=MIX溶液に用いられる単糖の無水補正x質量(g)。 - 単糖質量を計算するには、次の式を使用します。
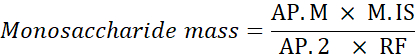
AP.M:分析したサンプル中の単糖ピーク領域
M. IS: 内部標準の質量が追加されました。ここで、C SI=1 mg/mL
AP.2: 試料中の2-デオキシグルコースのピーク面積
RF: 応答係数 - 以下の式を用いて、各単糖の割合を計算します。

- ステップ6.3.2から400 μLの溶液を取り、特別な管に入れてください。コントロールMIX溶液の400 μLを取り、特別なチューブに入れてください。
7. 抽出リグニンの化学的機能 (フーリエ形質転換赤外)
- 抽出されたリグニンの化学官能基を同定するために、減衰した全反射率(ATR)モジュールを搭載したFT-IR分光計を使用してください。分光法ソフトウェアを開き、パラメータを調整します:解像度4 cm-1、サンプルスキャン時間32、バックグラウンドスキャン時間16、4000から400cm-1、結果スペクトル透過率のデータを保存します。
- サンプルを追加しないでください。 バックグラウンドシングルチャンネルを押します。今結晶上のサンプルの1mgを置き、 サンプル単一チャネルを押します。取得したスペクトルを処理します。
8. 抽出リグニンの分子量(ゲル透過クロマトグラフィー)
- ジメチルホルムアミド(DMF)の溶液を0.5%塩化リチウム(LiCl)で調製します。1 L体積フラスコに5gのLiClを取り、ゲージラインにDMFを加え、均質な液体が得られるまで内容物を混ぜます。
- 0.5% LiClで3 mLのDMFにリグニンサンプルの3mgを溶解する。遠心分離機を10mL遠心分離チューブに入れ、可溶分をバイアルに分離する。
- 3 mgのポリスチレン標準1 kDa、2 kDa、3 kDa、10 kDa、20 kDa、および30 kDaを0.5%のLiClでDMFの溶液に溶解する。10 mLホウケイ酸ガラス管に遠心分離機を入れ、可溶分をバイアルに移す。
- 高速液体クロマトグラフィー-紫外線(UV)システムを準備します。
- データシステムを開き、UV検出器を確認します。
- 蒸留水でシステムをパージします。溶出液にプランジャを取り付けます(0.5% LiClのDMF)。パージバルブを開き、流量1 mL/分でラインを15分間パージします。流れを止めて、パージバルブを閉じます。
- 流量を1mL/minに10分間設定し、検出器への溶出経路をきれいにします。流量を停止します。
- ガード列が前に付いた列をインストールします ( 資料一覧を参照)。45°Cでカラムヒーターをオンにし、UV検出器をオンにし、流量が0.6mL/minになるまで徐々に流量を設定します。
- 各サンプルの30 μLを270 nmの波長で40分間注入します。取得したデータを処理し、キャリブレーションラインを使用して質量分布を計算します。
- 数平均分子量(Mn)、重量平均分子量(Mw)、および多分散度指数(PDI)を算出する。
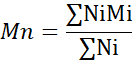
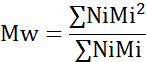
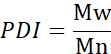
Mi:鎖の分子量
Ni:その分子量の鎖の数
9. データ処理と統計分析
- すべての分析実験を三重で行い、その結果を乾物の%として表現します。
- 一方向分散分析(ANOVA)を実行し、Tukeyの多重比較検定を使用して平均を比較します。
- 主成分分析 (PCA) を実行する。
結果
図2A-Cは、マイクロ波-DES前処理を組み合わせた後の6つの原料からの抽出のリグニン収量を示す図1A-Fに示す。結果は、DES1(ChCl-シュウ酸)で得られたリグニン収率(図2A)がDES2(ChCl-乳酸)およびDES3(ChCl-尿素)で得られた収率よりも低かったことを示している(
ディスカッション
この研究には多くの目的がありました。最初の方法は、イオン液体と有機溶剤の両方の特性を持つ低コストのグリーン溶剤を調製し、使用することであった。第二の目的は、アルカリ溶媒、基礎、または熱物理学的技術を使用してソックスレーまたはヘミセルロースを使用して抽出物の抽出などの予備的なステップを必要とせずに、単一のステップでバイオマスを分画し、リグニンを抽出す?...
開示事項
著者らは利益相反を報告していない。
謝辞
MKとTBは、ハイサム・アイエブに統計分析と図の準備、ワロン地域(欧州地域開発-VERDIR)、高等教育科学研究大臣(Taoufik Bettaieb)に資金を提供してくれたことに感謝します。
資料
| Name | Company | Catalog Number | Comments |
| HPLC Gel Permeation Chromatography | Agilent 1200 series | ||
| 1 methylimadazole | Acros organics | ||
| 2-deoxy-D-glucose (internal standard) | Sigma Aldrich (St. Louis, USA) | ||
| Acetic acid | Sigma Aldrich (St. Louis, USA) | ||
| Acetic anhydride | Sigma Aldrich (St. Louis, USA) | ||
| Adjustables pipettors | |||
| Alkali | alkali-extracted lignin | ||
| Arabinose (99%) | Sigma Aldrich (St. Louis, USA) | ||
| Autoclave | CERTO CLAV (Model CV-22-VAC-Pro) | ||
| Water Bath at 70 °C | |||
| Boric acid | Sigma Aldrich (St. Louis, USA) | ||
| Bromocresol | Sigma Aldrich (St. Louis, USA) | ||
| Catalyst | CTQ (coded A22) (1.5 g K2SO4 + 0.045 g CuSO4.5 H2O + 0.045 g TiO2) | Merck | |
| Centrifugation container | |||
| Centrifuge | BECKMAN COULTER | Avanti J-E centrifuge | |
| Ceramic crucibles | |||
| Choline chloride 99% | Acros organics | ||
| Column | Agilent PLGel Mixed C (alpha 3,000 (4.6 × 250 mm, 5 µm) preceded by a guard column (TSK gel alpha guard column 4.6 mm × 50 mm, 5 µm) | ||
| Column | HP1-methylsisoxane (30 m, 0.32 mm, 0.25 mm) | ||
| Crucible porosity N°4 ( Filtering crucible) | Shott Duran Germany | boro 3.3 | |
| Deonized water | |||
| Dessicator | |||
| Dimethylformamide | VWR BDH Chemicals | ||
| Dimethylsulfoxide | Acros organics | ||
| Erlenmeyer flask | |||
| Ethanol | Merck (Darmstadtt, Germany) | ||
| Filtering crucibles, procelain | |||
| Filtration flasks | |||
| Fourrier Transformed Inra- Red | Vertex 70 Bruker apparatus equipped with an attenuated total reflectance (ATR) module. Spectra were recorded in the 4,000–400 cm−1 range with 32 scans at a resolution of 4.0 cm−1 | ||
| Galactose (98% | Sigma Aldrich (St. Louis, USA) | ||
| Gaz Chromatography | Agilent (7890 series) | ||
| Glass bottle 100 mL | |||
| Glass tubes ( borosilicate) with teflon caps 10 mL | |||
| Glucose (98% | Sigma Aldrich (St. Louis, USA) | ||
| Golves | |||
| Graduated cylinder 50 mL /100 mL | |||
| H2SO4 Titrisol (0.1 N) | Merck (Darmstadtt, Germany) | ||
| H2SO4 (95-98%) | Sigma Aldrich (St. Louis, USA) | BUCHI R-114) | |
| Hummer cutter equiped with 1 mm and 0.5 mm sieve | Mill Ttecator (Sweden) | Cyclotec 1093 | |
| Indulin | Raw lignin control | ||
| Kjeldahl distiller | Kjeltec 2300 (Foss) | ||
| Kjeldahl tube | FOSS | ||
| Kjeldhal rack | |||
| Kjeldhal digester | Kjeltec 2300 (Foss) | ||
| Kjeldhal suction system | |||
| Lab Chem station Software | GC data analysis | ||
| Lactic acid | Merck (Darmstadtt, Germany) | ||
| Lithium chloride LiCl | Sigma Aldrich (St. Louis, USA) | ||
| Mannose (98%) | Sigma Aldrich (St. Louis, USA) | ||
| Methyl red | |||
| Microwave | START SYNTH MILESTONE Microwave laboratory system | ||
| Microwave temperature probe | |||
| Microwave container | |||
| Muffle Furnace | |||
| NaOH | Merck (Darmstadtt, Germany) | ||
| Nitrogen free- paper | |||
| Opus | spectroscopy software | ||
| Oven | GmbH Memmert SNB100 | Memmert SNB100 | |
| Oxalic acid | VWR BDH Chemicals | ||
| P 1000 | Soda-processed lignin | ||
| pH paper | |||
| precision balance | |||
| Infrared spectroscopy | |||
| Quatz cuvette | |||
| Rhamnose (98%) | Sigma Aldrich (St. Louis, USA) | ||
| Rotary vacuum evaporator | Bucher | ||
| Round-bottom flask 500 mL | |||
| sodium borohydride NaBH4 | |||
| Schott bottle | glass bottle | ||
| Sovirel tubes | sovirel | Borosilicate glass tubes | |
| Spatule | |||
| Special tube | |||
| Spectophotometer | UV-1800 Shimadzu | ||
| Sterilization indicator tape | |||
| Stir bar in teflon | |||
| Stirring plate | |||
| Syringes | |||
| Sodium borohydride | Sigma Aldrich (St. Louis, USA) | ||
| Titrisol | Merck | Merck 109984 | 0.1 N H2SO4 |
| Urea | VWR BDH Chemicals | ||
| Vials | |||
| VolumetriC flask 2.5 L /5 L | Bucher | ||
| Vortex | |||
| Xylose (98%) | Sigma Aldrich (St. Louis, USA) |
参考文献
- Kammoun, M., et al. Hydrothermal dehydration of monosaccharides promoted by seawater fundamentals on the catalytic role of inorganic salts. Frontiers in Chemistry. 7, 132 (2019).
- Kammoun, M., Ayeb, H., Bettaieb, T., Richel, A. Chemical characterisation and technical assessment of agri-food residues, marine matrices, and wild grasses in the South Mediterranean area: A considerable inflow for biorefineries. Waste Management. 118, 247-257 (2020).
- Zhang, C. W., Xia, S. Q., Ma, P. Facile pretreatment of lignocellulosic biomass using deep eutectic solvents. Bioresource Technology. 219, 1-5 (2016).
- Mora-Pale, M., Meli, L., Doherty, T. V., Linhardt, R. J., Dordick, J. S. Room temperature ionic liquids as emerging solvents for the pretreatment of lignocellulosic biomass. Biotechnology and Bioengineering. 108 (6), 1229-1245 (2011).
- Chen, Z., Wan, C. Ultrafast fractionation of lignocellulosic biomass by microwave-assisted deep eutectic solvent pretreatment. Bioresource Technologie. 250, 532-537 (2018).
- Francisco, M., Van Den Bruinhorst, A., Kroon, M. C. New natural and renewable low transition temperature mixtures ( LTTMs ): screening as solvents for lignocellulosic biomass processing. Green Chemistry. 14 (8), 2153-2157 (2012).
- Liu, Y. C., et al. Efficient cleavage of lignin - carbohydrate complexes and ultrafast extraction of lignin oligomers from wood biomass by microwave-assisted treatment with deep eutectic solvent. Chem sus chem. 10, 1692-1700 (2017).
- Xu, G. C., Ding, J. C., Han, R. Z., Dong, J. J., Ni, Y. Enhancing cellulose accessibility of corn stover by deep eutectic solvent pretreatment for butanol fermentation. Bioresource Technologie. 203, 364-369 (2016).
- Jablonský, M., Andrea, &. #. 3. 5. 2. ;., Kamenská, L., Vrška, M., Šima, J. Deep eutectic solvents fractionation of wheat straw deep eutectic solvents fractionation of wheat straw. Bioresources. 10 (4), 8039-8047 (2015).
- Shen, X. J., et al. Facile fractionation of lignocelluloses by biomass-derived deep eutectic solvent (DES) pretreatment for cellulose enzymatic hydrolysis and lignin valorization. Green Chemistry. 21, 275-283 (2019).
- Alvarez-Vasco, C., et al. Unique low-molecular-weight lignin with high purity extracted from wood by deep eutectic solvents (DES): a source of lignin for valorization. Green Chemistry. 18, 5133-5141 (2016).
- Banu, J. R., et al. A review on biopolymer production via lignin valorization. Bioresource Technologie. 290, 121790 (2019).
- Gordobil, O., Olaizola, P., Banales, J. M., Labidi, J. Lignins from agroindustrial by-products as natural ingredients for cosmetics chemical structure and in vitro sunscreen and cytotoxic activities. Molecules. 25 (5), 1131 (2020).
- Lee, C. S., Thu Tran, T. M., Weon Choi, J., Won, K. Lignin for white natural sunscreens. International Journal of Biological Macromolecules. 122, 549-554 (2019).
- Widsten, P. Lignin-based sunscreens-state-of-the-art, prospects and challenges. Cosmetics. 7, 85 (2020).
- Qian, Y., Qiu, X., Zhu, S. Lignin: a nature-inspired sun blocker for broad-spectrum sunscreens. Royal Society of Chemistry. 17, 320-324 (2015).
- Zijlstra, D. S., et al. Extraction of lignin with high β-O-4 content by mild ethanol extraction and its effect on the depolymerization yield. Journal of Visualized Experiments. (143), e58575 (2019).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved