Method Article
iPSC-대식세포에 의한 죽은 신경 모세포종 세포의 식증에 대한 체외 정량적 이미징 분석
요약
신경 퇴행성 질환은 dysregulated 마이크로글리아 기능과 관련이 있습니다. 이 문서는 iPSC-대식세포에 의한 신경 모세포종 세포의 phagocytosis의 체외 분석방법을 설명합니다. 정량현미경 판독은 살아있는 세포 시간 경과 화상 진찰 과 고정 세포 고함량 화상 진찰을 위해 기술됩니다.
초록
Microglia는 파킨슨 병과 알츠하이머 병을 포함한 여러 신경 퇴행성 질환에서 신경 면역 반응을 조율합니다. Microglia는 phagocytosis의 전문적인 양식인 efferocytosis의 과정을 통해 죽고 죽어가는 뉴런을 정리합니다. phagocytosis 기능은 microglia에 영향을 미치는 환경 또는 유전 위험 요소에 의해 중단될 수 있습니다. 이 논문은 식세포화물에 대한 pH 민감성 염료로 표지된 인간 신경모세포종 세포주(SH-SY5Y)를 사용하여 마이크로글리아의 유도된 만능 줄기 세포(iPSC) 모델에서 미세글리아 에페로세포증을 연구하기 위한 신속하고 간단한 체외 현미경 프로토콜을 제시한다. 절차는 파고 세포에 의해 "먹는 나"신호로 인식 표면 인산화를 표시 죽은 신경 모세포종 세포의 높은 수율 결과. 상기 96웰 플레이트 분석법은 라이브 셀 타임랩스 이미징에 적합하거나, 플레이트는 고함량 현미경 검사법에 의해 추가 처리 및 정량화되기 전에 성공적으로 고정될 수 있다. 고정 세포 고함량 현미경 검사는 소분자 억제제의 스크리닝을 위해 분석법을 확장하거나 유전 적 변이체 iPSC 라인의 phagocytic 기능을 평가할 수 있게 한다. 이 분석체는 iPSC-대식세포에 의한 전체 죽은 신경모세포종의 식증증을 연구하기 위해 개발되었지만, 분석체는 시냅토좀 및 골린 및 기타 식세포 유형과 같은 신경 퇴행성 질환과 관련된 다른 화물에 쉽게 적응할 수 있다.
서문
Microglia는 뇌 조직 거주자 대식세포이며, 그들의 기능은 면역 감시를 포함, 상해 / 감염에 염증 반응을 조정, 시냅스 리모델링, 죽은 세포의 phagocytosis, myelin, 단백질 집계, 및 병원균. Phagocytosis는 microglia가 표면 수용체와 화물을 인식하고 다음화물의 저하를 위해 리소좀과 융합 phagosome로 개체를 삼키기 위해 자신의 세포 골격을 재구성하는 과정입니다. 건강한 microglia phagocytose 세포 세포는 괴사1되기전에 그들을 제거하는 것을. 세포 세포의 식세포는 또한 efferocytosis로 알려져 있으며, 죽어가는 세포2에의하여 인산다이들세린 "eat-me" 신호의 표시를 요구한다. 수많은 마이크로글리아 수용체는 TIM-4, BAI1, Stabilin-2 및 TREM2를 포함하여 인산염에 직접 결합합니다. Microglial TAM 수용체(예를 들어, MERTK) 및 인테그린은 각각 액세서리 단백질 GAS6 또는 MFG-E8을 사용하여 인파디델세린에 간접적으로 결합한다. 다른 "eat-me" 신호는 죽어가는 세포의 인식에 필요할 수 있습니다., 이들은 글리코실화 또는 표면 단백질의 전하에 변화를 포함; 세포 내 단백질 ICAM3, 칼레티쿨린, 세포 표면의 부속제-I의 발현; 산화 LDL; 또는 마이크로글리아 생산에 의한 세포 세포의 코팅은 C1q1,2를상량한다.
파킨슨병, 알츠하이머병, 전두엽 치매, 근위축성 측삭 경화증 을 포함한 신경퇴행성 질환은 죽은 세포, 골린 단편, 단백질 응집체 와 같은 뇌 폐기물의 축적을 포함하여 마이크로글리아 기능에 대한 손상과 관련이 있으며, 이러한자극3에대한 과장된 염증 반응. 식세포증은 신경 퇴행성 질환에서 손상될 수 있으며 노화, 염증 또는 특정 유전적 위험 변이체4,5의조합으로 인해 병리학에 기여할 수 있다. 한편, 마이크로글리아가 부적절한 식세포증이 가능한 뉴런 또는 시냅스6,7,8을할 수 있다는 신경퇴행성 질환의 동물 모델도 있다. 이 메커니즘은 마이크로글리아질 식세포 수용체 TREM2 또는 GPR56에 의해 직접적으로 감지되거나 간접적으로 용해 성 체형 C1q 코팅C1q코팅에 의해 감지되는 손상된 뉴라이트의 인산화제린 디스플레이에 의해 선동될 가능성이 높으며, 이는 CR3-phagois1, CR3-phagois1, 90-phagoistoted10에이르는 코피타이들벨세린 농축 멤브레인을 코팅하는 용해성 상류체에 의해 간접적으로 감지된다.
식세포 기능의 시험관 내 소사, 예를 들어, 마이크로글리아에서 유전 적 위험 변이체의 현상적 영향을 평가하기 위해, 라텍스 구슬4와같은 비생리적 화물을 사용하여 자주 수행된다. 형광으로 표지된 박테리아와 zymosan은 생리적이지만 신경 퇴행성 질환과 관련이 없는 사용됩니다. 비생리적 생리성 화물은 식세포 침몰의 기본 기계에서 결함을 감지하는 데 사용할 수 있지만 세포 신경의 phagocytosis에서 첫 번째 "인식"단계를 정확하게 모델링하지 못합니다. 화물의 크기, 모양, 강성 및 유형은 또한 활성화된 세포내 신호 경로를 지시하여 microglia 활성화 상태의 다른 결과를 초래합니다. 예를 들어, 대장균 균은 인간 세포와 달리 작고 뻣뻣하며, 표면에 있는 리포폴리사카라이드는 식세포증 및 프로 염증 신호 경로를 활성화하는 톨-유사 수용체 4(TLR4)에 의해 인식된다2,12.
신경 퇴행성 질환 연구의 맥락에서, 더 관련 phagocytic 화물 포유류 플라즈마 막에 인산화 체린 디스플레이 있을 것 이다, 이상적으로 인간과 신경 것, microglia 발생할 가능성이 신호를 포함. 이러한 식세포프로토콜의 경우, 인간 신경모세포종 세포주 SH-SY5Y는 배양하기 쉬운 뉴런 모델로 선택되었다. 영구 표면 인산화제린 디스플레이는 파라포름알데히드에 의해 인위적으로 유도되었으며, 이는 이전에 혈소판13의포스파디들세린 디스플레이를 유발하는 것으로 나타났다. microglia 세포 모델 인간 iPSC-대식세포가 사용되어 인간 마이크로글리아의 온토게니 및 전사 프로파일을 모방하고, phagocytically유능한 14,15,16,17. iPSC-대식세포는 가장 정통 적인 microglia 모델 사용, 예를 들어, 그들은 마이크로 글리아 형태를 모방 하지 않습니다;; 그러나, 원할 경우 microglia의 보다 정통 단일문화 iPSC 모델로 대체할 수있다. 인간 iPSC 모델은 인간 대 마우스 신경퇴행성 질환 조직조직(18)에서관찰된 마이크로글리아 전사 모듈의 제한된 중첩에 대한 우려로 인해 신경 변성을 연구하기 위한 1차 설치류 마이크로글리아보다 바람직하다. 죽은 SH-SY5Ys는 중성 pH에서 약하게 형광하고 phagocytosis 후 iPSC 대식세포의 phagolysosomes 안쪽에 더 강하게 형광하는 산에 민감한 염료로 얼룩져 있습니다. 산에 민감한 염료를 사용하면 식세포 이벤트를 감지하는 정확도를 향상시키고, 라이브 및 고정 대식세포19의다양한 판독을 위한 다기능성을 향상시킵니다. 이 프로토콜은 식세포증의 라이브 셀 타임랩스 이미징과 식세포증에 대한 고정 된 고함량 이미징 분석, 판독 전에 동일한 세포 준비 단계를 모두 간략하게 설명합니다(그림 1).
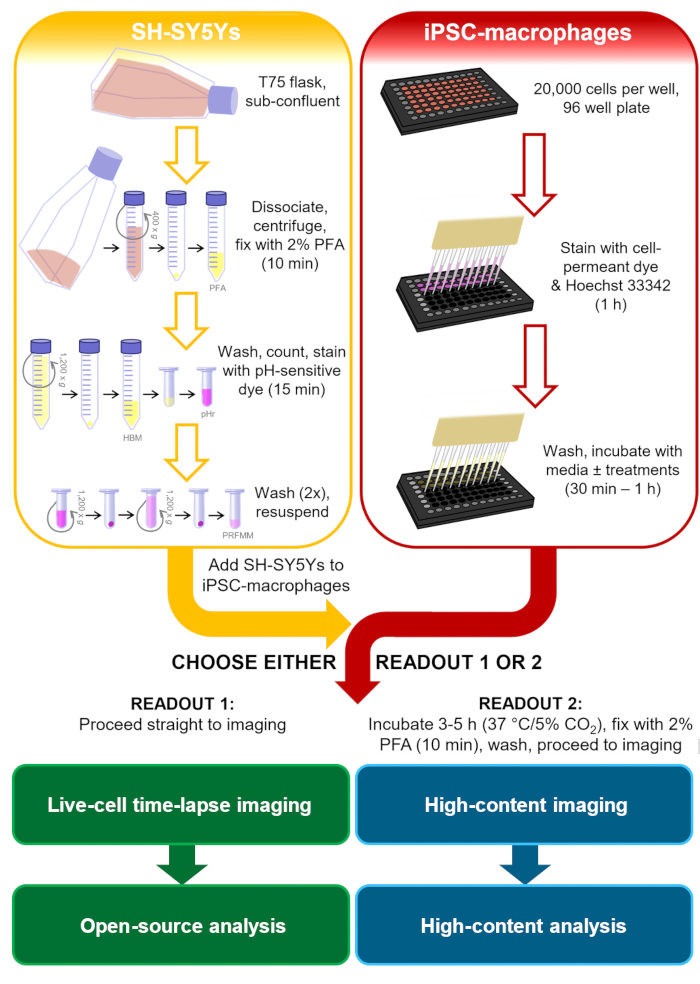
그림 1: 방법론의 회로도. cagocytosis 분석의 개요, 여기서 SH-SY5Ys의 준비 및 iPSC-대식세포의 염색은 병렬로 수행되고, 다음 SH-SY5Ys는 iPSC-대식세포에 배관된다. 살아있는 세포 시간 경과 화상 진찰은 즉시 능력을 발휘하거나, 세포는 필요한 기간 동안 37°C/5% CO2에서 배양되고 고함량 현미경 검사를 수행하기 전에 고정된다. PFA: 파라포멀데히드, HBM: 페놀 레드 프리 HEPES 버퍼링 미디어, pHr: pH-민감한 적색 형광염염수 STP 에스테르 솔루션, PRFMM: 페놀 레드 프리 대식세포 미디어. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
프로토콜
이 프로토콜은 옥스포드 대학, 옥스포드 파킨슨 병 센터 (윤리위원회 : 국립 보건 서비스, 건강 연구 당국, NRES 위원회 사우스 센트럴, 버크셔, 영국 (REC 10/H0505/71)에서 파생 된 인간 iPS 세포주를 사용하기위한 지침을 따릅니다. 인간 iPSC는 가능한 모험 에이전트로부터 근로자를 보호하기 위해 클래스 II 안전 캐비닛 내에서 처리되어야한다. 지역, 국가 및 EU 의 보건 및 안전 규정을 준수해야 합니다. 세포 배양 배지 조성물은 표 1에상세하며, 모든 재료는 재료의 보충 표에 기재되어 있다.
1. 실험 전에 세포 배양
- iPSC 배지내의 배양 iPSC(표1)는hESC 자격을 갖춘 지하 멤브레인 매트릭스, 서브 컨컬러 및 낮은 통로 번호로 미리 코팅된 6웰 플레이트에서.
- 인간 iPSC-대식세포 전구체에 인간 iPSC를 분화: 배아 체질의 2mL를 가진 마이크로웰 저준수 24웰 플레이트에 400만 iPSC를 종자400만 iPSC를배아 체세포 형성을 장려하고 5-6일 동안 매일 75% 미디어 변경을 수행한다. 배아 체를 T175 플라스크로 이송하여 플라스크당 약 150개의 배아 체로, 20mL의 공장용지(표 1)를함유하고 있다. 공장 미디어의 10-20 mL의 추가로 매주 피드.
참고: iPSC-대식세포 전구체는 약 2-3주 후에 상체로 나타나고 몇 달 동안 지속적으로 생산됩니다. 이러한 실험을 위해, 분화 공장이 설정된 후 약 6주로부터 세포를 사용하는 것이 바람직하다. 이전에 수확된 iPSC-대식세포는 일부 증식 능력을 유지할 수 있으며 덜 부착되어 낮은 세포 밀도에서 파종조차 방지합니다. phagocytosis 기능에 대 한 상한은 결정 되지 않았습니다. - iPSC-대식세포 전구체를 iPSC-대식세포로 분화: 수퍼나티의 필요한 부피를 제거하여 전구체를 수확; 덩어리를 제거하기 위해 40 μm 세포 여과기를 통과; 원심분리기에서 400 x g에서 5분 동안 펠릿 세포및 대식세포 에서 재중단(표1). 종자 iPSC-대식세포는 96웰 조직 배양(TC)에서 잘 처리된 96웰 조직 배양(TC)에서 잘 초당 20,000-30,000개의 세포에서, 잘 당 100 μL의 대식세포 배지에서 검정 우물 벽과 광학적으로 맑은 바닥을 가진 마이크로 플레이트. 가장자리 우물을 피하고 PBS로 이것들을 채웁니다. 이것은 분석에 증발의 효력을 감소시키기 위하여 중요합니다. 37°C/5% CO2에서인큐베이션으로 6-10일 동안 분화한다.
참고: 이 분석의 경우 iPSC 라인 BIONi010-C(ECACC ID: 66540023)가 사용되었습니다. 그러나 다른 iPSC 라인을 대체할 수 있습니다. - SH-SY5Y를 3-4일마다 20mL의 SH-SY5Y미디어(표 1)로T75 플라스크의 하위 연결에 유지합니다.
| 이름 | 베이스 미디어 | 첨가제, 최종 농도 |
| iPSC 미디어 | mTeSR1 | - |
| 배아 바디 미디어 | mTeSR1 | BMP4, 50 ng/mL |
| VEGF, 50 ng/mL | ||
| SCF, 20 ng/mL | ||
| 공장 미디어 | XVIVO15 | 글루타맥스, 2mM |
| 페니실린, 100대/mL | ||
| 연쇄상 구균, 100 μg/mL | ||
| 2-메르카포에탄올, 50 μM | ||
| IL-3, 25 ng/mL | ||
| M-CSF, 100 ng/mL | ||
| 대식세포 미디어 | XVIVO15 | 글루타맥스, 2mM |
| 페니실린, 100대/mL | ||
| 연쇄상 구균, 100 μg/mL | ||
| M-CSF, 100 ng/mL | ||
| SH-SY5Y 미디어 | DMEM/F12 | 태아 소 혈청, 10% |
| 페니실린, 100대/mL | ||
| 연쇄상 구균, 100 μg/mL |
표 1: 미디어 레시피.
프로토콜에 사용되는 세포 배양 매체의 성분. 미디어 구성 요소에 대한 자세한 내용은 재료 표에서찾을 수 있습니다.
2. 죽은 SH-SY5Y의 준비
- 클래스 II 생물학적 안전 캐비닛에서, 해리 SH-SY5Ys, 재조합 트립신 과 같은 효소와 1.1 mM EDTA를 포함하는 세포 해리 버퍼의4 mL을 첨가하여 즉시 제거되어야하며 1mL 미만이 박막 코팅으로 유지되도록 즉시 제거되어야합니다. 37 °C / 5 % CO2에서2 -3 분 동안 배양하십시오.
- T75 플라스크에 10mL의 HBSS를 넣고 SH-SY5Y를 15mL 원심분리기 튜브에 파이펫을 넣습니다. 원심 분리기 400 x g에서 5 분 동안. 수퍼내티퍼를 흡인하고 페놀 무적HEPES 버퍼링 된 미디어의 2 mL에서 세포를 다시 일시 중단합니다 (재료 표참조). 펠릿을 조심스럽게 재연하여 100-1,000 μL 파이펫으로 파이펫을 사용하여 고정하기 전에 덩어리를 분해하십시오.
- 관에 4% 파라포름알데히드(최종 농도 2%)의 2mL를 추가하여 세포를 수정한다. 실내 온도에서 10분 동안 배양하고 가끔 씩씩한 튜브를 교반합니다.
- 튜브에 10mL의 HBSS를 추가합니다. 원심분리기는 1,200 x g에서 7분 동안 다시 중단하고 페놀 레드 프리 HEPES 버퍼링 미디어의 2mL에서 다시 중단합니다.
참고: 2.4단계 후, 고정 SH-SY5Y 제제는 유동 세포측정 판독을 통해 세포 투과성을 측정하기 위해 접근 가능한 인산염 및 프로피듐 요오드를 보여주기 위해 인속서 V-FITC로 염색하여 품질 조절될 수 있다. 고정된 제제를 2.2단계에서 얻은 SH-SY5Y와 비교합니다. 섹션 7 및 보충 그림 S1을참조하십시오. 2.4단계 이후에 고정 된 SH-SY5Y의 저장은 평가되지 않았기 때문에 권장되지 않습니다.
3. pH 에 민감한 적색 형광 염료로 죽은 SH-SY5Y의 라벨링
- 단계 2.4 후, 세포를 계산하고, 2mL 저단백질 결합 튜브에 필요한 총 세포 수를 제거한다. 각 100만 SH-SY5Y에 대해 페놀 레드 프리 HEPES 버퍼링 된 미디어로 2 mL 튜브에서 300-500 μL까지 총 부피를 구성합니다. 37°C 의 수조에서 튜브를 잠시 데우십시오.
- pH 에민감한 적색 형광염을 재구성하고(재료표참조) 12.5 μg당 12.5 μg의 염료를 세포의 따뜻한 2mL 튜브에 첨가한다. 파이펫팅으로 부드럽게 섞으세요. 실내 온도에서 30분 동안 튜브를 배양하여 빛으로부터 보호합니다.
참고: pH 에민감한 염료의 STP 에스테르 종은 1차 아민과 반응하므로 라벨링 버퍼에는 무료 아민이 포함되어서는 안 됩니다. 수성 완충제의 잠재적으로 제한된 용해도로 인해 DMSO 용해 염료를 추가하여 수성 버퍼를 따뜻하게 하고 즉시 혼합하고 침전물 징후 (가벼운 현미경 아래 어두운 입자)를 검사하십시오. - 4°C에서 7분 동안 1200 x g에서 HBSS 및 원심분리기 1mL를 추가합니다. 상체를 버리고 2mL HBSS로 씻으십시오. 원심분리를 반복합니다.
- 상체를 버리고 페놀 무적대식세포 매체(재료표참조)에서 세포를 다시 일시 중단하여 200,000-120만 개의 세포/mL 농도로 50 μL이 10,000-60,000세포(즉, 0.5x-3배 더 SH-SY5Y)입니다.
참고: 미디어에서 페놀 레드는 배경 형광을 증가시키고 따라서 살아있는 세포 이미징이 수행될 경우 페놀 무적미디어가 사용되어야 합니다. 스테인드 SH-SY5Y를 몇 시간 이상 보관하는 것은 평가되지 않았기 때문에 권장되지 않습니다. 스테인드 SH-SY5Y를 얼음에 보관하고 빛으로부터 보호하십시오.
4. iPSC 대식세포 염색
- 생물학적 안전 캐비닛에서 깊은 적색 형광, 세포 왜곡, succinimidyl 에스테르 반응성 염료의 대식세포 매체에서 용액을 준비하십시오 (재료표참조). Hoechst 33342를 추가합니다(재료 표참조). 작업 용액을 수조에서 37°C로 데우도록 데우습니다.
- 다중 채널 파이펫으로 셀 수퍼나티를 멸균 저장소로 파이프하여 iPSC 대식세포 배지를 부드럽게 흡인시합니다. 멀티채널 파이펫을 사용하여 4.1 단계에서 제조된 염료 용액70 μL/웰을 iPSC-대식세포에 추가합니다. 37 °C / 5 % CO2에서1 h에 대한 인큐베이션.
- 페놀 무적대식 세포파지 미디어에서 실험적 치료를 준비합니다. 10 μM 사이토샬라신 D를 음의 대조군 치료로 포함하십시오. 인큐베이션 후 는 iPSC-대식세포 배지를 멀티채널 파이펫으로 매우 부드럽게 흡인하고 행크의 완충식식용(HBSS)의 100 μL/웰을 추가하여 세척합니다. 부드러운 파이펫팅으로 HBSS를 즉시 제거한 다음 100 μL의 미디어 ± 화합물을 추가합니다. 37 °C / 5 % CO2에서10 분 - 1 h에 대한 인큐베이션.
참고 : Cytochalasin D는 강력한 액틴 억제제이며 phagocytosis를 차단합니다. 더 긴 배큐베이션이 필요한 실험적 치료의 경우, 예를 들어, 24-72h, 전체 대식세포 기질에서 100 μL/웰의 치료를 사용하여 4.1 단계 전에 실험적 치료를 수행한다. 세포 염색이 수행되고 그 후 치료가 phagocytosis 분석의 나머지 부분에 대한 페놀 무적대식 파지 매체에 재적용되도록 프로토콜에 따라 4.1-4.3 단계를 수행합니다.
5. 이미징 식세포증
다음은 두 가지 다른 phagocytosis 판독 방법, 하위 섹션을 선택 5.1 또는 5.2.
- 라이브 셀 타임랩스 이미징
- phagocytosis 에 앞서, 살아있는 세포 시간 경과 화상 진찰 현미경을 켜십시오 (재료의 표참조), 컴퓨터, 환경 챔버 및 CO2 가스. 이미지 캡처 소프트웨어를 엽니다. DAPI, RFP 및 CY5 라이트 큐브가 현미경에 설치되어 있는지 확인합니다. 시간 경과 | 클릭 인큐베이트 | 환경 챔버를 활성화하고 CO2 가스로 37 °C로 온난화를 선택하여 습도가 선택 해제되도록하십시오. 현미경이 37 °C로 따뜻하도록 30 분 허용하십시오.
- 4.3 단계에서 화합물 인큐베이션 중에 iPSC-대식세포 판을 현미경으로 적재한다.
- 이미지 | 클릭 캡처 | 선박 전문가. 웰 플레이트를 선택하고 96웰 플레이트 유형을 선택합니다.
- 이미지 탭에서 위상 채널을 켜고 세로 슬라이더를 사용하여 거칠고 미세한 초점을 조정하여 셀이 초점을 맞춥니다. 수평 슬라이더로 조명 레벨을 조정합니다. DAPI, RFP 및 CY5 채널을 클릭하고 각 채널의 조명 수준을 조정합니다.
- 시스템 탭에서 보정 용기 정렬을 클릭하고 화면 지침을 따릅니다.
- 시간 경과 | 클릭 루틴 | 새 루틴 을 만듭니다. 타임랩스 마법사의첫 번째 화면에서 루틴의 이름을 지정합니다. 다음을클릭합니다. 두 번째 화면에서 는 20배 목표를 선택하고 흑백 캡처를 선택하고 DAPI, RFP, CY5 및 위상 채널을 선택합니다. 다음 옵션을 선택하지 마십시오: 자동 찾기 샘플, 자동 미세 포커스, Z-스택, 자동 조명. 다음을클릭합니다.
- 다음 화면에서 각 우물의 중앙에 비콘을 설치하여 현미경이 매 시간 지점에 대해 동일한 조명 설정과 동일한 좌표로 돌아갈 수 있습니다. 각 비콘의 초점 및 조명 설정은 독립적입니다. 비콘을 설정하려면 파란색 원을 플레이트 맵의 위치로 드래그하고, 거칠고 미세한 초점 수직 슬라이더를 사용하고, 만족하면 비콘 추가클릭을 클릭합니다. 비콘 설정은 나중에 선택한 업데이트 버튼을 사용하여 업데이트할 수 있습니다.
- 식세포 분석기를 시작할 준비가 되면 분석 판을 제거하고 생물학적 안전 캐비닛에 놓습니다. 멀티채널 파이펫을 사용하여 우물당 SH-SY5Y 50 μL을 추가하여 액체 의 가장자리에 있는 각 우물의 측면에 추가합니다.
- 플레이트를 현미경에 적재하고 열 이동이 평형화될 때까지 약 30분 정도 기다립니다.
참고: 플레이트가 현미경에 있는 처음 30분 동안, 분석 판의 온도가 변경되면 초점이 바뀌게 됩니다. 플레이트가 평형화되지 않으면 캡처된 이미지가 시간 경과 중에 초점이 바뀝니다. - 각 비콘을 클릭하고 포커스 설정을 업데이트합니다. 다음을클릭합니다. 타임랩스 마법사의다음 화면에서 파일 형식 TIFF를선택하고 개별 채널을 저장하고각 비콘에 대한 비디오를 만드는옵션을 활성화하고 아래 옵션을 워터마크로 포함하도록 허용합니다. 다음을클릭합니다.
- 장면 수를 1로 설정합니다. 다음을클릭합니다. 시간 경과의 지속 시간 및 간격을 설정합니다(예: 3h 및 이미징 은 5분마다) 하나의 프레임만 캡처를선택하지 마십시오. 다음을클릭합니다.
- 37°C 및 CO2의 온도로 환경 챔버를 활성화하십시오(습도는 짧은 실험을 위한 선택 사항입니다). 다음 을 두 번 클릭합니다. 데이터를 저장하는 경로를 선택합니다. 다음을클릭합니다. 시작 을 클릭하여 시간 경과를 시작합니다.
- 고정 셀 고함량 이미징
- 멀티채널 파이펫을 사용하여 라벨이 부착된 SH-SY5Y의 50μL을 잘 추가하여 액체 의 가장자리에 있는 각 우물의 측면에 추가합니다. 3-5 h에 대한 37 °C / 5 % CO2에서 배양.
- 식세포증 이큐베이션 후, 멀티채널 파이펫으로 파이펫을 사용하여 셀 수퍼나티를 부드럽게 흡인하고 폐기하십시오. 100 μL PBS로 한 번 씻으시면 됩니다.
- 2% 파라포름알데히드의 100 μL을 추가하여 플레이트를 고정하고 실온에서 15분 동안 배양합니다.
- 우물을 흡입하고 PBS의 100 μL을 추가합니다. 플레이트 실러와 호일로 덮으십시오. 필요할 때까지 4°C에 보관하십시오.
참고: 분석 플레이트는 상당한 신호 저하 없이 적어도 일주일 동안 이처럼 저장할 수 있습니다. 스토리지가 테스트되지 않았습니다. - 고콘텐츠 이미징 현미경(재료 표 참조)을켜고 이미지 캡처 소프트웨어를 엽니다. 화면 상단의 로드 아이콘을 클릭하여 분석 플레이트를 현미경에 로드합니다.
- 설정 탭을 선택합니다. 왼쪽 상단 상자의 드롭다운 메뉴: 적절한 플레이트 유형을 선택하고 자동 초점 옵션 인 Two Peak(기본값)를선택하고 목표 40x 물, NA1.1을선택하고 공초점 모드를 선택하고 1의비닝을 선택합니다.
- 설정 메뉴를 통해 사용하기 전에 40배의 물 목표를 플러시하십시오.
- 채널 선택 상자에서 + 아이콘을 사용하여 채널 DAPI, Alexa 647 및 Alexa 568을 추가합니다. 1 μm의 단일 평면에서 측정하도록 설정합니다. 분석 플레이트의 염색 효율을 위해 시간 및 전력 설정을 최적화합니다.
참고: 지침으로 DAPI를 200ms 노출 및 100% 전력으로 설정하고, Alexa 647은 1500ms 노출 및 100% 전력, 100ms 노출 및 40%의 전력으로 Alexa 568을 설정합니다. - 채널을 분리하기 위해 채널 시퀀스를 클릭하여 채널을 동시에 측정하지 않도록 합니다.
- 탐색 | 레이아웃 을 정의측정의우물을 선택하고 잘 당 9-12 필드를 선택합니다.
- 설정 하는 동안, 플레이트 지도에 대표 필드를 클릭 하 고 차례로 각 측정 채널을 확인, 얼룩이 존재 하 고 이미지 집중 되어 있는지 확인, 채널 오프셋을 조정 하 여.
- 원격 분석을 위해 서버에 데이터를 업로드하려면 온라인 작업 상자와 관련 화면 이름을 클릭합니다. 이렇게 하면 이미징 후 서버에 데이터를 자동으로 업로드할 수 있습니다.
- 저장 버튼을 클릭하여 분석 프로토콜을 저장합니다.
- 상단의 실험 실행 탭을 클릭하고 실험 판의 이름을 지정한 다음 시작을 클릭합니다.
6. 데이터 분석
다음은 두 가지 다른 데이터 분석 방법, 하위 섹션 5.1을 따르는 경우 하위 섹션 6.1을 선택하거나 하위 섹션 5.2를 따르는 경우 하위 섹션 6.2를 선택합니다.
- 살아있는 세포 시간 경과 현미경에 의해 얻어진 phagocytosis 심상 분석
- 권장되는 오픈 소스 소프트웨어를 다운로드하여 설치합니다(재료 표참조). 소프트웨어를 엽니다.
- 입력 모듈 상자에서 이미지를선택합니다.
- Windows 탐색기에서비콘-1, 비콘-2 등이라는 하위 폴더가 포함된 데이터 폴더를 엽니다. 모든 비콘 폴더를 선택하고 파일 목록 상자에 드래그합니다.
- 입력 모듈 상자에서 메타데이터를 선택합니다. 메타데이터 추출의경우 예를 선택합니다. 메타데이터 추출 방법옆에 있는 드롭다운 메뉴에서 파일/폴더 이름에서 추출을 선택합니다. 메타데이터 원본의경우 폴더 이름을 선택합니다. 일반 식 오른쪽에 있는 돋보기를 클릭하고입력합니다. P.*)" Regex 텍스트 상자에 넣습니다(견적 표시 제외). 제출을클릭합니다. 에서 메타 데이터 추출의경우 모든 이미지를 선택합니다. 화면 하단의 업데이트를 클릭합니다. 이제 이미지가 비콘으로 그룹화됩니다.
- 입력 모듈 상자에서 NameAndType을 선택합니다. 다음 프로세스를 통해 각 시간지점에 대한 이미지를 올바른 형광 채널에 할당할 수 있습니다. 이미지 일치 규칙(드롭다운 메뉴)에 이름을 할당합니다. 규칙 기준을 다음 규칙의 모든(드롭다운 메뉴)와 일치합니다. 파일(드롭다운 메뉴), 드롭다운 메뉴(드롭다운 메뉴), 포함(드롭다운 메뉴), DAPI(텍스트 상자). 이러한 이미지 DAPI(텍스트 상자)에 할당할 이름입니다. 이미지 유형 그레이스케일 Image(드롭다운 메뉴)를 선택합니다. 이미지 메타데이터(드롭다운 메뉴)에서 강도 범위를 설정합니다.
- 화면 하단에서 다른 이미지 추가를클릭하고 6.1.5 단계를 반복합니다. RFP 이미지를 그룹화할 수 있도록 DAPI를 RFP로바꿉다.
- CY5 채널 이미지에 대해 6.1.6 단계를 반복합니다.
- 화면 하단의 업데이트를 클릭하면 이미지 파일이 DAPI, RFP 및 CY5라는 세 개의 열에 나열됩니다.
- 입력 모듈 상자에서 그룹을 선택합니다. 이미지를 그룹화하시겠습니까? 메타데이터 카테고리의드롭다운 메뉴에서 비콘을선택합니다.
- 분석 모듈 상자에서 공백을 마우스 오른쪽 단추로 클릭하여 모든 모듈 목록을 호출합니다.
- | 추가를 클릭합니다. 이미지 처리 | 강화기능 억제 기능. 첫 번째 드롭다운 상자에서 DAPI를 입력 이미지로 선택합니다. 출력 이미지를 "DAPIspeckles"로 지정합니다. 기능 크기가 20픽셀인 기능 유형 인 Enhance 및 피처 유형 스펙클을선택합니다. 속도 및 정확도 옵션 빠른 / 육각형을 선택합니다.
- 새 모듈을 만듭니다. | 추가 개체 처리 | 기본 개체 식별. 첫 번째 드롭다운 상자에서 입력 이미지로 DAPIspeckles를 선택합니다. 기본 개체 "핵"의 이름을 지정합니다. 개체의 일반적인 직경을 10~ 35픽셀 단위로 입력합니다. 이 매개 변수를 최적화할 수 있습니다. 임계 전략 글로벌을선택, 임계 값 방법 RidlerCalvard,스무딩 방법 자동,낮은 및 상한 0-1로 임계 값 보정 계수를 제공합니다. 메서드를 변경하여 뭉크된 객체를 모양으로 구별하지만 기본 설정에 다른 매개 변수를 남깁니다.
참고: iPSC-대식세포 핵은 직경을 감소시키고 핵의 대비를 증가시키는 이미지 처리 단계에 따라 6.1.12 단계로 대략 세분화되었습니다. SH-SY5Y가 희미한 핵으로 나타나고 그렇지 않으면 iPSC-대식세포로 착각되기 때문에 가장 밝은 핵만 선택되는 것이 중요합니다. 선택된 핵의 비율을 조정하려면 임계값 보정 계수를 증가또는 감소시합니다. 시험 단계 동안, 결과 핵 선택을 비콘의 위상 이미지와 비교하여 세포 형태를 사용하여 iPSC-대식세포와 SH-SY5Y를 쉽게 구별할 수 있다. - 새 모듈을 만듭니다. | 추가 이미지 처리 | 교정일루미네이션계산. 첫 번째 드롭다운 상자에서 CY5를 입력 이미지로 선택합니다. 출력 이미지의 이름을 "IllumCY5"라고 지정합니다. 조명 방법 선택,드롭다운 메뉴에서 배경을 선택합니다. 다른 매개 변수를 기본 설정에 둡니다.
- 새 모듈을 만듭니다. | 추가를 클릭합니다. 이미지 처리 | 수정일루미네이션 적용. 첫 번째 드롭다운 상자에서 CY5를 입력 이미지로 선택합니다. 출력 이미지 "CorrCY5"의 이름을 지정합니다. 일루미네이션을 선택보려면드롭다운 메뉴에서 IllumCY5를 선택합니다. 조명 을 선택,드롭 다운 메뉴에서 나누기 선택.
참고: 단계 6.13-6.1.14의 목적은 CY5 이미지의 배경 조명의 변화를 수정하는 것이며, 이는 그렇지 않으면 올바른 셀 세분화를 방해합니다. - 새 모듈을 만듭니다. | 추가를 클릭합니다. 개체 처리 | 보조 객체식별. 첫 번째 드롭다운 상자에서 CorrCY5를 입력 이미지로 선택합니다. 입력 개체로 핵을 선택합니다. 보조 개체의 이름을 "Mac"입니다. 거리 - B로식별 방법을 선택합니다. 임계값 전략 글로벌,임계값 설정 방법 RidlerCalvard, 스무딩 방법 없음 스무딩,그리고 하부 및 상한0-1을 가진 1으로 임계 값 보정 계수를 제공합니다. 다른 매개 변수를 기본 설정에 둡니다.
참고: 이 세포 세분화 단계는 세포 경계를 성장하거나 축소하기 위해 임계값 보정 계수를 조정하여 최적화가 필요할 수 있습니다. 분할 효율은 또한 이미징 중에 iPSC-대식세포 염색의 강도, 또는 CY5 라이트 큐브의 조명을 증가시킴으로써 향상될 수 있다. - 새 모듈을 만듭니다. | 추가를 클릭합니다. 이미지 처리 | 강화기능 억제 기능. 첫 번째 드롭다운 상자에서 RFP를 입력 이미지로 선택합니다. 출력 이미지를 "필터링된RFP"로 지정합니다. 기능 크기가 15픽셀인 기능 유형 인 Enhance 및 피처 유형 스펙클을선택합니다. 피처 크기를 최적화할 수 있습니다. 속도 및 정확도 옵션 빠른 / 육각형을 선택합니다.
- 새 모듈을 만듭니다. | 추가를 클릭합니다. 개체 처리 | 기본 개체 식별. 첫 번째 드롭다운 상자에서 입력 이미지로 필터링된RFP를 선택합니다. 기본 개체 "pHr"의 이름을 지정합니다. 개체의 일반적인 직경을 5-20 픽셀 단위로 입력합니다. 임계값 전략 설명서를선택하고 임계값(예: 0.005)을 수동으로 입력합니다. 메서드를 변경하여 뭉크된 객체를 모양으로 구별하지만 다른 매개 변수를 기본 설정에 둡니다.
참고: SH-SY5Y는 직경을 줄이고 말장난의 대비를 증가시키는 이미지 처리 단계에 따라 6.1.17 단계로 분할되었습니다. pH 에 민감한 염료의 강도는 시간이 지남에 따라 phagocytosed 입자에서 증가하기 때문에 수동 임계값을 수행하는 것이 중요하며, 다른 임계 값 전략은 초기 시점에서 pH 에 민감한 염료 말크타 수를 인위적으로 팽창시킬 것입니다. 수동 임계값은 테스트 모드를 사용하여 각 후속 실험 반복에 대해 조정되어야 합니다. - 새 모듈을 만듭니다. | 추가를 클릭합니다. 개체 처리 | 관련 개체. 드롭다운 메뉴에서 입력 자식 개체 pHr을 선택합니다. 드롭다운 메뉴에서 입력 된 상위 개체 Mac을 선택합니다. 모든 자식 측정에 대해 부모당 평균을 계산하기 위해 예를선택합니다. 자식-부모거리(없음)를계산하지 마십시오.
참고: 단계 6.1.18은 pH 민감염 염료 신호를 iPSC-대식세포에 관련시켜 iPSC-대식세포당 평균 식세포 개체 수를 측정할 수 있도록 합니다. - 새 모듈을 만듭니다. | 추가를 클릭합니다. 파일 처리 | 내보내기To스프레드시트. 열 구분 기호를 탭으로 선택하고 파일 이름에 접두사를 추가하여 비콘 번호를 나타냅니다. 아래 와 같이 수출에 대한 특정 측정을 선택하십시오(6.1.19.1 - 6.1.19.4 단계); 기본 설정에 다른 매개 변수를 남깁니다.
- 이미지 | | 카운트 pHr 및 Mac 선택
- 이미지 | 파일
- 이미지 | 그룹
- 맥 | 어린이 | pHr
- 출력 상자에서 출력 설정 보기를클릭합니다. 이 실험에 대한 바탕 화면에 새 폴더를 만들고 이를 기본 출력 폴더로 설정합니다.
- 파이프라인 파일 | 저장 세이브 프로젝트로 ....
- 왼쪽 하단 모서리에 있는 시작 테스트 모드를 클릭하여 대표 이미지에서 파이프라인을 테스트하고 최적화합니다. 프로그램은 테스트를 위해 첫 번째 이미지를 자동으로 선택하고 파이프 라인의 각 단계를 눈으로 기호를 클릭하여 볼 수 있으며, 이는 출력을 표시한 다음 실행을 클릭합니다. 테스트에 사용되는 비콘을 변경하려면 테스트 | 상단 메뉴 표시줄에서 클릭합니다. 이미지 그룹을 선택합니다. 비콘 내에서 이미지(시간 표시점)를 변경하려면 상단 메뉴 막대에서 테스트 | 클릭합니다. 이미지 집합을 선택합니다. 최적화해야 하는 매개 변수는 이전 단계에 명시되어 있습니다.
- 파이프라인에 만족하면 종료 테스트 모드를 클릭하고 열린 눈 기호를 클릭하여 닫습니다. 파이프라인을 저장합니다. 이미지 분석을 클릭하여 전체 이미지 분석을 시작합니다.
- 생성된 텍스트 파일은 적절한 스프레드시트 소프트웨어가 있는 스프레드시트로 열 수 있으며"이미지"라고 표시된 파일에는 매개 변수를 나타내는 열과 함께 각 이미지 타임포인트에 대한 행이 포함됩니다.
참고: Count_Mac 및 Count_pHr iPSC 대식세포 수와 이미지에서 식별된 pH 감지 개체수를 나타냅니다. 수에 phagocytosed되지 않은 희미한 형광 SH-SY5Y를 포함하기 때문에 Count_pHr 데이터를 사용하지 마십시오. Mean_Mac_Children_pHr_Count 컬럼은 개별 이미지, 즉 비콘의 개별 타임포인트에 대해 Mac당 평균 phagocytosed pHr 개체 수(6.1.18 관련 개체 단계)를 사용합니다. - 각 비콘이 스프레드시트의 별도의 열이되도록 데이터를 정렬하고, 이미지는 스프레드시트 워크북의 다른 시트를 차지하는 서로 다른 매개 변수와 함께 연대순으로 정렬됩니다.
- Mean_Mac_Children_pHr_Count 측정값을 Count_Mac 곱하여 이미지당 반점 수의 매개 변수를 생성합니다. 각 비콘에 대한 평균 Count_Mac 계산합니다. 이미지당 반점 수를 해당 비콘의 평균 Count_Mac 나누어 셀당 반점 수의 매개 변수 수를 생성합니다.
참고: 6.1.26 단계는 비콘의 모든 시간점에 걸쳐 평균 iPSC-대식세포 수로 데이터를 정상화하여 iPSC-대식세포 수(Count_Mac)에서 발생할 수 있는 잘못된 변동을 수정합니다. - phagocytosis시작 이후 시간을 할당 (분) 각 이미지 행에.
- 복제 우물/비콘에 대한 수단과 표준 편차를 생성합니다. 시간(x축)에 대해 셀당 반점 수(y축)를 그래프로 지정하여 식세포증의 속도를 시각화합니다.
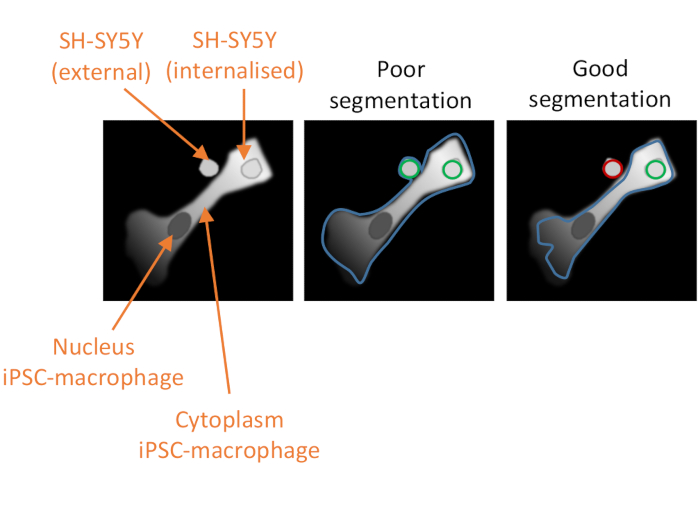
그림 2: 고함량 식세포 분석에서 세포 세분화. 두 번째 SH-SY5Y가 완전히 phagocytosed와 비 phagocytosed SH-SY5Y에 근접한 iPSC-대식세포의 양호한 분할을 보여주는 그림. 두 세포 유형이 모두 회색으로 표시되면 컴퓨터 분석에 의해 묘사된 iPSC-대식세포 세포 경계가 설명되어 있습니다(파란색). phagocytosis 이벤트로 계산되는 SH-SY5Ys는 분석에서 제외된 경우 녹색 또는 빨간색으로 윤곽이 표시됩니다. 가운데 의 이미지는 세분화가 좋지 않습니다. iPSC-대식세포는 세포 테두리 내에서 비-phagocytosed SH-SY5Y를 포함하는 최적 이하의 계측체를 가지며, 이는 식세포증 이벤트로 계산됩니다. 오른쪽 이미지는 iPSC-대식세포 테두리를 정의하는 보다 엄격한 파라미터로 인해 양호한 세분화를 나타내며, 이로 인해 비-식세포가 없는 SH-SY5Y가 분석에서 올바르게 배제되었다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
- 고함량 현미경으로 얻은 phagocytosis 이미지의 분석
- 권장 이미지 처리 소프트웨어에 로그인합니다(재료 표참조).
- 화면 이름 폴더를 선택하고 이미징은 왼쪽 메뉴에서 하위 폴더를 실행합니다. 이미지 분석 아이콘(돋보기가 있는 화면)을 클릭합니다. 분석 파이프라인을 설정하기 위해 플레이트 레이아웃에서 대표를 잘 선택합니다.
- 첫 번째 분석 빌딩 블록은 입력 이미지입니다. 스택처리(개별 평면)및 플랫필드 보정(없음)에 대한 기본 설정을 둡니다. 블록 의 오른쪽 상단 모서리에있는 + 기호를 클릭하여 다음 구성 블록을 추가하고 핵 찾기를 선택합니다.
- 핵 찾기에서, DAPI로채널을 설정, ROI 인구 없음으로, C로세분화하는 방법 . 메서드 상자에는 공통 임계값(예: 0.40) 및 영역(예: >30 μm2)에대한 설정과 함께 매개 변수를 최적화할 수 있는 드롭다운 메뉴가 포함되어 있습니다. 출력 채우기 "핵"의 이름을 지정합니다. + 기호를 클릭하여 다음 빌딩 블록을 추가하고 세포질 찾기를 선택합니다.
- 세포질 찾기에서채널은 Alexa 647로 설정하고 메서드를 B로 설정합니다. 메서드 상자에는 공통 임계값(즉, 0.45)과 개별 임계값(즉, 0.20)에 대한 설정과 함께 매개 변수를 최적화할 수 있는 드롭다운 메뉴가 포함되어 있습니다. + 기호를 클릭하여 다음 빌딩 블록을 추가하고 채우기 선택을 선택합니다.
참고: 식세포가 적용되지 않았지만 phagocytosed화물을 제외하지 않은 인접한 SH-SY5Y를 제외하도록 세포질 세분화를 적절하게 최적화하는 것이 중요합니다(그림 2참조). - 선택 인구에서,인구 핵,메서드 공통 필터,경계 개체 제거를위한 진드기 및 "핵 선택"이라는 출력 채우기가 될 기본 설정을 유지합니다. + 기호를 클릭하여 다음 빌딩 블록을 추가하고 형태 속성 계산을선택합니다.
- 형태학적 특성 계산에서,모집단을 선택된 핵으로설정하, 셀로 영역, 메서드를 표준으로설정한다. 드롭다운 메뉴에서 영역과 원도(μm2)를선택해야 합니다. 출력 채우기의 이름을 "형태 세포"입니다. + 기호를 클릭하여 다음 빌딩 블록을 추가하고 채우기 선택을 선택합니다.
- 선택 인구(2)에서선택된 모집단 핵을 선택하고, 속성별로 필터방법을 선택한다. 필터 F1아래의 드롭다운 상자에서 형태학적 세포 영역[μm2]을선택합니다. 드롭다운 상자에서 오른쪽으로 > 선택하고 상자에 160을 입력합니다. 출력 채우기의 이름을 "핵 선택2". + 기호를 클릭하여 다음 빌딩 블록을 추가하고 스팟 찾기를 선택합니다.
참고: 이 단계는 부적절하게 분할된 세포와 죽은 세포를 추가 분석에서 제외합니다. 컷오프 크기를 늘리거나 줄임으로써 최적화해야 할 수도 있습니다. - 스팟 찾기에서,채널 알렉사(568)를선택하고, ROI 인구 핵선택 2,ROI 영역 세포,방법 B,출력 집단 "반점"의 이름을 지정한다. 이 방법은 필요한 경우 드롭다운 메뉴를 사용하여 감지 감도(예: 0.20) 및 분할 감도(예: 0.400)를 사용하여 최적화할 수 있습니다. + 기호를 클릭하여 다음 빌딩 블록을 추가하고 형태 속성 계산을선택합니다.
- 형태학적 특성 계산(2)에서,모집단 반점,지역 스팟및 방법 표준을 선택합니다. 드롭다운 메뉴에서 영역과 원도(μm2)를선택해야 합니다. 출력 속성의 이름을 "형태 스팟"입니다. + 기호를 클릭하여 다음 빌딩 블록을 추가하고 채우기 선택을 선택합니다.
- 채우기 선택(3)에서도면점 및 속성별 필터 방법을 선택합니다. 필터 F1아래의 드롭다운 상자에서 스팟 영역 [px2],>, 20을선택합니다. 필터 F2아래의 드롭다운 상자에서 스팟 영역 [px2],<, 2500을선택합니다. 필터 F3아래의 드롭다운 상자에서 형태 반점 원등, >, 0.6을선택하십시오. 필터 F4아래의 드롭다운 상자에서 영역 강도, >, 2.5로 스팟을선택합니다. 출력 채우기의 이름을 "선택한 스팟"입니다. + 기호를 클릭하여 다음 빌딩 블록을 추가하고 채우기 선택을 선택합니다.
참고: 자동 스팟 선택은 iPSC-대식세포 내의 자동 형광 체에서 발생하는 많은 작은 형광 반점을 세분화합니다. 이 단계는 반점의 영역, 둥글림 및 강도에 엄격한 컷오프를 적용하여 자동 형광 체체를 필터링하는 것을 목표로하며 약간의 최적화가 필요할 수 있습니다. - 선택 인구(4)에서, 선택된 모체 2 및 속성별 방법 필터를선택한다. 필터 F1아래의 드롭다운 상자에서 반점 수, > 0.5를선택합니다. 출력 채우기의 이름을 "스팟 포지티브 셀"입니다. + 기호를 클릭하여 다음 빌딩 블록을 추가하고 결과 정의를 선택합니다.
- 결과 정의에서첫 번째 메서드를 출력 목록으로 선택합니다. 기본 설정은 각 개체에 대해 계산할 개체 수에 대한 것입니다. 인구에 대한 드롭다운 메뉴를 클릭합니다: 핵 선택 2 및 개체 수가 체크아웃되었는지 확인하고 모든 드롭다운 메뉴에 적용메뉴에서 모두를 선택합니다. 채우기 스팟 포지티브 셀의 경우 개체 수가 틱되어 있는지 확인합니다. 다른 채우기의 경우 매개 변수를 보고할 필요가 없습니다. 두 번째 메서드를 수식 출력으로선택하고 수식(a/b)*100을 입력합니다. 변수 A 스팟 포지티브 셀 수-개체수로 선택하고 변수 B는 핵 선택 2- 개체 수를 선택합니다. 출력을 "스팟 포지티브 셀(%)"으로 지정합니다.
- 파이프라인 저장: 디스크에 분석 저장 아이콘(아래쪽 화살표가 있는 플로피 디스크)을 클릭합니다.
- 아이콘 배치 분석(화면 상단을 따라 깔때기 및 톱니바퀴 기호)를 클릭합니다. 왼쪽의 실험 폴더에서 선택한 측정 수를 1로업데이트해야 하는 원시 데이터 파일을 선택합니다. 분석 옵션 영역에서 메서드의드롭다운 메뉴를 클릭하고 기존 분석을 선택합니다. 클릭 ... 스크립트 파일 옆에 있는 기호와 저장된 분석 파일(suffixed .aas)을 찾아봅니다. 그런 다음 시작 분석 옆에 있는 녹색 화살표를 클릭합니다. 검색 진행 상황을 화면의 오른쪽 상단 모서리에 있는 작업 상태(작업 상태)를 클릭하여 모니터링할 수 있습니다.
- 분석이 완료되면 탭 내보내기를클릭하고 실험 폴더를 선택하고 대상 폴더를 선택합니다. TIFF 이미지가 아닌 데이터를 내보내고 내보내기를 시작하는 기본 설정을 둡니다.
- 다운로드한 파일을 적절한 스프레드시트 소프트웨어에서 스프레드시트로 엽니다. 우물은 행과 열의 매개 변수로 정렬됩니다. 스팟 포지티브 셀(), 핵 선택 2 - 반점 수 - 우물당 평균 및 핵 선택 2 - 총 스팟 영역 - 총 스팟 영역 - 음당 평균으로 분류하여 각 매개 변수에 대한 신선한 스프레드시트에 복사하여 데이터를 선택합니다. 각 조건의 복제 우물에 대한 매개 변수 평균을 계산하고 적절하게 그래프를 계산합니다.
7. 고정 SH-SY5Y의 균질성에 대한 품질 관리 분석
- 2단계에서 라이브 SH-SY5Y의 알리쿼시를 수집하고 mL당 약 200,000개의 세포의 농도에서 부속물 V-FITC 염색 키트로부터 부속품 결합 버퍼에서 재축된다.
- 2.4단계에서 고정 SH-SY5Y의 알리쿼트를 수집하고 mL당 약 200,000개의 세포의 농도로 부속 결합 버퍼에서 재연한다.
- 부속서 V-FITC 5 μL과 5 μL의 프로피듐 요오드(재료 표 참조)로두 개의 시험관을 준비합니다. 라이브 SH-SY5Y 500 μL을 한 튜브에 추가하고 다른 튜브에 고정 된 SH-SY5Y의 500 μL을 추가합니다.
- 세 가지 제어 튜브를 준비: 부속서 V-FITC의 5 μL하나, 프로피듐 요오드의 5 μL, 그리고 하나의 튜브 비어 있는 하나. 라이브 및 고정 SH-SY5Y의 1:1 비율을 함께 혼합하고 각 제어 튜브에 500 μL을 추가합니다.
- 파이프팅으로 튜브를 부드럽게 섞습니다. 10 분 동안 실온에서 배양하여 빛으로부터 보호합니다.
- 즉시 흐름 사이토미터(Ex = 488 nm;) 측정; Em = 530 nm) 부속제 V-FITC에 대한 FITC 신호 검출기 (일반적으로 FL1)를 사용하고, 프로피듐 요오드에 대한 피코에리스린 방출 신호 검출기 (일반적으로 FL2).
- 모든 유동 세포 분석 소프트웨어를 사용하여 FITC 대 PI 신호의 도트 플롯을 표시하고 직사각형 게이팅 도구를 사용하여 이중 음수 도수를 선택합니다. 이중 음수 인구 내에서 FSC 대 SSC를 표시하고 다각형 게이팅 도구를 사용하여 매우 낮은 FSC 및 SSC로 인구 주위에 배제 게이트를 만들 수 있으며, 이는 파편으로 분류되므로 추가 분석에서 제외됩니다. 나머지 이벤트를 FITC 대 PI 신호로 표시하고 단일 스테인드 및 스테인드 컨트롤을 사용하여 FITC/PI-, FITC+/PI-, FITC -/PI+및 FITC+/PI+ 이벤트에 대한 사분면 게이트를 설정합니다.
참고: 인공적으로 인산화 를 유도할 수 있는 라이브 SH-SY5Ys로 거친 취급, 소용돌이 또는 긴 배양을 피하십시오. 지체없이 순환 측정을 진행합니다. 바람직한 결과는 FITC/PI-이벤트의 비율이 고정 SH-SY5Y의 <5%라는 것입니다. 대표적인 결과는 보충 도서 S1에표시됩니다.
결과
살아있는 세포 시간 경과 화상 진찰은 야생 형 iPSC-대식세포가 잘 당 20,000 세포에서 시드로 이전에 설명된 프로토콜을 사용하여 수행되었습니다. SH-SY5Ys의 상이한 양이 적용(10,000-30,000 단계 3.1의 세포 수에서 추정됨) 및 식세포 억제제 cytochalasin D는 일부 우물로 사전 배양(1h)을 적용하여 각 양의 SH-SY5에 대한 phagocytosis를 억제하는 대조군역할을 하였다. 화상 진찰은 SH-SY5Ys의 추가 후에 40 분 시작되고 심상은 다음 3 시간 동안 5 분 간격으로 캡처되었습니다 (데이터는 초기 40 분 지연을 포함합니다). 대표적인 타임랩스 비디오는 보충 데이터에포함되며 그림 3에 도시된 정량적 데이터를 분석한다. 우물당 10,000개의 SH-SY5Y의 양으로, 세포당 식세포 입자(spots)의 수는 시간이 지남에 따라 선형적으로 증가하고, 사이토찰라신 D에 의해 약 50%까지 억제되었다. 사이토샬라신 D에 의한 억제는 예상보다 약했으며, 조건당 단 하나의 우물만이 3개의 이미지 필드로 이미지되었기 때문에 기술적 또는 생물학적 복제가 부족하여 발생할 가능성이 큽으로써 발생했습니다. 우물당 SH-SY5Y(20,000및 30,000)의 양이 더 많은 경우, phagocytosis는 iPSC-대식세포및 SH-SY5Y의 세분화가 불량하여 보다 붐비는 시야에서 열악한 선형성을 보였습니다.
고정세포 고함량 이미징은 이전에 설명된 프로토콜을 사용하여 수행되었으며, 야생형 iPSC-대식세포는 웰당 20,000세포, SH-SY5Ys의 여러 가지 양(웰당 10,000-80,000)을, 분석 플레이트는 5시간 후에 고정및 이미지화하였다. 식세포증의 대표적인 이미지는 도 4A에제시되고, 도 4B17에도시된 분석된 데이터. SH-SY5Y의 양을 증가시켜 세포당 더 많은 수의 식세포 입자(spots)가 발생했습니다. 그러나 SH-SY5Y 수량의 두 배만 증가하면 셀당 반점 수가 1.5배 증가합니다. 이는 테스트된 양이 phagocytosis에 대한 속도 제한이 아님을 나타냅니다. 그 후 고함량 영상식세포분석은 식세포증의 여러 억제제(도4C)17을사용하여 검증하였다. 액틴 중합 억제제 는 세포질 D와 자스플라키놀라이드가 phagocytosis를 각각 91% 및 90%씩 현저히 억제하며, 식세포증 전에 1시간 전에 사전 배양하였다. 세포샬라신 D 또는 자스플라키놀라이드가 음의 대조군으로 사용될 때 분석의 견고한 Z'는 각각20으로계산된다. 리소솜 산성화 억제제 바필로마이신 A1은 phagocytosis를 31%까지 현저히 감소시켰습니다. 리소솜 산성화 억제제 대 액틴 억제제의 약한 효과는 내면화된 화물의 검출이 충고의 완전한 산성화를 필요로 하지 않을 수 있음을 시사한다. 재조합 부속서 V는 SH-SY5Ys 표면에 노출된 포스파디들세린을 구체적으로 차단하는 대조군으로 사용되어, 교피 수용체가 리간드에 접근하는 것을 방지하여 중요한 "eat-me" 신호이다. 재조합 부속서 V를 첨가하여 SH-SY5Y 첨가 직전에 우물에 첨가하면 식세포증을 30%까지 현저히 감소시다. 고정 된 SH-SY5Ys는 형광 부속서 V 프로브를 사용하여 인산화를 노출하는 것으로 확인되었으며, 반면 살아있는 SH-SY5Ys는 부속서 V 염색(도 4D)에대해 부정적이었습니다.
microglial phagocytosis 수용체 TREM2는 이전에 세포 세포 신경21의phagocytosis에 중요 한 것으로 표시 되었습니다. TREM2의 R47H 돌연변이는 알츠하이머 병의 늦은 발병을 위한 위험 유전자이며, TREM223의리간드 결합을 감소시키기 위해 가설이다. R47H TREM2 및 TREM2 KO의 식세포 기능을 평가하기 위해 고정 셀 고함량 식세포 분석은 WT/R47H/KO TREM217을사용한 동생성 iPSC-대식세포 라인을 사용하여 수행되었다. 1에서 5h까지 의 식세포 지속 시간의 몇 가지 길이는 파고 세포화물 (40,000 SH-SY5Ys)의 비틀거리는 추가를 사용하여 테스트되었습니다. 결과 신호는 선형적으로 4h로 증가하여 5h(그림 5)17에서약간 수평을 유지합니다. R47H TREM2 돌연변이체가 변한 식세포증을 나타내지 않은 반면, TREM2 KO에서 감소된 식세포증 비율 및 용량(% 현물 양성 세포)은 명백했다. TREM2 KO 세포의 식세포 결함은 TREM2 기능이 정상 식세포증을 지원하기에 충분하기 때문에 R47H TREM2 돌연변이에 의해 페노복사되지 않습니다.
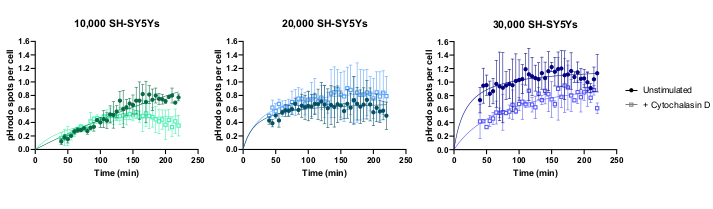
그림 3: 살아있는 세포 시간 경과 phagocytosis 분석에 대한 예제 데이터. 야생형 iPSC-대식세포 BIONi010-C(ECACC ID: 66540023)에 의한 죽은 SH-SY5Y의 섭취는 3시간 동안 5분 간격으로 이미지된다. 그래프에 표시되는 시간은 측정없이 처음 40 분을 포함하여 phagocytosis의 개시에서 비롯됩니다. 복제웰 3개에서 셀당 평균 반점 수가 플롯됩니다. 10,000SH-SY5Ys의 식도증은 1시간 전처리로 10μM 사이토샬라신 D로 억제되는 반면, 더 많은 양의 SH-SY5Ys(20,000 및 30,000)는 phagocytosis의 최적이 아닌 정량화를 가지고 있습니다. 표준 편차(SD), N = 1 실험을 ± 평균. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
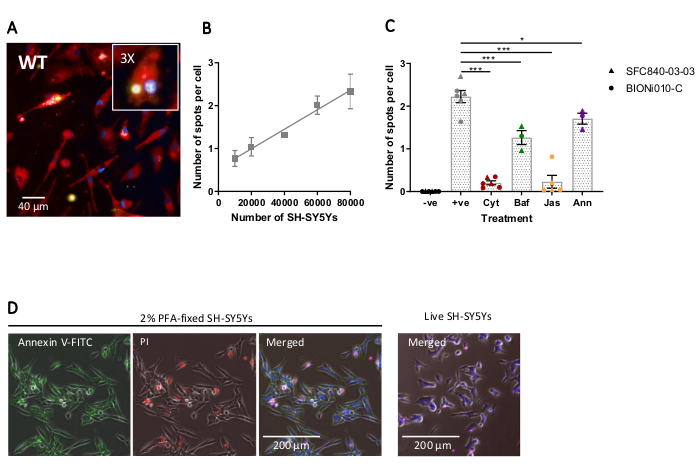
그림 4: 고함량 식세포 분석의 최적화 및 검증. (A)야생형 iPSC-대식세포 BIONi010-C(ECACC ID: 66540023)에 의해 SH-SY5Ys 의 대표적인 고함량 현미경 이미지. 40,000 SH-SY5Y가 있는 3h 시간 점이 표시됩니다. 형광 채널은 빨간색으로 표시된 iPSC-대식세포 얼룩과 병합되고, 핵은 파란색으로, SH-SY5Ys는 노란색으로 표시됩니다. 인셋 패널은 3배 확대된 영상의 단면이다.(B)5시간 후 식세포사멸SH-SY5Ys의 셀당 반점 수, 야생형 iPSC-대식세포에 다른 양의 화물을 첨가한다. 평균 (SEM)의 표준 오차를 ± 평균, N = 3 수확에 대한. (C)식세포증(3h)은 10μM 시토샬라신 D(Cyt), 1 μM 바필로마이신 A1(Baf), 1 μM 자스플라키놀라이드(1시간 전처리 포함)로 억제된다. Jas) 및 13 μg/mL 재조합 부속서 V(죽은 SH-SY5Ys에 동시에 추가됨; 앤). SH-SY5Y가 첨가되지 않은 iPSC-대식세포는 음의 대조군(-ve)으로 사용되었고, 양성(+ve) 제어는 SH-SY5Y를 첨가한 처리되지 않은 iPSC-대식세포이다. 실험 반복을 위한 평균으로 데이터가 정규화되었습니다. ± SEM, N = 3-6 수확 및 두 개의 야생 형 세포주 (SFC840-03-03)를 사용하면이 라인의 특성화가 설명됩니다 (페르난데스 외21 및 BIONi010-C). Dunnett의 포스트 호크 테스트와 1 방향 ANOVA, 처리되지 않은 세포에 대한 비교 * < p < 0.01 p.p .01. (D)인산다이들세린 디스플레이(부속품 V-FITC)를 위해 상고하게 고정된 SH-SY5Ys 얼룩(부속어 V-FITC)을 위해 균일하게 고정하고 세포 투과성(propidium 요오드)이 제한된다. 라이브 SH-SY5Ys는 배양에서 몇 가지 죽은 세포에 존재하는 초점 얼룩을 제외하고, 부속서 V-FITC 또는 프로피듐 요오드에 대한 얼룩을 하지 않습니다. 수치는 알츠하이머 연구 및 치료17의허가로 재현됩니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
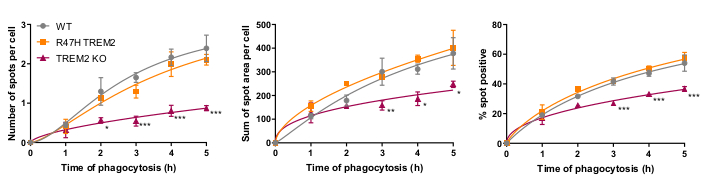
그림 5: Phagocytosis는 TREM2 KO에서 감소하지만 R47H TREM2 iPSC-대식세포에서는 감소하지 않습니다. 고함량 식세포 분석은 엇갈렸던 첨가물로 40,000개의 SH-SY5Y를 잘 수행했습니다. 수단은 세포당 반점 수, 셀당 현물 영역(μm2)의합, 필드당 phagocytosed 입자를 함유하는 세포의 백분율 등 파라미터에 대해 정량화되었다. 실험당 각 유전자형에 대한 의미로 데이터가 정규화되었습니다. N = 3 수확에 대한 ± SEM을 의미합니다. 반복 조치 2-way ANOVA, 던넷의 포스트 혹 후 테스트, 각 시간에 대 한 WT에 쌍으로 비교: *p < 0.05, **p < 0.01, ***p < 0.001. 수치는 알츠하이머 연구 및 치료17의허가로 재현됩니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
보충 도 S1: SH-SY5Ys 준비를 위한 예제 QC. 해리된 SH-SY5Ys는 0%(라이브 셀), 1%, 파라포름데히드(PFA)의 2%로 10분 동안 고정된 후 세척하였다. 세포는 부속서 V-FITC 및 프로피듐 요오드(PI)로 염색하고 혈류 세포측정에 의해 즉시 측정하였다. 색상 밀도 점 플롯은 단일 스테인드 및 스테인드되지 않은 컨트롤을 사용하여 사분면 게이트를 배치하여 유동 세포 측정 분석 소프트웨어에서 만들어졌습니다. 사분면은 해당 사분면 내의 이벤트 비율에 대해 추가됩니다. 살아있는 세포는 주로 4분기에 있으며 고정 셀은 주로 2분기에 있습니다. Q1 = 부속서 V/PI-, Q2 = 부속서 V+/PI+, Q3 = 부속서 V+/PI-, Q4 = 부속서 V/PI-(라이브 셀). 이 파일을 다운로드하려면 여기를 클릭하십시오.
보충 비디오: 라이브 셀 시간 경과 phagocytosis. 야생형 iPSC-대식세포 BIONi010-C(ECACC ID: 66540023)에 의해 S-SY5Ys의 대표적인 타임랩스 비디오. 이미지는 3 시간 동안 5 분마다 촬영되었습니다. 비디오가 자르고 초당 3 프레임에서 실행되어 분석의 마지막 1.5 h를 보여줍니다. 산에 민감한 염료 염색 SH-SY5Ys는 포고솜 산성화로 증가하는 빨간색, 신호 강도로 표시됩니다. Hoechst 33342로 염색된 세포 핵은 파란색으로 표시됩니다. 이 비디오를 다운로드하려면 여기를 클릭하십시오.
토론
Microglia는 세포 세포 신경세포의 phagocytosis를 포함하여 신경 퇴행성 질병의 개시 그리고 진행에 영향을 미치는 중요한 기능을 가지고 있습니다. 손상된 microglial phagocytosis 및 시 냅 스의 부적 절 교 감 증 둘 다 신경 퇴행 성 질환과 관련 된, 기본 메커니즘 및 인과 잘 이해 되지 않지만4,23. 이 논문은 iPSC-대식세포에 의한 세포 세포 의 식세포증을 측정하는 식세포 분석법을 간략하게 설명하며, 라이브 셀 타임랩스 이미징 판독또는 고정 셀 고함량 현미경 검사법 또는 단일 분석기의 조합으로 구성된다. 이 다재다능함은 분석이 몇 가지 우물에서 시간이 지남에 따라 개별 phagocytic 이벤트를 연구하는 데 사용되거나 여러 조건이나 치료법으로 고함량 스크리닝에 사용될 수 있음을 의미합니다. 고함량 분석이 단일 타임포인트에 고정되므로 여러 분석 플레이트를 동시에 준비할 수 있습니다. 고함량 분석은 질병 관련 유전 이체로 대식세포/마이크로글리아를 특성화하거나 식세포증의 변화에 대한 작은 분자 억제제를 선별하는 잠재적 인 유틸리티를 가지고 있습니다. 분석은 또한 쉽게 다른 microglia 모델의 phagocytosis를 공부하기 위하여 적응될 수 있습니다, 또는 잠재적으로 성상 세포. 식증 분석은 잠재적으로 살아있는 세포 이미징 얼룩, 예를 들어, 미토콘드리아, 칼슘, 또는 ROS 지표로 멀티플렉스화될 수 있으며, 단백질에 대한 고정 후 면역형광 염색을 수행할 수 있다. 세포 세포 세포를 활용하는 기존의 식세포 분석법에 비해, 이 프로토콜이 부여하는 주요 장점은 phagocytic 화물의 제조가 비교적 간단하고 빠르며 균일 한 제품으로 초래한다는 것입니다. 다른 아세약은 2시간 25분, 오카다산용 2시간 25분, 4-16h26,27,28,29 또는 UV-조사용 S-니트로소-L-시스테인을 가진 뉴런 또는 SH-SY5Ys의 세포 나 SH-SY5Ys의 세포멸을 유도하고, 24h30의세포에서 다른 세포에 발생할 수 있다. 더욱이, 살아있는 세포 화상 진찰 및 고함량 화상 진찰 읽기는 저자가 인식하는 한, 이전에 설명되지 않았습니다. 파포름알데히드 고정을 사용하여 phagocytic 화물을 준비하는 주요 제한은 세포가 더 작은 크기로 인해 세포가 세포로 분할되는 것을 막기 때문에 세포가 세포가 세포가 세포로 분할되는 것을 완전히 재구성하지 않는다는 것입니다. 그것은 고정이 phagocytes를 유치하는 표적 세포에서 뉴클레오티드 "나를 찾아"신호 (예를 들어, ATP, UDP)의 분비에 어떤 효과 고정이 있는지 알 수 없습니다. 세포 세포와 유사하게, 고정된 SH-SY5Ys는 요오드제를 프로피듐에 대한 일부 멤브레인 투과성을 나타낸다. 멤브레인 투과성은 "나를 찾아"신호의 방출과 관련이 있습니다; 그러나, 이것은 고정된 SH-SY5Ys에서 공부되지 않았으며, 뉴클레오티드가 너무 빨리 방출되는 경우에, SH-SY5Ys가 iPSC-대식세포에 추가되기 전에 멀리 세척될 것이다.
프로토콜의 첫 번째 중요한 단계는 pH 에스테르가 있는 죽은 SH-SY5Y를 pH 에스테르로 염색하는 것입니다. 이 염료는 죽은 SH-SY5Ys의 표면에 무료 기본 아민과 신속하고 공유적으로 반응한다. 염색 지속 시간을 최적화할 필요가 없습니다. 그러나 라벨을 붙이기 전에 염료를 처리하는 데 주의를 기울여야 합니다. 라벨링 반응은 무료 아민을 포함하는 버퍼에서 수행되어서는 안 됩니다. 더욱이, DMSO 재고가 감기 수성 완충또는 높은 최종 농도로 희석될 경우 강수량이 발생할 위험이 있다. 침전물은 현미경의 밑에 조밀한 어두운 객체로 나타납니다. 또한, pH 에 민감한 염료 용액은 일반 플라스틱 원심분리기 튜브에 달라 붙어 천천히 하스포합니다. 따라서 라벨링 단계에는 바인딩이 낮은 튜브가 권장됩니다. pH 에 민감한 염료를 사용하면 영구적으로 형광 염료 대신 에광된 입자의 식별을 돕고 플라즈마 멤브레인을 접대하는 입자에 대해 도움을 줄 수 있습니다. 중립 pH에는 약간의 형광이 있기 때문에, 식세포 화물및 iPSC-대식세포의 밀도는 정확한 세분화를 위해 충분히 낮게 유지되어야 하지만, 수많은 식세포 이벤트가 포착될 만큼 충분히 높습니다. 고함량 현미경 검사는 우물에서 화물의 중간 밀도(iPSC-대식세포당 2SH-SY5Ys 이상)로 식증을 정확하게 식별할 수 있었습니다. 반대로, 깊은 적색 스펙트럼에서 현미경의 민감도가 약하기 때문에, 살아있는 세포 시간 경과 이미징 데이터에서 iPSC-대식세포의 세분화는 자신감이 부족하고 거짓 긍정의 가능성을 줄이기 위해 화물의 매우 낮은 밀도를 사용해야 했습니다 (2 개의 iPSC-대식세포마다 1 SH-SY5Y). 적절한 세분화 및 화물 밀도의 검증은 처리되지 않은 및 사이토샬라신 D 처리 우물 사이의 비교와 함께 수행되어야합니다. 잘 최적화된 분석에서, cytochalasin D는 처리되지 않은 견본에 비해 세포 당 반점의 평균 수를 90% 감소시켜야 합니다.
프로토콜의 또 다른 중요한 단계는 iPSC-대식세포 염색으로, 이는 모든 외부 SH-SY5Y가 개구부에서 제외되도록 세포를 이미지 분석에서 식별하고 분할할 수 있도록 하는 것입니다. 권장염료는 세포 감이 있으며 세포질 내불용 형광 제품으로 변환되어 고칠 수 있으며 독성이 없습니다 (재료 표참조). 염색 단계는 고함량 이미징 phagocytosis 분석과 iPSC-대식세포의 사용에 최적화되었으며, 다른 세포 유형을 사용하는 경우 다시 최적화되어야 한다고 제안합니다. 세포 염색의 지속 기간은 세포 내의 불용성 형광 제품의 증착을 향상시키기 위하여 증가할 수 있습니다. 염료 농도가 최적화되면 유기 용매 차량의 독성 수준을 피하기 위해주의를 기울여야합니다.
분석의 성공에 대한 세 번째 중요한 요소는 데이터 분석입니다. 제공된 분석 파이프라인은 얼룩 강도 또는 세포 형태에 대한 차이로 인해 파이프라인의 세분화 효과를 기록할 수 있기 때문에 규범이 아닌 지침이 될 수 있습니다. 따라서 적절한 양수 및 음수 컨트롤에 대한 파이프라인 테스트와 최적화해야 하는 매개 변수를 프로토콜 텍스트에 표시하여 일부 최적화가 필요합니다. 부정적인 대조군은 SH-SY5Ys를 첨가하기 전에 iPSC-대식세포가 세포증 D와 같은 강력한 식세포 억제제로 미리 처리되는 조건을 포함해야 한다. 또 다른 가능한 부정적인 제어는 분석의 끝에 iPSC-대식세포의 이전에 처리되지 않은 우물에 SH-SY5Ys를 첨가하고, 고정하기 10 분 전에, 이는 화물의 일부 침전을 허용하지만 phagocytosis의 감사 수량에 너무 짧다. phagocytosis 이벤트는 깊은 적색 형광 채널을 사용하여 소프트웨어 알고리즘에 의해 정의된 iPSC-대식세포의 테두리 내의 적색 형광 개체로 정의됩니다. 세포의 세분화가 불량한경우(도 2),iPSC-대식세포에 근접한 많은 비-식세포 SH-SY5Y가 분석, 즉 거짓 긍정에 잘못 포함될 수 있다. 좋은 세분화를 달성하는 가장 중요한 요소는 iPSC-대식세포의 엄격한 묘사입니다. 두 해석모두에 대한 세분화가 자동화되므로 모든 셀에 대해 완벽한 세분화를 얻을 수 없습니다. 그러나 몇 가지 테스트 이미지를 참조로 사용하여 세분화를 보다 최적입니다. 사이토찰라신 D 제어는 이 조건에서 검출된 많은 수의 phagocytic 이벤트가 세분화가 최적이아님을 나타내기 때문에 최적의 세분화를 평가하는 데 중요합니다. 데이터 분석 파이프라인의 최적화는 세포당 phagocytic 이벤트의 수가 세포별 80%-90% 더 낮을 때까지 이상적으로 반복되어야 하며, 아토찰라신 D 조건에서는 억제제가 없다.
발생 가능성이 가장 높은 phagocytosis 분석의 문제점은 다음과 같습니다: (1) 양성 대조군에서 약한 pH 에 민감한 형광, (2) 분석의 끝에 대식세포의 희소 또는 고르지 않은 분포, 또는 (3) 비 phagocytosed SH-SY5Ys에서 분석에서 거짓 긍정의 높은 숫자. 약한 pH 에 민감한 형광의 문제 해결은 먼저 SH-SY5Ys의 염색이 강한 마젠타 색을 가진 세포 펠릿귀가 초래되었다는 것을 확인해야합니다. 색상이 약한 경우, 신선한 염료 재고가 사용되는지 확인하고, 라벨링 버퍼가 아민이 없는지 확인하고, 염색하기 전에 SH-SY5Y에 추가 세척을 추가하고, 정확한 수의 SH-SY5Y가 염색되었는지 확인하고, 염료 침전량이 증거가 없는지 확인하고, 염료 침전물의 농도를 최적화합니다. SH-SY5Y가 강하게 염색되면 분석판에 첨가된 농도가 정확한지 확인하고 iPSC-대식세포가 건강하고 너무 오래되지 않았는지 확인하십시오. 두 번째 유형의 문제인 고르지 않은 대식세포 분포는 파이펫 팅 중 세포의 손실로 인해 발생할 수 있으며 좁은 보어 팁을 피하면서 세포에서 경험하는 파이펫팅 력을 줄이기 위한 조치를 취해야 합니다. 문제가 남아 있으면 iPSC-대식세포를 세포 에 대한 무의미한 염료로 적재하는 잠복기 시간을 줄입니다. 세 번째 문제는 분석에서 비식세포 입자를 잘못 포함하는 것과 관련하여 분석 파이프라인의 최적화가 더 필요하다는 것을 나타냅니다. 문제 해결은 먼저 셀 세분화 및 소프트웨어가 인접 한 개체를 포함 하는지 여부에 초점을 맞추어야 합니다. 조정할 수 있는 특정 매개 변수는 관련 단계 이하의 노트에서 제안된다(라이브 셀 타임랩스 분석을 위한 단계 6.1.11-6.15 및 고함량 분석을 위한 단계 6.2.4-6.2.8). 세포 세분화를 더 개선할 수 없는 경우, 고함량 분석은 부적절하게 분할된 iPSC-대식세포를 배제하는 추가 단계(단계 6.2.8)를 가한다. 더욱이, iPSC-대식세포 내에서 pH 민감형의 허용된 반점을 걸러내는 모듈을 최적화하여 허용된 개체의 임계값 강도를 증가시켜 비-phagocytosed SH-SY5Ys를 배제하는 데 도움이 될 것입니다(라이브 셀 타임랩스 분석을 위한 단계 6.1.17, 및 높은 함량 분석을 위한 단계 6.2.11).
우리는 각각 장점과 한계가 있는 phagocytosis 분석에 대한 현미경 판독의 두 가지 유형을 개발했습니다. 라이브 셀 타임랩스 이미징은 phagocytosis 운동학에 대한 추가 정보를 제공하는 장점이 있으며 고콘텐츠 이미징 플랫폼보다 더 널리 사용할 수 있습니다. 권장된 오픈 소스 소프트웨어는 현미경 소스에 불가지론적이며 라이브 셀 타임 랩스 기능의 유무에 관계없이 양질의 형광 현미경과 함께 사용할 수 있습니다. 라이브 셀 이미징의 주요 제한은 제한된 감도와 광학으로 iPSC-대식세포의 좋은 세분화를 감지하고 수행하는 것이 더 어려워집니다. 이 제한은 iPSC-대식세포 염색의 기간을 증가시키거나, 사용 가능한 경우에 더 민감한 현미경으로 전환하여 완화될 수 있었습니다. 고함량 이미징 식세포 분석은 고함량 이미징 시스템을 사용할 수 있는 경우 권장 판독입니다. 고콘텐츠 이미징 시스템은 더 높은 처리량과 보다 안정적인 데이터를 가능하게 하여 이 분석이 스크리닝에 사용될 수 있게 해주며, 이 분석은 "셀당 반점 수" 출력20에대해 ≥0.7의 강력한 Z'가 예상될 것으로 예상됩니다. 라이브 셀 타임랩스 방법에 비해, 고함량 현미경 판독기는 더 높은 감도, 높은 수준의 자동화 및 속도, 더 많은 우물 및 이미징 필드를 처리할 수 있으며 고해상도 공초점 이미지가 생성됩니다. 세포 세분화는 좋은 이미지로 더 효과적이며, 세분화는 고불규칙한 모양의 세포에 적합한 더 많은 세포 세분화 방법을 제공하는 고함량 이미징 분석 소프트웨어에 의해 추가적으로 지원된다. 고함량 이미징 분석 소프트웨어는 또한 phagocytosis의 더 많은 매개 변수를 계산, 오픈 소스 소프트웨어에 비해, 이러한 phagocytic 세포의 백분율등. 고함량 phagocytosis 분석의 주요 한계는 이미징 시스템 및 분석 소프트웨어의 비용과 접근성 중 하나입니다.
결론적으로, 이 논문에 제시된 정량적 phagocytosis 분석체는 체외에서 죽은 뉴런의 microglia phagocytosis를 모델링하기 위한 유용한 도구입니다. 마이크로글리아는 iPSC-대식세포에 의해 모델링되고 죽은 뉴런은 파라포름알데히드 고정 SH-SY5Ys에 의해 모델링됩니다. 비록 가장 본격적인 microglia 및 죽은/apoptotic 뉴런 모델 게시, 이들은 쉽게 준비 하 고 확장. 분석 자체는 매우 다재다능하며 두 가지 유형의 이미징 판독이 상세하며, 다른 마이크로글리아/대식세포 단양 모델 또는 다른 세포 유형과 함께 사용하기 위해 적응할 가능성이 있습니다. 고함량 이미징 판독값은 정량적 데이터를 얻기에 유리하며, iPSC-대식세포에서 식세포증의 소분자 변조기 또는 스크린 유전적 변이체까지 확장할 수 있다. 그러나 고함량 이미징 시스템은 비용이 많이 들고 데이터 가중이기 때문에 필요한 경우 양질의 기존 형광 현미경으로 대체 될 수있는 라이브 셀 타임 랩스 현미경을 사용하여 프로토콜에 대체 된 대체 된 이미징 판독이 프로토콜에 포함되었습니다.
공개
저자는 공개 할 것이 없습니다.
감사의 말
저자는 높은 함량현미경 검사법에 대한 도움을 준 발 밀러 박사와 소하이브 니자미 박사와 고함량 현미경에 대한 접근을 위한 다니엘 이브너 박사에게 감사드립니다. 또한, 저자는 분석 개발 조언에 대한 박사 엠마 미드, 부인 캐시 브라운 iPSC 지원을 감사드립니다. 이 작품은 알츠하이머 연구 영국 옥스포드 약물 발견 연구소에 의해 지원되었다 (ARUK ODDI, 보조금 참조 ARUK-2020DDI-OX), 옥스포드 마틴 학교 LC0910-004에서 제임스 마틴 줄기 세포 시설 옥스포드에 추가 지원 (S.A.C.); 파킨슨 병 영국에서 기념물 신뢰 발견 상 (J-1403); MRC 치매 플랫폼 영국 줄기 세포 네트워크 자본 장비 MC_EX_MR/ N50192X/1, 파트너십 MR/N013255/1, 모멘텀 MC_PC_16034 어워드.
자료
| Name | Company | Catalog Number | Comments |
| 15 mL conical centrifuge tube | Falcon | 352096 | For centrifugation of cells |
| 2-20 µL, 20-200 µL, 100-1000 µL single-channel micropipettes | |||
| 2-mercaptoethanol 50 mM | Gibco | 31350010 | Component of Factory media |
| 4% paraformaldehyde in PBS | Alfa Aesar | J61899 | For fixation of cells |
| 6-well plate, tissue culture treated | |||
| AggreWell-800 24-well plate | STEMCELL Technologies | 34815 | Microwell low-adherence 24-well plate for formation of embryoid bodies |
| Annexin V-FITC Apoptosis Staining / Detection Kit | Abcam | ab14085 | Kit for annexin V-FITC staining , as an assay for quality control of fixed SH-SY5Ys. Kit contains annexin binding buffer, annexin V-FITC, and propidium iodide. |
| Automated cell counter | |||
| Benchtop centrifuge | |||
| Benchtop microcentrifuge | |||
| CellCarrier-96 Ultra Microplates, tissue culture treated, black, 96-well with lid | Perkin Elmer | 6055302 | 96-well tissue culture (TC)-treated microplate with black well walls and an optically-clear bottom, for phagocytosis assay |
| CellProfiler software | Open-source software for analysis of phagocytosis images obtained by live-cell time-lapse microscope. Download for free from website (http://cellprofiler.org/), this protocol used version 2.2.0. | ||
| CellTracker Deep Red dye | Thermo Fisher | C34565 | Deep red-fluorescent, cell-permeant, succinimidyl ester-reactive dye for staining cytoplasm of iPS-macrophages. Dissolve CellTracker Deep Red dye in DMSO to 2 mM (1.4 mg/mL). Use at 1 μM, by dilution of DMSO stock with Macrophage media. |
| Class 2 laminar air flow safety cabinet | |||
| CO2 gas bottle | Accessory for EVOS FL Auto | ||
| CO2 incubator, set to 37°C and 5 % CO2 | |||
| Columbus Image Data Storage and Analysis System | Perkin Elmer | Columbus | Data storage and analysis platform for Opera Phenix. Supports all major high content screening instruments. |
| Cytochalasin D | Cayman | 11330 | Negative control treatment for phagocytosis assay. Reconstitute in DMSO to 10 mM and store aliquots at -20°C, avoid further freeze-thaw cycles. Use at final concentration 10 µM. |
| DMEM/F12 | Gibco | 11320074 | Component of SH-SY5Y media |
| DMSO | Sigma | D8418 | Solvent for CellTracker and pHrodo dyes |
| EVOS FL Auto Imaging System | Thermo Fisher | AMF4300 | Live-cell time-lapse imaging microscope |
| EVOS Light Cube CY5 | Thermo Fisher | AMEP4656 | Accessory for EVOS FL Auto |
| EVOS Light Cube DAPI | Thermo Fisher | AMEP4650 | Accessory for EVOS FL Auto |
| EVOS Light Cube RFP | Thermo Fisher | AMEP4652 | Accessory for EVOS FL Auto |
| EVOS Onstage Incubator | Thermo Fisher | AMC1000 | Accessory for EVOS FL Auto |
| Fetal Bovine Serum | Sigma | F4135 | Component of SH-SY5Y media |
| Flow cytometer | |||
| Flow cytometry analysis software | |||
| Geltrex LDEV-Free, hESC-Qualified, Reduced Growth Factor Basement Membrane Matrix | Invitrogen | A1413302 | hESC-qualified basement membrane matrix for iPSC culture |
| GlutaMAX Supplement | Gibco | 35050-038 | Component of both Factory and Macrophage media |
| HBSS | Lonza | BE 10-547F | Hank’s balanced salt solution for washing steps |
| Human recombinant BMP4 | Gibco | PHC9534 | Component of Embryoid Body media |
| Human recombinant IL-3 | Gibco | PHC0033 | Component of both Factory and Macrophage media |
| Human recombinant SCF | Miltenyi Biotech | 130-096-695 | Component of Embryoid Body media |
| Human recombinant VEGF | Gibco | PHC9394 | Component of Embryoid Body media |
| Live Cell Imaging Solution | Thermo Fisher | A14291DJ | Phenol red-free HEPES-buffered media for labelling dead SH-SY5Ys |
| Low protein binding 2 mL tubes | Eppendorf | 30108.132 | For staining SH-SY5Ys |
| M-CSF | Thermo Fisher | PHC9501 | Component of both Factory and Macrophage media |
| mTeSR1 Medium | STEMCELL Technologies | 85850 | iPSC media |
| Multichannel 20-200 uL pipette | For liquid handling of 96-well plate | ||
| NucBlue Live ReadyProbes Reagent | Thermo Fisher | R37605 | Hoechst 33342 formulation in a dropper bottle for staining nuclei of iPS-macrophages, use 0.5 drops/mL in Macrophage media. |
| Opera Phenix High-Content Screening System | Perkin Elmer | HH14000000 | High-content imaging microscope, used with Harmony software version 4.9. |
| Penicillin-Streptomycin | Gibco | 15140-122 | Component of Factory, Macrophage, and SH-SY5Y media |
| pHrodo iFL Red STP-Ester | Thermo Fisher | P36011 | pH-sensitive red fluorescent dye for labelling dead SH-SY5Ys. Reconstitute pHrodo iFL Red STP Ester powder in DMSO to a 5 mg/mL concentration. For each 1 million SH-SY5Ys, add 2.5 μL (12.5 μg) of pHrodo iFL Red STP Ester stock to pre-warmed cells suspended in Live Cell Imaging Solution. |
| Serological pipette filler | |||
| T175 flask, tissue culture treated | Vessel for differentiations of iPSC-macrophage precursors, known as "Factories" | ||
| T75 flask | Vessel for SH-SY5Y culture | ||
| Transparent plate sealers | Greiner Bio-One | 676001 | For assay plate storage and transportation |
| TrypLE Express (1X), no phenol red | Gibco | 12604013 | Cell dissociation buffer containing recombinant trypsin-like enzymes and 1.1 mM EDTA, use neat. |
| Water bath, set to 37°C | |||
| X-VIVO 15 Medium with L-glutamine, gentamicin, and phenol red | Lonza | BE04-418F | Component of Factory and Macrophage media |
| X-VIVO 15 Medium with L-glutamine; without gentamicin or phenol red | Lonza | 04-744Q | Phenol red-free macrophage media, for use in phagocytosis without additives or growth factors |
참고문헌
- Hochreiter-Hufford, A., Ravichandran, K. S. Clearing the dead: apoptotic cell sensing, recognition, engulfment, and digestion. Cold Spring Harbour Perspectives in Biology. 5, 008748 (2013).
- Freeman, S. A., Grinstein, S. Phagocytosis: receptors, signal integration, and the cytoskeleton. Immunological Reviews. 2262, 193-215 (2014).
- Hickman, S., Izzy, S., Sen, P., Morsett, L., El Khoury, J. Microglia in neurodegeneration. Nature Neuroscience. 21 (10), 1359-1369 (2018).
- Galloway, D. A., Phillips, A. E. M., Owen, D. R. J., Moore, C. S. Phagocytosis in the brain: Homeostasis and disease. Frontiers in Immunology. 10, 790 (2019).
- Nizami, S., Hall-Roberts, H., Warrier, S., Cowley, S. A., Di Daniel, E. Microglial inflammation and phagocytosis in Alzheimer's disease: potential therapeutic targets. British Journal of Pharmacology. 176 (18), 3515-3532 (2019).
- Hong, S., et al. Complement and microglia mediate early synapse loss in Alzheimer mouse models. Science. 352 (6286), 712-716 (2016).
- Neher, J. J., et al. Inhibition of microglial phagocytosis is sufficient to prevent inflammatory neuronal death. The Journal of Immunology. 186 (8), 4973-4983 (2011).
- Brown, G. C., Neher, J. J. Microglial phagocytosis of live neurons. Nature Reviews Neuroscience. 15 (4), 209-216 (2014).
- Scott-Hewitt, N., et al. Local externalization of phosphatidylserine mediates developmental synaptic pruning by microglia. The EMBO Journal. 39 (16), 105380 (2020).
- Li, T., et al. A splicing isoform of GPR56 mediates microglial synaptic refinement via phosphatidylserine binding. The EMBO Journal. 39 (16), 104136 (2020).
- Sapar, M. L., et al. Phosphatidylserine externalization results from and causes neurite degeneration in Drosophila. Cell Reports. 24 (9), 2273-2286 (2018).
- Skjesol, A., et al. The TLR4 adaptor TRAM controls the phagocytosis of Gram-negative bacteria by interacting with the Rab11-family interacting protein 2. PLOS Pathogens. 15 (3), 1007684 (2019).
- Wong, K., Li, X., Ma, Y. Paraformaldehyde induces elevation of intracellular calcium and phosphatidylserine externalization in platelets. Thrombosis Research. 117 (5), 537-542 (2006).
- van Wilgenburg, B., Browne, C., Vowles, J., Cowley, S. A. Efficient, long term production of monocyte-derived macrophages from human pluripotent stem cells under partly-defined and fully-defined conditions. PLoS One. 8 (8), (2013).
- Haenseler, W., et al. A highly efficient human pluripotent stem cell microglia model displays a neuronal-co-culture-specific expression profile and inflammatory response. Stem Cell Reports. 8 (6), 1727-1742 (2017).
- Buchrieser, J., James, W., Moore, M. D. Human induced pluripotent stem cell-derived macrophages share ontogeny with MYB-independent tissue-resident macrophages. Stem Cell Reports. 8 (2), 334-345 (2017).
- Hall-Roberts, H., et al. TREM2 Alzheimer's variant R47H causes similar transcriptional dysregulation to knockout, yet only subtle functional phenotypes in human iPSC-derived macrophages. Alzheimer's Research & Therapy. 12, 151 (2020).
- Friedman, B. A., et al. Diverse brain myeloid expression profiles reveal distinct microglial activation states and aspects of Alzheimer's disease not evident in mouse models. Cell Reports. 22 (3), 832-847 (2018).
- Aziz, M., Yang, W. L., Wang, P. Measurement of phagocytic engulfment of apoptotic cells by macrophages using pHrodo succinimidyl ester. Current Protocols in Immunology. 100, 1-8 (2013).
- Atmaramani, R., Pancrazio, J. J., Black, B. J. Adaptation of robust Z' factor for assay quality assessment in microelectrode array based screening using adult dorsal root ganglion neurons. Journal of Neuroscience Methods. 339, 108699 (2020).
- Fernandes, H. J. R., et al. ER Stress and Autophagic Perturbations Lead to Elevated Extracellular α-Synuclein in GBA-N370S Parkinson's iPSC-Derived Dopamine Neurons. Stem Cell Reports. 6 (3), 342-356 (2016).
- Takahashi, K., Rochford, C. D. P., Neumann, H. Clearance of apoptotic neurons without inflammation by microglial triggering receptor expressed on myeloid cells-2. Journal of Experimental Medicine. 201 (4), 647-657 (2005).
- Kober, D. L., Brett, T. J. TREM2-ligand interactions in health and disease. Journal of Molecular Biology. 429 (11), 1607-1629 (2017).
- Hong, S., et al. Complement and microglia mediate early synapse loss in Alzheimer mouse models. Science. 352 (6286), 712-716 (2016).
- Witting, A., Müller, P., Herrmann, A., Kettenmann, H., Nolte, C. Phagocytic clearance of apoptotic neurons by microglia/brain macrophages in vitro: Involvement of lectin-, integrin-, and phosphatidylserine-mediated recognition. Journal of Neurochemistry. 75 (3), 1060-1070 (2000).
- Hsieh, C. L., et al. A role for TREM2 ligands in the phagocytosis of apoptotic neuronal cells by microglia. Journal of Neurochemistry. 109 (4), 1144-1156 (2009).
- Beccari, S., Diaz-Aparicio, I., Sierra, A. Quantifying microglial phagocytosis of apoptotic cells in the brain in health and disease. Current Protocols in Immunology. 122 (1), 49 (2018).
- Diaz-Aparicio, I., et al. Microglia actively remodel adult hippocampal neurogenesis through the phagocytosis secretome. Journal of Neuroscience. 40 (7), 1453-1482 (2020).
- Shirotani, K., et al. Aminophospholipids are signal-transducing TREM2 ligands on apoptotic cells. Scientific Reports. 9 (1), 1-9 (2019).
- Garcia-Reitboeck, P., et al. Human induced pluripotent stem cell-derived microglia-like cells harboring TREM2 missense mutations show specific deficits in phagocytosis. Cell Reports. 24 (9), 2300-2311 (2018).
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기더 많은 기사 탐색
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유