このコンテンツを視聴するには、JoVE 購読が必要です。 サインイン又は無料トライアルを申し込む。
Method Article
FRET感作発光を伴う生細胞におけるタンパク質相互作用の評価(英語)
要約
2つの蛍光色素分子間のフェルスター共鳴エネルギー移動(FRET)は、生細胞におけるタンパク質相互作用の研究に使用できます。ここでは、共焦点レーザー走査顕微鏡を使用してアクセプターの感作放出およびドナー分子の消光を検出することによって、生細胞中のFRETを測定する方法に関するプロトコルが提供される。
要約
フェルスター共鳴エネルギー移動(FRET)は、励起ドナーからアクセプター分子へのエネルギーの無放射移動であり、分子の距離と配向、およびドナー発光スペクトルとアクセプター吸収スペクトルの重なりの程度に依存します。FRETは、生細胞内のタンパク質の相互作用を経時的におよび異なる細胞内コンパートメントで研究することを可能にする。顕微鏡を使用してFRETを測定するためのさまざまな強度ベースのアルゴリズムが文献に記載されています。ここでは、アクセプターの感作放出およびドナー分子の消光の両方を測定することに基づいてFRET効率を定量化するためのプロトコルおよびアルゴリズムが提供される。生細胞中のレシオメトリックFRETの定量には、蛍光タンパク質のクロストーク(スペクトルスピルオーバー、またはブリードスルー)の決定だけでなく、顕微鏡セットアップの検出効率も必要です。ここで提供されるプロトコルは、これらの重要なパラメータを評価する方法を詳述しています。
概要
フェルスター共鳴エネルギー移動(FRET)の顕微鏡ベースの分析により、生細胞内のタンパク質間の相互作用の評価が可能になります。これは、細胞内のどこで、どの細胞内コンパートメントで相互作用が起こるか、そしてこの相互作用が時間とともに変化するかどうかに関する情報を含む、空間的および時間的情報を提供する。
テオドール・フェルスターは1948年にFRETの理論的基礎を築きました1。FRETは、励起ドナーからアクセプター分子への無放射エネルギー伝達であり、分子の距離と遷移双極子の相対配向、およびドナー発光スペクトルとアクセプター吸収スペクトルの重なりに依存します。エネルギー伝達率は、ドナー - アクセプター距離の6乗に反比例する。したがって、FRETは、1〜10nmの範囲の分子近接を測定するために使用することができる。
FRETは、ドナー分子の他の脱励起プロセスと競合し、アクセプターのいわゆるドナー消光および感作放出をもたらす。ドナー消光は放出されたドナー光子の数の減少であり、増感放出は放出された受容体光子の増加である。多くの顕微鏡FRET分析では、アクセプター光退色2、ドナー光退色2、またはアクセプター3のFRET増感光退色などの蛍光強度測定が使用されます。
ここでは、レシオメトリックFRETと呼ばれることが多いドナークエンチングおよびアクセプター感作発光4,5を使用してFRETを定量化するための段階的な実験プロトコルおよび数学的アルゴリズムが提示される。増感発光を近似する方法に関する多くのプロトコルが公開されているが、絶対FRET効率を定量化したものはほとんどない6、7、8、9。生細胞におけるFRET効率の定量化には、(i)蛍光タンパク質のクロストーク(スペクトルスピルオーバー、またはブリードスルー)と、(ii)顕微鏡セットアップの検出効率を決定する必要があります。クロストークは、蛍光色素の1つだけを発現する細胞をイメージングすることによって評価することができますが、ドナーおよびアクセプター蛍光の相対的な検出効率の評価はより複雑です。測定されたシグナルを生じさせるドナー分子とアクセプター分子の数の少なくとも比の知識が必要です。しかし、生細胞で発現する蛍光色素の数は細胞ごとに異なり、不明です。いわゆるα因子は、単一の励起ドナーおよびアクセプター分子からの相対的なシグナル強度を特徴付ける。この因子の知識は、蛍光タンパク質を用いた生細胞イメージング中に遭遇するような、受容体とドナーの分子比が変化するサンプルにおける定量的レシオメトリックFRET測定の前提条件です。1対1のドナー-アクセプター融合タンパク質をキャリブレーションプローブとして使用することで、α因子の測定が可能になり、ポジティブコントロールとしても機能します。この遺伝的に結合されたプローブは、未知の総量で細胞によって発現されるが、1対1の固定された既知の相対量で発現される。次のプロトコルは、1-to-1プローブの構築方法と、FRET効率の定量化に使用する方法を示しています。すべての数式を含むスプレッドシートは補足にあり、以下に概説するように、読者がそれぞれの列に独自の測定値を入力するために使用できます。
プロトコルはGFP-Cherryドナー/アクセプターペアを使用しますが、提示されたアプローチは他の任意のFRETペアで実行できます。 補足ファイル1 は、シアンとイエローのペアの詳細を提供します。
プロトコル
1. プラスミド構築
- eGFP-mCherry1融合プローブの作製には、制限部位AgeIおよびBsrGIを用いてmCherry110を挿入したN1哺乳類細胞発現ベクター(材料の表を参照)を使用します。
- 以下のオリゴヌクレオチドを使用して、終止コドンなしでeGFP11 を SalI-BamHI フラグメントとして増幅します:N末端プライマー5'-AAT TAA CAG TCG ACG ATG GTG AGC AAG GGC GAG G 3'およびC末端プライマー5'-AAT ATA TGG ATC CCG CTT GTA CAG CTC GTC CAT GC 3'。
- この SalI-BamHI フラグメントをN1ベクターのマルチクローニングサイトに挿入し、緑色蛍光タンパク質と赤色蛍光タンパク質の間にRNPPVリンカー(5アミノ酸)リンカーを導入します。
注:このリンカーは、GFP-Cherryドナー-アクセプターペアの平均FRET効率が約0.25 -0.3になります(図1A)。測定されたFRET効率をスケーリングするために、さまざまな長さの硬い12 およびらせん状の13 リンカーを選択することは、他の場所で議論されていますが、融合タンパク質の目的には必要ありません。今後は、簡単にするために、蛍光タンパク質を「GFP」および「チェリー」と呼びます。
2. 細胞培養とトランスフェクション
- フェノールレッドを含まない ダルベッコ改変イーグル培地(DMEM)などの培地でのFRET実験には、NRK細胞などの任意の細胞株を使用して、バックグラウンド蛍光を低減します。同じ理由で、フェノールレッド遊離トリプシンの使用が推奨されます。
- 細胞が80%コンフルエントになったら、1 mLの0.05%トリプシン-EDTAで細胞を剥離し、ノイバウアーチャンバーを使用して懸濁液中の細胞数を数え、8ウェルチャンバーカバーガラスのウェルあたり約10,000細胞を播種します。あるいは、T25フラスコで増殖させたコンフルエントな細胞培養物から、2 mLピペットからの細胞懸濁液1滴、またはT12.5細胞培養フラスコで増殖させたコンフルエント培養液からの5mL細胞懸濁液から3滴を使用します。
- 標準的な細胞培養条件(37°Cおよび5%CO2)での蛍光生細胞顕微鏡用の#1.0カバーガラスを備えた8ウェルチャンバー(0.8 cm2 /ウェル)で細胞を増殖させます。
- プレーティングから24時間後に、適切な市販のトランスフェクション培地( 材料の表を参照)を使用して、GFP、チェリー、GFP/チェリーミックス(1:1ミックス、すなわち、0.8 μgおよび0.8 μgのGFPおよびチェリープラスミドDNA)、およびGFP-チェリーキメラを使用して細胞をトランスフェクションします。
- トランスフェクションには、45 μLのDMEMおよび1.6 μgのプラスミドDNA中の5 μLのトランスフェクション試薬を使用します。マイクロ遠心チューブを軽くフリックして攪拌します。
- 室温で15分間インキュベートした後、トランスフェクション試薬混合物を8ウェルチャンバースライドの各ウェルに1〜2 μL加えます。チャンバーカバーガラスをインキュベーターに戻します。
- トランスフェクション後20時間経過してから生細胞イメージングを行い、特に赤色蛍光色素の適切な蛍光タンパク質の発現、フォールディング、成熟を可能にします。
3. FRETイメージング
- 37°Cで加湿および加熱された環境チャンバー内で細胞をトランスフェクトして画像化する。 細胞培地を生理的pHで緩衝するには、5%フローに設定されたCO2 ガスを使用するか、20 mM HEPESを添加して細胞培地をCO2非依存性にします。
- 共焦点レーザー走査型顕微鏡を使用してください。励起と放射を次のように設定して、信号を最適化し、クロストークを最小限に抑えます。
- アルゴンイオンレーザーの488nmラインを使用してGFPを励起し、561nmダイオード励起固体レーザー(または利用可能なレーザーラインに応じて543nmヘリウムネオンレーザー)を使用してチェリーを励起します。
- 市販の共焦点顕微鏡のソフトウェアで以下を設定します。 ダイクロイックミラー を488/561に設定するには、プルダウンメニューを使用してボタンをクリックします。チャンネル1では505 - 530 nm(または505 - 550 nm)の発光帯を介して励起するには488 nmのレーザー光を使用して蛍光を収集し、チャンネル2ではロングパスフィルター>585 nmで励起し、チャンネル3では585 nmのロングパス>フィルター(波長タイプ)で励起に561 nmのレーザー光を使用します。バンドパスフィルター、例えば、590〜650nmまたは同様のものも使用でき、ラマン散乱を排除するという利点があります。
- 2つのレーザーを順番に励起し、イメージングモードを 各ラインの後に切り替え に設定して、512 x 512ピクセル画像の励起が各ラインの後に交互になるようにします(各フレームの後ではなく、異なる励起で画像を記録している間、標識タンパク質の拡散によるFRETを検出する機能を廃止します;ボタンをクリックします)。
- ボタンクリックで3つの画像のミニ時系列を設定し、著しい光退色が発生するかどうかを検出し、レーザー出力を低下させる可能性があります。1%未満の光退色が最適である。高いレーザ強度はまた、見かけのFRET効率を低下させる吸収飽和をもたらし得る14。対物レンズで測定された最大10〜20μWのレーザー出力は安全に使用できます。
- まず、GFP-Cherry融合構築物を発現する細胞を画像化する。共焦点画像のピクセルあたりの時間積分レーザー強度を定義するパラメーター、つまりマイクロ秒単位のピクセル滞留時間、パーセント単位の音響光学チューナブルフィルター(AOTF)透過率、およびズームを設定します。
- 63 倍のオイル対物レンズを使用し、 ズーム を 3 倍に設定してセルを画像化します。これにより、細胞全体を画像化するのに十分な倍率と解像度が得られます。70〜80nmのピクセルサイズを目指します。
- ピクセル滞留時間を2〜4μsに設定し、488nmおよび561nmレーザーのAOTF透過率を設定して、画像が漂白されず、蛍光強度の飽和を示すピクセルがない良好な信号対雑音比を持つようにします。488および561のレーザ出力を、チャネル1およびチャネル3の信号レベルが類似するように調整することは有利である。
- 光電子増倍管(平均化モード)ゲインを600〜800に設定します。
- これらの設定で15〜20個の細胞がGFP-Cherry融合タンパク質を発現する画像。15〜20個のセルは、FRET測定セッションの合計時間を数時間に制限しながら、良好な統計を提供し、顕微鏡セットアップの安定性を確保します。
- GFP、チェリー、GFPおよびチェリーを発現する細胞および非トランスフェクト細胞を同じ設定で画像化する。緑チャンネルまたは赤チャンネルでそれぞれ発現細胞を検索します。
- 次に、GFPおよびCherryにそれぞれ結合した目的のタンパク質を共発現する15〜20個の細胞を画像化する。発現細胞を探索し、蛍光タンパク質を漂白しないように細胞の長時間暴露を避ける。チェリーはGFPよりも光安定性が低く、アクセプターであるチェリーを漂白するとFRET分析が損なわれます。
注:GFPとチェリーの吸収スペクトルと発光スペクトルを 補足図1に示します。5〜6時間測定した後、イメージングセッションの最後にGFP-Cherryキメラを発現するいくつかの細胞のイメージングを繰り返して、セットアップが安定し、検出されたFRET効率を文書化することをお勧めしますイメージングセッションの過程でGFP-Cherry融合タンパク質のFRET効率は有意に変化しませんでした。
4. ドナークエンチングと増感発光を用いたFRET絶対効率検出のための画像解析
注:ここでは、添付のスプレッドシート(補足ファイル2)を使用してFRET効率を決定する方法に関する実用的なステップバイステップガイドを提供します。提示された方程式の理論および導出は、以前の出版物4、15、16、17に詳細を見出すことができる。記載された設定では、以下の蛍光強度が収集される。
- チャネル1、ドナーチャネルのドナーシグナルI1を、488 nmの励起と505〜530 nmの発光帯で測定します。
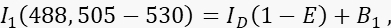
ここで、IDはアクセプターがない場合に測定されるチャネル1の消光されていないドナー信号、は平均FRET効率、B 1はチャネル1の平均バックグラウンド信号です。 - アクセプターチャネルであるチャネル3のアクセプターシグナルI3を、>585 nmで561 nmの励起と発光で測定します。
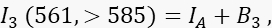
ここで、IAはアクセプタ信号、B 3はチャネル3のバックグラウンドです。 - 転送チャネルであるチャンネル2のFRET信号を、>585nmで488nmの励起と発光で測定します。
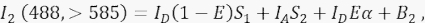
ここで、チャネル2の信号は、4つの異なる成分の合計である:(i)ID(1 - E)S 1は、消光されたドナー信号から>585検出チャネルへのスペクトルスピルオーバー(クロストーク係数S1を使用)であり、(ii)IAS2は、488nmの光による直接励起からのアクセプター信号である(クロストーク係数S2を有する)、 (iii)IDEαは、励起ドナー分子からのFRETによるアクセプターの感作放出であり(α 4.8〜4.10でさらに詳述する)、(iv)B2はバックグラウンドシグナルである。 - 非トランスフェクト細胞またはモックトランスフェクト細胞のチャネル1、2、3の平均バックグラウンド強度を測定します。どちらもわずかな違いで問題ありません。すべての細胞測定では、フリーハンドツールを使用して関心領域を描写し、自家蛍光が増加した核周囲小胞を避けます。これらの核周囲小胞からの有意な自己蛍光を避けることが重要です。
- 提供されたスプレッドシートの列X、Y、およびZに測定値を入力します。3つのチャンネルの平均バックグラウンド強度は、Excelスプレッドシート(補足ファイル2)のA2、B2、およびC2に入力されます。
- GFPまたはCherryのみを発現する細胞のチャネル1、2、3の平均強度を測定し、測定値を列C、D、E、N、O、Pに入力します。
- Eを算出するために、FRET効率から、クロストーク係数S1及びS2を求める。スペクトルクロストーク因子S1は、GFPのみを発現する細胞から算出される。
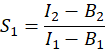
列Iで、 S1 の平均値をExcelスプレッドシートのセルD2に入力します。 - Cherryのみを発現する細胞からスペクトルクロストーク係数S2を計算する
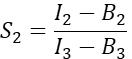
列Tに 、S2 の平均をExcelスプレッドシートのセルE2に入力します。 - α因子が、チャネル1内の任意の数の励起GFP分子からのシグナルを、チャネル2内の同数の励起チェリー分子のシグナルに関連付けることを確認し、次式で定義されます。
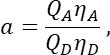

ここで、QAおよびQDはチェリーおよびGFPの蛍光量子収率である。ηAおよびηDは、それぞれチャネル2および1におけるアクセプターおよびドナー蛍光の検出効率を示す。
注:α因子は、GFPとチェリーの既知の絶対量を表す2つのサンプルから決定できます。しかし、細胞内で発現しているGFPとチェリーの正確な量を知ることは不可能です。そこで、GFP-Cherry融合タンパク質を発現する細胞を用いて因子を算出した。ここで、絶対量はまだ不明であるが、ドナー分子とアクセプター分子の比率は1であることが知られている。 - GFP-Cherry融合タンパク質を発現する細胞のチャネル1、2、3の平均強度を測定し、測定値をカラムAE、AF、AGに入力します。バックグラウンド強度が差し引かれます(AH、AI、AJ)。
- GFP-Cherry融合タンパク質のチャネル1、2、および3の蛍光強度からα係数(AJカラム)を次のように計算します。
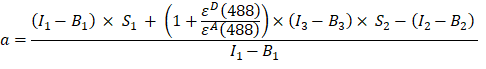
- チャネル1(I1−B1)、2(I2−B2)および3(I3−B3)でそれぞれ測定されたバックグラウンド補正強度は、GFP−チェリーキメラを用いて測定される。 スペクトルクロストーク因子S1は、GFPのみを発現する細胞を用いて決定した(4.7参照)。εDおよびεAは、488 nmにおけるドナーであるGFPと受容体であるチェリーの吸光係数であり、文献(ε GFP = 53,000 M-1 cm-1)18およびチェリー(εチェリー≈5560 M-1cm 1)の吸収曲線から決定できます。比率
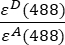 は、ExcelスプレッドシートのセルG2に入力されています。α係数の平均値をJ2に入力します。
は、ExcelスプレッドシートのセルG2に入力されています。α係数の平均値をJ2に入力します。 - 次のように、決定されたα係数を使用してFRET効率 Eを計算します(列AK)。
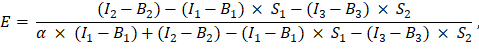
- あるいは、ネガティブコントロール、すなわちGFPとCherryの共発現とGFP単独の発現について、GFP-Cherry融合タンパク質測定の列AD、AE、およびAFのエクセルシートにチャネル1、2、および3の測定値を加算することにより、FRET効率 Eを決定します。同じ方法で、目的のGFPとチェリー標識タンパク質間のFRET効率を測定します。
- 消光されていないドナー強度を(I 1 - B 1)/(1 - E)として決定し、アクセプター強度をIA = I 3 - B3として決定します。これらの値は、タグ付きタンパク質の発現レベルに比例する。
- GFP-Cherry融合タンパク質の補正されたアクセプター対ドナー強度比(Q)を以下のように決定します(列AL):

- 他の共トランスフェクト細胞については、アクセプターとドナーの分子比N A/NDを次のように計算します。
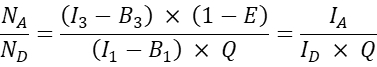
注:N A / N D比を決定し、平均セルラーFRET効率E対N A / N Dをプロットする理論的根拠は、1つのドナー分子が複数のアクセプターにエネルギーを伝達できるのに対し、アクセプター分子は特定の時間に1つのドナーからしかエネルギーを受け取ることができないということです。相互作用の化学量論のために1つのアクセプターのみがドナーと相互作用できる場合でも、アクセクター濃度の増加は、質量作用の法則のためにアクセクターと複雑なドナーの割合を増加させると予想されます。したがって、固定された(または狭い範囲の)ドナー発現の場合、FRET効率はN A/N Dの増加とともに上昇するはずです。しかし、GFPとチェリーの共発現、すなわちネガティブプローブのFRET効率E対N A / N Dをプロットする場合、N A / N Dの増加はFRET効率の増加をもたらさないはずです(少なくとも、ドナー色素へのアクセプター色素の近傍によるランダムなFRETが発生しない十分に低いアクセプター濃度)。
結果
図1は、ドナーチャネル、チャネル1(488、505〜530nm)、転送チャネル、チャネル2(488、>585nm)、およびアクセプターチャネル、チャネル3(561、>585nm)で得られた画像をそれぞれ示す。GFPのみ、チェリーのみ、GFPとチェリーを共発現し、GFP-Cherry融合タンパク質を発現する細胞の代表的な画像。GFP-Cherry融合タンパク質を発現するNRK細胞(陽性対照、図2A)およ?...
ディスカッション
提示されたプロトコルは、共焦点顕微鏡によるアクセプターの感作放出の検出およびドナー分子の消光を使用してFRETを定量するための遺伝的に結合された1対1の蛍光タンパク質較正プローブの使用を詳述している。この方法は、異なる細胞内区画における生細胞の生理学的状況におけるタンパク質相互作用を評価するために適用することができる。空間分解能は、提示されたアルゴリズムを?...
開示事項
著者は開示するものは何もありません。
謝辞
このプロジェクトに機器とスペースを提供してくれたスタンフォード大学医学部の神経科学イメージングサービスに感謝します。この研究は、スタンフォードがん研究所とスタンフォード婦人科腫瘍学部門の学内資金、およびハンガリー国立研究開発イノベーションオフィスのGINOP-2.3.2-15-2016-00026、GINOP-2.3.3-15-2016-00030、NN129371、ANN135107によってサポートされました。
資料
| Name | Company | Catalog Number | Comments |
| 0.5% Trypsin-EDTA without phenol red (10x) | Thermo Fisher Scientific | 15400054 | |
| Clontech mCherry N1 vector | Addgene | 3553 | |
| DMEM without phenol red | Thermo Fisher Scientific | 11054020 | |
| Fugene 6 | Promega | E2691 | |
| HEPES | Thermo Fisher Scientific | 15630080 | |
| LabTek 8-well chambers #1.0 | Thermo Fisher Scientific | 12565470 | |
| L-Glutamine (200 mM) | Thermo Fisher Scientific | 25030081 |
参考文献
- Förster, T. Zwischenmolekulare Energiewanderung und Fluoreszenz. Annal der Physik. 437, 55-75 (1948).
- Jovin, T. M., Arndt-Jovin, D. J. Luminescence digital imaging microscopy. Annual Review of Biophysics and Biophysical Chemistry. 18, 271-308 (1989).
- Mekler, V. M. A photochemical technique to enhance sensitivity of detection of fluorescence resonance energy transfer. Photochemistry and Photobiology. 59, 615-620 (1994).
- Vamosi, G., et al. Conformation of the c-Fos/c-Jun complex in vivo: A combined FRET, FCCS, and MD-modeling study. Biophysical Journal. 94 (7), 2859-2868 (2008).
- Renz, M., Daniels, B. R., Vamosi, G., Arias, I. M., Lippincott-Schwartz, J. Plasticity of the asialoglycoprotein receptor deciphered by ensemble FRET imaging and single-molecule counting PALM imaging. Proceedings of the National Academy of Science U. S. A. 109 (44), 2989-2997 (2012).
- van Rheenen, J., Langeslag, M., Jalink, K. Correcting confocal acquisition to optimize imaging of fluorescence resonance energy transfer by sensitized emission. Biophysical Journal. 86 (4), 2517-2529 (2004).
- Muller, S. M., Galliardt, H., Schneider, J., Barisas, B. G., Seidel, T. Quantification of Forster resonance energy transfer by monitoring sensitized emission in living plant cells. Frontiers in Plant Sciences. 4, 413 (2013).
- Gates, E. M., LaCroix, A. S., Rothenberg, K. E., Hoffman, B. D. Improving quality, reproducibility, and usability of FRET-based tension sensors. Cytometry Part A. 95 (2), 201-213 (2019).
- Menaesse, A., et al. Simplified instrument calibration for wide-field fluorescence resonance energy transfer (FRET) measured by the sensitized emission method. Cytometry Part A. , 24194 (2020).
- Shaner, N. C., et al. Improved monomeric red, orange and yellow fluorescent proteins derived from Discosoma sp. red fluorescent protein. Nature Biotechnology. 22 (12), 1567-1572 (2004).
- Cormack, B. P., Valdivia, R. H., Falkow, S. FACS-optimized mutants of the green fluorescent protein (GFP). Gene. 173, 33-38 (1996).
- Nagy, P., et al. Novel calibration method for flow cytometric fluorescence resonance energy transfer measurements between visible fluorescent proteins. Cytometry Part A. 67 (2), 86-96 (2005).
- Arai, R., Ueda, H., Kitayama, A., Kamiya, N., Nagamune, T. Design of the linkers which effectively separate domains of a bifunctional fusion protein. Protein Engineering. 14 (8), 529-532 (2001).
- Szendi-Szatmari, T., Szabo, A., Szollosi, J., Nagy, P. Reducing the detrimental effects of saturation phenomena in FRET microscopy. Analytical Chemistry. 91 (9), 6378-6382 (2019).
- Tron, L., et al. Flow cytometric measurement of fluorescence resonance energy transfer on cell surfaces. Quantitative evaluation of the transfer efficiency on a cell-by-cell basis. Biophysical Journal. 45 (5), 939-946 (1984).
- Sebestyen, Z., et al. Long wavelength fluorophores and cell-by-cell correction for autofluorescence significantly improves the accuracy of flow cytometric energy transfer measurements on a dual-laser benchtop flow cytometer. Cytometry. 48 (3), 124-135 (2002).
- Szaloki, N., et al. High throughput FRET analysis of protein-protein interactions by slide-based imaging laser scanning cytometry. Cytometry Part A. 83 (9), 818-829 (2013).
- McRae, S. R., Brown, C. L., Bushell, G. R. Rapid purification of EGFP, EYFP, and ECFP with high yield and purity. Protein Expression and Purification. 41 (1), 121-127 (2005).
- Kremers, G. J., Goedhart, J., van Munster, E. B., Gadella, T. W. Cyan and yellow super fluorescent proteins with improved brightness, protein folding, and FRET Forster radius. Biochemistry. 45 (21), 6570-6580 (2006).
- Bajar, B. T., Wang, E. S., Zhang, S., Lin, M. Z., Chu, J. A Guide to Fluorescent Protein FRET Pairs. Sensors (Basel). 16 (9), (2016).
- Scott, B. L., Hoppe, A. D. Optimizing fluorescent protein trios for 3-Way FRET imaging of protein interactions in living cells. Science Reports. 5, 10270 (2015).
- Chen, Y. C., Spring, B. Q., Clegg, R. M. Fluorescence lifetime imaging comes of age how to do it and how to interpret it. Methods Molecular Biology. 875, 1-22 (2012).
- King, C., Sarabipour, S., Byrne, P., Leahy, D. J., Hristova, K. The FRET signatures of noninteracting proteins in membranes: Simulations and experiments. Biophysical Journal. 106 (6), 1309-1317 (2014).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved