Method Article
Ultrason Tetiklenen İlaç Salınımı için Floresan Etiketli Mikrobubbles'ın Karakterizasyonu için Çok Zamanlı Mikroskopi Yöntemleri
Bu Makalede
Özet
Sunulan protokoller, aktivasyon mekanizmaları ve biyoeffeksleri de dahil olmak üzere ultrason tetiklenen ilaç dağıtım uygulamaları için tasarlanmış floresan etiketli mikrobubbles'ın yanıtını karakterize etmek için kullanılabilir. Bu makale, ilgili uzunluk ve zaman ölçeklerini yakalamak için gerçekleştirilen bir dizi in vitro ve in vivo mikroskopi tekniğini kapsamaktadır.
Özet
Mikrobubble kontrast ajanlar ultrason ile ilaç dağıtım uygulamaları için büyük umut tutar. Nanopartiküllerde ilaçların kapsüllenerek sistemsel toksisitesi azaltır ve ilaçların dolaşım süresini artırır. Mikrobubble destekli ilaç dağıtımına yeni bir yaklaşımda, nanopartiküller mikrobubble kabuklarına dahil edilir ve ultrason ile nanopartikül yükünün lokal ve tetiklenmiş salınımını sağlar. Geniş ultrason parametre alanı içindeki serbest bırakma mekanizmalarının kapsamlı bir şekilde anlaşılması, verimli ve kontrollü salınım için çok önemlidir. Sunulan bu protokoller kümesi, floresan etiket içeren bir kabuk içeren mikrobubbles için geçerlidir. Burada, modifiye Nil Kırmızısı boya ile doped polimerik nanopartiküller ile poli (2-etil-butil siyanoakrilat) ile yüklü mikrobubbles üzerinde durulmaktadır. Parçacıklar denatüre kazein kabuğu içinde sabitlenir. Mikrobubbles güçlü karıştırma ile üretilir, kazein ve nanopartiküller içeren sıvı fazda perfloropropan gazının bir dağılımı oluşturur, daha sonra mikrobubble kabuğu kendiliğinden bir araya toplanır. Nanopartikül stabilize mikrobubbles nanopartikül salınım sürecinin tüm ilgili zaman ölçeklerinde karakterize etmek için çeşitli mikroskopi teknikleri gereklidir. Nanopartiküllerin floresan, tek mikrobubblelerin konfokal görüntülemesini sağlar ve kabuk içindeki parçacık dağılımını ortaya çıkarır. Saniyede 10 milyon kare hızında parlak alan mikroskopisi kullanılarak in vitro ultra yüksek hızlı görüntüleme, ultrason inzomasyonuna yanıt olarak kabarcık dinamikleri hakkında fikir sağlar. Son olarak, kabarcık kabuğundan nanopartikül salınımı, saniyede 500.000 karede gerçekleştirilen floresan mikroskopisi ile en iyi şekilde görselleştirilir. İlaç dağıtımını in vivo olarak karakterize etmek için, vaskültür içindeki nanopartiküllerin tetiklenen salınımı ve endotel tabakasının ötesindeki ekstravazasyonu, dorsal cilt kat pencere odalarına yerleştirilen tümörlerde intravital mikroskopi kullanılarak, birkaç dakikalık bir zaman ölçeğinde incelenir. Bu tamamlayıcı karakterizasyon tekniklerinin kombinasyonu, mikrobubbles'ın davranışı ve hem in vitro hem de in vivo olmak üzere çeşitli zaman ve uzunluk ölçeklerinde yük salınımı hakkında benzersiz bir içgörü sağlar.
Giriş
Ultrason en yaygın kullanılan tıbbi görüntüleme tekniğidir. İstilacı olmayan, hızlı, güvenli, uygun maliyetli ve taşınabilir1,2,3'dür. Bununla birlikte, kan zayıf bir ultrason saçılımcısıdır ve kan havuzunun kontrastı ultrason kontrast ajanlarının intravenöz enjeksiyonu ile arttırılabilir3. Bu gelişmiş kan havuzu kontrastı, örneğin koroner arter hastalığı4 ve metastatik karaciğer hastalığının tespitinde tanı amaçlı organ perfüzyonunun nicelleştirilmesini sağlar5. Nitekim tümör vaskülatlarının önemli bir prognostik faktör olduğu kanıtlanmıştır6. Büyük bir araştırma çabası artık mikrobubble destekli, hedefli moleküler görüntüleme ve terapötik kullanım için kontrast ajanlarına yöneliktir.
Piyasada bulunan ultrason kontrast ajanları tipik olarak 1 μm ila 10 μm9 arasında değişen çaplara sahip kaplamalı mikrobubbles7,8 süspansiyonundan oluşur. Ultrason kontrast maddesi mikrobubbles kırmızı kan hücrelerinden biraz daha küçük olduğundan7, mikrobubbles bir tıkanıklık oluşturmadan en küçük kılcal damarlara bile güvenle ulaşabilir3. Mikrobubbles, sıkıştırılabilir gaz çekirdeği nedeniyle doku10'a kıyasla önemli ölçüde artmış ultrason gerilme katsayısına sahiptir11. Ayrıca, mikrobubble eko son derece doğrusal değildir, yani spektrumu sürüş frekansının harmoniklerini ve altharmoniklerini içerir. Ek olarak, yankı gücü kabarcık12'nin rezonans tepkisine bağlıdır. Doku sadece doğrusal olarak dağılırken, harmonik görüntülemede yüksek algılama hassasiyeti elde etmek için az sayıda mikrobubble yeterlidir13,14. Bu doğrusal olmayan kontrast üretimi, gövdedeki tek kabarcıkları izlemek için bile yeterince güçlü olabilir15.
Ultrason kontrast maddesinin kabuğu, kabarcıkları çözünme ve birleşmeye karşı stabilize eder, böylece kan havuzundaki dolaşım sürelerini arttırır16. Kabuk lipitler, polimerler veya denatüre proteinlerden oluşabilir3,8. Irklararası gerilimi azaltır, böylece Laplace basınç güdümlü çözünmenin etkisini sınırlar17 ve gaz difüzyona karşı dirençli bir bariyer oluşturur18. Stabiliteyi daha da artırmak için, kontrast mikrobubbles tipik olarak kanda düşük çözünürlüğe sahip yüksek moleküler ağırlıklı bir gazla doldurulur11. Mikrobubble kabuğu, mikrobubbles ultrason insonation11 tepkisini önemli ölçüde değiştirir. Kaplamasız gaz kabarcıkları, boyutlarıyla ters orantılı karakteristik bir rezonans frekansı vardır ve lipid kaplamanın eklenmesi, kabuğun iç sertliği nedeniyle kaplamasız bir buble ile ilgili olarak rezonans sıklığını arttırır3. Ayrıca, kabuk, kaplamalı kabarcıklar için baskın sönümleme kaynağını oluşturan dilatasyonal viskozite yoluyla enerjiyi dağıtır3. Stabilize edici kabuk, örneğin ligandları mikrobubbles yüzeyine bağlayarak işlevselleştirilebilmesi için ek avantaja sahiptir. Bu hedefleme, bu kabarcıklar için birçok uygulama ve özellikle ultrason14,19 ile moleküler görüntüleme sağlar.
Mikrobubble kontrast ajanlar ultrason ile ilaç dağıtım uygulamaları için büyük umut tutar. Bir kan damarının hapsedilmesinde salınan mikrobubbles, kılcal duvarda mikroakunlamanın yanı sıra lokal normal ve kesme gerilmelerine neden olabilir3. Yüksek akustik basınçlarda, büyük genlik salınımları, atalet kavitasyonu olarak adlandırılan şiddetli bir süreçte mikrobubble çökmesine neden olabilir ve bu da kan damarının yırtılmasına veya invajinasyonuna yol açabilir20. Bu şiddetli fenomenler, sonopermeation21 gibi biyoeffect'leri teşvik edebilir ve terapötik ilaçların endotel duvarı boyunca paraselüler veya hücrelerarası olarak interstisyuma ekstravazasyonunu arttırabilir. Ayrıca, stroma bakımından zengin tümörlerin hücre dışı matrisi21,22 ve biyofilmler23,24 aracılığıyla terapötik ajanların penetrasyonunu artırabilir, ancak bu mekanizma hala iyi anlaşılmamıştır26.
Ultrason aracılı ilaç dağıtımı hem preklinik olarak27,28 hem de klinik çalışmalarda umut verici sonuçlar göstermiştir22. Ayrıca, nispeten düşük frekanslı ultrason (~1 MHz) ile kullanıldığında, mikrobubbles lokal ve geçici olarak kan-beyin bariyer geçirgenliğini artırmak için bildirilmiştir, böylece ilaçların beyin parankimine girmesini sağlar, hem klinik öncesi hem de klinik çalışmalarda29,30,31,32,33,34.
Ultrason aracılı ilaç dağıtımına genellikle iki yaklaşım vardır: terapötik malzeme kabarcıklarla birlikte uygulanabilir veya kabarcık kabuğuna takılabilir veya yüklenebilir28,35,36. İkinci yaklaşımın ilaç teslimatı açısından daha verimli olduğu gösterilmiştir37. Mikrobubbles, kabüğa bağlı nanopartiküllerde (lipozomlar veya polimerik nanokonstrüksiyonlar) kapsüllenmiş ilaçlar veya genetik materyalle yüklenebilir veya doğrudan mikrobubble kabuğuna dahil edilebilir35,36. Nanopartikül yüklü mikrobubbles yerel nanopartikül yükü serbest bırakmak için (odaklanmış) ultrason ile etkinleştirilebilir28,33,38,39,40. Böyle bir mikrobubble bir hücre ile doğrudan temas halindeyse, yükün sonoprinting34,35 adı verilen bir işlemde hücre sitoplazmik zarına bile biriktirilebileceği in vitro olarak gösterilmiştir.
Mikrobubble inzozyonu için ultrason parametre alanı geniştir ve in vivo biyolojik koşullar daha da karmaşıklık ekler. Bu nedenle, odaklanmış ultrason ve nanopartikül yüklü mikrobubbles kombinasyonu hedeflenen terapötikler alanında bir zorluk teşkil eder.
Bu çalışmanın amacı, ultrason parametrelerinin bir işlevi olarak mikrobubbles'ın yanıtını ayrıntılı olarak görüntüleyebilecek protokoller sağlamak ve floresan etiketli kabuk malzemesinin kabuk yırtılmasına ve daha sonra salınmaya yol açan mekanizmaları incelemektir. Bu protokoller kümesi, floresan boya içeren kabuklu mikrobubbles için geçerlidir. Şekil 1, SINTEF'te (Trondheim, Norveç) geliştirilen polimerik-nanopartikül ve protein stabilize mikrobubbles şematik bir temsilini göstermektedir. Bu kabarcıklar perfloropropan gazı (C3F8) ile doldurulur ve kabuğu stabilize eden nanopartiküller Nil Kırmızısı floresan boyasının lipofilik bir türevi olan NR668 içerir38,43. Nanopartiküller poli (2-etil-butil siyanoakrilat) (PEBCA) oluşur ve PEGylated. Polietilen glikol (PEG) ile fonksiyonelleştirme, mononükleer fagosit sistemi tarafından opsonizasyon ve fagositozu azaltır, böylece dolaşım süresini uzatır14,44. Sonuç olarak, PEGylation hedef bölgeye ulaşan nanopartikül miktarını arttırır, böylece tedavinin etkinliğini artırır16. Şekil 2, dört mikroskopi yönteminin kullanılmasının araştırmacıların ilgili tüm zaman ve uzunluk ölçeklerini kapsamasına nasıl izin verdiğini göstermektedir. Optik mikroskopide elde edilebilen mekansal çözünürlüğün, hedefin ışık ve sayısal diyaframının (NA) dalga boyu ve nesne aydınlatma kaynağınınkine bağlı olan kırınım sınırına göre belirlendiği belirtilmelidir45. Eldeki sistemler için optik çözünürlük sınırı genellikle 200 nm'dir. Ayrıca, hücre içi mikroskopi hücre altı seviye46'da görüntü almak için kullanılabilir. Bu çalışmada kullanılan nanopartikül ve protein stabilize mikrobubbles için, intravital mikroskopi ile ilgili minimum uzunluk ölçeği küçük kılcal damarların büyüklüğüdür (≥10 μm). Tek mikrobubbles için in vitro yüksek hızlı optik görüntüleme (saniyede 10 milyon kare) ve yüksek hızlı floresan görüntüleme (saniyede 500.000 kare) deneyleri tanımlanmıştır. Nanosaniye zaman ölçeklerinde yüksek hızlı parlak alan görüntüleme, titreşimli kabarcıkların zaman çözümlenmiş radyal dinamiklerini incelemek için uygundur. Buna karşılık, yüksek hızlı floresan mikroskopisi, floresan etiketli nanopartiküllerin salınımının doğrudan görselleştirilmesini sağlar. Ayrıca, mikrobubble kabuğunun yapısı Z-yığını üç boyutlu (3D) konfokal mikroskopi ve tarama elektron mikroskopisi kullanılarak incelenebilir (ikincisi için protokol mevcut çalışmaya dahil değildir). İntravital mikroskopi, lokal kan akışı ve vivo47'deki floresan etiketli nanopartiküllerin akıbeti hakkında gerçek zamanlı bilgi sağlamak için dorsal pencere odalarında büyüyen tümörleri görüntülemek için multifotoğraf mikroskopisinin kullanılmasından oluşur. Bu mikroskopi yöntemlerinin kombinasyonu sonuçta hem in vitro hem de in vivo ultrason yanıt terapötik mikrobubble ajanlarının davranışı hakkında ayrıntılı bilgi sağlar.
Protokol
NOT: Tüm deneysel prosedürler Norveç Hayvan Araştırma Otoriteleri tarafından onaylanmıştır. Protokolde kullanılan malzemelerin detaylarına Malzeme Tablosundan ulaşabilirsiniz.
1. Mikrobubbles üretimi
NOT: Bu çalışmada, ilgi çekici mikrobubbles protein ve nanopartikül stabilize mikrobubbles, hangi üretim protokolü daha önce tanımlanmıştır 28,33,48. Bu nedenle, fabrikasyon protokolü burada kısaca özetlenmiştir.
- İlk olarak, bir pipet kullanarak, ultra saf suyu fosfat tamponlu salin (PBS) içinde kazein% 0.5 wt ile karıştırın ve floresan boyanın% 0.21 wt'si ile etiketlenmiş nanopartiküllerin% 1 wt'si, NR668 (modifiye Nil Kırmızısı), steril bir cam crimp üst şişesinde (10 mL, 2 cm çapında). Polimerik nanopartiküller, Mørch ve ark. 38.
NOT: Burada, boya nanopartikül salınımının görselleştirilmesini sağlamak için bir model ilaç olarak işlev görüyor. Nanopartikül çözeltisi ile çalışırken laboratuvar önlüğü, gözlük ve eldiven giyin. Nanopartikül çözeltisinin dökülmelerini hemen % 100 aseton ile silin. - Şişeyi kauçuk kapakla kaplayın, hafifçe karıştırın ve olası agregaları ortadan kaldırmak için şişeyi oda sıcaklığında 10 dakika ultrasonik bir banyoya yerleştirin. Cam şişenin altından karıştırıcının ucu ~0,5 cm olacak şekilde bir dispersiyon aleti yerleştirin. Gaz kabına bağlı bir cam pipet kullanarak, çözelti hafifçe köpürmeye başlayana kadar perfloropropan gazı çözeltiyi içeren şişenin baş boşluğuna ekleyin.
NOT: Karıştırma sırasında cam şişenin kaymasını önlemek için dispersiyon aracının tabanının etrafına kendiliğinden sızdırmazlık filmi sarın. - Dispersiyon aracını kullanarak çözeltiyi 1935 × g'da (3 mm dönüş yarıçapı ile 24.000 rpm) 4 dakika boyunca kuvvetlice karıştırın. Şişeyi kauçuk kapakla kapatın ve daha fazla kullanım için şişeyi kapatın.
NOT: Karıştırma sıvıdaki gazı tuzağa çevirir. Mikrobubble kabuğu daha sonra aktif bir adım gerektirmeden kendiliğinden bir araya toplanır. - Fazla kazein ve nanopartikül çözeltisini 4 °C'de saklayın ve dispersiyon aletini% 100 asetonla temizleyin.
2. Tek kabarcıkları görüntüleme
- Konfokal mikroskopi
- Numune hazırlama
- Kabarcık çözeltisini tek mikrobubbles görüntüsüne aşağıdaki gibi seyreltin. Bölüm 1'de açıklanan prosedürü izleyerek üretilen mikrobubbleleri içeren cam bir sıkma üst şişesine bir havalandırma iğnesi (19 G-21 G) yerleştirin. Büyük kabarcıkların şişenin mühründen uzaklaşmasını sağlamak için şişeyi ters çevirin.
- Şişe hala baş aşağıyken, şişeye küçük (~1 mL) bir şırınganın başka bir iğne ucunu (19 G) yerleştirin. Kabarcık süspansiyonunun az miktardaını çıkarın ve şırınnanın içeriğini bir sonraki adımda daha kolay pipetleme için küçük bir tüpe aktarın.
NOT: Çıkarılacak süspansiyonun hacmi doğrudan kabarcık süspansiyonunun türüne ve konsantrasyonuna bağlıdır. Bu durumda 0.2 mL çıkarıldı. - Pipet kullanarak, tek kabarcıklı görüntülemeyi etkinleştirmek için yaklaşık 2 × 105 ila 6 × 105 mikrobubbles / mL konsantrasyon elde etmek için filtrelenmiş PBS'deki mikrobubble süspansiyonunu (bölüm 1'den) seyreltin.
NOT: Kabarcık tipine bağlı olarak, serbest floresan boyayı çıkarmak için kabarcık süspansiyonunun yıkanması önerilir. Bu, özellikle floresan boyanın kabuğuna aşıladığı kabarcıklarla önemlidir. Kabarcıkları yıkamak için kabarcık süspansiyonunu seyreltin (örneğin, 10 mL PBS'de kabarcık çözeltisinin 100 μL'sini alarak) ve santrifüj (tipik olarak 100 × g'luk sıranın hızlarında). Son olarak, daha fazla analiz için mikrobubbles içeren süpernatantı bir pipetle çıkarın. Kalan çözelti serbest floresan parçacıklarını içerir ve atılabilir. Yıkama adımı gerektiği gibi tekrarlanmalıdır. - Ortamın viskozitesini artırmak ve Brownian hareketinin neden olduğu hareketi ortadan kaldırmak için karışıma gliserol ekleyin, aksi takdirde oldukça yavaş konfokal Z-stack görüntülemeye müdahale eder.
NOT: Gliserol miktarı, görüntülenmiş kabarcık türüne bağlıdır (burada, ~% 50). Bazı kabarcık türleri için gliserol stabilite üzerinde olumsuz bir etkiye sahip olabilir49. Ancak konfokal görüntüleme altında yaklaşık 30 dk'nın üzerindeki kabarcıklarda gözle görülür bir değişiklik gözlenmedi. Ayrıca gliserol mikrobubbles akustik tepkisini değiştirebilir ve bu nedenle sadece mikrobubbles insonified olmadığı görüntüleme yöntemleri ile kullanılabilir. - Mikrobubble süspansiyonu, kanal kaydırağı gibi optimum görüntüleme için ince duvarlara sahip bir odaya yerleştirin.
- Görüntüleme protokolü
- Konfokal mikroskobu açarak uygun bir hedef ve konfokal mikroskopi sırasında kullanmak için istenen lazer ve tarayıcıyı seçin.
NOT: Burada, 0,08 μm/piksel çözünürlük için 60x su daldırma hedefi kullanın ve kabarcık boyutuna bağlı olarak 256 x 256 piksel veya 128 x 128 piksellik bir bölgeyi görüntüleyin. Bu özel deneylerde 488 nm lazer ve Galvano tarayıcı kullanın. Emisyon dalga boyu floresan boyaya bağlıdır ve tipik olarak geniş banttır. - Parlak alanda bir mikrobubble bulun ve konfokal mikroskopiye geçin. Konfokal mikroskobun tarayacağı istenen üst ve alt düzlemleri ayarlayın. 3D yapısını gözlemlemek için bir Z yığını haline alın; Z yönünde 100 nm'lik bir adım boyutu kullanın.
- Konfokal mikroskobu açarak uygun bir hedef ve konfokal mikroskopi sırasında kullanmak için istenen lazer ve tarayıcıyı seçin.
- Numune hazırlama
- Parlak alan mikroskopisi
- Optik sistemin montajı
NOT: Şekil 3A'da parlak alan mikroskopi kurulumunun şematik gösterimi gösterilmiştir. Bozulmamış ultrason yayılımını sağlamak için, su banyosu iki açıklık içerir: biri ışık kaynağı ve diğeri ultrason dönüştürücü için. Optik sistem bir (modüler) mikroskop, yüksek hızlı bir kamera ve eşleşen optiklerden oluşur. Mikrobubble salınımları süresi tipik olarak 1 μs (1 MHz ultrason kullanılarak) sırasına göre olduğundan, kamera saniyede en az 5 milyon kare kare hızında kayıt yapmak üzere ayarlanmalıdır. Burada, kamera, daha yüksek harmonikler de dahil olmak üzere kabarcık dinamiklerinin tüm ayrıntılarını yakalamak için 256 kare (25,6 μs) için saniyede 10 milyon kare (256 x 400 piksel) kaydedecek şekilde ayarlanacaktır.- Mikroskopa uygun büyütme, çalışma mesafesi ve NA ile bir su daldırma hedefi takın.
NOT: Suyun kademeli buharlaşmasına rağmen istikrarlı bir çalışma mesafesi sağlamak için suya daldırma hedefi kullanılmıştır. Burada, 60x büyütme, 2 mm çalışma mesafesi ve 1 NA ile suya daldırma hedefi seçildi. - Aydınlatma için en az 1 kW tepe güç çıkışına sahip bir flaş ışığı ve mikroskop ile kamera arasında bir tüp lens kullanarak mümkün olduğunca az ortam ışığının yüksek hızlı kameranın sensörüne ulaşmasını sağlayın.
- Tek mikrobubbles odaklanmak ve gerçek zamanlı görüntüleme için optik ve akustik sistemin hizalanması için kısılabilir bir halojen ışık kaynağı kullanın.
- Mikroskopa uygun büyütme, çalışma mesafesi ve NA ile bir su daldırma hedefi takın.
- Akustik sistemin montajı
- Dönüştürücünün düzgün bir sarmal ve dalga formu ile sürülmesi için programlanabilir bir rasgele dalga biçimi jeneratörü ve bir güç amplifikatörü (56 dB kazanç) kullanın. Sinyali kontrol etmek için rastgele dalga biçimi üretecine bir osiloskop bağlayın. Şirket içinde yazılmış bir komut dosyası kullanarak gelen akustik basınç dalgasını programlamak için kişisel bir bilgisayarı rastgele dalga biçimi üretecine bağlayın.
- Optik ve akustik sistemleri senkronize etmek için ana tetikleyici olarak bir darbe/gecikme jeneratörü kullanın. Darbe/gecikme jeneratörü ve kamera yazılımındaki tetik gecikmelerini, ultrason dalgasının kabarcıklara ulaşmasını sağlamak için ultrason iletimi sonrasında kayıt 16 μs başlayacak şekilde ayarlayın. Kabarcık salınımları sırasında doğru aydınlatmayı sağlamak için kayıt başlamadan önce ışık kaynağını 1,5 μs tetikleyin (zamanlama diyagramı için Şekil 3B'ye bakın).
- Uygun bir merkez frekansa sahip uygun bir dönüştürücü seçin. Numune tutucu membranlarından yansımaları en aza indirmek ve duran dalga oluşumunu azaltmak için optik eksene göre bir açıda olacak şekilde su banyosunun bir açıklığı içine yerleştirin.
NOT: Burada, optik eksene göre 35° açıyla 2,25 MHz merkez frekansa, 1" odak mesafesine ve 0,75" eleman çapına sahip tek eleman odaklı daldırma dönüştürücü yerleştirildi. Transfer fonksiyonunun kalibrasyonunun akustik sistemde kullanılan amplifikatör kullanılarak gerçekleştirilmesi gerekir. Ultrason iletim frekansının bir fonksiyonu olarak fiber optik hidrofon kullanarak gerilim genliğinden dönüştürücünün basınç genliğine transfer işlevini kalibre edin.
- Numune tutucuyu seçme
- Optik ve akustik olarak şeffaf membranlara sahip bir örnek tutucu ve aynı numune içindeki birkaç tek mikrobubblenin görüntülenmesine izin sağlayacak kadar büyük bir hacim kullanın.
NOT: Burada 10 mL hacimli, membran alanları 25 cm2 ve membran kalınlığı 175 μm olan bir hücre kültürü kaseti kullanılmıştır. Alt zardaki akustik yansımalar ve mikroskop hedefi ve üst zar tarafından yansıtılan dalgaların paraziti nedeniyle, yerinde akustik basınç keyfi dalga biçimi üretecinde programlanandan farklı olabilir. Dönüştürücünün numune tutucu membranlarına göre bir açıya yerleştirilmesi duran dalga oluşumunu azaltır, ancak membranlardan yansımaları artırabilir. - Numunenin tamamen suya batırılabildiğinden ve hem dönüştürücü hem de mikroskop hedefinin odağına getirilebildiğinden emin olun. Numune tutucuyu bağımsız olarak taşımak için 3D mikro konumlama aşamasına bağlı bir alüminyum destek kullanın.
- Optik ve akustik olarak şeffaf membranlara sahip bir örnek tutucu ve aynı numune içindeki birkaç tek mikrobubblenin görüntülenmesine izin sağlayacak kadar büyük bir hacim kullanın.
- Optik ve akustik sistemlerin hizalanması
- Kurulumu hizalamak için 3D çeviri için, su banyoyu bir XY çeviri aşamasına takın ve deneyler sırasında hareket etmediğine emin olmak için sahneyi optik bir tabloya takın. Ardından, su banyosunu suyla doldurun ve kısılabilir halojen ışık kaynağını kapatın. Hizalama sırasında, ultrason yansımalarını önlemek için mikroskop hedefini yana doğru hareket ettinin.
- Numune tutucu koluna bir iğne hidrofon (0,2 mm) takın ve iğne hidrofonunu hedefin görüş alanındaki ucuyla birlikte su banyosuna yerleştirin. Amplifikatörü ve rastgele dalga biçimi jeneratörünü açın; 5 ila 10 ultrason döngüsünde tek darbe ve 15 Hz darbe tekrarlama frekansı kullanın. Maksimum basınç genliğine ulaşılana kadar tankı XY yönünde ve iğneyi Z yönünde hareket ettirin.
- Hidrofonun ucuna yeniden odaklanmak için mikroskobun odağını ayarlayın.
NOT: Bu protokol, mikroskop odağı ile dönüştürücü odağı arasındaki hizalamayı sağlar. Hizalamadan sonra mikroskop ve dönüştürücünün konumunu değiştirmeyin.
- Numune hazırlama
- Örnek çözümü hazırlamak için 2.1.1.1 ile 2.1.1.3. Tek kabarcıklı görüntülemeyi etkinleştirmek ve komşu kabarcıkların akustik etkileşimlerini ekarte etmek için kabarcık çözeltisini seyreltin.
- Numune tutucunun çıkışını açın. Bir şırınna kullanarak, numune çözeltisini tamamen dolana kadar numune tutucunun diğer açıklığı içine enjekte edin. Ultrason alanı ile istenmeyen etkileşimleri önlemek için numune tutucunun içinde hava kabarcıkları olmadığından emin olun.
- Numune tutucunun her iki vanasını da kapatın ve numune tutucuyu optik eksene dik olarak yerleştirin.
NOT: Taşıma sırasında kabarcıkların numune tutucunun bir tarafına kaymasını önlemek için doldurulmuş numune tutucu seviyesini koruyun.
- Görüntüleme protokolü
- Yukarıda belirtilen şirket içi yazılı komut dosyası aracılığıyla keyfi dalga biçimi jeneratörü istenen ultrason sürüş frekansı ve akustik basınç programlayın.
NOT: Burada, akustik basınç dalgası 8 çevrim Gauss konik darbe ile 40 döngüden oluşan tek bir patlamaydı. Bu deneylerde kullanılan ultrason frekansları 1 MHz, 2 MHz veya 3 MHz'dir ve akustik basınç genlikleri 81 kPa ile 1200 kPa arasında değişir. - Mikroskop odağındaki tek mikrobubbleleri bulmak için XYZ aşamasını kullanarak numune çözümünü içeren numune tutucuyu hareket ettinin. Örnek tutucunun bir köşesindeki görüş alanıyla başlayın ve mikrobubbles'ın kenarının net bir şekilde görünür ve net olduğundan emin olun (ideal bir kamera görünümü için Şekil 3C'ye bakın).
- Halojen ışığa daha önce bağlanmış bir optik fiberin ucunun ucunun bir flaş ışığına tutturulması, böylece diğer ucun hala su banyosuna bağlı olmasıdır. Kaydı tetikleyin.
- 2.2.6.2 ile 2.2.6.3 arasında ultrason ayarı (frekans ve akustik basınç) başına istenenden daha fazla kez tekrarlayın, görüş alanındaki mikrobubbles'ın önceki deneylerde inzomuz olmadığından emin olmak için mikrobubbles içeren hücre kültürü kasetini önceki konumdan (odak düzleminde) hareket ettirebilirsiniz.
NOT: Burada, her deney ~20 kez tekrarlandı. Tüm numune tutucusu insonified olduğunda, numune tutucuyu boşaltın ve sonraki deneyler için taze numune çözeltisi ile yeniden doldurun.
- Yukarıda belirtilen şirket içi yazılı komut dosyası aracılığıyla keyfi dalga biçimi jeneratörü istenen ultrason sürüş frekansı ve akustik basınç programlayın.
- Veri analizi
- Araştırma sorusuna göre veri analizi yapmak ve görüntüleri işledikten sonra kenar algılama yapmak için bir programlama ortamı benimseyin. Görüntü bölgelerinin özelliklerini ölçen bir işlev kullanarak, baloncuğun konturunu (ve dolayısıyla kabarcık yarıçapı R'yi) algılamak için bir baloncuğun merkezini ve her baloncuğun etrafındaki yoğunluk profilinin türevini bulun. Tek mikrobubbles için zaman içinde yarıçaptan ilgili parametreleri çıkarın.
NOT: Bu çalışmada, tek mikrobubbles kayıtlarını binarize etmek ve filtrelemek için görüntü işleme için bir programlama ortamı kullanılmıştır. Her baloncuğun etrafındaki yoğunluk profilinin türevini bulmak için şirket içi bir komut dosyası kullanıldı.
- Araştırma sorusuna göre veri analizi yapmak ve görüntüleri işledikten sonra kenar algılama yapmak için bir programlama ortamı benimseyin. Görüntü bölgelerinin özelliklerini ölçen bir işlev kullanarak, baloncuğun konturunu (ve dolayısıyla kabarcık yarıçapı R'yi) algılamak için bir baloncuğun merkezini ve her baloncuğun etrafındaki yoğunluk profilinin türevini bulun. Tek mikrobubbles için zaman içinde yarıçaptan ilgili parametreleri çıkarın.
- Optik sistemin montajı
- Floresan mikroskopi
- Optik sistemin montajı
- Floresan mikroskopi (Şekil 4A) kurulumunu, bölüm 2.2'de açıklanan parlak alan mikroskopisinde kullanılan tabanla oluşturun.
NOT: Bölüm 2.3'te açıklanan kurulum, bölüm 2.2'de parlak alan mikroskopisi için açıklanan kurulumla birleştirilebilir. Hem floresan mikroskopi hem de parlak alan mikroskopisinin birleştirilmesi, nanopartikül salınımını görüntülemede mikrobubble gaz çekirdeğinin görselleştirilmesini sağlar. - Yüksek hızlı kamerayı 128 kare (256 μs) için saniyede 500.000 kare (400 x 250 piksel) kaydedecek şekilde ayarlayın.
NOT: Işık yoğunluğu floresan olarak sınırlı olduğundan ve parçacık tesliminin gerçekleştiği zaman ölçeği kabarcık dinamiklerinden daha uzun olduğundan, görüntüleme süresi parlak alan deneylerinden daha uzundur. - Yeterli ışık sağlayacak kadar yüksek ve uygun bir heyecan dalga boyuna sahip bir güce sahip bir lazer seçin ve numunenin ağartılmasını önlemek için bir acousto-optik modülatör ile birleştiğinden emin olun.
NOT: Bu çalışmada nanopartiküllerin floresanını heyecanlandırmak için 532 nm'lik bir ekscitasyon dalga boylarına sahip 5 W sürekli dalga lazeri kullanılmıştır. - Floresan emisyonunun kameraya ulaşmasını sağlarken heyecan ışığını örneğe yönlendirmek için lazer ve mikroskop hedefi arasına bir ışın ayırıcı, dikroik ayna ve çentik filtresi yerleştirin.
- Floresan mikroskopi (Şekil 4A) kurulumunu, bölüm 2.2'de açıklanan parlak alan mikroskopisinde kullanılan tabanla oluşturun.
- Akustik sistemin montajı
- Mikrobubbles inzote etmek için, bölüm 2.2.2'dekiyle aynı akustik kurulumu kullanın. Bu özel deneylerdeki dönüştürücüyü, merkez frekansı 2,25 MHz, odak mesafesi 1,88" ve eleman çapı 1"olan tek elemanlı, odaklanmış daldırma dönüştürücüsüyle değiştirin. Numune tutucu membranlarından yansımaları en aza indirmek ve duran dalga oluşumlarını azaltmak için optik eksene göre 35° açıyla yerleştirin.
- Optik ve akustik sistemlerin hizalanması
- Bölüm 2.2.4'te açıklanan adımları yineleyin.
- Numune hazırlama
- Örnek çözümü bölüm 2.2.5'te açıklandığı gibi hazırlayın.
- Görüntüleme protokolü
- Yukarıda belirtilen şirket içi yazılı komut dosyası aracılığıyla keyfi dalga biçimi üretecinde istenen ultrason sürüş frekansını ve akustik basınç genliği ayarlayın.
NOT: Burada, akustik basınç dalgası, 10 çevrim Gauss konik darbe ile 140 döngülü tek bir ultrason patlaması olarak programlandı. Kabarcık dinamiklerini incelemek için gerekenlere kıyasla biyo-etkileri teşvik etmek için genellikle daha uzun nabız süreleri gereklidir. Bu deneylerde kullanılan ultrason frekansları 1 MHz, 2 MHz veya 3 MHz'dir ve akustik basınç genlikleri 81 kPa ile 1200 kPa arasında değişir. - Darbe/gecikme jeneratörü üzerinde, kayıt sırasında nanopartiküllerin mikrobubbles'tan floresan eksitasyonu için lazerin tetik gecikmesini ayarlayın.
NOT: Bu özel deneyler için tetikleme gecikmesi toplam 150 μs süreyle 20 μs ile 170 μs arasındaydı. Zamanlama diyagramı Şekil 4B'de gösterilmiştir. - Mikroskop odağındaki tek mikrobubbleleri bulmak için XYZ aşamasını kullanarak numune çözümünü içeren numune tutucuyu hareket ettinin. Örnek tutucunun bir köşesinin görüş alanıyla başlayın; Mikrobubbles arayüzünün açıkça görülebildiği ve odakta olduğu ideal bir kamera görünümü için Şekil 4C'ye bakın. Kaydı tetikleyin.
- 2.3.5.3 adımını ultrason ayarı (frekans ve akustik basınç) başına istenildiği kadar tekrarlayın, görüş alanındaki mikrobubbles'ın önceki deneylerde sonike olmadığından emin olmak için mikrobubbles içeren hücre kültürü kasetini önceki konumdan en az 2 mm (optik düzlemde) hareket ettirerek.
NOT: Bu çalışmada her deney ~10-20x olarak tekrarlandı. Tüm numune tutucusu insonified olduğunda, numune tutucuyu boşaltın ve sonraki deneyler için taze numune çözeltisi ile yeniden doldurun. Numune tutucunun deneyler arasında hangi mesafeye taşına kadar taşınalı akustik ışın boyutuna bağlıdır.
- Yukarıda belirtilen şirket içi yazılı komut dosyası aracılığıyla keyfi dalga biçimi üretecinde istenen ultrason sürüş frekansını ve akustik basınç genliği ayarlayın.
- Veri analizi
- Araştırma sorusuna göre floresan mikroskopi kayıtlarını analiz edin. Her mikrobubble için, floresan mikroskopi deneylerinde nanopartiküllerin teslimatının gerçekleşip gerçekleşmediğini görsel olarak belirleyin. Nanopartiküllerin gaz çekirdeğinden numune tutucu membran üzerine ayrılarak birikmesi tek bir mikrobubble için gözlenirse, programlama ortamında gerçekleşen teslimatı manuel olarak girin.
- Optik sistemin montajı
3. İntravital mikroskopi
- Dorsal skinfold pencere odası ameliyatı (daha önce 26,47,50 olarak açıklanmıştır)
- Pencere odalarını yerleştirmeden önce hayvanları bir hafta boyunca alıştırın. Hem dişi hem de erkek fareler kullanılabilmesine ve yaşın önemsiz olmasına rağmen, cildin yeterince esnek olması için farelerin ağırlığının en az 22-24 g olduğundan emin olun.
- İntraoperatif ve postoperatif analjezik tedavi ile ameliyatı genel anestezi altında gerçekleştirin. 10 g ağırlık başına 0,1 mL dozda fentanil (0,05 mg/kg)/medetomidin (0,5 mg/kg)/midazolam (5 mg/kg)/su (2:1:2:5) deri altı enjeksiyonu ile hayvanı uyuşturun. Hayvanın vücut sıcaklığını korumak için bir ısıtma yastığı veya ısıtma lambası kullanın.
- Hayvanın sırtındaki çift deri tabakasına hafifçe çekin, böylece cilt pencere odasının iki simetrik polioksimetilen çerçevesi arasına sıkıştırılır. Çift cilt tabakası boyunca uzanan ve odanın üst kenarı boyunca dikişli iki vida yerleştirerek hazneyi sabitleyin.
- Cildin bir tarafındaki odanın dairesel çerçevesi içindeki cildi çıkarın. Cildin çıkarıldığı çerçevenin içine 11,8 mm çapında bir kapak camı yerleştirerek dokuya bir pencere açın.
- Anesteziyi sonlandırmak için panzehir olarak 10 g başına 0,1 mL dozda atipemazol (2,5 mg/kg), flumazenil (0,5 mg/kg) ve su (1:1:8) deri altı enjeksiyonu kullanın. Hayvanı bir gecede ısıtılmış bir kurtarma rafı içine yerleştirin. Cerrahi bölgede enfeksiyonu önlemek için hayvanlar için suyu 25 mg / mL enrofloksasin ile destekleyin.
- Tümör modeli oluşturma
- %10 fetal sığır serumu ve 100 U/mL penisilin ve 100 mg/mL streptomisinin ile desteklenmiş uygun kültür ortamında kanser hücrelerini 37 °C'de ve %5 CO2 atmosferinde koruyun.
NOT: Bu protokolde insan osteosarkom (İsG) hücre hattı kullanılmıştır, ancak diğer hücre hatları da kullanılabilir. - 3.1.5 adımından sonraki gün, hayvanı birkaç dakika boyunca izofluran (indüksiyon sırasında% 5 ve bakım sırasında% 1-2) ile uyuşturun. Kapak camını çıkarın, 30 μL hücre kültürü ortamında 5 × 106 kanser hücresi uygulayın ve kapak camını değiştirin.
- Tümörlerin görüntülemeden önce 2 hafta boyunca büyümesine izin verin ve bu süre zarfında haftada en az 3 kez hayvanların ağırlığını ve sağlık durumunu izleyin.
- %10 fetal sığır serumu ve 100 U/mL penisilin ve 100 mg/mL streptomisinin ile desteklenmiş uygun kültür ortamında kanser hücrelerini 37 °C'de ve %5 CO2 atmosferinde koruyun.
- Optik sistemin montajı
- Ultrason tedavisi sırasında (önceki çalışmada açıklandığı gibi26) söz konusu araştırma sorusuna bağlı olarak uygun bir mikroskop ve hedefle intravital görüntüleme gerçekleştirin. Deneysel kurulumun şematik gösterimi için Şekil 5A'ya bakın.
NOT: Bu özel deney için, 20x su daldırma hedefi (1.0'ın NA'ı ve 2 mm çalışma mesafesi) ve darbeli lazer ile donatılmış çok sesli bir mikroskop kullanıldı. Görüntüler, 400 x 400 μm2 görüş alanına sahip saniyede 31 kare (512 x 512 piksel) rezonans tarama modunda elde edildi. Heyecan dalga boyu 790 nm idi. İki galyum arsenit fosfit dedektörünün önündeki filtreler floresan tespiti için uzun geçişli 590 nm ve bant geçişi 525/50 nm'ydi.
- Ultrason tedavisi sırasında (önceki çalışmada açıklandığı gibi26) söz konusu araştırma sorusuna bağlı olarak uygun bir mikroskop ve hedefle intravital görüntüleme gerçekleştirin. Deneysel kurulumun şematik gösterimi için Şekil 5A'ya bakın.
- Akustik sistemin montajı
- Dorsal cilt katları pencere odasının kapak camından yansımaları en aza indirmek ve duran dalga oluşumlarını azaltmak için optik eksene göre hedefin altına 45° açıyla yerleştirilmiş bir dalga kılavuzuna (özel yapım) uygun bir ultrason dönüştürücü takın. Dalga kılavuzlarını damıtılmış ve gazdan arındırılmış su ile doldurun. Dalga kılavuzunun üzerine ultrasonik kavrama jeli uygulayın.
- Optik ve akustik sistemlerin hizalanması
- Optik ekseni ultrasonun odağıyla hizalayın. Fiber optik bir hidrofon hedefin odağına yerleştirin. Ardından, dönüştürücüyü 100 Hz darbe tekrar frekansına sahip kısa patlamalarla (5-10 döngü) heyecanlandırmak için amplifikatör ve keyfi dalga biçimi jeneratörünü açın ve ultrason dönüştürücüsünü osiloskop üzerindeki hidrofon sinyali ile en yüksek basıncın algılandığı konuma getirin.
NOT: Hizalamadan sonra dönüştürücünün konumunu değiştirmeyin.
- Optik ekseni ultrasonun odağıyla hizalayın. Fiber optik bir hidrofon hedefin odağına yerleştirin. Ardından, dönüştürücüyü 100 Hz darbe tekrar frekansına sahip kısa patlamalarla (5-10 döngü) heyecanlandırmak için amplifikatör ve keyfi dalga biçimi jeneratörünü açın ve ultrason dönüştürücüsünü osiloskop üzerindeki hidrofon sinyali ile en yüksek basıncın algılandığı konuma getirin.
- Görüntüleme protokolü
- Isıtılmış hayvan tutucuyu (özel olarak tasarlanmış) dalga kılavuzu ve hedef arasında bir XY konumlandırma aşamasına bağlı olarak konumlandırın ve daha fazla kavrama jeli ekleyin. Hayvanı uyuşturun ve bir kuyruk damarı kateteri yerleştirin. Fareyi ısıtılmış tutucuya yerleştirin ve pencere haznesini tutucuya sabitleyin. Pencere haznesine kapak kaymasının üzerine bir su damlası ekleyin ve tümör dokusunu görüntüleyemek için hedefi yerinde hareket ettinin.
-
Şekil 5B , olayların sırasını gösteren deneylerin zamanlama diyagramını gösterir. Vaskülatı görselleştirmek için floresan etiketli 2 MDa dektran'ı intravenöz olarak (30 μL, salinle seyreltilmiş 4 mg/mL) enjekte edin ve uygun kan damarlarına sahip bir pozisyon bulmak için XY çeviri aşamasını kullanarak fareyi hareket ettirin. Ultrason tedavisinden önce temel görüntüleri kaydedin. Araştırma sorusuna ve görüntülenecek mikroskop ve boyaların özelliklerine bağlı olarak kare hızını, görüş alanını ve kayıt uzunluğunu ayarlayın.
NOT: Bu deneylerde saniyede 31 kare 400 x 400 μm2 görüş alanı ile kaydedilmiş ve görüntüleme 5 dakika boyunca sürekli olarak yapılmıştır. - Rastgele dalga biçimi jeneratörü üzerinde istediğiniz ultrason sürüş frekansını, darbe uzunluğunu ve akustik basınç genliği ayarlayın.
NOT: Bu deneyler için 10 ms darbe uzunluğu ve 0,2 MPa ile 0,8 MPa arasında tepe negatif basınç genlikleri ile 1 MHz frekans kullanılmıştır. Ultrason darbeleri arasında tedavi edilen bölgeye yeni mikrobubbles reperfüzyon sağlamak için 0.5 Hz veya 0.1 Hz darbe tekrar frekansı kullanıldı. - 50 μL mikrobubbles (2 × 108 ila 5 × 108 mikrobubbles / mL) intravenöz olarak enjekte edin ve görüntüleme sırasında ultrason uygulayın, 26'da açıklandığı gibi.
- Veri analizi
- Araştırma sorusuna bağlı olarak, kan damarı parametrelerini (çap, dallanma, akış hızı ve yön), damarlarda nanopartiküllerin birikmesini ve dektran ve nanopartiküllerin tümör dokusuna ekstravazasyonunun kinetik ve penetrasyon derinliğini belirlemek için görüntüleri (açık kaynak) görüntü işleme yazılımı ve bir programlama ortamı ile analiz edin.
Sonuçlar
Protokolde açıklandığı gibi üretilen mikrobubbleler, çeşitli mikroskopi yöntemleri kullanılarak ve çeşitli zaman ölçeklerinde analiz edildi.
Konfokal mikroskopideki nanopartiküllerin floresanları (Şekil 6A), kabuğun homojen olmayan bir parçacık dağılımına sahip olduğunu gösterir. Kabarcık karakterizasyonu için diğer mikroskopi yöntemleri kullanılabilir. Örneğin, Şekil 6B , önceki çalışmada gösterildiği gibi taramalı elektron mikroskopisi kullanarak mikrobubblenin genel yapısını gösterir34.
Radyal dinamikler ve fenomenolojik kabarcık davranışı, mikrobubbles saniyede 10 milyon kare olarak görüntülendiği tarif edilen in vitro parlak alan mikroskopi yöntemi kullanılarak incelenebilir. Tek mikrobubbles yarıçapı, şirket içinde yazılmış bir komut dosyası kullanılarak zaman içinde ayıklandı. Böyle bir radyal yanıt örneği Şekil 7'de gösterilmiştir.
Bölüm 2.3.6'da açıklandığı gibi tipik başarılı nanopartikül iletiminin bir görüntü dizisi Şekil 8A'da gösterilmiştir. Mikrobubble kabuğuna gömülü nanopartiküllerin, lazer ışığı balona ulaştığında floresan nedeniyle yandığı görülebilir. Ultrason inkontasyonu ile tahrik edilen floresan nanopartiküller mikrobubbles gaz çekirdeğinden ayrılır ve numune tutucunun zarında biriktirilir. Son olarak, lazer kapalı ve floresan nanopartiküller artık heyecanlı değil. Mikrobubbles floresan etiketli yükün başarısız teslimatı tipik olarak Şekil 8B'de gösterilen görüntü dizisine benziyor, floresan nanopartiküller ultrason maruziyeti sırasında bozulmadan kalan mikrobubble'ın kabuğunda yanıyor.
Ultrason sırasında gerçek zamanlı intravital multifotoğraf mikroskopisi, ultrason ve mikrobubbles'ın kandaki nanopartikül davranışı üzerindeki etkilerini, tümör kan damarlarının geçirgenliğinin arttırıldığını ve nanopartiküllerin verilmesinin iyileştirilmesini araştırmak için kullanılmıştır. Akustik basınç, frekans ve darbe uzunluklarının bir fonksiyonu olarak hücre dışı matrise penetrasyonun kapsamı ve kinetiği karakterize edilebilir. Ultrason tedavisinin etkisi, damarların büyüklüğüne ve morfolojisine ve baloncuğun hapsedilmesine göre değişebilir. Ultrason tedavisinin kan akışını ve yönünü nasıl etkilediği belirlenebilir. Nanopartiküllerin zaman içinde ekstravazasyonunu gösteren örnek bir deney Şekil 9'da 0,826 mekanik indekste (MI) gösterilmiştir. intravital multifotoğraf mikroskopi sonuçları, ultrason maruziyeti sırasında nanopartiküllerin mekansal ve zamansal ekstravazasyonunu aydınlatır, bu da nanopartiküllerin ultrason aracılı tesliminin altında yatan mekanizmaların tam olarak anlaşılması ve bu teknolojilerin optimize edilmesi için son derece faydalıdır26.
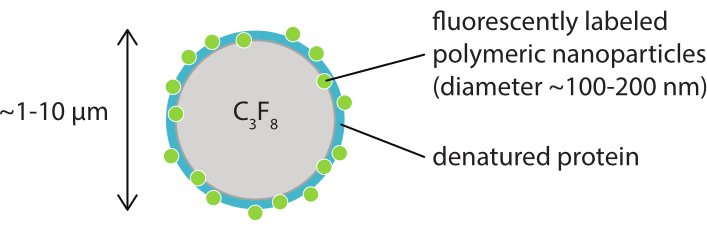
Şekil 1: Denatüre kazeinde floresan etiketli polimerik nanopartiküllerin kabuğuna sahip bir mikrobubblenin şematik gösterimi. Mikrobubbles genellikle 1 μm ile 10 μm çapındadır. Nanopartiküllerin çapı çoğunlukla 100 nm ile 200 nm38 arasındadır. Kısaltma: C3F8 = perfloropropane gazı. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
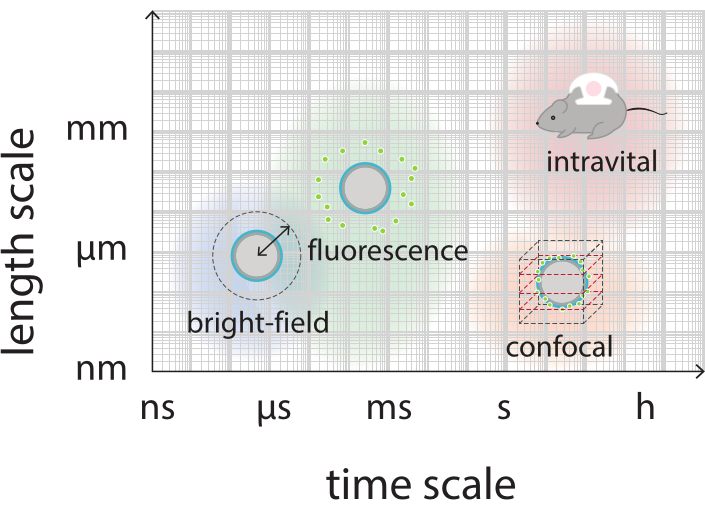
Şekil 2: Parlak alan, floresan, konfokal ve intravital mikroskopi için ilgili zaman ve uzunluk ölçeklerini gösteren şematik genel bakış.
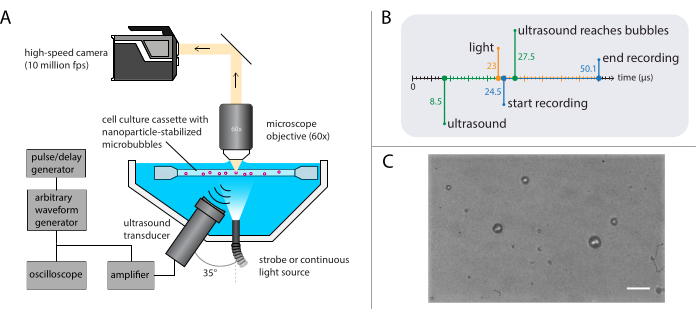
Şekil 3: Parlak alan mikroskopi deneylerinin şematik gösterimi. (A) Deneysel kurulum, (B) zamanlama diyagramı ve (C) tipik bir kaydedilmiş çerçeve. Ölçek çubuğu (C) = 10 μm. Kısaltma: fps = saniyedeki kareler. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
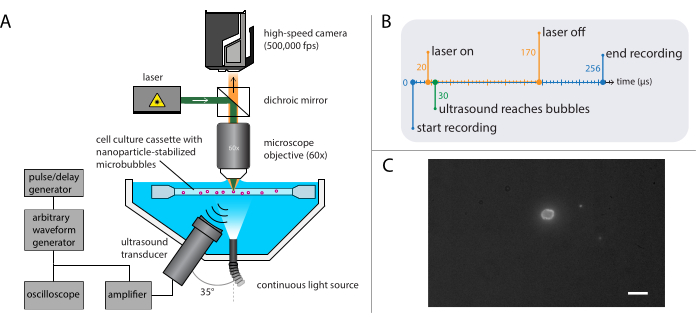
Şekil 4: Floresan mikroskopi deneylerinin şematik gösterimi. (A) Deneysel kurulum, (B) zamanlama diyagramı ve (C) tipik kaydedilmiş bir çerçeve. Ölçek çubuğu (C) = 10 μm. Kısaltma: fps = saniyedeki kareler. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
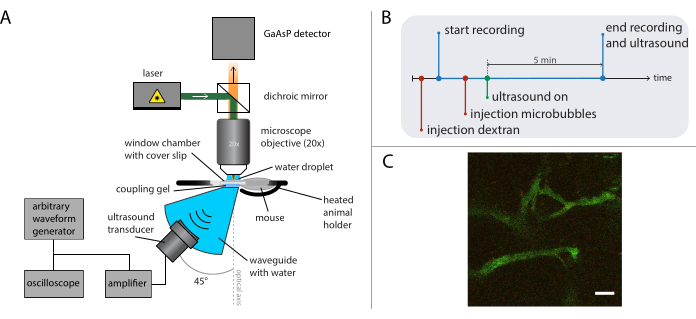
Şekil 5: Intravital mikroskopi deneylerinin şematik gösterimi. (A) Deneysel kurulum, (B) zamanlama diyagramı ve (C) tipik bir kaydedilmiş çerçeve. Ölçek çubuğu (C) = 50 μm. Yeşil dektran-FITC'ye ve kırmızı nanopartiküllere karşılık gelir. Kısaltma: GaAsP = galyum arsenit fosfit. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
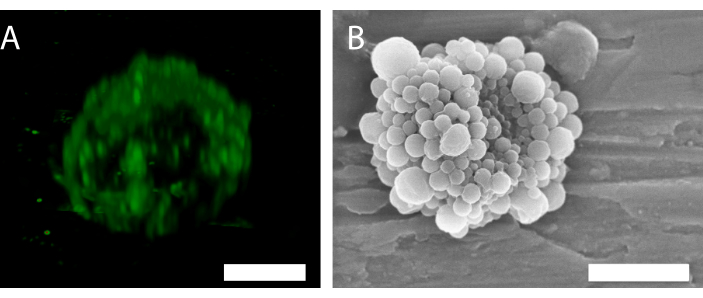
Şekil 6: Tek bir nanopartikül ve protein stabilize mikrobubblenin 3B yapısı. (A) Nanopartikülleri göstermek için konfokal mikroskopi kullanmak ve (B) 3D yapıyı göstermek için taramalı elektron mikroskobu kullanmak. (B) 34'ten izin alınarak çoğaltılmıştır. Ölçek çubuğu (A) = 5 μm; ölçek çubuğu (B) = 2 μm. Bu şeklin daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
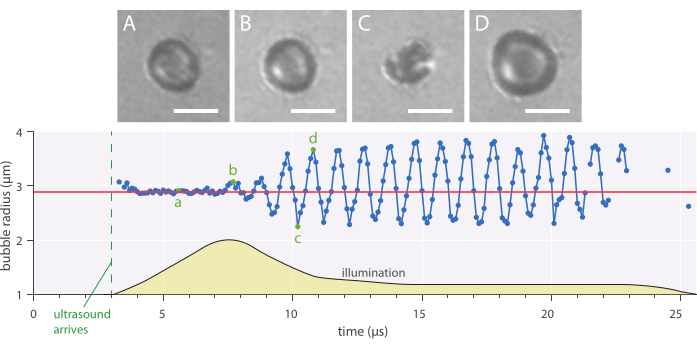
Şekil 7: 1 MHz ultrason frekansında inzozifiye edilmiş 2,89 μm yarıçaplı nanopartikül ve protein stabilize mikrobubblenin tipik küresel salınımları ve 142 kPa akustik basınç genliği. (A-D) Yüksek hızlı kayıttan görüntüler ve zaman eğrisi (altta). Ölçek çubukları = 5 μm ve kırmızı çizgi başlangıç yarıçapını gösterir. Aydınlatma profili (rasgele birimler) sarı ile gösterilir. Büyütme 120x'tir. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
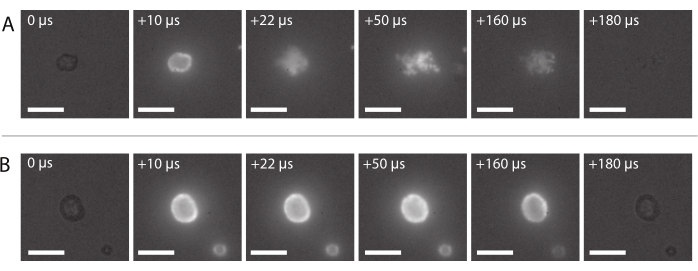
Şekil 8: Yüksek hızlı floresan mikroskopiden görüntü dizisi. (A) 2 MHz ultrason frekansında ve 600 kPa akustik basınç genliğinde inzomsonlaştırılmış nanopartikül ve protein stabilize mikrobubble floresan etiketli nanopartiküllerin başarılı bir şekilde teslimi. (B) 2 MHz ultrason frekansında ve 210 kPa akustik basınç genliğinde inzozifiye edilmiş nanopartikül ve protein stabilize mikrobubble floresan etiketli nanopartiküllerin başarısız teslimatı. Ölçek çubukları = 10 μm. Büyütme 120x'tir . Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
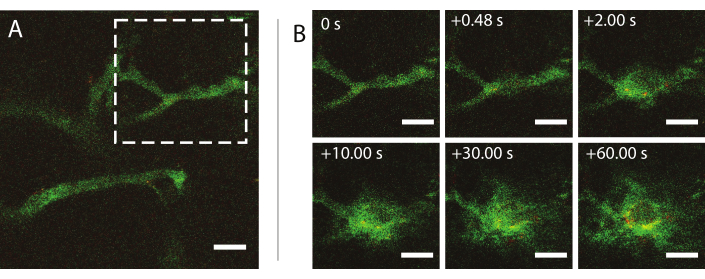
Şekil 9: Nanopartikül ve protein stabilize mikrobubbles insonasyonundan sonra intravital mikroskopi 1 MHz ultrason frekansında ve 800 kPa akustik basınç genliğinde. (A) Gemi içindeki nanopartiküller ve (B) dektran (yeşil) ve nanopartiküllerin (kırmızı) ekstravazasyonunu gösteren (A) içindeki beyaz kesikli kare ile gösterilen alanın bir görüntü dizisi. Ölçek çubukları = 50 μm. Büyütme 20x'tir . Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
Tartışmalar
Nanopartiküllerin mikrobubbles yüzeyinden çevredeki ortama tesliminde çeşitli adımlar hakkında bilgi edinmek için farklı optik mikroskopi yöntemleri birleştirildi. Kabarcık salınımlarının görüntülenmesinin yanı sıra nanopartiküllerin kabarcık kabuğundan salınması, ekstravazasyon ve in vivo tümörlerin hücre dışı matrisinden penetrasyonun görüntülenmesi yapıldı. İn vitro görüntüleme, daha karmaşık in vivo kurulumlara kıyasla birçok ultrason parametresinin taranmasını sağlar. Bu görüntüleme yöntemlerini birleştirmenin yararı, farklı zaman ölçeklerinde elde edilebilecek tamamlayıcı bilgilerdir - mikrobubbles'ı başarılı bir şekilde teslim etmek ve terapötik etkinlik elde etmek için karakterize etmek ve optimize etmek için çok önemli bir özelliktir. Bu yaklaşım, floresan etiketli nanopartiküller ve ilaçlar içeren yapılar da dahil olmak üzere tüm mikrobubbles için teslimat mekanizmalarını anlamak için yararlıdır.
Tek mikrobubbleleri incelemek için kullanılan mikroskopi yöntemlerinde en kritik adımlar aşağıdaki gibidir. Floresan mikroskopi için nanopartiküller, parçacık salınımının görselleştirilmesini sağlamak için floresan olarak etiketlenmelidir. Ayrıca, numune çözeltisi konfokal, parlak alan ve floresan mikroskopi yöntemlerinde analiz için tek mikrobubbleleri izole edecek kadar seyreltilmelidir. Ek olarak, kabarcıkları en verimli şekilde, yani rezonanslarında heyecanlandırmak için bir ultrason sürüş frekansı ve akustik basınç seçmek önemlidir. Araştırma sorusu nanopartikül yükünün teslimi ile ilgiliyse, uygun ultrason parametreleri araştırmanın bir parçası olmalıdır. Rezonansın yanında, bu kabarcıklar nanopartikül salınımı için eşiklerinin üzerinde veya ötesinde, tipik olarak nispeten yüksek akustik basınç genliklerinde (MI > 0.3)51.51'de sürülmelidir. Parlak alanlı mikroskopi görüntüleme için, hareket bulanıklığını en aza indirmek ve takma ad vermekten kaçınmak için yeterince yüksek kare hızına sahip yüksek hızlı bir kamera seçmek önemlidir.
Parlak alan mikroskopisi esas olarak mevcut ışık kaynaklarının görüntüleme kare hızı ve yoğunluğu ile sınırlıdır, çünkü daha yüksek bir kare hızı kabarcık dinamikleri hakkında daha ayrıntılı bir zaman çözümlenmiş içgörü verecektir, ancak daha kısa pozlama süreleri nedeniyle daha yoğun aydınlatma gerektirir. Parçacık salınımını daha ayrıntılı incelemek için, floresan görüntüleme için çerçeve hızı, prensip olarak lazer ışığının yoğunluğunu artırarak artırılabilir. Bununla birlikte, yüksek yoğunluklu lazer ışığının floresan etiketli mikrobubbles tarafından emilimi, yüksek kuantum verim boyalarında bile ısı üretir. Bu ısı, söz konusu deneylere müdahale edebilir ve aşırı durumlarda foto-termal kavitasyona neden olabilir52. Bu nedenle, pratikte, uygulanan lazer fluansının bir sınırı vardır. Bununla birlikte, yoğun lazer aydınlatma, lipozomlardan parçacık salınımı sağlamak için kasıtlı olarak da kullanılabilir53. Sıcaklık kabarcık tip54 bağlı kabarcık dinamikleri ve ultrason yanıtı etkiler. Bu nedenle in vitro ve intravital yöntemler objektif olarak karşılaştırılacaksa protokolde tartışılan in vitro yöntemlerin 37 °C'de yapılması gerekmektedir. Mevcut makalede tartışılan in vitro yöntemlerin bir başka sınırlaması, mikrobubbles numune tutucu membranının altında yüzeceğinden kabarcıkların serbest alan ortamında olmamasıdır. Ayrıca, tek mikrobubbles görüntülemede bir seçim önyargısı vardır. Bununla birlikte, tek kabarcıklar üzerinde tekrarlanan deneyler yapmak, boyutun etkisinin araştırılmasına ve şaşırtıcı faktör-boyut dağılımının kaldırılmasına izin verir. Kabarcık-kabarcık etkileşimlerini önlemek için konsantrasyon çok yüksek değilken boyutun bir fonksiyonu olarak kabarcık yanıtı anlaşılabilirse, herhangi bir rastgele kabarcık popülasyonunun yanıtı hesaplanabilir. Son olarak, hem parlak alan hem de floresan mikroskopi yöntemleri, iki boyutlu (2B) bir görüntüde dolanan mikrobubbles hakkında fikir sağlar. Araştırma sorusu 2D görüntülemeden fazlasını gerektiriyorsa, kabarcıkların 3D davranışı, protokolde açıklanan kurulumu çok düzlemli görüntüleme için bir yan görünüm kurulumuyla birleştirerek çözülebilir55.
Mikrobubbles incelemek için alternatif bir yöntem akustik karakterizasyondur56. Bununla birlikte, tek bir mikrobubble'ın yankısını ölçmek, ultrason ışını içinde tek bir mikrobubble bulmayı ve izole etmeyi gerektirir56, bu da tipik olarak dar bir tüp veya optik veya akustik cımbız kullanımıyla mücadele edilen bir zorluk teşkil eder57,58. Kabarcıkları akustik olarak boyutlandırmak için, mikrobubbles geometrik saçılma rejiminde rezonans frekanslarından çok daha yüksek frekanslarda inzozifiye edilebilir, bu da hacimsel mikrobubble salınımlarını teşvik etmez59. Bir "akustik kamera" kullanımı, ultrasona yanıt olarak tek mikrobubbles radyal dinamiklerini görüntüleyecek şekilde bir yöntemdir, burada baloncuğun düşük frekanslı bir sürüş dalgasına radyal tepkisini belirlemek için yüksek frekanslı bir ultrason probu kullanılır60. Bu yöntemin dezavantajı, yalnızca mikrobubble yarıçapının göreli değişimini belirlemek için kullanılabilmesidir; bu nedenle, optik görüntüleme61,62 aracılığıyla mutlak kabarcık yarıçapını belirlemek için başka bir yönteme ihtiyaç vardır. Mikrobubbles rezonans frekanslarından daha yüksek frekanslarda ultrasona maruz kaldığı yöntemlerin dezavantajı, bu kadar yüksek frekanslarda penetrasyon derinliğinin azalmasıdır59, in vivo uygulamalar için kullanılabilirliği sınırlar. Diğer mikroskopi formları, taramalı elektron mikroskopisi, atomik kuvvet mikroskopisi ve iletim elektron mikroskopisi63 gibi mikrobubbles'leri incelemek için de kullanılabilir. Bununla birlikte, bu alternatif mikroskopi tekniklerinin ulaşılabilir mekansal-zamansal çözünürlüğü genellikle daha sınırlıdır ve bu teknikler, görüntülemenin ultrason maruziyeti öncesinde veya sonrasında off-line analiz ile yapılması ve tipik olarak düşük bir aktarım hızı63 sunması dezavantajıdır. Başka bir alternatif, tek mikrobubbles radyal dinamiklerini gerçek zamanlı olarak incelemek için kullanılabilecek, ancak akustik saçılma yöntemlerine kıyasla düşük sinyal -gürültü oranına sahip hafif bir saçılma yöntemi kullanmaktır64.
Ultrason maruziyeti sırasında gerçek zamanlı intravital mikroskopi, ultrason maruziyeti sırasında vaskülat, mikrobubbles, nanopartiküllerin veya diğer moleküllerin (bu durumda dektran gibi) davranışı hakkında yeni bir fikir edinmek için güçlü bir yöntemdir. Gerçek zamanlı intravital mikroskopi yapılırken genel bir sınırlama, dokunun sadece küçük bir alanının görüntülenmiş olması ve ışığın dokuya nüfuz etme derinliğinin sınırlı olmasıdır. Görüntülenen damarlar görüş alanı içinde çok az mikrobubbles ve/veya nanopartikül içeriyorsa, nanopartikül davranışı ve ekstravazasyonu hakkında çok az bilgi elde edilebilir veya hiç bilgi elde edilebilir. Ek olarak, sınırlı görüş alanı nedeniyle, ışık ve ultrason yolları arasında uygun bir hizalama çok önemlidir. Ultrason basıncı kabarcık yıkımına neden olacak kadar yüksekse, taze kabarcıkların ultrason darbeleri arasında görüş alanına yeniden girmesini sağlayan bir darbe tekrarlama frekansı seçmek de önemlidir. Ayrıca, ultrason pencere odasındaki kapak camından ve amaçtan yansıyacağından, dönüştürücünün bir açıya yerleştirilmesi, kalibre edilmiş basınç alanını bozan ayakta dalgaların oluşumunu önlemek için yansımaları azaltmak için önemlidir. Bir diğer pratik konu, kurulumun ultrason dönüştürücüserini monte etmek için yeterli alana sahip olması ve mikroskop kurulumundaki hedefin üstünde veya altında dalga kılavuzuna sahip olması gerektiğidir. Dorsal pencere odasındaki tümörler, hapsetme odası ve kapak kayması nedeniyle sınırlı kalınlıkta olacaktır; ancak, gerekirse, başka modeller kullanılabilir. Örneğin meme yağ pedinde cilt katları tümörleri veya çeşitli organlardaki tümörlerin karın içi intravital görüntülemesi66 örnektir. Bu tür tümörler uygun mikroçevrimde ortotopik olarak yetiştirilebilir ve bu nedenle klinik olarak daha alakalı bir vaka sunar.
Bu çalışmada açıklanan yöntemler, floresan etiketli mikrobubbles'ın kabarcıklar ve ultrason kullanarak ilaç dağıtım uygulamalarının temellerini inceleme potansiyelini aydınlatmaktadır. Mikroskopi yöntemlerinin bu kombinasyonu, ultrason insonasyonuna ve ilişkili akustik parametre alanına mikrobubble yanıtı hakkında değerli bir fikir sağlar ve ilgili zaman ve uzunluk ölçekleri aralığında mikrobubble ve yük davranışının net bir görünümünü sunar.
Açıklamalar
Yazarlar çıkar çatışması olmadığını beyan ediyor.
Malzemeler
| Name | Company | Catalog Number | Comments |
| 100 MS/s Dual-Channel Arbitrary Waveform Generator model 8026 | Tabor Electronics | Arbitrary waveform generator (programmable) | |
| 2100 L | ENI | Amplifier, used in window chamber setup | |
| 2 MDa dextran | Sigma-Aldrich | ||
| 33522 A | Agilent Technologies | Arbitrary wave form generator, used in window chamber setup | |
| A1R | Nikon Instruments | Confocal microscope | |
| ACE I | SCHOTT | Dimmable AC halogen light source | |
| Atipemazol | Orion Pharma | Antidote to wake animal | |
| Baytril | Bayer | Enrofloxacin | |
| BD Neoflon 24 G | Becton Dickinson & Company | Tail vein catheter | |
| BNC model 575 | Berkely Nucleonics Corporation | Pulse/delay generator | |
| Branson 2510 Ultrasonic Cleaner | Branson | Ultrasonic bath | |
| Channel slide | Ibidi | ||
| CLINIcell 25 | Laboratoires Mabio International | Cell culture casette (volume 10 mL, membrane area 25 cm2, membrane thickness 175 µm) | |
| Cohlibri | Lightline | Laser (5 W, excitation wavelength 532 nm) | |
| DP03014 Digital Phosphor Oscilloscope | Tektronix | Oscilloscope | |
| Fentanyl | Actavis Group HF | Anaesthesia of mouse | |
| Fetal Bovine Serum | Sigma-Aldrich | Supplement for cell culture medium | |
| Fiber-optic hydrophone | Precision Acoustics | Used for alignment | |
| Flumanezil | Fresenius Kabi | Antidote to wake animal | |
| Heated animal holder | Custom design | A steel holder where the mouse is positioned on its side in a cavity fitting the size of a mouse, with the window chamber lying flat and immobilized with screws on each side. Below the chamber there is a hole in the holder to secure acoustic contact between the transducer and the skin. The holder is heated to a maximum temperature of 37°C, and the temperature is controlled by feedback from a rectal temperature probe in the mouse. The holder is mounted to an XY positioning stage so the animal can be moved independently to image different areas of the window chamber | |
| Hyper Vision HPV-X2 | Shimadzu | High-speed camera | |
| ImageJ | National Institutes of Health and the Laboratory for Optical and Computational Instrumentation, University of Wisconsin | open source image processing program | |
| In vivo SliceScope | Scientifica | Multiphoton microscope | |
| Isoflurane | Baxter | ||
| ISOTON | Beckman Coulter | Filtered, phosphate-buffered saline solution | |
| LUMPLFLN60XW | Olympus | Water immersion objective (magnification 60x, working distance 2 mm) | |
| MaiTai DeepSee | Spectra-Physics | Pulsed laser | |
| MATLAB | Mathworks | Programming environment | |
| Medetomidine | Orion Pharma | Anesthesia of mouse | |
| Midazolam | Accord Healthcare Limited | Anesthesia of mouse | |
| Milli-Q | Merck | Ultrapure water | |
| MVS 7010 High Intensity Xenon Strobe | PerkinElmer | Strobe light | |
| Panametrics-NDT C305 | Olympus | Single-element focused immersion transducer (center frequency 2.25 MHz, focal distance 1", diameter 1") | |
| Panametrics-NDT V304 | Olympus | Single-element focused immersion transducer (center frequency 2.25 MHz, focal distance 1.88", diameter 1.25") | |
| Penicillin | Sigma-Aldrich | Addition to cell culture medium before implantation of tumor in animals | |
| Perfluoropropane gas | F2 Chemicals | ||
| Roswell Park Memorial Institute 1640 | Gibco Thermo-Fisher | Cell culture medium | |
| Safe-Lock tube | Eppendorf | ||
| Streptomycin | Sigma-Aldrich | Addition to cell culture medium before implantation of tumor in animals | |
| T 25 basic ULTRA-TURRAX | IKA laboratory technology | Dispersion tool | |
| TDS 210 | Tektronix | Oscilloscope, used in window chamber setup | |
| Transducer | Precision Acoustics Ltd | Used in window chamber setup | |
| U-TLU | Olympus | Tube lens | |
| VBA100-200 | Vectawave | Amplifier | |
| Window chambers | Custom made | Used in window chamber setup | |
| XLUMPLFLN20 XW | Olympus | 20x water dipping objective | |
| XY(Z) translation stages | Thorlabs |
Referanslar
- Szabo, T. L. . Diagnostic ultrasound imaging: inside out. , (2004).
- Paefgen, V., Doleschel, D., Kiessling, F. Evolution of contrast agents for ultrasound imaging and ultrasound-mediated drug delivery. Frontiers in Pharmacology. 6, 197 (2015).
- Versluis, M., Stride, E., Lajoinie, G., Dollet, B., Segers, T. Ultrasound contrast agents modeling. Ultrasound in Medicine and Biology. 46 (9), 2117-2144 (2020).
- Coelho-Filho, O. R., Rickers, C., Kwong, R. Y., Jerosch-Herold, M. MR myocardial perfusion imaging. Radiology. 266 (3), 701-715 (2013).
- Pandharipande, P. V., Krinsky, G. A., Rusinek, H., Lee, V. S. Perfusion imaging of the liver: current challenges and future goals. Radiology. 234 (3), 661-673 (2005).
- Weidner, N., Carroll, P. R., Flax, J., Blumenfeld, W., Folkman, J. Tumor angiogenesis correlates with metastasis in invasive prostate carcinoma. The American Journal of Pathology. 143 (2), 401-409 (1993).
- Quaia, E., Quaia, E. Classification and safety of microbubble-based contrast agents. Contrast Media in Ultrasonography. Medical Radiology (Diagnostic Imaging). , 3-14 (2005).
- Unger, E. C., Porter, T., Culp, W., Labell, R., Matsunaga, T., Zutshi, R. Therapeutic applications of lipid-coated microbubbles. Advanced Drug Delivery Reviews. 56 (9), 1291-1314 (2004).
- Blomley, M. J. K., Cooke, J. C., Unger, E. C., Monaghan, M. J., Cosgrove, D. O. Microbubble contrast agents: a new era in ultrasound. BMJ. 322 (7296), 1222-1225 (2001).
- Faez, T., et al. 20 years of ultrasound contrast agent modeling. IEEE transactions on ultrasonics, ferroelectrics, and frequency control. 60 (1), 7-20 (2012).
- De Jong, N., Emmer, M., Van Wamel, A., Versluis, M. Ultrasonic characterization of ultrasound contrast agents. Medical & Biological Engineering & Computing. 47 (8), 861-873 (2009).
- De Jong, N. . Acoustic properties of ultrasound contrast agents. , (1993).
- Schneider, M. Characteristics of sonovueTM. Echocardiography. 16, 743-746 (1999).
- Klibanov, A. L. Microbubble contrast agents: targeted ultrasound imaging and ultrasound-assisted drug-delivery applications. Investigative Radiology. 41 (3), 354-362 (2006).
- Averkiou, M. A., Powers, J., Skyba, D., Bruce, M., Jensen, S. Ultrasound contrast imaging research. Ultrasound Quarterly. 19 (1), 27-37 (2003).
- Snipstad, S., et al. Contact-mediated intracellular delivery of hydrophobic drugs from polymeric nanoparticles. Cancer Nanotechnology. 5 (1), 8 (2014).
- Epstein, P. S., Plesset, M. S. On the stability of gas bubbles in liquid-gas solutions. The Journal of Chemical Physics. 18 (11), 1505-1509 (1950).
- Borden, M. A., Longo, M. L. Dissolution behavior of lipid monolayer-coated, air-filled microbubbles: effect of lipid hydrophobic chain length. Langmuir. 18 (24), 9225-9233 (2002).
- Deshpande, N., Needles, A., Willmann, J. K. Molecular ultrasound imaging: current status and future directions. Clinical Radiology. 65 (7), 567-581 (2010).
- Miller, M. W., Miller, D. L., Brayman, A. A. A review of in vitro bioeffects of inertial ultrasonic cavitation from a mechanistic perspective. Ultrasound in Medicine & Biology. 22 (9), 1131-1154 (1996).
- Snipstad, S., et al. Sonopermeation to improve drug delivery to tumors: from fundamental understanding to clinical translation. Expert Opinion on Drug Delivery. 15 (12), 1249-1261 (2018).
- Dimcevski, G., et al. A human clinical trial using ultrasound and microbubbles to enhance gemcitabine treatment of inoperable pancreatic cancer. Journal of Controlled Release. 243, 172-181 (2016).
- May, J. -. N., et al. Multimodal and multiscale optical imaging of nanomedicine delivery across the blood-brain barrier upon sonopermeation. Theranostics. 10 (4), 1948-1959 (2020).
- Carmen, J. C., et al. Ultrasonic-enhanced gentamicin transport through colony biofilms of Pseudomonas aeruginosa and Escherichia coli. Journal of Infection and Chemotherapy. 10 (4), 193-199 (2004).
- Runyan, C. M., et al. Low-frequency ultrasound increases outer membrane permeability of Pseudomonas aeruginosa. The Journal of General and Applied Microbiology. 52 (5), 295-301 (2006).
- Yemane, P. T., et al. Effect of ultrasound on the vasculature and extravasation of nanoscale particles imaged in real time. Ultrasound in Medicine & Biology. 45 (11), 3028-3041 (2019).
- van Wamel, A., et al. Acoustic Cluster Therapy (ACT) enhances the therapeutic efficacy of paclitaxel and Abraxane® for treatment of human prostate adenocarcinoma in mice. Journal of Controlled Release. 236, 15-21 (2016).
- Snipstad, S., et al. Ultrasound improves the delivery and therapeutic effect of nanoparticle-stabilized microbubbles in breast cancer xenografts. Ultrasound in Medicine & Biology. 43 (11), 2651-2669 (2017).
- Sheikov, N., McDannold, N., Vykhodtseva, N., Jolesz, F., Hynynen, K. Cellular mechanisms of the blood-brain barrier opening induced by ultrasound in presence of microbubbles. Ultrasound in Medicine & Biology. 30 (7), 979-989 (2004).
- Hynynen, K., McDannold, N., Sheikov, N. A., Jolesz, F. A., Vykhodtseva, N. Local and reversible blood-brain barrier disruption by noninvasive focused ultrasound at frequencies suitable for trans-skull sonications. Neuroimage. 24 (1), 12-20 (2005).
- Aslund, A. K. O., et al. Nanoparticle delivery to the brain-By focused ultrasound and self-assembled nanoparticle-stabilized microbubbles. Journal of Controlled Release. 220, 287-294 (2015).
- Downs, M. E., Buch, A., Karakatsani, M., Konofagou, E. E., Ferrera, V. P. Blood-brain barrier opening in behaving non-human primates via focused ultrasound with systemically administered microbubbles. Scientific Reports. 5, 15076 (2015).
- Baghirov, H., et al. Ultrasound-mediated delivery and distribution of polymeric nanoparticles in the normal brain parenchyma of a metastatic brain tumour model. PloS One. 13 (1), 0191102 (2018).
- Sulheim, E., et al. Therapeutic effect of cabazitaxel and blood-brain barrier opening in a patient-derived glioblastoma model. Nanotheranostics. 3 (1), 103 (2019).
- Lentacker, I., et al. Lipoplex-loaded microbubbles for gene delivery: a Trojan Horse controlled by ultrasound. Advanced Functional Materials. 17 (12), 1910-1916 (2007).
- De Temmerman, M., et al. mRNA-Lipoplex loaded microbubble contrast agents for ultrasound-assisted transfection of dendritic cells. Biomaterials. 32 (34), 9128-9135 (2011).
- Burke, C. W., Alexander, E., Timbie, K., Kilbanov, A. L., Price, R. J. Ultrasound-activated agents comprised of 5FU-bearing nanoparticles bonded to microbubbles inhibit solid tumor growth and improve survival. Molecular Therapy. 22 (2), 321-328 (2014).
- Mørch, &. #. 2. 2. 1. ;., et al. Nanoparticle-stabilized microbubbles for multimodal imaging and drug delivery. Contrast Media & Molecular Imaging. 10 (5), 356-366 (2015).
- Jamburidze, A., et al. Nanoparticle-coated microbubbles for combined ultrasound imaging and drug delivery. Langmuir. 35 (31), 10087-10096 (2019).
- Snipstad, S., et al. Sonopermeation enhances uptake and therapeutic effect of free and encapsulated cabazitaxel. Ultrasound in Medicine and Biology. , (2021).
- De Cock, I., Lajoinie, G., Versluis, M., De Smedt, S. C., Lentacker, I. Sonoprinting and the importance of microbubble loading for the ultrasound mediated cellular delivery of nanoparticles. Biomaterials. 83, 294-307 (2016).
- Roovers, S., et al. Sonoprinting of nanoparticle-loaded microbubbles: Unraveling the multi-timescale mechanism. Biomaterials. 217, 119250 (2019).
- Klymchenko, A. S., et al. Highly lipophilic fluorescent dyes in nano-emulsions: towards bright non-leaking nano-droplets. RSC Advances. 2 (31), 11876 (2012).
- Aslund, A. K. O., et al. Quantification and qualitative effects of different PEGylations on Poly (butyl cyanoacrylate) Nanoparticles. Molecular Pharmaceutics. 14 (8), 2560-2569 (2017).
- Born, M., Wolf, E. . Principles of optics: electromagnetic theory of propagation, interference and diffraction of light. , (1999).
- Pittet, M. J., Weissleder, R. Intravital imaging. Cell. 147 (5), 983-991 (2011).
- Hak, S., Reitan, N. K., Haraldseth, O., de Lange Davies, C. Intravital microscopy in window chambers: a unique tool to study tumor angiogenesis and delivery of nanoparticles. Angiogenesis. 13 (2), 113-130 (2010).
- Fusser, M., et al. Cabazitaxel-loaded Poly (2-ethylbutyl cyanoacrylate) nanoparticles improve treatment efficacy in a patient derived breast cancer xenograft. Journal of Controlled Release. 293, 183-192 (2019).
- Abou-Saleh, R. H., et al. Molecular effects of glycerol on lipid monolayers at the gas-liquid interface: impact on microbubble physical and mechanical properties. Langmuir. 35 (31), 10097-10105 (2019).
- Seynhaeve, A. L. B., ten Hagen, T. L. M. Intravital microscopy of tumor-associated vasculature using advanced dorsal skinfold window chambers on transgenic fluorescent mice. Journal of Visualized Experiments. (131), e55115 (2018).
- Luan, Y., et al. Lipid shedding from single oscillating microbubbles. Ultrasound in Medicine & Biology. 40 (8), 1834-1846 (2014).
- Lajoinie, G., et al. Ultrafast vapourization dynamics of laser-activated polymeric microcapsules. Nature Communications. 5 (1), 1-8 (2014).
- Mathiyazhakan, M., et al. Non-invasive controlled release from gold nanoparticle integrated photo-responsive liposomes through pulse laser induced microbubble cavitation. Colloids and Surfaces B: Biointerfaces. 126, 569-574 (2015).
- Vos, H. J., Emmer, M., de Jong, N. Oscillation of single microbubbles at room versus body temperature. 2008 IEEE Ultrasonics Symposium. , 982-984 (2008).
- Vos, H. J., Dollet, B., Bosch, J. G., Versluis, M., de Jong, N. Nonspherical vibrations of microbubbles in contact with a wall-a pilot study at low mechanical index. Ultrasound in Medicine & Biology. 34 (4), 685-688 (2008).
- Sijl, J., et al. Acoustic characterization of single ultrasound contrast agent microbubbles. The Journal of the Acoustical Society of America. 124 (6), 4091-4097 (2008).
- Garbin, V., et al. Changes in microbubble dynamics near a boundary revealed by combined optical micromanipulation and high-speed imaging. Applied Physics Letters. 90 (11), 114103 (2007).
- Baresch, D., Garbin, V. Acoustic trapping of microbubbles in complex environments and controlled payload release. Proceedings of the National Academy of Sciences of the United States of America. 117 (27), 15490-15496 (2020).
- Maresca, D., et al. Acoustic sizing of an ultrasound contrast agent. Ultrasound in Medicine & Biology. 36 (10), 1713-1721 (2010).
- Renaud, G., Bosch, J. G., vander Steen, A. F. W., de Jong, N. An "acoustical camera" for in vitro characterization of contrast agent microbubble vibrations. Applied Physics Letters. 100 (10), 101911 (2012).
- Renaud, G., Bosch, J. G., Van Der Steen, A. F. W., De Jong, N. Low-amplitude non-linear volume vibrations of single microbubbles measured with an "acoustical camera.". Ultrasound in Medicine & Biology. 40 (6), 1282-1295 (2014).
- Luan, Y., et al. Combined optical sizing and acoustical characterization of single freely-floating microbubbles. Applied Physics Letters. 109 (23), (2016).
- Lajoinie, G., et al. In vitro methods to study bubble-cell interactions: Fundamentals and therapeutic applications. Biomicrofluidics. 10 (1), 011501 (2016).
- Guan, J., Matula, T. J. Using light scattering to measure the response of individual ultrasound contrast microbubbles subjected to pulsed ultrasound in vitro. The Journal of the Acoustical Society of America. 116 (5), 2832-2842 (2004).
- Sofias, A. M., Åslund, A. K. O., Hagen, N., Grendstad, K., Hak, S. Simple and robust intravital microscopy procedures in hybrid TIE2GFP-BALB/c transgenic mice. Molecular Imaging and Biology. 22 (3), 486-493 (2020).
- Ritsma, L., Steller, E. J. A., Ellenbroek, S. I. J., Kranenburg, O., Borel Rinkes, I. H. M., van Rheenen, J. Surgical implantation of an abdominal imaging window for intravital microscopy. Nature Protocols. 8 (3), 583-594 (2013).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiThis article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır