Se requiere una suscripción a JoVE para ver este contenido. Inicie sesión o comience su prueba gratuita.
Method Article
Un método generalizado para determinar la composición del ácido fenólico soluble libre y la capacidad antioxidante de los cereales y las legumbres
En este artículo
Resumen
Los ácidos fenólicos son fitoquímicos importantes que están presentes en los granos enteros. Poseen propiedades bioactivas como funciones protectoras antioxidantes. Este trabajo tuvo como objetivo informar sobre un método generalizado para la identificación de HPLC, la estimación del contenido fenólico total y la determinación de la capacidad antioxidante de los ácidos fenólicos en cereales y legumbres.
Resumen
Los ácidos fenólicos son una clase de compuestos orgánicos que tienen tanto un grupo fenólico como un grupo carboxílico. Se encuentran en los granos y se concentran en el salvado de los cereales o la capa de semillas de las legumbres. Poseen propiedades antioxidantes que han generado mucho interés de investigación en los últimos años, sobre sus posibles funciones antioxidantes protectoras de la salud. Este trabajo presenta un método generalizado para la extracción de ácidos fenólicos solubles libres de granos enteros y el análisis de su capacidad antioxidante. Se utilizaron cinco muestras de granos enteros que comprenden dos cereales (trigo y maíz amarillo) y tres legumbres (caupí, frijol y soja). Los granos se molían en harina y sus ácidos fenólicos solubles libres se extraían utilizando metanol acuoso. Los compuestos se identificaron utilizando un cromatógrafo de líquidos de alta presión (HPLC). El método Folin-Ciocalteu se utilizó para determinar su contenido fenólico total, mientras que sus capacidades antioxidantes se determinaron utilizando los ensayos de capacidad de eliminación de radicales DPPH, capacidad antioxidante equivalente (TEAC) de Trolox y capacidad de absorción de radicales de oxígeno (ORAC). Los ácidos fenólicos identificados incluyeron ácidos vanílico, cafeico, p-cumárico y ferúlico. El ácido vanílico se identificó solo en el caupí, mientras que el ácido cafeico se identificó solo en el frijol. El ácido p-cumárico se identificó en el maíz amarillo, el caupí y la soja, mientras que el ácido ferúlico se identificó en todas las muestras. El ácido ferúlico fue el ácido fenólico predominante identificado. La concentración total de ácidos fenólicos en las muestras disminuyó en el siguiente orden: soja > caupí > maíz amarillo = frijol > trigo. La capacidad antioxidante total (suma de valores de los ensayos DPPH, TEAC y ORAC) disminuyó de la siguiente manera: soja > frijol > maíz amarillo = caupí > trigo. Este estudio concluyó que el análisis de HPLC, así como los ensayos DPPH, TEAC y ORAC proporcionan información útil sobre la composición del ácido fenólico y las propiedades antioxidantes de los granos enteros.
Introducción
Los ácidos fenólicos se encuentran entre los fitoquímicos más importantes estudiados en las plantas debido al papel vital que desempeñan en la defensa de las plantas contra la herbivoría y la infección por hongos, así como en el mantenimiento del soporte estructural y la integridad en los tejidos vegetales 1,2. Son abundantes en el salvado de cereales y en la capa de semillas de legumbres3. Estructuralmente, se dividen en dos grupos: los ácidos hidroxibenzoico (Figura 1) y los ácidos hidroxicinámicos (Figura 2). Los ácidos hidroxibenzoicos comunes en cereales y legumbres incluyen ácidos gálico, p-hidroxibenzoico, 2,4-dihidroxibenzoico, protocatecúico, vanílico y sirígrico, mientras que los ácidos hidroxicinámicos comunes incluyen ácidos cafeico, p-cumárico, ferúlico y sinápico3. Los ácidos fenólicos también poseen propiedades antioxidantes, ya que son capaces de eliminar los radicales libres, que causan rancidez oxidativa en las grasas, e iniciar y propagar el estrés oxidativo inducido por radicales en los sistemas fisiológicos 4,5. Debido a este papel fisiológico vital como antioxidantes, son objeto de investigaciones recientes. Esto se debe a que cuando se consumen como componentes de alimentos vegetales, pueden ejercer protección antioxidante.
Los cereales y los productos de cereales son las principales fuentes de alimentos con carbohidratos para humanos y animales en todo el mundo6. Los cereales incluyen trigo, arroz, maíz (maíz), cebada, triticale, mijo y sorgo. Entre ellos, el maíz es el más utilizado, con una utilización global estimada de 1.135,7 millones de toneladas en 2019/2020, seguido del trigo con una utilización global estimada de 757,5 millones de toneladas durante el mismo período7. Los alimentos de cereales son grandes fuentes de energía para los consumidores, ya que son fuentes ricas en carbohidratos. También aportan algo de proteínas, grasas, fibra, vitaminas y minerales6. Además de su valor nutricional, los cereales son buenas fuentes de antioxidantes fitoquímicos, particularmente ácidos fenólicos, que tienen el potencial de proteger el sistema fisiológico del daño oxidativo inducido por radicales3. Las legumbres también son buenas fuentes de nutrientes y generalmente son más altas en proteínas que los cereales. También contienen vitaminas y minerales y se utilizan en la preparación de diversos alimentos8. Además, las legumbres son buenas fuentes de una variedad de antioxidantes fitoquímicos, incluidos ácidos fenólicos, flavonoides, antocianinas y proantocianidinas 9,10. Diferentes variedades de cereales y legumbres pueden tener una composición de ácido fenólico diferente. Por lo tanto, existe la necesidad de estudiar la composición de ácido fenólico de los cereales y las legumbres y sus variedades, con el fin de conocer sus posibles beneficios para la salud con respecto a los antioxidantes fenólicos.
Se han reportado varios ensayos para medir la cantidad de ácidos fenólicos en granos de cereales y leguminosas, y determinar sus actividades antioxidantes. Los métodos de análisis más comunes para los ácidos fenólicos de grano entero son la espectrofotometría y la cromatografía líquida11. El objetivo de este trabajo fue demostrar un método cromatográfico líquido generalizado de alta presión para determinar la composición del ácido fenólico soluble libre, y métodos espectrofotométricos para determinar el contenido fenólico total y la capacidad antioxidante de algunos cereales y legumbres integrales.
Protocolo
1. Tipo de muestras
- Use cinco muestras de granos enteros, que comprenden dos cereales (por ejemplo, trigo duro y maíz amarillo) y tres legumbres (por ejemplo, caupí Blackeye, soja y frijol rojo) para este estudio.
- Moler 50 g de cada grano en triplicados en harina, usando un molinillo de café, y pasarlos a través de un tamiz de 500 μm.
- Guárdelos a -20 °C.
2. Preparación de la muestra
-
Determinación del contenido de materia seca y expresión de la base de peso seco
NOTA: Determinar el contenido de materia seca de cada muestra en polvo según el método de AOAC (2000)12.- Encienda un horno de convección forzada y ajuste la temperatura a 130 °C.
- Desecante seco (gel de sílice) en el horno durante 30 min a 1 h y transferir el gel de sílice seco a un desecador.
- Pese con precisión 2 g de cada muestra en una lata de aluminio limpia, presecada y pesada.
- Secar las muestras pesadas a 130 °C durante 1 h en un horno de convección forzada.
- Transfiera la muestra seca al desecador y deje enfriar a temperatura ambiente.
- Pesar la muestra seca y enfriada y registrar su peso.
- Calcule el contenido de materia seca de cada muestra de la siguiente manera:
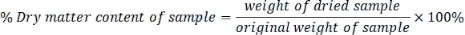
- Exprese cada parámetro medido en base de peso seco utilizando la siguiente fórmula:

-
Extracción de ácido fenólico
NOTA: Extraer los compuestos fenólicos libres solubles en las muestras de grano utilizando una modificación del método de Y. Qiu et al.5 que permite la extracción fenólica de cantidades de miligramos de granos enteros.- Pese con precisión 100 mg de la muestra de harina de grano entero directamente en un tubo de microcentrífuga de 2 ml de capacidad de color ámbar. El color oscuro del tubo ayuda a prevenir la exposición de la mezcla a la luz.
- Agregue 1 ml de metanol acuoso de grado HPLC al 80% a cada uno de los tubos que contienen las muestras.
- Vórtice brevemente para mezclar la solución de metanol y las muestras.
- Sonicar las muestras durante 60 min para extraer los compuestos fenólicos solubles libres. Coloque una cubierta sobre las muestras durante la duración de la sonicación para mayor protección contra la luz.
- Después de la sonicación, centrifugar la mezcla a 20.000 × g durante 5 min para sedimentar los residuos sólidos que salen del sobrenadante en la parte superior. Los compuestos fenólicos libres estarán presentes en el sobrenadante después de la centrifugación.
- Transfiera el sobrenadante a un tubo de microcentrífuga limpio.
NOTA: El sobrenadante debe filtrarse antes de inyectarse en el instrumento HPLC. Para filtrar el sobrenadante, retire el émbolo de una jeringa de 3 ml y conecte un filtro de jeringa. El filtro debe tener un tamaño de poro no mayor de 0,22 μm. - Pipetear aproximadamente 0,4 ml del sobrenadante en la parte superior de la jeringa. Vuelva a insertar el émbolo y empuje el líquido a través del filtro en un vial de HPLC que contenga un inserto de vial.
- Una vez que el instrumento se ha configurado para ejecutar el método descrito en el manuscrito para el análisis de HPLC, cargue los viales en el carrusel para que se correspondan con la lista de muestras.
- Obtener cromatogramas de HPLC a 320 nm y 280 nm mostrando picos distintos que representan diferentes compuestos fenólicos.
- Utilizando curvas estándar apropiadas, cuantificar los ácidos hidroxicinámicos a 320 nm, ya que tienen la máxima absorbancia en esta longitud de onda. Por el mismo principio, cuantificar los ácidos hidroxibenzoicos a 280 nm.
- Conservar los extractos restantes a -20 °C para otros análisis.
3. Composición fenólica
- Utilice un cromatógrafo de líquidos de alta presión (Tabla de materiales) para identificar y cuantificar los compuestos fenólicos extraídos en las muestras, basado en el método de J. Xiang, F.B. Apea-Bah, V. U. Ndolo, M.C. Katundu y T. Beta 4.
- Preparar estándares de ácido fenólico (ácido vanílico, ácido cafeico, ácido p-cumárico, ácido ferúlico y ácido sinápico) para identificar y cuantificar los compuestos fenólicos constituyentes en los extractos.
- Para hacer esto, pese 1 mg de cada estándar y disuelva en 1 ml de metanol acuoso al 50% para producir 1,000 μg / ml de cada estándar.
- Mezcle volúmenes iguales de los cinco estándares en un tubo centrífugo de ámbar de 2 ml para producir un cóctel de estándares, cada uno con una concentración de 200 μg / ml.
- Prepare diluciones en serie del cóctel estándar tomando un volumen en un tubo nuevo y diluyendo con el mismo volumen del disolvente de metanol acuoso.
- Repetir las diluciones seriadas hasta una concentración de 3,125 μg/mL.
- Además, diluya por separado cada estándar 40 veces con el disolvente para obtener una concentración de 25 μg / ml de cada estándar.
- Ajuste la temperatura de la columna a 35 °C y la temperatura del horno de muestra a 15 °C.
- Para preparar la fase A móvil (ácido fórmico acuoso al 0,1%), transfiera 1 ml de ácido fórmico a un matraz volumétrico de 1 L de capacidad y agregue agua de grado HPLC a la marca de 1 L. Agitar bien para mezclar.
- Para preparar la fase B móvil (0,1% de ácido fórmico en metanol), transfiera 1 ml de ácido fórmico a un matraz volumétrico de 1 L de capacidad y agregue metanol de grado HPLC a la marca de 1 L. Agitar bien para mezclar.
- Ajuste los volúmenes a la marca de 1 L si es necesario.
- Filtra ambas fases móviles a través de un papel de filtro hidrófilo de 0,45 μm.
- Para el análisis, inyecte 10 μL de cada extracto o estándar (estándares de 25 μg/ml y los cócteles estándar) en la columna de fase inversa.
- Elute con las fases móviles según el programa de gradiente lineal para una carrera de 25 min de la siguiente manera: 0-3.81 min, 9%-14% B; 3.81-4.85 min, 14%-15% B; 4.85-5.89 min, 15%-15% B, 5.89-8.32 min, 15%-17% B; 8.32-9.71 min, 17%-19% B; 9.71-10.40 min, 19%-19% B; 10.40-12.48 min, 19%-26% B; 12.48-13.17 min, 16%-28% B; 13.17-14.21 min, 28%-35% B; 14.21-15.95 min, 35%-40% B; 15.95-16.64 min, 40%-48% B; 16.64-18.37 min, 48%-53% B; 18.37-22.53 min, 53%-70% B; 22.53-22.88 min, 70%-90% B; 22.88-25.00 min, 90% B.
- Comparar los tiempos de retención de los picos cromatográficos obtenidos para los estándares auténticos de concentraciones de 25 μg/mL, a 280 nm y 320 nm, con los de los extractos, con el fin de identificar los compuestos fenólicos constituyentes en las muestras.
- Trazar curvas de calibración para los cócteles estándar de ácido fenólico, con concentración de los estándares en el eje horizontal y el área de pico en el eje vertical
- Utilice las curvas de calibración para estimar las concentraciones de los compuestos fenólicos identificados, comparando las áreas de pico en la parcela con las de los compuestos identificados a 280 nm y 320 nm como se mencionó en la sección anterior.
4. Contenido fenólico total
NOTA: Determinar el contenido fenólico total de los extractos utilizando el método Folin-Ciocalteu descrito por F.B. Apea-Bah et al.13.
- Preparar estándares de ácido ferúlico y ácido gálico dentro del rango de concentración de 0.025 a 0.150 mg / ml para trazar curvas de calibración en comparación, para la estimación del contenido fenólico total.
- Para hacer esto, pese con precisión 1 mg cada uno de los estándares de ácido ferúlico y ácido gálico en tubos de centrífuga de 2 ml de capacidad.
- Agregue 1 ml de metanol acuoso al 50% a cada estándar y vórtice para disolver, produciendo 1 mg / ml de stock de cada estándar.
- Preparar una serie de diluciones de cada solución madre en un total de 500 μL.
- Pipetear 18.2 μL de cada extracto o estándar en un pozo separado en una microplaca de 96 pocillos.
- Añadir 36,4 μL de reactivo acuoso folin-Ciocalteu al 10% (v/v) a cada extracto o estándar.
- Luego, agregue 145.4 μL de carbonato de sodio de 700 mM a cada mezcla de reacción.
- Incubar las mezclas de reacción en la oscuridad a temperatura ambiente (20-25 °C) durante 2 h.
- Lea la absorbancia en un lector de microplacas a 750 nm.
- Trazar curvas de calibración de cambio en la absorbancia contra la concentración de los estándares de ácido fenólico y utilizarlas para estimar el contenido fenólico total.
- Expresar los resultados como equivalentes de miligramo de ácido ferúlico por gramo de muestra molida (mg FAE/g) y equivalentes de miligramo de ácido gálico por gramo de muestra molida (mg GAE/g) sobre la base del peso seco.
5. Ensayos antioxidantes
NOTA: Determinar la capacidad antioxidante de los extractos de grano utilizando los siguientes tres ensayos: capacidad de eliminación de radicales 2,2-difenil-1-picrilhidracilo (DPPH); Capacidad de eliminación de radicales 2,2'-azino-bis(ácido etilbenzotiazolina-6-sulfónico (ABTS), que también se denomina capacidad antioxidante equivalente a Trolox (TEAC); y capacidad de absorción de radicales de oxígeno (ORAC).
- Preparación de estándares Trolox para curvas estándar
- Use Trolox, un análogo soluble en agua de la vitamina E, como estándar para estimar la capacidad antioxidante in vitro de los extractos de granos enteros.
- Pese con precisión 1 mg de Trolox en un tubo de 15 ml. Disolver en 4 mL de metanol acuoso al 50%. Vórtice para disolver para preparar una solución madre de 1 mM (1000 μM).
- Preparar seis concentraciones de Trolox, es decir, 50, 100, 200, 400, 600 y 800 μM para trazar curvas estándar para la estimación de la capacidad de eliminación de radicales DPPH y la capacidad antioxidante equivalente de Trolox (TEAC). Del mismo modo, prepare concentraciones de 6.25, 12.5, 25 y 50 μM de Trolox para estimar la capacidad de absorción de radicales de oxígeno (ORAC). Componga el volumen total de cada concentración a 500 μL como se muestra en la Tabla 1.
- Dilución de extractos de muestra
- Diluya los extractos de muestra con metanol antes del análisis. Aquí, los extractos de maíz amarillo y caupí se diluyeron dos veces, el trigo y el frijol se diluyeron cinco veces, mientras que el extracto de soja se diluyó 10 veces con metanol.
- Ensayo de capacidad antioxidante equivalente (TEAC) de Trolox
- Medir la capacidad antioxidante equivalente (TEAC) de Trolox de las muestras utilizando el método descrito anteriormente por F.B. Apea-Bah et al.14.
- Pesar 8,23 mg de ABTS en un tubo de centrífuga ámbar limpio de 2 ml de capacidad.
- A continuación, pese 1,62 mg de persulfato de potasio en otro tubo de centrífuga ámbar limpio de 2 ml de capacidad.
- Agregue 1 ml de agua destilada a cada uno de ellos y vórtice para disolverlos.
NOTA: Esto da como resultado una solución madre ABTS de 16 mM con una solución acuosa de persulfato de potasio de 6 mM. - Prepare la solución madre de ABTS mezclando las soluciones de ABTS y persulfato de potasio en volúmenes iguales. La solución cambiará inmediatamente a un color oscuro.
- Incubar la mezcla de reactivos en la oscuridad durante 12-16 h.
- Diluya la solución madre de ABTS 30 veces con solución salina tamponada con fosfato (PBS) de 200 mM, para formar la solución de trabajo de ABTS. Para hacer esto, agregue 58 ml de PBS de 200 mM a 2 ml de la solución madre ABTS. La solución de trabajo contendrá 0,27 mM de ABTS y 0,1 mM de persulfato de potasio.
- Para el análisis, coloque 10 μL de cada extracto diluido o Trolox en una microplaca de 96 pocillos.
- Agregue 190 μL de solución de trabajo ABTS a cada pozo e incube las mezclas de reacción durante 60 min.
- Mida la absorbancia de las mezclas de reacción a 750 nm en un lector de microplacas.
- Utilice los estándares Trolox en una concentración que oscila entre 100 y 800 μmol/L para trazar una curva de calibración.
- Estimar la capacidad de eliminación de radicales ABTS a partir de la curva de calibración.
- Expresar los resultados como equivalentes de Trolox micromol por gramo (μmol TE/g) de muestra sobre la base del peso seco.
- Ensayo DPPH
NOTA: Determinar la capacidad de eliminación de radicales DPPH de las muestras utilizando el método descrito anteriormente por F.B. Apea-Bah et al.13. El ensayo antioxidante DPPH requiere un compuesto generador de radicales, DPPH (2,2-difenil-1-picrilhidracilo).- Pesa con precisión 1,2 mg de DPPH en un tubo centrífugo vacío de 50 ml de capacidad. Disolver el DPPH en 30 ml de metanol para preparar una solución metanólica de 60 μmol/L.
NOTA: El ensayo DPPH prueba la capacidad de los extractos de muestra para eliminar los radicales libres producidos por DPPH. - Para el análisis, agregue 5 μL de los extractos de muestra o la solución de Trolox en los pocillos de microplacas.
- A continuación, agregue 195 μL de la solución metanólica DPPH de 60 μmol/L e incube durante 60 min.
- Mida la absorbancia de la mezcla de reacción a 515 nm.
- Utilice los estándares trolox (50-800 μmol/L) para trazar una curva de calibración, con el cambio de absorbancia en el eje vertical y las concentraciones de Trolox en el eje horizontal.
- Estimar la capacidad de barrido de DPPH a partir de la curva de calibración.
- Expresar los resultados como equivalentes de Trolox micromol por gramo (μmol TE/g) de muestra sobre la base del peso seco.
- Pesa con precisión 1,2 mg de DPPH en un tubo centrífugo vacío de 50 ml de capacidad. Disolver el DPPH en 30 ml de metanol para preparar una solución metanólica de 60 μmol/L.
- Capacidad de absorción de radicales de oxígeno
- Determinar la capacidad de absorción de radicales de oxígeno (ORAC) de las muestras basándose en el método de F.B. Apea-Bah et al.13.
- Para comenzar, prepare los estándares Trolox de concentraciones de 6.25, 12.5, 25 y 50 μM a partir de una solución madre estándar Trolox de 1,000 μM en un tampón de fosfato de potasio de 75 mM (K2HPO4 / KH2PO4).
- Para hacer esto, pese 1 mg de polvo de Trolox y disuelva en 4 ml de la solución tampón bajo sonicación para preparar una solución madre de 1.000 μM.
- Luego, tome 50 μL de la solución madre en un tubo de centrífuga de 2 ml de capacidad y diluya con 950 μL de solución tampón para obtener 1.000 μL de solución Trolox de 50 μM.
- Pipetear 500 μL de la solución de 50 μM en un nuevo tubo y diluir con igual volumen de tampón para obtener una solución trolox de 25 μM.
- Repetir la dilución en serie de los 25 μM para obtener 12,5 μM, y luego repetir de manera similar la dilución de 12,5 μM para obtener 6,25 μM.
- Preparar las diluciones apropiadas de los extractos de muestra.
- Diluya los extractos amarillos de maíz y caupí 20 veces, los extractos de trigo y frijol 50 veces y el extracto de soja 100 veces con la solución tampón.
- Transfiera 200 μL de cada muestra o estándar Trolox a los pozos de una microplaca negra de 96 pocillos para pipeteo automático.
- Luego, llene los tres tanques de reactivos provistos con el equipo ORAC, con lo siguiente: (1) la solución tampón; 2) fluoresceína de 0,816 nM en el tampón; y (3) 153 mM de 2,2′-azobis(2-amidinopropano) diclorhidrato (AAPH) en tampón.
- Colóquelos en sus receptáculos para pipetear automáticamente.
- Configure la máquina ORAC y el sistema de pipeteo automático para el análisis, según el procedimiento operativo estándar.
- Para el análisis, configure el sistema de pipeteo automatizado para transferir 25 μL de cada extracto diluido o estándar a los pozos de una microplaca negra de fondo transparente de 96 pocillos.
- Luego, agregue automáticamente 150 μL de 0.816 nM de fluoresceína en el tampón.
- Incubar la mezcla de reacción a 37 °C durante 15 min en la máquina ORAC.
- Posteriormente, agregue automáticamente 25 μL del AAPH a cada mezcla de reacción.
- Incubarlos a 37 °C durante 50 min en la máquina ORAC.
- Configure la máquina ORAC para medir la desintegración de la fluorescencia, durante el período de incubación, en longitudes de onda de excitación y emisión de 485 nm y 520 nm, respectivamente.
- Después de las mediciones, trace una curva estándar de Trolox, con Trolox (6.25-50 μM) en el eje horizontal y desintegración de fluorescencia en el eje vertical.
- Estimar la capacidad de absorción de radicales de oxígeno de los extractos de la curva estándar de Trolox.
- Expresar los resultados como muestra de μmol TE/g sobre la base del peso seco.
- Análisis estadístico
- Presente todos los resultados como medias ± desviación estándar de al menos triplicados.
- Realizar análisis de varianza (ANOVA) para determinar el efecto del tipo de grano sobre las variables de respuesta.
- Cuando existan diferencias significativas en p < 0,05, utilice la diferencia menos significativa (LSD) para comparar las medias.
- Realizar análisis de correlación de Pearson para estimar la relación entre el contenido fenólico y las capacidades antioxidantes.
Resultados
La Tabla 2 muestra los ácidos fenólicos que se identificaron en los granos de cereales y legumbres. Sobre la base de los estándares auténticos disponibles, se identificaron cuatro ácidos fenólicos en las muestras y son: ácidos vanílico, cafeico, p-cumárico y ferúlico. El ácido vainílico es un ácido hidroxibenzoico, mientras que los otros tres son ácidos hidroxicinámicos. El ácido vanílico se identificó solo en el caupí Blackeye, mientras que el ácido cafeico se identificó s...
Discusión
Los granos enteros fueron seleccionados como granos de cereales representativos y legumbres que encuentran amplias aplicaciones alimentarias en todo el mundo. Si bien pueden existir variaciones entre los cultivares de cada grano, el enfoque de este estudio fue demostrar un método generalizado para la extracción y análisis de ácido fenólico libre para granos enteros. El método de extracción se modificó reduciendo sustancialmente las cantidades de muestras y disolventes, con el fin de reducir la cantidad de product...
Divulgaciones
Los autores declaran que no hay conflictos de intereses.
Agradecimientos
Los autores agradecen el apoyo técnico de la Sra. Alison Ser y la Sra. Hannah Oduro-Obeng, así como el apoyo a la edición de vídeo de la Sra. Janice Fajardo y el Sr. Miguel del Rosario.
Materiales
| Name | Company | Catalog Number | Comments |
| 15 mL Falcon conical centrifuge tubes | Fisher Scientific | 05-527-90 | |
| 2 mL Amber glass ID Surestop vial | Thermo Scientific | C5000-2W | |
| 2 mL Amber microcentrifuge tubes | VWR | 20170-084 | |
| 2,2′-Azobis(2-amidinopropane) dihydrochloride (AAPH) | Sigma-Aldrich | 440914-100G | |
| 2,2'-Azino-bis(3-ethylbenzothiazoline-6-sulfonic acid (ABTS) (C18H18N4O6S4) ≥98%, | Sigma Aldrich | A1888-2G | |
| 2,2-Diphenyl-1pikrylhydrazyl (DPPH) (C18H12N5O6) | Sigma Aldrich | D913-2 | |
| 6-Hydroxy-2,5,7,8-tetramethylchroman-2-carboxylic acid (Trolox) (C14H18O4), ≥98% | Fluka Chemika | 56510 | |
| 9 mm Autosampler Vial Screw Thread Caps | Thermo Scientific | 60180-670 | |
| 96 well flat bottom plates | Fisher Scientific | 12565501 | |
| Agilent BioTek ELx800 microplate reader | Fisher Scientific | BT-ELX800NB | |
| Agilent BioTek Precision 2000 96/384 Automated Microplate Pipetting System | Fisher Scientific | N/A | |
| Agilent BioTek FLx800 Microplate Fluorescence Reader | Fisher Scientific | N/A | |
| Analytical balance SI-114 | Denver Instrument | SI-114.1 | |
| Autosampler, Waters 717 Plus | Waters | WAT078900 | |
| BD 3 mL syringe Luer-Lok Tip | BD | 309657 | |
| Bransonic ultrasonic cleaner, Branson 5510 | Millipore Sigma | Z245143 | |
| Corning LSE Vortex Mixer | Corning | 6775 | |
| Durapore Filter (0.45 µm PVDF Membrane) | Merck Millipore Ltd | HVLP04700 | |
| Durapore Membrane Filters (0.45 µm HV) | Merck Millipore Ltd | HVHP04700 | |
| Eppendorf Research plus, 0.5-10 µL | Eppendorf | 3123000020 | |
| Eppendorf Research plus, 0.5-5 mL | Eppendorf | 3123000071 | |
| Eppendorf Research plus, 100-1000 µL | Eppendorf | 3123000063 | |
| Eppendorf Research plus, 10-100 µL | Eppendorf | 3123000047 | |
| Ethyl acetate, HPLC grade | Fisher Chemical | E195-4 | |
| Ferulic acid standard | Sigma Aldrich | 128708-5G | |
| Fluorescein | Fisher Scientific | AC119245000 | |
| Folin & Ciocalteu phenol reagent | Sigma Aldrich | F9252 | |
| Formic acid, 99% | Acros Organics, Janssen Pharmaceuticalaan 3a | 27048-0010 | |
| Gallic acid standard | Sigma | G7384 | |
| High performance liquid chromatograph (HPLC), Waters 2695 | Waters | 960402 | |
| Methanol, HPLC grade | Fisher Chemical | A452-4 | |
| Micro pipet tips, 0.5-10 µL | Fisherbrand | 21-197-2F | |
| Microcentrifuge Sorvall Legend Micro 21 centrifuge | Thermo Scientific | 75002435 | |
| Multichannel micropipette, Proline Plus, 30-300 µL | Sartorius | 728240 | |
| Photodiode array detector, Waters 2996 | Waters | 720000350EN | |
| Pipet tips, 1000 µL | VWR | 83007-382 | |
| Pipet tips, 1-5 mL | VWR | 82018-840 | |
| Potassium persulfate (K2S2O8), ≥99.0% | Sigma Aldrich | 216224-100G | |
| Potassium phosphate dibasic anhydrous (K2HPO4) | Fisher Scientific | P288-500 | |
| Potassium phosphate monobasic (KH2PO4) | Fisher Scientific | P285-500 | |
| PYREX 250 mL Short Neck Boiling Flask, Round Bottom | Corning | 4321-250 | |
| Reversed phase C18 Analytical Column (100 x 3 mm) Accucore aQ | Thermo Scientific | 17326-103030 | |
| Roto evaporator, IKA RV 10 | IKA | 0010005185 | |
| Sodium carbonate (NaCO3) anhydrous | Fisher Chemical | S263-1 | |
| Sodium chloride (NaCl) | Mallinckrodt AR® | 7581 | |
| Sodium phosphate dibasic anhydrous (Na2HPO4) | Fisher Scientific | BP332-500 | |
| Sodium phosphate monobasic anhydrous (NaH2PO4) | Fisher bioreagents | BP329-500 | |
| Standardization pipet tips 0-200µL | Fisherbrand | 02-681-134 | |
| Syringe Driven Filter unit (0.22 µm) | Millex®-GV | SLGVR04NL | |
| Target micro-serts vial insert (400 µL) | Thermo Scientific | C4011-631 | |
| Ultrapure water (Direct Q-3 UV system with pump) | Millipore | ZRQSVP030 |
Referencias
- Huitu, O., et al. Silicon, endophytes and secondary metabolites as grass defenses against mammalian herbivores. Frontiers in Plant Science. 5, 478 (2014).
- Joshi, J. R., Burdman, S., Lipsky, A., Yariv, S., Yedidia, I. Plant phenolic acids affect the virulence of Pectobacterium aroidearum and P. carotovorum ssp. brasiliense via quorum sensing regulation. Molecular Plant Pathology. 17 (4), 487-500 (2016).
- Dykes, L., Rooney, L. W. Phenolic compounds in cereal grains and their health benefits. Cereal Foods World. 52 (3), 105-111 (2007).
- Xiang, J., Apea-Bah, F. B., Ndolo, V. U., Katundu, M. C., Beta, T. Profile of phenolic compounds and antioxidant activity of finger millet varieties. Food Chemistry. 275, 361-368 (2019).
- Qiu, Y., Liu, Q., Beta, T. Antioxidant properties of commercial wild rice and analysis of soluble and insoluble phenolic acids. Food Chemistry. 121 (1), 140-147 (2010).
- Beverly, R. L., Motarjemi, Y. . Encyclopedia of Food Safety. 3, 309-314 (2014).
- FAO. Food Outlook - Biannual report on global food markets. Food and Agriculture Organization. , (2020).
- Erbersdobler, H. F., Barth, C. A., Jahreis, G. Legumes in human nutrition. Nutrient content and protein quality of pulses. Ernahrungs Umschau. 64 (9), 134-139 (2017).
- Dueñas, M., Hernández, T., Estrella, I. Assessment of in vitro antioxidant capacity of the seed coat and the cotyledon of legumes in relation to their phenolic contents. Food Chemistry. 98 (1), 95-103 (2006).
- Khang, D. T., Dung, T. N., Elzaawely, A. A., Xuan, T. D. Phenolic profiles and antioxidant activity of germinated legumes. Foods. 5 (2), 27 (2016).
- Hefni, M. E., Amann, L. S., Witthöft, C. M. A HPLC-UV method for the quantification of phenolic acids in cereals. Food Analytical Methods. 12 (12), 2802-2812 (2019).
- AOAC. . Official Methods of Analysis. 17th edn. , (2000).
- Apea-Bah, F. B., Head, D., Scales, R., Bazylo, R., Beta, T. Hydrothermal extraction, a promising method for concentrating phenolic antioxidants from red osier dogwood (Cornus stolonifer) leaves and stems. Heliyon. 6 (10), 05158 (2020).
- Apea-Bah, F. B., Minnaar, A., Bester, M. J., Duodu, K. G. Sorghum-cowpea composite porridge as a functional food, Part II: Antioxidant properties as affected by simulated in vitro gastrointestinal digestion. Food Chemistry. 197, 307-315 (2016).
- Robbins, R. J., Bean, S. R. Development of a quantitative high-performance liquid chromatography-photodiode array detection measurement system for phenolic acids. Journal of Chromatography A. 1038 (1-2), 97-105 (2004).
- Singleton, V. L., Rossi, J. A. Colorimetry of total phenolics with phosphomolybdic-phosphotungstic acid reagents. American Journal of Enology and Viticulture. 16, 144-158 (1965).
- Prior, R. L., Wu, X., Schaich, K. Standardized methods for the determination of antioxidant capacity and phenolics in foods and dietary supplements. Journal of Agricultural and Food Chemistry. 53 (10), 4290-4302 (2005).
- Ainsworth, E. A., Gillespie, K. M. Estimation of total phenolic content and other oxidation substrates in plant tissues using Folin-Ciocalteu reagent. Nature Protocols. 2 (4), 875-877 (2007).
- Waterhouse, A. L. Determination of total phenolics. Current Protocols in Food Analytical Chemistry. 1, 1-8 (2002).
- Huang, D., Ou, B., Prior, R. L. The chemistry behind antioxidant capacity assays. Journal of Agricultural and Food Chemistry. 53 (6), 1841-1856 (2005).
- Esterbauer, H., Wäg, G., Puhl, H. Lipid peroxidation and its role in atherosclerosis. British Medical Bulletin. 49 (3), 566-576 (1993).
- Esterbauer, H., Gebicki, J., Puhl, H., Jürgens, G. The role of lipid peroxidation and antioxidants in oxidative modification of LDL. Free Radical Biology and Medicine. 13 (4), 341-390 (1992).
- Apea-Bah, F. B., Serem, J. C., Bester, M. J., Duodu, K. G. Phenolic composition and antioxidant properties of Koose, a deep-fat fried cowpea cake. Food Chemistry. 237, 247-256 (2017).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados