Bu içeriği görüntülemek için JoVE aboneliği gereklidir. Oturum açın veya ücretsiz deneme sürümünü başlatın.
Method Article
Tahılların ve baklagillerin serbest çözünür fenolik asit bileşimini ve antioksidan kapasitesini belirlemek için genelleştirilmiş bir yöntem
Bu Makalede
Özet
Fenolik asitler, kepekli tahıllarda bulunan önemli fitokimyasallardır. Antioksidan koruyucu fonksiyonlar gibi biyoaktif özelliklere sahiptirler. Bu çalışma, HPLC tanımlaması, toplam fenolik içerik tahmini ve tahıl ve baklagillerde fenolik asitlerin antioksidan kapasitesinin belirlenmesi için genelleştirilmiş bir yöntemin raporlanmasını amaçlamıştır.
Özet
Fenolik asitler, hem fenolik bir grubu hem de bir karboksilik grubu taşıyan bir organik bileşik sınıfıdır. Tahıllarda bulunurlar ve tahılların kepeğinde veya baklagillerin tohum kabuğunda yoğunlaşırlar. Son yıllarda potansiyel antioksidan koruyucu sağlık işlevleri hakkında çok fazla araştırma ilgisi yaratan antioksidan özelliklere sahiptirler. Bu çalışma, serbest çözünür fenolik asitlerin kepekli tahıllardan ekstraksiyonu ve antioksidan kapasitelerinin analizi için genelleştirilmiş bir yöntem sunmaktadır. İki tahıl (buğday ve sarı mısır) ve üç baklagilden (börülce fasulyesi, barbunya fasulyesi ve soya fasulyesi) oluşan beş tam tahıl örneği kullanılmıştır. Taneler un haline getirildi ve serbest çözünür fenolik asitleri sulu metanol kullanılarak ekstrakte edildi. Bileşikler daha sonra yüksek basınçlı sıvı kromatografı (HPLC) kullanılarak tanımlandı. Toplam fenolik içeriklerini belirlemek için Folin-Ciocalteu yöntemi kullanılırken, antioksidan kapasiteleri DPPH radikal süpürme kapasitesi, Trolox eşdeğer antioksidan kapasitesi (TEAC) ve oksijen radikal absorbans kapasitesi (ORAC) testleri kullanılarak belirlendi. Tanımlanan fenolik asitler vanillik, kafeik, p-kumarik ve ferulik asitleri içeriyordu. Vanillik asit sadece börülcede tanımlanırken, kafeik asit sadece böbrek fasulyesinde tanımlanmıştır. p-Kumarik asit sarı mısır, börülce ve soya fasulyesinde tanımlanırken, tüm örneklerde ferulik asit tanımlanmıştır. Ferulik asit, tanımlanan baskın fenolik asitti. Numunelerdeki fenolik asitlerin toplam konsantrasyonu aşağıdaki sırayla azalmıştır: soya fasulyesi > börülce fasulyesi > sarı mısır = buğday > barbunya fasulyesi. Toplam antioksidan kapasitesi (DPPH, TEAC ve ORAC tahlillerinin değerlerinin toplamı) aşağıdaki gibi azalmıştır: soya fasulyesi > böbrek fasulyesi > sarı mısır = börülce fasulyesi > buğday. Bu çalışma, HPLC analizinin yanı sıra DPPH, TEAC ve ORAC tahlillerinin kepekli tahılların fenolik asit bileşimi ve antioksidan özellikleri hakkında yararlı bilgiler sağladığı sonucuna varmıştır.
Giriş
Fenolik asitler, otçul ve mantar enfeksiyonuna karşı bitki savunmasında oynadıkları hayati rol ve bitki dokularında yapısal destek ve bütünlüğün korunmasından dolayı bitkilerde incelenen en önemli fitokimyasallar arasındadır 1,2. Tahılların kepeğinde ve baklagillerin tohum kabuğunda bol miktarda bulunurlar3. Yapısal olarak, iki gruba ayrılırlar: hidroksibenzoik asitler (Şekil 1) ve hidroksisinnamik asitler (Şekil 2). Tahıllarda ve baklagillerde yaygın hidroksibenzoik asitler gallik, p-hidroksibenzoik, 2,4-dihidroksibenzoik, protokateşik, vanillik ve şırıngalik asitleri içerirken, yaygın hidroksisinnamik asitler kafeik, p-kumarik, ferulik ve sinapik asitleri içerir3. Fenolik asitler ayrıca yağlarda oksidatif kokululuğa neden olan serbest radikalleri temizleyebildikleri ve fizyolojik sistemlerde radikal kaynaklı oksidatif stresi başlatıp çoğaltabildikleri için antioksidan özelliklere sahiptirler 4,5. Antioksidanlar olarak bu hayati fizyolojik rol nedeniyle, son araştırmaların konusudur. Bunun nedeni, bitkisel gıdaların bileşenleri olarak tüketildiğinde, antioksidan koruma uygulayabilmeleridir.
Tahıllar ve tahıl ürünleri, dünya çapında insanlar ve hayvanlar için başlıca karbonhidrat besin kaynaklarıdır6. Tahıllar arasında buğday, pirinç, mısır (mısır), arpa, tritikale, darı ve sorgum bulunur. Bunlar arasında, 2019/2020 yıllarında tahmini 1.135,7 milyon ton küresel kullanım ile mısır en çok kullanılanıdır, bunu aynı dönemde tahmini 757,5 milyon ton küresel kullanım ile buğday izlemektedir7. Tahıl gıdaları, zengin karbonhidrat kaynakları oldukları için tüketiciler için harika enerji kaynaklarıdır. Ayrıca bazı protein, yağ, lif, vitamin ve mineraller sağlarlar6. Besin değerlerine ek olarak, tahıllar, fizyolojik sistemi radikal kaynaklı oksidatif hasardan koruma potansiyeline sahip fitokimyasal antioksidanların, özellikle fenolik asitlerin iyi kaynaklarıdır3. Baklagiller de iyi besin kaynaklarıdır ve genellikle protein bakımından tahıllardan daha yüksektir. Ayrıca vitamin ve mineral içerirler ve çeşitli yiyeceklerin hazırlanmasında kullanılırlar8. Ek olarak, baklagiller fenolik asitler, flavonoidler, antosiyaninler ve proantosiyanidinler 9,10 dahil olmak üzere çeşitli fitokimyasal antioksidanların iyi kaynaklarıdır. Farklı tahıl ve baklagil çeşitleri farklı bir fenolik asit bileşimine sahip olabilir. Bu nedenle, fenolik antioksidanlarla ilgili potansiyel sağlık yararlarını bilmek için tahılların ve baklagillerin fenolik asit bileşimini ve çeşitlerini incelemeye ihtiyaç vardır.
Tahıl ve baklagil tanelerindeki fenolik asitlerin miktarını ölçmek ve antioksidan aktivitelerini belirlemek için bir dizi tahlil bildirilmiştir. Tam tahıllı fenolik asitler için en yaygın analiz yöntemleri spektrofotometri ve sıvı kromatografisi11'dir. Bu çalışmanın amacı, serbest çözünür fenolik asit bileşimini belirlemek için genelleştirilmiş yüksek basınçlı sıvı kromatografik bir yöntem ve bazı tam tahıllı tahılların ve baklagillerin toplam fenolik içeriğini ve antioksidan kapasitesini belirlemek için spektrofotometrik yöntemleri göstermektir.
Protokol
1. Numune türü
- Bu çalışma için iki tahıl (örneğin, durum buğdayı ve sarı mısır) ve üç baklagilden (örneğin, Blackeye börülce fasulyesi, soya fasulyesi ve kırmızı barbunya fasulyesi) oluşan beş tam tahıl örneği kullanın.
- Her bir tahılın 50 gramını bir kahve değirmeni kullanarak üç kat un haline getirin ve 500 μm'lik bir elek ile geçirin.
- Bunları -20 °C'de saklayın.
2. Numune hazırlama
-
Kuru madde içeriğinin belirlenmesi ve kuru ağırlık esasının ifadesi
NOT: Her toz numunenin kuru madde içeriğini AOAC (2000)12 yöntemine göre belirleyin.- Zorla konveksiyonlu bir fırını açın ve sıcaklığı 130 ° C'ye ayarlayın.
- Fırında 30 dakika ila 1 saat kuru kurutucu (silika jel) ve kurutulmuş silika jeli bir kurutucuya aktarın.
- Her numunenin 2 gramını temiz, önceden kurutulmuş ve tartılmış bir alüminyum kutuya doğru şekilde tartın.
- Tartılan numuneleri 130 °C'de cebri konveksiyonlu fırında 1 saat kurutun.
- Kurutulmuş numuneyi kurutucuya aktarın ve ortam sıcaklığına soğumaya bırakın.
- Kurutulmuş, soğutulmuş numuneyi tartın ve ağırlığını kaydedin.
- Her numunenin kuru madde içeriğini aşağıdaki gibi hesaplayın:
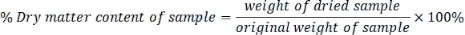
- Aşağıdaki formülü kullanarak kuru ağırlık bazında ölçülen her parametreyi ifade edin:

-
Fenolik asit ekstraksiyonu
NOT: Tahıl numunelerindeki çözünür serbest fenolik bileşikleri, tam tahılların miligram miktarlarından fenolik ekstraksiyonu sağlayan Y. Qiu ve ark.5 yönteminin bir modifikasyonunu kullanarak çıkarın.- 100 mg tam tahıllı un numunesini doğrudan amber renkli 2 mL kapasiteli mikrosantrifüj tüpüne doğru bir şekilde tartın. Tüpün koyu rengi, karışımın ışığa maruz kalmasını önlemeye yardımcı olur.
- Numuneleri içeren tüplerin her birine 1 mL% 80 sulu HPLC sınıfı metanol ekleyin.
- Metanol çözeltisini ve numuneleri karıştırmak için kısaca vorteks.
- Serbest çözünür fenolik bileşikleri çıkarmak için örnekleri 60 dakika boyunca sonikleştirin. Işıktan ek koruma için sonikasyon süresi boyunca örneklerin üzerine bir kapak koyun.
- Sonikasyondan sonra, süpernatantı üstte bırakan katı kalıntıları tortulamak için karışımı 20.000 × g'da 5 dakika boyunca santrifüj edin. Santrifüjlemeden sonra süpernatantta serbest fenolik bileşikler bulunacaktır.
- Süpernatantı temiz bir mikrosantrifüj tüpüne aktarın.
NOT: Süpernatantın HPLC cihazına enjekte edilmeden önce filtrelenmesi gerekir. Süpernatanı filtrelemek için, 3 mL'lik bir şırınganın pistonunu çıkarın ve bir şırınga filtresi takın. Filtre, 0,22 μm'den büyük olmayan bir gözenek boyutuna sahip olmalıdır. - Süpernatantın yaklaşık 0,4 mL'sini şırınganın üst kısmına pipetleyin. Pistonu tekrar takın ve sıvıyı filtreden bir şişe eki içeren bir HPLC şişesine itin.
- Cihaz, HPLC analizi için makalede özetlenen yöntemi çalıştıracak şekilde ayarlandıktan sonra, numune listesine karşılık gelmesi için şişeleri atlıkarıncaya yükleyin.
- Farklı fenolik bileşikleri temsil eden farklı zirveleri gösteren 320 nm ve 280 nm'de HPLC kromatogramları elde edin.
- Uygun standart eğrileri kullanarak, hidroksisinnamik asitleri 320 nm'de sayısallaştırın, çünkü bu dalga boyunda maksimum emilime sahiptirler. Aynı prensibe göre, hidroksibenzoik asitleri 280 nm'de sayısallaştırın.
- Diğer analizler için kalan ekstraktları -20 °C'de saklayın.
3. Fenolik kompozisyon
- J. Xiang, F.B. Apea-Bah, V. U. Ndolo, M.C. Katundu ve T. Beta 4 yöntemine dayanarak, numunelerde ekstrakte edilen fenolik bileşikleri tanımlamak ve ölçmek için yüksek basınçlı bir sıvı kromatograf (Malzeme Tablosu) kullanın.
- Ekstraktlardaki kurucu fenolik bileşikleri tanımlamak ve ölçmek için fenolik asit standartlarını (vanilik asit, kafeik asit, p-kumarik asit, ferulik asit ve sinapik asit) hazırlayın.
- Bunu yapmak için, her standardın 1 mg'ını tartın ve her standardın 1.000 μg / mL'sini üretmek için 1 mL% 50 sulu metanol içinde çözün.
- Her biri 200 μg / mL'lik bir konsantrasyona sahip bir standart kokteyli üretmek için beş standardın eşit hacimlerini 2 mL amber santrifüj tüpünde karıştırın.
- Yeni bir tüpe bir hacim alarak ve sulu metanol çözücünün eşit hacmiyle seyrelterek standart kokteylin seri seyreltmelerini hazırlayın.
- Seri seyreltmeleri 3.125 μg / mL'lik bir konsantrasyona kadar tekrarlayın.
- Ayrıca, her standardın 25 μg / mL konsantrasyonunu elde etmek için her standardı çözücü ile 40 kez ayrı ayrı seyreltin.
- Kolon sıcaklığını 35 °C'ye ve numune fırın sıcaklığını 15 °C'ye ayarlayın.
- Mobil faz A'yı (% 0.1 sulu formik asit) hazırlamak için, 1 mL formik asidi 1 L kapasiteli bir hacimsel şişeye aktarın ve 1 L işaretine HPLC sınıfı su ekleyin. Karıştırmak için iyice çalkalayın.
- Mobil faz B (metanolünde% 0.1 formik asit) hazırlamak için, 1 mL formik asidi 1 L kapasiteli hacimsel şişeye aktarın ve 1 L işaretine HPLC sınıfı metanol ekleyin. Karıştırmak için iyice çalkalayın.
- Gerekirse ses seviyelerini 1 L işaretine ayarlayın.
- Her iki mobil fazı da 0,45 μm hidrofilik filtre kağıdından filtreleyin.
- Analiz için, ters faz kolonuna her bir ekstraktın veya standardın (25 μg / mL standartları ve standart kokteyller) 10 μL'sini enjekte edin.
- 25 dakikalık bir çalışma için doğrusal gradyan programına göre mobil fazlarla aşağıdaki gibi salın: 0-3.81 dakika,% 9 -% 14 B; 3,81-4,85 dakika, %14-%15 B; 4,85-5,89 dk, %15-%15 B, 5,89-8,32 dk, %15-%17 B; 8,32-9,71 dk, %17-%19 B; 9,71-10,40 dakika, %19-%19 B; 10,40-12,48 dk, %19-%26 B; 12,48-13,17 dk, %16-%28 B; 13,17-14,21 dk, %28-%35 B; 14.21-15.95 dk, %35-%40 B; 15,95-16,64 dk, %40-%48 B; 16,64-18,37 dk, %48-%53 B; 18,37-22,53 dk, %53-%70 B; 22,53-22,88 dk, %70-%90 B; 22.88-25.00 dk., %90 B.
- Numunelerdeki kurucu fenolik bileşikleri tanımlamak için, 280 nm ve 320 nm'de 25 μg / mL'lik konsantrasyonların otantik standartları için elde edilen kromatografik piklerin tutma sürelerini, ekstraktlarınkilerle karşılaştırın.
- Fenolik asit standart kokteylleri için kalibrasyon eğrilerini, standartların yatay eksende konsantrasyonu ve dikey eksendeki tepe alanı ile çizin
- Tanımlanan fenolik bileşiklerin konsantrasyonlarını tahmin etmek için kalibrasyon eğrilerini, önceki bölümde belirtildiği gibi 280 nm ve 320 nm'deki tanımlanmış bileşiklerin tepe alanlarıyla karşılaştırarak kullanın.
4. Toplam fenolik içerik
NOT: F.B. Apea-Bah ve ark.13 tarafından tanımlanan Folin-Ciocalteu yöntemini kullanarak ekstraktların toplam fenolik içeriğini belirleyin.
- Toplam fenolik içeriğin tahmini için kalibrasyon eğrilerini karşılaştırmalı olarak çizmek için 0,025 ila 0,150 mg/mL konsantrasyon aralığında ferulik asit ve gallik asit standartları hazırlayın.
- Bunu yapmak için, ferulik asit ve gallik asit standartlarının her biri 1 mg'ı 2 mL kapasiteli santrifüj tüplerine doğru bir şekilde tartın.
- Her standarda 1 mL% 50 sulu metanol ekleyin ve her standarttan 1 mg / mL stok üreterek çözünmesi için vorteks ekleyin.
- Her stok çözeltisinden toplam 500 μL'de bir dizi seyreltme hazırlayın.
- Pipet, her bir ekstraktın 18,2 μL'si veya standardı, 96 delikli bir mikro plaka üzerinde ayrı bir kuyuya yerleştirilir.
- Her ekstrakta veya standarda 36.4 μL% 10 (v / v) sulu Folin-Ciocalteu reaktifi ekleyin.
- Daha sonra, her reaksiyon karışımına 145.4 μL 700 mM sodyum karbonat ekleyin.
- Reaksiyon karışımlarını karanlıkta oda sıcaklığında (20-25 °C) 2 saat boyunca inkübe edin.
- Absorbansı 750 nm'de bir mikro plaka okuyucuda okuyun.
- Fenolik asit standartlarının konsantrasyonuna karşı absorbanstaki değişimin kalibrasyon eğrilerini çizin ve bunları toplam fenolik içeriği tahmin etmek için kullanın.
- Sonuçları, öğütülmüş numunenin gramı başına miligram ferulik asit eşdeğerleri (mg FAE / g) ve öğütülmüş numunenin gramı başına miligram gallik asit eşdeğerleri (mg GAE / g) olarak kuru ağırlık bazında ifade edin.
5. Antioksidan tahliller
NOT: Aşağıdaki üç tahlil kullanılarak tahıl ekstraktlarının antioksidan kapasitesini belirleyin: 2,2-difenil-1-pikrilhidrazil (DPPH) radikal süpürme kapasitesi; 2,2'-azino-bis (3-etilbenzotiyazolin-6-sülfonik asit (ABTS) radikal süpürme kapasitesi, Trolox eşdeğer antioksidan kapasitesi (TEAC) olarak da adlandırılır; ve oksijen radikal absorbans kapasitesi (ORAC).
- Standart eğriler için Trolox standartlarının hazırlanması
- Tam tahıl ekstraktlarının in vitro antioksidan kapasitesini tahmin etmek için standart olarak E vitamininin suda çözünür bir analoğu olan Trolox'u kullanın.
- 1 mg Trolox'u 15 mL'lik bir tüpe doğru şekilde tartın. 4 mL% 50 sulu metanol içinde çözün. 1 mM'lik (1000 μM) bir stok çözeltisi hazırlamak için çözülecek vorteks.
- DPPH radikal süpürme kapasitesi ve Trolox eşdeğer antioksidan kapasitesinin (TEAC) tahmini için standart eğrileri çizmek üzere altı Trolox konsantrasyonu, yani 50, 100, 200, 400, 600 ve 800 μM hazırlayın. Benzer şekilde, oksijen radikal absorbans kapasitesini (ORAC) tahmin etmek için 6.25, 12.5, 25 ve 50 μM Trolox konsantrasyonları hazırlayın. Her konsantrasyonun toplam hacmini Tablo 1'de gösterildiği gibi 500 μL'ye kadar yapın.
- Numune ekstraktlarının seyreltilmesi
- Analizden önce numune ekstraktlarını metanol ile seyreltin. Burada, sarı mısır ve börülce özleri iki kez, buğday ve böbrek fasulyesi beş kez, soya fasulyesi ekstresi metanol ile 10 kez seyreltildi.
- Troloks eşdeğer antioksidan kapasite (TEAC) testi
- Daha önce F.B. Apea-Bah ve ark.14 tarafından açıklanan yöntemi kullanarak numunelerin Trolox eşdeğer antioksidan kapasitesini (TEAC) ölçün.
- 8,23 mg ABTS'yi temiz, 2 mL kapasiteli amber santrifüj tüpüne tartın.
- Daha sonra, 1.62 mg potasyum persülfatı başka bir temiz 2 mL kapasiteli amber santrifüj tüpüne tartın.
- Her birine 1 mL damıtılmış su ekleyin ve çözmek için vorteks yapın.
NOT: Bu, 6 mM sulu potasyum persülfat çözeltisi ile 16 mM ABTS stok çözeltisi ile sonuçlanır. - ABTS ve potasyum persülfat çözeltilerini eşit hacimlerde karıştırarak ABTS stok çözeltisini hazırlayın. Çözelti hemen koyu bir renge dönüşecektir.
- Reaktif karışımını karanlıkta 12-16 saat boyunca inkübe edin.
- ABTS çalışma çözeltisini oluşturmak için ABTS stok çözeltisini 200 mM fosfat tamponlu salin (PBS) ile 30 kez seyreltin. Bunu yapmak için, ABTS stok çözümünün 2 mL'sine 58 mL'lik 200 mM PBS ekleyin. Çalışma çözeltisi 0.27 mM ABTS ve 0.1 mM potasyum persülfat içerecektir.
- Analiz için, her seyreltilmiş ekstraktın veya Trolox'un 10 μL'sini 96 delikli bir mikro plakaya yerleştirin.
- Her bir oyuğa 190 μL ABTS çalışma çözeltisi ekleyin ve reaksiyon karışımlarını 60 dakika boyunca inkübe edin.
- Bir mikroplaka okuyucuda 750 nm'de reaksiyon karışımlarının emiciliğini ölçün.
- Bir kalibrasyon eğrisi çizmek için Trolox standartlarını 100 ila 800 μmol/L arasında değişen bir konsantrasyonda kullanın.
- Kalibrasyon eğrisinden ABTS radikal temizleme kapasitesini tahmin edin.
- Sonuçları kuru ağırlık bazında gram başına mikromol Trolox eşdeğerleri (μmol TE/g) numune olarak ifade edin.
- DPPH testi
NOT: Daha önce F.B. Apea-Bah ve ark.13 tarafından açıklanan yöntemi kullanarak numunelerin DPPH radikal süpürme kapasitesini belirleyin. DPPH antioksidan testi, radikal üreten bir bileşik olan DPPH'yi (2,2-difenil-1-pikrilhidrazil) gerektirir.- 1,2 mg DPPH'yi 50 mL kapasiteli boş bir santrifüj tüpüne doğru şekilde tartın. 60 μmol / L metanolik bir çözelti hazırlamak için DPPH'yi 30 mL metanol içinde çözün.
NOT: DPPH testi, numune ekstraktlarının DPPH tarafından üretilen serbest radikalleri temizleme yeteneğini test eder. - Analiz için, mikroplaka kuyucuklarına 5 μL numune ekstraktları veya Trolox çözeltisi ekleyin.
- Daha sonra, 60 μmol / L DPPH metanolik çözeltisinden 195 μL ekleyin ve 60 dakika boyunca inkübe edin.
- Reaksiyon karışımının emiciliğini 515 nm'de ölçün.
- Dikey eksendeki absorbans değişikliği ve yatay eksendeki Trolox konsantrasyonları ile bir kalibrasyon eğrisi çizmek için Trolox standartlarını (50-800 μmol/L) kullanın.
- Kalibrasyon eğrisinden DPPH temizleme kapasitesini tahmin edin.
- Sonuçları kuru ağırlık bazında gram başına mikromol Trolox eşdeğerleri (μmol TE/g) numune olarak ifade edin.
- 1,2 mg DPPH'yi 50 mL kapasiteli boş bir santrifüj tüpüne doğru şekilde tartın. 60 μmol / L metanolik bir çözelti hazırlamak için DPPH'yi 30 mL metanol içinde çözün.
- Oksijen radikal absorbans kapasitesi
- F.B. Apea-Bah ve ark.13 yöntemine dayanarak numunelerin oksijen radikal absorbans kapasitesini (ORAC) belirleyin.
- Başlamak için, 75 mM potasyum fosfat (K 2 HPO4/KH 2 PO4) tamponunda 1.000 μM Trolox standart stok çözeltisinden6.25, 12.5,25ve 50 μM konsantrasyonlarının Trolox standartlarını hazırlayın.
- Bunu yapmak için, 1 mg Trolox tozunu tartın ve 1,000 μM'lik bir stok çözeltisi hazırlamak için sonikasyon altında tampon çözeltisinin 4 mL'sinde çözün.
- Daha sonra, 50 μL stok çözeltisini 2 mL kapasiteli bir santrifüj tüpüne alın ve 1.000 μL 50 μM Trolox çözeltisi elde etmek için 950 μL tampon çözeltisi ile seyreltin.
- Pipet, 50 μM çözeltinin 500 μL'sini yeni bir tüpe dönüştürün ve 25 μM Trolox çözeltisi elde etmek için eşit hacimli tamponla seyreltin.
- 12,5 μM elde etmek için 25 μM'nin seri seyreltmesini tekrarlayın ve ardından benzer şekilde 6,25 μM elde etmek için 12,5 μM'lik seyreltmeyi tekrarlayın.
- Numune ekstraktlarının uygun seyreltmelerini hazırlayın.
- Sarı mısır ve börülce ekstraktlarını 20 kez, buğday ve barbunya çekirdeği ekstraktlarını 50 kez ve soya fasulyesi ekstraktını tampon çözeltisi ile 100 kez seyreltin.
- Her numunenin veya Trolox standardının 200 μL'sini, otomatik pipetleme için siyah 96 delikli mikro plakanın kuyularına aktarın.
- Ardından, ORAC ekipmanı ile birlikte verilen üç reaktif tankını aşağıdakilerle doldurun: (1) tampon çözeltisi; (2) tamponda 0.816 nM floresein; ve (3) tamponda 153 mM 2,2′-azobis (2-amidinopropan) dihidroklorür (AAPH).
- Otomatik pipetleme için bunları prizlerine yerleştirin.
- Standart çalışma prosedürüne bağlı olarak analiz için ORAC makinesini ve otomatik pipetleme sistemini kurun.
- Analiz için, seyreltilmiş her bir ekstraktın veya standardın 25 μL'sini şeffaf tabanlı siyah 96 delikli bir mikro plakanın kuyularına aktarmak için otomatik pipetleme sistemini kurun.
- Ardından, tampona otomatik olarak 150 μL 0,816 nM floresein ekleyin.
- Reaksiyon karışımını ORAC makinesinde 15 dakika boyunca 37 °C'de inkübe edin.
- Daha sonra, her reaksiyon karışımına otomatik olarak 25 μL AAPH ekleyin.
- ORAC makinesinde 50 dakika boyunca 37 ° C'de inkübe edin.
- Kuluçka süresi boyunca, sırasıyla 485 nm ve 520 nm uyarma ve emisyon dalga boylarında floresan bozunumunu ölçmek için ORAC makinesini kurun.
- Ölçümlerden sonra, yatay eksende Trolox (6.25-50 μM) ve dikey eksende floresan bozunumu ile bir Trolox standart eğrisi çizin.
- Trolox standart eğrisinden ekstraktların oksijen radikal absorbans kapasitesini tahmin edin.
- Sonuçları kuru ağırlık bazında μmol TE/g numune olarak ifade edin.
- İstatistiksel analiz
- Tüm sonuçları, en az üçlü standart sapma ± araçlar olarak sunun.
- Tane tipinin yanıt değişkenleri üzerindeki etkisini belirlemek için varyans analizi (ANOVA) gerçekleştirin.
- p < 0.05'te anlamlı farklılıklar varsa, ortalamaları karşılaştırmak için en az anlamlı farkı (LSD) kullanın.
- Fenolik içerik ve antioksidan kapasiteleri arasındaki ilişkiyi tahmin etmek için Pearson korelasyon analizi yapın.
Sonuçlar
Tablo 2, tahıl ve baklagil tanelerinde tanımlanan fenolik asitleri göstermektedir. Mevcut otantik standartlara dayanarak, örneklerde dört fenolik asit tanımlanmıştır ve bunlar: vanillik, kafeik, p-kumarik ve ferulik asitler. Vanillik asit bir hidroksibenzoik asittir, diğer üçü ise hidroksisinnamik asitlerdir. Vanillik asit sadece Blackeye börülce fasulyesinde tanımlanırken, kafeik asit sadece böbrek fasulyesinde tanımlanmıştır. p-Kumarik asit sarı mısır, börül...
Tartışmalar
Kepekli tahıllar, dünya çapında geniş gıda uygulamaları bulan temsili tahıl taneleri ve baklagiller olarak seçildi. Her tahılın çeşitleri arasında farklılıklar olsa da, bu çalışmanın odak noktası, tam tahıllar için serbest fenolik asit ekstraksiyonu ve analizi için genelleştirilmiş bir yöntem göstermekti. Ekstraksiyon yöntemi, bu tür deneyler yapıldığında çevreye salınacak kimyasalların miktarını azaltmak için numune ve çözücü miktarlarını önemli ölçüde azaltarak değişt...
Açıklamalar
Yazarlar çıkar çatışması olmadığını beyan ederler.
Teşekkürler
Yazarlar, Bayan Alison Ser ve Bayan Hannah Oduro-Obeng'in teknik desteğinin yanı sıra Bayan Janice Fajardo ve Bay Miguel del Rosario'nun video düzenleme desteğini minnetle kabul etmektedir.
Malzemeler
| Name | Company | Catalog Number | Comments |
| 15 mL Falcon conical centrifuge tubes | Fisher Scientific | 05-527-90 | |
| 2 mL Amber glass ID Surestop vial | Thermo Scientific | C5000-2W | |
| 2 mL Amber microcentrifuge tubes | VWR | 20170-084 | |
| 2,2′-Azobis(2-amidinopropane) dihydrochloride (AAPH) | Sigma-Aldrich | 440914-100G | |
| 2,2'-Azino-bis(3-ethylbenzothiazoline-6-sulfonic acid (ABTS) (C18H18N4O6S4) ≥98%, | Sigma Aldrich | A1888-2G | |
| 2,2-Diphenyl-1pikrylhydrazyl (DPPH) (C18H12N5O6) | Sigma Aldrich | D913-2 | |
| 6-Hydroxy-2,5,7,8-tetramethylchroman-2-carboxylic acid (Trolox) (C14H18O4), ≥98% | Fluka Chemika | 56510 | |
| 9 mm Autosampler Vial Screw Thread Caps | Thermo Scientific | 60180-670 | |
| 96 well flat bottom plates | Fisher Scientific | 12565501 | |
| Agilent BioTek ELx800 microplate reader | Fisher Scientific | BT-ELX800NB | |
| Agilent BioTek Precision 2000 96/384 Automated Microplate Pipetting System | Fisher Scientific | N/A | |
| Agilent BioTek FLx800 Microplate Fluorescence Reader | Fisher Scientific | N/A | |
| Analytical balance SI-114 | Denver Instrument | SI-114.1 | |
| Autosampler, Waters 717 Plus | Waters | WAT078900 | |
| BD 3 mL syringe Luer-Lok Tip | BD | 309657 | |
| Bransonic ultrasonic cleaner, Branson 5510 | Millipore Sigma | Z245143 | |
| Corning LSE Vortex Mixer | Corning | 6775 | |
| Durapore Filter (0.45 µm PVDF Membrane) | Merck Millipore Ltd | HVLP04700 | |
| Durapore Membrane Filters (0.45 µm HV) | Merck Millipore Ltd | HVHP04700 | |
| Eppendorf Research plus, 0.5-10 µL | Eppendorf | 3123000020 | |
| Eppendorf Research plus, 0.5-5 mL | Eppendorf | 3123000071 | |
| Eppendorf Research plus, 100-1000 µL | Eppendorf | 3123000063 | |
| Eppendorf Research plus, 10-100 µL | Eppendorf | 3123000047 | |
| Ethyl acetate, HPLC grade | Fisher Chemical | E195-4 | |
| Ferulic acid standard | Sigma Aldrich | 128708-5G | |
| Fluorescein | Fisher Scientific | AC119245000 | |
| Folin & Ciocalteu phenol reagent | Sigma Aldrich | F9252 | |
| Formic acid, 99% | Acros Organics, Janssen Pharmaceuticalaan 3a | 27048-0010 | |
| Gallic acid standard | Sigma | G7384 | |
| High performance liquid chromatograph (HPLC), Waters 2695 | Waters | 960402 | |
| Methanol, HPLC grade | Fisher Chemical | A452-4 | |
| Micro pipet tips, 0.5-10 µL | Fisherbrand | 21-197-2F | |
| Microcentrifuge Sorvall Legend Micro 21 centrifuge | Thermo Scientific | 75002435 | |
| Multichannel micropipette, Proline Plus, 30-300 µL | Sartorius | 728240 | |
| Photodiode array detector, Waters 2996 | Waters | 720000350EN | |
| Pipet tips, 1000 µL | VWR | 83007-382 | |
| Pipet tips, 1-5 mL | VWR | 82018-840 | |
| Potassium persulfate (K2S2O8), ≥99.0% | Sigma Aldrich | 216224-100G | |
| Potassium phosphate dibasic anhydrous (K2HPO4) | Fisher Scientific | P288-500 | |
| Potassium phosphate monobasic (KH2PO4) | Fisher Scientific | P285-500 | |
| PYREX 250 mL Short Neck Boiling Flask, Round Bottom | Corning | 4321-250 | |
| Reversed phase C18 Analytical Column (100 x 3 mm) Accucore aQ | Thermo Scientific | 17326-103030 | |
| Roto evaporator, IKA RV 10 | IKA | 0010005185 | |
| Sodium carbonate (NaCO3) anhydrous | Fisher Chemical | S263-1 | |
| Sodium chloride (NaCl) | Mallinckrodt AR® | 7581 | |
| Sodium phosphate dibasic anhydrous (Na2HPO4) | Fisher Scientific | BP332-500 | |
| Sodium phosphate monobasic anhydrous (NaH2PO4) | Fisher bioreagents | BP329-500 | |
| Standardization pipet tips 0-200µL | Fisherbrand | 02-681-134 | |
| Syringe Driven Filter unit (0.22 µm) | Millex®-GV | SLGVR04NL | |
| Target micro-serts vial insert (400 µL) | Thermo Scientific | C4011-631 | |
| Ultrapure water (Direct Q-3 UV system with pump) | Millipore | ZRQSVP030 |
Referanslar
- Huitu, O., et al. Silicon, endophytes and secondary metabolites as grass defenses against mammalian herbivores. Frontiers in Plant Science. 5, 478 (2014).
- Joshi, J. R., Burdman, S., Lipsky, A., Yariv, S., Yedidia, I. Plant phenolic acids affect the virulence of Pectobacterium aroidearum and P. carotovorum ssp. brasiliense via quorum sensing regulation. Molecular Plant Pathology. 17 (4), 487-500 (2016).
- Dykes, L., Rooney, L. W. Phenolic compounds in cereal grains and their health benefits. Cereal Foods World. 52 (3), 105-111 (2007).
- Xiang, J., Apea-Bah, F. B., Ndolo, V. U., Katundu, M. C., Beta, T. Profile of phenolic compounds and antioxidant activity of finger millet varieties. Food Chemistry. 275, 361-368 (2019).
- Qiu, Y., Liu, Q., Beta, T. Antioxidant properties of commercial wild rice and analysis of soluble and insoluble phenolic acids. Food Chemistry. 121 (1), 140-147 (2010).
- Beverly, R. L., Motarjemi, Y. . Encyclopedia of Food Safety. 3, 309-314 (2014).
- FAO. Food Outlook - Biannual report on global food markets. Food and Agriculture Organization. , (2020).
- Erbersdobler, H. F., Barth, C. A., Jahreis, G. Legumes in human nutrition. Nutrient content and protein quality of pulses. Ernahrungs Umschau. 64 (9), 134-139 (2017).
- Dueñas, M., Hernández, T., Estrella, I. Assessment of in vitro antioxidant capacity of the seed coat and the cotyledon of legumes in relation to their phenolic contents. Food Chemistry. 98 (1), 95-103 (2006).
- Khang, D. T., Dung, T. N., Elzaawely, A. A., Xuan, T. D. Phenolic profiles and antioxidant activity of germinated legumes. Foods. 5 (2), 27 (2016).
- Hefni, M. E., Amann, L. S., Witthöft, C. M. A HPLC-UV method for the quantification of phenolic acids in cereals. Food Analytical Methods. 12 (12), 2802-2812 (2019).
- AOAC. . Official Methods of Analysis. 17th edn. , (2000).
- Apea-Bah, F. B., Head, D., Scales, R., Bazylo, R., Beta, T. Hydrothermal extraction, a promising method for concentrating phenolic antioxidants from red osier dogwood (Cornus stolonifer) leaves and stems. Heliyon. 6 (10), 05158 (2020).
- Apea-Bah, F. B., Minnaar, A., Bester, M. J., Duodu, K. G. Sorghum-cowpea composite porridge as a functional food, Part II: Antioxidant properties as affected by simulated in vitro gastrointestinal digestion. Food Chemistry. 197, 307-315 (2016).
- Robbins, R. J., Bean, S. R. Development of a quantitative high-performance liquid chromatography-photodiode array detection measurement system for phenolic acids. Journal of Chromatography A. 1038 (1-2), 97-105 (2004).
- Singleton, V. L., Rossi, J. A. Colorimetry of total phenolics with phosphomolybdic-phosphotungstic acid reagents. American Journal of Enology and Viticulture. 16, 144-158 (1965).
- Prior, R. L., Wu, X., Schaich, K. Standardized methods for the determination of antioxidant capacity and phenolics in foods and dietary supplements. Journal of Agricultural and Food Chemistry. 53 (10), 4290-4302 (2005).
- Ainsworth, E. A., Gillespie, K. M. Estimation of total phenolic content and other oxidation substrates in plant tissues using Folin-Ciocalteu reagent. Nature Protocols. 2 (4), 875-877 (2007).
- Waterhouse, A. L. Determination of total phenolics. Current Protocols in Food Analytical Chemistry. 1, 1-8 (2002).
- Huang, D., Ou, B., Prior, R. L. The chemistry behind antioxidant capacity assays. Journal of Agricultural and Food Chemistry. 53 (6), 1841-1856 (2005).
- Esterbauer, H., Wäg, G., Puhl, H. Lipid peroxidation and its role in atherosclerosis. British Medical Bulletin. 49 (3), 566-576 (1993).
- Esterbauer, H., Gebicki, J., Puhl, H., Jürgens, G. The role of lipid peroxidation and antioxidants in oxidative modification of LDL. Free Radical Biology and Medicine. 13 (4), 341-390 (1992).
- Apea-Bah, F. B., Serem, J. C., Bester, M. J., Duodu, K. G. Phenolic composition and antioxidant properties of Koose, a deep-fat fried cowpea cake. Food Chemistry. 237, 247-256 (2017).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiThis article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır