Method Article
Применение ИНТЕРФЕРЕНЦИИ CRISPR (CRISPRi) для глушения генов у патогенных видов лептоспир
В этой статье
Резюме
Здесь описано применение ИНТЕРФЕРЕНЦИИ CRISPR (CRISPRi) для специфического глушения генов у видов Leptospira. Клетки лептоспир трансформируются путем конъюгации с плазмидами, экспрессирующими dCas9 (каталитически «мертвый» Cas9) и однонаправленной РНК (sgRNA), отвечающей за спаривание оснований с желаемой геномной мишенью. Представлены методы валидации глушения генов.
Аннотация
Лептоспироз является глобальным забытым зоонозом, ответственным за не менее 1 миллиона случаев в год и почти 60 тысяч смертей. Заболевание вызывается патогенными и вирулентными бактериями рода Leptospira,либо при непосредственном контакте с бактериями, либо косвенно при воздействии загрязненной воды или почвы. Домашние и дикие животные действуют как резервуарные хозяева инфекции, выбрасывая лептоспиры из колонизированных почечных канальцев почки через мочу в окружающую среду. Генерация мутантных штаммов Leptospira имеет решающее значение для оценки и понимания патогенных механизмов инфекции. Интерференция CRISPR (CRISPRi) оказалась простым, доступным и специфическим инструментом для глушения генов в патогенных Leptospira. Поэтому будут описаны методологические детали получения плазмидных конструкций, содержащих как dCas9, так и направляющую РНК, доставки плазмид в Leptospira путем конъюгации со штаммом E. coli β2163, а также трансконъюгантного восстановления и оценки. Кроме того, недавно описанная среда Хорнсби-Альт-Нэлли (HAN) позволяет относительно быстро изолирует и отбирать колонии мутантов на агаровых пластинах.
Введение
Лептоспироз является запущенным во всем мире зоонозом, вызванным патогенными и вирулентными видами рода Leptospira. У людей на болезнь приходится более одного миллиона случаев заболевания и 60 000 смертей в год во всем мире1,2. До сих пор не существует долгосрочной и эффективной вакцины от болезни. Выявление факторов вирулентности и патогенных механизмов имеет решающее значение для разработки более эффективных терапевтических и профилактических стратегий. Поэтому способность генерировать генетические мутации и оценивать полученный фенотип имеет решающее значение для функционального геномного анализа3.
Конструировать мутантов в патогенных Leptospira до сих пор считалось по своей сути неэффективным, трудоемким, дорогостоящим и трудным в реализации. Этот сценарий резко изменился с применением недавней интерференции CRISPR (CRISPRi) к сапрофитным4 и патогенным5 лептоспирам.
Глушение генов достигается экспрессией двух компонентов: варианта CRISPR/Cas(cблестящего regularly interspaced short palindromic repeat/C RISPR каксоциированного) фермента Cas9 из Streptococcus pyogenes,называемого каталитически мертвым Cas9 (dCas9) и однонаправленной РНК (sgRNA), которая может быть отредактирована в соответствии с желаемой мишенью6,7,8. Белок dCas9, будучи связанным с sgRNA, направляется к специфическим мишеням ДНК путем спаривания оснований Уотсона и Крика, вызывая стерическую блокировку удлинения РНК-полимеразы, что приводит к глушению генов из-за затрудненной транскрипции гена7 (рисунок 1).
Эта рукопись направлена на описание конструкции плазмиды для экспрессии как dCas9, так и sgRNA, конъюгации между донорской E. coli β2163 и клетками-реципиентами Leptospira, трансконъюгантного восстановления и, наконец, валидации выбранных мутантных колоний.
протокол
1. Определение протоспейсера и построение плазмиды
ПРИМЕЧАНИЕ: В этом разделе описан первый шаг выбора соответствующих протоспейсеров для построения sgRNA и дальнейшего лигирования в pMaOri.dCas9(рисунок 1). Эта протоспейсерная последовательность состоит из последовательности 20 нуклеотидов против желаемой мишени.
- Получить нуклеотидную последовательность гена, интересующего для глушения, в GenBank (https://www.ncbi.nlm.nih.gov/genbank). Отправьте его на веб-сервер CHOPCHOP (http://chopchop.cbu.uib.no/), с параметрами, определенными для Streptococcus pyogenes Cas9 и протоспейсером, смежным мотивом NGG после выбора «Fasta Target». Определите параметры для "CRISPR/Cas9" и PAM (протоспейсер смежный мотив) NGG.
- На основании полученных результатов выбирают протоспейсеры с максимально возможной оценкой (зеленая стрелка), которые расположены как можно ближе к 5'концу кодирующей области и, самое главное, содержатся в шаблонной (минусовой) цепи, так как sgRNA должна спариваться с кодирующей нитью гена для полного глушения гена.
ПРИМЕЧАНИЕ: Мотив NGG не включен в окончательную последовательность sgRNA. - Используйте промотор lipL32 для экспрессии одной направляющей РНК, которая содержит переменную 20 нуклеотидную последовательность на конце 5' и законсервированную последовательность каркаса dCas9. Объедините последовательность 20-nt, названную протоспейсером, с промотором lipL32 (на его 5'конце) и каркасом sgRNA (3'end)(рисунок 1B).
ПРИМЕЧАНИЕ: Для четко определенного промотора lipL32 используйте область промотора, содержащую -334, к TSS (Transcription Start Site, based on Zhukova et al.9). Проверьте дополнительный файл на наличие окончательной кассеты sgRNA. - Сгенерировать кассету сгРНК путем последовательнойПЦР 5 или синтезировать ее коммерческим провайдером.
- После получения кассеты сажайте ее в плазмиду pMaOri.dCas9 в месте ограничения XmaI на обоих концах (cccggg)4.
- Переваривайте как кассету sgRNA, так и плазмиду pMaOri.dCas9 с ферментом рестрикции XmaI и приступайте к лигации(рисунок 1B).
- Выполняйте этапы клонирования в dT ауксотрофном штамме E. coli π110,обусловленном pMaOri11 (и, соответственно, pMaOri.dCas9) начала репликации, R6K-гамма.
ПРИМЕЧАНИЕ: Подробный протокол лигирования и отбора клонов см. в предыдущих публикациях Фернандеса и Насименто12. sgRNA-управляемый dCas9 будет связываться с кодирующей нитью выбранного гена, представляющим интерес, и, следовательно, будет препятствовать удлинению РНК-полимеразы(рисунок 1C),что приведет к глушению генов.
2. Трансформация лептоспир путем спряжения
ПРИМЕЧАНИЕ: Графическая схема этого шага представлена на рисунке 2. Чтобы сделать HAN media и HAN пластины, обратитесь к Hornsby et al.13 и Fernandes et al.5.
- Выращивать патогенные клетки лептоспир при 29 или 37 °C в среде HAN13 при перемешивании путем разбавления насыщенной культуры в свежем HAN при 1:100; Как правило, L. interrogans serovar Copenhageni штамму Fiocruz L1-130 требуется 4-6 дней, чтобы достичь соответствующей плотности клеток.
- Убедитесь, что культуры достигают O.D. 0,2-0,4 при 420 нм (от 2 до 5 x 108 клеток / мл) перед использованием для конъюгации.
ПРИМЕЧАНИЕ: Поскольку среда HAN изменяет цвет по мере увеличения плотности клеток (из-за фенольно-красного цвета, содержащегося в среде DMEM), центрифуга (4000 х г,15 мин, комнатная температура) 1 мл культурального носителя для удаления лептоспир и нанесения супернатанта в качестве заготовки для измерения O.D.
- Убедитесь, что культуры достигают O.D. 0,2-0,4 при 420 нм (от 2 до 5 x 108 клеток / мл) перед использованием для конъюгации.
- Трансформируйте конъюгативный штамм E. coli β2163, ауксотрофный для диаминопимеевой кислоты (DAP), плазмидой pMaOri.dCas9, содержащей кассету sgRNA. Для E. преобразование коли, используйте либо протоколы теплового шока, либо электропорацию. Включите трансформацию с плазмидой pMaOri.dCas9 без кассеты sgRNA в качестве контроля.
- Для трансформации теплового шока смешайте плазмидную ДНК (100 нг) с химически компетентными клетками E. coli и инкубируйте на льду в течение 30 минут. Выполните тепловой удар при 42 °C в течение 90 с и снова положите на лед на 5 минут. Восстанавливают клетки, добавляя 1 мл lb-среды, инкубируют при 37 °C в течение 1 ч и приступают к покрытию.
- Для электропорации используют электрокомпетентные клетки, смешанные со 100 нг плазмидной ДНК. Используйте следующие параметры для импульса: 1,8 кВ, 100 Ω и 25 мкФ. Восстановите клетки, как описано выше.
- Пластинчатость трансформированных донорских клеток E. coli в агаровой среде LB, дополненная диаминопимеловой кислотой (DAP) (0,3 мМ) и спектиномицином (40 мкг/мл) для выбора плазмид.
- Для конъюгации выбирают по одной колонии из каждой пластины за сутки до дня конъюгации (которая определяется путем мониторинга О.Д. культур лептоспир).
- Выберите одну колонию E. coli β2163 из пустой pMaOri.dCas9 и одну из пластин pMaOri.dCas9sgRNA. Дайте им расти в течение ночи в 10 мл LB плюс DAP и спектиномицин при 37 °C.
- На следующий день разводят насыщенные культуры 1:100 в 10 мл свежего LB плюс DAP (не включайте антибиотик сюда) до OD420 нм 0,2-0,4. Обычно E. coli требуется 2-3 ч, чтобы достичь этих плотностей.
- Внутри вытяжки биобезопасности BSL2 соберите фильтрационный аппарат, поместив на верхнюю часть стеклянного основания мембранный фильтр с диаметром 25 мм, размером пор 0,1 мкм, смешанным эфиром эфиров. Поместите стеклянную воронку 15 мл сверху и удерживайте обе части пружинными зажимами. Подключите стекло к вакуум-насосу и добавьте культуры в воронку для фильтрации.
- Добавьте в воронку 5 мл культуры Leptospira. Добавьте объем E. coli, чтобы составить пропорцию 1:1 на основе значений OD420 нм обеих культур. Включите вакуумный насос и концентратные ячейки путем фильтрации. После концентрации клеток в мембранном фильтре осторожно извлеките его. Убедитесь, что среда фильтруется через мембрану.
ПРИМЕЧАНИЕ: Фильтрация занимает от 5 до 10 минут. - Поместите фильтр на коммерчески доступную пластину EMJH (см. Таблицу материалов),дополненную DAP (0,3 мМ). Убедитесь, что бактерии подняты. Инкубировать пластины при 29 °C в течение 24 ч.
ПРИМЕЧАНИЕ: Если используются HAN или дополненные пластины EMJH14, E. coli может размножаться и преодолевать предполагаемую пропорцию 1:1, что, в свою очередь, может снизить эффективностьсопряжения 5. - Через 24 ч извлеките фильтры из пластин и поместите каждый отдельный фильтр в коническую трубку 50 мл.
- Используйте 1 мл жидкой среды HAN для освобождения клеток от поверхности фильтра путем обширного пипетирования и вихря.
- Визуализируйте восстановленные смешанные бактериальные растворы с помощью микроскопии темного поля, чтобы проверить жизнеспособность и подвижность клеток, а также пропорции Leptospira: E. coli.
ПРИМЕЧАНИЕ: На этом этапе можно увидеть эквивалентное количество E. coli и Leptospira. - Нанесите 100-200 мкл этой культуры на пластины HAN, содержащие 0,4% инактивированной кроличьей сыворотки и 40 мкг/мл спектиномицина. Инкубировать пластины при 37 °C в атмосфере 3% CO2.
ПРИМЕЧАНИЕ: В норме L. interrogans serovar Copenhageni штамм Fiocruz L1-130 клеток образует колонии через 5-7 дней на контрольных пластинах и через 8-10 дней на спектиномициновых пластинах. На этом этапе E. coli не будет расти, так как они ауксотрофны для DAP. - В качестве контроля разводят культуры на 104 лептоспира/мл и добавляют 100 мкл на пластины без антибиотика для мониторинга роста лептоспирала.
3. Отбор колоний и трансконъюгантный рост и валидация
ПРИМЕЧАНИЕ: Колонии должны быть очевидны к 10-му дню. Однако их не слишком легко визуализировать. Обычно в этот момент времени пластины HAN немного непрозрачны из-за высушенных клеток, которые были распространены, и колонии Leptospira могут выглядеть как прозрачный ореол на беловатом фоне. Рекомендуется рассматривать пластины под разными углами, чтобы добиться разной легкости, поэтому, делая колонии более очевидными. При более длительном времени инкубации колонии могут приобретать более плотный вид, и в этом случае они присутствуют в виде молочных ореолов на темном фоне.
- Добавьте 100 мкл жидкой среды HAN к каждой микропробире объемом 1,5 мл для восстановления мутантов. Возьмите не менее 3 колоний с каждой тарелки.
- С помощью наконечника микропипетки «выкопайте» агар, чтобы извлечь колонии из пластин, так как лептоспиральные колонии могут быть подповерхностными.
ПРИМЕЧАНИЕ: Ожидается, что на данном этапе агарт будет взят с собой. Колонии следует взять из контрольных пластин, содержащих пустую плазмиду pMaOri.dCas9, и пластин с лептоспирами, содержащими плазмиды, экспрессивающие как dCas9, так и одиночную направляющую РНК, предназначенную для гена-мишени. - Дозируют собранную колонию в 100 мкл среды HAN в микропробирке 1,5 мл и энергично гомогенизируют. На этом этапе обеспечьте максимальный разрыв целостности агара для высвобождения клеток. Вихревая подвеска в течение 10 с.
- С помощью наконечника микропипетки «выкопайте» агар, чтобы извлечь колонии из пластин, так как лептоспиральные колонии могут быть подповерхностными.
- Визуализируйте восстановленные клетки с помощью микроскопии темного поля с увеличением 200-400x, добавив каплю 5 мкл на стеклянный слайд и немедленно накройте образцы крышкой.
- Подтвердите наличие живых и жизнеспособных лептоспир, извлеченных из колоний.
- После визуализации и подтверждения жизнеспособности лептоспиратов переносят 100 мкл клеток в жидкие среды HAN, содержащие 40 мкг/мл спектиномицина.
- После роста в жидких средах HAN оценивают культуры на наличие плазмиды с праймером pMaOri2 F (ACGCAATGTATCGATACCGAC) и R (ATAGGTGAAGTAGGCCCACCC), которые распознают область, которая фланкирует кассету sgRNA.
- Собрать 200 мкл культуры, центрифугу (4000 х г,15 мин), отбросить супернатант и повторно суспендировать полученную гранулу в 20 мкл воды.
- Используйте эту суспензию в качестве шаблона для дополнительной ПЦР, без необходимости извлечения ДНК12.
ПРИМЕЧАНИЕ: Клетки с pMaOri.dCas9 будут отображать ампликон 281 bp, по сравнению с теми, которые содержат плазмиды с кассетой sgRNA, которая будет отображать ампликон 723 bp.
- Для подтверждения глушения генов выполните иммуноблот, используя клеточные экстракты трансконъюгантов, содержащих только pMaOri.dCas9 (отрицательный контроль) и pMaOri.dCas9sgRNA.
- Нанесите эквивалент 5 х 107 клеток на полосу полиакриламидного геля додецилсульфата натрия (SDS).
- Электротрансфер белков на мембрану для инкубации с соответствующими антителами. Помимо антитела против гена-мишени для глушения, используйте еще одно для контроля нагрузки.
- Храните мутантные культуры в среде HAN плюс спектиномицин для поддержания плазмиды. Если антибиотики не применяются к среде, полное глушение генов может наблюдаться по крайней мере в течение трех проходов5.
Результаты
Несмотря на то, что содержание CG в геномах Leptospira spp. обычно составляет около 35%; практически каждый ген, вероятно, содержит PAM 5'NGG 3'; этот мотив необходимо учитывать в цепочке шаблона. После ввода кодирующей последовательности гена (от начала до остановки кодонов), основываясь на результатах CHOPCHOP, протоспейсеры должны быть выбраны на минусовой (-, шаблонной) нити. Важно не включать мотив NGG в 20-нтовый протопайсер sgRNA.
Если конъюгация проводится с соотношением донор:1 донор:реципиентная клетка, в течение 24 ч на поверхности пластин агара EMJH плюс DAP, и 200 мкл восстановленной бактериальной суспензии распространяются на HAN плюс пластины спектиномицинового агара, колонии трансконъюгантов должны быть видны примерно через 8-10 дней. Распределение этого объема обычно приводит к 20-40 колониям на пластину(рисунок 3А). Чтобы проверить жизнеспособность клеток после конъюгации, клетки могут быть распределены на пластины HAN без выбора антибиотиков. При этом колонии можно наблюдать уже через 7 дней. Пластины HAN бледно-желтые в атмосфере 3% CO2.
После сбора колоний и роста в жидких средах плюс спектриномицин, ПЦР с использованием целых клеток и праймеров pMaOri2 может быть использована для первоначальной проверки качества трансконъюгантов(рисунок 3B). Лептоспиральные клетки, содержащие контрольную плазмиду pMaOri.dCas9, должны привести к получению ампликона 281 bp, в то время как клетки, содержащие плазмиду для глушения, то есть содержащие как dCas9, так и sgRNA, должны привести к ампликону 723 bp. Праймеры pMaOri2 F и R были разработаны для фланкирования участка ограничения XmaI, который является сайтом, используемым во время лигирования кассет sgRNA.
При подтверждении присутствия плазмиды клетки можно собирать из среды, дважды промывать PBS, а затем использовать для приготовления цельноклеточного экстракта для иммуноблоттинга. Если глушение произошло, то белки-мишени, в данном случае либо LipL32, либо LigA и LigB, должны наблюдаться только в клетках дикого типа и в клетках, содержащих pMaOri.dCas9; даже при более высоком времени воздействия в клетках, содержащих pMaOri.dCas9sgRNA(рисунок 3C),не должно быть видно соответствующих белков.
Если планируются эксперименты по оценке вирулентности лептоспиральных вирулеров после глушения генов, культуры, используемые для конъюгации, должны быть низкопроходными вирулентными Leptospira. После подтверждения глушения генов несколько аликвот могут быть заморожены в качестве резервной копии. Если молчаливый ген имеет измеримый фенотип, например, основанный на предыдущей работе с рекомбинантными белками, культуры могут быть использованы для валидации и, в этом случае, клетки, содержащие только pMaOri.dCas9, могут быть включены в качестве отрицательного контроля.
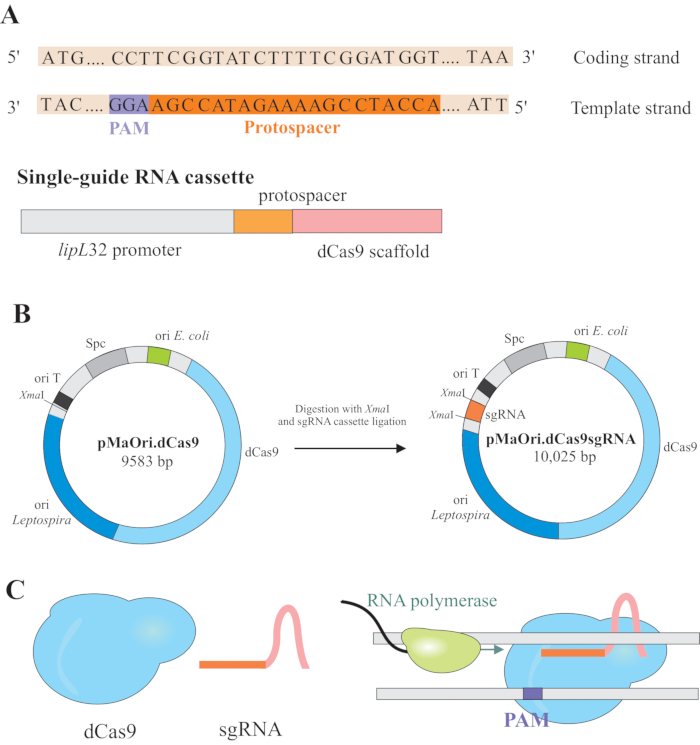
Рисунок 1:Развитие dCas9 и sgRNA-экспрессирующей плазмиды. (A) Протоспейсер длиной 20 нт, за которым следует S. pyogenes dCas9 PAM 5'-NGG-3', выбирается в шаблонной цепи гена-мишени, чтобы последующая sgRNA могла выполнять спаривание оснований Watson и Crick с соответствующей кодирующей нитью, что приводит к полному глушителю гена. (B) Кассета sgRNA состоит из промотора lipL32, 20-nt протоспейсера и каркаса dCas9. Плазмида pMaOri.dCas9 используется в качестве основы для лигирования кассет сгРНК в месте ограничения XmaI. Полученная плазмида, получившаяся под ими pMaOri.dCas9sgRNA доставляется к лептоспирам, и экспрессия как dCas9, так и sgRNA отвечает за глушение гена. (C)sgRNA-направленный dCas9 действует как физический барьер для удлинения РНК-полимеразы, следовательно, препятствуя транскрипции. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
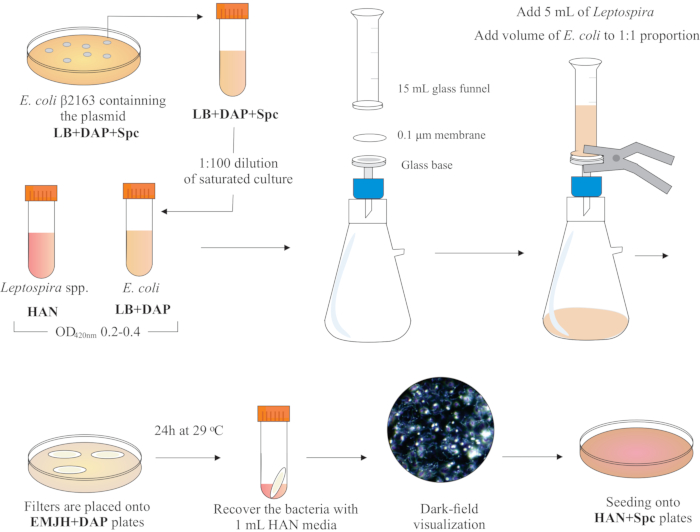
Рисунок 2:Схематическое представление протокола сопряжения. Желаемый вид Leptospira выращивают в среде HAN, под перемешиванием, до O.D. 0,2-0,4 (средняя фаза) при 420 нм. За день до конъюгации из пластин агара LB+DAP+Spc выбирается колония рекомбинантного донора E. coli β2163, содержащая интересующая плазмида, поскольку клетки выращиваются в течение ночи в жидком LB с той же добавкой. На следующий день насыщается Е. культуры коли разбавляют в LB плюс DAP и выращивают до O.D. 0,2-0,4 при 420 нм. Как донорская кишечная палочка, так и реципиент Leptospira смешиваются в пропорции клеток 1:1 на поверхности фильтра 0,1 мкм фильтрующим устройством под отрицательным давлением. Затем фильтры помещают поверх агаровых пластин EMJH, дополненных DAP, и инкубация продолжается в течение 24 ч при 29 °C. Использование EMJH ограничивает распространение E. coli, и предполагаемая пропорция 1:1 сохраняется. Бактерии извлекаются из фильтров путем пипетирования средой HAN 1 мл, а суспензии визуализируются под микроскопией темного поля. Наконец, 100-200 мкл каждой суспензии высевают на агаровые пластины HAN, содержащие 0,4% кроличьей сыворотки, и инкубируют при 37 °C в 3% CO2. На этом этапе DAP опускается, и в результате ауксотрофная кишечная палочка не будет расти. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
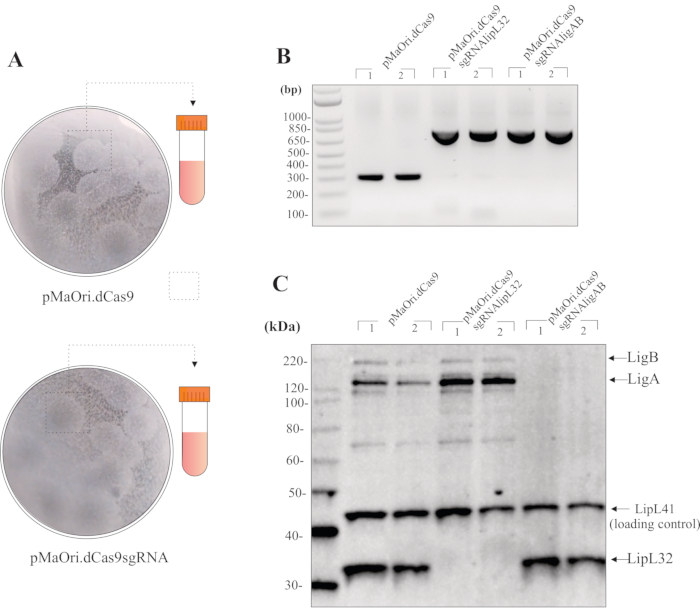
Рисунок 3:Репрезентативные результаты оценки мутантов. (A) Колонии из пластин, содержащих Leptospira, преобразованные с пустым pMaOri.dCas9 (отрицательный контроль для дальнейших экспериментов) и плазмиды pMaOri.dCas9sgRNA (с целевым геном, заглушенным) собирают, энергично гомогенизируют в жидкой HAN и выращивают в жидкой HAN, содержащей спектриномицин. Рекомбинантные клетки могут быть проверены с помощью ПЦР с праймерами, фланкируя сайт XmaI в pMaOri.dCas9. (B)В этом случае клетки, содержащие pMaOri.dCas9, приводили только к ампликону 281 bp, в то время как клетки, содержащие плазмиду для глушения, содержащие как dCas9, так и sgRNA, показали ампликон 723 bp. После подтверждения наличия плазмид глушение генов было подтверждено иммуноблот-анализом. (C)Рекомендуется инкубация с антителами как к белку-мишени, так и к белку контроля нагрузки; в репрезентативном иммуноблоте отображаются цельклеточные экстракты трансконъюгантов, содержащих pMaOri.dCas9 отдельно или с кассетами sgRNA, нацеленными на гены lipL32 (pMaOri.dCas9sgRNAlipL32) и как LigA, так и LigB (pMaOri.dCas9sgRNAligAB). Коинкубация с анти-LipL32, анти-LigAB и анти-LipL41 (нецелевая, нагрузочная контроль) подтверждает, что экспрессия белка LipL32 отменена в клетках, содержащих pMaOri.dCas9sgRNAlipL32 и как LigA, так и LigB в клетках, содержащих pMaOri.dCas9sgRNAligAB. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
Дополнительный файл: Последовательность кассет с одной направляющей РНК (sgRNA). Транскрипция sgRNA направляется конститутивным промотором lipL32 (жирные нуклеотиды). sgRNA состоит из 20 нуклеотидов, относящихся к протоспейсеру, ответственному за спаривание оснований с кодирующей нитью гена-мишени, и последовательности каркаса dCas9 (подчеркнутые нуклеотиды). Хма I рестрикционные участки (cccggg) включены на обоих концах для лигирования в плазмиде pMaOri.dCas9. Пожалуйста, нажмите здесь, чтобы загрузить этот файл.
Обсуждение
После раннего секвенирования патогенных15,16,17,18 и сапрофитных19видовLeptospira, анализ данных генома пролил свет на несколько аспектов патогенеза лептоспиральных. В большинстве случаев функцию белка исследовали с помощью рекомбинантного аналога предполагаемого лептоспирального поверхностно-экспонированного белка и последующего предположения о нативной функции белка20,21,22,23,24,25,26.
Генерация мутантов и оценка их соответствующего фенотипа являются ключевыми компонентами функционального геномного анализа. Первоначальные попытки генерации мутантов в Leptospira spp. были достигнуты случайным транспозонным мутагенезом27,28,29,30; однако после обширного и кропотливого анализа для вывода идентичности нарушенных генов было отмечено, что только 15% всех генов у L. interrogans serovar Manilae были нарушены27. Целевой нокаут гена был дополнительно достигнут путем гомологичного рекомбинации с использованием плазмид самоубийства для доставки кассеты устойчивости к антибиотикам, окруженной гомологичными руками в пределах желаемойцели 31,32.
Применяя эти технологии, были исследованы некоторые аспекты лептоспиральной базовой биологии и вирулентности31,33,34,35,36,37. Развитие конъюгативного челночного вектора E. coli-Leptospira, pMaOri 11,позволило доставлять компоненты для эписомального глушения генов.
Ранее было показано, что cas9-индуцированный двухцепочечный разрыв смертелен для Leptospira spp. и, в качестве альтернативы, каталитически неактивный вариант фермента, dCas9, может быть использован для достижения глушения генов как у сапрофитных, так и у патогенных видов4,5. Используя плазмиду pMaOri.dCas9 в качестве основы для лигирования кассет сгРНК, можно получить специфическое и стабильное глушение генов за счет экспрессии как dCas9, так и sgRNA; dCas9-связанная sgRNA приведет белок к желаемой цели путем спаривания основания Уотсона-Крика.
Для полного глушения генов протоспейсер должен быть спроектирован на основе шаблонной цепи желаемого гена таким образом, чтобы происходит спаривание оснований sgRNA с кодирующей нитью. Исходя из среднего содержания C + G 35% в Leptospira spp., PAM 5'-NGG-3' будет встречаться не менее 3 раз каждые 100 bp. Поэтому практически любой ген в геноме Leptospira будет содержать хотя бы один PAM. Однако, если мотив NGG не найден, альтернативный мотив NAG может быть оценен.
Предыдущие методы глушения генов, такие как цинковые пальцы и TALE (эффекторы, подобные активатору транскрипции), основывались на построении одного отдельного белка для каждой мишени, что делало эти методы трудоемкими и дорогостоящими38. В случае CRISPRi переменным компонентом является sgRNA, что делает необходимым изменение только 20 bp на 5' конце. Полное, стабильное и целенаправленное глушение генов наблюдалось не только у Leptospira spp.4,5,но и у других бактерий8,39,40,41.
Разработка HAN media13 благоприятствовала восстановлению мутантов, резко сокращая время инкубации для формирования колоний и позволяя Leptospira расти при 37 oC. Однако на этапе конъюгации его использование не рекомендуется, поскольку кишечная палочка может энергично размножаться в этой среде и преодолевать предполагаемую пропорцию 1:1 между донорскими и реципиентными клетками. На данном этапе EMJH плюс DAP является лучшим выбором, так как E. coli плохо реплицируются в этой среде. Стоит отметить, что некоторые лаборатории производят внутри компании дополненный EMJH, который может содержать дополнительные компоненты, которые также могут поддерживать рост клеток E. coli.
Представленный здесь протокол сопряжения был оптимизирован для L. interrogans серовар копенгагенского штамма Fiocruz L1-130, а также доказано его эффективность при трансформации недавно выделенного патогенного штамма из образцов почвы5. Первоначальные попытки применения различных сероваров видов L. borgpetersenii указывают на более низкую эффективность сопряжения с описанным протоколом. Таким образом, при работе с различными видами/сероварами Leptospiraоптимальные условия конъюгации следует определять эмпирически, учитывая пропорции донора:клетки-реципиента, начальную плотность клеток, конъюгационные среды и время (24 и 48 ч). Разумно предположить, что разные виды Leptospira и серовары будут вести себя по-разному с разными протоколами сопряжения.
Несмотря на то, что сапрофитные колонии Leptospira относительно легко визуализировать на пластинах, патогенные колонии может быть труднее наблюдать. В норме при использовании среды HAN, дополненной 0,4% кроличьей сывороткой и спектиномицином, трансконъюгантные колонии могут наблюдаться на 10-й день. По нашему опыту, колонии изначально присутствуют в виде прозрачного ореола на поверхности среды. В видеопротокольном виде показаны более плотные колонии после 14 дней роста, так как прозрачные колонии было трудно снять. На этом этапе вращение пластины для достижения различного освещения и смещение между белым и темным фоном может помочь идентифицировать колонии.
Для валидации мутантов иммуноблоттинг предлагает простой подход; однако, поскольку антитела не всегда доступны против белков-мишеней, можно использовать альтернативные стратегии для проверки глушения генов. Количественная ПЦР с обратной транскриптазой (qRT-PCR) с использованием праймеров для гена-мишени и конститутивного контроля эффективна для проверки глушения генов, поскольку dCas9, управляемый сгРНК, отвечает за блокировку транскрипции генов. Если ген-мишень кодирует четко определенную белковую полосу в белковых гелях, SDS-PAGE может продемонстрировать глушение, и в соответствии с геном lipL32 глушение5. Если гены биосинтеза LPS заглушены, можно использовать окрашивание LPS; в случае глушения генов, кодирующих ферменты с четко определенными субстратами, кинетические анализы с хромогенными субстратами являются действительными стратегиями; β-галактозидазы в L. biflexa было подтверждено использованием субстратов X-gal и ONPG (орто-нитрофенил-β-галактозид)4.
После подтверждения глушения генов могут быть разработаны эксперименты для дальнейшей оценки фенотипа. Связывающие анализы могут быть выполнены в случае глушения бактериальных адгезинов; анализы сывороточного вызова подтвердили роль LigA и LigB в выживаемости сыворотки, показанной патогенными Leptospira5. Мутанты также могут быть использованы для прививки животных для оценки ослабления вирулентности; в этом случае животных, привитых мутантом, следует сравнивать с инфицированными только клетками, содержащими только pMaOri.dCas9.
В заключение, текущий протокол описывает применение CRISPRi для глушения генов у патогенных видов Leptospira с использованием среды HAN для облегчения восстановления мутантов в течение 10 дней. Глушение генов в сочетании с функциональным геномным анализом улучшит наше понимание патогенных механизмов Leptospiraи в конечном итоге приведет к разработке лучших профилактических стратегий для борьбы с болезнями.
Раскрытие информации
Авторам нечего раскрывать.
Благодарности
USDA является поставщиком равных возможностей и работодателем. Упоминание торговых наименований или коммерческих продуктов в этой публикации предназначено исключительно с целью предоставления конкретной информации и не подразумевает рекомендации или одобрения со стороны Министерства сельского хозяйства США. Бразильское агентство FAPESP (грант 2014/50981-0) финансово поддержало эту работу; LGVF финансируется стипендией FAPESP (2017/06731-8 и 2019/20302-8). Спонсоры не имели никакого значения в разработке исследования, сборе и анализе данных, принятии решения о публикации или подготовке рукописи. Авторы также благодарят Ханну Хилл и Александра Граймса из USDA Visual Services за съемку и редактирование видеопротоколя.
Материалы
| Name | Company | Catalog Number | Comments |
| 0.1 µm pore size mixed cellulose esters membrane | Millipore | VCWP02500 | Filtration for bacterial conjugation |
| 2,6-Diaminopimelic acid (DAP) | Sigma | D1377 | Growth of auxotrophic E. coli β2163 |
| Agar Noble | BD & Company | 214230 | Used for preparation of solid EMJH and HAN plates |
| Bacto Agar | BD & Company | 214010 | Used for preparation of solid LB plates |
| Clarity Western ECL substrate | Biorad | 170-5060 | Chemiluminescent substrate |
| dNTP set | Thermo Fisher | 10297-018 | dNTPs for PCR reaction |
| Glass Microanalysis Filter Holder | Millipore | XX1012530 | Filtration for bacterial conjugation |
| Imaging System | Biorad | ChemiDoc MP | Chemiluminescence detection |
| LB broth, Miller | BD & Company | 244620 | Lysogenic liquid medium for E. coli culturing |
| Leptospira Enrichment EMJH | BD & Company | 279510 | Supplementation of EMJH media |
| Leptospira Medium Base EMJH | BD & Company | 279410 | EMJH medium for Leptospira |
| Mini-PROTEAN TGX Gels 12% | Biorad | 4568043 | Used for polyacrylamide gel eletrophoresis |
| Optical density reader | Molecular Devices | SpectraMax M2 | For optical density measurements of bacterial cultures |
| Phosphate Buffered Saline 7.4 | Sigma | 806552 | Saline solution for washing bacterial pellets |
| Spectinomycin | Sigma | S0692 | Selection of pMaOri backbone plasmids |
| Taq DNA Polymerase | Thermo Fisher | EP0402 | Enyme, buffer and MgCl2 for PCR reaction |
| Thermocycler | Applied Biosystem | GeneAmp PCR System 9700 | Used for PCR reaction cycling |
| Thymidine (dT) | Sigma | T9250 | Growth of auxotrophic E. coli π1 |
| XmaI restriction enzyme | New Englan BioLabs | R0180L | Digestion of plasmids and inserts |
Ссылки
- Bharti, A. R., et al. Leptospirosis: A zoonotic disease of global importance. Lancet Infectious Disease. 3 (12), 757-771 (2003).
- Costa, F., et al. Global morbidity and mortality of Leptospirosis: A systematic review. PLoS Neglected Tropical Disease. 9 (9), 0003898(2015).
- Shapiro, R. S., et al. A CRISPR-Cas9-based gene drive platform for genetic interaction analysis in Candida albicans. Nature Microbiology. 3 (1), 73-82 (2018).
- Fernandes, L. G. V., et al. Gene silencing based on RNA-guided catalytically inactive Cas9 (dCas9): a new tool for genetic engineering in Leptospira. Science Reports. 9 (1), 1839(2019).
- Fernandes, L. G. V., Hornsby, R. L., Nascimento, A. L. T. O., Nally, J. E. Genetic manipulation of pathogenic Leptospira: CRISPR interference (CRISPRi)-mediated gene silencing and rapid mutant recovery at 37 C. Science Reports. 11 (1), 1768(2021).
- Jinek, M., et al. A programmable dual-RNA-guided DNA endonuclease in adaptive bacterial immunity. Science. 337 (6096), 816-821 (2012).
- Qi, L. S., et al. Repurposing CRISPR as an RNA-guided platform for sequence-specific control of gene expression. Cell. 152 (5), 1173-1183 (2013).
- Choudhary, E., Thakur, P., Pareek, M., Agarwal, N. Gene silencing by CRISPR interference in mycobacteria. Nature Communication. 6, 6267(2015).
- Zhukova, A., et al. Genome-wide transcriptional start site mapping and sRNA identification in the pathogen. Frontiers in Cell and Infectious Microbiology. 7, 10(2017).
- Demarre, G., et al. A new family of mobilizable suicide plasmids based on broad host range R388 plasmid (IncW) and RP4 plasmid (IncPalpha) conjugative machineries, and their cognate Escherichia coli host strains. Research in Microbiology. 156 (2), 245-255 (2005).
- Pappas, C. J., Benaroudj, N., Picardeau, M. A replicative plasmid vector allows efficient complementation of pathogenic Leptospira strains. Applied Environmental Microbiology. 81 (9), 3176-3181 (2015).
- Fernandes, L. G. V., Nascimento, A. L. T. O. Specific gene silencing in Leptospira biflexa by RNA-guided catalytically inactive Cas9 (dCas9). Methods in Molecular Biology. 2134, 109-122 (2020).
- Hornsby, R. L., Alt, D. P., Nally, J. E. Isolation and propagation of leptospires at 37 °C directly from the mammalian host. Science Reports. 10 (1), 9620(2020).
- Haake, D. A. Hamster model of leptospirosis. Current Protocols in Microbiology. , Chapter 12, Unit 12E.12 (2006).
- Nascimento, A. L., et al. Comparative genomics of two Leptospira interrogans serovars reveals novel insights into physiology and pathogenesis. Journal of Bacteriology. 186 (7), 2164-2172 (2004).
- Nascimento, A. L., et al. Genome features of Leptospira interrogans serovar Copenhageni. Brazillian Journal of Medical Biology Research. 37 (4), 459-477 (2004).
- Ren, S. X., et al. Unique physiological and pathogenic features of Leptospira interrogans revealed by whole-genome sequencing. Nature. 422 (6934), 888-893 (2003).
- Bulach, D. M., et al. Genome reduction in Leptospira borgpetersenii reflects limited transmission potential. Proceedings of the National Academy of Science U. S. A. 103 (39), 14560-14565 (2006).
- Picardeau, M., et al. Genome sequence of the saprophyte Leptospira biflexa provides insights into the evolution of Leptospira and the pathogenesis of leptospirosis. PLoS One. 3 (2), 1607(2008).
- Fernandes, L. G., et al. OmpL1 is an extracellular matrix- and plasminogen-interacting protein of Leptospira spp. Infections and Immunity. 80 (10), 3679-3692 (2012).
- Fernandes, L. G., et al. Leptospira spp.: Novel insights into host-pathogen interactions. Veterinary Immunology and Immunopathology. 176, 50-57 (2016).
- Castiblanco-Valencia, M. M., et al. Leptospiral immunoglobulin-like proteins interact with human complement regulators factor H, FHL-1, FHR-1, and C4BP. Journal of Infectious Diseases. 205 (6), 995-1004 (2012).
- Choy, H. A., et al. The multifunctional LigB adhesin binds homeostatic proteins with potential roles in cutaneous infection by pathogenic Leptospira interrogans. PLoS One. 6 (2), 16879(2011).
- Siqueira, G. H., et al. The recombinant LIC10508 is a plasma fibronectin, plasminogen, fibrinogen and C4BP-binding protein of Leptospira interrogans. Pathogen and Diseases. 74 (2), (2016).
- Teixeira, A. F., et al. Features of two new proteins with OmpA-like domains identified in the genome sequences of Leptospira interrogans. PLoS One. 10 (4), 0122762(2015).
- Kochi, L. T., et al. The interaction of two novel putative proteins of Leptospira interrogans with E-cadherin, plasminogen and complement components with potential role in bacterial infection. Virulence. 10 (1), 734-753 (2019).
- Murray, G. L., et al. Genome-wide transposon mutagenesis in pathogenic Leptospira species. Infections and Immunity. 77 (2), 810-816 (2009).
- Bourhy, P., Louvel, H., Saint Girons, I., Picardeau, M. Random insertional mutagenesis of Leptospira interrogans, the agent of leptospirosis, using a mariner transposon. Journal of Bacteriology. 187 (9), 3255-3258 (2005).
- Pětrošová, H., Picardeau, M. Screening of a Leptospira biflexa mutant library to identify genes involved in ethidium bromide tolerance. Applied Environmental Microbiology. 80 (19), 6091-6103 (2014).
- Slamti, L., Picardeau, M. Construction of a library of random mutants in the spirochete Leptospira biflexa using a mariner transposon. Methods in Molecular Biology. 859, 169-176 (2012).
- Croda, J., et al. Targeted mutagenesis in pathogenic Leptospira species: Disruption of the LigB gene does not affect virulence in animal models of leptospirosis. Infections and Immunity. 76 (12), 5826-5833 (2008).
- Picardeau, M., Brenot, A., Saint Girons, I. First evidence for gene replacement in Leptospira spp. Inactivation of L. biflexa flaB results in non-motile mutants deficient in endoflagella. Molecular Microbiology. 40 (1), 189-199 (2001).
- King, A. M., et al. High-temperature protein G is an essential virulence factor of Leptospira interrogans. Infections and Immunity. 82 (3), 1123-1131 (2014).
- Lambert, A., et al. FlaA proteins in Leptospira interrogans are essential for motility and virulence but are not required for formation of the flagellum sheath. Infections and Immunity. 80 (6), 2019-2025 (2012).
- Murray, G. L., et al. Leptospira interrogans requires heme oxygenase for disease pathogenesis. Microbes and Infections. 11 (2), 311-314 (2009).
- Ristow, P., et al. The OmpA-like protein Loa22 is essential for leptospiral virulence. PLoS Pathogens. 3 (7), 97(2007).
- Sasaki, Y., et al. Leptospiral flagellar sheath protein FcpA interacts with FlaA2 and FlaB1 in Leptospira biflexa. PLoS One. 13 (4), 0194923(2018).
- Gaj, T., Gersbach, C. A., Barbas, C. F. ZFN, TALEN, and CRISPR/Cas-based methods for genome engineering. Trends in Biotechnology. 31 (7), 397-405 (2013).
- Cress, B. F., et al. Rapid generation of CRISPR/dCas9-regulated, orthogonally repressible hybrid T7-lac promoters for modular, tuneable control of metabolic pathway fluxes in Escherichia coli. Nucleic Acids Research. 44 (9), 4472-4485 (2016).
- Zhao, C., Shu, X., Sun, B. Construction of a gene knockdown system based on catalytically inactive ("dead") Cas9 (dCas9) in Staphylococcus aureus. Applied Environmental Microbiology. 83 (12), (2017).
- Zhao, Y., et al. CRISPR/dCas9-mediated multiplex gene repression in Streptomyces. Biotechnology Journal. , 1800121(2018).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеThis article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены