È necessario avere un abbonamento a JoVE per visualizzare questo. Accedi o inizia la tua prova gratuita.
Method Article
Creazione di un ecosistema di polpi per la ricerca biomedica e bioingegneria
In questo articolo
Riepilogo
Comprendere le strutture fisiologiche e anatomiche uniche dei polpi può avere un grande impatto sulla ricerca biomedica. Questa guida dimostra come creare e mantenere un ambiente marino per ospitare questa specie e include approcci di imaging e analisi all'avanguardia per visualizzare l'anatomia e la funzione del sistema nervoso del polpo.
Abstract
Molti sviluppi nella ricerca biomedica sono stati ispirati dalla scoperta di meccanismi anatomici e cellulari che supportano funzioni specifiche in diverse specie. Il polpo è uno di questi animali eccezionali che ha dato agli scienziati nuove intuizioni nei campi delle neuroscienze, della robotica, della medicina rigenerativa e delle protesi. La ricerca con questa specie di cefalopodi richiede la creazione di strutture complesse e cure intensive sia per il polpo che per il suo ecosistema, che è fondamentale per il successo del progetto. Questo sistema richiede più sistemi di filtraggio meccanici e biologici per fornire un ambiente sicuro e pulito per l'animale. Insieme al sistema di controllo, sono necessarie una manutenzione e una pulizia di routine specializzate per mantenere efficacemente la struttura operativa a lungo termine. Si consiglia di fornire un ambiente arricchito a questi animali intelligenti cambiando il paesaggio del serbatoio, incorporando una varietà di prede e introducendo compiti impegnativi per loro da affrontare. I nostri risultati includono la risonanza magnetica e un imaging a autofluorescenza di tutto il corpo, nonché studi comportamentali per comprendere meglio il loro sistema nervoso. I polpi possiedono una fisiologia unica che può avere un impatto su molte aree della ricerca biomedica. Fornire loro un ecosistema sostenibile è il primo passo cruciale per scoprire le loro capacità distinte.
Introduzione
I nuovi concetti nella ricerca biomedica e nell'ingegneria biomedica sono spesso ispirati dall'identificazione di strategie specifiche che le specie biologiche possiedono per affrontare le condizioni e le sfide ambientali e fisiologiche. Ad esempio, la comprensione delle proprietà di fluorescenza nelle lucciole ha portato allo sviluppo di nuovi sensori fluorescenti in grado di segnalare l'attività cellulare in altri organismi modello1; l'identificazione dei canali ionici attivati dalla luce nelle alghe ha portato allo sviluppo di neuromodulazione cellulare e temporale specifica basata sulla luce2,3,4,5; la scoperta di proteine nel pesce gatto di vetro che navigano secondo il campo magnetico terrestre ha portato allo sviluppo della neuromodulazione a base magnetica6,7,8,9,10,11; la comprensione del riflesso del sifone in Aplysia è stata strumentale alla comprensione delle basi cellulari del comportamento12,13,14.
I ricercatori continuano ad espandere l'attuale bioingegneria e la cassetta degli attrezzi filogenetica sfruttando i punti di forza unici e le nuove prospettive sulle funzioni fisiologiche che le specie di laboratorio non convenzionali detengono. Le agenzie federali stanno iniziando a sostenere queste linee di studi finanziando nuovi lavori eseguiti su diverse specie.
Un genere di animali con capacità uniche di anatomia e rigenerazione, nonché il controllo adattivo di ciascuna delle sue braccia, affascinanti biologi e ingegneri e un pubblico accattivante da ogni parte della società è Octopus17. In effetti, molti aspetti della fisiologia e del comportamento del polpo sono stati studiati negli ultimi decenni15,16,17,18,19,20,21,22,23,24,25,26 . Tuttavia, i recenti sviluppi della biologia molecolare ed evolutiva, della robotica, della registrazione del movimento, dell'imaging, dell'apprendimento automatico e dell'elettrofisiologia accelerano le scoperte relative alla fisiologia e al comportamento del polpo e le traducono in strategie innovative di bioingegneria27,28,29,30,31,32,33,34,35 ,36,37,38,39.
Qui descriviamo come impostare e mantenere l'allevamento del polpo, che sarebbe di interesse e rilevanza per scienziati e ingegneri di diversa estrazione, interessi scientifici e obiettivi. Tuttavia, i nostri risultati si concentrano sull'applicazione dei polpi nelle neuroscienze e nella ricerca neuroingegneria. Il polpo ha un sistema nervoso altamente sviluppato con 45 milioni di neuroni nel cervello centrale, 180 milioni di neuroni nei lobi ottici e altri 350 milioni di neuroni negli otto cordoni assiali e nei gangli periferici; in confronto, un cane ha un numero simile di neuroni e un gatto solo la metà di esso40. A differenza del sistema nervoso dei vertebrati, ci sono solo 32K fibre efferenti e 140K afferenti che collegano i milioni di neuroni nel cervello del polpo ai milioni di neuroni in ciascuno dei cordoni assiali del loro braccio40,41,42. Queste fibre relativamente poche interconnesse suggeriscono che la maggior parte dei dettagli per l'esecuzione dei programmi motori vengono eseguiti nel cordone assiale stesso, sottolineando il controllo neuronale distribuito in modo univoco che i polpi possiedono. Le braccia del polpo hanno uno straordinario controllo motorio fine che consente loro abilità di manipolazione come l'apertura dei coperchi dei barattoli, anche quando si trovano all'interno del contenitore. Questa capacità motoria prensile altamente sviluppata è unica per la classe dei cefalopodi (polpi, seppie e calamari)43.
Infatti, attraverso centinaia di milioni di anni di evoluzione, il polpo ha sviluppato un genoma e un sistema fisiologico notevoli e sofisticati43,44 che ha ispirato nuovi sviluppi e progressi in tutti i campi scientifici e ingegneristici. Ad esempio, un cerotto adesivo resistente all'acqua basato sulla struttura anatomica dei polloni del polpo può aderire a superfici bagnate e asciutte45; un materiale mimetico sintetico ispirato alla pelle mimetica del polpo può trasformare una superficie piatta 2D in una tridimensionale con protuberanze e buche46. Robot morbidi e autonomi in miniatura (ad esempio, Octobots) che in futuro potrebbero servire come strumenti chirurgici all'interno del corpo47; e sono stati sviluppati anche un braccio (ad esempio, OctoArm) collegato a un robot simile a un carro armato48. Molte specie di polpi sono utilizzate nella ricerca biomedica, ad esempio Octopus vulgaris, Octopus sinensis, Octopus variabilis e Octopus bimaculoides (O. bimaculoides); l'O. vulgaris e l'O. bimaculoides sono i più comuni34,49,50. Il recente sequenziamento di diversi genomi di polpo rende questo genere di particolare interesse e apre nuove frontiere nella ricerca sui polpi34,43,51,52.
O. bimaculoides utilizzata nel nostro set-up è una specie di polpo di medie dimensioni, scoperta per la prima volta nel 1949, che può essere trovata in acque poco profonde al largo della costa nord-orientale del Pacifico dalla California centrale al sud della penisola della Baja California17. Può essere riconosciuto dalle false macchie oculari sul suo mantello sotto i suoi occhi. Rispetto al polpo gigante del Pacifico (Enteroctopus dofleini) e al polpo comune (O. vulgaris), il polpo a due macchie della California (O. bimaculoides) è di dimensioni relativamente piccole, iniziando più piccolo di pochi centimetri, crescendo velocemente come un giovane. Se allevato all'interno di un laboratorio, la dimensione del mantello adulto può crescere fino a una dimensione media di 100 cm e pesare fino a 800 g53,54. I polpi hanno un periodo di crescita rapido entro i loro primi 200 giorni; da allora, sono considerati adulti e continuano a crescere per il resto della loro vita55,56,57. I polpi possono essere cannibali, specialmente quando entrambi i sessi sono alloggiati insieme all'interno di un serbatoio; pertanto, devono essere alloggiati singolarmente in serbatoi separati58.
Protocollo
Tutti gli studi sugli animali sono stati approvati dall'Institutional Animal Care and Use Committee (IACUC) della Michigan State University.
1. Configurazione dell'attrezzatura del serbatoio del polpo
- In primo luogo, ottenere tutti i materiali non biologici per un acquario che saranno incorporati nel sistema ambientale marino, come mostrato nella Tabella dei materiali. Le dimensioni sono fornite in pollici.
- Lavare tutte le parti di tubi, tubazioni e sistemi di filtraggio con etanolo al 70% e acqua deionizzata (DI) prima dell'installazione. Non usare sapone o altri prodotti chimici durante la pulizia.
- Posiziona un tavolo in fibra di vetro 13 pollici x 49 pollici x 1/2 pollice (Parte #71) con quattro gambe del tavolo in fibra di carbonio e con le dimensioni di 2 pollici x 2 pollici x 23 pollici (Parte #72). Attaccare le gambe direttamente sotto gli angoli del piano del tavolo.
- Sotto la superficie superiore, tra ciascuna delle gambe del tavolo, posizionare le bretelle di stabilizzazione in fibra di carbonio lunghe 2 pollici x 2 pollici (parte #72) attaccate alla parte inferiore del tavolo e direttamente contro il bordo del ripiano superiore. Fissare con viti un altro ripiano con le stesse dimensioni direttamente sul terreno sotto il tavolo. Lasciare che la pompa (vedi Tabella dei materiali) si sieda direttamente sulla superficie del ripiano inferiore mentre il serbatoio si trova sulla superficie superiore. Questo sistema è mostrato nella Figura 1.
NOTA: l'uscita dell'acqua dal serbatoio è alimentata a gravità e tutti i tubi, ad eccezione di quelli che entrano ed escono dal serbatoio, devono essere inferiori al fondo del serbatoio per garantire la massima pressione della testa di drenaggio.

Figura 1: Configurazione del serbatoio Octopus. Ingresso e uscita dell'acqua (a). Tre vasche di polpo ciascuna con una superficie di 1,22 m x 0,3 m (b). Fare clic qui per visualizzare una versione più grande di questa figura.
- Praticare un singolo foro da 13/4 pollici, a 2 pollici da uno dei lati del serbatoio, utilizzando punte da taglio in vetro. La parte inferiore della schermata di aspirazione dell'acqua in uscita determinerà l'elevazione del foro di uscita come mostrato sul lato destro della Figura 2a. Il livello dell'acqua sarà determinato dallo schermo di aspirazione e dovrà essere di almeno 6 pollici dalla parte superiore del serbatoio consentendo una zona di spruzzi d'acqua.
- Utilizzare un primer in PVC e cemento per collegare in modo permanente le sezioni. Per fare ciò, in primo luogo, far scorrere l'estremità del tubo in PVC maschio previsto nell'estremità del tubo femmina. Posizionare un pezzo di nastro adesivo all'esterno della parte maschile che è ancora visibile per evitare che il primer e il cemento vengano visualizzati all'esterno del tubo. Separare le parti dopo la nastratura e posizionare una leggera mano di primer all'esterno del tubo maschio dopo l'applicazione del cemento nella stessa area.
- Rimontare il tubo maschio nel tubo femmina, il prima possibile, dopo l'applicazione del cemento e rimuovere il nastro. 24 ore dopo l'applicazione del primer e del cemento, lavare le parti appena collegate con acqua DI. Per il tempo di polimerizzazione, guarda il prodotto cementizio per ulteriori indicazioni.
NOTA: assicurarsi che la configurazione di tutti i tubi e le attrezzature sia posizionata correttamente prima di utilizzare primer in PVC e cemento; i requisiti di lunghezza del tubo possono variare. - Quindi, collegare in modo permanente l'estremità del diametro esterno (OD) di 1 pollice dello schermo di aspirazione all'estremità del diametro interno (ID) di 1 pollice dell'articolazione del gomito. Collegare l'estremità dell'articolazione del gomito al tubo in PVC dritto (1 pollice OD). Collegare l'altro lato del tubo dritto, quindi all'ID da 1 pollice della presa femmina dell'adattatore dritto a parete passante.
NOTA: ID si riferisce alla distanza più ampia tra le pareti interne del tubo. OD si riferisce all'esterno della larghezza del tubo. - Collegare in modo permanente l'adattatore dritto a parete passante a un tubo in PVC dritto lungo 4 pollici con un OD da 1 pollice (dal passaggio 1.8). Questo tubo sarà rivolto fuori dal serbatoio.
- Collegare in modo permanente il tubo dritto al centro del connettore in PVC (1 pollice ID a forma di T; dal passaggio 1.9). Quindi, collegare in modo permanente due tubi lunghi 6 pollici (parte n. 69) (OD da 1 pollice) a entrambe le estremità opposte del connettore a T: uno rivolto direttamente verso l'alto per il rilascio dell'aria e l'altro direttamente verso il basso per il flusso d'acqua.
- Collegare in modo permanente il tubo dritto esteso verso il basso (dal passaggio 1.10) a un adattatore dritto a spina femmina (ID da 1 pollice). Collegare un tubo di gomma lungo 36 pollici (ID 3/4 di pollice) all'adattatore per tubo spinato.
- Posizionare il sistema di raffreddamento tra il tubo di uscita dell'acqua e il sistema del pozzetto.
- Collegare i raccordi barbici da 3/4 di pollice, forniti con il sistema, alle porte di ingresso e uscita dell'unità chiller. Posizionare il tubo di gomma (dal punto 1.11) sul raccordo di ingresso del refrigeratore.
- Collegare un nuovo pezzo di tubo ID da 3/4 di pollice (dal passaggio 1.13) dall'uscita del refrigeratore (dal passaggio 1.12) all'ingresso del sistema di pozzetto come mostrato nella Figura 2b.
- Quindi, posizionare il filtro del calzino da 4 pollici x 12 pollici, con dimensioni dei pori di 200 μm, nell'area designata come mostrato nella Figura 2. Inoltre, come illustrato nella Figura 2, posizionare lo schiumatoio proteico e la pompa di ritorno nelle aree appropriate. Insieme alla pompa di ritorno, collegare la valvola automatica a galleggiante superiore alla parete interna dell'area della pompa, 2 pollici sopra la parte superiore dell'ingresso dell'acqua della pompa; non bloccare la rimozione della pompa dal serbatoio, se necessario.
- Collegare in modo permanente un tubo dritto lungo 12 pollici (3/4 di pollice OD) all'uscita della pompa (dal passaggio 1.15). All'altra estremità del tubo dritto OD da 3/4 di pollice, collegare permanentemente l'OD del tubo a un giunto del gomito ID 45 ° id 3/4 di pollice. All'altra estremità del giunto, collegare in modo permanente un tubo OD da 3/4 di pollice.
- Collegare l'altra estremità del tubo dritto (dal punto 1.16) all'ID da 3/4 di pollice di un adattatore di riduzione dritto. Collegare in modo permanente l'estremità dell'adattatore più grande (OD da 2 pollici) all'ingresso della luce UV.
NOTA: le lunghezze dei tubi dritti possono variare. - Quindi, abbinare il posizionamento dell'ingresso della luce UV con il tubo di uscita della pompa (dal passaggio 1.17) in modo che il tubo non si pieghi tra la luce e la pompa (dal passaggio 1.15). Praticare fori nel tutore di stabilizzazione per abbinare i fori di attacco della luce UV. Abbinare le dimensioni delle viti con la punta del trapano e fissare la luce UV al tavolo utilizzando le viti fornite.
- Collegare in modo permanente il lato da 2 pollici di un altro adattatore riducente all'uscita della luce UV (dal passaggio 1.18). Collegare un OD da 1 pollice di un tubo dritto lungo 5 pollici all'ID da 1 pollice dell'adattatore. Quindi, collegare un pezzo angolare a 90 ° con l'ID da 1 pollice al tubo OD da 1 pollice; avere l'estremità non attaccata del pezzo d'angolo rivolta verso il lato del serbatoio in cui è destinato l'ingresso dell'acqua (stesso lato del punto 1.5).
- Collegare in modo permanente l'altra estremità dell'angolo (dal passaggio 1.19) a un tubo lungo 6 pollici (parte #69) con OD da 1 pollice con l'ingresso dell'unità di controllo del flusso (parte #2). Collegare in modo permanente un altro tubo OD da 1 pollice (parte #69) all'uscita dell'unità di monitoraggio del flusso; la lunghezza deve estendersi di almeno 3 pollici oltre il lato del serbatoio.
- Utilizzando una punta da taglio del vetro da 13/4 di pollice (Parte #1), tagliare un nuovo foro 3 pollici sopra la linea di galleggiamento prevista e 2 pollici di distanza dal lato del serbatoio (Figura 1a) sul lato opposto a quello con foro di uscita dell'acqua. Fissare un altro raccordo per paratia a parete passante con uno slittamento da 1 pollice (parte n. 77) rivolto verso l'esterno del serbatoio.
- Allo slittamento della paratia collegare un tubo dritto con l'OD da 1 pollice e 4 pollici di lunghezza (parte # 69) in modo permanente. Tagliare il tubo dall'ultima parte del passaggio 1.21 in modo che corrisponda alla distanza che questo tubo si estende dal serbatoio. Collegare in modo permanente un tubo a 90 ° (parte n. 65) a ciascuno dei tubi aperti e tagliare un tubo dritto OD finale da 1 pollice (parte n. 69) che collega in modo permanente entrambi i pezzi angolari.
NOTA: la Figura 3 mostra una semplice rappresentazione del sistema dell'acquario. - Impostare il resto del sistema di controllo (Parte #34), prima montando la ciabatta (Parte #53) sul tavolo stesso o su una parete vicina. Accanto ad esso montare il modulo di monitoraggio dei fluidi (Parte #2).
- Collegare il sensore di flusso, la ciabatta e i sensori di rilevamento delle perdite al modulo. Impostare la luce di crescita (parte #26) che è attaccata al bidone delle alghe (Figura 2).
- Collegare il sensore di flusso, la luce UV, la luce di crescita, la pompa e lo schiumatoio proteico alla barra energetica. Impostare la programmazione del sistema di controllo dell'acqua in base al manuale del produttore.
- Preparare l'acqua salata mescolando mezza tazza di miscela di sale disponibile in commercio con 1 gallone di acqua ad osmosi inversa (RO) o deionizzata (DI). Fai 45 galloni per riempire completamente un serbatoio e un sistema di pozzetto.
- Accendere la pompa all'interno del regolatore di flusso del sistema di pozzetto e continuare ad aggiungere acqua salata fino a quando la valvola di spegnimento automatica non è in posizione off in modo da non richiedere acqua dolce aggiuntiva.
- Una volta che l'acqua è piena, interrompere il riempimento e accendere l'unità di raffreddamento dell'acqua per impostare la temperatura tra 18 °C e 22 °C poiché questo è l'intervallo di temperatura preferibile53. Accendere lo schiumatoio proteico.
- Aggiungi 30 kg di corallo frantumato sul fondo del serbatoio e uno strato di corallo frantumato sul fondo del cestino delle alghe. Aggiungi più rocce vive e qualsiasi altra aggiunta all'ambiente del polpo. Posizionare una parte superiore per coprire l'apertura del serbatoio.
NOTA: Le rocce vive sono coralli morti che sono abitati da vita marina macroscopica come batteri e alghe. - Aggiungere batteri nitrificanti utilizzati negli acquari di acqua salata come indicato sulla confezione. Continua ad aggiungerlo come indicato, controllando temperatura, salinità, pH, ammoniaca, nitrito e nitrato ogni giorno con kit di test dell'acqua, sensore di pH e sensore di temperatura. I valori di sicurezza per i livelli di ammoniaca, nitriti e nitrati sono inferiori rispettivamente a 0,5 ppm, 0,25 ppm e 10 ppm58.
- Assicurarsi che la luce UV sia spenta per i giorni in cui vengono aggiunti batteri nitrificanti per consentire ai microrganismi dell'acqua salata di crescere. Dopo che i parametri sono all'interno di intervalli di sicurezza, la luce UV può essere riattivata.
- Dopo aver stabilito il sistema, verificare anche che il pH e l'ossigenazione siano rispettivamente a 8,0-8,4 e
 59. Prima di aggiungere animali all'acquario, verificare la presenza di eventuali livelli di rame e ossigeno all'interno del sistema utilizzando un kit di test dell'acqua di rame.
59. Prima di aggiungere animali all'acquario, verificare la presenza di eventuali livelli di rame e ossigeno all'interno del sistema utilizzando un kit di test dell'acqua di rame.
NOTA: Il rame provoca danni agli invertebrati e interferisce con l'osmoregolazione nelle branchie dei pesci60,61. - Se il rame si trova nell'acqua, testare la fonte d'acqua DI/RO. Dopo aver determinato che la fonte d'acqua non contiene rame, eseguire un cambio d'acqua del 30% e posizionare il blocco di carbone attivo (Parte #46) all'interno dell'acqua. Se il problema persiste, eseguire un cambio d'acqua completo e pulire tutte le parti.
- Dopo che tutti i parametri dell'acqua sono stati determinati per essere entro livelli di sicurezza, aggiungere 10 gamberetti fantasma nel sistema almeno una settimana prima di aggiungere i polpi. Ciò contribuirà a introdurre biomassa per i batteri e indicherà la qualità complessiva dell'acqua.
- Aggiungi ulteriori abitanti dell'ecosistema dell'acquario al cestino delle alghe. Questo include Chaetomorpha spp. (spaghetti alghe), Trochus Sp. (lumaca trochus fasciata) e Mercenaria mercenaria (vongole di ciliegio).

Figura 2: Sistema di pozzetto. Vista laterale del sistema di pozzetto (a). Vista dall'alto del sistema di pozzetto (b). Fare clic qui per visualizzare una versione più grande di questa figura.
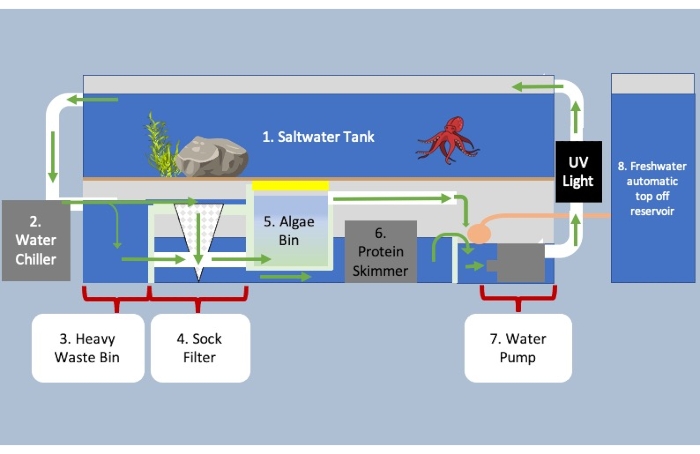
Figura 3: Acquario con sistema di filtraggio del pozzetto sotto il serbatoio e unità di controllo ambientale. Le frecce verdi indicano la direzione del flusso d'acqua attraverso il sistema. Acqua che scorre dalla sezione uno a due per il raffreddamento e su tre per separare la materia biologica pesante dalla materia più leggera. I rifiuti pesanti galleggiano verso il basso e verso la sezione cinque, mentre la materia biologica più piccola fluisce nel filtro del calzino all'interno della sezione quattro. L'acqua scorre da quattro sotto la sezione cinque entrando nello schiumatoio proteico in sei per rimuovere i rifiuti rimanenti all'interno dell'acqua. Il bidone delle alghe contiene microrganismi per abbattere rifiuti, ammoniaca e nitrati e ossigenare l'acqua. Nell'ultima parte del sistema, viene aggiunta più acqua per tenere conto dell'evaporazione prima di essere pompata nuovamente nel serbatoio. Fare clic qui per visualizzare una versione più grande di questa figura.
2. Serbatoi di stoccaggio
- Installa due alti serbatoi di stoccaggio dell'acqua da 60 galloni, uno per l'acqua salata e l'altro per l'acqua RO. Assicurarsi che la linea di riempimento massima del serbatoio di acqua dolce sia più alta della tabella. Collegare un tubo da 1/4 di pollice alla parte superiore automatica della valvola a galleggiante nel sistema a pozzetto e collegare l'altra estremità del tubo al fondo del serbatoio di acqua dolce.
NOTA: Questo è da riempire se l'acqua evapora. Il sale rimarrà nell'acqua. - Riempire il serbatoio dell'acqua salata con acqua e aggiungere la quantità proporzionale di sale al serbatoio. Aerare continuamente il serbatoio di stoccaggio dell'acqua salata per la miscelazione e la corretta ossigenazione. Attendere un'ora prima dell'uso per garantire la miscelazione completa del sale.
NOTA: Il serbatoio dell'acqua salata è utile per riempire i serbatoi dopo la pulizia.
3. Configurazione del serbatoio del cibo
- Per mantenere in vita i gamberetti per più di una settimana, conservarli in un serbatoio separato dal polpo con la salinità inferiore a 30 ppt e la temperatura vicina a 25 °C.
- Per fare ciò, una settimana dopo la maturazione dei serbatoi di polpo, trasferire 8 litri di acqua salata matura al serbatoio dei gamberetti. Aggiungere 15 kg di corallo frantumato sul fondo del serbatoio. Aggiungi alcune rocce vive al serbatoio per i nascondigli per la muta (Figura 4).
NOTA: L'acqua di mare matura si riferisce al processo di consentire ai batteri marini di crescere all'interno dell'acqua salata, come mostrato nel passaggio 1.30. - Collegare un filtro cannister al bordo del serbatoio. Impostare il filtro contenitore come indicato dal produttore. Aggiungere una pompa dell'aria accanto al serbatoio collegato a un tubo con una pietra d'aria attaccata inserita nel serbatoio.
- Pulire il filtro e cambiare i cuscinetti del filtro ogni settimana. Inoltre, il 25% dell'acqua dovrà essere cambiato allo stesso tempo. Controllare quotidianamente i parametri di azoto, pH e temperatura nei serbatoi degli alimenti con kit per il test dell'acqua come descritto nel passaggio 1.30. Se i parametri dell'azoto dell'acqua rimangono elevati, eseguire ulteriori cambi d'acqua e aggiungere un sacchetto assorbente di azoto all'acqua; o se i problemi persistono per più di un mese, i gamberetti dovranno essere spostati in un serbatoio più grande.
- Aggiungi gamberetti non appena il sedimento corallino schiacciato viene dissipato. Per aggiungere prima i gamberetti, all'arrivo, spostare i gamberetti senza spedire acqua nel piccolo serbatoio di acqua salata per 5 minuti per rimuovere i rifiuti organici. Quindi, i gamberetti possono essere aggiunti direttamente al serbatoio. Il pesce zanzara, all'arrivo, può essere aggiunto direttamente alla vasca dei gamberetti.
NOTA: gamberetti e pesci zanzara possono essere acquistati da qualsiasi fornitore commerciale di animali vivi elencato sul foglio dei materiali o da altri fornitori di alimenti. È anche possibile offrire polpi scongelati gamberetti. - Nutrire gamberetti e pesci con fiocchi di pesce, vegetazione morta o alghe62, come indicato sulle istruzioni alimentari.
- Per il serbatoio del granchio, aggiungere 1 gallone di acqua salata e 10 kg di ciottoli. Ammucchiare i ciottoli da un lato lasciando terra asciutta da un lato e 2 cm di acqua salata dall'altro lato (come notato nella Figura 4). I parametri ambientali ottimali dell'acqua per questi invertebrati dovrebbero essere rispettivamente 30-35 ppt e 22-25 °C per salinità e temperatura11,63.
- Aggiungere i granchi violinisti direttamente nel serbatoio (Figura 4). I granchi trascorreranno la maggior parte della loro vita a terra, ma possono rimanere sott'acqua per alcuni giorni alla volta, rendendo il serbatoio che è parzialmente sott'acqua cruciale per la loro sopravvivenza a lungo termine.
- Dai da mangiare ai granchi violinisti una volta al giorno aggiungendo fiocchi di pesce nel piatto nell'area asciutta del serbatoio. Pulire settimanalmente rimuovendo i granchi e cambiando il 100% dell'acqua salata. Pulisci i ciottoli.
- Conservare i molluschi bivalvi marini (vongole e cozze) all'interno dei serbatoi di acqua salata affinché i polpi si aprano e forniscano un altro meccanismo di filtraggio dell'acqua64.
- Posizionare le cozze all'interno di un serbatoio separato non occupato per la prima settimana per evitare di posizionare un carico di rifiuti non necessario sul sistema di filtraggio del serbatoio del polpo.
NOTA: Mentre le cozze sono state il cibo preferito dal polpo, è più probabile che muoiano subito dopo l'arrivo e aumenteranno sostanzialmente i rifiuti biologici all'interno del serbatoio se sono presenti in grandi quantità.
4. Introduzione del polpo nel serbatoio
- Assicurarsi che i livelli di ammoniaca, nitriti e nitrati siano inferiori rispettivamente a 0,5 ppm, 0,25 ppm e 10 ppm. Avere a disposizione una pompa a mano dell'acqua per rimuovere l'inchiostro di polpo dal serbatoio. Si consiglia inoltre di avere due persone per questa procedura.
- All'arrivo, posizionare la borsa sulla bilancia e sottrarre il peso della borsa dopo che il polpo è stato rimosso. Aggiungi una pietra d'aria alla borsa per aumentare l'ossigenazione dell'acqua mentre trasferisci l'animale nel loro serbatoio. Misurare la temperatura e la salinità dell'acqua di spedizione. Registra i casi di malattia prolungata dopo la spedizione.
- Senza trasferire acqua dalla borsa al serbatoio, appendere la borsa di trasporto sopra l'angolo del serbatoio con la borsa parzialmente immersa nell'acqua del serbatoio per iniziare a cambiare la temperatura della borsa di trasporto. Rimuovere il 10% dell'acqua dal sacchetto e scaricare il lavandino. Aggiungere la stessa quantità di acqua dal serbatoio alla borsa. Ripetere ogni 10 minuti fino a quando la temperatura dell'acqua nel sacchetto non è superiore a 1 ° diversa dalla temperatura dell'acqua nel serbatoio.
- Una volta che la differenza di temperatura della borsa e del serbatoio è entro 1°, assicurarsi che i guanti siano indossati per spostare i polpi nel loro serbatoio individuale. Per muoversi, posizionare entrambe le mani sotto il polpo per fornire supporto durante il trasferimento; la seconda persona dovrà tirare delicatamente le braccia aspirate dal lato della borsa.
- Una volta che il polpo è fuori dalla borsa, spostalo rapidamente nell'acqua del suo nuovo habitat trasferendo meno acqua possibile dalla borsa di spedizione. Utilizzare la pompa manuale per rimuovere l'inchiostro che il polpo rilascia quando si trova nel serbatoio. Ora pesare la borsa con acqua per ottenere il peso approssimativo dell'animale.
- Per le prime 2 settimane dopo l'arrivo, monitorare il consumo giornaliero del polpo che dovrebbe essere compreso tra il 4% e l'8% del loro peso58,65,66. Il polpo dovrebbe essere controllato quattro volte al giorno; questo può essere ridotto a due volte al giorno dopo 2 settimane. Pesare ogni due settimane per regolare il consumo di cibo secondo necessità.
NOTA: Alcune specie di polpo sono note per sfuggire dal loro serbatoio, quindi è consigliabile posizionare un peso di 2,5 kg sul coperchio del loro serbatoio.
5. Cura quotidiana
- Utilizzando un kit di test dell'acqua salata disponibile in commercio per pH, ammoniaca, nitrito e nitrato, aggiungere la quantità diretta dal kit di acqua del serbatoio alle quattro provette fornite con il kit. Come specificato nel kit di test, aggiungere la quantità di reagente colorimetrico al tubo corrispondente.
- Se i livelli di ammoniaca, nitriti e nitrati sono superiori rispettivamente a 0,5 ppm, 0,25 ppm e 10 ppm, lavare la biomassa dal filtro del calzino o passare a un nuovo filtro per calze. Inoltre, pulire la biomassa dalla parte superiore dello skimmer con una spazzola e aggiungere ulteriori batteri denitrificanti al serbatoio. Se i problemi persistono, sostituisci il 25% di acqua salata fresca.
NOTA: i passaggi precedenti riducono i composti azotati all'interno dell'ecosistema. - Rimuovere tutte le carcasse di granchi e gamberetti morti dal serbatoio e qualsiasi materia fecale di polpo usando una pompa a mano. Rimuovi tutti i granchi viventi rimanenti dal serbatoio e spostali di nuovo nel serbatoio di stoccaggio. Quindi, riorganizzare oggetti di grandi dimensioni all'interno del serbatoio.
- Introdurre la metà del numero di granchi che il polpo mangerebbe quotidianamente nel serbatoio del peso di 1,25 +/- 0,25 g. Dai da mangiare gamberetti scongelati o piccoli granchi violinisti maschi a giovani polpi. A seconda dell'esperimento, granchi e gamberetti possono essere introdotti ovunque nel serbatoio o direttamente nel polpo.
NOTA: Il consumo giornaliero di cibo dei polpi è pari al 4%-8% del loro peso67. I gamberetti congelati possono anche essere forniti come fonte di cibo in base al peso del polpo. - Offri cinque gamberetti fantasma al giorno. In media, tre sono stati consumati in questo esperimento. Per fornire una varietà di cibo al polpo, dare una vongola o una cozza viva una volta alla settimana e mantenere sempre tre pesci zanzara all'interno del serbatoio.
NOTA: Dare agli animali una varietà di cibo non è richiesto e può impedire agli animali di essere attratti dal cibo durante gli esperimenti. Il programma di alimentazione utilizzato qui per monitorare al meglio l'alimentazione e il comportamento dei polpi è quello di introdurre metà del numero di granchi in base al peso e aumentare il numero di gamberetti a cinque al mattino. La sera, introdurre la seconda metà dei granchi nel serbatoio.
6. Igienizzazione settimanale
- Spegnere lo skimmer, la pompa e le luci del cestino delle alghe prima di pulire il sistema di pozzetto. Quindi, spegnere la valvola automatica del sistema prima di rimuovere l'acqua. Infine, rimuovere lo skimmer e tutta l'acqua solo dal sistema di pozzetto.
- Strofinare leggermente il cestino delle alghe per rimuovere la maggior parte della biomassa dalle sue pareti. Pulire il resto dell'area del pozzetto con un pennello. Rimuovere il filtro del calzino, pulire con aceto e lasciarlo asciugare; ruotare con un altro filtro calzino ogni settimana sostituendolo con uno nuovo ogni tre mesi. Rimuovere e pulire la biomassa dalla parte superiore dello skimmer settimanalmente.
NOTA: Evitare l'uso di metallo per pulire la plastica in quanto creerà graffi che potrebbero essere soggetti a crescita microbica. - Rimetti lo skimmer nel sistema e inizia a riempire con acqua salata. Quando l'area della pompa inizia a riempirsi, tutti i sistemi possono essere riaccesi. Interrompere l'aggiunta di acqua quando la parte superiore automatica della valvola a galleggiante è in posizione off.

Figura 4: Serbatoio per granchi violinisti (Minuca pugnax). Il fondo del serbatoio è per metà designato per il letto asciutto e l'altra metà per 2 cm di acqua salata poco profonda. Fare clic qui per visualizzare una versione più grande di questa figura.

Figura 5: Serbatoio per gamberetti fantasma (Palaemonetes paludosus). Le rocce nel serbatoio dei gamberetti forniscono posti per i gamberetti per nascondersi e muta, nonché per la crescita di microrganismi. Fare clic qui per visualizzare una versione più grande di questa figura.
7. Cura degli animali malati
- Segui la guida reference66 per valutare il benessere del polpo.
NOTA: per i polpi femmina, la fine del ciclo di vita inizia normalmente dopo la deposizione delle uova. L'animale inizierà a diminuire il consumo di cibo e smetterà di mangiare del tutto e diventerà più letargico. La durata della vita dopo il processo di fine vita varia. Non è possibile intraprendere ulteriori azioni se non l'alimentazione e il monitoraggio dell'animale. I maschi senescenti diminuiranno il consumo di cibo e diventeranno letargici68.
8. Anestesia del polpo
- Eseguire l'anestesia del polpo come dettagliato in Butler-Struben et al.69.
- Ottenere un contenitore da 6 L con coperchio alto almeno 15 cm. Introdurre 4 L di acqua direttamente dal serbatoio del polpo nel contenitore e fornire aerazione per 4 L di acqua salata utilizzando una piccola pompa ad aria con pietra d'aria per diffondere ossigeno nell'ambiente idrico58.
- Prima dell'introduzione del polpo, aggiungere l'1% di EtOH al contenitore. Prima di maneggiare il polpo, registrare il numero di respiri al minuto contando l'espirazione dell'acqua dal sifone.
NOTA: Per i polpi all'interno del laboratorio del ricercatore, le respirazioni di base sono 16 - 24 respiri al minuto. - Prima di spostare il polpo, registrare la pigmentazione della pelle del polpo e la frequenza respiratoria basale. Rimuovere il polpo dal serbatoio utilizzando un contenitore pulito a bocca aperta da 4 L raccogliendolo con l'acqua circostante.
NOTA: Durante l'anestesia, le frequenze respiratorie non indicano necessariamente l'anestesia completa. - Pesare il polpo mentre si trova nel contenitore, quindi spostarlo posizionando entrambe le mani attorno al corpo del polpo e sollevandolo. Potrebbe essere necessaria una seconda persona per rimuovere gli arti aspirati dalle pareti del contenitore.
- Sposta rapidamente il polpo nel contenitore preparato con l'1% di EtOH. Chiudere il coperchio per evitare una possibile fuga.
- Registrare la respirazione del polpo al minuto contando l'espirazione dell'acqua dal sifone alla fine dei primi 5 minuti. Se la respirazione rimane al di sopra del basale e l'animale continua a rispondere a un leggero pizzico, aggiungere un ulteriore 0,25% di EtOH all'acqua. L'aggiunta di etanolo all'acqua può continuare fino ad un massimo del 3% di EtOH.
NOTA: Un'indicazione che il polpo è incosciente è la sua perdita di controllo dei suoi cromatofori. In questo caso la pelle appare più chiara del normale. Un'ulteriore indicazione è quella di pizzicare leggermente le braccia e verificare se c'è una risposta motoria. Se non c'è ancora risposta a questo punto, il polpo è incosciente e gli esperimenti possono essere eseguiti. - Mentre sei in anestesia, monitora la respirazione e il colore del polpo per assicurarti che rimanga incosciente per tutta la durata della procedura. Se il polpo inizia a risvegliarsi durante la procedura, aggiungere un ulteriore 0,25% etOH.
- Per invertire gli effetti dell'anestesia con etanolo, trasferire il polpo in un nuovo serbatoio di acqua ossigenata da 4 L o superiore dal suo serbatoio di mantenimento permanente. Una volta che le respirazioni tornano alla normalità, il polpo diventa attivo e la sua pelle ritorna ai pigmenti normali; può essere spostato di nuovo nel suo serbatoio.
9. Eutanasia del polpo
- Seguire gli standard internazionali per l'eutanasia del polpo come dettagliato in Fiorito et al., Moltschaniwskyj et al., e Butler-Struben et al57,58,69.
- Preparare un nuovo contenitore da 6 L con 4 L di acqua dal serbatoio di contenimento del polpo. Mescolare MgCl2 ad una concentrazione del 4% nel serbatoio di eutanasia. Eseguire passaggi da 8.1 a 8.9 per anestetizzare il polpo.
- Sposta il polpo dopo il passaggio 8.8 nel serbatoio dell'eutanasia. Dopo che la respirazione si ferma, attendere 5 minuti ed eseguire una decerebrazione del polpo o tenere nella vasca di eutanasia per altri 5 minuti.
10. Comportamento di O. bimaculoides
- Non nutrire il polpo al mattino quando saranno addestrati a utilizzare un contenitore con tappo a vite. Impostare un dispositivo di registrazione della fotocamera che punti all'area destinata all'alimentazione.
- Ottenere un tubo con tappo a vite da 50 ml con fori di 1 mm di diametro su tutta la superficie e il tappo per il flusso d'acqua in tutto il contenitore. Metti un granchio violinista all'interno del contenitore. Posizionare un peso all'interno del contenitore o attaccato all'esterno in modo che rimanga sul fondo del serbatoio.
- Posizionare il contenitore sul fondo del serbatoio all'interno dell'area aperta e in vista del polpo e della fotocamera. Se il granchio non è stato mangiato dopo 4 ore, rimuoverlo dal tubo e riprendere il programma di alimentazione per il giorno. Continua a eseguire questo esercizio ogni giorno.
NOTA: questo è mostrato nella Figura 6 e discusso nella sezione dei risultati rappresentativi.
11. Risonanza magnetica del polpo
NOTA: In precedenza, le risposte mriche funzionali evocate nella retina del polpo venivano misurate in animali anestetizzati70. Qui, abbiamo ottenuto una risonanza magnetica ad altissima risoluzione spaziale del sistema nervoso del polpo che ha richiesto ore di scansione. Quindi, questo è stato eseguito in un O. bimaculoides eutanasizzato.
- Ottenere immagini MRI utilizzando un sistema 7T. Avvolgere il polpo in un involucro di plastica di cloruro di polivinile da cucina per mantenere l'idratazione del tessuto. Posizionare il polpo sull'involucro, infilare le estremità e quindi rotolare per sigillare.
- Utilizzare una bobina di trasmissione / ricezione del volume con un diametro di 4 cm per acquisire immagini del cervello e di più braccia. Utilizzare la sequenza RARE ponderata T1 con i seguenti parametri: tempo di ripetizione (TR) di 1500 ms, tempo di eco (TE) di 20 ms, risoluzione 117 x 117 x 500 μm, medie 100, fattore RARE 8. Questi sono parametri tipici della risonanza magnetica per l'imaging del cervello dei roditori. L'utilizzo di un fattore RARE rende l'imaging più veloce, mentre 100 immagini vengono mediate insieme per aumentare il rapporto segnale-rumore71.
- Immagina il braccio del polpo usando una bobina di trasmissione con un volume di 86 mm e una bobina di ricezione array a 4 canali da 4 x 4 cm. Tagliare un braccio usando le forbici chirurgiche e metterlo in un tubo conico da 15 ml pieno di soluzione salina tamponata con fosfato.
NOTA: La sequenza era una sequenza di ripristino dell'inversione T1_weighted (MP-RAGE) con parametri: TR/TE = 4000/2,17 ms, ritardo di inversione 1050 ms, risoluzione 100 x 100 x 500 μm, 9 medie, tempo di scansione 1,5 h (Figura 7). Una sequenza di inversione-recupero annulla il segnale dall'acqua e aumenta il contrasto all'interno dell'immagine; questa sequenza è stata scelta perché permette la visualizzazione dell'anatomia interna del braccio72.
12. Imaging della tomografia a criofluorescenza (CFT)
- Flash-freeze il polpo: lavora in una cappa aspirante. Coprire il fondo di un Dewar con ghiaccio secco, quindi riempire di esani. Abbassare lentamente il polpo negli esani per circa 10 minuti, aggiungendo esani freschi e ghiaccio secco come richiesto per coprire completamente il polpo con esani freddi. Tenere il polpo congelato a -20 °C fino a quando non è incorporato.
- Incorporare e sezionare il polpo: creare uno stampo rettangolare delle dimensioni appropriate per contenere il polpo utilizzando gli strumenti forniti dal produttore CFT. Coprire il fondo dello stampo con un supporto OCT (temperatura di taglio ottimale) (materiale standard utilizzato nei laboratori di istologia) e lasciarlo congelare in un gel semisolido.
- Posizionare il polpo congelato nello strato di gel dell'OCT, quindi coprire lentamente con OCT in 2-3 strati. Tra una fase di versamento e l'altra, congelare i passaggi del blocco fino a quando l'OCT non è allo stadio di gel. Dopo che il polpo è stato completamente coperto, congelare il blocco per almeno 12 ore a -20 °C.
- Caricare il campione nel sistema di tomografia a criofluorescenza73.
- Sezione e immagine dell'intero O. bimaculoides eutanasizzato a risoluzione mesoscopica utilizzando 3 filtri di emissione/eccitazione producendo così diversi set di dati isotropi 3D.
- Quando il sezionamento raggiunge il braccio e il sistema digestivo, trasferire le sezioni ai vetrini per un'ulteriore istologia.
- Caricare il set di dati grezzo nel software di ricostruzione del fornitore CFT appositamente progettato per consentire un'elaborazione rapida.
- Ricostruisci una pila tridimensionale utilizzando l'allineamento del punto di riferimento, il bilanciamento dell'istogramma e le correzioni e la normalizzazione della fluorescenza, inclusa la rimozione degli effetti di fluorescenza del sottosuolo per ciascuna lunghezza d'onda.
- Una volta che lo stack 3D finale è prodotto dallo strumento di ricostruzione, visualizza i dati con lo strumento software di imaging e crea fly-through con luce bianca e sovrapposizioni di fluorescenza insieme a proiezioni di intensità massima 3D (3D-MIPS), ad esempio figura 873.
Risultati
Tutti gli animali nei nostri studi sono stati ottenuti in natura, e quindi la loro età esatta non poteva essere determinata e la loro permanenza in laboratorio era variabile. La condizione del polpo è stata osservata quotidianamente. Non abbiamo visto parassiti, batteri, danni alla pelle o comportamenti anormali. Il peso medio degli animali era di 170,38 +/- 77,25 g. Ogni animale abitava il proprio serbatoio da 40 galloni. La deviazione standard media ± per i parametri registrati per un serbatoio nell'arco di una sett...
Discussione
Configurazione del sistema:
L'ecosistema dell'acquario è stato sviluppato in modo da impiegare metodi sia meccanici che biologici di filtraggio e ossigenazione dell'acqua. Gli elementi filtranti del sistema utilizzano filtri per calze, schiumatoi proteici e pulizia regolare per mantenere i livelli di azoto e ossigeno. Ancora più importante, ci affidiamo anche a microrganismi marini per consumare i pericolosi composti azotati e altri rifiuti biologici, nonché per aerare l'acqua attraverso processi d...
Divulgazioni
Tutti gli autori dichiarano nessun conflitto di interessi.
Riconoscimenti
Questo lavoro è stato supportato da NIH UF1NS115817 (G.P.). G.P. è parzialmente supportato dalle sovvenzioni NIH R01NS072171 e R01NS098231. Vorremmo ringraziare Patrick Zakrzewki e Mohammed Farhoud di Emit Imaging per l'aiuto e il supporto nella raccolta e visualizzazione dei dati sulla piattaforma di imaging Xerra. MSU ha un accordo di ricerca con Bruker Biospin.
Materiali
| Name | Company | Catalog Number | Comments |
| 1-3/4 in. Drill Bit | Home Depot | 204074205 | Glass cutting tool Part number:1 |
| 1" flow sensors | Neptune Systems | Local Dealer | Pipe with sensor to measure water flow Part number:2 |
| 1" Slip Bulkhead Strainer | Bulk Reef Supply | 207113 | Strainer for water leaving tank Part number:3 |
| 10 gallon tank | Preuss Pets | Local Dealer | Fiddler crab holding tank Part number:4 |
| 4 inch X 12 inch 200 Micron Nylon Monofiliment Mesh Filter Sock w/ Plastic Ring | AQUAMAXX | UJ41171 | Filter for large organic matter in sump Part number:5 |
| 40 gallon aquarium | Preuss Pets | Local Dealer | 4 Food aquarium tanks Part number:6 |
| 60g poly tanks - rectangle | Preuss Pets | Local Dealer | 2 Water Storage (salt and freshwater) Part number:7 |
| Active Aqua 1/10th HP Hydroponic or Aquarium Chiller 2018 Model | WayWe | 719574198463 | For cooling water continuously Part number:8 |
| ALAZCO 2 Soft-Grip Handle Heavy-Duty Tile Grout Brush | ALAZCO | B06W2FT5V5 | Tank Cleaning Part number:9 |
| Ammonia Testing Kit | Aquarium Pharmaceuticals | 33D | For water testing Part number:10 |
| Apex system WiFi | Neptune Systems | Local Dealer | System connection for off site monitoring Part number:11 |
| API Aquarium Test Kit | Amazon | B001EUE808 | For water testing Part number:12 |
| API Copper Test Kit | Amazon | B0006JDWH8 | For water testing Part number:13 |
| Aqua Ultraviolet Classic UV 25 Watt Series Units | Aqua Ultraviolet | A00028 | For removing bacteria leaving sump system Part number:14 |
| AquaClear 50 Foam Filter Inserts, 3 pack | Aquaclear | A1394 | Food Tank Carbon Filter Inserts Part number:15 |
| Aqueon QuietFlow LED PRO Aquarium Power Filter 30 | Aqueon | 100106082 | Food tank filtering units Part number:16 |
| Auto Top Off Kit (ATK) (Each includes 1 FMM module, 2 optical sensors and 1 float) | Neptune Systems | Local Dealer | For freshwater tank Part number:17 |
| Automatic top off from RODI (LLC) | Neptune Systems | Local Dealer | From water storage to octopus tanks Part number:18 |
| Banded Trochus Snail | LiveAquaria | CN-112080 | For algae bin Part number:19 |
| Chaetomorpha Algae, Aquacultured | LiveAquaria | BVJ-76354 | For algae bin Part number:20 |
| Clams - Live, Hard Shell, Cherrystone, Wild, USA Dozen | Fulton Fish Market | N/A | Live food Part number:21 |
| Classic Sea Salt Mix - Tropic Marin | Bulk Reef Supply | 211813 | Salt for tank water Part number:22 |
| Clear Masterkleer Soft PVC Plastic Tubing, for Air and Water, 3/4" ID, 1" OD | McMaster | 5233K71 | Cleaning tool Part number:23 |
| Continuum Aquablade-P Acrylic Safe Algae Scraper W/ Plastic Blade - 15 Inch | Marine Depot | 4C31001 | Cleaning tool Part number:24 |
| Copper Testing Kit | Aquarium Pharmaceuticals | 65L | For water testing Part number:25 |
| Curve Refugium CREE LED Aquarium Light | Eshopps | 6500K | Algae bin light Part number:26 |
| Eheim 1262 return pumps | EHEIM | 1250219 | Pump for storage tanks Part number:27 |
| Eshopps R-100 Refugium Sump GEN 3 | Eshopps | 15000 | Sump system Part number:28 |
| Ethyl Alcohol, 200 Proof | Sigma-Aldrich | 64-17-5 | Anesthesia Part number:29 |
| Extech DO600 ExStik II Dissolved Oxygen Meter | Extech | DO600 | Oxygen measurement Part number:30 |
| Fiddler Crabs; live; dozen | NORTHEAST BRINE SHRIMP | N/A | Live food Part number:31 |
| Filter Cartridges | Aqueon | 100106087 | Food tank filters Part number:32 |
| Florida Crushed Coral Dry Sand - CaribSea | Bulk Reef Supply | 212959 | Sediment for bottom of tank Part number:33 |
| FMM module | Neptune Systems | Local Dealer | Controller for apex system Part number:34 |
| Fritz-Zyme TurboStart 900 - Fritz | Bulk Reef Supply | 213036 | Bacteria start Part number:35 |
| Hand Operated Drum Pump, Siphon, Basic Pump with Spout, For Container Type Bucket, Pail | Grainger | 38Y789 | Water Hand Pump Part number:36 |
| High pH Testing Kit | Aquarium Pharmaceuticals | 27 | For water testing Part number:37 |
| Imagitarium Fine Mesh Net for Shrimp | Petco | 2580993 | Shrimp and fish transfer net Part number:38 |
| Leak Detection Kit (LDK) - Includes FMM module plus 2 ALD sensors | Neptune Systems | Local Dealer | Placed on floor to detect water Part number:39 |
| Lee`S Algae Scrubber Pad Jumbo - Glass | Marine Depot | LE12007 | Cleaning tool Part number:40 |
| Live rocks | Preuss Pets | Local Dealer | Habitat for octopus Part number:41 |
| Long Bottle Cleaning Brush 17" Extra Long | Haomaomao | B07FS7J7PN | Tank Cleaning Part number:42 |
| Magnesium chloride | Sigma-Aldrich | M1028-100ML | Euthanasia Part number:43 |
| Magnetic Probe Rack | Neptune Systems | Local Dealer | For holding apex sensor probes Part number:44 |
| Marine Ghost Shrimp | NORTHEAST BRINE SHRIMP | N/A | Live food Part number:45 |
| Marineland C-Series Canister Carbon Bags Filter Media, 2 count | Chewy | 98331 | For elevated copper levels Part number:46 |
| Nitra-Zorb Bag | Aquarium Pharmaceuticals | AP2213 | Absorbs nitrogen compounds Part number:47 |
| Nitrate Testing Kit | Aquarium Pharmaceuticals | LR1800 | For water testing Part number:48 |
| Nitrite Testing Kit | Aquarium Pharmaceuticals | 26 | For water testing Part number:49 |
| Pawfly 2 Inch Air Stones Cylinder 6 PCS Bubble Diffuser Airstones for Aquarium Fish Tank Pump Blue | Amazon | B076S56XWX | Aerate water Part number:50 |
| Penn Plax Airline Tubing for Aquariums –Clear and Flexible Resists Kinking, 8 Feet Standard | Amazon | B0002563MM | Tubing for connecting air pump to air stone Part number:51 |
| Plumbing with unions/valves plus 3/4" flex hose | Preuss Pets | Local Dealer | Water transport Part number:52 |
| PM1 module | Neptune Systems | Local Dealer | Power control module for apex Part number:53 |
| Protein skimmer | Reef Octopus | AC20284 | Removes biowaste from system Part number:54 |
| PVC Apex Mounting board, grommets, wire mounts | Neptune Systems | Local Dealer | Helps ensure organization for wires and tubing within system Part number:55 |
| PVC Regular Cement and 4-Ounce NSF Purple Primer | Amazon | Oatey - 30246 | For connecting PVC pipes Part number:56 |
| RODI unit | Neptune Systems | Local Dealer | RO Water Part number:57 |
| Salinity Probes | HANNA probes | HI98319 | Measures salinity of water Part number:58 |
| Seachem Pristine Aquarium Treatment | Seachem | 1438 | Provides bacteria that break down excess food, waste and detritus Part number:59 |
| Seachem Stability Fish Tank Stabilizer | Seachem | 116012607 | Seachem Stability will rapidly and safely establish the aquarium biofilter in freshwater and marine systems Part number:60 |
| Set of lexan tops | Preuss Pets | Local Dealer | Aquarium tank lids Part number:61 |
| Set of Various extended length aquabus cables | Neptune Systems | Local Dealer | Cables for Apex system Part number:62 |
| SLSON Aquarium Algae Scraper Double Sided Sponge Brush Cleaner Long Handle Fish Tank Scrubber for Glass Aquariums | Amazon | B07DC2TZCJ | Cleaning tool Part number:63 |
| Standard-Wall PVC Pipe Fitting for Water, 45 Degree Elbow Adapter, 3/4 Socket Female x 3/4 Socket Male | McMaster | 4880K189 | PVC pipe Part number:64 |
| Standard-Wall PVC Pipe Fitting for Water, 90 Degree Elbow Adapter, 1 Socket Female x 1 Socket Male | McMaster | 4880K773 | PVC pipe Part number:65 |
| Standard-Wall PVC Pipe Fitting for Water, Adapter, 1 Socket-Connect Female x 1 Barbed Male | McMaster | 4880K415 | PVC pipe Part number:66 |
| Standard-Wall PVC Pipe Fitting for Water, Straight Reducer, 2 Socket Female x 3/4 Socket Female | McMaster | 4880K008 | PVC pipe Part number:67 |
| Standard-Wall PVC Pipe Fitting for Water, Tee Connector, White, 1 Size Socket-Connect Female | McMaster | 4880K43 | PVC pipe Part number:68 |
| Standard-Wall Unthreaded Rigid PVC Pipe for Water, 1 Pipe Size, 10 Feet Long | McMaster | 48925K13 | PVC pipe Part number:69 |
| Standard-Wall Unthreaded Rigid PVC Pipe for Water, 3/4 Pipe Size, 5 Feet Long | McMaster | 48925K92 | PVC pipe Part number:70 |
| Structural FRP Fiberglass Sheet, 48" Wide x 96" Long, 1/2" Thick | McMaster | 8537K15 | Table top material Part number:71 |
| Structural FRP Fiberglass Square Tube, 10 Feet Long, 2" Wide x 2" High Outside, 1/8" Wall Thickness | McMaster | 8548K33 | Structural table material Part number:72 |
| Tank Sediment | TopDawg Pet Supply | 8479001207 | Sediment for bottom of fiddler crab tank Part number:73 |
| Temperature probe | Neptune Systems | Local Dealer | Temperature probe for tanks Part number:74 |
| Tetra TetraMarine Large Saltwater Flakes for all Marine Fish | Amazon | B00025K0US | Fish, shrimp, and crab food Part number:75 |
| Tetra Whisper Aquarium Air Pump for 10 gallon Aquariums | Petco | 2335234 | Air pump for smaller tanks Part number:76 |
| Thick-Wall Through-Wall Pipe Fitting, for Water, PVC Connector, 1 Socket-Connect Female | McMaster | 36895K843 | PVC pipe Part number:77 |
| Vectra s2 pump | Bulk Reef Supply | 212141 | Aquarium Pump Part number:78 |
| Water Pump | TACKLIFE | GHWP1A | Pump for cleaning tanks Part number:79 |
| Wyze Cam v2 1080p HD Indoor WiFi Smart Home Camera with Night Vision | Amazon | B076H3SRXG | DeepLabCut Recording Part number:80 |
Riferimenti
- Wet, J. R., Wood, K. V., DeLuca, M., Helinski, D. R., Subramani, S. Firefly luciferase gene: structure and expression in mammalian cells. Molecular and Cellular Biology. 7 (2), 725-737 (1987).
- Han, X., Boyden, E. S. Multiple-color optical activation, silencing, and desynchronization of neural activity, with single-spike temporal resolution. PLoS One. 2 (3), 299 (2007).
- Zhang, F., et al. Multimodal fast optical interrogation of neural circuitry. Nature. 446 (7136), 633-639 (2007).
- Li, N., et al. Optogenetic-guided cortical plasticity after nerve injury. Proceedings of the National Academy of Sciences of the United States of America. 108 (21), 8838-8843 (2011).
- Airan, R. D., Li, N., Gilad, A. A., Pelled, G. Genetic tools to manipulate MRI contrast. NMR Biomedicine. 26 (7), 803-809 (2013).
- Cywiak, C., et al. Non-invasive neuromodulation using rTMS and the electromagnetic-perceptive gene (EPG) facilitates plasticity after nerve injury. Brain Stimulation. 13 (6), 1774-1783 (2020).
- Hwang, J., et al. Regulation of Electromagnetic Perceptive Gene Using Ferromagnetic Particles for the External Control of Calcium Ion Transport. Biomolecules. 10 (2), (2020).
- Lu, H., et al. Transcranial magnetic stimulation facilitates neurorehabilitation after pediatric traumatic brain injury. Scientific Reports. 5, 14769 (2015).
- Krishnan, V., et al. Wireless control of cellular function by activation of a novel protein responsive to electromagnetic fields. Bioscience Reports. 8 (1), 8764 (2018).
- Mitra, S., Barnaba, C., Schmidt, J., Pelled, G., Gilad, A. A. Functional characterization of an electromagnetic perceptive protein. bioRxiv. , 329946 (2020).
- Hunt, R. D., et al. Swimming direction of the glass catfish is responsive to magnetic stimulation. PLoS One. 16 (3), 0248141 (2021).
- Kandel, E. R., Krasne, F. B., Strumwasser, F., Truman, J. W. Cellular mechanisms in the selection and modulation of behavior. Neurosciences Research Program bulletin. 17, 521 (1979).
- Carew, T. J., Castellucci, V. F., Kandel, E. R. An analysis of dishabituation and sensitization of the gill-withdrawal reflex in Aplysia. International Journal of Neuroscience. 2 (2), 79-98 (1971).
- Kandel, E. R. The molecular biology of memory storage: a dialog between genes and synapses. Bioscience Reports. 21 (5), 565-611 (2001).
- Forsythe, J. W., Hanlon, R. T. Effect of temperature on laboratory growth, reproduction and life-span of octopus-bimaculoides. Marine Biology. 98 (3), 369-379 (1988).
- Forsythe, J. W., Hanlon, R. T. Behavior, body patterning and reproductive-biology of octopus-bimaculoides from California. Malacologia. 29 (1), 41-55 (1988).
- Pickford, B. M. The Octopus bimaculatus problem: A study in sibling species. Bulletin of the Bingham Oceanographic Collection. 12, 1-66 (1949).
- Sumbre, Y., Fiorito, G., Flash, T. Control of octopus arm extension by a peripheral motor program. Science. 293 (5536), 1845-1848 (2001).
- Gutfreund, Y., et al. Organization of octopus arm movements: a model system for studying the control of flexible arms. Journal of Neuroscience. 16 (22), 7297-7307 (1996).
- Gutfreund, Y., Matzner, H., Flash, T., Hochner, B. Patterns of motor activity in the isolated nerve cord of the octopus arm. The Biological Bulletin. 211 (3), 212-222 (2006).
- Hague, T., Florini, M., Andrews, P. L. R. Preliminary in vitro functional evidence for reflex responses to noxious stimuli in the arms of Octopus vulgaris. Journal of Experimental Marine Biology and Ecology. 447, 100-105 (2013).
- Hochner, B., Brown, E. R., Langella, M., Shomrat, T., Fiorito, G. A learning and memory area in the octopus brain manifests a vertebrate-like long-term potentiation. Journal of Neurophysiology. 90 (5), 3547-3554 (2003).
- Hochner, B., Glanzman, D. L. Evolution of highly diverse forms of behavior in molluscs. Current Biology. 26 (20), 965-971 (2016).
- Hvorecny, L. M., et al. Octopuses (Octopus bimaculoides) and cuttlefishes (Sepia pharaonis, S. officinalis) can conditionally discriminate. Animal Cognition. 10 (4), 449-459 (2007).
- Kier, W. M., Stella, M. P. The arrangement and function of octopus arm musculature and connective tissue. Journal of Morphology. 268 (10), 831-843 (2007).
- Levy, G., Hochner, B. Embodied organization of octopus vulgaris morphology, vision, and locomotion. Frontiers in Physiology. 8, 164 (2017).
- Giorgio-Serchi, F., Arienti, A., Laschi, C. Underwater soft-bodied pulsed-jet thrusters: Actuator modeling and performance profiling. The International Journal of Robotics Research. 35 (11), 1308-1329 (2016).
- Han, S., Kim, T., Kim, D., Park, Y., Jo, S. Use of deep learning for characterization of microfluidic soft sensors. IEEE Robotics and Automation Letters. 3 (2), 873-880 (2018).
- Hanassy, S., Botvinnik, A., Flash, T., Hochner, B. Stereotypical reaching movements of the octopus involve both bend propagation and arm elongation. Bioinspiration and Biomimetics. 10 (3), 035001 (2015).
- Hochner, B., Shomrat, T., Fiorito, G. The octopus: a model for a comparative analysis of the evolution of learning and memory mechanisms. The Biological Bulletin. 210 (3), 308-317 (2006).
- Imperadore, P., Fiorito, G. Cephalopod tissue regeneration: consolidating over a century of knowledge. Frontiers in Physiology. 9, 593 (2018).
- Imperadore, P., et al. Nerve regeneration in the cephalopod mollusc Octopus vulgaris: label-free multiphoton microscopy as a tool for investigation. Journal of the Royal Society, Interface. 15 (141), 20170889 (2018).
- Levy, G., Flash, T., Hochner, B. Arm coordination in octopus crawling involves unique motor control strategies. Current Biology. 25 (9), 1195-1200 (2015).
- Li, F., et al. Chromosome-level genome assembly of the East Asian common octopus (Octopus sinensis) using PacBio sequencing and Hi-C technology. Molecular Ecology Resources. 20 (6), 1572-1582 (2020).
- Lopes, V. M., Rosa, R., Costa, P. R. Presence and persistence of the amnesic shellfish poisoning toxin, domoic acid, in octopus and cuttlefish brains. Marine Environmental Research. 133, 45-48 (2018).
- Mazzolai, B., Margheri, L., Dario, P., Laschi, C. Measurements of octopus arm elongation: Evidence of differences by body size and gender. Journal of Experimental Marine Biology and Ecology. 447, 160-164 (2013).
- McMahan, W., et al. . Proceedings 2006 IEEE International Conference on Robotics and Automation, 2006. , 2336-2341 (2006).
- Meisel, D. V., Kuba, M., Byrne, R. A., Mather, J. The effect of predatory presence on the temporal organization of activity in Octopus vulgaris. Journal of Experimental Marine Biology and Ecology. 447, 75-79 (2013).
- Nesher, N., Levy, G., Grasso, F. W., Hochner, B. Self-recognition mechanism between skin and suckers prevents octopus arms from interfering with each other. Current Biology. 24 (11), 1271-1275 (2014).
- Wells, M. J. . Octopus : Physiology and behaviour of an advanced invertebrate. , (1978).
- Young, J. Z. . The anatomy of the nervous system of Octopus vulgaris. , (1971).
- Zullo, L., Sumbre, G., Agnisola, C., Flash, T., Hochner, B. Nonsomatotopic organization of the higher motor centers in octopus. Current Biology. 19 (19), 1632-1636 (2009).
- Albertin, C. B., et al. The octopus genome and the evolution of cephalopod neural and morphological novelties. Nature. 524 (7564), 220-224 (2015).
- Albertin, C. B., Simakov, O. Cephalopod Biology: At the intersection between genomic and organismal novelties. Annual Review if Animal Biosciences. 8, 71-90 (2020).
- Baik, S., et al. A wet-tolerant adhesive patch inspired by protuberances in suction cups of octopi. Nature. 546 (7658), 396-400 (2017).
- Pikul, J. H., et al. Stretchable surfaces with programmable 3D texture morphing for synthetic camouflaging skins. Science. 358 (6360), 210 (2017).
- Wehner, M., et al. An integrated design and fabrication strategy for entirely soft, autonomous robots. Nature. 536 (7617), 451-455 (2016).
- McMahan, W., et al. Field trials and testing of the OctArm continuum manipulator. Proceedings 2006 IEEE International Conference on Robotics and Automation, 2006. ICRA. , 2336-2341 (2006).
- Hochner, B., Brown, E. R., Langella, M., Shomrat, T., Fiorito, G. A learning and memory area in the octopus brain manifests a vertebrate-like long-term potentiation. Journal of Neurophysiology. 90 (5), 3547-3554 (2003).
- Tapia-Vasquez, A. E., et al. Proteomic identification and physicochemical characterisation of paramyosin and collagen from octopus (Octopus vulgaris) and jumbo squid (Dosidicus gigas). International Journal of Food Science & Technology. 55 (10), 3246-3253 (2020).
- Kim, B. -. M., et al. The genome of common long-arm octopus Octopus minor. GigaScience. 7 (11), (2018).
- Zarrella, I., et al. The survey and reference assisted assembly of the Octopus vulgaris genome. Scientific data. 6 (1), 13 (2019).
- Forsythe, J. W., Hanlon, R. T. Effect of temperature on laboratory growth, reproduction and life span of Octopus bimaculoides. Marine Biology. 98 (3), 369-379 (1988).
- Stoskopf, M. K., Oppenheim, B. S. Anatomic features of Octopus bimaculoides and Octopus digueti. Journal of Zoo and Wildlife Medicine. 27 (1), 1-18 (1996).
- Ramos, J. E., et al. Body size, growth and life span: implications for the polewards range shift of Octopus tetricus in south-eastern Australia. PLoS One. 9 (8), 103480 (2014).
- Hanlon, R. T., Forsythe, J. W. Advances in the laboratory culture of octopuses for biomedical research. Lab Animal Science. 35 (1), 33-40 (1985).
- Moltschaniwskyj, N. A., Carter, C. G. Protein synthesis, degradation, and retention: mechanisms of indeterminate growth in cephalopods. Physiological and Biochemical Zoology. 83 (6), 997-1008 (2010).
- Fiorito, G., et al. Guidelines for the care and welfare of Cephalopods in Research -A consensus based on an initiative by CephRes, FELASA and the Boyd Group. Lab Animal. 49, 1-90 (2015).
- Valverde, J. C., Garcia, B. G. Suitable dissolved oxygen levels for common octopus (Octopus vulgaris cuvier, 1797) at different weights and temperatures: analysis of respiratory behaviour. Aquaculture. 244 (1-4), 303-314 (2005).
- Cardeilhac, P. T., Whitaker, B. R. Copper Treatments: Uses and Precautions. Veterinary Clinics of North America: Small Animal Practice. 18 (2), 435-448 (1988).
- Hodson, P. V., Borgman, U., Shear, H. Toxicity of copper to aquatic biota. Copper in the Environment. (2), 307-372 (1979).
- Poole, B. M. Techniques for the culture of ghost shrimp (palaemonetes pugio). Environmental Toxicology and Chemistry. 7 (12), 989-995 (1988).
- Burggren, W. W. Respiration and circulation in land crabs: novel variations on the marine design. American Zoologist. 32 (3), 417-427 (1992).
- Reitsma, J., Murphy, D. C., Archer, A. F., York, R. H. Nitrogen extraction potential of wild and cultured bivalves harvested from nearshore waters of Cape Cod, USA. Marine Pollution Bulletin. 116 (1), 175-181 (2017).
- Messenger, J. B. Cephalopod chromatophores: neurobiology and natural history. Biological Reviews. 76 (4), 473-528 (2001).
- Morgan Holst, M. M., Miller-Morgan, T. The Use of a species-specific health and welfare assessment tool for the giant pacific octopus, enteroctopus dofleini. Journal of Applied Animal Welfare Science. 24 (3), 272-291 (2021).
- Rosas, C., et al. Energy balance of Octopus maya fed crab or an artificial diet. Marine Biology. 152 (2), 371-381 (2007).
- Anderson, R. C., Wood, J. B., Byrne, R. A. Octopus Senescence: The Beginning of the end. Journal of Applied Animal Welfare Science. 5 (4), 275-283 (2002).
- Butler-Struben, H. M., Brophy, S. M., Johnson, N. A., Crook, R. J. In vivo recording of neural and behavioral correlates of anesthesia induction, reversal, and euthanasia in cephalopod molluscs. Frontiers in Physiology. 9, 109 (2018).
- Jiang, X., et al. Octopus visual system: A functional MRI model for detecting neuronal electric currents without a blood-oxygen-level-dependent confound. Magnetic Resonance in Medicine. 72 (5), 1311-1319 (2014).
- Hennig, J., Nauerth, A., Friedburg, H. RARE imaging: a fast imaging method for clinical MR. Magnetic Resonance in Medicine. 3 (6), 823-833 (1986).
- Brant-Zawadzki, M., Gillan, G. D., Nitz, W. R. MP RAGE: a three-dimensional, T1-weighted, gradient-echo sequence--initial experience in the brain. Radiology. 182 (3), 769-775 (1992).
- Bertapelle, C., Polese, G., Di Cosmo, A. Enriched environment increases PCNA and PARP1 Levels in Octopus vulgaris central nervous system: first evidence of adult neurogenesis in Lophotrochozoa. Journal of Experimental Zoology Part B: Molecular and Developmental Evolution. 328 (4), 347-359 (2017).
- Maselli, V., Polese, G., Soudy, A. -. S. A., Buglione, M., Cosmo, A. D. Cognitive stimulation induces differential gene expression in Octopus vulgaris: The key role of protocadherins. Biology. 9, (2020).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneEsplora altri articoli
This article has been published
Video Coming Soon