È necessario avere un abbonamento a JoVE per visualizzare questo. Accedi o inizia la tua prova gratuita.
Method Article
Sviluppo di una striscia immunocromatografica a flusso laterale per la rilevazione rapida e quantitativa di composti di piccole molecole
* Questi autori hanno contribuito in egual misura
In questo articolo
Abstract
Le strisce immunocromatografiche a flusso laterale a membrana (ICI) sono strumenti utili per l'autodiagnosi a basso costo e sono state applicate in modo efficiente alla rilevazione di tossine, indici fisiologici e biomarcatori clinici. In questo protocollo, forniamo una descrizione dettagliata dei passaggi per sviluppare un test immunologico a flusso laterale rapido, sensibile e quantitativo (utilizzando AuNP come marcatore e mAbs come sonda). La procedura descrive la preparazione e la caratterizzazione dell'oro colloidale, la sintesi del coniugato AuNP-mAb, l'assemblaggio della striscia immunocromatografica e l'indagine metodologica del saggio. I risultati hanno mostrato che le strisce finali possono essere ulteriormente utilizzate per l'autodiagnosi rapida e conveniente di una piccola molecola, che può fornire uno strumento alternativo nell'analisi rapida e precisa degli indici fisiologici e biologici.
Introduzione
Le strisce immunocromatografiche a flusso laterale (ICI) a membrana sono strumenti utili per il rilevamento rapido e a basso costo. La membrana di nitrocellulosa come vettore e l'oro colloidale come marcatori dei reagenti diagnostici rapidi per cromatografia immunitaria sono il metodo POCT (point of care testing) più comunemente usato e l'ambito di prova del progetto è più ampio. Dalla loro applicazione originale nel monitoraggio durante la gravidanza, il loro uso è stato esteso per monitorare lo stato di coagulazione del sangue1,2, danno miocardico3, medicina veterinaria4, residui di pesticidi5, malattie infettive6 e concentrazioni di farmaci. È possibile valutare più tipi di campioni, tra cui urina, saliva, sangue intero, siero e altri fluidi corporei7,8,9.
Negli ultimi anni, sono stati sviluppati numerosi nuovi saggi per rilevare biomarcatori nella diagnosi di disturbi, tra cui HPLC, UPLC, LC-MS ed ELISA, che sono sensibili e accurati, credibili e specifici. Tuttavia, questi metodi richiedono strumentazione sofisticata, pre-elaborazione complessa e trattamenti dispendiosi in termini di tempo9. Quindi, lo sviluppo di una strategia diagnostica point-of-care più rapida e conveniente per il rilevamento autonomo e in tempo reale dei composti attivi medicinali è urgente10,11.
La popolarità degli I BIOS, soprattutto per i test comuni, è guidata dalla loro facilità d'uso, in quanto non richiedono professionisti o elaborate configurazioni strumentali12. In altre parole, le persone che non hanno una formazione speciale possono utilizzare strisce o auto-test13. I risultati del test possono essere ottenuti in 5 minuti, il che significa che può essere utilizzato per le ispezioni in loco14. Inoltre, secondo i nostri calcoli, il costo delle strisce potrebbe essere inferiore a 1 RMB15, il che significa che i test sono economici per promuovere16. Quindi, l'ICS è un dispositivo usa e getta relativamente accurato, semplice ed economico. Gli ISI basati sull'oro colloidale17,18 sono applicati anche nel rilevamento rapido covid-19.
Il principio di ICS può essere suddiviso in ICS sandwich e ICS competitivo. La Figura 1A è un diagramma schematico dell'ICS sandwich, che viene utilizzato principalmente per rilevare sostanze macromolecolari come le proteine, compresi i marcatori tumorali, i fattori infiammatori e la gonadotropina corionica umana (HCG, antigene della gravidanza precoce). In questo metodo, vengono utilizzati anticorpi accoppiati mirati a diversi epitopi dell'antigene e l'anticorpo di cattura viene essiccato sulla membrana NC come linea di prova. L'anticorpo etichettato viene essiccato sul tampone coniugato e l'anticorpo secondario viene utilizzato come linea di controllo.
La Figura 1B è un diagramma schematico dell'ICS competitivo, che viene utilizzato principalmente per rilevare sostanze a piccole molecole (MWCO < 2000 Da). L'antigene di rivestimento è fissato sulla membrana NC come linea di prova e l'anticorpo etichettato viene essiccato sul tampone coniugato. Durante il rilevamento, il campione e l'anticorpo marcato fluiscono attraverso la linea di rilevamento sotto azione capillare e l'antigene rivestito lega in modo competitivo l'antigene libero nel campione e sviluppa un colore rosso sulla linea di rilevamento.
Recentemente, abbiamo descritto la procedura di generazione di anticorpi monoclonali contro prodotti naturali19. In questo lavoro, abbiamo sviluppato un nuovo test immunologico a flusso laterale basato sull'anti-SSD mA20 preparato per un rilevamento rapido e in loco. I risultati indicano che il test immunocromatografico è uno strumento indispensabile e conveniente per rilevare composti naturali derivati dal prodotto.
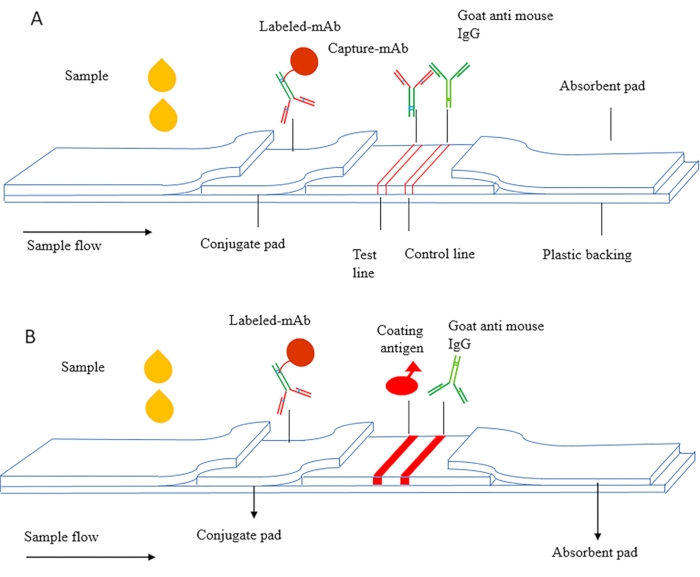
Figura 1 Schema schematico del saggio immunocromatografico (A) Strisce reattive immunocromatografiche sandwich. (B) Strisce reattive immunocromatografiche competitive indirette. Questa cifra è stata modificata da Zhang et al., 201821. Fare clic qui per visualizzare una versione più grande di questa figura.
Protocollo
Tutte le procedure eseguite in questo studio sono state approvate dal Comitato di revisione etica presso l'Università di Medicina Cinese di Pechino (numero di approvazione 2017BZYYL00120).
1. Preparazione e caratterizzazione dell'oro colloidale
NOTA: Per la sintesi dell'oro colloidale, poiché l'oro colloidale è facilmente adsorbito sulla parete interna del recipiente ed è soggetto a precipitazioni da parte di impurità, il recipiente per la sintesi e lo stoccaggio dell'oro colloidale deve essere accuratamente pulito e imbevuto di acido (40 ml di acqua distillata, 360 ml di acido solforico concentrato, 20 g di dicromato di potassio) o sottoposto a trattamento di passivazione superficiale. Un metodo di riduzione dell'acido citrico è stato utilizzato per sintetizzare l'oro colloidale.
- Accendere l'agitatore magnetico e posizionare il pallone (250 ml) sul mixer.
- Preparare rispettivamente la soluzione acida di cloruro d'oro al 4% e la soluzione di citrato di sodio all'1%.
- Aggiungere 120 ml di acqua distillata in un matraccio a fondo tondo e riscaldarlo fino all'ebollizione su un agitatore magnetico termostatico.
- Continuare a bollire e aggiungere rapidamente 0,5 ml di acido cloroaurico al 4% e 5 ml di citrato di sodio all'1%.
- Osservare il colore della soluzione. La soluzione di acido cloroaurico giallo pallido diventa rosso vino in pochi minuti.
- Continuare a riscaldare per 10 minuti, fino a quando la soluzione cambia da incolore a rosso vino trasparente.
- Spegnere l'alimentazione del miscelatore magnetico termostatico, raffreddare a temperatura ambiente e spostare la miscela in una bottiglia pulita. Conservare a 4 °C.
- Determinare le dimensioni e la morfologia degli AuNP mediante spettroscopia ultravioletta e imaging TEM.
NOTA: Diverse dimensioni di particelle di oro colloidale per varie applicazioni possono essere ottenute modificando la proporzione di citrato sodico e acido cloroaurico.
2. Sintesi del coniugato AuNPs-mAb
NOTA: Poiché gli anticorpi si legano all'oro colloidale per adsorbimento elettrostatico, le cariche sulla superficie delle proteine e dell'oro colloidale influenzano direttamente l'intensità di legame; pertanto, il valore del pH tampone è un fattore importante che influenza la stabilità del coniugato anticorpo-oro colloidale. SSD e anti-SSD mAbs sono usati come esempi in questo protocollo.
- Valutazione del pH di accoppiamento
- Aggiungere 100 μL di soluzione di NaCl (10% m/v) in otto tubi.
- Regolare le soluzioni AuNP a pH 5, 6, 7, 8, 9, 10, 11 e 12 con 0,1 M K2CO3.
- Aggiungere 100 μL di soluzione di oro colloidale (pH regolato 5-12) a otto tubi contenenti NaCl.
- Lasciare riposare le soluzioni per diversi minuti dopo la miscelazione. Osservare il cambiamento di colore di ogni soluzione di tubo e registrare il tubo che rimane rosso.
- Scegli il valore di pH con la minima aggiunta di K2CO 3 e il colore dellasoluzione stabile come valore di pH ottimale per la preparazione dei coniugati AuNP-mAb.
NOTA: non utilizzare un pHmetro perché la sonda potrebbe essere distrutta da AuNP.
- Valutazione della quantità di anticorpi
- Aggiungere 100 μL di soluzione di NaCl (10% m/v) a otto tubi.
- Aggiungere 100 μL di soluzione di oro colloidale con pH ottimale a ciascun tubo.
- Aggiungere le soluzioni di anticorpi monoclonali (concentrazione proteica 0,1 mg/mL-3,2 mg/mL) alle otto provette sopra menzionate.
- Lasciare riposare le soluzioni per diversi minuti dopo la miscelazione. Osservare il cambiamento di colore di ogni soluzione di tubo e registrare il tubo che rimane rosso.
- Scegli la quantità di anticorpi con la più bassa concentrazione di mAb e il colore stabile della soluzione come quantità ottimale di mAb per preparare i coniugati AuNP-mAb.
- Preparare il tampone di risuspensione: aggiungere 1 M Tris-HCl (pH 8,8), 1% (p/v) BSA, 0,5% (v/v) Tween 20 e 1% (v/v) PEG 20000 e frullare bene.
- Sintesi del coniugato AuNP-mAb
- Prendere 10 mL di soluzione di oro colloidale e utilizzare 0,1 M K2CO3 per regolare la soluzione al valore di pH ottimale.
- Aggiungere lentamente SSD mAbs a concentrazioni appropriate e agitare a temperatura ambiente per 30 minuti.
- Centrifugare la miscela a 83 x g (1.000 giri/min) per 10 minuti a 4 °C. Rimuovere il precipitato, che contiene impurità o oro colloidale precipitato.
- Centrifugare la miscela a 8.330 x g (10.000 giri/min) per 30 minuti a 4 °C. Scartare il surnatante e il precipitato è il coniugato colloidale oro-mAb.
- Aggiungere il buffer di risuspensione per dissociare la precipitazione.
3. Assemblaggio della striscia
NOTA: per i test immunologici a flusso successivo, la selezione e il pretrattamento del materiale di membrana influenzeranno direttamente il test, che dovrebbe essere studiato. La striscia immunocromatografica è costituita da un tampone campione, un tampone coniugato, una membrana di nitrocellulosa (NC), un tampone assorbente e un cartone in PVC (Figura 1). Il materiale della membrana deve essere controllato e valutato mediante stereomicroscopia per eliminare la disomogeneità.
- Incollare la membrana NC su un cartone in PVC a 2 cm di distanza dal bordo dell'estremità di aspirazione della scheda.
- Aggiungere SSD-BSA (2 mg/mL) a goccia alla membrana NC (2 cm a parte il bordo superiore) come linea di prova (1 mm di larghezza) e aggiungere IgG anti-topo di capra (1,5 mg/mL) a goccia sulla membrana NC (2 cm a parte il bordo inferiore) come linea di controllo (1 mm di larghezza). Controllare la quantità di proteine aggiunte.
- Fissare il tampone assorbente al foglio di PVC sopra la membrana NC e sovrapporlo alla membrana NC di 2 mm.
- Immergere la membrana in fibra di vetro nella soluzione coniugata AuNPs-mAb. Asciugare la membrana bagnata in un incubatore a 37 °C.
- Tagliare la membrana in fibra di vetro a 5 cm di lunghezza e 2 cm di larghezza e utilizzarla come cuscinetto coniugato.
- Incollare il tampone coniugato pretrattato sotto la membrana NC. La lunghezza di sovrapposizione con la membrana NC dovrebbe essere di 0,1 cm.
NOTA: La membrana in fibra di vetro ha una forte capacità di legare e rilasciare proteine. - Tagliare la membrana fusion 3 a 1,8 cm di lunghezza e 3,5 cm di larghezza e utilizzarla come tampone di campionamento.
- Incollare il tampone campione sulla scheda in PVC e sovrapporlo al tampone coniugato di 2 mm.
- Tagliare il cartone assemblato in strisce larghe 3,5 mm utilizzando una macchina da taglio e compattarlo utilizzando un sistema di laminazione batch.
- Infine, posizionare le strisce reattive nel guscio, sigillarle in un sacchetto di alluminio contenente essiccante e conservarle al lontano dalla luce. Gli IS sono ora assemblati.
NOTA: Quanto sopra è la procedura di laboratorio. Nella produzione, le attrezzature per la spruzzatura dell'oro e gli strumenti a membrana incrociata vengono utilizzati per spruzzare l'oro e realizzare le linee T e C.
4. Rilevazione quantitativa
- Rilasciare 50 μL di soluzione campione sul foro del campione per osservare il processo di cromatografia.
NOTA: A seguito dell'azione capillare guidata dal tampone assorbente, la soluzione campione migra verso l'altra estremità della striscia. Quando la soluzione campione raggiunge il pad coniugato, l'SSD (antigene) nel campione reagisce con gli AuNP-mAb precaricati sul pad. Quando la soluzione migra e raggiunge la T-line, l'AuNPs-mAb senza SSD può essere catturato selettivamente da SSD-BSA (coniugato proteico antigene-vettore), mostrandosi come un colore rosso sulla T-line. Quindi, la soluzione migra verso la linea C, dove gli AuNP-mAb vengono catturati dalle IgG anti-topo di capra nella regione, mostrandosi così come un colore rosso sulla linea C. - Analizza le strisce con un lettore di strisce portatile. La macchina può fornire il rapporto tra la linea di prova e la linea di controllo (T/C).
- Valutare la specificità, la sensibilità, la ripetibilità e la stabilità del test ICS.
NOTA: in caso di rilevamento qualitativo, una linea rossa indica un risultato positivo (linea di controllo). Due linee rosse indicano un risultato negativo (linee di test e controllo). Se la linea di controllo non è presente, il test è considerato non valido.
Risultati
Caratterizzazione dell'oro colloidale
Le soluzioni di oro colloidale preparate erano rosso claret. Le analisi TEM sono state utilizzate per determinare la morfologia e la forma degli AuNP (Figura 2A-D). La Figura 2A e la Figura 2B rivelano che le particelle sono di forma poliedrica e uniformemente distribuite. Il diametro medio degli AuNP è risultato essere di circa 14 nm (F...
Discussione
In questo lavoro, presentiamo un protocollo per la preparazione di mAbs contro piccole molecole derivate da prodotti naturali. I passaggi essenziali e le questioni che richiedono attenzione nella procedura sono stati delineati e abbiamo dimostrato l'utilità di questo protocollo utilizzando l'SSD a piccola molecola come esempio. Spettri di esempio, immagini TEM, risultati quantitativi e indagini metodologiche sono mostrati in dati rappresentativi. Quindi, abbiamo dimostrato che la produzione di oro colloidale, la coniuga...
Divulgazioni
Gli autori non hanno nulla da rivelare.
Riconoscimenti
Questo lavoro è stato sostenuto dai Fondi speciali per i fondi di ricerca fondamentale di istituti di istruzione superiore affiliati ai dipartimenti centrali. Apprezziamo il supporto del Classical Prescription Basic Research Team dell'Università di Medicina Cinese di Pechino.
Materiali
| Name | Company | Catalog Number | Comments |
| Chloroauric acid solution (HAuCl4) | Tianjin Fu Chen Chemical Reagents Factory | JY-SJ102 | |
| bovine serum albumin | AMRESCO | 332 | |
| centrifuge tube 15 mL | Corning | 430645 | |
| centrifuge tube 50 mL | Corning | 430828 | |
| ELISA plates, 96 well | NUNC | 655101 | |
| Filter paper | Sinopharm | H5072 | |
| Glass fibre membranes | Jieyi | XQ-Y6 | |
| goat-anti-mouse IgG antibody | applygen | C1308 | |
| Nitrocellulose membranes | Millipore | millipore 180 | |
| ovalbumin | Beijing BIODEE | 5008-25g | |
| PEG20000 | Sigma Aldrich | RNBC6325 | |
| Pipette 10mL | COSTAR | 4488 | |
| Pipette 25mL | FALCON | 357525 | |
| semi-rigid PVC sheets | Jieyi | JY-C104 | |
| Sodium citrate | Beijing Chemical Works | C1034 | |
| sodium periodate | Sinopharm Chemical | BW-G0008 | |
| Sulfo-GMBS | Perbio Science Germany | 22324 | |
| TipOne Tips 1,000 µL | Starlab | S1111-2021 | |
| Tris-HCl | Solarbio | 77-86-1 | |
| TWEEN 20 | Solarbio | 9005-64-5 |
Riferimenti
- Huang, X., et al. Membrane-based lateral flow immunochromatographic strip with nanoparticles as reporters for detection: A review. Biosensors and Bioelectronics. 75, 166-180 (2016).
- Chang, H. -. F., Wang, J. -. Q., Wang, B., Deng, A. -. P. An immune chromatographic assay for rapid and simultaneous detection of levonorgestrel and methylprednisolone in water samples. Chinese Chemical Letters. 24 (10), 937-940 (2013).
- Lai, J. J., Stayton, P. S. Improving lateral-flow immunoassay (LFIA) diagnostics via biomarker enrichment for mHealth. Methods in Molecular Biology. 1256, 71-84 (2015).
- Zhang, M. Z., et al. Development of a colloidal gold-based lateral-flow immunoassay for the rapid simultaneous detection of clenbuterol and ractopamine in swine urine. Analytical & Bioanalytical Chemistry. 395 (8), 2591-2599 (2009).
- Kranthi, K. R., et al. Development of a colloidal-gold based lateral-flow immunoassay kit for 'quality-control' assessment of pyrethroid and endosulfan formulations in a novel single strip format. Crop Protection. 28 (5), 428-434 (2009).
- Qian, K., et al. Development and evaluation of an immunochromatographic strip for rapid detection of capsid protein antigen p27 of avian leukosis virus. Journal of Virological Methods. (221), 115-118 (2015).
- Guo, H., et al. Lateral flow immunoassay devices for testing saliva and other liquid samples and methods of use of same. US Patent. , (2003).
- Miočević, O., et al. Quantitative Lateral Flow Assays for Salivary Biomarker Assessment: A Review. Frontiers in Public Health. 5, 1-13 (2017).
- Lisa, M., et al. Gold nanoparticles based dipstick immunoassay for the rapid detection of dichlorodiphenyltrichloroethane: an organochlorine pesticide. Biosensors and Bioelectronics. 25 (1), 224-227 (2009).
- Zhang, Z., et al. Monoclonal Antibody-Europium Conjugate-Based Lateral Flow Time-Resolved Fluoroimmunoassay for Quantitative Determination of T-2 Toxin in Cereals and Feed. Analytical Methods. 7 (6), 2822-2829 (2015).
- Shen, H., et al. Facile synthesis of high-quality CuInZnxS2+x core/shell nanocrystals and their application for detection of C-reactive protein. Journal of Materials Chemistry. 22 (35), 18623-18630 (2012).
- Xiang, T., et al. A novel double antibody sandwich-lateral flow immunoassay for the rapid and simple detection of hepatitis C virus. International Journal of Molecular Medicine. 30 (5), 1041-1047 (2012).
- Yang, Q., et al. Quantum dot-based immunochromatography test strip for rapid, quantitative and sensitive detection of alpha fetoprotein. Biosensors & Bioelectronics. 30 (1), 145 (2011).
- Song, L. W., et al. Rapid fluorescent lateral-flow immunoassay for hepatitis B virus genotyping. Analytical Chemistry. 87, 5173-5180 (2015).
- Zhang, Y., et al. Quantum dot-based lateral-flow immunoassay for rapid detection of rhein using specific egg yolk antibodies. Artificial Cells, Nanomedicine, and Biotechnology. 1, (2017).
- Qu, H., et al. Rapid Lateral-Flow Immunoassay for the Quantum Dot-based Detection of GsRerarin. Biosensors and Bioelectronics. 81, 358-362 (2016).
- Li, Z., et al. Development and Clinical Application of a Rapid IgM-IgG Combined Antibody Test for SARS-CoV-2 Infection Diagnosis. Journal of Medical Virology. 92 (9), (2020).
- Xiaomei, L., Jing, W., Ya, Z. The clinical application value analysis of the 2019-coronary virus disease was analyzed by the whole blood Sars-COV 2 specific antibody detection. Natural Science Edition. 42, (2020).
- Zhang, Y., et al. Generation of Monoclonal Antibodies Against Natural Products. Journal of Visualized Experiments. , e57116 (2019).
- Sai, J., et al. Development of an Enzyme-Linked Immunosorbent Assay and Immunoaffinity Column Chromatography for Saikosaponin d Using an Anti-Saikosaponin d Monoclonal Antibody. Planta Medica. 82, 432-439 (2016).
- Yue, Z., et al. A Highly Sensitive Immunochromatographic Strip Test for Rapid and Quantitative Detection of Saikosaponin d. Molecules. 23 (2), 338 (2018).
- Qu, H., et al. Rapid Lateral-Flow Immunoassay for the Quantum Dot-based Detection of Puerarin. Biosensors and Bioelectronics. 81, 358-362 (2016).
- Zhang, Y., et al. Quantum dot-based lateral-flow immunoassay for rapid detection of rhein using specific egg yolk antibodies. Artificial Cells, Nanomedicine, and Biotechnology. 1, (2017).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneThis article has been published
Video Coming Soon