Se requiere una suscripción a JoVE para ver este contenido. Inicie sesión o comience su prueba gratuita.
Method Article
Aislamiento y selección de hongos entomopatógenos a partir de muestras de suelo y evaluación de la virulencia fúngica contra plagas de insectos
En este artículo
Resumen
Aquí presentamos un protocolo basado en el sistema de cebo del gusano de la harina (Tenebrio molitor) que se utilizó para aislar y seleccionar hongos entomopatógenos (EPF) a partir de muestras de suelo. Se utiliza una fórmula efectiva de número de conidios (ECN) para seleccionar EPF altamente tolerante al estrés en función de las características fisiológicas para el control microbiano de plagas en el campo.
Resumen
Los hongos entomopatógenos (EPF) son uno de los agentes de control microbiano para el manejo integrado de plagas. Para controlar las plagas locales o invasoras, es importante aislar y seleccionar el EPF autóctono. Por lo tanto, el método de cebo del suelo combinado con el sistema de cebo de insectos (gusano de la harina, Tenebrio molitor) se utilizó en este estudio con algunas modificaciones. Los EPF aislados fueron sometidos a la prueba de virulencia contra la plaga agrícola Spodoptera litura. Además, las cepas potenciales de EPF fueron sometidas a identificaciones morfológicas y moleculares. Además, se realizó el ensayo de producción de conidios y termotolerancia para las cepas EPF prometedoras y se comparó; estos datos se sustituyeron además por la fórmula del número de conidios efectivos (ECN) para la clasificación de laboratorio. El sistema de gusanos de la harina de cebo del suelo y la fórmula ECN se pueden mejorar reemplazando las especies de insectos e integrando más factores de estrés para la evaluación de la comercialización y la aplicación en el campo. Este protocolo proporciona un enfoque rápido y eficiente para la selección de EPF y mejorará la investigación sobre agentes de control biológico.
Introducción
Actualmente, los hongos entomopatógenos (EPF) son ampliamente utilizados en el control microbiano de plagas agrícolas, forestales y hortícolas. Las ventajas de EPF son sus amplias gamas de huéspedes, buena adaptabilidad ambiental, naturaleza ecológica y que se puede utilizar con otros productos químicos para mostrar el efecto sinérgico para el manejo integrado de plagas1,2. Para la aplicación como agente de control de plagas, es necesario aislar una gran cantidad de EPF de insectos enfermos o del entorno natural.
El muestreo de estos organismos de sus huéspedes ayuda a comprender la distribución geográfica y la tasa de prevalencia de EPF en huéspedes naturales3,4,5. Sin embargo, la colección de insectos infectados por hongos suele estar limitada por factores ambientales y poblaciones de insectos en el campo4. Teniendo en cuenta que los insectos huéspedes morirán después de la infección por EPF y luego caerán en el suelo, el aislamiento de EPF a partir de muestras de suelo podría ser un recurso estable3,6. Por ejemplo, se sabe que los saprófitos usan el huésped muerto como su recurso para el crecimiento. Los sistemas de cebo de suelo y medio selectivo se han utilizado ampliamente para detectar y aislar EPF del suelo3,4,7,8,9,10.
En el método del medio selectivo, la solución de suelo diluida se coloca en un medio que contiene antibióticos de amplio espectro (por ejemplo, cloranfenicol, tetraciclina o estreptomicina) para inhibir el crecimiento de bacterias2,3,9,11. Sin embargo, se ha informado que este método puede distorsionar la diversidad y densidad de la cepa y puede causar una sobreestimación o subestimación de muchas comunidades microbianas6. Además, las cepas aisladas son menos patógenas y compiten con los saprófitos durante el aislamiento. Es difícil aislar el EPF de la solución de suelo diluido3. En lugar de utilizar un medio selectivo, el método de cebo en el suelo aísla el EPF de los insectos muertos infectados, que puede almacenarse durante 2-3 semanas, proporcionando así un método de separación EPF más eficiente y estándar3,4,7,6. Debido a que el método es fácil de operar, se puede aislar una variedad de cepas patógenas a un bajo costo4. Por lo tanto, es ampliamente utilizado por muchos investigadores.
Al comparar los diferentes tipos de sistemas de cebo de insectos, Beauveria bassiana y Metarhizium anisopliae son las especies de EPF más comunes que se encuentran en insectos pertenecientes a Hemiptera, Lepidoptera, Blattella y Coleoptera6,12,13,14. Entre estos cebos de insectos, Galleria mellonella (orden Lepidoptera) y Tenebrio molitor (orden Coleoptera) muestran mayores tasas de recuperación de Beauveria y Metarhizium spp., en comparación con otros insectos. Por lo tanto, G. mellonella y T. molitor se utilizan comúnmente para el cebo de insectos. A lo largo de los años, el Departamento de Agricultura de los Estados Unidos (USDA) ha establecido una Biblioteca EPF (Agricultural Research Service Collection of EPF cultures, ARSEF) que contiene una amplia variedad de especies, incluidas 4081 especies de Beauveria spp., 18 especies de Clonostachys spp., 878 especies de Cordyceps spp., 2473 especies de Metarhizium spp., 226 especies de Purpureocillium spp., y 13 especies de Pochonia spp. entre otras15. Otra Biblioteca EPF fue construida por el Laboratorio de Investigación de Entomología (ERL) de la Universidad de Vermont en los Estados Unidos durante aproximadamente 30 años. Incluye 1345 cepas de EPF de estados Unidos, Europa, Asia, África y Oriente Medio16.
Para controlar las plagas locales o de invasión en Taiwán, se requiere el aislamiento y la selección de EPF autóctonos. Por lo tanto, en este protocolo, hemos modificado y descrito el procedimiento del método de cebo del suelo y lo hemos combinado con el sistema de cebo de insectos (gusano de la harina, Tenebrio molitor)17. Sobre la base de este protocolo, se estableció una biblioteca EPF. Se realizaron dos rondas de cribado (cuantificación de la inoculación) para los aislados preliminares de EPF. Los aislados de EPF mostraron patogenicidad a los insectos. Las cepas potenciales fueron sometidas a identificaciones morfológicas y moleculares y analizadas posteriormente por el ensayo de termotolerancia y producción conidial. Además, también se propuso un concepto de número de conidios efectivo (ECN). Utilizando la fórmula ECN y el análisis de componentes principales (PCA), las cepas potenciales se analizaron bajo presión ambiental simulada para completar el proceso de establecimiento y detección de la biblioteca EPF. Posteriormente, se probó la patogenicidad de cepas prometedoras de EPF para la plaga objetivo (por ejemplo, Spodoptera litura). El protocolo actual integra datos de termotolerancia y producción conidial en la fórmula ECN y el análisis PCA, que se puede utilizar como un sistema de clasificación estándar para la investigación relacionada con EPF.
Protocolo
NOTA: Todo el diagrama de flujo se muestra en la Figura 1.
1. Aislamiento y selección de posibles hongos entomopatógenos (EPF)
- Recoger la muestra de suelo
- Retire 1 cm del suelo de la superficie y luego recoja el suelo dentro de la profundidad de 5-10 cm usando una pala de cada sitio de muestreo.
NOTA: Los sitios de muestreo serían una montaña, un bosque o áreas escasamente pobladas para evitar la contaminación de cepas de EPF rociadas artificialmente. Asegúrese de que las áreas para la recolección de muestras de suelo estén cubiertas con maleza en la superficie. El suelo seco o húmedo no es adecuado para este experimento. - Registre los detalles de cada sitio de muestreo, incluido el GPS, la elevación, el tipo de campo, la temperatura anual, la precipitación anual, el tiempo de recolección (temporada), el tipo de suelo y el valor del pH.
- Recoger 100 g de la muestra de suelo en una bolsa de plástico y mantenerla a temperatura ambiente si se somete al protocolo de aislamiento de hongos en el laboratorio en un plazo de 3 h.
NOTA: Si la muestra no se puede utilizar en un plazo de 3 h, almacene el suelo a temperatura ambiente en condiciones de oscuridad. Si el experimento no se realiza inmediatamente, la muestra de suelo puede almacenarse a 4 °C durante 1 semana hasta el inicio del protocolo18,19.
- Retire 1 cm del suelo de la superficie y luego recoja el suelo dentro de la profundidad de 5-10 cm usando una pala de cada sitio de muestreo.
- Cebar y aislar el EPF con gusano de la harina (Tenebrio molitor)
- Coloque 100 g de la muestra de suelo en un vaso de plástico (diámetro de la tapa = 8,5 cm, altura = 12,5 cm) y luego coloque 5 gusanos de la harina en la superficie del suelo a temperatura ambiente en la oscuridad durante 2 semanas.
NOTA: También se pueden utilizar otros tipos de recipientes de plástico. Si los suelos están demasiado secos (agrietados o arenosos), rocíe ddH2O esterilizado por pulverización (aproximadamente 5-10 ml) en los suelos. La longitud corporal c.a. 2,5 cm (14º instar) de larvas de T. molitor ayuda en las pantallas aisladas de hongos20. - Observar y registrar las larvas diariamente para la mortalidad y la micosis; mantenga las larvas muertas en la taza hasta 2 semanas para el aislamiento de hongos.
NOTA: La espora de conidios fúngicos en las muestras de suelo se unirá a las larvas del gusano de la harina durante el proceso anterior. La micosis fúngica se observará a medida que las hifas crecen desde la membrana intersegmental, y luego todo el cuerpo se cubrirá con el micelio. La esporulación comenzará después de 7 días y el color de la infección por hongos cambiará al color de la masa de conidios. - Transfiera los insectos muertos a un banco limpio y use un palillo estéril para recolectar los conidios. Rayarlos en una placa de medio de agar dextrosa Sabouraud de un cuarto de fuerza (1/4 SDA) (55 mm) en el laboratorio21. Incubar la placa de cultivo a 25 °C durante 7 días para obtener el cultivo primario de hongos.
NOTA: La placa de 1/4 SDA se prepara de la siguiente manera: Mezcle 1.5 g de caldo de dextrosa Sabouraud y 3 g de agar en 200 ml de H2O, y luego esterilice durante 20 min. Alícuota 1/4 SDA en cada placa de Petri de 55 mm antes de la solidificación. Las placas SDA 1/4 solidificadas se almacenan a 4 °C hasta su uso. - Vuelva a rayar cada hongo de cultivo primario en una placa SDA de 55 mm 1/4 en un flujo laminar e incube la placa de cultivo a 25 °C durante 7 días para obtener colonias individuales de hongos.
- Repita este reaislamiento ~ 2-3 veces y observe bajo microscopía de luz para obtener colonias de hongos morfológicos únicos y puros.
NOTA: Aísle todo el EPF usando T. molitor-bait y guárdelo como se describe en la siguiente sección. La separación, preservación, cultivo puro y rayado deben realizarse en un flujo laminar en las secciones posteriores.
- Coloque 100 g de la muestra de suelo en un vaso de plástico (diámetro de la tapa = 8,5 cm, altura = 12,5 cm) y luego coloque 5 gusanos de la harina en la superficie del suelo a temperatura ambiente en la oscuridad durante 2 semanas.
- Almacenar los aislados de EPF
- Corte 3 de los bloques de agar de 5 mm en el borde de cada placa aislada de cultivo de hongos puros con un barrenador de corcho y colóquelo en un tubo de microcentrífuga de 1,5 ml como una réplica.
NOTA: Se recomiendan tres réplicas para cada aislado de hongos para el almacenamiento de las cepas EPF después de la 2ª prueba de virulencia. También se recomienda la identificación molecular si el espacio de almacenamiento es limitado. - Añadir 250 μL de solución de surfactante al 0,03% (Tabla de Materiales) y 250 μL de glicerol al 60% en el tubo de microcentrífuga de 1,5 ml utilizando una micropipeta; luego, vórtice durante 10 s.
- Selle el tubo de microcentrífuga de 1,5 ml con película de parafina y enfríelo previamente en un refrigerador de -20 °C durante 24 h. Luego, transfiera las existencias de hongos preenfriadas a un refrigerador de -80 ° C para la criopreservación.
NOTA: En la sección 1.4 se utilizaron placas de cultivo de hongos extra puros (aparte de las muestras crioconservadas).
- Corte 3 de los bloques de agar de 5 mm en el borde de cada placa aislada de cultivo de hongos puros con un barrenador de corcho y colóquelo en un tubo de microcentrífuga de 1,5 ml como una réplica.
- 1ª prueba de patogenicidad para aislados de hongos
- Coloque cinco larvas de T. molitor directamente sobre la superficie de cada placa de cultivo de hongos puros a 25 °C.
- Observe y registre la micosis y la mortalidad durante 10 días. Seleccione el aislado de hongos para un análisis posterior.
NOTA: Los aislados de hongos que causan una mortalidad del 100% se seleccionan para la 2ª prueba de virulencia para confirmar su virulencia a las larvas de T. molitor . Alternativamente, el investigador puede ajustar los criterios según su propio estudio.
- 2ª prueba de virulencia de aislados fúngicos
NOTA: Sobre la base de la 1ª prueba de patogenicidad, recupere los aislados de hongos seleccionados de -80 °C para la 2ª prueba de virulencia. El propósito de la 2ª prueba de virulencia es cuantificar la patogenicidad de los aislados de hongos seleccionados después de la 1ª ronda de cribado.- Cosechar conidios de cada aislado de hongos por vórtice durante 1 min y contar el número de conidios usando un hemocitómetro.
- Ajuste la suspensión de conidios a una concentración de 1 x 107 conidios/ml en una solución de surfactante al 0,03% (Tabla de materiales).
- Extienda 10 μL de la suspensión fúngica sobre placas SDA de 55 mm 1/4 y crezca durante 7 días a 25 °C en la oscuridad.
- Coloque cinco larvas de T. molitor directamente en la superficie de cada placa de cultivo de hongos puros (c.a. 6 x 107 conidios). Selle las placas con película de parafina e incube a 25 °C en la oscuridad.
- Observe y registre la micosis y la mortalidad durante 10 días.
- Repita la prueba (del paso 1.51 al 1.5.5) por triplicado para cada aislado de hongo.
NOTA: Los aislados de hongos que causan una mortalidad del 100% se seleccionan para la 3ª prueba de virulencia para confirmar su virulencia para atacar la plaga.
- 3ª prueba de virulencia de aislados fúngicos para plaga objetivo (Spodoptera litura como ejemplo)
- Repita los pasos 1.5.2 a 1.5.6 con aislados seleccionados de la 2ª virulencia para probar la virulencia contra la plaga objetivo.
- Calcule el LT50 de cada aislado fúngico22.
NOTA: El LT50 de cada aislado fúngico se calculó a través de modelos lineales generalizados (GLM) utilizando R studio (versión 3.4.1); la distribución de errores cuasibinomiales y una función de enlace de registro se pueden utilizar para tener en cuenta la sobredispersión.
2. Identificación molecular de EPF
- Extracción de ADN genómico fúngico
- Recoja c.a. 1 cm2 EPF de la placa SDA de 7 días y 1/4.
- Extraiga el ADN genómico fúngico utilizando un kit de extracción de ADN genómico fúngico de acuerdo con las instrucciones del fabricante23 (Tabla de Materiales).
- Amplificación por PCR y secuenciación de ADN
- Amplificar la región ITS fúngica mediante PCR de la muestra de ADN21 utilizando la mezcla maestra de PCR (2x), el conjunto de cebadores ITS1F/ITS4R24 (Tabla 1) con el siguiente programa de PCR: 94 °C durante 1 min, y luego 35 ciclos de 94 °C durante 30 s, 55 °C durante 30 s y 72 °C durante 1 min, seguido de una extensión final de 7 min a 72 °C.
NOTA: El conjunto de cebadores ITS1F/ITS4R es para la identificación a nivel de género. - Secuenciar la PCR mediante servicio de secuenciación comercial.
- Utilice la búsqueda NCBI BLAST de hongos similares en la base de datos NCBI y seleccione las especies de tipo fúngico relativas para el análisis filogenético.
NOTA: Las especies de hongos pertenecientes al género metarhizium o Beauveria deben identificarse aún más a nivel de especie con el conjunto de cebadores tef-983F/tef-2218R25 (repita los pasos 2.1.1 a 2.2.3). Para los hongos que no pertenecen a los géneros Metarhizium o Beauveria, se pueden utilizar otros marcadores moleculares para identificar las especies, incluyendo la ADN liasa (APN2), la beta tubulina (BTUB), la subunidad más grande de la ARN polimerasa II (RPB1), la segunda subunidad más grande de la ARN polimerasa II (RPB2) y la porción 3' del factor de elongación de la traducción 1 alfa (TEF)25,26 .
- Amplificar la región ITS fúngica mediante PCR de la muestra de ADN21 utilizando la mezcla maestra de PCR (2x), el conjunto de cebadores ITS1F/ITS4R24 (Tabla 1) con el siguiente programa de PCR: 94 °C durante 1 min, y luego 35 ciclos de 94 °C durante 30 s, 55 °C durante 30 s y 72 °C durante 1 min, seguido de una extensión final de 7 min a 72 °C.
- Análisis filogenético
- Utilice el software ClustalX 2.127 para alinear las múltiples secuencias de los pasos 2.2.2 y 2.2.3. Recorte la región de secuencias conservadas manualmente con GeneDoc28.
- Realizar el análisis filogenético mediante el software MEGA729 basado en los métodos de evolución mínima (ME), Neighbor-Joining (NJ) y máxima verosimilitud (ML).
NOTA: Realizar los tres métodos puede ayudar a confirmar y concluir con precisión el estado de clasificación. Los aislados de hongos examinados por el 1er cribado de patogenicidad se utilizan para la identificación molecular a nivel de género. Los aislados fúngicos cribados por la 2ª prueba de virulencia se utilizan para la identificación molecular y morfológica a nivel de especie.
3. Identificación morfológica de la EPF
- Observación de la morfología de la colonia fúngica
- Use una cámara para capturar el crecimiento de la colonia de cultivo de hongos durante 7 días y registre el crecimiento, la forma (esponjosa, firme) y el color de las colonias.
- Observación de conidios y conidióforos
- Raspe los conidios de la colonia de hongos de cultivo puro con un bucle de inoculación y transfiera las esporas a un portaobjetos de vidrio con una solución de Tween 80 al 0,1%. Luego, cubra con un cobertor para la observación microscópica ligera de los conidios.
- Use un bisturí para cortar un bloque de agar de 5 mm2 de la hebra hifal en el borde de la colonia de hongos, y luego transfiera el bloque de agar a un portaobjetos de vidrio.
- Realice la limpieza de la siguiente manera: Agregue la solución Tween 80 al 0.1% en el bloque de agar con un gotero de plástico y lave la mayor parte del exceso de conidios con pinzas. Luego, cúbralo con un cobertor para la observación microscópica ligera.
NOTA: El 0,1% de Tween 80 puede ser sustituido por otro surfactante más potente (Tabla de Materiales) dependiendo de las especies de hongos y la hidrofobicidad. - Mida y registre el ancho y la longitud de los conidios y conidióforos para comparar las diferencias entre los diferentes aislados de hongos.
- Utilice la prueba ANOVA de Welch y la prueba Games-Howell (prueba post-hoc) para analizar el ancho y la longitud conidiales de cada cepa utilizando R studio (versión 3.4.1).
NOTA: El análisis de datos de los caracteres morfológicos se puede ajustar por casos. Los aislados fúngicos cribados con la 3ª prueba de virulencia se utilizan para la caracterización fisiológica y clasificación ECN en las secciones 4 y 5.
4. Investigación de la productividad conidial y termotolerancia
- Ensayo de producción conidial
- Cultive el aislado fúngico seleccionado en medio SDA 1/4 a 25 ± 1 °C en la oscuridad durante 10 días.
- Preparar 1 ml de la suspensión conidial del aislado fúngico en solución de surfactante al 0,03% y ajustar a 1 x 107 conidios/ml como se describió anteriormente.
- Deje caer tres gotas de 10 μL de suspensión conidial en 1/4 SDA e incube a 25 ° C en la oscuridad durante 7, 10 y 14 días para contar la esporulación de hongos.
NOTA: 10 μL es el mejor volumen para recoger el bloque de 5 mm con esporulación fúngica uniforme después del crecimiento de hongos durante 7-14 días. - Use el barrenador del corcho para separar el bloque de agar de 5 mm del centro de la colonia y transferirlo a 1 ml de solución de surfactante al 0,03% (Tabla de materiales) en un tubo de microcentrífuga de 1,5 ml en cada punto de tiempo.
- Vórtice el tubo a 3.000 rpm a temperatura ambiente durante 15 minutos y use un hemocitómetro para contar el número de conidios.
NOTA: La fórmula utilizada para contar es el número de conidios por cada 25 cuadrados de la celda más pequeña (tamaño = 0,025 mm2; profundidad de la cámara = 0,1 mm):
Número total de conidios en 5 plazas ÷ 80 × (4 × 106) - Repita tres veces para cada aislado.
- Ensayo de termotolerancia
- Cultive el aislado fúngico seleccionado en medio SDA 1/4 a 25 ± 1 °C en la oscuridad durante 10 días.
- Preparar 1 ml de la suspensión conidial de aislado fúngico en solución de surfactante al 0,03% y ajustar a 1 x 107 conidios/ml como se describió anteriormente.
- Vórtice la suspensión conidial y caliéntela en un baño seco de 45 °C durante 0, 30, 60, 90 y 120 min. Deje caer tres gotas de 5 μL de la suspensión conidial en un medio SDA de 55 mm 1/4 en cada punto de tiempo posterior a la exposición al calor e incube a 25 ± 1 °C durante 18 h.
NOTA: Evite esparcir las gotitas de hongos para poder concentrarse mejor en el área. - Cuente el número de esporas de conidios germinados con cinco campos seleccionados al azar bajo microscopía de luz 200x para determinar la tasa de germinación.
- Realice tres réplicas para cada aislado.
5. Clasificación efectiva del número de conidios (ECN)
- Cálculo de ECN
NOTA: Obtenga los datos de producción conidial y termotolerancia de cada cepa fúngica potencial antes de calcular el ECN21 total.- Calcule el cambio de pliegue (FC) de la producción conidial en cada punto de tiempo:
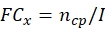
donde, x = punto de tiempo para la recopilación de datos; ncp = número de conidios después de cada día de crecimiento; e I = número inicial de conidios sembrados. - Calcule el número de conidios bajo el tratamiento de estrés en cada punto de tiempo utilizando la siguiente fórmula:

Donde, y = la ECN del punto temporal objeto de tratamiento; TT0 = la tasa de germinación de los conidios que no sufren estrés térmico (= tasa de germinación de 0 min de tratamiento térmico); TTz = coeficiente de tensión es la tasa de germinación de los conidios en diferentes momentos del tratamiento térmico (z). - Calcule el ECN total utilizando la siguiente fórmula:

- Compare el ECN de cada cepa fúngica.
- Calcule el cambio de pliegue (FC) de la producción conidial en cada punto de tiempo:
- Análisis de componentes principales (PCA) de cepas fúngicas
NOTA: El análisis de PCA confirma la clasificación de ECN y ayuda a comprender la correlación entre los valores de caracteres fisiológicos. Compare los valores de ECN y seleccione los aislados de EPF que tengan valores de ECN más altos. - Utilice el software R para crear PCA mediante codificación:
#Input archivo de datos PCA
a = read.table("PCA.csv",sep=',',header=T)- # Procesamiento de datos de muestra
row.names(a) <- c("NCHU-9","NCHU-11", "NCHU-64", "NCHU-69", "NCHU-95", "NCHU-113")
X=row.names(a)
df<- a[2:11] - #PCA cálculo de la tecnología
pca <- prcomp(df, center = TRUE, escala = TRUE)
vars <- (pca$sdev)^2
pc1_percent = vars[1] / sum(vars)
pc2_percent = vars[2] / sum(vars)
valor = pca$x - #Output archivo de visualización PCA
png(archivo = 'pca.png', altura = 2000, ancho = 2000, res = 300)
NOTA: Utilice de 7 a 14 días la producción conidial y todos los datos de termotolerancia para ejecutar el análisis de componentes principales (PCA) para confirmar la clasificación ECN.
- # Procesamiento de datos de muestra
- Seleccione las cepas de hongos de mejor rendimiento basadas en ECN o PCA y realice la prueba de virulencia de las plagas objetivo para una mayor investigación.
Resultados
Aislamiento y selección de posibles hongos entomopatógenos (EPF)
Mediante el uso del método de construcción de la biblioteca de hongos entomopatógenos (EPF) mediado por Tenebrio molitor, se excluiría el número de hongos sin actividad de eliminación de insectos; por lo tanto, la eficiencia del aislamiento y la selección de EPF podrían aumentarse en gran medida. Durante la aplicación de este método, se registró la información de los sitios de mues...
Discusión
Los hongos entomopatógenos (EPF) se han utilizado para el control de insectos. Existen varios métodos para aislar, seleccionar e identificar EPF30,31,32. Comparando los diferentes tipos de métodos de cebo de insectos, Beauveria bassiana y Metarhizium anisopliae se encontraron comúnmente en cebos de insectos6,12,13,14.
Divulgaciones
Los autores declaran que no hay conflicto de intereses involucrado en este trabajo.
Agradecimientos
Esta investigación fue apoyada por la Subvención 109-2313-B-005 -048 -MY3 del Ministerio de Ciencia y Tecnología (MOST).
Materiales
| Name | Company | Catalog Number | Comments |
| Agar Bacteriological grade | BIOMAN SCIENTIFIC Co., Ltd. | AGR001 | Suitable in most cell culture/molecular, biology applications. |
| AGAROSE, Biotechnology Grade | BIOMAN SCIENTIFIC Co., Ltd. | AGA001 | For DNA electrophoresis. |
| BioGreen Safe DNA Gel Buffer | BIOMAN | SDB001T | |
| Brass cork borer | Dogger | D89A-44001 | |
| Canon kiss x2 | Canon | EOS 450D | For record strain colony morphology |
| Constant temperature incubator | Yihder Co., Ltd. | LE-509RD | Fungal keeping. |
| cubee Mini-Centrifuge | GeneReach | MC-CUBEE | |
| DigiGel 10 Digital Gel Image System | TOPBIO | DGIS-12S | |
| Finnpipette F2 0.2 to 2 µL Pipette | Thermo Scientific | 4642010 | |
| Finnpipette F2 1 to 10 µL Pipette | Thermo Scientific | 4642030 | |
| Finnpipette F2 10 to 100 µL Pipette | Thermo Scientific | 4642070 | |
| Finnpipette F2 100 to 1000 µL Pipette | Thermo Scientific | 4642090 | |
| Finnpipette F2 2 to 20 µL Pipette | Thermo Scientific | 4642060 | |
| Finnpipette F2 20 to 200 µL Pipette | Thermo Scientific | 4642080 | |
| GeneAmp PCR System 9700 | Applied Biosystems | 4342718 | |
| GenepHlow Gel/PCR Kit | Geneaid | DFH100 | |
| Genius Dry Bath Incubator | Major Science | MD-01N | |
| Graduated Cylinder Custom A 100mL | SIBATA | SABP-1195906 | Measure the volume of reagents. |
| Hand tally counter | SDI | NO.1055 | |
| Hemocytometer | bioman | AP-0650010 | Calculate the number of spore |
| Inoculating loop | Dogger | D8GA-23000 | |
| lid | IDEAHOUSE | RS92004 | |
| Micro cover glass | MUTO PURE CHEMICALS CO.,LTD | 24241 | |
| Microscope imaging system | SAGE VISION CO.,LTD | SGHD-3.6C | |
| Microscope Slides | DOGGER | DG75001-07105 | |
| Mupid-2plus DNA Gel Electrophoresis | ADVANCE | AD110 | |
| Nikon optical microscope | SAGE VISION CO.,LTD | Eclipse CI-L | |
| Plastic cup | IDEAHOUSE | CS60016 | |
| Presto Mini gDNA Yeast Kit | Geneaid | GYBY300 | Fungal genomic DNA extraction kit |
| Sabouraud Dextrose Broth (Sabouraud Liquid Medium) | HiMedia Leading BioSciences Company | M033 | Used for cultivation of yeasts, moulds and aciduric microorganisms. |
| Scalpel Blade No.23 | Swann-Morton | 310 | |
| Scalpel Handle No.4 | AGARWAL SURGICALS | SSS -FOR-01-91 | |
| Shovel | Save & Safe | A -1580242 -00 | |
| Silwet L-77 | bioman(phytotech) | S7777 | Surfactant |
| Sorvall Legend Micro 17 Microcentrifuge | Thermo Scientific | 75002403 | |
| Steel Tweezers | SIPEL ELECTRONIC SA | GG-SA | |
| Sterile Petri Dish | BIOMAN SCIENTIFIC Co., Ltd. | 1621 | Shallow cylindrical containers with fitted lids, specifically for microbiology or cell culture use. |
| ThermoCell MixingBlock | BIOER | MB-101 | |
| Tween 80 | FUJIFILM Wako Pure Chemical Corporation | 164-21775 | |
| TwinGuard ULT Freezer | Panasonic Healthcare Holdings Co., Ltd. | MDF-DU302VX | -80°C sample stored. |
| Vertical floor type cabinet | Chih Chin | BSC-3 | Fungal operating culturing. |
| Vortex Genie II | Scientific | SIG560 | |
| Zipper storage bags | Save & Safe | A -1248915 -00 | |
| 100 bp DNA Ladder | Geneaid | DL007 | |
| -20°C Freezer | FRIGIDAIRE | Frigidaire FFFU21M1QW | -20°C sample and experimental reagents stored. |
| 2X SuperRed PCR Master Mix | TOOLS | TE-SR01 | |
| 50X TAE Buffer | BIOMAN | TAE501000 |
Referencias
- Wraight, S. P., Carruthers, R. I. . Biopesticides: use and Delivery. , 233-269 (1999).
- Chase, A., Osborne, L., Ferguson, V. Selective isolation of the entomopathogenic fungi Beauveria bassiana and Metarhizium anisopliae from an artificial potting medium. Florida Entomologist. , 285-292 (1986).
- Meyling, N. V. Methods for isolation of entomopathogenic fungi from the soil environment. University of Copenhagen. , 1-18 (2007).
- Zimmermann, G. The 'Galleria bait method'for detection of entomopathogenic fungi in soil. Journal of applied Entomology. 102 (1-5), 213-215 (1986).
- Schneider, S., Widmer, F., Jacot, K., Kölliker, R., Enkerli, J. Spatial distribution of Metarhizium clade 1 in agricultural landscapes with arable land and different semi-natural habitats. Applied Soil Ecology. 52, 20-28 (2012).
- Hallouti, A., et al. Diversity of entomopathogenic fungi associated with Mediterranean fruit fly (Ceratitis capitata (Diptera: Tephritidae)) in Moroccan Argan forests and nearby area: impact of soil factors on their distribution. BMC Ecology. 20 (1), 1-13 (2020).
- Meyling, N. V., Eilenberg, J. Occurrence and distribution of soil borne entomopathogenic fungi within a single organic agroecosystem. Agriculture, Ecosystems and Environment. 113 (1-4), 336-341 (2006).
- Skalický, A., Bohatá, A., Šimková, J., Osborne, L. S., Landa, Z. Selection of indigenous isolates of entomopathogenic soil fungus Metarhizium anisopliae under laboratory conditions. Folia Microbiologica. 59 (4), 269-276 (2014).
- Veen, K., Ferron, P. A selective medium for the isolation of Beauveria tenella and of Metarrhizium anisopliae. Journal of Invertebrate Pathology. 8 (2), 268-269 (1966).
- Goettel, M., Inglis, D., Lacy, L. . Manual of Techniques in Insect Pathology. , 213-249 (1997).
- Luz, C., Netto, M. C. B., Rocha, L. F. N. In vitro susceptibility to fungicides by invertebrate-pathogenic and saprobic fungi. Mycopathologia. 164 (1), 39-47 (2007).
- Mantzoukas, S., et al. Trapping entomopathogenic fungi from vine terroir soil samples with insect baits for controlling serious pests. Applied Sciences. 10 (10), 3539 (2020).
- Goble, T., Dames, J., Hill, M., Moore, S. The effects of farming system, habitat type and bait type on the isolation of entomopathogenic fungi from citrus soils in the Eastern Cape Province, South Africa. BioControl. 55 (3), 399-412 (2010).
- Nishi, O., Iiyama, K., Yasunaga-Aoki, C., Shimizu, S. Isolation of entomopathogenic fungi from soil by using bait method with termite, Reticulitermes speratus. Enotomotech. 35, 21-26 (2011).
- Castrillo, L. . ARS Collection of Entomopathogenic Fungal Cultures (ARSEF). , (2014).
- Kim, J. C., et al. Tenebrio molitor-mediated entomopathogenic fungal library construction for pest management. Journal of Asia-Pacific Entomology. 21 (1), 196-204 (2018).
- Keyser, C. A., Henrik, H., Steinwender, B. M., Meyling, N. V. Diversity within the entomopathogenic fungal species Metarhizium flavoviride associated with agricultural crops in Denmark. BMC Microbiology. 15 (1), 1-11 (2015).
- Quesada-Moraga, E., Navas-Cortés, J. A., Maranhao, E. A., Ortiz-Urquiza, A., Santiago-Álvarez, C. Factors affecting the occurrence and distribution of entomopathogenic fungi in natural and cultivated soils. Mycological Research. 111 (8), 947-966 (2007).
- Park, J. B., et al. Developmental characteristics of Tenebrio molitor larvae (Coleoptera: Tenebrionidae) in different instars. International Journal of Industrial Entomology. 28 (1), 5-9 (2014).
- Chang, J. -. C., et al. Construction and selection of an entomopathogenic fungal library from soil samples for controlling Spodoptera litura. Frontiers in Sustainable Food Systems. 5, 15 (2021).
- Podder, D., Ghosh, S. K. A new application of Trichoderma asperellum as an anopheline larvicide for eco friendly management in medical science. Scientific reports. 9 (1), 1-15 (2019).
- . Geneaid Biotech Ltd. Presto Mini gDNA Yeast, Ver. 04.27.17 Available from: https://www.geneaid.com/data/files/1605664221308055331.pdf (2021)
- White, T. J., Bruns, T., Lee, S., Taylor, J. Amplification and direct sequencing of fungal ribosomal RNA genes for phylogenetics. PCR protocols: A guide to methods and applications. 18 (1), 315-322 (1990).
- Kepler, R. M., Humber, R. A., Bischoff, J. F., Rehner, S. A. Clarification of generic and species boundaries for Metarhizium and related fungi through multigene phylogenetics. Mycologia. 106 (4), 811-829 (2014).
- Kepler, R. M. A phylogenetically-based nomenclature for Cordycipitaceae (Hypocreales). IMA Fungus. 8 (2), 335-353 (2017).
- Thompson, J. D., Gibson, T. J., Plewniak, F., Jeanmougin, F., Higgins, D. G. The CLUSTAL_X windows interface: flexible strategies for multiple sequence alignment aided by quality analysis tools. Nucleic Acids Research. 25 (24), 4876-4882 (1997).
- Kumar, S., Stecher, G., Tamura, K. MEGA7: Molecular evolutionary genetics analysis version 7.0 for bigger datasets. Molecular Biology and Evolution. 33 (7), 1870-1874 (2016).
- Herlinda, S., Mulyati, S. I. Selection of isolates of entomopathogenic fungi and the bioefficacy of their liquid production against Leptocorisa oratorius nymphs. Microbiology Indonesia. 2 (3), 9 (2008).
- Herlinda, S., Irsan, C., Mayasari, R., Septariani, S. Identification and selection of entomopathogenic fungi as biocontrol agents for Aphis gossypii from South Sumatra. Microbiology Indonesia. 4 (3), 137-142 (2010).
- Montes-Bazurto, L. G., Peteche-Yonda, Y., Medina-Cardenas, H. C., Bustillo-Pardey, A. E. Selection of entomopathogenic fungi for the biological control of Demotispa neivai (Coleoptera: Chrysomelidae) in oil palm plantations in Colombia. Journal of Entomological Science. 55 (3), 388-404 (2020).
- Shin, T. -. Y., Choi, J. -. B., Bae, S. -. M., Koo, H. -. N., Woo, S. -. D. Study on selective media for isolation of entomopathogenic fungi. International Journal of Industrial Entomology. 20 (1), 7-12 (2010).
- Sharma, L., Oliveira, I., Torres, L., Marques, G. Entomopathogenic fungi in Portuguese vineyards soils: Suggesting a 'Galleria-Tenebrio-bait method'as bait-insects Galleria and Tenebrio significantly underestimate the respective recoveries of Metarhizium (robertsii) and Beauveria (bassiana). MycoKeys. (38), 1 (2018).
- Rodríguez, M., Gerding, M., France, A. Selección de Hongos Entomopatógenos para el Control de Varroa destructor (Acari: Varroidae). Chilean journal of agricultural research. 69 (4), 534-540 (2009).
- Yang, H., et al. Persistence of Metarhizium (Hypocreales: Clavicipitaceae) and Beauveria bassiana (Hypocreales: Clavicipitaceae) in tobacco soils and potential as biocontrol agents of Spodoptera litura (Lepidoptera: Noctuidae). Environmental entomology. 48 (1), 147-155 (2019).
- Muñiz-Reyes, E., Guzmán-Franco, A. W., Sánchez-Escudero, J., Nieto-Angel, R. Occurrence of entomopathogenic fungi in tejocote (C rataegus mexicana) orchard soils and their pathogenicity against R hagoletis pomonella. Journal of Applied Microbiology. 117 (5), 1450-1462 (2014).
- Lacey, L. A., et al. Goettel Insect pathogens as biological control agents: Back to the future. Journal of Invertebrate Pathology. 132, 1-41 (2015).
- Humber, R. A. . Manual of techniques in insect pathology. , 153-185 (1997).
- Rehner, S. A., Buckley, E. A Beauveria phylogeny inferred from nuclear ITS and EF1-α sequences: evidence for cryptic diversification and links to Cordyceps teleomorphs. Mycologia. 97 (1), 84-98 (2005).
- Quandt, C. A., et al. Phylogenetic-based nomenclatural proposals for Ophiocordycipitaceae (Hypocreales) with new combinations in Tolypocladium. IMA fungus. 5 (1), 121-134 (2014).
- Shah, F. A., Wang, C. S., Butt, T. M. Nutrition influences growth and virulence of the insect-pathogenic fungus Metarhizium anisopliae. FEMS Microbiology Letters. 251 (2), 259-266 (2005).
- Ignoffo, C. Environmental factors affecting persistence of entomopathogens. Florida Entomologist. , 516-525 (1992).
- Rodrigues, I. W., Forim, M., Da Silva, M., Fernandes, J., Batista Filho, A. Effect of ultraviolet radiation on fungi Beauveria bassiana and Metarhizium anisopliae, pure and encapsulated, and bio-insecticide action on Diatraea saccharalis. Advances in Entomology. 4 (3), 151-162 (2016).
- Paula, A. R., Ribeiro, A., Lemos, F. J. A., Silva, C. P., Samuels, R. I. Neem oil increases the persistence of the entomopathogenic fungus Metarhizium anisopliae for the control of Aedes aegypti (Diptera: Culicidae) larvae. Parasites and Vectors. 12 (1), 1-9 (2019).
- Morley-Davies, J., Moore, D., Prior, C. Screening of Metarhizium and Beauveria spp. conidia with exposure to simulated sunlight and a range of temperatures. Mycological Research. 100 (1), 31-38 (1996).
- Rangel, D. E., Braga, G. U., Flint, S. D., Anderson, A. J., Roberts, D. W. Variations in UV-B tolerance and germination speed of Metarhizium anisopliae conidia produced on insects and artificial substrates. Journal of Invertebrate Pathology. 87 (2-3), 77-83 (2004).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados