Method Article
Herstellung von siRNA-beladenen Lipid-Nanopartikeln mit einem mikrofluidischen Gerät
In diesem Artikel
Zusammenfassung
Mikrofluidik-basierte Lipid-Nanopartikel (LNP) Produktionsmethoden haben Aufmerksamkeit in Drug-Delivery-Systemen (DDSs) erregt, einschließlich der RNA-Delivery. Dieses Protokoll beschreibt die Herstellung, die LNP-Produktion (siRNA-loaded LNP) und die LNP-Auswertungsprozesse unter Verwendung unseres ursprünglichen mikrofluidischen Geräts namens iLiNP.
Zusammenfassung
Die Entwicklung funktioneller Lipid-Nanopartikel (LNPs) ist eine der großen Herausforderungen im Bereich der Drug Delivery Systeme (DDS). In jüngster Zeit haben LNP-basierte RNA-Delivery-Systeme, nämlich RNA-geladene LNPs, Aufmerksamkeit für die RNA-Therapie auf sich gezogen. Insbesondere mRNA-beladene LNP-Impfstoffe wurden zur Vorbeugung von COVID-19 zugelassen, was zum Paradigmenwechsel hin zur Entwicklung von Nanoarzneimitteln der nächsten Generation führte. Für die LNP-basierten Nanoarzneimittel ist die LNP-Größe ein wesentlicher Faktor bei der Kontrolle der LNP-Biodistribution und der LNP-Leistung. Daher ist eine präzise LNP-Größenkontrolltechnik für den LNP-Produktionsprozess unverzichtbar. Hier berichten wir über ein Protokoll für die größengesteuerte LNP-Produktion mit einem mikrofluidischen Gerät namens iLiNP. siRNA-beladene LNPs werden ebenfalls mit dem iLiNP-Gerät hergestellt und durch In-vitro-Experimente ausgewertet. Repräsentative Ergebnisse werden für die LNP-Größe gezeigt, einschließlich siRNA-beladener LNPs, Z-Potential, siRNA-Verkapselungseffizienz, Zytotoxizität und Zielgen-Silencing-Aktivität.
Einleitung
Lipid-Nanopartikel (LNP) sind einer der am weitesten verbreiteten Nanocarrier für RNA-Abgabesysteme. Vor kurzem wurden mRNA-beladene LNPs als Impfstoffe zur Prävention von COVID-191,2,3 zugelassen. Im Allgemeinen spielt die Größe von LNP eine entscheidende Rolle für die Leistung der Bioverteilungs- und Drug-Delivery-Systeme (DDS), einschließlich Gen-Silencing oder Proteinexpression4,5,6. Daher ist eine präzise LNP-Größenkontrollmethode für den LNP-Produktionsprozess erforderlich.
Für die Herstellung von größenkontrollierten LNPs haben mikrofluidische Geräte im Laufe der Jahre Aufmerksamkeit erregt7. Im Jahr 2018 wurden die ersten von der Food and Drug Administration (FDA) zugelassenen siRNA-beladenen LNPs (z. B. Onpattro) mit dem mikrofluidischen Gerät entwickelt8,9. Bei der mikrofluidischen LNP-Produktionsmethode werden eine Lipidlösung und eine wässrige Lösung getrennt in die mikrofluidische Vorrichtung eingebracht und dann im Mikrokanal gemischt. Um die Mischeffizienz zu verbessern, wurde das chaotische Mischgerät für die LNP-Produktion verwendet10,11,12. Das chaotische Mischpultgerät ermöglicht es, LNPs in spezifischer Größe herzustellen.
Ein einfaches mikrofluidisches Gerät namens invasive Lipid-Nanopartikelproduktion (iLiNP), das mit Prallwandstrukturen ausgestattet ist, wurde entwickelt, um die LNP-Größe genau zu kontrollieren13,14. Im Vergleich zum chaotischen Mischpultgerät war das iLiNP-Gerät in der Lage, die LNP-Größe im Bereich von 20 bis 100 nm in 10 nm-Intervallen zu steuern. Darüber hinaus produzierte das iLiNP-Gerät siRNA-beladene LNPs6, mRNA-beladene LNPs15, Ribonukleoprotein-beladene LNPs16 und Exosomen-ähnliche LNPs17. Ziel dieses Beitrags ist es, den Herstellungs- undsiRNA-beladenen LNP-Produktionsprozess des iLiNP-Geräts vorzustellen und den vom iLiNP-Gerät erzeugten LNP-Bewertungsprozess zu beschreiben.
Protokoll
1. Herstellung des iLiNP-Gerätes
HINWEIS: Das iLiNP-Gerät wird mit der Standard-Softlithographie-Methode hergestellt18. Das detaillierte Fertigungsprotokoll wurde bereits berichtet10,13.
- SU-8 Formenbau
- Gießen Sie SU-8 3050 auf einen 3-Zoll-Siliziumwafer. Beschichten Sie den Siliziumwafer, um eine 100 μm dicke SU-8-Schicht zu erhalten.
- Den Siliciumwafer backen, indem Sie ihn bei 65 °C für 5 min und 95 °C für 45 min auf eine Kochplatte legen.
- Stellen Sie den Siliziumwafer nach dem Backen auf die Bühne eines maskenlosen Desktop-Lithographiesystems.
- Den Siliziumwafer bei 365 nm für 1,5 s pro Position UV-Licht aussetzen.
HINWEIS: In diesem Experiment wurde ein maskenloses Desktop-Lithographiesystem verwendet. Das System belichtet automatisch UV-Licht in einem geteilten Bestrahlungsbereich (eine Position) des Mikrokanals. - Nach UV-Bestrahlung den Siliciumwafer auf der Heizplatte bei 65 °C für 1 min und 95 °C für 5 min backen.
- Kühlen Sie den Siliziumwafer ab und tränken Sie dann einen SU-8-Entwickler für 15 Minuten, um unexponierte SU-8 zu entfernen.
- Behandeln Sie die SU-8-Form mit Infusion von Trichlor (1H, 1H, 2H, 2H- Perfluoroctyl) silan mit einem Exsikkator und einer Vakuumpumpe.
- Fertigung des iLiNP-Gerätes
- Mischen Sie die Silikonbasis und das Polydimethylsiloxan (PDMS) Härter im Verhältnis 10:1 (w/w).
- Entgasen Sie das Gemisch mit einer Vakuumpumpe und einem Exsikkator.
HINWEIS: PDMS wurde mit einer Vakuumpumpe für 10 min bei Raumtemperatur entgast. - Gießen Sie das entgaste PDMS in einer 100 mm Petrischale mit einer Dicke von bis zu 0,5 bis 1 cm auf die SU-8-Form, gefolgt von einem Backen in einem Ofen bei 80 ° C für 1 h.
- Kühlen Sie die Form ab und schälen Sie dann das PDMS-Substrat mit einer Pinzette aus der SU-8-Form.
- Stanzen Sie drei Löcher (0,5 mm) in das PDMS-Substrat. Verbinden Sie das PDMS-Substrat und einen Glasobjektträger mit einem Sauerstoffplasmareiniger, um ein iLiNP-Gerät zu bauen (siehe Abbildung 1)13.
- Verbinden Sie drei PEEK-Kapillaren (I.D. 0,3 mm, O.D. 0,5 mm) an den Ein- und Auslass des iLiNP-Geräts und härten Sie mit einem Sekundenkleber aus.
HINWEIS: Die Länge der PEEK-Kapillaren ist einstellbar und hängt vom Experiment ab.
2. Herstellung von Lipidlösungen
- Herstellung von Lipid/Ethanol-Lösungen: 13,4 mM 1-Palmitoyl-2-oleoyl-sn-glycero-3-phosphocholin (POPC), 10 mM 1,2-Distearoyl-sn-glycero-3-phosphocholin (DSPC), 20 mM 1,2-dioleoyloxy-3-trimethylammoniumpropan (DOTAP), 5 mM 1,2-Dimyristoyl-rac-glycero-3-methoxypolyethylenglykol-2000 (DMG-PEG2k) und 20 mM Cholesterin. Lagern Sie die Lagerlösungen vor dem Versuch bei -20 °C.
- Um die siRNA-beladenen LNPs herzustellen, mischen Sie DOTAP-, DSPC-, Cholesterin- und DMG-PEG2k-Lösungen in einem molaren Verhältnis von 50/10/38,5/1,5. Die Gesamtlipidkonzentration wird auf 8 mM eingestellt.
3. Herstellung wässriger Lösungen
- Wässrige Lösungen zubereiten: 154 mM NaCl (Kochsalzlösung), 25 mM Acetatpuffer bei pH 4,0 unter Verwendung von DNase/RNase-freiem destilliertem Wasser.
- Filtern Sie die Lösungen durch 0,2 μm große Membranfilter oder Spritzenfilter.
4. Herstellung der siRNA/Pufferlösung
- 70 μg siGL4 in 1 ml 25 mM Acetatpuffer (pH 4,0) auflösen.
HINWEIS: siGL4 wird für den Knockdown des Luciferase-Gens verwendet.
5. Einrichtung des iLiNP-Gerätes und Produktion von LNPs
HINWEIS: Siehe Abbildung 1 für die Schaltpläne.
- Füllen Sie 1 ml Glasspritzen mit Lipid- bzw. wässrigen Lösungen (aus den Schritten 3.1 und 4.1 in einzelnen Spritzen).
HINWEIS: Passen Sie das Lipid- und wässrige Lösungsvolumen in Abhängigkeit von der menge an, die für das LNP-Bewertungsexperiment erforderlich ist. - Verbinden Sie die Glasspritzen über Spritzenverbinder mit den PEEK-Kapillaren.
- Stellen Sie die Durchflussrate der Lipid- und wässrigen Lösungen ein.
ANMERKUNG: Das Durchflussverhältnis (FRR) der wässrigen Phase zur Lipidphase liegt zwischen 3:1 und 9:1. - Führen Sie die Lipid- und wässrigen Lösungen separat mit Hilfe von Spritzenpumpen in das iLiNP-Gerät ein.
- Sammeln Sie LNP-Suspensionen in einem Mikroröhrchen aus dem Auslass des iLiNP-Geräts (Abbildung 1).
6. Dialyse der LNP-Suspension und LNP-Größenmessung
- Dialysieren Sie die LNP-Suspension mit einer Dialysemembran (12−14 kDa MW Cutoffs) bei 4 °C über Nacht gegen Kochsalzlösung oder D-PBS für POPC-LNPs bzw. siRNA-beladene LNPs.
HINWEIS: POPC wird nicht in Kochsalzlösung aufgelöst (siehe 2.1). POPC/Ethanol-Lösung wird im iLiNP-Gerät mit Kochsalzlösung verdünnt. - Sammeln Sie die dialysierten LNP-Suspensionen in Mikroröhrchen.
- 20-30 μL der LNP-Suspension werden in eine Mikroquarzzelle pipettiert.
- Messen Sie die LNP-Größe, die LNP-Größenverteilung und den Polydispersitätsindex durch dynamische Lichtstreuung (DLS).
7. Messung des Z-Potentials des LNP
HINWEIS: Für die Messung des Z-Potentials wurde nach Herstellerangaben ein Partikelanalysator (siehe Materialtabelle) verwendet.
- Die aus Schritt 6.1 erhaltene LNP-Suspension wird 35 mal mit 10 mM HEPES-Puffer (pH 7,4) verdünnt.
- 700 bis 1000 μL der verdünnten LNP-Suspension werden in eine Kapillarzelle pipettiert.
- Messen Sie das Z-Potential gemäß den Anweisungen des Herstellers.
8. siRNA-Verkapselungseffizienz durch RiboGreen-Assay
HINWEIS: Der Ribogreen-Assay wird durchgeführt, um die siRNA-Verkapselung in LNPs19 zu bewerten. Der Ribogreen-Assay kann die Menge an RNAs innerhalb und außerhalb von LNPs mit/ohne Tensid (z. B. TritonX-100) messen.
- Verdünnen Sie 2 mg/ml siGL4 mit 10 mM HEPES-Puffer (pH 7,4) auf 500 ng/ml siGL4-Lösung.
- Bereiten Sie die Verdünnungsreihe (0, 12,5, 25, 50, 100, 200 ng/ml) der siGL4-Lösung vor, um eine Kalibrierkurve für Triton (+) und Triton (-) Proben zu erstellen.
- Verdünnen Sie die LNP-Suspension 100 Mal mit 10 mM HEPES-Puffer (pH 7,4).
- Mischen Sie Folgendes für Triton (+) Lösung: 980 μL 10 mM HEPES (pH 7,4), 20 μL 10% w/v TritonX-100 und 1,25 μL RiboGreen für 10 Vertiefungen einer 96-Well-Mikroplatte.
- Mischen Sie für Triton (-) Lösung Folgendes: 1000 μL 10 mM HEPES (pH 7,4) und 1,25 μL RiboGreen für 10 Vertiefungen einer 96-Well-Mikroplatte.
- 100 μL der Verdünnungsreihe aus siGL4-Lösung und verdünnten LNP-Suspensionen werden in die Vertiefungen einer schwarzen 96-Well-Mikroplatte pipettiert.
ANMERKUNG: Die Verdünnungsreihe von siGL4-Lösung und verdünnten LNP-Suspensionen wurde in vier Mikrotruhen pro Zustand dosiert. - 100 μL der Nachweislösung (TritonX-100 (+) oder Triton (-)) in die Vertiefungen pipettieren.
ANMERKUNG: Die Nachweislösung (TritonX-100 (+)) wurde in zwei Vertiefungen pro Probe und Zustand dosiert, und die TritonX-100 (-)-Lösung wurde in die verbleibenden zwei Vertiefungen pro Probenbedingung dosiert. - Inkubieren Sie die Mikrotiterplatte für 5 min bei Raumtemperatur.
- Messen Sie die Fluoreszenzintensität mit einem Mikroplattenleser bei einer Wellenlänge von 475 nm.
- Berechnen Sie die siRNA-Verkapselungseffizienz aus der folgenden Gleichung19.
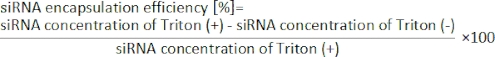
9. Zellkultur
- Herstellung eines Wachstumsmediums, das DMEM, hitzeinaktivierte 10% FBS, 100 U/ml Penicillin, 100 μg/ml Streptomycin und 400 μg/ml G418 enthält.
- Kultivieren Sie HeLa-Zellen, die Glühwürmchen und Renilla-Luciferase (HeLa-dluc) stabil in einer 100 mm TC-behandelten Zellkulturschale mit dem Wachstumsmedium bei 37 °C in einem 5%igen CO2-Inkubator enthalten.
10. Zelllebensfähigkeitstest
- Säen Sie 100 μL einer Suspension von HeLa-Zellen im Wachstumsmedium (6 x 103 Zellen/Well) in eine 96-Well-Mikrotiterplatte.
HINWEIS: Die Zellen wurden mit einer Zellgegenplatte und einem Mikroskop gezählt. - Inkubieren Sie die Mikrotiterplatte für 24 h bei 37 °C in einem 5% CO2-Inkubator.
- Verdünnen Sie die siRNA-beladenen LNPs mit DMEM (FBS (-)) in den Konzentrationen von 10 und 100 nM siRNAs.
- Dosieren Sie 100 μL der verdünnten siRNA-beladenen LNP-Suspension pro Vertiefung.
- Inkubieren Sie die Mikrotiterplatte für 4 h bei 37 °C in einem 5% CO2-Inkubator.
- Entfernen Sie die LNP-Suspension und fügen Sie 100 μL DMEM (FBS (+)) hinzu.
- Inkubieren Sie die Mikrotiterplatte für 20 h bei 37 °C in einem 5% CO2-Inkubator.
- Messen Sie die Zelllebensfähigkeit mit einem handelsüblichen Kit gemäß dem Protokoll des Herstellers.
ANMERKUNG: D-PBS (-) wurde als Negativkontrolle verwendet.
11. Luciferase-Gen-Knockdown-Assay
- Säen Sie 75 μL einer Suspension von HeLa-Zellen im Wachstumsmedium (4,5 x 103 Zellen / Well) in eine 96-Well-Mikrotiterplatte.
- Inkubieren Sie die Mikrotiterplatte für 24 h bei 37 °C in einem 5% CO2-Inkubator.
- Verdünnen Sie die siRNA-beladenen LNPs mit DMEM (FBS (-)) in den Konzentrationen von 10 und 100 nM siRNAs.
- Dosierung von 75 μL der verdünnten siRNA-beladenen LNP-Suspension pro Vertiefung.
- Inkubieren Sie die Mikrotiterplatte für 4 h bei 37 °C in einem 5% CO2-Inkubator.
- Entfernen Sie die LNP-Suspension und fügen Sie 75 μL DMEM (FBS (+)) hinzu.
- Inkubieren Sie die Mikrotiterplatte für 20 h bei 37 °C in einem 5% CO2-Inkubator.
- Messen Sie die Luciferase-Expression mit einem handelsüblichen Kit gemäß dem Protokoll des Herstellers.
HINWEIS: Wir haben D-PBS (-) als Negativkontrolle verwendet.
Ergebnisse
Abbildung 2A,B zeigt die POPC-LNP-Größenverteilung, die unter verschiedenen Strömungsbedingungen erzeugt wird. Die mikrofluidische LNP-Präparationsmethode kann die Größe von LNPs durch die Strömungsbedingungen wie die Gesamtdurchflussrate (TFR) und die FRR steuern. Im Vergleich zu den typischen mikrofluidischen Geräten, einschließlich des chaotischen Mischgeräts und des strömungsfokussierenden mikrofluidischen Geräts, ermöglichte das iLiNP-Gerät eine präzise LNP-Größensteuerung im Bereich von 20 bis 100 nm (Abbildung 2). Kleine LNPs bilden sich bei hohen Gesamtdurchflussbedingungen. Darüber hinaus waren die LNP-Größen, die bei der FRR von 5 gebildet wurden, kleiner als die der FRR von 3, unabhängig von der Gesamtdurchflussrate13.
siRNA-beladene LNPs wurden ebenfalls mit dem iLiNP-Gerät hergestellt (Abbildung 3A). Für das siRNA-beladene LNP-Präparat wurde DOTAP, ein kationisches Lipid, verwendet, um die siRNA effektiv in die LNPs einzukapseln. Das iLiNP-Gerät produzierte 90 nm große siRNA-beladene kationische LNPs mit enger Verteilung (Abbildung 3A,B). Die siRNA-Verkapselungseffizienz betrug 95% aufgrund der elektrostatischen Wechselwirkung zwischen dem kationischen Lipid und negativ geladenen siRNAs (Abbildung 3C).
Die Zytotoxizität und die Gen-Silencing-Aktivität von 90 nm großen siRNA-beladenen LNPs wurden wie in Abbildung 4 und Abbildung 5 gezeigt bewertet. siRNA-beladene LNPs zeigten Zytotoxizität bei einer Dosis von 10 und 100 nM siRNA. Wir bestätigten auch, dass das Expressionsniveau der Luciferase in Abhängigkeit von der siRNA-Konzentration erniedrigt war. Die siRNA-beladenen LNPs unterdrückten 80% Luciferase-Expression bei einer Dosis von 100 nM siRNA. Der Einfluss der LNP-Größe auf die Gen-Silencing-Aktivität wurde zuvor berichtet6,13,17.
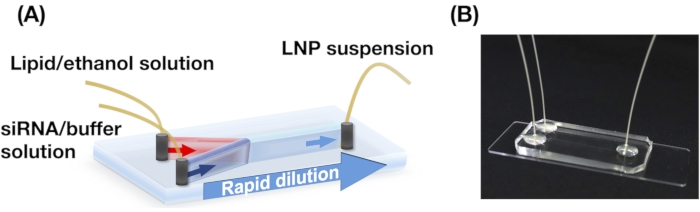
Abbildung 1: (A) Schematische Darstellung und (B) Foto des iLiNP-Geräts. Das iLiNP-Gerät besteht aus PDMS und Glassubstraten. Das iLiNP-Gerät wird mit einem Sekundenkleber mit PEEK-Kapillaren verbunden. Die Lipid- und siRNA/Pufferlösungen werden separat mit Hilfe von Spritzenpumpen in das iLiNP-Gerät eingebracht. Die LNP-Suspension wird in einem Mikroröhrchen gesammelt. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
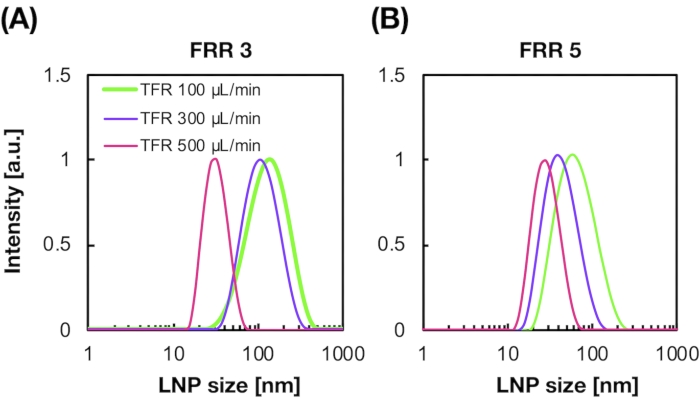
Abbildung 2: POPC-LNP-Größenverteilungen, die vom iLiNP-Gerät bei den verschiedenen Durchflussraten (FRR) erzeugt werden. Die POPC-LNP-Größe wird durch dynamische Lichtstreuung (DLS) gemessen. Die POPC-LNPs werden durch Änderung des Gesamtdurchflusses und der FRR erstellt: (A) 3 FRR und (B) 5 FRR. Kleine LNPs werden bei hohen Gesamtdurchflussbedingungen gebildet. Darüber hinaus waren die LNP-Größen, die bei der FRR von 5 gebildet wurden, kleiner als die bei der FRR von 3. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
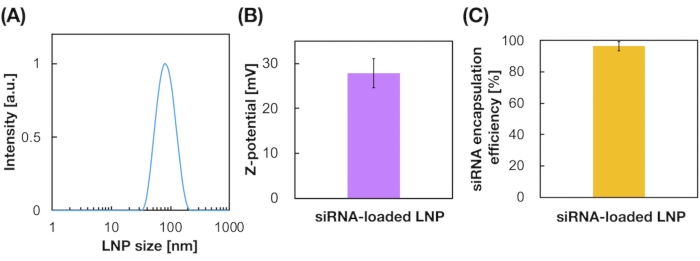
Abbildung 3: Charakterisierung der siRNA-beladenen LNPs. (A) Größenverteilung von siRNA-beladenen LNPs. siRNAs (siGL4) werden durch elektrostatische Wechselwirkung zwischen dem kationischen Lipid (DOTAP) und negativ geladenen siRNAs in die LNPs eingekapselt. (B) Z-Potential der siRNA-beladenen LNPs. Die LNP-Suspension wurde vor der Messung mit 10 mM HEPES-Puffer (pH 7,4) verdünnt. Die Daten werden als Mittelwert ± SD (Standardabweichung) dargestellt. n = 3. (C) siRNA-Verkapselungseffizienz der DOTAP-basierten LNPs. Die Verkapselungseffizienz wurde mittels RiboGreen-Assay bestimmt. Die Daten werden als Mittelwert ± SD dargestellt. n = 3. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
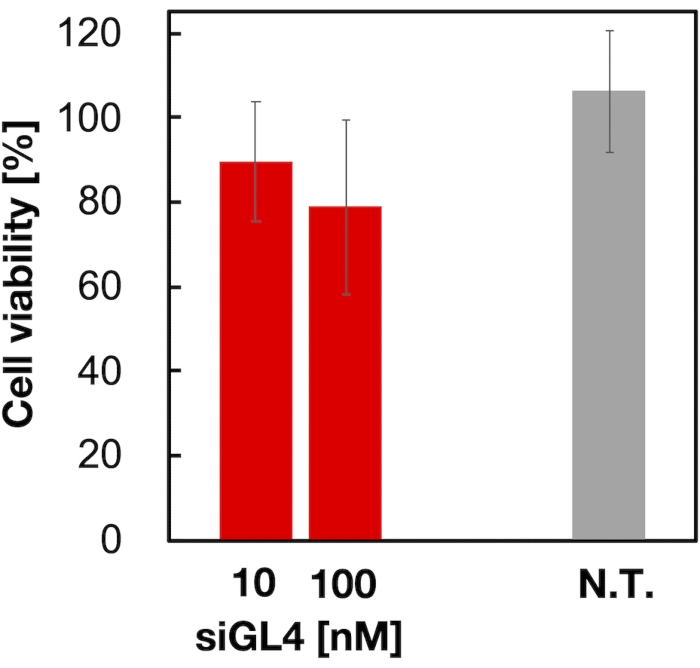
Abbildung 4: Zytotoxizität der siRNA-beladenen LNPs. siRNA-beladene LNPs wurden mit DMEM (FBS (-)) verdünnt, um die siGL4-Konzentrationen von 10 und 100 nM zu erhalten. Die LNP-Suspensionen werden zu HeLa-dLuc-Zellen gegeben und 4 h bei 37 °C in einem 5% CO2-Inkubator inkubiert. N.T.: Nicht behandelt (D-PBS(-)). Die Daten werden als Mittelwert ± SD dargestellt. n = 3. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
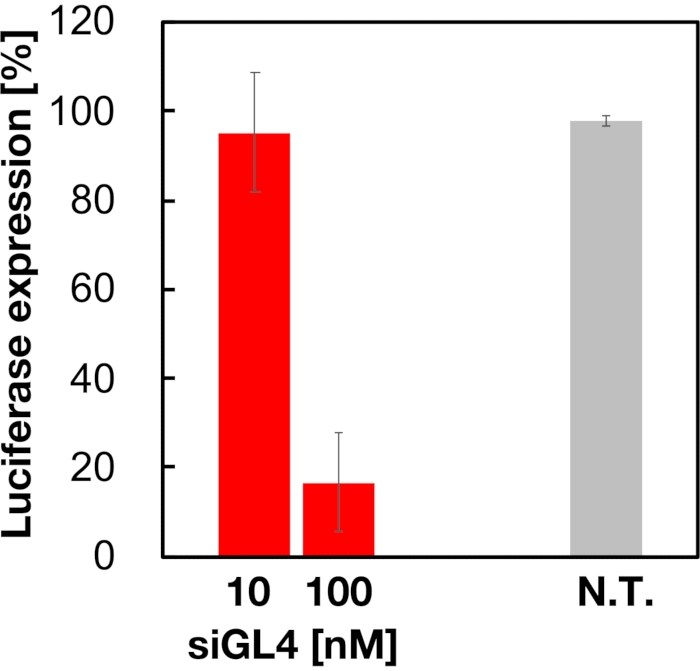
Abbildung 5: Luciferase-Gen-Knockdown-Aktivität, die mit siRNA-beladenen LNPs behandelt wurde. siRNA-geladene LNPs werden auf die gleiche Weise wie der Zelllebensfähigkeitstest hergestellt. Das Luciferase-Expressionsniveau wird mit dem Dual-Glo Luciferase Assay System gemessen. N.T.: Nicht behandelt (D-PBS(-)). Die Daten werden als Mittelwert ± SD dargestellt. n = 3. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
Diskussion
Die LNP-Größe beeinflusst die LNP-Bioverteilung, den Anti-Tumor-Effekt und die Gen-Silencing-Leistung. Daher ist die LNP-Größenkontrollmethode eine bedeutende Technik zur Herstellung von DDS-Nanoarzneimitteln, einschließlich RNA-Abgabesystemen. Ziel dieses Beitrags ist es, das iLiNP-Gerät zur präzisen Größenabstimmung von LNPs und seine Anwendung auf die siRNA-beladene LNPs-Produktion einzuführen. Das iLiNP-Gerät war in der Lage, die LNP-Größe im Bereich von 20 bis 100 nm zu steuern (Abbildung 2)13. Wenn die Strömungsbedingungen, wie die Gesamtdurchflussrate und der FRR, geändert werden, um die LNP-Größe zu steuern, sollte die LNP-Suspension nach etwa 5 bis 10 s gesammelt werden, um den Lösungsfluss zu stabilisieren. Die aus dem Auslass des iLiNP-Geräts gesammelte LNP-Suspension wurde sofort gegen die Pufferlösung dialysiert, um Ethanol zu entfernen und die LNP-Aggregation zu verhindern.
Die LNP-Größenkontrolle ist eine der großen Herausforderungen im Bereich DDS. Im Allgemeinen erfordert der herkömmliche LNP-Produktionsprozess, wie z. B. die Lipidfilmhydratationsmethode, nach der LNP-Produktion20 einen Größenabstimmungsprozess. Auf der anderen Seite kann die mikrofluidische LNPs-Produktionsmethode die größenkontrollierten LNPs erzeugen, indem die Lipid- und wässrigen Lösungen in die mikrofluidische Vorrichtung eingeführt werden6,11,13. Obwohl der Dialyseprozess erforderlich ist, um Ethanol aus der LNP-Suspension zu entfernen, verspricht ein kontinuierlicher Prozess durch die mikrofluidische Vorrichtung in Verbindung mit dem tangentialen Strömungssystem die Automatisierung des LNP-Produktionsprozesses14. Laut Literatur betrugen die POPC-LNP-Größen 50-60 nm und 30-60 nm für die strömungsfokussierende mikrofluidische Vorrichtung21 bzw. die chaotische Mischervorrichtung10. Im Vergleich zu anderen mikrofluidischen Geräten ermöglicht das iLiNP-Gerät die POPC-LNP-Größenkontrolle in einem weiten Bereich von 20 bis 100 nm.
Der Herstellungsprozess des verwendeten iLiNP-Geräts war die Standard-Softlithographie. So kann das iLiNP-Gerät durch Rapid-Prototyping-Technik in Serie produziert werden und eine Kreuzkontamination von Lösungen durch die Verwendung eines Einweggeräts verhindern. Das iLiNP-Gerät kann siRNA-beladene LNPs auf die gleiche Weise wie die POPC-LNP-Produktionsmethode produzieren. Für die LNP-Produktionsmethode mit dem iLiNP-Gerät benötigt der Anwender keine komplizierten Verfahren. Aus diesen Gründen wird erwartet, dass die mikrofluidische LNP-Produktionsmethode, einschließlich des iLiNP-Geräts, als Standard-LNP-Produktionsmethode verwendet wird. Das Protokoll dieses Papiers kann an andere mikrofluidische Geräte für die LNP-Produktion angepasst werden. Darüber hinaus wird die Produktion von mRNA-beladenen LNPs auch ermöglicht, indem die siRNA/Pufferlösung in eine Pufferlösung mit mRNAs geändert wird.
Offenlegungen
Die Autoren haben nichts preiszugeben.
Danksagungen
Diese Arbeit wurde unterstützt von JST, CREST Grant Number JPMJCR17H1, Japan, JST, PRESTO Grant Number JPMJPR19K8, Japan, JST, SCORE, Japan, den Sonderausgaben für Bildung, Kultur, Sport, Wissenschaft und Technologie, JSPS KAKENHI Grant Number JP19KK0140 und der Iketani Science and Technology Foundation.
Materialien
| Name | Company | Catalog Number | Comments |
| 1-palmitoyl-2-oleoyl-sn-glycero-3-phosphocholine (POPC) | NOF Corp. | MC-6081 | |
| 1,2-dimyristoyl-rac-glycero-3-methoxypolyethylene glycol-2000 (DMG-PEG2K) | NOF Corp. | GM-020 | |
| 1,2-dioleoyloxy-3-trimethylammonium propane (DOTAP) | NOF Corp. | CL-8181TA | |
| 1,2-Distearoyl-sn-glycero-3-phosphocholinev (DSPC) | NOF Corp. | MC-8080 | |
| 10 x D-PBS (-) | FUJIFILM Wako Pure Chemical Corp. | 048-29805 | |
| Acetic acid | FUJIFILM Wako Pure Chemical Corp. | 017-00251 | |
| CellTiter-Blue Cell Viability Assay | Promega | G8081 | |
| cholesterol | Sigma-Aldrich | C8667-5G | |
| Desktop maskless lithography system | NEOARK CORPORATION | DDB-701-DL4 | |
| Dialysis membrane | Repligen | 132697 | |
| Dual-Glo Luciferase Assay System | Promega | E2940 | |
| Fetal bovine serum (FBS) | Thermo Fisher Scientific | Lot: 42G6587K | |
| G418 | Nacalai Tesque | 08973-14 | |
| Glass substrate | Matsunami Glass Ind., Ltd. | S1111 | |
| Glass syringe | Hamilton | GASSTIGHT 1002 | |
| HeLa cell | HeLa-dluc cells were provided from Dr. Yusuke Sato at Hokkaido University | ||
| HEPES | FUJIFILM Wako Pure Chemical Corp. | 342-01375 | |
| Low-glucose Dulbecco’s modified Eagle medium (DMEM) | Sigma-Aldrich | D6046-500ML | |
| Oxygen plasma cleaner | Femto Science | CUTE-1MP/R | |
| Penicillin–streptomycin, trypsin (2.5%) | Thermo Fisher Scientific | 15140122 | |
| Quant-iT RiboGreen RNA Reagent | Thermo Fisher Scientific | R11491 | |
| siGL4 | Hokkaido System Science Co., Ltd | The sense and antisense strand sequences of siGL4 are 5'-CCGUCGUAUUCGUGAGCAATsT -3' and 5'-UUGCUCACGAAUACGACGGTsT -3', respectively. | |
| Silicon wafer | GTC | ||
| SILPOT 184 W/C (PDMS) | Dow Corning Toray Co., Ltd. | silicone base and curing agent are included | |
| Sodium acetate | FUJIFILM Wako Pure Chemical Corp. | 192-01075 | |
| Sodium chloride | FUJIFILM Wako Pure Chemical Corp. | 191-01665 | |
| SU-8 3050 | Nippon Kyaku Co., Ltd. | ||
| Syringe connector | Institute of microchemical Technology Co., Ltd. | ISC-011 | |
| Syringe pump | Chemyx | CX07200 | |
| trichloro(1H,1H,2H,2H-perfluorooctyl)silane | Sigma-Aldrich | 448931-10G | |
| TritonX-100 | Nacalai Tesque | 35501-15 | |
| UltraPure DNase/RNase-Free Distilled Water | Thermo Fisher Scientific | 10977015 | |
| Zetasizer Nano ZS | Malvern Instruments | ZEN3600 |
Referenzen
- Schoenmaker, L., et al. mRNA-lipid nanoparticle COVID-19 vaccines: Structure and stability. International Journal of Pharmaceutics. 601, 120586 (2021).
- Chung, Y. H., Beiss, V., Fiering, S. N., Steinmetz, N. F. COVID-19 Vaccine frontrunners and their nanotechnology design. ACS Nano. 14 (10), 12522-12537 (2020).
- Dong, Y., et al. A systematic review of SARS-CoV-2 vaccine candidates. Signal Transduction and Targeted Therapy. 5 (1), 237 (2020).
- Cabral, H., et al. Accumulation of sub-100 nm polymeric micelles in poorly permeable tumours depends on size. Nature Nanotechnology. 6 (12), 815-823 (2011).
- Sato, Y., et al. Elucidation of the physicochemical properties and potency of siRNA-loaded small-sized lipid nanoparticles for siRNA delivery. Journal of Controlled Release. 229, 48-57 (2016).
- Kimura, N., et al. Three-dimensional, symmetrically assembled microfluidic device for lipid nanoparticle production. RSC Advances. 11 (3), 1430-1439 (2021).
- Maeki, M., Kimura, N., Sato, Y., Harashima, H., Tokeshi, M. Advances in microfluidics for lipid nanoparticles and extracellular vesicles and applications in drug delivery systems. Advanced Drug Delivery Reviews. 128, 84-100 (2018).
- Akinc, A., et al. The Onpattro story and the clinical translation of nanomedicines containing nucleic acid-based drugs. Nature Nanotechnology. 14 (12), 1084-1087 (2019).
- Kulkarni, J. A., Witzigmann, D., Chen, S., Cullis, P. R., vander Meel, R. Lipid nanoparticle technology for clinical translation of siRNA therapeutics. Accounts of Chemical Research. 52 (9), 2435-2444 (2019).
- Maeki, M., et al. Understanding the formation mechanism of lipid nanoparticles in microfluidic devices with chaotic micromixers. PLoS One. 12 (11), 0187962 (2017).
- Maeki, M., et al. A strategy for synthesis of lipid nanoparticles using microfluidic devices with a mixer structure. RSC Advances. 5 (57), 46181-46185 (2015).
- Belliveau, N. M., et al. Microfluidic synthesis of highly potent limit-size lipid nanoparticles for in vivo delivery of siRNA. Molecular Therapy - Nucleic Acids. 1, 37 (2012).
- Kimura, N., et al. Development of the iLiNP Device: Fine Tuning the Lipid Nanoparticle Size within 10 nm for Drug Delivery. ACS Omega. 3 (5), 5044-5051 (2018).
- Kimura, N., et al. Development of a microfluidic-based post-treatment process for size-controlled lipid nanoparticles and application to siRNA delivery. ACS Applied Materials & Interfaces. 12 (30), 34011-34020 (2020).
- Hashiba, A., et al. The use of design of experiments with multiple responses to determine optimal formulations for in vivo hepatic mRNA delivery. Journal of Controlled Release. 327, 467-476 (2020).
- Suzuki, Y., et al. Lipid nanoparticles loaded with ribonucleoprotein-oligonucleotide complexes synthesized using a microfluidic device exhibit robust genome editing and hepatitis B virus inhibition. Journal of Controlled Release. 330, 61-71 (2020).
- Kimura, N., Maeki, M., Ishida, A., Tani, H., Tokeshi, M. One-step production using a microfluidic device of highly biocompatible size-controlled noncationic exosome-like nanoparticles for RNA delivery. ACS Applied Bio Materials. 4 (2), 1783-1793 (2021).
- Deng, T., Wu, H., Brittain, S. T., Whitesides, G. M. Prototyping of masks, masters, and stamps/molds for soft lithography using an office printer and photographic reduction. Analytical Chemistry. 72 (14), 3176-3180 (2000).
- Sato, Y., et al. A pH-sensitive cationic lipid facilitates the delivery of liposomal siRNA and gene silencing activity in vitro and in vivo. Journal of Controlled Release. 163 (3), 267-276 (2012).
- Ong, S. G., Chitneni, M., Lee, K. S., Ming, L. C., Yuen, K. H. Evaluation of extrusion technique for nanosizing liposomes. Pharmaceutics. 8 (4), (2016).
- Mijajlovic, M., Wright, D., Zivkovic, V., Bi, J. X., Biggs, M. J. Microfluidic hydrodynamic focusing based synthesis of POPC liposomes for model biological systems. Colloids and Surfaces B: Biointerfaces. 104, 276-281 (2013).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten