È necessario avere un abbonamento a JoVE per visualizzare questo. Accedi o inizia la tua prova gratuita.
Method Article
Determinazione dell'affinità di legame (KD) degli anticorpi radiomarcati contro gli antigeni immobilizzati
In questo articolo
Riepilogo
Qui, viene descritto un metodo per determinare l'affinità di legame (KD) degli anticorpi radiomarcati agli antigeni immobilizzati. KD è la costante di dissociazione di equilibrio che può essere determinata da un esperimento di legame di saturazione misurando il legame totale, specifico e non specifico di un anticorpo radiomarcato a varie concentrazioni al suo antigene.
Abstract
Determinare l'affinità di legame (KD) è un aspetto importante della caratterizzazione degli anticorpi radiomarcati (rAb). Tipicamente, l'affinità di legame è rappresentata dalla costante di dissociazione di equilibrio, KD, e può essere calcolata come la concentrazione di anticorpi alla quale metà dei siti di legame anticorpale sono occupati all'equilibrio. Questo metodo può essere generalizzato a qualsiasi anticorpo radiomarcato o ad altre scaffold proteiche e peptidiche. A differenza dei metodi basati sulle cellule, la scelta degli antigeni immobilizzati è particolarmente utile per convalidare le affinità di legame dopo la conservazione a lungo termine degli anticorpi, distinguere le affinità di legame dei bracci della regione legante l'antigene del frammento (Fab) nei costrutti anticorpali bispecifici e determinare se esiste variabilità nell'espressione dell'antigene tra diverse linee cellulari. Questo metodo prevede l'immobilizzazione di una quantità fissa di antigene in pozzetti specificati su una piastra frangibile a 96 pozzetti. Quindi, il legame non specifico è stato bloccato in tutti i pozzetti con albumina sierica bovina (BSA). Successivamente, il rAb è stato aggiunto in un gradiente di concentrazione a tutti i pozzi. È stato scelto un intervallo di concentrazioni per consentire al rAb di raggiungere la saturazione, cioè una concentrazione di anticorpi alla quale tutti gli antigeni sono continuamente legati dal rAb. Nei pozzetti designati senza antigene immobilizzato, è possibile determinare il legame non specifico del rAb. Sottraendo il legame non specifico dal legame totale nei pozzetti con antigene immobilizzato, è possibile determinare il legame specifico del rAb all'antigene. Il KD del rAb è stato calcolato dalla curva di legame di saturazione risultante. Ad esempio, l'affinità di legame è stata determinata utilizzando amivantamab radiomarcato, un anticorpo bispecifico per il recettore del fattore di crescita epidermico (EGFR) e le proteine di transizione mesenchimale-epiteliale citoplasmatica (cMET).
Introduzione
Gli anticorpi radiomarcati (rAb) hanno una varietà di usi in medicina. Mentre la maggior parte sono utilizzati in oncologia come agenti di imaging e terapeutici, ci sono applicazioni di imaging per l'infiammazione correlata alla reumatologia, la cardiologia e la neurologia1. Imaging rAbs ha un'alta sensibilità per rilevare le lesioni e ha il potenziale per aiutare nella selezione del paziente per il trattamento 2,3,4,5. Sono anche usati per la terapia a causa della loro specificità per i rispettivi antigeni. In una strategia nota come teranostica, lo stesso rAb viene utilizzato sia per l'imaging che per il trattamento6.
Idealmente, l'anticorpo scelto per la radioetichettatura è già dimostrato di avere un'elevata affinità e specificità di legame utilizzando metodi non radiomarcati. La radioelabazione degli anticorpi può essere ottenuta tramite modifica chimica diretta degli anticorpi con un radionuclide che forma legami covalenti stabili (es. radioiodio), o indirettamente tramite coniugazione con chelanti che successivamente si coordinano ai radiometalli 7,8. La radioetichettatura diretta, ad esempio con il radioiodio, modifica specificamente i residui di tirosina e istidina sull'anticorpo. Se questi residui sono importanti per il legame con l'antigene, allora questa radioconiugazione altererebbe l'affinità di legame. Al contrario, esistono molteplici protocolli stabiliti per la coniugazione e la radioetichettatura indiretta degli anticorpi. Ad esempio, un chelante comune utilizzato per legare lo zirconio-89 (89Zr) per l'imaging PET degli anticorpi è il p-isotiocianatobenzil-desferrioxamina (DFO), che viene coniugato casualmente ai residui di lisina dell'anticorpo 9,10. Se ci sono residui di lisina nella regione di legame con l'antigene, la coniugazione in questi siti potrebbe ostacolare stericamente il legame con l'antigene e quindi compromettere il legame anticorpo-antigene. Pertanto, i diversi metodi di radioconiugazione utilizzati per la radioetichettatura indiretta o diretta degli anticorpi possono potenzialmente influenzare l'immunoreattività, definita come la capacità del radioconiugato anticorpale di legarsi al suo antigene 7,11. I metodi di coniugazione sito-specifici possono aggirare questa limitazione, ma queste tecniche richiedono l'ingegneria anticorpale per incorporare ulteriori residui di cisteina o esperienza nelle reazioni enzimatiche sui residui di carboidrati 12,13,14,15,16. Una volta che un anticorpo è radiomarcato, è importante verificare se l'immunoreattività viene mantenuta come parte della caratterizzazione del rAb. Un modo per misurare l'immunoreattività è determinare l'affinità di legame del rAb.
Lo scopo di questo protocollo è quello di descrivere un processo per determinare l'affinità di legame per rAbs utilizzando un test di saturazione radioligante stabilito per quantificare il legame rAb-antigene. La tendenza vincolante è descritta nella Figura 1. La quantità di antigene legato aumenterà man mano che più rAb viene aggiunto a una quantità fissa di antigene immobilizzato. Una volta che tutti i siti di legame dell'antigene sono saturi, verrà raggiunto un plateau e l'aggiunta di più rAbs non avrà alcun effetto sulla quantità di antigene legato. In questo modello, la costante di dissociazione di equilibrio (KD) è la concentrazione di anticorpi che occupa la metà dei recettori dell'antigene17. Il KD rappresenta quanto bene un anticorpo si lega al suo bersaglio con un KD inferiore corrispondente a una maggiore affinità di legame. In precedenza è stato riportato che un rAb ideale dovrebbe avere un KD di 1 nanomolare o meno18. Tuttavia, rAbs più recenti sono stati sviluppati con KD nella gamma nanomolare bassa e sono considerati adatti per applicazioni di imaging non invasive 19,20,21,22. Un altro parametro che può essere determinato nel test di saturazione radioligidale di rAbs è Bmax, che corrisponde alla quantità massima di legame con l'antigene. Bmax può essere utilizzato per calcolare il numero di molecole di antigene, se necessario.

Figura 1: Curva di legame di saturazione rappresentativa. La percentuale di antigene legata è tracciata contro concentrazioni crescenti di anticorpi aggiunti a una quantità fissa di antigene. I pop-out dimostrano la rilegatura in vari punti. Vengono mostrate la concentrazione e il legame corrispondenti a KD e Bmax, rispettivamente. Questa figura è stata creata con BioRender.com. Fare clic qui per visualizzare una versione più grande di questa figura.
Questo test è particolarmente importante per i costrutti anticorpali bispecifici radiomarcati per determinare il KD per ciascun braccio della regione legante l'antigene (Fab) del legame dell'anticorpo bispecifico radiomarcato con i rispettivi antigeni. Questo protocollo può essere utilizzato per determinare il KD di ciascun braccio Fab separatamente su antigeni immobilizzati per caratterizzare in modo indipendente se l'affinità di legame di ciascun braccio Fab per il rispettivo antigene è stata influenzata dopo la radioconiugazione. Questo protocollo è dimostrato dall'uso di amivantamab radiomarcato, un anticorpo bispecifico per il recettore del fattore di crescita epidermico (EGFR) e le proteine di transizione mesenchimale-epiteliale citoplasmatica (cMET)19. Gli anticorpi a braccio singolo radiomarcati, in cui un braccio Fab si lega a EGFR (α-EGFR) o a cMET (α-cMET) e l'altro braccio Fab è un controllo isotipico, sono stati utilizzati anche come esempi19. Questo protocollo è anche appropriato per qualsiasi anticorpo radiomarcato con un antigene noto che può essere immobilizzato. In questo protocollo, una serie di diluizione del rAb viene aggiunta a una quantità fissa di antigene immobilizzato in pozzetti designati specifici per ciascun braccio Fab del rAb. Il rAb viene anche aggiunto a pozzetti che sono stati bloccati solo con albumina sierica bovina (BSA), senza antigene, per determinare il legame non specifico. Per determinare il legame specifico, il legame non specifico all'antigene immobilizzato viene sottratto dal legame totale rAb. La curva di legame di saturazione risultante viene quindi utilizzata per determinare KD, come descritto sopra.
Un vantaggio di questo metodo è una maggiore riproducibilità quando si utilizzano antigeni purificati rispetto all'utilizzo di linee cellulari come fonte di antigeni, dato che i livelli di espressione dell'antigene potrebbero essere influenzati durante la coltura cellulare e che diverse linee cellulari hanno livelli variabili di espressione dell'antigene. Nel caso di anticorpi bispecifici radiomarcati, le linee cellulari che esprimono solo uno degli antigeni senza l'altro potrebbero non essere disponibili, il che renderebbe molto impegnativa la caratterizzazione dell'affinità di legame dei singoli bracci Fab. In particolare, il vantaggio principale del metodo di saggio di saturazione radioligida rispetto ai metodi non radiomarcati è la caratterizzazione specifica dell'affinità di legame del rAb senza il contributo della frazione non coniugata del rAb. Per quanto a conoscenza degli autori, attualmente non esistono tecniche di purificazione per separare il rAb dal suo anticorpo genitore non coniugato. Date le dimensioni relativamente piccole del chelante e del radionuclide, il loro contributo al peso molecolare complessivo del rAb è insignificante nella cromatografia di esclusione dimensionale. Pertanto, il prodotto generato da qualsiasi tecnica di radioetichettatura è quasi sempre una miscela del rAb e del suo anticorpo genitore non coniugato. La caratterizzazione dell'affinità di legame utilizzando il test di saturazione radiomarcato garantisce che il prodotto da testare sia esclusivamente il rAb.
Protocollo
NOTA: fare riferimento alla Figura 2 per una rappresentazione grafica del protocollo.
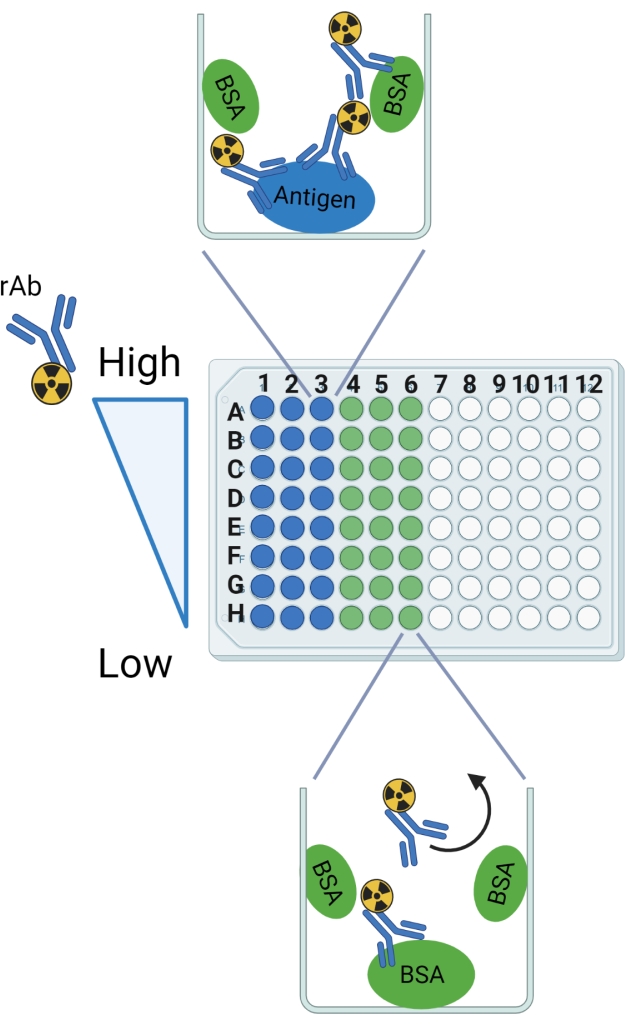
Figura 2: Schema del protocollo. Le etichette di riga e colonna sono indicate come guida per la configurazione della piastra frangibile a 96 pozzetti. Il legame anticipato è mostrato in un pozzo di esempio per l'antigene e la BSA. La freccia curva indica il rAb che dovrebbe essere lavato fuori dai pozzi solo con BSA. Questa figura è stata creata con BioRender.com. Fare clic qui per visualizzare una versione più grande di questa figura.
1. Preparazione del buffer
- Preparare 50 mL di tampone di immobilizzazione (soluzione acquosa di 50 mM Na2CO3; pH = 9,0).
- Pesare 191 mg di NaHCO3 e 23,9 mg di Na2CO3 sulla carta da pesare e trasferirli in un tubo conico da 50 ml. Aggiungere 40 ml di acqua da 18 MΩ e vortice per dissolvere. Regolare il pH a 9,0 se necessario prima di portare il volume totale a 50 mL con acqua 18 MΩ.
- Preparare circa 200 mL di tampone di lavaggio (soluzione salina tamponata con fosfato (PBS) contenente lo 0,05% di Tween-20) aggiungendo 200 mL di PBS e poi 100 μL di Tween-20 in un flacone da 250 mL.
- Preparare 50 ml di tampone legante (PBS contenente lo 0,05% di Tween-20 e lo 0,1% di albumina sierica bovina (BSA)).
- Pesare 50 mg di BSA su carta da pesare e trasferirli in un tubo conico da 50 ml. Aggiungere 50 mL di PBS e poi 25 μL di Tween-20 al tubo. Vortice delicatamente per mescolare.
- Preparare 50 ml di buffer di blocco (3% BSA in PBS).
- Pesare 1,5 g di BSA su carta da pesare e trasferirlo in un tubo conico da 50 ml. Aggiungere 50 ml di PBS e vorticare delicatamente per mescolare.
NOTA: si consiglia di conservare tutti i buffer per un massimo di 1 settimana a 4 °C per ottenere i migliori risultati.
- Pesare 1,5 g di BSA su carta da pesare e trasferirlo in un tubo conico da 50 ml. Aggiungere 50 ml di PBS e vorticare delicatamente per mescolare.
2. Immobilizzazione dell'antigene
- Diluire l'antigene nel tampone di immobilizzazione per raggiungere una concentrazione di 5 μg/mL.
- Aggiungere 100 μL per pozzetto di antigene sul fondo di 24 pozzetti di una piastra a fondo piatto a 96 pozzetti frangibili in un array 8 x 3 (colonne 1-3 per le righe A-H). Coprire la piastra con nastro sigillante.
NOTA: Assicurarsi che la superficie della piastra del pozzo sia stata trattata per massimizzare l'adsorbimento dei domini idrofobici e idrofili misti. Queste piastre pretrattate sono disponibili in commercio. - Incubare a 4 °C durante la notte.
- Il giorno seguente, lavare la piastra 3 volte con il tampone di lavaggio.
- Capovolgere rapidamente la piastra nel lavandino per smaltire il liquido e picchiettare la piastra su una pila di asciugamani di carta per rimuovere il liquido in eccesso.
- Utilizzando una pipetta multicanale, aggiungere 300 μL per pozzetto di tampone di lavaggio ai pozzetti contenenti l'antigene. Rimuovere il liquido come descritto al punto 2.4.1. Ripetere la fase di lavaggio per un totale di tre volte.
3. Blocco di siti non specifici con BSA
- Utilizzando una pipetta multicanale, aggiungere 300 μL per pozzetto di tampone di blocco ai 24 pozzetti rivestiti di antigene e ai 24 pozzetti vuoti della piastra a 96 pozzetti (colonne 1-6 per le righe A-H).
- Incubare la piastra per 1 ora a temperatura ambiente.
- Lavare la piastra con 300 μL per pozzetto di tampone di lavaggio per un totale di tre volte. Fare riferimento al passaggio 2.4 per una descrizione dettagliata del lavaggio della piastra.
4. Diluizioni seriali e aggiunta della soluzione rAb
ATTENZIONE: i seguenti passaggi riguardano la radioattività. I passaggi dovrebbero essere eseguiti solo da coloro che hanno una formazione sulla sicurezza delle radiazioni. I ricercatori dovrebbero raddoppiare il guanto ed eseguire passaggi con un'adeguata schermatura.
- Sintetizzare il rAb in esame utilizzando il metodo scelto. I rAb utilizzati come esempio sono stati sintetizzati come descritto in precedenza19.
NOTA: Questo protocollo si concentra sulla caratterizzazione di un rAb una volta radiomarcato. - Effettuare 8 diluizioni seriali 3 volte (designate per le file A-H sulla piastra) del rAb nel buffer di legame.
NOTA: Le concentrazioni delle diluizioni seriali varieranno per ogni rAb. I dettagli sono discussi nella sezione Discussione. Se il fattore di diluizione cambia, il volume necessario per ogni diluizione deve essere ricalcolato per garantire un volume sufficiente per 1) legame del rAb in ciascun pozzetto, 2) semina della successiva diluizione e 3) aliquota di una soluzione standard rAb per il conteggio gamma per misurare la radioattività del rAb totale aggiunto a ciascun pozzetto.- Calcolare il volume di stock rAb necessario per produrre una soluzione da 1,2 ml della prima concentrazione (etichetta come A).
- Aggiungere 800 μL di tampone legante ai tubi microcentrifuga etichettati B, C, D, ... a H. Aggiungere 1,2 ml meno il volume calcolato nel punto 4.2.1 del tampone di legame a un tubo di microcentrifuga etichettato A.
- Aggiungere il volume di stock rAb calcolato in 4.2.1 al tubo A. Vortice delicatamente per mescolare e poi girare verso il basso usando una mini microcentrifuga per raccogliere tutto il liquido sul fondo del tubo.
- Aggiungere 400 μL dal tubo A al tubo B. Vortice per mescolare e poi girare verso il basso usando una mini microcentrifuga. Ripeti aggiungendo da B a C, da C a D, ..., da G a H.
- Aggiungere 100 μL per pozzetto di ogni diluizione a tre pozzetti immobilizzati con antigene e tre pozzetti bloccati solo con BSA. Ad esempio, aggiungere la diluizione A ai pozzetti A1-A3 (antigene) e A4-A6 (BSA).
- Aggiungere 100 μL di ciascuna diluizione ai tubi di microcentrifuga etichettati A std - H std. Salvare questi tubi come standard rAb da analizzare nel contatore gamma.
- Incubare la piastra per 1 ora a 37 °C con un leggero dondolo.
5. Lavare le piastre e testare la radioattività
- Etichettare i tubi microcentrifuga per ogni pozzo (da A1 ad A6, da B1 a B6 ... attraverso H1-H6). Utilizzare due diversi marcatori colorati per codificare i campioni a colori, se lo si desidera: uno per i pozzetti rivestiti di antigene e uno solo per i pozzetti con BSA.
- Aspirare il rAb da ciascun pozzo utilizzando un aspiratore a vuoto.
- Utilizzando una pipetta multicanale, aggiungere 300 μL di tampone di lavaggio a ciascun pozzetto. Aspirare il tampone di lavaggio. Ripetere il lavaggio per un totale di cinque volte.
- Rompere i pozzetti negli appositi tubi microcentrifuga.
- Contare la radioattività nei tubi usando un contatore gamma. Contare prima i tubi con l'antigene (H1, H2, da H3 ad A1, A2, A3), e poi quelli con solo BSA (H4, H5, H6 ad A4, A5, A6). Per ridurre al minimo le interferenze, contare separatamente gli standard per ogni diluizione (da H std a A std) in un momento diverso.
6. Analisi dei dati
NOTA: i file supplementari contengono fogli di calcolo corrispondenti e modelli di analisi statistica per l'analisi e il plottaggio dei dati.
- In un foglio di calcolo, calcolare l'associazione totale, specifica e non specifica per ogni campione (vedere il modello di foglio di calcolo allegato come file supplementare).
- Calcola "Bound Activity" come i conteggi al minuto (CPM) del campione (ottenuto dal contatore gamma) diviso per il CPM dello standard appropriato. Calcola "% Bound" come Attività vincolata volte 100.
- Calcola "Total Bound, mol/L" moltiplicando "% Bound" per la concentrazione (mol/L) del rAb aggiunto. Calcola "Total Bound, mol" moltiplicando "Total Bound, mol/L" per il volume di rAb aggiunto in litri (0,0001 L).
- Calcola "Specific Binding, mol" sottraendo "Total Bound, mol" delle diluizioni BSA dalle diluizioni dell'antigene in modo tale che A1 si abbini a A4, A2 con A5, A3 con A6, B1 con B4, ecc.
- Calcola "Legame non specifico, mol" sottraendo "Legame specifico, mol" da "Legame totale, mol" per ogni pozzo.
- Nel software di tracciamento dell'analisi statistica, tracciare la concentrazione di rAb aggiunto (nmol/ L) sull'asse x rispetto al legame (mol) sull'asse y. Creare gruppi separati per tracciare in triplice copia l'associazione totale, l'associazione specifica e l'associazione non specifica. Eseguire un'analisi di adattamento non lineare selezionando i seguenti parametri nel software utilizzato (Tabella dei materiali; vedere il modello di analisi statistica allegato come file supplementare).
- Selezionate Nuova analisi (New Analysis). In Analisi XY selezionare Regressione non lineare (adattamento della curva). Assicurarsi che tutti i dati siano selezionati in Analizza quali set di dati? e quindi selezionare OK.
- Nella scheda Modello , in Binding - Saturazione, selezionare Un sito - Binding specifico. Nella scheda Confidenza , seleziona Identifica adattamenti "ambigui". Lasciare tutti gli altri parametri come predefiniti e selezionare Ok.
NOTA: questo calcolerà KD e Bmax per il binding totale, specifico e non specifico. Il KD del legame specifico è il KD in nmol/L del rAb legato all'antigene.
Risultati
Questo metodo calcola l'affinità di legame (KD) per un rAb in base al saggio di legame di saturazione in cui diverse concentrazioni di rAb sono state aggiunte a una quantità fissa di antigene immobilizzato. La curva di legame dovrebbe seguire la crescita logaritmica dove è inizialmente ripida e poi si stabilizza quando l'antigene è saturo. Per garantire che il KD determinato sia accurato, le concentrazioni di rAb devono essere abbastanza alte da raggiungere la saturazione. Per questo test, gli a...
Discussione
Come parte dello sviluppo di rAbs, è importante garantire che un rAb si leghi specificamente al suo target con un'elevata affinità di legame. La determinazione dell'affinità di legame può informare se l'immunoreattività del rAb è influenzata dalla radioconiugazione attraverso il test di saturazione del radioligato utilizzando l'antigene immobilizzato. La determinazione del legame di rAb alla BSA può essere utilizzata per quantificare il legame non specifico per misurare il legame specifico all'antigene immobilizza...
Divulgazioni
Gli autori non hanno conflitti di interesse.
Riconoscimenti
Gli autori ringraziano 3D Imaging per la produzione di [89Zr]Zr-ossalato e la dottoressa Sheri Moores di Janssen Pharmaceuticals per aver fornito anticorpi.
Materiali
| Name | Company | Catalog Number | Comments |
| Bovine Serum Albumin (BSA) | Sigma-Aldrich | A9647 | |
| Gamma Counter | Hidex | Hidex Automatic Gamma Counter | |
| GraphPad Prism Software | GraphPad | version 9.2; used for statistical analyses in this study | |
| Immuno Breakable MaxiSorp 96-well plates | Thermo Scientific | 473768 | |
| Microplate Sealing Tape | Corning | 4612 | |
| Microsoft Excel | Microsoft | ||
| Phosphate Buffered Saline (PBS) | Gibco | 14190144 | |
| Sodium Bicarbonate | JT Baker | 3506-01 | |
| Sodium Carbonate | Sigma-Aldrich | S7795 | |
| Tween-20 | Sigma-Aldrich | P7949 |
Riferimenti
- Krecisz, P., Czarnecka, K., Krolicki, L., Mikiciuk-Olasik, E., Szymanski, P. Radiolabeled Peptides and Antibodies in Medicine. Bioconjugate Chemistry. 32 (1), 25-42 (2021).
- Dun, Y., Huang, G., Liu, J., Wei, W. ImmunoPET imaging of hematological malignancies: From preclinical promise to clinical reality. Drug Discovery Today. 27 (4), 1196-1203 (2022).
- Lohrmann, C., et al. Retooling a Blood-Based Biomarker: Phase I assessment of the high-affinity CA19-9 antibody HuMab-5B1 for immuno-pet imaging of pancreatic cancer. Clinical Cancer Research. 25 (23), 7014-7023 (2019).
- Pandit-Taskar, N., et al. A phase I/II study for analytic validation of 89Zr-J591 immunoPET as a molecular imaging agent for metastatic prostate cancer. Clinical Cancer Research. 21 (23), 5277-5285 (2015).
- Rousseau, C., et al. Initial clinical results of a novel immuno-PET theranostic probe in human epidermal growth factor receptor 2-negative breast cancer. Journal of Nuclear Medicine. 61 (8), 1205-1211 (2020).
- Moek, K. L., et al. Theranostics using antibodies and antibody-related therapeutics. Journal of Nuclear Medicine. 58 (2), 83-90 (2017).
- Chomet, M., van Dongen, G., Vugts, D. J. State of the art in radiolabeling of antibodies with common and uncommon radiometals for preclinical and clinical immuno-PET. Bioconjugate Chemistry. 32 (7), 1315-1330 (2021).
- Kumar, K., Ghosh, A. Radiochemistry, production processes, labeling methods, and immunoPET imaging pharmaceuticals of Iodine-124. Molecules. 26 (2), 414 (2021).
- Vosjan, M. J., et al. Conjugation and radiolabeling of monoclonal antibodies with zirconium-89 for PET imaging using the bifunctional chelate p-isothiocyanatobenzyl-desferrioxamine. Nature Protocols. 5 (4), 739-743 (2010).
- Zeglis, B. M., Lewis, J. S. The bioconjugation and radiosynthesis of 89Zr-DFO-labeled antibodies. Journal of Visualized Experiments: JoVE. (96), e52521 (2015).
- Wei, W., et al. ImmunoPET: concept, design, and applications. Chemical Reviews. 120 (8), 3787-3851 (2020).
- Tavaré, R., et al. An effective immuno-PET imaging method to monitor CD8-dependent responses to immunotherapy. Cancer Research. 76 (1), 73-82 (2016).
- Tavaré, R., et al. Engineered antibody fragments for immuno-PET imaging of endogenous CD8+ T cells in vivo. Proceedings of the National Academy of Sciences. 111 (3), 1108-1113 (2014).
- Zeglis, B. M., et al. Chemoenzymatic strategy for the synthesis of site-specifically labeled immunoconjugates for multimodal PET and optical imaging. Bioconjugate Chemistry. 25 (12), 2123-2128 (2014).
- Zeglis, B. M., et al. Enzyme-mediated methodology for the site-specific radiolabeling of antibodies based on catalyst-free click chemistry. Bioconjugate Chemistry. 24 (6), 1057-1067 (2013).
- Kristensen, L. K., et al. Site-specifically labeled 89Zr-DFO-trastuzumab improves immuno-reactivity and tumor uptake for immuno-PET in a subcutaneous HER2-positive xenograft mouse model. Theranostics. 9 (15), 4409-4420 (2019).
- Maguire, J. J., Kuc, R. E., Davenport, A. P., Davenport, A. P. . Radioligand binding assays and their analysis. in Receptor Binding Techniques. , 31-77 (2012).
- Davenport, A. P., Russell, F. D., Mather, S. J. Radioligand bindsing assays: theory and practice. Current Directions in Radiopharmaceutical Research and Development. , 169-179 (1996).
- Cavaliere, A., et al. Development of [89Zr]ZrDFO-amivantamab bispecific to EGFR and c-MET for PET imaging of triple negative breast cancer. European Journal of Nuclear Medicine and Molecular Imaging. 48 (2), 383-394 (2021).
- Marquez, B. V., et al. Evaluation of (89)Zr-pertuzumab in breast cancer xenografts. Molecular Pharmaceutics. 11 (11), 3988-3995 (2014).
- Marquez-Nostra, B. V., et al. Preclinical PET imaging of glycoprotein non-metastatic melanoma B in triple negative breast cancer: feasibility of an antibody-based companion diagnostic agent. Oncotarget. 8 (61), 104303-104314 (2017).
- Ghai, A., et al. Development of [(89)Zr]DFO-elotuzumab for immunoPET imaging of CS1 in multiple myeloma. European Journal of Nuclear Medicine and Molecular Imaging. 48 (5), 1302-1311 (2021).
- McKnight, B. N., et al. Imaging EGFR and HER3 through (89)Zr-labeled MEHD7945A (Duligotuzumab). Scientific Reports. 8 (1), 1-13 (2018).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneThis article has been published
Video Coming Soon