Un abonnement à JoVE est nécessaire pour voir ce contenu. Connectez-vous ou commencez votre essai gratuit.
Method Article
Conception d’un bioréacteur pour améliorer l’acquisition de données et modéliser le débit des tissus cardiaques modifiés
Dans cet article
Résumé
Les tissus cardiaques tridimensionnels issus de la bio-ingénierie à l’aide de cardiomyocytes dérivés de cellules souches sont apparus comme des modèles prometteurs pour l’étude in vitro du myocarde humain sain et malade, tout en récapitulant les aspects clés de la niche cardiaque native. Ce manuscrit décrit un protocole de fabrication et d’analyse de tissus cardiaques artificiels à haut contenu générés à partir de cardiomyocytes induits pluripotents dérivés de cellules souches humaines.
Résumé
L’insuffisance cardiaque reste la principale cause de décès dans le monde, ce qui crée un besoin pressant de meilleurs modèles précliniques du cœur humain. L’ingénierie tissulaire est cruciale pour la recherche fondamentale en cardiologie. La culture de cellules humaines in vitro élimine les différences interspécifiques des modèles animaux, tandis qu’un environnement 3D plus semblable à celui des tissus (par exemple, avec une matrice extracellulaire et un couplage hétérocellulaire) simule les conditions in vivo dans une plus grande mesure que la culture bidimensionnelle traditionnelle sur des boîtes de Pétri en plastique. Cependant, chaque système modèle nécessite un équipement spécialisé, par exemple des bioréacteurs conçus sur mesure et des dispositifs d’évaluation fonctionnelle. De plus, ces protocoles sont souvent compliqués, laborieux et en proie à la défaillance des petits tissus délicats.
Cet article décrit un processus de génération d’un système modèle robuste de tissu cardiaque artificiel (hECT) utilisant des cardiomyocytes pluripotents induits dérivés de cellules souches pour la mesure longitudinale de la fonction tissulaire. Six hECT avec une géométrie linéaire de bande sont cultivés en parallèle, chaque hECT étant suspendu à une paire de poteaux en polydiméthylsiloxane (PDMS) à détection de force fixés à des racks PDMS. Chaque poste est recouvert d’un suivi de poste stable PDMS (SPoT) noir, une nouvelle fonctionnalité qui améliore la facilité d’utilisation, le débit, la rétention des tissus et la qualité des données. La forme permet un suivi optique fiable des déviations des poteaux, ce qui permet d’améliorer les tracés de la force de contraction avec une tension active et passive absolue. La géométrie du capuchon élimine les défaillances tissulaires dues au glissement des hECT des poteaux, et comme ils impliquent une deuxième étape après la fabrication du rack PDMS, les SPoT peuvent être ajoutés aux conceptions PDMS existantes basées sur les poteaux sans modifications majeures du processus de fabrication du bioréacteur.
Le système est utilisé pour démontrer l’importance de mesurer la fonction hECT à des températures physiologiques et montre une fonction tissulaire stable pendant l’acquisition des données. En résumé, nous décrivons un système modèle de pointe qui reproduit les conditions physiologiques clés pour faire progresser la biofidélité, l’efficacité et la rigueur des tissus cardiaques modifiés pour des applications in vitro .
Introduction
Les modèles de tissus cardiaques modifiés se présentent sous la forme d’un large éventail de géométries et de configurations permettant de récapituler divers aspects de la niche cardiaque native qui sont difficiles à atteindre avec la culture cellulaire bidimensionnelle traditionnelle. L’une des configurations les plus courantes est la bande de tissu linéaire, avec des ancrages flexibles à chaque extrémité pour induire l’auto-assemblage des tissus et fournir au tissu une précharge définie et une lecture des forces de contraction résultantes 1,2,3,4,5,6,7,8,9,10,11, 12,13,14,15,16,17,18,19,20,21
,22,23,24,25,26,27. La force générée peut être déterminée de manière robuste grâce au suivi optique du raccourcissement des tissus et à l’utilisation de la théorie des faisceaux élastiques pour calculer la force à partir des flèches mesurées et de la constante de ressort des ancrages 1,2,3,4,5,6,7,8,9,10,11, 12,13,14,15,16,17,18,19,20,
21,22,25,26,28.
Cependant, l’ingénierie des tissus cardiaques est encore un domaine en constante évolution, et certains défis demeurent. Des équipements spécialisés, tels que des bioréacteurs sur mesure et des dispositifs d’évaluation fonctionnelle, sont nécessaires pour chaque système modèle 10,29,30,31. La taille et la complexité du microenvironnement de ces constructions sont souvent limitées par un faible débit en raison de protocoles à forte intensité de main-d’œuvre, d’un nombre élevé de cellules et de la fragilité des tissus. Pour y remédier, certains groupes se sont tournés vers la fabrication de microtissus ne contenant que des centaines ou des milliers de cellules afin de faciliter les tests à haut débit utiles à la découverte de médicaments. Cependant, cette échelle réduite complique l’évaluation précise de la fonction12, élimine des aspects clés de la niche cardiaque native (tels que les gradients de diffusion des nutriments et de l’oxygène et l’architecture complexe36) et limite la quantité de matériel disponible pour l’analyse moléculaire et structurale ultérieure (nécessitant souvent la mise en commun des tissus). Le tableau 1 résume certaines des configurations des modèles linéaires de bandelettes tissulaires dans la littérature 1,2,3,4,5,6,7,8,9,10,11,12,13,14,15, 16,17,18,19,20,
21,22,23,24,25,26,37,38,39,40.
| Groupe | Cellules par tissu | Mouchoirs par plaque | Format de la plaque | Fonction d’ancrage | Procédé d’acquisition de données fonctionnelles | Bain multimédia partagé ? | Mesure fonctionnelle in situ ? | ||||
| Yoshida (ECT)38 | 4 millions | 6 | Plaque modifiée à 6 puits* | capteur de force | Mesure directe de la force | Non | Non | ||||
| Chan (hESC-CM-ECTs)26 | 310 millier | 6 | Plat personnalisé à 6 puits | Poteaux PDMS | Mesure directe de la force | oui | Non | ||||
| Feinberg (dyn-EHT)16 | 1,5 million | 6 | Plat personnalisé à 6 puits | Fil PDMS | forme des tissus | Non | oui | ||||
| RADISIC (BioWire)39, 40 | 110 millier | 8 | fil polymère | Forme du fil | oui | oui | |||||
| Costa (hECT simple)1, 2 | 1 à 2 millions | 4** | Boîte de Pétri de 10 cm** | Poteaux PDMS | Déviation optique (suivi des bords/objets) | oui | oui | ||||
| Costa (multi-hECT)3–9 | 500 k-1 million | 6 | Boîte de Pétri de 6 cm | Poteaux PDMS | Déviation optique (suivi des bords/objets) | oui | oui | ||||
| Costa (multi-hECT avec SPoT) | 1 million | 6 | Boîte de Pétri de 6 cm | Poteaux PDMS avec capuchons noirs | Déviation optique (suivi d’objet) | oui | oui | ||||
| Passier (EHT)17 | 245 millier | 36 | Plaque à 12 puits | Poteaux PDMS avec capuchons noirs | Déviation optique (suivi d’objet) | oui | oui | ||||
| Vunjak-Novakovic13, 18 | 1 million | 12 | Boîte de Pétri de 6 cm | Poteaux PDMS avec capuchons | Déviation optique (détection des bords) | oui | oui | ||||
| Vunjak-Novakovic (MilliPilier)14 | 550 millier | 6 | Plat personnalisé à 6 puits | Poteaux PDMS avec capuchons | déviation optique (suivi d’objet) ; Imagerie calcique | Non | oui | ||||
| Eschenhagen (EHT)10, 19–21 | 1 million | 12 | Plaque à 12 puits | Poteaux PDMS avec capuchons | déviation optique (détection des bords de la déviation post) ; Imagerie calcique | Non | oui | ||||
| Zandstra (CaMiRi)22 | 25 à 150 milles | 96 | Plaque à 96 puits | Poteaux PDMS avec crochets | Déviation optique (détection des bords) | Non | oui | ||||
| Murry23, 24 | 900 millier | 24 | Plaque à 24 puits | Poteaux PDMS avec capuchons, aimant intégré | Capteur magnétique | Non | oui | ||||
| Reich (μTUG)11, 12, 25 | indéfini | 156 | Antenne parabolique à 156 puits | Poteaux PDMS avec capuchons, aimant intégré | Suivi optique (bille fluorescente) | oui | oui | ||||
Tableau 1 : Caractéristiques de certains modèles linéaires de tissus cardiaques dans la littérature. Les modèles linéaires de tissus cardiaques varient en termes de taille, de débit, de conception des caractéristiques d’ancrage et de facilitation des bains moyens partagés, ainsi que des exigences d’un système de bain musculaire séparé pour la caractérisation fonctionnelle. * Les chercheurs ont utilisé un système de tissus artificiels disponible dans le commerce basé sur les dimensions d’une plaque standard à 6 puits. ** Un système modulaire dans lequel des bioréacteurs à tissu unique sont ancrés à n’importe quelle boîte de culture en plastique dans le nombre et l’emplacement souhaités.
Cet article décrit le dernier protocole pour la fabrication de notre modèle établi de tissu cardiaque linéaire d’ingénierie humaine (hECT)1,2,3,4,5,6,7,8,9,15,27 et des méthodes d’évaluation de la fonction contractile de l’hECT. Chaque bioréacteur multi-tissus peut accueillir jusqu’à six hECT dans un bain de milieu partagé et est composé de deux pièces « rack » en polydiméthylsiloxane élastomère de silicone (PDMS) montées sur un châssis rigide en polysulfone. Chaque rack PDMS contient six poteaux flexibles intégrés à détection de force de 0,5 mm de diamètre et de 3,25 mm de long, et ensemble, deux racks fournissent six paires de poteaux, chacun contenant un hECT. L’inversion du bioréacteur permet de surmonter tout obstacle à la visualisation des hECTs par le bas en raison de la condensation de l’eau du milieu de culture ou des distorsions du ménisque de l’interface air-liquide. Chaque contraction d’un hECT provoque une déviation des bornes intégrées, et la mesure optique du signal de déviation est traitée en un traçage de la force en fonction du temps représentant la fonction contractile de l’hECT 1,2,3,4,5,6,7,8,9,15,27 . Par rapport aux bioréacteurs à tissu unique généralement utilisés pour les tissus de cette taille, la conception multi-tissus améliore le débit expérimental et permet l’étude de la signalisation paracrine entre des tissus adjacents de composition cellulaire potentiellement différente. Ce système a été validé dans des études publiées décrivant des applications dans la modélisation des maladies 4,8, la signalisation paracrine 6,7, la culture hétérocellulaire 5,9 et le criblage thérapeutique 7,9.
Dans ce système, les hECT sont conçus pour avoir une longueur d’environ 6 mm et un diamètre de 0,5 mm afin de faciliter un suivi optique robuste des mesures de force avec un faible bruit. De plus, les aspects de la complexité tissulaire tels que les gradients de diffusion et l’organisation cellulaire sont équilibrés avec un besoin gérable de 1 million de cellules par tissu. Avec la technologie de caméra CCD standard, des forces aussi faibles que 1 μN (représentant moins de 5 μm après la déviation) génèrent un signal clair, garantissant que même une fonction contractile extrêmement faible, telle qu’observée avec certains modèles de maladie hECT, peut être mesurée avec précision. Cela facilite également l’analyse détaillée de la courbe de force de contraction, permettant ainsi l’analyse à haut contenu d’un maximum de 16 paramètres de contractilité41, y compris la force développée, les taux de contraction (+dF/dt) et de relaxation (−dF/dt), et la variabilité de la vitesse de battement.
Ce protocole commence par des instructions pour la fabrication des composants du bioréacteur. Une attention particulière est accordée aux étapes permettant de maximiser le rendement de l’hECT, de réduire la variabilité technique de la fonction tissulaire et d’optimiser la qualité et la profondeur de l’évaluation tissulaire. La plupart des études d’ingénierie des tissus cardiaques ne font pas état de taux de perte de tissus au cours de la fabrication et des tests à long terme, bien qu’il s’agisse d’un défi bien connu sur le terrain et qu’il réduise le débit et l’efficacité des études27. Les méthodes d’ingénierie tissulaire décrites ici ont été affinées au fil des ans pour assurer la rétention de tous les hECT dans la plupart des bioréacteurs (quelle que soit la façon dont les racks PDMS sont fabriqués). Cependant, même une perte de 5 à 20 % de tissus peut affecter considérablement la puissance statistique, en particulier dans les petites expériences limitées par le nombre de cardiomyocytes disponibles (par exemple, en raison de problèmes de différenciation avec certaines lignées cellulaires malades4 ou en raison du coût élevé des cardiomyocytes achetés dans le commerce), ou par les conditions de traitement (par exemple, la disponibilité limitée ou le coût élevé de divers composés de traitement).
Ce protocole décrit la fabrication de trackers de poteaux stables (SPoT), une nouvelle fonctionnalité des racks PDMS, qui fonctionnent comme des capuchons aux extrémités des poteaux de détection de force qui maintiennent les hECT27. Il est démontré comment la géométrie du capuchon réduit considérablement la perte d’hECT due à la chute ou à l’arrachement des poteaux, ouvrant ainsi de nouvelles possibilités pour la culture d’hECT avec une plus grande variété de rigidités et de tensions, qui sont difficiles à cultiver sur des poteaux non coiffés. De plus, les SPoT fournissent un objet à contraste élevé pour améliorer le suivi optique de la contraction de l’hECT grâce à une forme cohérente et bien définie27. Ceci est suivi d’une description de la culture des cellules souches pluripotentes induites humaines (CSPi) et de la différenciation des cardiomyocytes basée sur des protocoles publiés antérieurement 3,42,43 et d’une explication de la fabrication, de la culture et des mesures fonctionnelles de l’hECT.
Cet article traite également de la nécessité de mesurer la fonction tissulaire à la température physiologique. Le myocarde humain (tissus sains et malades du fœtus et de l’adulte), ainsi que le tissu cardiaque d’un large éventail d’espèces animales (y compris les rats, les chats, les souris, les furets et les lapins)44,45, présentent une augmentation marquée de la force de contraction adaptée à la fréquence à des températures de 28 °C à 32 °C par rapport à la température physiologique - un phénomène connu sous le nom d’inotropie hypothermique45, Chapitre 46. Cependant, les effets de la température sur la fonction du tissu myocardique artificiel restent peu étudiés. De nombreux modèles récents de tissus cardiaques modifiés dans la littérature sont conçus pour être évalués fonctionnellement à 37 °C afin de se rapprocher des conditions physiologiques 13,14,37. Cependant, à notre connaissance, les effets dépendants de la température sur la force générée par les tissus cardiaques modifiés n’ont pas été systématiquement étudiés. Ce protocole décrit une conception d’électrode de stimulation qui minimise les pertes de chaleur pendant les essais, tout en permettant l’incorporation d’un élément chauffant isolé dans l’installation pour les mesures fonctionnelles, ce qui peut maintenir les hECT à la température physiologique sans compromettre la stérilité27. Nous rapportons ensuite certains des effets observés de la température sur la fonction hECT, y compris sur la force développée, la fréquence des battements spontanés, +dF/dt et −dF/dt. Dans l’ensemble, cet article fournit les détails nécessaires à la fabrication de ce système de bioréacteur multi-tissu à détection de force pour fabriquer des tissus cardiaques modifiés chez l’homme et pour évaluer leur fonction contractile, et un ensemble de données est présenté qui fournit une base de comparaison pour les mesures à température ambiante et à 37 °C27.
Protocole
Ce protocole utilisait une lignée anonymisée de CSPi, SkiPS 31.3 (reprogrammée à l’origine à l’aide de fibroblastes dermiques provenant d’un homme de 45 ans en bonne santé)47, et était donc exempté de l’approbation spécifique du comité d’examen institutionnel, conformément aux lignes directrices du comité d’éthique de la recherche sur des êtres humains de l’établissement. Effectuez toutes les manipulations de cellules et d’hECT dans des conditions aseptiques dans une enceinte de sécurité biologique de classe II filtrée HEPA ou un banc de travail à flux laminaire. Stériliser toutes les solutions non stériles par filtration à travers un filtre de 0,22 μm, et maintenir toutes les cellules et les hECT dans un incubateur à 37 °C, 95 % d’humidité relative et 5 % de CO2.
1. Fabrication de bioréacteurs
- Composants de bioréacteurs et fabrication de pièces moulées en aluminium
NOTA : Les fichiers de conception assistée par ordinateur (CAO) sont fournis dans le fichier supplémentaire 1. Le protocole peut être mis en pause n’importe où entre ces étapes. Il est recommandé de faire appel à un machiniste professionnel pour fabriquer les moules maîtres décrits dans cette section, car des tolérances élevées (≤5 μm) et une finition lisse sont nécessaires pour une géométrie précise des poteaux et pour un ajustement correct des cadres en polysulfone aux plaques de base en polytétrafluoroéthylène (PTFE) (en visant un ajustement serré par friction, mais pas trop serré).- À l’aide d’une fraiseuse à commande numérique par ordinateur (CNC), usinez la plaque de base en PTFE selon les schémas de la figure 1A. Les hECTs seront formés dans les six puits régulièrement espacés (flèches blanches).
- À l’aide d’une fraiseuse CNC, usinez le polydiméthylsiloxane (PDMS) en aluminium selon les schémas de la figure 1B, avec trois supports de cadre (astérisques verts). Percez six trous régulièrement espacés (pointes de flèches magenta) de 0,5 mm de diamètre pour créer les poteaux PDMS.
- À l’aide d’une fraiseuse CNC, usinez le châssis du bioréacteur en polysulfone selon les schémas de la figure 1C. Les supports de cadre (astérisques verts) correspondent aux supports de cadre vus dans le moulage de la crémaillère (Figure 1B, astérisques verts).
- À l’aide d’une fraiseuse CNC, usinez le support en fonte d’aluminium en aluminium selon les schémas de la figure 1D. Chaque emplacement contient une étagère triangulaire (triangle orange) de 0,25 mm de hauteur pour fournir un espace mort permettant au PDMS de s’écouler à travers les trous des moulages de rack PDMS (Figure 1B, pointes de flèches magenta).
- Moulage du rack PDMS à partir des masters négatifs en aluminium
- À l’aide d’une imprimante 3D de modélisation par dépôt de fil fondu thermoplastique, imprimez deux supports d’appareil de moulage en rack PDMS (fichier supplémentaire 1). Utilisez les paramètres d’impression suivants : une hauteur de couche de 0,1 mm, une épaisseur de paroi/bas/haut de 1 mm, une densité de remplissage de 90 % avec des triangles, une température d’impression de 230 °C, une température de plaque de construction de 70 °C et un bord pour l’adhérence.
- Placez quatre moulages principaux négatifs en aluminium dans le support de moulage (Figure 2AI) de manière à ce que les trous de poteau s’alignent avec l’espace mort opposé aux étagères triangulaires (voir Figure 1D). Enveloppez l’appareil dans une pièce rectangulaire de feuille de silicone de 0,5 mm d’épaisseur (Figure 2B, flèches blanches) en guise de joint d’étanchéité pour éviter toute fuite du liquide PDMS et serrez-le entre deux supports parallèles imprimés en 3D à l’aide d’une pince à vis.
- Ajouter 0,5 mL d’agent de durcissement PDMS à 5 mL d’élastomère PDMS (rapport 1 :10, selon les instructions du fabricant) dans un récipient peu profond et mélanger vigoureusement pendant 5 min. Dégazer le mélange PDMS dans une chambre à vide et appliquer un vide puissant (0,1 à 1 kPa) pendant 20 à 60 minutes à température ambiante ou jusqu’à ce que les bulles disparaissent.
- Versez le mélange PDMS sur l’appareil de coulée, en le remplissant en surplus pour assurer la couverture complète de chaque fente (Figure 2AII). Si vous le souhaitez, ajoutez de petites billes de verre colorées sur le corps des racks PDMS (Figure 2AII), à l’opposé du côté avec les poteaux (Figure 2B), pour l’identification unique de chaque rack PDMS. Remettez l’appareil de coulée dans la chambre à vide (en veillant à ce qu’elle soit horizontalement de niveau) et appliquez un vide puissant pendant au moins 12 h. Laissez le PDMS durcir à température ambiante pendant environ 48 h à l’abri de la poussière pour permettre un durcissement complet et une résistance maximale des tenons délicats. Évitez d’utiliser un four car cela déforme les composants imprimés en 3D.
REMARQUE : Le protocole peut être mis en pause ici.
- Retrait de la crémaillère PDMS des pièces maîtresses négatives en aluminium
- Retirez la pince, les supports et la feuille de silicone de l’appareil de coulée. À l’aide d’une lame de rasoir en acier inoxydable, coupez le film PDMS sur le dessus de l’appareil de coulée et des supports de cadre, et utilisez doucement les doigts pour séparer les supports PDMS des côtés du support de coulée. Insérez une lame de rasoir en acier inoxydable émoussée dans l’espace mort entre le moulage et le porte-moulage, et écartez-les (Figure 2CI, II), en veillant à ce que le PDMS remplissant l’espace mort reste avec le support de coulée (car celui-ci est fixé aux poteaux). À l’aide d’une lame tranchante en acier inoxydable, découpez les pellicules PDMS restantes et coupez l’espace mort PDMS à partir de l’extrémité des poteaux (figure 2C III-V).
- ÉTAPE CRITIQUE : Libérez le rack PDMS de la fonte (Figure 2D). En commençant par le côté opposé aux poteaux, utilisez les doigts pour séparer lentement le rack PDMS du moulage, en travaillant sur des côtés alternés jusqu’à ce que les poteaux soient libérés des moulages principaux.
- Répétez l’étape précédente jusqu’à ce que tous les racks PDMS et tous les postes soient libérés. Utilisez une lame de rasoir bien aiguisée pour couper tout excédent de PDMS restant des racks. Le résultat est un support PDMS (figure 2E) avec six poteaux intacts (pointes de flèches orange) et des perles colorées (flèche bleue) pour l’identification.
REMARQUE : Le protocole peut être mis en pause ici.
- Fabrication de trackers de poteaux stables (SPoT)
- À l’aide d’une imprimante 3D de modélisation par dépôt de fil fondu thermoplastique, imprimez les composants de l’appareil de coulée SPoT (Fichier supplémentaire 2 et Figure 3AI, II). Utilisez les paramètres d’impression suivants : une hauteur de couche de 0,1 mm, une épaisseur de paroi/bas/haut de 1 mm, une densité de remplissage de 80 % avec des triangles, une température d’impression de 230 °C, une température de plaque d’impression de 70 °C et un bord pour l’adhérence.
- Assurez-vous d’un ajustement sûr entre les pièces imprimées en 3D, ainsi qu’entre les racks PDMS et le gabarit à trois dents, et confirmez que les racks PDMS s’adaptent parfaitement aux poteaux qui atteignent juste le fond des puits sans être pliés. Coupez/limez le plastique si nécessaire.
- Ajouter 0,5 mL de PDMS noir partie A à 0,5 mL de partie B (rapport 1 :1, selon les instructions du fabricant) dans un petit bateau de pesée (ou un petit récipient peu profond similaire) et bien mélanger jusqu’à ce que la couleur soit uniforme. Dégazer le PDMS noir mélangé dans une chambre à vide sous vide intense pendant 20 min. Versez le PDMS noir dégazé sur la base imprimée en 3D pour remplir les trous, et tapotez pour vous assurer qu’il ne reste pas de bulles. Grattez autant que possible l’excédent de PDMS de la base.
- Enclenchez la pièce à trois dents sur la base et placez les supports PDMS dans les rainures du gabarit à trois dents (figure 3AII, rectangle turquoise), en veillant à ce que les extrémités des poteaux plongent dans le PDMS noir dans les puits circulaires (figure 3B, C). Durcir le PDMS noir à température ambiante et à l’abri de la poussière pendant 48 h.
REMARQUE : Le protocole peut être mis en pause ici. - Faites glisser la pièce à trois branches, en minimisant la tension sur les poteaux. Utilisez de petites pinces pour gratter la fine pellicule de PDMS noire qui entoure chaque SPoT ; Ensuite, insérez des pinces courbées à pointe fine dans le puits SPoT pour le libérer de la base imprimée en 3D (Figure 3D).
- Inspectez les SPoT (Figure 3E) et coupez tout film PDMS noir restant du processus de coulée qui n’a pas été retiré à l’étape 1.4.5 à l’aide de ciseaux Vannas fins. Assurez-vous que les poteaux finis sont de la bonne longueur en installant les racks PDMS sur le cadre en polysulfone, puis en le faisant glisser sur la plaque de base noire (Figure 4A).
REMARQUE : Le protocole peut être mis en pause ici. - Associez les racks PDMS et ajoutez-les au cadre à l’aide des languettes du cadre (Figure 4A). Autoclaver dans un sac avec une plaque de base en PTFE pendant un cycle d’au moins 30 minutes (<122 °C pour réduire le gauchissement).
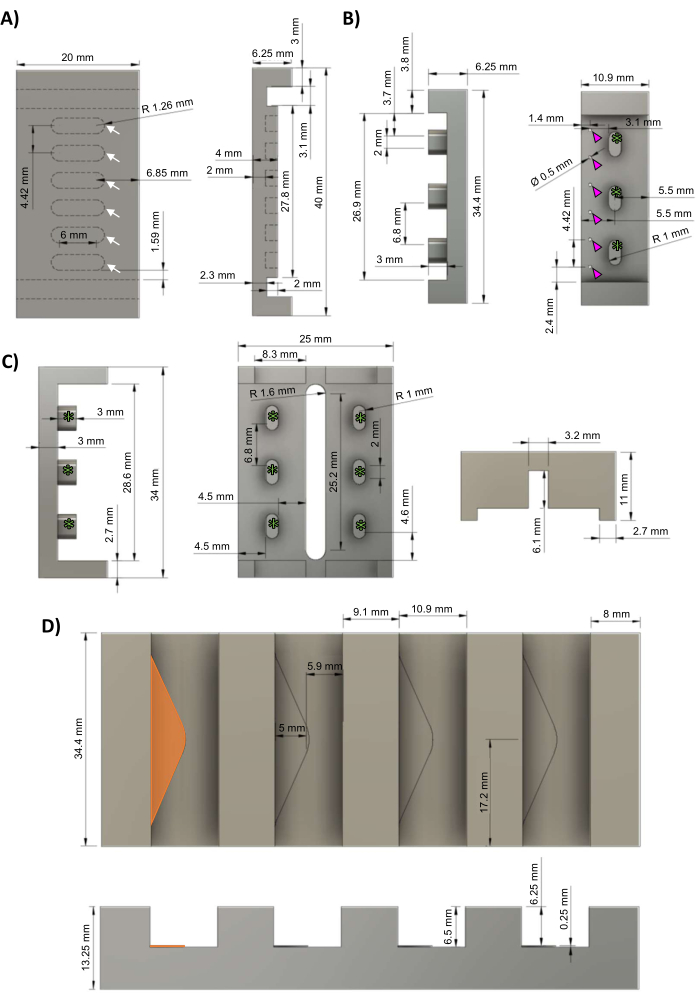
Figure 1 : Composants du bioréacteur hECT. (A) Vue de dessus (à gauche) et vue latérale (à droite) de la plaque de base en PTFE avec six puits régulièrement espacés pour former des hECT (flèches blanches). (B) Vue latérale (à gauche) et vue de dessus (à droite) des moulages principaux négatifs en aluminium pour les racks PDMS avec six poteaux régulièrement espacés (pointes de flèches magenta) et trois espaces pour la fixation au châssis du bioréacteur (astérisques verts). (C) Vue latérale (à gauche) et vue de dessous (à droite) des cadres en polysulfone pour les racks PDMS avec trois supports de cadre régulièrement espacés (astérisques verts) correspondant aux supports de cadre dans le rack PDMS cast (panneau B). (D) Vue de dessus (en haut) et vue latérale (en bas) du support en fonte d’aluminium avec quatre fentes pour les moulages en rack PDMS, chacune avec une étagère triangulaire de 0,25 mm de haut (l’étagère la plus à gauche surlignée en orange). Ce chiffre a été modifié à partir de van Neste27. Abréviations : hECT = tissu cardiaque modifié par l’homme ; Ø = diamètre ; PTFE = polytétrafluoroéthylène ; PDMS = polydiméthylsiloxane ; R = rayon. Veuillez cliquer ici pour voir une version agrandie de cette figure.
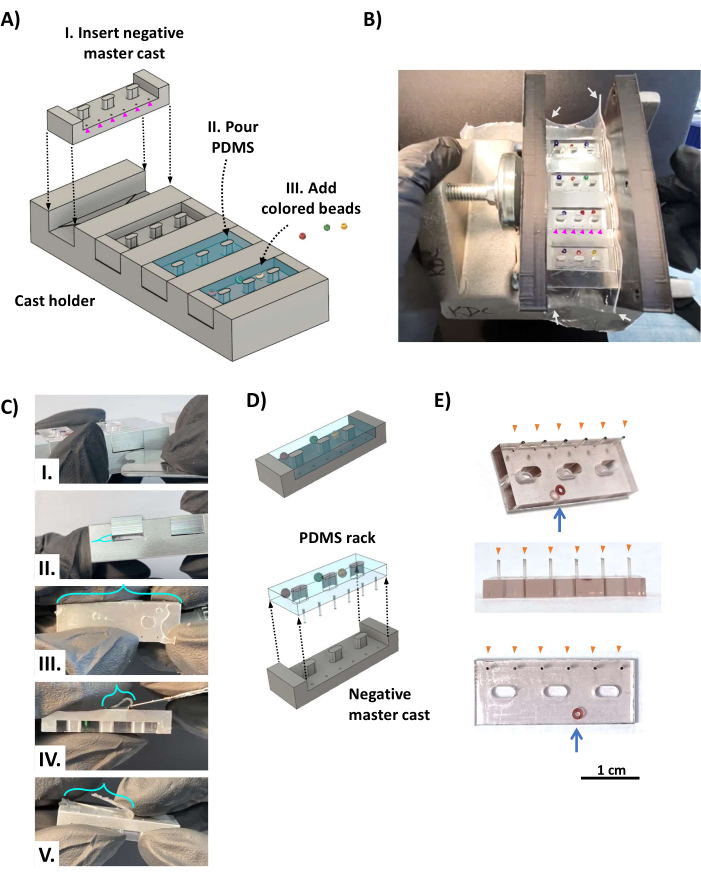
Figure 2 : Fabrication des racks PDMS. (A) Les rendus CAO montrent une vue oblique de l’appareil de coulée. (I) Un moulage principal négatif du rack PDMS est inséré dans chacune des quatre fentes du support de coulée avec les trous qui forment les poteaux PDMS (pointes de flèche magenta) placés sur l’espace mort opposé à l’étagère triangulaire (Figure 1D, triangle orange). (II) Le PDMS est versé dans chaque cavité de la coulée maîtresse négative. (III) Des billes colorées sont ajoutées au PDMS non polymérisé en tant que système d’identification à code couleur. (B) Photo montrant l’appareil de coulée en rack PDMS assemblé, qui est serré de chaque côté avec deux supports imprimés en 3D maintenus en place par une pince à vis et enveloppés d’une feuille de silicone de 0,5 mm d’épaisseur (flèches blanches) pour sceller les côtés serrés. Les perles colorées sont placées de manière à ne pas recouvrir les trous de 0,5 mm de diamètre qui forment les poteaux (pointes de flèches magenta). (C) Une fois le PDMS durci, le moulage est retiré du porte-moulage. (I) Une lame de rasoir émoussée en acier inoxydable ou un outil métallique mince similaire est inséré entre la fonte et le porte-fonte pour faire levier sur la fonte du porte-pièce (II). (III) Le film (supports turquoises) formé par le PDMS s’écoulant à travers les trous des poteaux est fixé aux extrémités des poteaux et doit être coupé à l’aide d’une lame tranchante (IV,V). (D) Le rack PDMS est séparé de la fonte. (E) Photos montrant des vues obliques (en haut), latérales (au milieu) et inférieures (en bas) du rack PDMS avec une bille de verre incrustée dans le corps pour l’identification (flèche bleue). Les extrémités des poteaux (pointes de flèches orange) ont été marquées à l’encre noire. Barre d’échelle = 1 cm. Ce chiffre a été modifié à partir de van Neste27. Abréviations : CAO = conception assistée par ordinateur ; PDMS = polydiméthylsiloxane. Veuillez cliquer ici pour voir une version agrandie de cette figure.
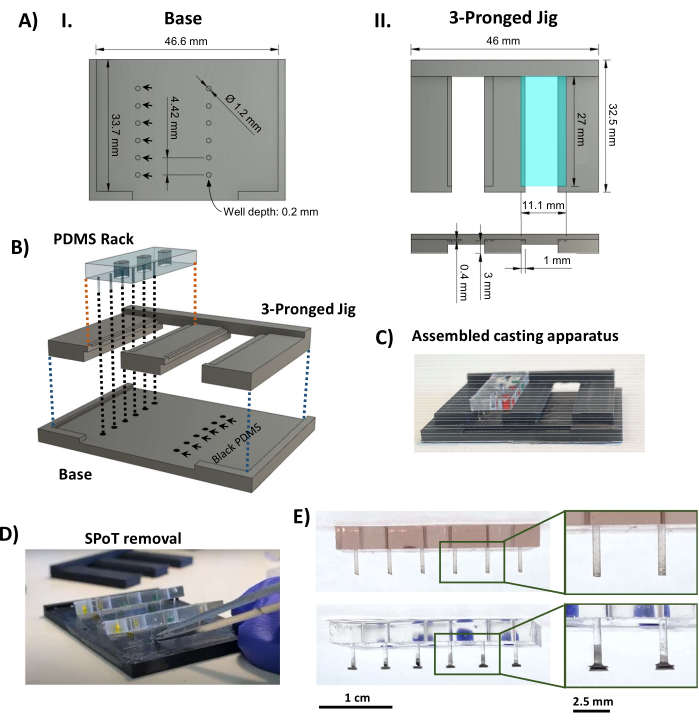
Figure 3 : Fabrication du SPoT. (A) Rendus CAO indiquant les dimensions clés de la base (I) et (II) de la pièce à trois branches du gabarit de coulée SPoT. Les dimensions des formulaires SPoT circulaires (AI, flèches noires) sont définies comme suit : 0,2 mm de profondeur x 1,2 mm de diamètre, et chacune d’entre elles contient le PDMS noir d’un SPoT individuel. L’étagère de 11,1 mm x 27 mm que l’on voit sur la vue de dessus (AII, en haut, rectangle turquoise) est abaissée de 0,4 mm (comme on le voit sur la vue latérale ci-dessous) pour maintenir le rack PDMS en place pendant le durcissement. (B) Rendu CAO montrant l’assemblage de l’appareil de coulée SPoT. (C) Une photo de l’appareil de coulée SPoT assemblé. (D) Une fois le PDMS durci, le gabarit à trois dents est glissé sous les racks PDMS, et les SPoT sont libérés de leurs puits à l’aide d’une pince fine. (E) Photos du rack PDMS sans (en haut) et avec (en bas) SPoT. Les encarts montrent des vues agrandies des poteaux. Barres d’échelle = 1 cm (E), 2,5 cm (images agrandies dans E). Ce chiffre a été modifié à partir de van Neste27. Abréviations : CAO = conception assistée par ordinateur ; Ø = diamètre ; PDMS = polydiméthylsiloxane ; R = rayon ; SPoT = suivi de poste stable. Veuillez cliquer ici pour voir une version agrandie de cette figure.
2. Culture cellulaire
- Culture des cellules iPS
REMARQUE : Différentes lignées cellulaires peuvent nécessiter des ajustements de la dilution et de la fréquence de passage et/ou du titrage des additifs du milieu.- Enduire une plaque à 6 puits traitée pour culture cellulaire d’une matrice de membrane basale qualifiée (diluée dans la solution nutritive F12 de Dulbecco Modified Eagle Medium :Ham’s F12 1 :1 [DMEM/F12] selon les instructions du fabricant) et incuber la plaque à 37 °C pendant au moins 30 minutes. Préparer 500 mL de milieu de culture iPSC selon les instructions du fabricant et ajouter 5 mL de solution mère de pénicilline-streptomycine (10 000 UI/mL à 10 000 μg/mL).
- Pour faire passer les cellules iPS, aspirez le milieu des puits et lavez chaque puits une fois avec 1 mL de solution saline tamponnée au phosphate (PBS). Ajouter 1 mL de solution de dissociation iPSC par puits et incuber dans une hotte à flux laminaire pendant 1 min.
- Aspirer la solution de dissociation iPSC et incuber les cellules à 37 °C (sans milieu) pendant 5 min. Ajouter 1 mL de thiazovivine à 2 μM dans un milieu iPSC pour neutraliser la solution de dissociation iPSC.
- À l’aide d’une pipette sérologique de 2 mL, dissocier les colonies en amas d’environ 10 cellules, laver chaque puits avec 1 mL supplémentaire de thiazovivine de 2 μM en milieu iPSC. Ajouter 2 mL de suspension cellulaire dans chaque puits de la plaque nouvellement recouverte d’une matrice de membrane basale (étape 2.1.1).
- Après 24 h, retirez le milieu et ajoutez le milieu iPSC frais (sans thiazovivine). Nourrissez les cellules iPS toutes les 48 h avec 2 mL de milieu iPSC ou toutes les 72 h avec 4 mL de milieu. Replaquer les cellules à une dilution de 1 :6 pour les faire passer tous les 3 jours ou lorsqu’elles atteignent 80 % de confluence.
REMARQUE : Différentes lignées cellulaires peuvent nécessiter un ajustement de la fréquence de dilution et de passage.
- Différenciation des cardiomyocytes
- Commencer la différenciation lorsque les monocouches de CSPi sont confluentes à 80 % à 90 %.
- Préparez le milieu de différenciation en ajoutant 10 mL de supplément de B27 sans insuline et 5 mL de solution mère de pénicilline-streptomycine à 500 mL de milieu Roswell Park Memorial Institute 1640 (RPMI). Préparer le milieu d’entretien des cardiomyocytes en ajoutant 10 mL de supplément de B27 et 5 mL de solution mère de pénicilline-streptomycine à 500 mL de RPMI 1640.
REMARQUE : Le milieu de différenciation et le milieu d’entretien des cardiomyocytes peuvent être conservés à 4 °C jusqu’à 2 semaines. - Jour 0 : Laver les cellules avec 1 mL de DMEM/F12 et ajouter 2 mL de 10 μM de CHIR99021 et de matrice de membrane basale diluée dans un milieu de différenciation.
- Jour 1 : Après 24 h, ou lorsque la confluence cellulaire est réduite à moins de 70 %, laver les cellules avec 1 mL de DMEM/F12, ajouter 2 mL de milieu de différenciation et incuber pendant 48 h.
- Jours 3-4 : Laver les cellules avec 1 mL de DMEM/F12 et ajouter 2 mL de 5 μM IWR-1 dans un milieu de différenciation. Répétez l’opération le jour 4.
- Jours 5 et 6 : Laver les cellules avec 1 mL de DMEM/F12 et ajouter 2 mL de milieu de différenciation. Répétez l’opération le jour 6.
- Jours 7 à 10 : Laver les cellules avec 1 mL de DMEM/F12 et ajouter 2 mL de milieu d’entretien des cardiomyocytes. Répétez toutes les 24 h.
- Jours 11+ : Remplacer le milieu par 4 mL de milieu d’entretien des cardiomyocytes frais toutes les 48 à 72 h. Aspirer et pipeter lentement pour éviter d’endommager les monocouches qui battent vigoureusement.
3. Culture de l’hECT
- Prélèvement des cardiomyocytes
- Récoltez les monocouches de cardiomyocytes pour les utiliser dans la fabrication de l’hECT 8 à 60 jours après l’induction de la différenciation. Attendez-vous à 2 à 5 millions de cellules par puits.
REMARQUE : Si les cellules n’ont pas commencé à battre au jour 10, il est peu probable que la différenciation réussisse. Les monocouches battant vigoureusement se détachent souvent après 11 à 15 jours de différenciation et se compactent en tissus denses. Il est recommandé d’utiliser ou de replaquer ces cellules à ce moment-là. - Rincez chaque puits de cardiomyocytes 2x avec 2 mL de PBS. Ajouter 1 mL de trypsine-EDTA à 0,25 % à température ambiante. Incuber à 37 °C pendant 5 à 10 minutes jusqu’à ce que les cellules paraissent arrondies et se détachent en tapotant légèrement la plaque.
- Ajouter 1 mL de FBS à 10 % dans un milieu d’entretien des cardiomyocytes dans chaque puits pour neutraliser la dissociation. Pipeter doucement les monocouches à l’aide d’une pointe de pipette sérologique de 5 mL et transférer dans un tube conique de 50 mL pour briser la pastille en amas de 10 à 20 cellules.
- Mélanger la suspension cellulaire en inversant le tube conique avant de transférer 10 μL de cellules à 10 μL de bleu trypan. Comptez les cellules à l’aide d’un compteur cellulaire automatisé ou d’un hémocytomètre en verre. Séparez la suspension cellulaire de manière appropriée si toutes les cellules ne seront pas utilisées ou si certaines cellules sont mises de côté pour la cytométrie en flux.
REMARQUE : Des cellules supplémentaires (telles que des fibroblastes) peuvent être ajoutées à ce stade. - Centrifuger les cellules à 250 × g pendant 5 min. Aspirer immédiatement autant de surnageant que possible sans perturber la pastille cellulaire et garder sur la glace. Travaillez rapidement pour minimiser le temps que les cellules passent dans la pastille.
- Récoltez les monocouches de cardiomyocytes pour les utiliser dans la fabrication de l’hECT 8 à 60 jours après l’induction de la différenciation. Attendez-vous à 2 à 5 millions de cellules par puits.
- Fabrication de hECT
- Utilisez les volumes du tableau 2 et ajustez en fonction du nombre de cellules dans la pastille afin que chaque hECT contienne 1 million de cellules. Après chaque étape, mélangez en pipetant lentement pour éviter les bulles.
REMARQUE : Effectuez les étapes 3.2.2 à 3.2.3 à l’abri de la lumière directe car certains composants sont sensibles à la lumière. - Préparez une solution de collagène de type 1 de 2,9 g/mL dans un microtube de 1,7 mL en ajoutant 13,442 μL d’eau distillée, 4,4 μL de PBS 10x et 0,638 μL de NaOH 1M. Ajouter 25,52 μL de solution mère de collagène à 5 mg/mL et mélanger lentement.
- Préparer le mélange de matrice extracellulaire (mélange ECM du tableau 2) : Ajouter 5,5 μL de solution HEPES à 0,2 N pH 9 suivi de 5,5 μL de MEM 10x. Mélangez soigneusement jusqu’à ce qu’une couleur jaune clair à rose clair uniforme soit observée. Transférez 35,2 μL de la solution de mélange ECM dans la pastille cellulaire et ajoutez 4,4 μL de matrice membranaire basale.
- Ouvrez le sac autoclavé contenant les pièces du bioréacteur (étape 1.4.7, Figure 4A). Lorsque vous portez des gants stérilisés à l’éthanol à 70 %, retirez la plaque de base noire du sac de l’autoclave et placez-la dans un plat de 60 mm avec les puits vers le haut. Pipeter lentement 44 μL du mélange cellulaire dans chaque puits pour éviter d’introduire des bulles. Si nécessaire, utilisez la pipette pour éliminer les bulles qui ont été introduites par le pipetage ou qui se sont formées en raison de l’hydrophobicité du PTFE. Restaurer le volume de l’hECT de manière à ce que la surface du liquide affleure la lèvre du puits (figure 4BI).
- Enfilez une nouvelle paire de gants stérilisés et retirez le cadre en polysulfone avec les supports PDMS du sac de l’autoclave. Abaissez le cadre sur la plaque de base de manière à ce que les extrémités du cadre s’insèrent dans les rainures aux extrémités de la plaque de base (Figure 4BII, III). Inspectez le bioréacteur pour vous assurer que les poteaux sont tous droits et que le cadre n’est pas incliné avant de le placer dans une boîte de 60 mm.
- Ajouter 1 mL de FBS à 10 % dans un milieu d’entretien des cardiomyocytes dans la boîte de 60 mm (en prenant soin de ne pas déranger les hECT) pour augmenter l’humidité dans la boîte au fur et à mesure que les hECT se solidifient. Placez la boîte de 60 mm sans couvercle dans une boîte de 100 mm à profil haut (20 mm de hauteur), couvrez avec un couvercle de boîte de 100 mm et remettez le bioréacteur dans l’incubateur à 37 °C et 5 % de CO2 pour permettre au collagène de former un gel avec les cellules en suspension.
- Au bout de 2 h, retirez le plat de l’incubateur. Ajouter 13 mL de FBS à 10 % dans un milieu d’entretien des cardiomyocytes, en inclinant la boîte pour favoriser l’écoulement du fluide entre la plaque de base en PTFE et les grilles PDMS.
- Inspectez le bioréacteur par le côté pour vous assurer qu’aucune bulle d’air n’est emprisonnée entre les surfaces hydrophobes de la plaque de base en PTFE et des racks PDMS, et remettez la parabole dans l’incubateur. S’il y a de l’air emprisonné, inclinez le bioréacteur hors du milieu pour laisser la bulle se briser, et abaissez-le lentement à nouveau, ou utilisez une micropipette avec un embout de chargement de gel pour siphonner l’air, en prenant soin de ne pas déranger les poteaux.
- Utilisez les volumes du tableau 2 et ajustez en fonction du nombre de cellules dans la pastille afin que chaque hECT contienne 1 million de cellules. Après chaque étape, mélangez en pipetant lentement pour éviter les bulles.
- Retrait de la plaque de base
- Inspectez le compactage hECT à travers l’espace dans le cadre. En l’espace de 24 à 96 h, les hECTs se compactent et deviennent plus opaques (Figure 4CI-III). Une fois qu’il y a un espace visible entre les hECT et la paroi de la plaque de base (Figure 4CII), effectuez deux changements de milieu d’un demi-volume pour changer le milieu en milieu d’entretien des cardiomyocytes sans FBS. Retirez la plaque de base lorsque les hECT sont compactés d’au moins 30 % par rapport au diamètre d’origine (Figure 4CIII). Remplissez la boîte de 60 mm contenant le bioréacteur avec du milieu d’entretien des cardiomyocytes jusqu’à ce que le liquide affleure le rebord de la boîte, puis ajoutez 14 ml dans une nouvelle boîte de 60 mm.
- ÉTAPE CRITIQUE : Tout en portant des gants stériles, retournez le bioréacteur dans sa boîte de manière à ce que la plaque de base soit sur le dessus (Figure 4BIV). Inspectez les bulles d’air emprisonnées comme indiqué à l’étape 3.2.8. Soulevez lentement la plaque de base en la maintenant à niveau (Figure 4BV).
- Si un hECT tombe lors du retrait de la plaque de base mais reste dans la plaque de base, utilisez une pince fine incurvée stérile pour transférer l’hECT de la plaque de base dans la boîte de 60 mm. Utilisez la pince pour guider l’extrémité de l’hECT vers son poteau. Utilisez une deuxième paire de pinces pour maintenir le poteau stable et enfilez-le dans le trou de l’hECT. Répétez l’opération pour le deuxième post si nécessaire.
- Une fois tous les hECT fixés aux poteaux, transférez le cadre avec les hECT dans la nouvelle parabole de 60 mm et placez le cadre avec les poteaux pointant vers le bas (Figure 4BVI). Inspectez le bioréacteur pour vous assurer que les hECT restent sur leurs postes juste à proximité des SPoT.
- Si un hECT a été poussé par la tension superficielle jusqu’à la base de ses poteaux, stabilisez le cadre avec une paire de pinces incurvées stériles. Insérez l’autre paire de pinces dans la fente du cadre, en la gardant fermée. Une fois que l’extrémité de la pince a été abaissée au-delà des grilles PDMS, tournez-la de manière à ce qu’elle atteigne le poteau et utilisez les pointes fermées pour pousser doucement l’hECT vers l’extrémité du poteau jusqu’à ce qu’il repose sur le SPoT (Figure 4BVI, médaillon).
- Entretien de hECT
- Effectuer des changements de milieu d’un demi-volume avec un milieu d’entretien des cardiomyocytes toutes les 24 à 48 h (après 2 semaines de culture, la fréquence peut être réduite à deux fois par semaine).
- Lorsque les hECT présentent des grappes de battements spontanés, généralement au jour 3, et des battements coordonnés avec une déviation visible après le jour 5, commencez les mesures fonctionnelles et répétez aussi souvent que vous le souhaitez.
REMARQUE : Il est peu probable que les hECT qui n’ont pas commencé à battre de manière coordonnée au jour 7 le fassent.
| Composant | Volume (μL) | |||||||
| distillé H2O | 13.442 | 2,9 mg/mL de solution de collagène | « Mélange ECM » | mélange final de cellules hECT | ||||
| NaOH 1N | 0.638 | |||||||
| PBS 10x | 4.4 | |||||||
| 5 mg/mL de bouillon de collagène | 25.52 | |||||||
| 0,2 N pH 9 HEPES | 5.5 | |||||||
| 10x MEM | 5.5 | |||||||
| Volume de mélange ECM à transférer dans la pastille cellulaire | 35.2 | |||||||
| Volume de Matrigel | 4.4 | |||||||
Tableau 2 : Réactifs hECT. Les composants doivent être ajoutés dans l’ordre indiqué et conservés sur la glace.
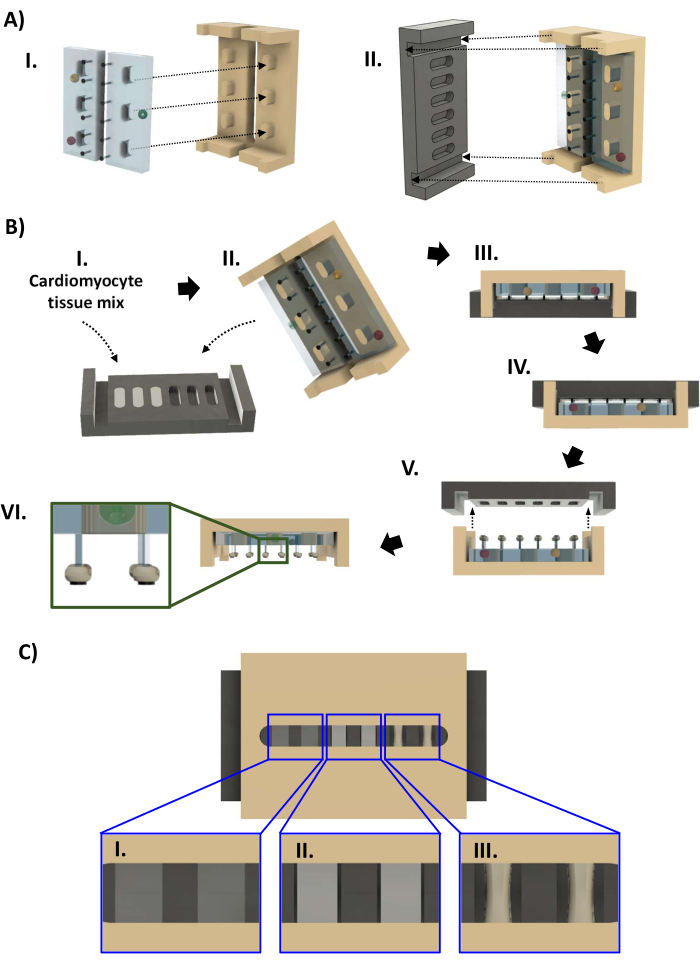
Figure 4 : Assemblage du bioréacteur et fabrication de l’hECT. (A) (I) Deux racks PDMS (à gauche, bleu clair) montés sur le cadre en polysulfone (à droite, beige). (II) La plaque de base en PTFE (noire, à gauche) s’adapte ensuite au cadre (à droite) de manière à ce que chaque paire de poteaux s’insère dans un puits de la plaque de base. (B) (I) Quarante-quatre microlitres de suspension de cardiomyocytes dans une matrice extracellulaire à base de collagène sont ajoutés à chacun des six puits de la plaque de base. (II, III) Le cadre avec racks PDMS est pressé sur la plaque de base. Après 1 à 4 jours, les hECT peuvent être retirés de la plaque de base. (IV) Tout d’abord, le bioréacteur est inversé avant que (V) la plaque de base ne soit soulevée du châssis. (VI) Vue latérale du bioréacteur avec six hECT. Encart : vue agrandie montrant la position de l’hECT sur les poteaux par rapport aux SPoT (médaillon). (C) Rendu CAO montrant trois niveaux de compactage hECT ([I] faible, [II] moyen et [III] élevé) vus à travers l’espace dans le cadre en polysulfone. Ce chiffre a été modifié à partir de van Neste27. Abréviations : CAO = conception assistée par ordinateur ; PDMS = polydiméthylsiloxane ; PTFE = polytétrafluoroéthylène ; SPoT = suivi de poste stable ; hECT = tissu cardiaque modifié par l’homme. Veuillez cliquer ici pour voir une version agrandie de cette figure.
4. Équipement de stimulation hECT
- Veste pour la scène chauffée
- À l’aide d’une machine de découpe laser, découper les composants de la gaine isolante en acrylique dans une feuille d’acrylique transparent de 0,635 cm d’épaisseur (fichier supplémentaire 3), un pour chacune des figures 5A à D et deux pour chacune des figures 5E et F.
- Assemblez les pièces (B), (C), (D) et l’une des pièces (E) de la figure 5 et collez-les ensemble à l’aide de colle acrylique comme illustré à la figure 5GI. Fixez le panneau supérieur (Figure 5GII), attendez plusieurs heures pour que la colle durcisse, puis faites glisser la platine chauffante sur le côté de la gaine (Figure 5GIII).
- Une fois la gaine en place, utilisez du ruban adhésif pour fixer les inserts entre les pieds de la platine chauffante et ajoutez le panneau avant (Figure 5GIV) pour terminer l’assemblage (Figure 5GV).
- Fabrication d’électrodes en graphite
- Couper des barres de graphite de 6,25 mm d’épaisseur et de 25 mm de largeur à l’aide d’une scie à ruban en blocs de 35 mm de long ; Ensuite, coupez chaque bloc dans le sens de la longueur en une ligne courbe de sorte que chaque électrode mesure 13 à 16 mm de haut à une extrémité et 8 à 10 mm de haut à l’autre extrémité. Percez deux trous de 0,7 mm de diamètre dans le coin supérieur (Figure 6AI). Polir les pièces avec du papier absorbant et soniser dans l’eau pendant 20 min pour enlever la poussière de graphite. Assurez-vous que les électrodes se calent entre les parois de la boîte et le bioréacteur de 25 mm de large pour assurer une distance constante entre les électrodes (Figure 6AII).
- Enfilez un fil d’acier de 150 mm de long x 0,25 mm de diamètre dans les trous des électrodes et pliez-le pour qu’il s’adapte sur le rebord de la parabole de 60 mm et autour des parois de la parabole de 100 mm afin que le couvercle puisse être fermé (Figure 6AII).
- Nettoyez les électrodes en les trempant dans de l’eau distillée pendant 1 à 2 h après chaque utilisation pour éliminer tout milieu absorbé, laissez-les sécher toute la nuit, puis autoclavez-les à 132 °C pendant 30 min. Avant de commencer les mesures, placer une électrode de chaque côté du bioréacteur (Figure 6AII). Positionnez les fils de manière à ce que le couvercle de la parabole de 100 mm puisse être fermé et remettez le bioréacteur dans l’incubateur pour qu’il s’équilibre.
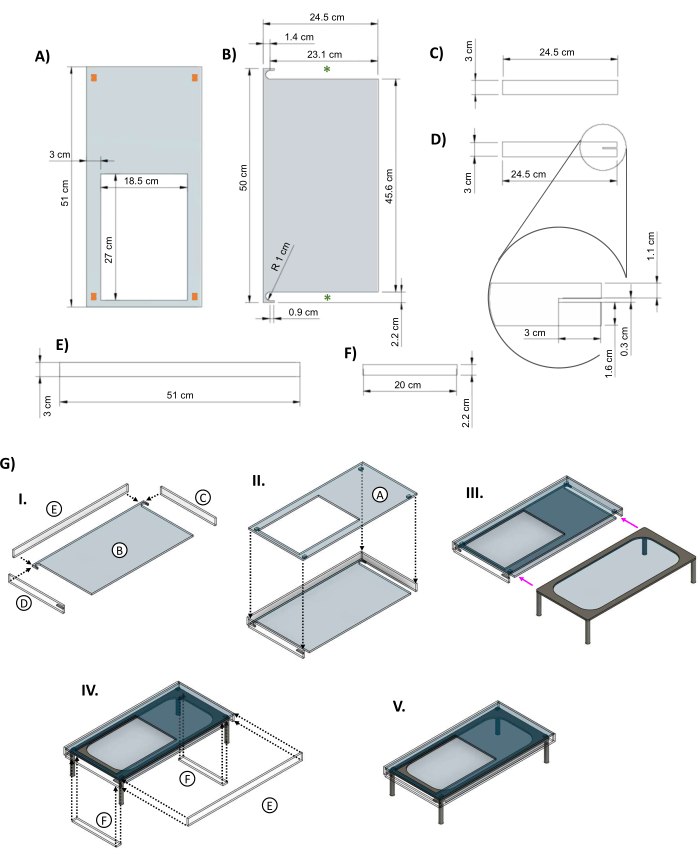
Figure 5 : Gaine en acrylique pour l’isolation de la platine en verre chauffé. Images CAO montrant les dimensions clés des pièces de la gaine acrylique conçue pour la table en verre. (A) Le panneau supérieur est percé d’un trou de 27 cm x 18,5 cm pour permettre à la parabole du bioréacteur de reposer sur l’élément chauffant. Les rectangles orange dans les coins indiquent l’emplacement suggéré de petites pièces d’espacement pour fournir de l’espace entre le haut de la veste et l’élément chauffant. (B) La partie inférieure de la veste comporte deux découpes pour permettre aux pieds de la scène chauffée de glisser (astérisques verts). (C&D) Deux panneaux latéraux s’insèrent sous la pièce supérieure. (D) Le panneau latéral gauche comprend une découpe de 3 cm x 0,3 cm (encart) pour le cordon d’alimentation de la scène. (E) De longs panneaux s’adaptent à l’avant et à l’arrière. (F) Des inserts sont ajoutés pour combler les espaces une fois que la table est à l’intérieur. (G) (I) Les panneaux latéraux et arrière sont fixés à la pièce inférieure, puis (II) le panneau supérieur est ajouté. (III) La table en verre est glissée dans la gaine (flèches magenta). (IV) Les inserts sont fixés entre les pieds de la table, et le dos s’insère sur l’ouverture pour fermer la boîte. (V) L’assemblage de la gaine terminé. Ce chiffre a été modifié à partir de van Neste27. Abréviations : CAO = conception assistée par ordinateur ; R = rayon ; Ø = diamètre. Veuillez cliquer ici pour voir une version agrandie de cette figure.

Figure 6 : Acquisition des données de la contraction de l’hECT. (A) (I) Photos des électrodes découpées dans des barres de graphite. Les flèches magenta indiquent les trous pour fixer les fils en acier inoxydable. Barre d’échelle = 1 cm. (II) Vue oblique (à gauche) et vue de dessus (à droite) montrant l’emplacement des électrodes en graphite dans le bioréacteur. Les électrodes occupent l’espace entre le bioréacteur de 25 mm de large et la paroi de la boîte pour assurer une distance constante entre les électrodes. Les fils sont pliés pour permettre la fermeture du couvercle de la vaisselle. (B) Photo de la configuration de stimulation hECT à l’intérieur du banc de nettoyage à flux laminaire - tout l’équipement est placé sur la table d’isolation des vibrations pour réduire le bruit de vibration du banc propre. Le bioréacteur (pointe de flèche magenta) se trouve sur la scène chauffée chemisée, éclairée par une source de lumière LED par le haut. Le microscope à dissection est pointé horizontalement vers un miroir à angle droit (astérisque orange) pour voir le bioréacteur d’en bas et est équipé d’une caméra CCD (à gauche). Le support turquoise indique un bain-marie pour une surveillance continue de la température afin de fournir un retour d’information au contrôleur de scène chauffé en boucle fermée. Ce chiffre a été modifié à partir de van Neste27. Abréviations : hECT = tissu cardiaque modifié par l’homme ; LED = diode électroluminescente. Veuillez cliquer ici pour voir une version agrandie de cette figure.
5. Mesures fonctionnelles hECT
- Configuration de l’espace de travail de stimulation
- Allumez la platine chauffée à 39,5 °C et installez l’équipement de stimulation sur une table d’isolation des vibrations à l’intérieur d’un banc de nettoyage à flux laminaire conformément à la Figure 6B. Montez le microscope à dissection sur une perche et pointez-le vers un miroir à angle droit (figure 6B, astérisque orange) situé sur un cric de laboratoire sous la table en verre pour voir le bioréacteur d’en bas. Fixez une caméra CCD haute vitesse au microscope et connectez-vous à l’ordinateur. Irradiez l’installation avec une lumière UV pendant 15 min pour stériliser l’espace de travail.
- Placez le bioréacteur (figure 6B, pointe de flèche magenta) sur la scène chauffée à double enveloppe, éclairée par une source lumineuse LED à col de cygne à double tête par le haut (les cols des lampes LED peuvent être fixés plus solidement à l’unité principale par rapport aux lampes à fibre optique). Minimisez le bruit supplémentaire en vous assurant que l’équipement de stimulation de la table vibrante (et la table elle-même) ne touche aucune partie du banc de nettoyage à flux laminaire.
- Ajoutez un deuxième plat de 60 mm rempli d’eau préchauffée à l’intérieur d’un plat de 100 mm sur la table chauffante (figure 6B, support turquoise) et équipez-le d’une sonde de température pour une surveillance continue de la température. Ajustez le réglage de la température de la platine chauffée au besoin pour maintenir la température de la boîte de référence à 36-37 °C.
- Réglez le grossissement du microscope sur 1,5x (ou un autre grossissement souhaité avec lequel un hECT peut être visualisé dans son intégralité avec une résolution adéquate).
- Réglage des paramètres de l’appareil photo
- Ouvrez le logiciel de l’appareil photo. Redimensionnez le flux vidéo pour recadrer le champ de vision autant que possible tout en visualisant un ensemble d’hECT. Cela maximise la vitesse de la caméra.
- Réglez la fréquence de capture sur 90 images par seconde. Ajustez le temps d’exposition et la position de la source lumineuse pour optimiser l’uniformité des conditions d’éclairage dans le champ de vision et maximiser le contraste des SPoT.
- Mise en place du logiciel d’acquisition
- Allumez le stimulateur d’impulsions carrées et connectez-le à l’ordinateur. Ajustez les paramètres pour délivrer des impulsions biphasiques d’une amplitude de 12 V et d’une durée de 5 ms.
- Ouvrez le logiciel d’acquisition de données, puis ouvrez le fichier « AutomatedPostTracking3.vi » (Fichier supplémentaire 4). Une fois chargé, cliquez sur la flèche blanche sur le côté gauche de la barre d’outils pour initialiser le programme (Figure 7A).
- Calibrer le logiciel à l’aide d’un hémocytomètre en verre sur la platine chauffée. Dans la barre d’outils (Figure 7B), cliquez sur l’outil Ligne pour tracer une ligne sur 1 mm des marquages de l’hémocytomètre (non illustré). Dans la zone Calibrage de la distance (pixels/mm) (Figure 7C), définissez la longueur de référence (mm) sur 1, puis cliquez sur le bouton Calculer .
- Mesurez la section transversale de l’hECT à l’aide de l’outil Ligne pour tracer une ligne sur la largeur du tissu. Cliquez sur le 1 dans la case Aire de la section transversale (mm^2) (Figure 7D) pour calculer l’aire (en supposant une géométrie cylindrique des bandelettes de tissu linéaires, telle qu’établie dans la littérature 1,2,3,4,5,6,7,8,9,10,11, 12,15,16,18,19,20,
21,22,23,24,25,26,37,38). Répétez l’opération le long de différentes parties de l’hECT et notez les valeurs sous les deux autres boutons de la boîte. Le fichier de table de données en sortie indique la moyenne de ces trois valeurs pour calculer le diamètre du tissu.
- Caractérisation fonctionnelle de l’hECT
- Assurez-vous que les conseils de publication sont nets. Allumez le commutateur de seuillage (Figure 7E) et ajustez le curseur (Figure 7F) jusqu’à ce que les SPoT (Figure 7G) soient bien délimités et ne changent pas de forme lorsque l’hECT se contracte.
- Utilisez l’outil Rectangle pour dessiner un rectangle autour de l’un des SpoT (Figure 7, rectangle vert), puis cliquez sur le bouton Set 1 (Set 1) (Définir 1) à l’intérieur de la zone Limites du poteau (Figure 7H) pour définir la position du rectangle autour du SPoT, en veillant à ce que le SPoT reste à l’intérieur de la limite du rectangle à tout moment. Répétez l’opération pour l’autre publication et enregistrez-la sous l’ensemble 2.
- Ajustez les paramètres de taille de l’objet (Figure 7I) pour empêcher le programme de suivre des objets plus petits. Assurez-vous que le nombre d’objets suivis dans chaque rectangle reste constant. L’interface (Figure 7J) indique en temps réel la distance mesurée entre les objets suivis. Utilisez ce graphique pour surveiller le bruit.
- Sélectionnez un répertoire pour enregistrer les fichiers (Figure 7K). Stockez les données de différents jours dans des dossiers séparés. Sélectionnez le numéro de tissu actuel et écrivez les commentaires souhaités dans la zone Commentaires .
- Sous l’en-tête Fréquence de stimulation (Hz) (Figure 7L), indiquez la plage de fréquences souhaitée (Min et Max) et l’intervalle souhaité pour passer de Min à Max. Si vous mesurez les hECT sur toute leur plage de capture, testez différentes fréquences de stimulation pour trouver la fréquence la plus basse à laquelle un rapport stimulus/crête de 1 :1 est atteint, et continuez à augmenter la fréquence jusqu’à ce que ce rapport soit perdu. Mesurez la fonction spontanée en choisissant une plage de fréquences arbitraire (par exemple, 0,01 Hz à 0,01 Hz) et en gardant la sortie carrée du stimulateur d’impulsions désactivée.
- Dans les cases de droite, choisissez le (s) temps(s) de réglage souhaité(s) (un intervalle de temps après que la fréquence a été réglée mais que les données ne sont pas enregistrées) pour permettre à l’hECT de s’adapter à la nouvelle fréquence de stimulation. Spécifiez la durée d’enregistrement (s) et la tension de stimulation (V). Lancez le programme en cliquant sur le bouton Démarrer le programme (Figure 7M).
REMARQUE : Les résultats sont enregistrés automatiquement dans le répertoire sélectionné. Après chaque enregistrement, observez que le script affiche la transformation de Fourier des données (Figure 7N), où les pics correspondent à la fréquence de battement détectée. - Si vous le souhaitez, exécutez le programme « Excitation Threshold Finding » pour trouver la tension minimale requise pour stimuler l’hECT en vue (Figure 7O). Si vous le souhaitez, calculez les flèches maximales et minimales des poteaux (figure 7P).
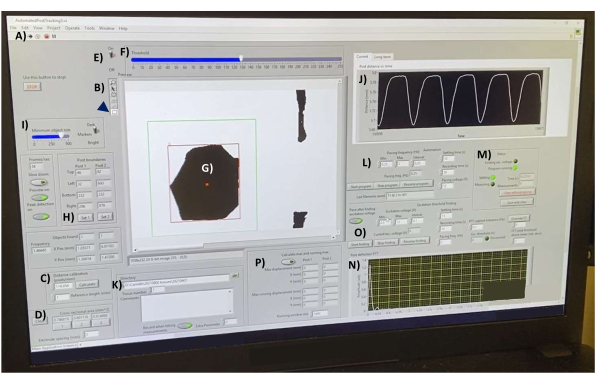
Figure 7 : Interface d’acquisition des données après la déflexion. (A) Bouton d’exécution du logiciel. (B) Barre d’outils contenant les outils ligne et rectangle pour les mesures de longueur et la sélection d’objets, respectivement. (C) Commandes d’étalonnage de distance. (D) Outils de mesure de la section transversale hECT en trois points différents. (E) Commutateur de seuillage et curseur (F) pour convertir le flux vidéo en images à contraste élevé en temps réel. (G) Un SPoT visible dans la fenêtre d’aperçu. (H) Outils de sélection des SPoT. (I) Curseur pour filtrer les objets par taille. (J) Graphique montrant la distance mesurée entre les objets suivis en temps réel. (K) Options de sélection du répertoire d’enregistrement des fichiers de sortie. (L) Options de réglage de la plage de fréquences, de l’intervalle de fréquence, de la durée d’enregistrement et de la durée de réglage entre les enregistrements pour le programme de post-suivi (M). (N) Sortie graphique de la transformation de Fourier de la courbe de déviation du dernier enregistrement sauvegardé. (O) Programme pour trouver la tension minimale requise pour stimuler les hECTs. (P) Programme de calcul des flèches maximales et minimales des poteaux. Abréviations : hECT = tissu cardiaque modifié par l’homme ; SPoT = suivi de poste stable. Veuillez cliquer ici pour voir une version agrandie de cette figure.
6. Mesures du rack PDMS
- Distances à vide
- Avant la fabrication hECT, montez la paire de racks PDMS souhaitée sur un châssis. Utilisez la configuration de stimulation et le logiciel décrits à l’étape 5.1 pour les mesures fonctionnelles. Sélectionnez les SPoT stationnaires aux extrémités des poteaux.
- Ajustez la source lumineuse et/ou le seuil si nécessaire pour réduire le bruit à <2 μm. Enregistrez la valeur y moyenne en direct indiquée dans le graphique dans une feuille de calcul.
- Hauteurs de poteaux et hauteurs hECT
- À partir de la configuration de stimulation décrite à l’étape 5.2, retirez le miroir incliné et la platine chauffante. Placez le bioréacteur directement sur le cric de laboratoire pour une vue latérale du bioréacteur.
- Ouvrez le logiciel de l’appareil photo. Ajustez le temps d’exposition et la position de la source lumineuse pour optimiser l’uniformité des conditions d’éclairage dans le champ de vision et maximiser la visibilité des poteaux.
- Ouvrez le logiciel d’acquisition de données, puis ouvrez le fichier « PostMeasurement_PB3.vi » (Fichier supplémentaire 5). Une fois chargé, cliquez sur la flèche blanche sur le côté gauche de la barre d’outils pour initialiser le programme.
- Calibrez le logiciel à l’aide d’un hémocytomètre en verre. Cliquez sur l’outil Ligne dans la barre d’outils verticale à gauche de la fenêtre d’affichage et tracez une ligne sur 1 mm des marques de l’hémocytomètre. Dans la zone Calibrage de la distance (pixels/mm) en bas à gauche de l’écran, définissez la longueur de référence (mm) sur 1, puis cliquez sur le bouton Calculer .
- Sous les champs d’étalonnage, définissez le numéro de tissu souhaité (pour l’identification) dans le champ Numéro de tissu . Effectuez la mise au point de la caméra sur le poteau gauche de l’hECT, puis sélectionnez Gauche dans la zone Côté du poteau .
- Utilisez l’outil Ligne pour tracer une ligne de la base du poteau (en haut) à la pointe des SPoT (en bas), et enregistrez en cliquant sur Mesurer le poteau Ht.
- Tracez une ligne de la base du poteau jusqu’au bord le plus éloigné de l’hECT, et enregistrez en cliquant sur Mesurer le tissu supérieur Ht. Tracez une ligne à partir de la base du poteau jusqu’au bord le plus proche de l’hECT, et enregistrez en cliquant sur Mesurer le Het de la base tissulaire.
- À ce stade, retournez le bioréacteur pour mesurer la bonne hauteur de poteau. Sélectionnez l’option de publication appropriée pour enregistrer les mêmes mesures. Cliquez sur le bouton Ajouter pour remplir la feuille de calcul avec les valeurs mesurées et calculer automatiquement la hauteur moyenne de l’hECT, qui sera utilisée à l’étape 7.
- Une fois l’enregistrement des hauteurs de tissu terminé, cliquez sur le bouton Enregistrer pour enregistrer les valeurs dans un fichier texte.
7. Traitement fonctionnel des données à l’aide de scripts d’analyse personnalisés
- Dans un tableur, remplissez le fichier récapitulatif à l’aide du modèle (Fichier supplémentaire 6). Utilisez les valeurs de longueur de tige et de hauteur moyenne des tissus acquises à l’étape 6.2. Assurez-vous que tous les hECT qui contiennent des données dans le dossier sont représentés dans le fichier récapitulatif. Nommez le fichier « summary #.csv », où # fait référence au nombre de jours de l’expérience.
REMARQUE : Les données fonctionnelles hECT doivent se trouver dans des dossiers séparés en fonction du jour de l’expérience. - Assurez-vous que le dossier contenant les scripts AnalyzeLogsGUI (fichier supplémentaire 7) et le dossier contenant les enregistrements hECT sont tous deux ajoutés au chemin d’accès.
- Ouvrez le logiciel d’analyse de données. À gauche de la barre de répertoire, cliquez sur le bouton Rechercher un dossier pour accéder au dossier parent qui contient à la fois le dossier AnalyzeLogsGUI et les données fonctionnelles hECT. Dans la barre latérale de la fenêtre actuelle , cliquez avec le bouton droit de la souris sur ces dossiers pour ajouter au chemin d’accès | Ajoutez les dossiers et sous-dossiers sélectionnés.
- Ouvrez le fichier « AnalyzeLogsGui_SC.m ». Dans l’onglet Éditeur, appuyez sur le bouton Exécuter et attendez que l’interface utilisateur graphique (GUI) apparaisse dans une nouvelle fenêtre.
- Dans la zone Log Selection (Sélection du journal ) (Figure 8AI), cliquez sur le bouton Select Directory (Sélectionner un répertoire ) et accédez au dossier qui contient les données fonctionnelles hECT. Sélectionnez l’hECT à traiter dans le menu déroulant Tissu .
- Dans la zone Entrées de données (Figure 8AII), entrez la distance déchargée entre les poteaux enregistrée à partir des étapes 6.1 dans le champ Distance diastolique. Entrez 0,25 dans le champ Rayon de la publication (mm).
- Dans la zone Analysis Constraints (Contraintes d’analyse ) (Figure 8AIII), choisissez les fréquences à omettre de l’analyse ou sélectionnez des fréquences spécifiques à inclure (séparées par des virgules). L’heure de début et l’heure de fin sont définies sur 0 et −1, respectivement, par défaut pour traiter toute la durée des enregistrements. Modifiez ces valeurs pour découper les enregistrements si nécessaire.
- Modifiez les paramètres de filtre (Figure 8AIV) de l’ordre polynomial et de la taille de trame pour modifier le niveau de lissage pendant le processus de filtrage et le curseur Seuil de détection des pics pour définir la taille minimale des pics qui sera reconnue par les scripts.
REMARQUE : Le script contient l’option Suppression des pointes, qui coupe les pics hauts causés par des artefacts ; Cependant, cela n’est pas recommandé car cela change la forme des secousses. Supprimez les artefacts en rognant l’enregistrement à la place (Figure 8AIII). - Utilisez des options supplémentaires (Figure 8AV) pour obtenir des résultats d’analyse de données supplémentaires : analyse post-déviation pour exécuter un algorithme de détection de pic supplémentaire, mise à l’échelle automatique de l’axe Y sur les tracés de zoom pour ajuster automatiquement les axes sur la courbe de force de contraction (Figure 8B), Enregistrer les courbes de trace de force pour enregistrer chaque chiffre de force de contraction dans un fichier .fig et Enregistrer les données de temps de force pour enregistrer les coordonnées X et Y des données filtrées tracées dans la figure de la courbe de force de contraction.
- Cliquez sur Exécuter l’analyse pour générer un fichier .txt qui contient les attributs de la courbe de force de contraction (Fichier supplémentaire 8) moyennée sur l’ensemble d’un enregistrement.
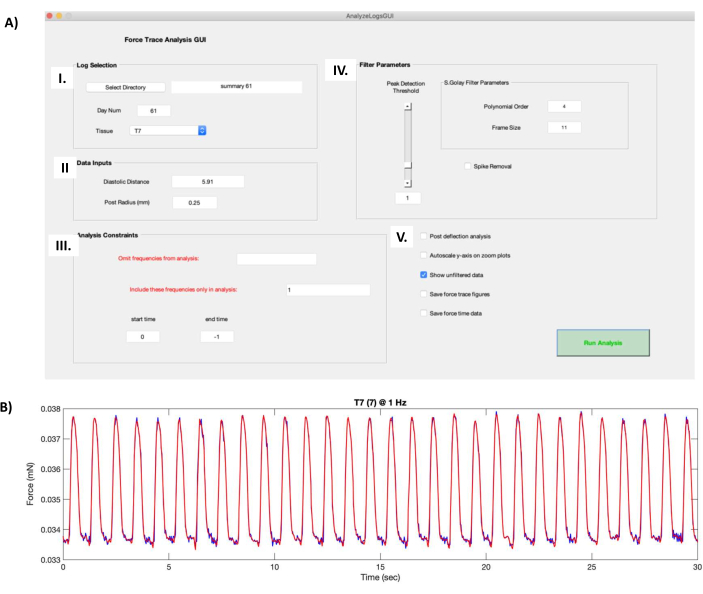
Figure 8 : Calculs de la courbe de force de contraction. (A) L’exécution du fichier « AnalyzeLogsGUI.m » dans le logiciel de traitement des données ouvre la fenêtre de l’interface graphique. (I) La zone Log Selection permet à l’utilisateur de sélectionner le répertoire du dossier contenant les données fonctionnelles hECT. Le champ Nombre de jours est automatiquement renseigné à partir du titre du fichier récapitulatif créé à l’étape de protocole 7.1. L’hECT à traiter est sélectionné à l’aide du menu déroulant Tissu. (II) La zone Entrées de données contient des informations sur la paire de poteaux PDMS qui supportent l’hECT, telles que la distance à vide (obtenue à l’étape 6.1 du protocole) et le rayon du poteau (0,25 mm). (III) La case Contraintes d’analyse permet à l’utilisateur de choisir les fréquences à omettre ou à inclure et de découper les enregistrements. (IV) La zone des paramètres du filtre contient les options permettant de choisir le mode de filtrage de la courbe de force de contraction brute. L’ordre polynomial et la taille de l’image modifient le niveau de lissage pendant le processus de filtrage. Le curseur Seuil de détection des pics détermine la taille minimale des pics qui sera reconnue par les scripts. L’option Suppression des pointes coupe les pics élevés causés par des artefacts. (V) Les options supplémentaires incluent l’analyse post-déflexion, qui exécute un algorithme de détection de pic supplémentaire, la mise à l’échelle automatique de l’axe Y sur les tracés de zoom, qui agit sur la courbe de force de contraction, l’enregistrement des courbes de trace de force, qui enregistre les chiffres de force de contraction, et l’enregistrement des données de force-temps, qui enregistre les données de force de contraction tracées. (B) Exemple de la courbe de force de contraction d’un enregistrement de 30 s d’un hECT rythmé à 1 Hz produit par la capture d’écran de l’interface graphique du panneau A. La courbe rouge de la force de contraction montre la force filtrée produite par les paramètres de l’AIV, superposée à la courbe de force de contraction brute (courbe bleu foncé, apparaît lorsque l’option Afficher les données non filtrées dans AV est sélectionnée). Abréviations : hECT = tissu cardiaque modifié par l’homme ; GUI = interface utilisateur graphique ; PDMS = polydiméthylsiloxane. Veuillez cliquer ici pour voir une version agrandie de cette figure.
Résultats
Suivant le protocole ci-dessus, les cardiomyocytes ont été générés à partir d’une lignée iPSC saine utilisée précédemment par notre groupe 9,15 et transformés en ECTh après 8 à 61 jours de culture. La figure 9A montre des images représentatives des hECT vues du bas, qui ont été créées sans (en haut) et avec (en bas) SPoT. Les mesures fonctionnelles ont été effectuées à température ambiante (23 °C) et à temp...
Discussion
Il existe de nombreux modèles linéaires de tissus cardiaques modifiés publiés dans la littérature, dont certains sont décrits dans le tableau 1. Certains modèles impliquent la mesure directe de la force tissulaire, mais ceux-ci nécessitent généralement de transférer la construction dans un bain musculaire séparé38. La plupart des modèles sont conçus avec les tissus ancrés en permanence aux deux extrémités, le plus souvent aux poteaux PDMS ...
Déclarations de divulgation
K.D.C. est cofondateur et directeur scientifique de Novoheart et détient une participation dans la société de portefeuille Medera Biopharmaceutical. Novoheart n’a pas contribué au financement, à la planification ou à l’exécution de cette étude ; cependant, les résultats de l’étude pourraient potentiellement avoir un impact financier sur Novoheart et Medera. Les autres auteurs déclarent qu’ils n’ont pas d’intérêts concurrents.
Remerciements
Les auteurs remercient le Dr Timothy Cashman pour ses travaux antérieurs sur cette méthode. Cette étude a été financée par les National Institutes of Health (NIH) (R01-HL132226 et K01 HL133424) et le programme des réseaux d’excellence internationaux de la Fondation Leducq (CURE-PLaN).
matériels
| Name | Company | Catalog Number | Comments |
| 0.25 mm diamete 304 Stainless Steel Wire | McMaster Carr | 6517K61 | |
| 0.25% trypsin-EDTA | Gibco | 25200056 | |
| 1.7 mL Microtubes | Axygen | MCT-175-C | |
| 10 cm dishes (20 mm tall) | Corning | 353003 | |
| 10 mL Serological Pipette | Drummond | 6-000-010 | |
| 10 N NaOH | Fisher Scientific | SS225-1 | dilute 1:10 in sterile distilled water |
| 10X Modified Eagle Medium | Sigma Aldrich | M0275 | |
| 20 - 200 μL Micropipette | Eppendorf | 3123000055 | |
| 200 μL MicroPipette Tips | VWR | 76322-150 | |
| 5 mL Serological Pipette | Drummond | 6-000-005 | |
| 50 mL Conical Centrifuge Tubes | Falcon | 352070 | |
| 6 cm Petri Dish | Corning | 353002 | |
| 6 Watt LED Dual Gooseneck Illuminator | AmScope | LED-6W | |
| 6-Well Plates | Corning | 353046 | |
| 90 degree angle mirror | Edmund Optics | 45-594 | |
| Acrylic bonding glue | SCIGRIP | #4 | |
| Adjustable 10 cm x 10 cm jack | Fisher Scientific | 14-673-50 | |
| Aluminum 6061 | McMaster Carr | 9008K82 | |
| A-Plan 10X Objective Lens | ZEISS | 1020-863 | |
| Autoclave Bags | Propper | 21002 | |
| B-27 supplement | ThermoFisher | 17504044 | |
| B-27 supplement (without insulin) | ThermoFisher | A1895601 | |
| Benchtop Centrifuge | Eppendorf | 5810 R | |
| Black ABS | Ultimaker | 2.85 mm wide | |
| Bovine Collagen I | Gibco | A1064401 | |
| CHIR99021 | Tocris | 4423 | |
| Class II Biosafety Cabinet | Labconco | 3430009 | |
| Clear Acrylic Sheeting | estreetplastics | 1002502436 | 6.25 mm thick |
| CNC Vertical Mill | Haas | VF-1 | |
| Conductive Graphite Bars | McMaster Carr | 1763T33 | |
| Dissection microscope | Olympus | SZ61 | |
| Dulbecco's Modified Eagle Medium/Ham's F-12 Nutrient Mix | ThermoFisher | 11330032 | |
| Ethanol | Fisher Scientific | A4094 | Dilute to 70% in water |
| EVE Automated Cell counter | NanoEntek | E1000 | |
| EVE Cell Counting Slide | NanoEntek | EVS-050 | |
| Fetal Bovine Serum | Life Technologies | 10438026 | |
| Fine Curved Forceps | Fine Science Tools | 11253-25 | |
| Forma Series II Water Jacketed CO2 Incubator | Thermo Electron Corporation | 3110 | AKA "incubator". With HEPA class 100 filter |
| Fusion360 software | Autodesk | AKA "CAD software" | |
| Glass Hemocytometer | Reichert | 1475 | 0.1 mm deep |
| HEPES | Sigma Aldrich | H3784 | |
| hESC qualified matrigel | Corning | 354277 | AKA "basement membrane matrix". Store in frozen aliquots |
| High Speed CCD Camera | PixelLINK | P7410 | |
| Inverted Microscope | Carl Zeiss Werk | Axiovert 40 CFL | 10X phase contrast objective |
| IWR-1 | Selleck Chem | S7086 | |
| LabView Software | National Instruments | 2016 | |
| Laminar flow clean bench | NuAire | NU-201-330 | necessary for hECT functional analysis |
| Laptop | AsusTek | Strix | Intel Core i& processor ,CPU 2.8GHz, 16GB RAM |
| Laser Cutting Machine | Epilog | Helix 24 | |
| Magnification headset | ExcelBlades | 70020 | Recommended for steps requiring fine manipulations |
| Matlab | Mathworks | Version 2019b or later | AKA "data analysis software" |
| Micro Vannas Scissors, 3 mm blade | WPI Instruments | 501839 | |
| Microscope Boom Stand | Olympus | SZ2-STU1 | |
| Penicillin-Streptomycin stock solution | ThermoFisher | 15140122 | 10,000 IU/ml penicillin; 10,000 μg/ml streptomycin |
| Phosphate-buffered saline without divalent cations | Sigma Aldrich | P3813 | Diluted in distilled water to 1X and 10X concentrations |
| Pipette Controller | Drummond | 4-000-100 | |
| PixelLINK Capture OEM | PixelLINK | 10.2.1.6 | AKA "Camera Software" |
| Polysulfone | McMaster Carr | 86735K73 | translucent amber color |
| Polytetrafluoroethylene (PTFE) | McMaster Carr | 8545K176 | Black, molded |
| ReLeSR | Stem Cell Technologies | 5872 | AKA "iPSC dissociation media" |
| Rosewell Park Memorial Institute 1640 Media | ThermoFisher | 11875135 | |
| Silicone Sheeting | SMI manufacturing | glossy, 0.02 in thickness, durometer 40 | |
| Size 10/0 Blue, Green, Red, and Yellow Glass Seed Beads | Michael's | color should withstand autoclaving | |
| Spatula | Fisher Scientific | 14-373 | used for mixing PDMS |
| Square Pulse Stimulator | Astro-Med / Grass Technologies | S88X | |
| Stainless Steel Razoblades | GEM | 62-0179-CTN | preferred over non-stainless steel due to lower hardness |
| Stemflex | ThermoFisher | A3349401 | AKA "iPSC culture media" |
| Sterile distilled water | ThermoFisher | 5230 | |
| Sylgard 170 - Silicone Elastomer Encapsulant Black 0.9 kg Kit | Dow | DOWSIL 170 2LB KIT | AKA black Polydimethylsiloxane (black PDMS) |
| Sylgard 184 - Silicone Elastomer Clear 1 lb Kit | Dow | DC 184 SYLGARD 0.5KG 1.1LB KIT | AKA Polydimethylsiloxane (PDMS) |
| Temperature-controlled heated stage | Okolab | H401-HG-SMU | Set height to 10 cm |
| Thermoplastic 3D printer | Ultimaker | Ultimaker 3 | |
| Thiazovivin | Selleck Chem | S1459 | |
| Trypan Blue | NanoEntek | EBT-001 | |
| Vacuum Chamber | Bel-Art Parts | F42027-0000 | |
| Variable Speed Mini Band Saw | Micro-Mark | 82203 | |
| Variable Speed Miniature Drill Press | Micro-Mark | 82959 | |
| Vibration Isolation Table | Labconco | 3618000 | |
| Weighing Boats | VWR | 10803-140 | |
| Talon Cylinder Bench Clamp | VWR | 97035-528 | AKA screw clamp |
Références
- Serrao, G. W., et al. Myocyte-depleted engineered cardiac tissues support therapeutic potential of mesenchymal stem cells. Tissue Engineering. Part A. 18 (13-14), 1322-1333 (2012).
- Turnbull, I. C., et al. Advancing functional engineered cardiac tissues toward a preclinical model of human myocardium. FASEB Journal. 28 (2), 644-654 (2014).
- Cashman, T. J., et al. Construction of defined human engineered cardiac tissues to study mechanisms of cardiac cell therapy. Journal of Visualized Experiments. (109), e53447 (2016).
- Stillitano, F., et al. Genomic correction of familial cardiomyopathy in human engineered cardiac tissues. European Heart Journal. 37 (43), 3282-3284 (2016).
- Mayourian, J., et al. Experimental and computational insight into human mesenchymal stem cell paracrine signaling and heterocellular coupling effects on cardiac contractility and arrhythmogenicity. Circulation Research. 121 (4), 411-423 (2017).
- Mayourian, J., et al. therapeutic paracrine modulation of cardiac excitation-contraction coupling. Circulation Research. 122 (1), 167-183 (2018).
- Mayourian, J., et al. Exosomal microRNA-21-5p mediates mesenchymal stem cell paracrine effects on human cardiac tissue contractility. Circulation Research. 7 (122), 933-944 (2018).
- Turnbull, I. C., et al. Cardiac tissue engineering models of inherited and acquired cardiomyopathies. Methods in Molecular Biology. 1816, 145-159 (2018).
- Murphy, J. F., et al. Adult human cardiac stem cell supplementation effectively increases contractile function and maturation in human engineered cardiac tissues. Stem Cell Research & Therapy. 10 (1), 373 (2019).
- Breckwoldt, K., et al. Differentiation of cardiomyocytes and generation of human engineered heart tissue. Nature Protocols. 12 (6), 1177-1197 (2017).
- Huang, C. Y., et al. Enhancement of human iPSC-derived cardiomyocyte maturation by chemical conditioning in a 3D environment. Journal of Molecular and Cellular Cardiology. 138, 1-11 (2020).
- Ramade, A., Legant, W. R., Picart, C., Chen, C. S., Boudou, T. Microfabrication of a platform to measure and manipulate the mechanics of engineered microtissues. Methods in Cell Biology. 121, 191-211 (2014).
- Ronaldson-Bouchard, K., et al. Engineering of human cardiac muscle electromechanically matured to an adult-like phenotype. Nature Protocols. 14 (10), 2781-2817 (2019).
- Tamargo, M. A., et al. milliPillar: A platform for the generation and real-time assessment of human engineered cardiac tissues. ACS Biomaterials Science & Engineering. 7 (11), 5215-5229 (2021).
- Ceholski, D. K., et al. CXCR4 and CXCR7 play distinct roles in cardiac lineage specification and pharmacologic β-adrenergic response. Stem Cell Research. 23, 77-86 (2017).
- Bliley, J. M., et al. Dynamic loading of human engineered heart tissue enhances contractile function and drives a desmosome-linked disease phenotype. Science Translational Medicine. 13 (603), (2021).
- Ribeiro, M. C., et al. A new versatile platform for assessment of improved cardiac performance in human-engineered heart tissues. Journal of Personalized Medicine. 12 (2), 214 (2022).
- Ronaldson-Bouchard, K., et al. Advanced maturation of human cardiac tissue grown from pluripotent stem cells. Nature. 556 (7700), 239-243 (2018).
- Mannhardt, I., et al. Human engineered heart tissue: Analysis of contractile force. Stem Cell Reports. 7 (1), 29-42 (2016).
- Mannhardt, I., et al. Blinded contractility analysis in hiPSC-cardiomyocytes in engineered heart tissue format: Comparison with human atrial trabeculae. Toxicological Sciences. 158 (1), 164-175 (2017).
- Saleem, U., et al. Force and calcium transients analysis in human engineered heart tissues reveals positive force-frequency relation at physiological frequency. Stem Cell Reports. 14 (2), 312-324 (2020).
- Thavandiran, N., et al. Functional arrays of human pluripotent stem cell-derived cardiac microtissues. Scientific Reports. 10 (1), 6919 (2020).
- Bielawski, K. S., Leonard, A., Bhandari, S., Murry, C. E., Sniadecki, N. J. Real-time force and frequency analysis of engineered human heart tissue derived from induced pluripotent stem cells using magnetic sensing. Tissue Engineering. Part C, Methods. 22 (10), 932-940 (2016).
- Leonard, A., et al. Afterload promotes maturation of human induced pluripotent stem cell derived cardiomyocytes in engineered heart tissues. Journal of Molecular and Cellular Cardiology. 118, 147-158 (2018).
- Bose, P., Huang, C. Y., Eyckmans, J., Chen, C. S., Reich, D. H. Fabrication and mechanical properties measurements of 3D microtissues for the study of cell-matrix interactions. Methods in Molecular Biology. 1722, 303-328 (2018).
- Zhang, W., et al. Maturation of human embryonic stem cell-derived cardiomyocytes (hESC-CMs) in 3D collagen matrix: Effects of niche cell supplementation and mechanical stimulation. Acta Biomaterialia. 49, 204-217 (2017).
- van Neste, C. Advances in bioreactor design and multi-dimensional analysis for assessing maturation phenotype of human engineered cardiac tissues. PhD thesis. Icahn School of Medicine at Mount Sinai. , (2022).
- Sala, L., et al. MUSCLEMOTION: A versatile open software tool to quantify cardiomyocyte and cardiac muscle contraction in vitro and in vivo. Circulation Research. 122 (3), e5-e16 (2018).
- Salazar, B. H., Cashion, A. T., Dennis, R. G., Birla, R. K. Development of a cyclic strain bioreactor for mechanical enhancement and assessment of bioengineered myocardial constructs. Cardiovascular Engineering and Technology. 6 (4), 533-545 (2015).
- Putame, G., et al. Application of 3D printing technology for design and manufacturing of customized components for a mechanical stretching bioreactor. Journal of Healthcare Engineering. 2019, 3957931 (2019).
- Akintewe, O. O., Roberts, E. G., Rim, N. -. G., Ferguson, M. A. H., Wong, J. Y. Design approaches to myocardial and vascular tissue engineering. Annual Review of Biomedical Engineering. 19, 389-414 (2017).
- Chen, G., et al. Phospholamban as a crucial determinant of the inotropic response of human pluripotent stem cell-derived ventricular cardiomyocytes and engineered 3-dimensional tissue constructs. Circulation. Arrhythmia and Electrophysiology. 8 (1), 193-202 (2015).
- Giacomelli, E., et al. Human-iPSC-derived cardiac stromal cells enhance maturation in 3D cardiac microtissues and reveal non-cardiomyocyte contributions to heart disease. Cell Stem Cell. 26 (6), 862-879 (2020).
- Beauchamp, P., et al. 3D co-culture of hiPSC-derived cardiomyocytes with cardiac fibroblasts improves tissue-like features of cardiac spheroids. Frontiers in Molecular Biosciences. 7, 14 (2020).
- Campostrini, G., et al. functional analysis and applications of isogenic three-dimensional self-aggregating cardiac microtissues from human pluripotent stem cells. Nature Protocols. 16 (4), 2213-2256 (2021).
- Swiatlowska, P., Iskratsch, T. Tools for studying and modulating (cardiac muscle) cell mechanics and mechanosensing across the scales. Biophysical Reviews. 13 (5), 611-623 (2021).
- Zhao, Y., et al. Engineering microenvironment for human cardiac tissue assembly in heart-on-a-chip platform. Matrix Biology. 85-86, 189-204 (2020).
- Fujiwara, Y., Deguchi, K., Miki, K., Nishimoto, T., Yoshida, Y. A method for contraction force measurement of hiPSC-derived engineered cardiac tissues. Methods in Molecular Biology. 2320, 171-180 (2021).
- Wang, E. Y., et al. Biowire model of interstitial and focal cardiac fibrosis. ACS Central Science. 5 (7), 1146-1158 (2019).
- Zhao, Y., et al. A platform for generation of chamber-specific cardiac tissues and disease modeling. Cell. 176 (4), 913-927 (2019).
- Lee, E. K., et al. Machine learning of human pluripotent stem cell-derived engineered cardiac tissue contractility for automated drug classification. Stem Cell Reports. 9 (5), 1560-1572 (2017).
- Batalov, I., Feinberg, A. W. Differentiation of cardiomyocytes from human pluripotent stem cells using monolayer culture. Biomarker Insights. 10, 71-76 (2015).
- Lian, X., et al. Robust cardiomyocyte differentiation from human pluripotent stem cells via temporal modulation of canonical Wnt signaling. Proceedings of the National Academy of Sciences of the United States of America. 109 (27), E1848-E1857 (2012).
- Penefsky, Z. J., Buckley, N. M., Litwak, R. S. Effect of temperature and calcium on force-frequency relationships in mammalian ventricular myocardium. Pflugers Archiv. 332 (4), 271-282 (1972).
- Bers, D. M. . Excitation-Contraction Coupling and Cardiac Contractile Force. , (2001).
- Kanaya, N., Gable, B., Wickley, P. J., Murray, P. A., Damron, D. S. Experimental conditions are important determinants of cardiac inotropic effects of propofol. Anesthesiology. 103 (5), 1026-1034 (2005).
- Galende, E., et al. Amniotic fluid cells are more efficiently reprogrammed to pluripotency than adult cells. Cellular Reprogramming. 12 (2), 117-125 (2010).
- Wacker-Gussmann, A., Strasburger, J. F., Cuneo, B. F., Wakai, R. T. Diagnosis and treatment of fetal arrhythmia. American Journal of Perinatology. 31 (7), 617-628 (2014).
- Federmann, M., Hess, O. M. Differentiation between systolic and diastolic dysfunction. European Heart Journal. 15, 2-6 (1994).
- Knight, W. E., et al. Maturation of pluripotent stem cell-derived cardiomyocytes enables modeling of human hypertrophic cardiomyopathy. Stem Cell Reports. 16 (3), 519-533 (2021).
- Ma, Z., et al. Contractile deficits in engineered cardiac microtissues as a result of MYBPC3 deficiency and mechanical overload. Nature Biomedical Engineering. 2 (12), 955-967 (2018).
- de Lange, W. J., et al. Human iPSC-engineered cardiac tissue platform faithfully models important cardiac physiology. American Journal of Physiology. Heart and Circulatory Physiology. 320 (4), H1670-H1686 (2021).
- Hiranandani, N., Varian, K. D., Monasky, M. M., Janssen, P. M. L. Frequency-dependent contractile response of isolated cardiac trabeculae under hypo-, normo-, and hyperthermic conditions. Journal of Applied Physiology. 100 (5), 1727-1732 (2006).
- Puglisi, J. L., Bassani, R. A., Bassani, J. W., Amin, J. N., Bers, D. M. Temperature and relative contributions of Ca transport systems in cardiac myocyte relaxation. The American Journal of Physiology. 270 (5), H1772-H1778 (1996).
- Puglisi, J. L., Yuan, W., Bassani, J. W., Bers, D. M. Ca(2+) influx through Ca(2+) channels in rabbit ventricular myocytes during action potential clamp: Influence of temperature. Circulation Research. 85 (6), e7-e16 (1999).
- Li, R. A., et al. Bioengineering an electro-mechanically functional miniature ventricular heart chamber from human pluripotent stem cells. Biomaterials. 163, 116-127 (2018).
- Sharma, A., et al. Biomanufacturing in low Earth orbit for regenerative medicine. Stem Cell Reports. 17 (1), 1-13 (2022).
- Strauss, D. G., Wu, W. W., Li, Z., Koerner, J., Garnett, C. Translational models and tools to reduce clinical trials and improve regulatory decision making for QTc and proarrhythmia risk (ICH E14/S7B updates). Clinical Pharmacology & Therapeutics. 109 (2), 319-333 (2021).
- Gintant, G., et al. Repolarization studies using human stem cell-derived cardiomyocytes: Validation studies and best practice recommendations. Regulatory Toxicology and Pharmacology. 117, 104756 (2020).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationExplorer plus d’articles
This article has been published
Video Coming Soon